-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Analýza pacientů se středně těžkou až těžkou psoriázou před zahájením biologické léčby v České republice – údaje z registru BIOREP 2005–2016
Analysis of Patients with Moderate to Severe Psoriasis before Starting Biologic Therapy in the Czech Republic – Data from BIOREP Registry 2005 – 2016
Background and objective:
Evaluation of patients with severe psoriasis treated with biologics in the Czech Republic and included in the register of biological therapy BIOREP.Methods:
We performed a retrospective evaluation of patients with severe psoriasis enrolled in the registry BIOREP from May 2005 to May 2016. The number of patients on biological therapy was evaluated and analysed according to the age and gender in this period, the incidence of associated disorders was assessed and the characteristics were compared with published data in literature.Results:
Baseline data were collected from 17 dermatology biological therapy centres. As of May 2016, 1525 patients were registered in BIOREP registry with a predominance of males (63.5%). The average patient age was 50.9 years. The mean baseline Psoriasis Area and Severity Index was 19.5 and the Dermatology Life Quality Index was 17.0. A total of 40.2% of patients reported a history of psoriatic arthritis. In our cohort a high proportion of patients (59.2%) with cardiovascular risk factors [hypertension (36.9%), hyperlipidemia (28.6%), diabetes mellitus (12.4%), coronary heart disease (4.9%), and obesity (32.4%)] were observed. 72% of patients were overweight or obese. Only 32.1% of patients had no concomitant disease, 31.0% of patients had one, 18.4% two, 12.8% three, and 5.7% of patients four or more comorbidities. The majority of patients had been previously treated with phototherapy (86.0%), acitretin (75.5%), methotrexate (69.3%) or ciclosporin (54.0%).Conclusion:
BIOREP is the first registry of patients with psoriasis treated with biologics in Central and Eastern Europe. Our results found a similar or even higher prevalence of comorbidities, long disease duration before biological treatment introduction and high impact on the quality of life among patients included in European registries.Key words:
psoriasis – biological therapy – registries
Autoři: M. Kojanová 1; J. Fialová 1; P. Cetkovská 2; S. Gkalpakiotis 3; J. Jirčíková 4; T. Doležal 4; P. Arenberger 3; Skupina Biorep
Působiště autorů: Dermatovenerologická klinika VFN a 1. LF UK, Praha přednosta prof. MUDr. Jiří Štork, CSc. 1; Dermatovenerologická klinika FN a LF UK, Plzeň přednosta prof. MUDr. Karel Pizinger, CSc. 2; Dermatovenerologická klinika 3. LF UK a FNKV, Praha přednosta prof. MUDr. Petr Arenberger, DrSc., MBA 3; Value Outcomes, Praha 4
Vyšlo v časopise: Čes-slov Derm, 91, 2016, No. 5, p. 223-232
Kategorie: Terapie, farmakologie a klinické studie
Souhrn
Cíl práce:
Hodnocení skupiny pacientů se závažnou psoriázou v České republice zařazených do registru biologické léčby BIOREP.Metody:
Bylo provedeno retrospektivní hodnocení pacientů se závažnou psoriázou zařazených do registru BIOREP od května 2005 do května 2016. Předmětem analýzy byli pacienti na biologické léčbě v daném období s cílem vyhodnotit věk, pohlaví, předchozí léčbu a výskyt souběžných onemocnění. Údaje byly porovnány s publikovanými údaji v literatuře.Výsledky:
Analýza zahrnuje údaje 1525 pacientů se středně těžkou až těžkou psoriázou zahajujících biologickou léčbu v 17 centrech. V souboru převládali muži (63,5 %), průměrný věk byl 50,9 let. Průměrná výchozí hodnota PASI byla 19,5 a DLQI 17,0. Celkem 40,2 % pacientů mělo zároveň psoriatickou artritidu. Ve sledované kohortě byl vysoký výskyt pacientů s kardiovaskulárními rizikovými faktory (59,2 %), především hypertenzí (36,9 %), hyperlipidémií (28,6 %), diabetem (12,4 %), ischemickou chorobou srdeční (4,9 %) a obezitou (32,4 %), celkem 72 % pacientů trpělo nadváhou či obezitou. Pouze 32,1 % pacientů nemělo žádné souběžné onemocnění, 31,0 % pacientů mělo jednu, 18,4 % pacientů dvě, 12,8 % pacientů tři a 5,7 % pacientů čtyři a více souběžných nemocí. Pacienti byli před zahájením biologické léčby předléčeni fototerapií (86,0 %), acitretinem (75,5 %), metotrexátem (69,3 %) a cyklosporinem (54,0 %).Závěr:
BIOREP je prvním registrem pacientů biologické léčby psoriázy v zemích střední a východní Evropy. Výsledky při porovnání s evropskými registry ukazují srovnatelnou nebo vyšší prevalenci souběžných onemocnění a rizikových faktorů, dlouhé období nedostatečné léčby a nízkou kvalitu života před nasazením biologické léčby.Klíčová slova:
psoriáza – biologická léčba – registryÚVOD
Psoriáza patří mezi chronická multifaktoriální zánětlivá onemocnění. Vznik nemoci, její závažnost, klinický obraz i průběh závisí na genetické predispozici a na zevních faktorech [18]. Prevalence psoriázy celosvětově značně kolísá od 0,47 % v Číně do 3,2 % ve Spojených státech. V Evropě se pohybuje od 1,2 % v Chorvatsku do 8,5 % v Norsku [12, 38, 41]. Prevalence onemocnění v mnoha dalších evropských zemích včetně České republiky není přesně známa a odhaduje se na 2 % [46].
Psoriáza se považuje za multisystémové onemocnění. U mnoha pacientů postihuje nejen kůži, ale i pohybový aparát a je často provázena i dalšími přidruženými chorobami, jako jsou kardiovaskulární onemocnění a metabolický syndrom (obezita, hypertenze, hyperlipidémie a diabetes mellitus), které se častěji pozorují u pacientů se závažnou psoriázou [24]. Přestože tradiční systémová terapie (metotrexát, cyklosporin a acitretin) zůstává v léčbě středně těžké a těžké psoriázy nadále důležitá, dostává se stále více do popředí léčba biologická, která je podle dostupných dat považována za méně toxickou [31].
Data o účinnosti a bezpečnosti biologické léčby lupénky pocházejí především z randomizovaných klinických studií, které jsou obvykle krátkodobé, výběr účastníků je užší a často zahrnuje zdravější a méně komplikované pacienty. Pro získání údajů z reálné klinické praxe jsou nezastupitelná data z národních registrů [14, 26, 48].
MATERIÁL A METODY
BIOREP je registr pacientů s psoriázou v České republice léčených biologickou léčbou. Shromažďuje data pacientů a sleduje dlouhodobou účinnost a bezpečnost terapie. Registr byl založen v květnu 2005, inovován v roce 2011 a je spravován pod dohledem České dermatovenerologické společnosti ČSL JEP. Biologická léčba psoriázy je v České republice poskytována v 18 specializovaných centrech.
Přestože v České republice máme publikované doporučené postupy k biologické léčbě závažné psoriázy založené na mezinárodních doporučených postupech [10], zahájení biologické léčby hrazené zdravotní pojišťovnou je možné pouze po splnění indikačních kritérií stanovených Státním ústavem pro kontrolu léčiv [50]. Podle těchto omezení je biologická léčba indikována a hrazena podle následujících kritérií:
1. Léčba přípravky Enbrel, Humira, Remicade, Remsima, Inflectra – léčba psoriázy u dospělých:
- a) se středně těžkou až těžkou psoriázou s PASI (Psoriasis Area and Severity Index) více než 10, kde nelze použít dva z následujících způsobů konvenční systémové léčby: acitretin, metotrexát, cyklosporin nebo fototerapii PUVA (Psoralen Ultra Violet-A) či NBUVB (Narrowband Ultra Violet-B) z důvodů nedostatečné účinnosti, intolerance či kontraindikace;
- b) se středně těžkou až těžkou psoriázou s PASI více než 10 se současnou aktivní psoriatickou artropatií, kde nelze použít metotrexát z důvodů nedostatečné účinnosti, intolerance či kontraindikace.
Ukončení léčby daným biologikem nebo přímé převedení na další biologikum je indikováno v případě:
- a) nedosažení hodnoty PASI 50 po 3, respektive 4 měsících (podle druhu přípravku) úvodní léčby;
- b) poklesu účinnosti zavedené biologické léčby pod PASI 50 nebo v intervalu PASI 50–75, ale se současnou hodnotou dermatologického indexu kvality života (DLQI – Dermatology Life Quality Index) větší nebo rovnou 5.
2. Léčba přípravkem Stelara: Léčba těžké plakové psoriázy postihující více než 10 % tělesného povrchu nebo PASI více než 10 a zároveň splňující alespoň jedno z následujících kritérií:
- a) kde nelze použít, nebo je riskantní jiná celková léčba (metotrexát, cyklosporin) z důvodů vzniklých nežádoucích účinků či toxicity, intolerance či kontraindikace;
- b) kde pacient nereaguje na standardní léčbu těžké psoriázy (metotrexát, cyklosporin, PUVA, 311 nm UVB), tj. po 3 měsících terapie není dostatečný efekt – zlepšení PASI nebo BSA (Body Surface Area) o > 50 % oproti výchozímu stavu, nebo by se musela zvyšovat dávka nad bezpečné limity;
- c) onemocnění nebylo v posledních 3 letech nikdy zhojeno nebo relapsy nastávají do jednoho měsíce po skončení předcházející intenzivní léčby.
Léčba se ukončí, pokud po 16 týdnech od zahájení terapie ustekinumabem nedojde ke zlepšení příznaků onemocnění v parametru PASI nebo BSA alespoň o 50 %.
3. Léčba přípravkem Benepali: Léčba dospělých se středně těžkou až těžkou psoriázou, postihující více než 10 % tělesného povrchu (BSA) nebo PASI více než 10 a je zároveň splněno alespoň jedno z následujících kritérií:
- a) nelze použít nebo je riskantní jiná celková léčba (acitretin, metotrexát, cyklosporin) z důvodů vzniklých nežádoucích účinků či toxicity, intolerance či kontraindikace;
- b) pacient nereaguje na standardní léčbu těžké psoriázy (acitretin, metotrexát, cyklosporin, PUVA, 311 nm UVB), tj. po 3 měsících terapie není dostatečný efekt (zlepšení PASI nebo BSA o > 50 % oproti výchozímu stavu), nebo by se musela zvyšovat dávka nad bezpečné limity;
- c) onemocnění nebylo v posledních 3 letech nikdy zhojeno nebo relapsy nastávají do jednoho měsíce po skončení předcházející intenzivní léčby. Léčba se ukončí, pokud po 3 měsících od zahájení terapie nedojde ke zlepšení příznaků onemocnění v parametru PASI nebo BSA alespoň o 50 %.
4. Léčba přípravkem Cosentyx: Léčba těžké plakové psoriázy u dospělých pacientů, u kterých je zároveň splněno alespoň jedno z následujících kritérií:
- a) nedošlo k dosažení hodnoty PASI 50 po 3, respektive 4 měsících (podle druhu přípravku) předchozí biologické léčby;
- b) nastal pokles účinnosti zavedené biologické léčby pod PASI 50 nebo při účinnosti v intervalu PASI 50 až 75, je-li současně hodnota DLQI větší nebo rovna 5;
- c) je kontraindikována jiná biologická léčba, nebo je předchozí biologická léčba ukončena z důvodu nežádoucích účinků.
Ukončení léčby secukinumabem nebo přímé převedení na další biologikum je indikováno v případě:
- a) nedosažení hodnoty PASI 50 po úvodních 4 měsících léčby nebo
- b) poklesu účinnosti zavedené léčby secukinumabem pod PASI 50 nebo při účinnosti v intervalu PASI 50 až 75, je-li současně hodnota DLQI větší nebo rovna 5.
V registru BIOREP je v současné době zařazeno 1710 pacientů s psoriázou. Předkládaná analýza hodnotí data u 1 525 pacientů ze 17 center zařazených od května 2005 do května 2016.
Pacienti jsou zařazováni do registru při prvním podání biologické léčby, kdy je zadáván věk, pohlaví a index tělesné hmotnosti (Body Mass Index – BMI). BMI je sledován v pěti kategoriích podle Světové zdravotnické organizace, kdy hodnota BMI pod 18,5 je hodnocena jako podvýživa, BMI 18,5–24,9 jako normální hmotnost, BMI 25,0–29,9 jako nadváha a BMI nad 30 jako obezita [55]. Dále je zadávána:
- anamnéza psoriázy, např. trvání nemoci, typ psoriázy, předcházející systémová léčba;
- PASI;
- DLQI;
- souběžná onemocnění: psoriatická artritida (PsA), hypertenze, hyperlipidémie, hepatopatie, obezita, diabetes mellitus, deprese, tyreopatie, ischemická choroba srdeční, neurologická onemocnění, tuberkulóza, předcházející malignita a nespecifické střevní záněty. Kardiovaskulární rizika zahrnují hypertenzi, ICHS, diabetes, hyperlipidémii a obezitu. Kontroly pacientů se vkládají 3 měsíce po zahájení léčby, po dalších 3 měsících a dále každých 6 měsíců. Sledována je aktivita onemocnění prostřednictvím hodnocení PASI, DLQI, BSA a zaznamenávající se nežádoucí účinky a případné změny terapie.
Statistická analýza
Data z registru BIOREP (demografické údaje, charakteristika onemocnění, PASI, DLQI apod.) byla analyzována prostřednictvím popisné statistiky. V případě kategoriálních proměnných byla data popsána pomocí počtu a procenta pacientů ve skupinách a v případě spojitých proměnných pomocí průměru a směrodatné odchylky. Vliv proměnných byl testován na pětiprocentní hladině významnosti pomocí dvouvýběrového neparametrického Wilcoxonova testu nebo neparametrického Kruskal--Wallisova testu.
Statistické zpracování probíhalo prostřednictvím software Microsoft Excel 2010 a STATA verze 13.1.
Součástí této analýzy je – kromě hodnocení dat z registru BIOREP – také porovnání s výstupy z Dánského registru DERMBIO – 1 277 pacientů [16], Španělského registru BIOBADADERM – 1 030 pacientů [9], Britského registru BADBIR – 5 065 pacientů [22] a Německého registru PSOBEST – 634, respektive 808 pacientů [6, 45].
VÝSLEDKY
V rámci analýzy bylo vyhodnoceno 1 525 pacientů, 556 žen (36,5 %) a 969 mužů (63,5 %). Průměrný věk v době zahájení biologické léčby byl 50,9 let. Průměrné BMI v době zahájení biologické léčby bylo 28,5 kg/m2. Celkem 72,0 % pacientů bylo podle BMI zařazeno do kategorie nadváha nebo obezita. Průměrná doba od stanovení diagnózy psoriázy byla 22,0 let a průměrná délka závažné aktivní formy onemocnění byla 10,4 let.
Průměrná výchozí hodnota skóre PASI byla 19,5 bodů ± 8,6 a průměrná hodnota DLQI byla 17,0 ± 7,8 bodů. Celkem 43,7 % pacientů mělo pozitivní rodinnou anamnézu psoriázy.
Dalším analyzovaným parametrem byla souběžná onemocnění pacientů. Pouze 32,1 % pacientů nemělo ani jednu ze sledovaných nemocí, 31,0 % pacientů mělo jedno, 18,4 % pacientů dvě, 12,8 % pacientů tři a 5,7 % pacientů čtyři a více souběžných onemocnění. Celkem 613 pacientů (40,2 %) mělo PsA, 902 pacientů (59,2 %) zaznamenalo alespoň jedno z kardiovaskulárních rizik (hypertenzi – 36,9 %, hyperlipidémii – 28,6 %, diabetes mellitus – 12,4 %, ischemickou chorobu srdeční (ICHS) – 4,9 % a obezitu – 32,4 % (tab. 1). Analýza prokázala závislost mezi hodnotou BMI a počtem souběžných onemocnění. Ve skupině pacientů bez souběžných onemocnění byla průměrná hodnota BMI 26,7 kg/m2, ve skupině pacientů s jedním souběžným onemocněním 27,9 kg/m2, se dvěma 29,5 kg/m2, se třemi 31,0 kg/m2 a se čtyřmi a více souběžnými onemocněními byla průměrná hodnota BMI 32,1 kg/m2. Tento vztah je na 5% hladině významnosti statisticky významný. Porovnání rozložení BMI mezi evropskými registry je uvedeno v tabulce 2.
Tab. 1. BIOREP – demografie, charakteristika psoriázy a souběžných onemocnění v době vstupu do registru 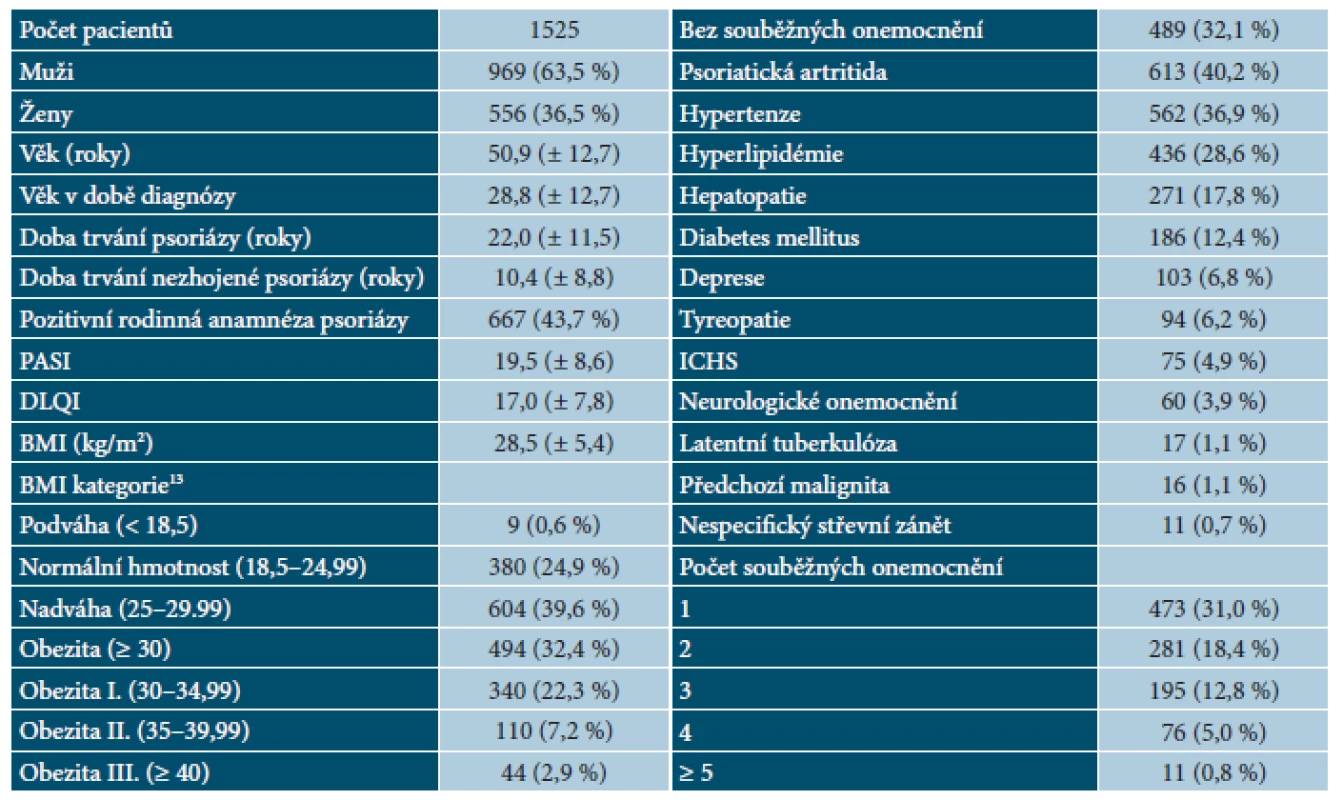
Tab. 2. Porovnání hodnot BMI v registrech psoriatických pacientů 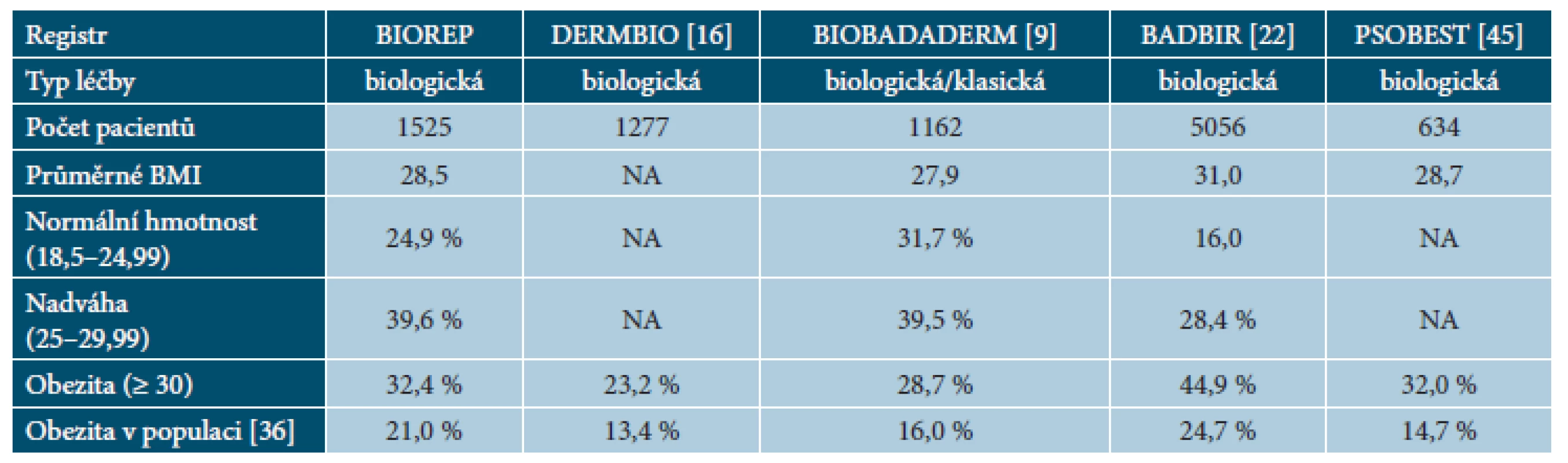
NA – data nejsou k dispozici, BMI – Body Mass Index. Hodnoty jsou uvedeny ve formátu počet a (%) nebo průměr a (± SD). PASI – Psoriasis Area and Severity Index, DLQI – Dermatology Life Quality Index, BMI – Body Mass Index, ICHS – ischemická choroba srdeční. V tabulce 3 je znázorněno porovnání počtu pacientů se souběžnými chorobami mezi registrem BIOREP a ostatními národními registry.
Tab. 3. Porovnání souběžných onemocnění v registru BIOREP s publikovanými daty v evropských registrech psoriatických pacientů 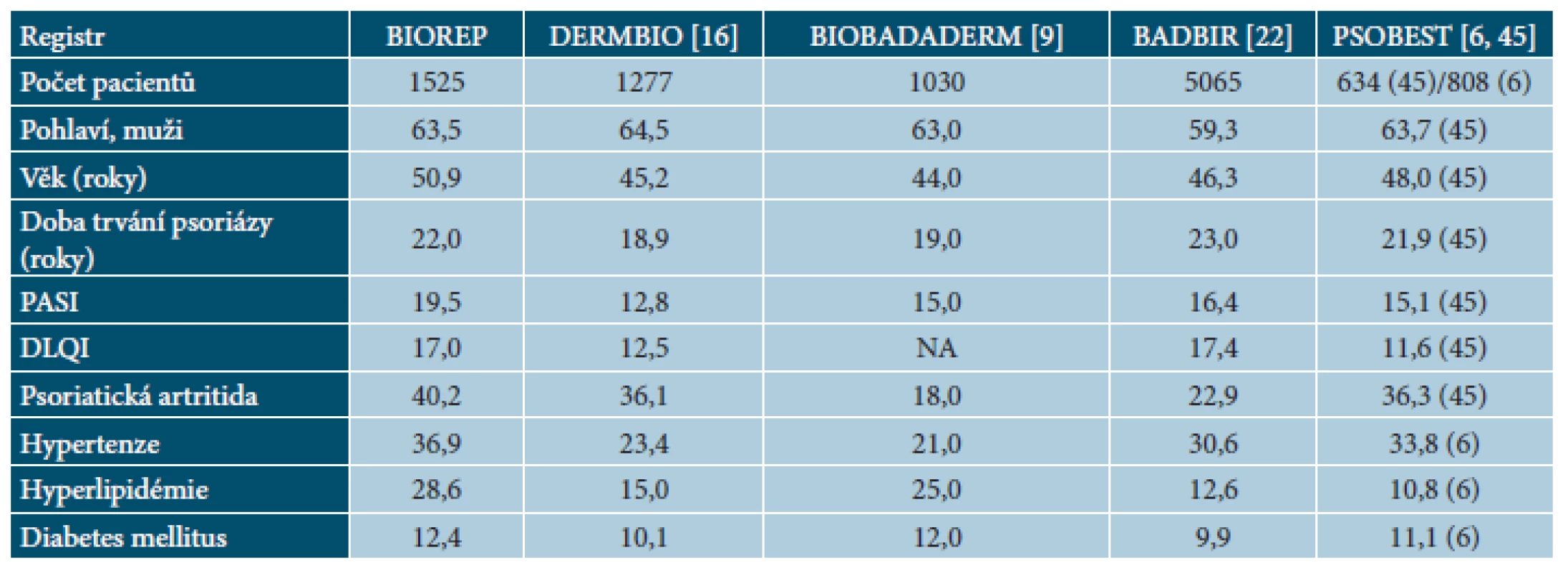
Hodnoty představují % pacientů nebo průměr. NA – hodnoty nejsou k dispozici, PASI – Psoriasis Area and Severity Index, DLQI – Dermatology Life Quality Index. Před zařazením do registru byla nejčastěji užívaná fototerapie (86,0 %), následovaná systémovou léčbou retinoidy (75,5 %), metotrexátem (69,3 %) a cyklosporinem (54,0 %). Velmi často pacienti užívali v historii více typů systémové terapie, 29,1 % pacientů užívalo dva typy terapie, 36,7 % pacientů tři typy terapie a 28,1 % pacientů všechny čtyři typy systémové terapie. Důvodem ukončení léčby byla nedostatečná účinnost (46,2 % u cyklosporinu až 86,8 % u fototerapie). Průměrná délka léčby se pohybovala od 8,8 měsíců v případě fototerapie po 19,5 měsíců v případě metotrexátu (tab. 4 a 5).
Tab. 4. BIOREP – předcházející systémová terapie u pacientů v registru 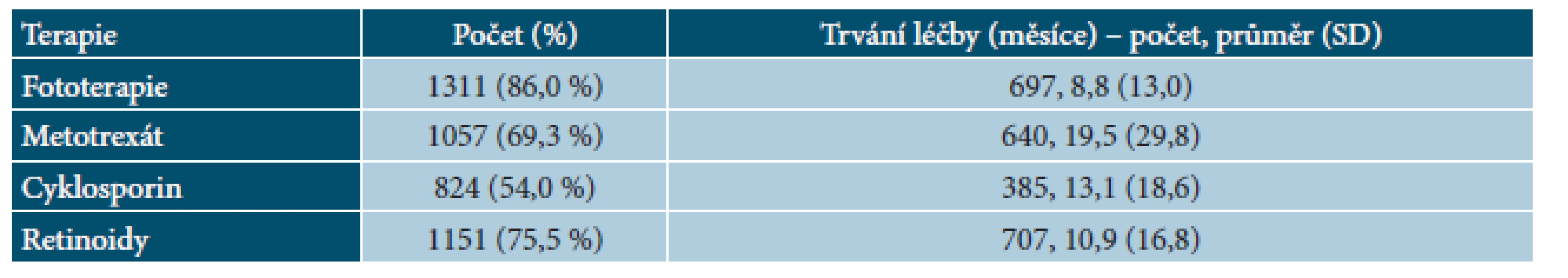
Tab. 5. BIOREP – důvody ukončení předcházející systémové terapie u pacientů v registru 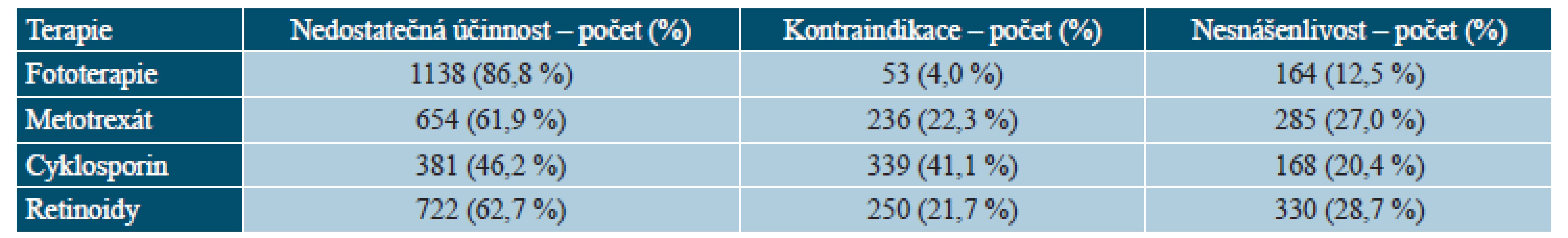
V registru BIOREP byla během sledovaného období zaznamenána biologická léčba preparátem Cosentyx (44 pacientů, 2,9 %), Enbrel (668 pacientů, 43,8 %), Humira (924 pacientů, 60,6 %), Raptiva (163 pacientů, 10,6 %), Remicade (226 pacientů, 14,8 %), Remsima (19 pacientů, 1,2 %) a Stelara (427 pacientů, 28,0 %). Celkem 57,4 % pacientů bylo léčeno jednou linií biologické léčby, 28,5 % pacientů mělo dvě linie, 9,5 % pacientů tři linie, 3,5 % čtyři linie, 0,9 % pacientů pět linií a 0,1 % pacientů šest linií biologické léčby.
DISKUSE
Podle současných poznatků je většina pacientů se středně těžkou až těžkou psoriázou léčena nedostatečně a systémová léčba je zahajována s dlouhou prodlevou. V mezinárodním sledování bylo téměř 90 % pacientů s hodnotou BSA >10 buď zcela bez léčby, či léčeno pouze lokálně [25]. Důvody odkládání systémové léčby těžké psoriázy byly jak na straně lékařů, tak i pacientů. Zhruba 39 % dermatologů udávalo, že léčilo jen 19,5 % pacientů se středně těžkou až těžkou psoriázou systémovou léčbou a 54 % pacientů léčilo pouze lokálními prostředky [53]. Epidemiologické studie ukazují, že nedostatečná péče o pacienty s psoriázou vede k výrazné frustraci nemocných [28]. Přestože je k dispozici účinná léčba psoriázy a psoriatické artritidy, je rozšířena nespokojenost s léčbou. V jedné studii bylo se současnou léčbou nespokojeno 52,3 % pacientů s psoriázou a 45,5 % pacientů s PsA [5], a to i v době, kdy dochází k vývoji nových léčebných možností díky lepšímu porozumění patofyziologie psoriázy [20]. Podle průzkumu mezi pacienty přináší moderní léčba větší spokojenost než léčba klasická, 63 % pacientů léčených injekční léčbou bylo spokojeno proti 38 % pacientům, kteří užívali perorální léky [39].
Data z registrů potvrzují dlouhé trvání psoriázy před nasazením biologické léčby: 18,9 let v Dánsku [16], 19 let ve Španělsku [9], 23 let ve Velké Británii [22], 21,9 let v Německu [45] a 22,0 let v České republice. Podobný byl i věk pacientů při zahájení biologické léčby: 45,2 let v Dánsku [16], 44 ve Španělsku [9], 46,3 v Británii [22], 48 v Německu [45] a 50,9 v České republice. Nespokojenost pacientů ukazuje i signifikantní snížení kvality života. Hodnota DLQI při zahájení biologické léčby je vysoká: 12,5 v Dánsku [16], 17,4 v Británii [22], 11,6 v Německu [45] a 17,0 v České republice.
Data sledující výskyt nemoci s ohledem na pohlaví se liší a neposkytují jasné závěry [38]. Podobně jako v jiných registrech, i v našem registru převažují muži nad ženami [37]. Podle švédského registru Psoreg se ukazuje, že muži jsou lupénkou postiženi více a tato asymetrie pravděpodobně odráží rozdílnou aktivitu onemocnění mezi pohlavími [19]. Tento názor potvrzuje i naše sledování, kde muži měli signifikantně vyšší hodnotu PASI než ženy (20,3 vs. 18,2).
V poslední době se psoriáza považuje za multisystémové onemocnění spojené s různými přidruženými nemocemi, jako jsou kardiovaskulární onemocnění s dalšími rizikovými faktory, např. metabolickým syndromem [17, 24]. Podle literatury více než 25 % pacientů indikovaných k systémové léčbě trpí těmito chorobami a těžká psoriáza je spojena se zvýšeným rizikem infarktu myokardu, mrtvice, kardiovaskulárního úmrtí i zvýšením celkové mortality [35]. Předpokládá se, že systémový zánět spojený s psoriázou vyvolává další zánětlivé změny, které vedou k inzulinové rezistenci a posléze k ateroskleróze [7, 15, 51]. Data z našeho registru ukazují varující procento pacientů (59,2 %) s kardiovaskulárními rizikovými faktory.
Dalším známým rizikovým faktorem ischemické choroby srdeční, cévní mozkové příhody a infarktu myokardu je hyperlipidémie, zahrnující abnormální hladiny lipidů v plazmě. Společné cytokiny přítomné u psoriázy a hyperlipidémie, jako je IL-1, IL-6 a TNF-α mohou měnit funkci hepatocytů a arteriální hladké svaloviny, což způsobí změnu složení lipoproteinu, zvýšenou expresi adhezivních molekul, zvýšené ukládání lipidů v arteriální stěně, což a přispívá k rozvoji aterosklerózy. Hladiny TNF-α a IL-1 ukazují spojitost se závažností psoriázy, čím vyšší je jejich hladina, tím větší je závažnost. Tato zjištění mohou vysvětlit, proč pacienti s těžkou psoriázou mají vyšší riziko hyperlipidémie [27].
Při porovnání dat z registrů jsme zjistili nejvyšší výskyt hyperlipidémie, a to 28,6 % oproti 15,0 % v Dánsku [16], 25 % ve Španělsku [9], 12,6 % v Británii [22] a 10,8 % v Německu [6].
Lupénka je často spojena s diabetem. Data ze studií ukazují 1,20–2,80krát zvýšené riziko vzniku cukrovky u pacientů s psoriázou [34, 40]. Ve srovnávací studii se potvrdil vyšší výskyt diabetu 2. typu ve srovnání s populací bez psoriázy (12 % vs. 6,1 %). Je zajímavé, že pacienti s pozdním vznikem onemocnění a bez rodinné zátěže lupénkou měli nejvyšší riziko diabetu [2]. Podobně jako zvýšený výskyt hyperlipidémie u pacientů s těžkou psoriázou, registry ukazují i zvýšený výskyt diabetu: 10,1 % v Dánsku [16], 12 % ve Španělsku [9], 9,9 % v Británii [22], 11,1 % v Německu [6] a 12,4 % v České republice. Pro porovnání, v České republice byla v roce 2013 prevalence diabetu v běžné populaci 8,2 % [52].
Některé studie prokazují vyšší výskyt arteriální hypertenze u pacientů s psoriázou [1]. Hypertenze je spojena s lupénkou prostřednictvím angiotenzinu II, produktu angiotenzin-konvertujícího enzymu, který reguluje tonus cév a stimuluje produkci zánětlivých cytokinů. Kromě toho se tvorba endotelinu-1, jehož hladina koreluje s aktivitou psoriázy, také spouští pomocí angiotenzinu-II. Dalším důvodem spojitosti psoriázy a hypertenze může být i zvýšený oxidační stres. Srovnávací studie zjistila, že pacienti s lupénkou mají o 44 % vyšší riziko hypertenze než kontroly [2]. Zároveň je hypertenze často nedostatečně kompenzována a vyžaduje intenzivnější léčbu ve srovnání s pacienty bez lupénky [4].
Výskyt hypertenze napříč registry je vysoký: 23,4 % v Dánsku [16], 21 % ve Španělsku [9], 30,6 % v Británii [22], 33,8 % v Německu [6] a nejvyšší (36,9 %) v České republice. Data o prevalenci hypertenze v běžné populaci v České republice nejsou jednotná, nicméně, v ordinacích praktických lékařů pro dospělé bylo v roce 2012 sledováno pro hypertenzi 22,4 % nemocných [56].
Vztah mezi psoriázou a obezitou je dobře známý a často diskutovaný. Vysvětlením může být funkce tukové tkáně jako aktivního endokrinního orgánu, který je schopen uvolňovat prozánětlivé cytokiny a adipokinem aktivovaný zánětlivý stav u obézních pacientů s psoriázou může indukovat metabolicky nepříznivý profil adipocytů [30, 47]. Psoriáza může podporovat obezitu v důsledku účinků zánětlivých mediátorů na adipogenezi a metabolismus lipidů [11], zároveň však obezita často vyplývá ze způsobu života pacientů s psoriázou [43]. Tato tvrzení podporuje zjištění, že zlepšení životního stylu spolu se snížením hmotnosti vede ke zlepšení psoriázy [33]. Ačkoliv ve většině případů obezita obvykle předchází diagnózu psoriázy, v rozsáhlé studii, která zkoumala výskyt obezity a psoriázy, se obezita objevila celkem u 6,3 % pacientů až během manifestace psoriázy. Pacienti s psoriázou měli 1,18krát větší riziko vzniku obezity po stanovení diagnózy oproti populaci bez lupénky [23]. Současně bylo zjištěno, že obezita je nezávislým rizikovým faktorem pro vývoj psoriázy [21, 32]. Nadměrná tělesná hmotnost je rizikovým faktorem pro manifestaci psoriázy a vyšší BMI je rizikovým faktorem pro vyšší hodnoty v indexu PASI při porovnání s pacienty s normální hmotností. Při zvýšení BMI o jednu jednotku, došlo k 9% nárůstu rizika vzniku psoriázy a 7% nárůstu rizika vyšších hodnot PASI. Obezita byla spojena s dvojnásobně zvýšeným rizikem vzniku psoriázy při porovnání populace s normální tělesnou hmotností [54].
Velký podíl pacientů v registru BIOREP trpí nadváhou nebo obezitou. Výskyt obezity I.–III. stupně v registru (32,4 %) je podstatně vyšší než výskyt u běžné populace v České republice (21 %) [36]. Naše výsledky odpovídají publikovaným údajům z ostatních registrů, jak je uvedeno v tabulce 2. Údaje z registrů zároveň podporují data ze systematických přehledů a metaanalýz a dokládají, že pacienti s psoriázou mají o více než 50 % vyšší pravděpodobnost, že budou obézní ve srovnání s osobami bez lupénky [3].
Psoriatickou artritidou trpí asi 30 % pacientů s psoriázou [29]. Předpokládá se, že PsA u pacientů s psoriázou je často nerozpoznaná, nicméně chybí kvalitní epidemiologické údaje [44, 49]. Nedostatečně diagnostikovanou PsA potvrzuje revmatologické hodnocení u pacientů s psoriázou, kdy diagnóza PsA byla zjištěna u 33 % pacientů, z nichž u 49 % bylo kloubní postižení identifikováno nově [42]. Také nedávné prospektivní studie popisují vyšší výskyt PsA než bylo uváděno dříve a odhalily řadu potenciálních rizikových faktorů pro rozvoj PsA, jako je například těžká psoriáza a postižení nehtů [13].
V naší studii mělo PsA 613 (40,2 %) pacientů z celkového počtu 1525 osob se závažnou psoriázou a tento počet byl při porovnání dat z ostatních registrů nejvyšší – 36,1 % v Dánsku [16], 18 % ve Španělsku [9], 22,9 % ve Velké Británii [22], 36,3 % v Německu [45].
ZÁVĚR
V Českém registru pacientů se závažnou psoriázou je vysoká prevalence souběžných onemocnění, která společně s psoriázou vedou k vyšší morbiditě, případné mortalitě a mohou vážně ovlivnit kvalitu života. Podle našich znalostí se jedná o první hodnocení u pacientů s psoriázou léčených biologiky ve střední a východní Evropě. Současně se jedná o první studii, která porovnává data z registrů v západní Evropě a České republice a ukazuje na nutnost komplexní péče o pacienty se středně těžkou až těžkou lupénku a aktivního vyhledávání souběžných onemocnění.
Poděkování
Autoři děkují všem zúčastněným dermatologům a spolupracovníkům, kteří se podílejí na registru BIOREP, za jejich úsilí a obětavost.
Skupina BIOREP: Zdeněk Antal, Jiřina Bartoňová, Linda Bláhová, Petra Brodská, Dominika Diamantová, Hana Duchková, Karel Ettler, Olga Filipovská, Petra Gkalpakioti, Martina Grycová, Jaroslav Hoffmann, Jiří Horažďovský, Eva Horká, Eduard Hrnčíř, Jaromíra Janků, Renata Kopová, Iva Lomicová, Alena Machovcová, Hana Malíková, Miroslav Nečas, Helena Němcová, Jitka Ošmerová, Marie Policarová, Veronika Slonková, Alena Stumpfová, Jaroslav Ševčík, Jan Šternberský, Jiří Štork, Kateřina Švarcová, Kateřina Teplá, Martin Tichý, Hana Tomková, Yvetta Vantuchová, Vladimír Vašků, Ivana Vejrová, Naděžda Vojáčková, Ivana Vybíralová.
Střet zájmů: Všichni autoři spolupracují jako konzultanti, řečníci pro Abbvie, Janssen, Merck-Serono, Novartis a Pfizer.
Do redakce došlo dne 24. 10. 2016.
Adresa pro korespondenci:
MUDr. Martina Kojanová, Ph.D.
Dermatovenerologická klinika 1. LF UK a VFN
U Nemocnice 2
120 00 Praha 2
e-mail: kojanova.martina@vfn.cz
Zdroje
1. ARMESTO, S., COTO-SEGURA, P., OSUNA, C. G. et al. Psoriasis and hypertension: a case-control study. J. Eur. Acad. Dermatol. Venereol., 2012, 26, p. 785–788.
2. ARMESTO, S., SANTOS-JUANES, J., GALACHE-OSUNA, C. et al. Psoriasis and type 2 diabetes risk among psoriatic patients in a Spanish population, Australas J. Dermatol., 2012, 53, p. 128–130.
3. ARMSTRONG, A. W., HARSKAMP, C. T., ARMSTRONG, E. J. The association between psoriasis and obesity: a systematic review and meta-analysis of observational studies. Nutr. Diabetes, 2012, 2, e54.
4. ARMSTRONG, A. W., LIN, S. W., CHAMBERS, C. J. et al. Psoriasis and the risk of diabetes and hypertension: a prospective study of US female nurses. Arch. Dermatol., 2009, 145, p. 379–338.
5. ARMSTRONG, A. W., ROBERTSON, A. D., WU, J. et al. Undertreatment, treatment trends, and treatment dissatisfaction among patients with psoriasis and psoriatic arthritis in the United States: findings from the National Psoriasis Foundation surveys, 2003-2011. JAMA Dermatol., 2013, 149, p. 1180–1185.
6. AUGUSTIN, M., SPEHR, C., RADTKE, M. A. et al. German psoriasis registry PsoBest: objectives, methodology and baseline data. J. Dtsch. Dermatol. Ges., 2014, 12, p. 48–57.
7. BOEHNCKE, W. H., BOEHNCKE, S., TOBIN, A. M. et al. The ‘psoriatic march’: a concept of how severe psoriasis may drive cardiovascular comorbidity. Exp. Dermatol., 2011, 20, p. 303–307.
8. CARRASCOSA, J. M., VILAVELLA, M., GARCIA-DOVAL, I. et al. Body mass index in patients with moderate-to-severe psoriasis in Spain and its impact as an independent risk factor for therapy withdrawal: results of the Biobadaderm Registry. J. Eur. Acad. Dermatol. Venereol., 2014, 28, p. 907–914.
9. CARRETERO, G., FERRANDIZ, C., DAUDEN, E. et al. Risk of adverse events in psoriasis patients receiving classic systemic drugs and biologics in a 5-year observational study of clinical practice: 2008–2013 results of the Biobadaderm registry. J. Eur. Acad. Dermatol. Venereol., 2015, 29, p. 156–163.
10. CETKOVSKÁ, P., KOJANOVÁ, M. Česká doporučení k biologické léčbě závažné chronické ložiskové psoriázy. Čes-slov. Derm., 2012, 87, p. 17–37.
11. DAVIDOVICI, B. B., SATTAR, N., PRINZ, J. C. et al. Psoriasis and systemic inflammatory diseases: potential mechanistic links between skin disease and co-morbid conditions. J. Invest. Dermatol., 2010, 130, p. 1785–1796.
12. DING, X., WANG, T., SHEN, Y. et al. Prevalence of psoriasis in China: a population-based study in six cities. Eur. J. Dermatol., 2012, 22, p. 663–667.
13. EDER, L., HADDAD, A., ROSEN, C. F. et al. The incidence and risk factors for psoriatic arthritis in patients with psoriasis – a prospective cohort study. Arthritis Rheumatol., 2016, 68, p. 915–923.
14. GARCIA-DOVAL, I., CARRETERO, G., VANACLOCHA, F. et al. Risk of serious adverse events associated with biologic and nonbiologic psoriasis systemic therapy: patients ineligible vs eligible for randomized controlled trials. Arch. Dermatol., 2012, 148, p. 463–470.
15. GERDES, S., OSADTSCHY, S., BUHLES, N. et al. Cardiovascular biomarkers in patients with psoriasis. Exp. Dermatol., 2014, 23, p. 322–325.
16. GNIADECKI, R., BANG, B., BRYLD, L. E. et al. Comparison of long-term drug survival and safety of biologic agents in patients with psoriasis vulgaris. Br. J. Dermatol., 2015, 172, p. 244–252.
17. GRUNDY, S. M., BREWER, H. B. Jr, CLEEMAN, J. I. et al. Definition of Metabolic Syndrome: report of the National Heart, Lung, and Blood Institute/American Heart Association conference on scientific issues related to definition. Arterioscler. Thromb. Vasc. Biol., 2004, 24, p. e13–e18.
18. GUPTA, R., DEBBANEH, M. G., LIAO, W. Genetic Epidemiology of Psoriasis. Curr. Dermatol. Rep., 2014, 3, p. 61–78.
19. HÄGG, D., ERIKSSON, M., SUNDSTRÖM, A. et al. The Higher Proportion of Men with Psoriasis Treated with Biologics May Be Explained by More Severe Disease in Men. PLoS One, 2013, 5, e63619.
20. HORN, E. J., FOX, K. M., PATEL, V. et al. Are patients with psoriasis undertreated? Results of National Psoriasis Foundation survey. J. Am. Acad. Dermatol., 2007, 57, p. 957–962.
21. HUERTA, C., RIVERO, E., RODRÍGUEZ, L. A. Incidence and risk factors for psoriasis in the general population. Arch. Dermatol., 2007, 143, p. 1559–1565.
22. ISKANDAR, I. Y., AAHCROFT, D. M., WARREN, R. B. et al. Demographics and disease characteristics of patients with psoriasis enrolled in the British Association of Dermatologists Biologic Interventions Register. Br. J. Dermatol., 2015, 173, p. 510–518.
23. KAYE, J. A., LI, L., JICK, S. S. Incidence of risk factors for myocardial infarction and other vascular diseases in patients with psoriasis. Br. J. Dermatol., 2008, 159, 895–902.
24. KIMBALL, A. B., GLADMAN, D., GELFLAND, J. M. et al. National Psoriasis Foundation clinical consensus on psoriasis comorbidities and recommendations for screening. J. Am. Acad. Dermatol., 2008, 58, p. 1031–42.
25. LEBWOHL, M. G., BACHELEZ, H., BARKER, J. et al. Patient perspectives in the management of psoriasis: Results from the population-based Multinational Assessment of Psoriasis and Psoriatic Arthritis Survey. J. Am. Acad. Dermatol., 2014, 70, p. 871–881.
26. LECLUSE, L. L., NALDI, L., STERN, R. S. et al. National registries of systemic treatment for psoriasis and the European ‘Psonet’ initiative. Dermatology, 2009, 218, p. 347–356.
27. MA, C., HARSKAMP, C. T., ARMSTRONG, E. J. et al. The association between psoriasis and dyslipidaemia: a systematic review. Br. J. Dermatol., 2013, 168, p. 486–495.
28. MAZA, A., RICHARD, M. A., AUBIN, F. et al. Significant Delay in the Introduction of Systemic Treatment of Moderate to Severe Psoriasis Severe Psoriasis. Br. J. Dermatol., 2012, 167, p. 643–648.
29. MEASE, P. J., GLADMAN, D. D., PAPP, K. A. et al. Prevalence of rheumatologist-diagnosed psoriatic arthritis in patients with psoriasis in European/North American dermatology clinics. J. Am. Acad. Dermatol., 2013, 69, p. 729–735.
30. MEIJER, K., DE VRIES, M., AL-LAHHAM, S. et al. Human Primary Adipocytes Exhibit Immune Cell Function: Adipocytes Prime Inflammation Independent of Macrophages. PLoS ONE, 2011, 6, e17154.
31. MENTER, A., KORMAN, N. J., ELMENTS, C. A. et al. Guidelines of care for the management of psoriasis and psoriatic arthritis: section 4. Guidelines of care for the management and treatment of psoriasis with traditional systemic agents. J. Am. Acad. Dermatol., 2009, 61, p. 451–485.
32. NALDI, L., CHATENOUD, L., LINDER, D. et al. Cigarette smoking, body mass index, and stressful life events as risk factors for psoriasis: results from an Italian case-control study. J. Invest. Dermatol., 2005, 125, p. 61–67.
33. NALDI, L., CONTI, A., CAZZANIGA, S. et al. Diet and physical exercise in psoriasis: a randomized controlled trial. Br. J. Dermatol., 2014, 170, p. 634–642.
34. NATALI, A., TOSCHI, E., BALDEWEG, S. et al. Clustering of insulin resistance with vascular dysfunction and low-grade inflammation in type 2 diabetes. Diabetes, 2006, 55, p. 1133–1140.
35. NEIMANN, A. L., SHIN, D. B., WANG, X. et al. Prevalence of cardiovascular risk factors in patients with psoriasis. J. Am. Acad. Dermatol., 2006, 55, p. 829–835.
36. Obesity Update, OECD 2014, dostupné 2.11.2015: http://www.oecd.org/health/Obesity-Update-2014.pdf
37. ORMEROD, A. D., AUGUSTIN, M., BAKER, C. et al. Challenges for synthesising data in a network of registries for systemic psoriasis therapies. Dermatology, 2012, 3, p. 236–243.
38. PARISI, R., SYMMONS, D. P. M., GRIFFITHS, C. E. et al. Identification and Management of Psoriasis and Associated Comorbidity (IMPACT) project team. Global Epidemiology of Psoriasis: A Systematic Review of Incidence and Prevalence. J. Invest. Dermatol., 2013, 133, p. 377–385.
39. POULIN, Y., PAPP, K. A., WASEL, N. R. et al. A Canadian online survey to evaluate awareness and treatment satisfaction in individuals with moderate to severe plaque psoriasis. Int. J. Dermatol., 2010, 49, p. 1368–1375.
40. QUERSHI, A. A., CHOI, H. K., SETTY, A. R. et al. Psoriasis and the risk of diabetes and hypertension: a prospective study of US female nurses. Arch. Dermatol., 2009, 145, p. 379–382.
41. RACHAKONDA, T. D., SCHUPP, C. W., ARMSTRONG, A. W. J. Psoriasis prevalence among adults in the United States. Am. Acad. Dermatol., 2014, 70, p. 512–516.
42. RANZA, R., CARNEIRO, S., QUERSHI, AA. et al. Prevalence of psoriatic arthritis in a large cohort of Brazilian patients with psoriasis. J. Rheumatol., 2015, 42, p. 829–834.
43. RAYCHAUDHURI, S. P., GROSS, J. Psoriasis risk factors: role of lifestyle practices. Cutis, 2000, 66, p. 348–352.
44. REICH, K., KRÜGER, K., MÖSSNER, R. et al. Epidemiology and clinical pattern of psoriatic arthritis in Germany: a prospective interdisciplinary epidemiological study of 1511 patients with plaque-type psoriasis. Br. J. Dermatol., 2009, p. 160 : 1040–1047.
45. REICH, K., MROWIETZ, U., RADTKE, M. A. et al. Drug safety of systemic treatments for psoriasis: results from The German Psoriasis Registry PsoBest. Arch. Dermatol. Res., 2015, 307, p. 875–883.
46. RENCZ, F., KEMÉNY, L., GAJDÁCSI, J. Z. et al. Use of biologics for psoriasis in Central and Eastern European countries. J. Eur. Acad. Dermatol. Venereol., 2015, 29, p. 2222–2230.
47. RONTI, T., LUPATELLI, G., MANNARINO, E. The endocrine function of adipose tissue: an update. Clin. Endocrinol, 2006, 64, p. 355–365.
48. SCHMITT-EGENOLF, M. Psoriasis therapy in real life: the need for registries. Dermatology, 2006, 213, p. 327–330.
49. SPELMAN, L., SU, J. C., FERNANDES-PEŇAS, P. et al. Frequency of undiagnosed psoriatic arthritis among psoriasis patients in Australian dermatology practice. J. Eur. Acad. Dermatol. Venereol., 2015, 29, p. 2184–2191.
50. Státní ústav pro kontrolu léčiv, dostupné 10.10.2016: http://www.sukl.cz/modules/medication/search.php.
51. TAKAHASHI, H., TSUJI, H., HASHIMOTO, Y. Serum cytokines and growth factor levels in Japanese patients with psoriasis. Clin. Exp. Dermatol., 2010, 35, p. 645–649.
52. ÚZIS ČR: Aktuální informace č. 2/2015, dostupné 10.10.2016: www.uzis.cz/system/files/ai_2015_02.pdf).
53. VAN DE KERKHOF, P. C., REICH, K. et al. Physician perspectives in the management of psoriasis and psoriatic arthritis: results from the population-based Multinational Assessment of Psoriasis and Psoriatic Arthritis survey. J. Eur. Acad. Dermatol. Venereol., 2015, 29, p. 2002–2010.
54. WOLK, K., MALLBRIS, L., LARSSON, P. et al. Excessive body weight and smoking associates with a high risk of onset of plaque psoriasis. Acta Derm. Venereol., 2009, 89, p. 492–497.
55. World Health Organisation, BMI classification, dostupné 2.11.2015: http://apps.who.int/bmi/index.jsp?introPage=intro_3.html.
56. Zpráva o zdraví obyvatel České republiky. Ministerstvo zdravotnictví České republiky, Praha 2014, dostupné 10.10.2016: http://www.mzcr.cz/verejne/dokumenty/zprava-o-zdravi-obyvatel-ceske-republiky2014-_9420_3016_5.html).
Štítky
Dermatologie Dětská dermatologie
Článek Odborné akce v roce 2016Článek Případ méně obvyklé mykózy
Článek vyšel v časopiseČesko-slovenská dermatologie
Nejčtenější tento týden
2016 Číslo 5- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Condylomata accuminata a jejich prevence i léčba
- Proces hojení ran krok za krokem a co ho může zkomplikovat
- Miniinvazivní léčba pilonidálního sinu: laserová a podtlaková terapie jako šetrná a účinná modalita
- Co s NSTI? NPWT!
-
Všechny články tohoto čísla
-
Kontaktní dermatitidy – část II:
epikutánní testy v současné praxi -
DOŠKOLOVÁNÍ LÉKAŘŮ
KONTROLNÍ TEST - Analýza pacientů se středně těžkou až těžkou psoriázou před zahájením biologické léčby v České republice – údaje z registru BIOREP 2005–2016
- Atypický fibroxantom – popis případu
- Případ méně obvyklé mykózy
- Klinický případ: generalizovaný exantém u dítěte
- Dermatoskopie nepigmentovaných kožních nádorů. Nepigmentované formy melanocytových névů a maligního melanomu
-
Zápis ze schůze výboru ČDS
konané dne 9. 6. 2016 v Praze -
Odešel prof. MUDr. Zdeněk Vlašín, DrSc.
(*8. 5. 1930–† 2. 10. 2016) - Odborné akce v roce 2016
-
Kontaktní dermatitidy – část II:
- Česko-slovenská dermatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle-
Kontaktní dermatitidy – část II:
epikutánní testy v současné praxi - Dermatoskopie nepigmentovaných kožních nádorů. Nepigmentované formy melanocytových névů a maligního melanomu
- Atypický fibroxantom – popis případu
- Případ méně obvyklé mykózy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



