-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPřehled biomarkerů a jejich vztah k axiálním spondyloartritidám asociovaným s idiopatickými střevními záněty
Overview of biomarkers and their relationship to axial spondyloarthritis associated with idiopathic inflammatory bowel diseases
Axial spondyloarthritis (spondyloarthropathies or spondyloarthritides – axSpA) accompanied by idiopathic bowel disease (IBD), also known as enteropathic spondyloarthritis, are systemic diseases characterized by chronic inflammation of both the musculoskeletal and gastrointestinal tracts. The incidence of IBD in patients with spondylarthritis (SpA) has been reported in 6–14%, but almost 60% of patients with SpA have subclinical macroscopic or microscopic inflammatory bowel disease on endoscopic examination. The presence of the human leukocyte antigen 27 (HLA-B27) gene in SpA/IBD is around 50–80%. This is significantly less than in ankylosing spondylitis (AS), where about 85–95% of patients are HLA-B27 positive. To date, there are few markers that can predict the development of IBD in axSpA. Endoplasmic reticulum aminopeptidase (ERAP-1) appears to be a promising indicator. ERAP-1 is also considered as one of the possible pathophysiological factors that contribute to the development of ulcerative colitis (UC) in patients with axSpA. Other gene variants related to the IL-17/23 pathway have been described. In IBD, a NOD2/CARD15 polymorphism appears to be the candidate gene. The presence of at least one of the three known gene variants of NOD2/CARD15 increases the risk of developing IBD, especially Crohn’s disease (CD), and is also associated with the risk of developing sacroiliitis in patients with IBD. Unlike HLA-B27, NOD2/CARD15 is not associated with a risk of developing SpA in patients with IBD. Disease-specific shared genes such as IL23R, IL12B, STAT3, PTGER4, and others have also been described. Acute phase reactants (CRP, ESR), composite indices (BASDAI, ASDAS score), a group of cytokines (IL-2, IL-6, IL-11, IL-23), pANCA antibodies, ASCA antibodies, and serum and faecal calprotectin are used to diagnose or evaluate disease activity. Predictors of radiographic progression in axSpA include, e.g., the determination of DKK-1, sclerostin and antisclerostin. In this work, we present an overview of the most promising biomarkers to date and their relationship to axial spondylarthritis associated with IBD. Finding suitable biomarkers could shed light not only on the pathogenesis of the disease but also on the possibility of correlating the mutual activity of axSpA and IBD.
Keywords:
Ulcerative colitis – biomarkers – Crohn’s disease – axial spondyloarthritis – idiopathic inflammatory boewl disease
Autoři: L. Ondrejčáková; M. Gregová; L. Šenolt; K. Pavelka
Působiště autorů: Revmatologická klinika 1. LF UK Praha ; Revmatologický ústav Praha
Vyšlo v časopise: Čes. Revmatol., 29, 2021, No. 2, p. 114-124.
Kategorie: Přehledové články
Souhrn
Axiální spondyloartritidy (axSpA) provázené idiopatickým střevním zánětem (ISZ), známé také pod názvem enteropatické spondyloartritidy, jsou systémová onemocnění charakterizovaná chronickým zánětem jak muskuloskeletálního, tak gastrointestinálního traktu. Výskyt ISZ u pacientů se spondyloartritidiou (SpA) byl popsán v 6–14 %, ale téměř 60 % pacientů se SpA má subklinický makroskopický nebo mikroskopický střevní zánět při endoskopickém vyšetření. Přítomnost genu human leukocyte antigen 27 (HLA-B27) u SpA/ISZ se pohybuje kolem 50–80 %. To je podstatně méně než u ankylozují spondylitidy (AS), kde je HLA-B27 pozitivních asi 85–95 % nemocných. Doposud je jen málo markerů, které dokážou predikovat rozvoj ISZ u axSpA. Jako slibný ukazatel se jeví aminopeptidáza endoplazmatického retikula (ERAP-1). ERAP-1 je také zvažován jako jeden z možných patofyziologických faktorů, které přispívají k rozvoji ulcerózní kolitidy (UC) u pacientů s axSpA. Popsány byly další genové varianty související s dráhou IL-17/23. U ISZ se kandidátním genem jeví polymorfismu NOD2/CARD15. Přítomnost alespoň jedné ze tří známých genových variant NOD2/CARD15 několikanásobně zvyšuje riziko vzniku ISZ, zejména Crohnovy choroby (CD) a současně souvisí s rizikem rozvoje sakroilitidy u pacientů s ISZ. Na rozdíl od HLA-B27 není NOD2/CARD15 spojen s rizikem vývoje SpA u pacientů s ISZ. Popsané byly i sdílené chorobou specifické geny, např. IL23R, IL12B, STAT3, PTGER4 a další. K diagnostice či hodnocení aktivity onemocnění slouží reaktanty akutní fáze (CRP, FW), kompozitní indexy (BASDAI, ASDAS skóre), skupina cytokinů (IL-2, IL-6, IL-11, IL-23), pANCA protilátky, ASCA protilátky, sérový a fekální kalprotektin. Mezi prediktory radiografické progrese u axSpA lze zařadit například stanovení DKK-1, sclerostinu a antisclerostinu. V této práci uvádíme přehled doposud nejslibnějších biomarkerů a jejich vztah k axiálním spondyloartritidám asociovaným s ISZ. Nalezení vhodných biomarkerů by mohlo ozřejmit nejen patogenezi onemocnění, ale současně možnost korelovat vzájemnou aktivitu onemocnění axSpA a ISZ.
ÚVOD
Spondyloartritidy (SpA) zařazujeme do skupiny chronických zánětlivých imunitně podmíněných revmatických onemocnění, která mají společné genetické, klinické a radiologické rysy. Dle dominantní lokalizace zánětlivého poškození můžeme SpA rozdělit na formu axiální, postihující preferenčně osový skelet, a na formu periferní nejčastěji v podobě asymetrické oligoartritidy zejména kloubů dolních končetin (1). Samotnou axiální formu spondyloartritidy (axSpA) rozdělujeme dle klasifikačních kritérií ASAS (Assessment of SpondyloArthritis International Society) na skupinu radiografickou, kdy mají pacienti průkaznou sakroiliitidu na rentgenu (RTG), a splňují tak newyorská klasifikační kritéria pro ankylozujíci spondylitidu (AS) (2, 3). Druhou je skupina neradiografická, kdy je sakroiliitida prokazatelná na magnetické rezonanci (MR) nebo pacienti splňují klinická kritéria pro tuto formu onemocnění (2, 3). Kromě postižení páteřních struktur ve smyslu sakroiliitidy a spondylitidy mohou mít pacienti se SpA celou řadu mimokloubních projevů, například oční, kožní, gastrointestinální, slizniční, kardiovaskulární nebo plicní (4). K jednomu z extraskeletálních projevů patří idiopatické střevní záněty (ISZ), mezi které je řazena Crohnova choroba (CD) a ulcerózní kolitida (UC). V tomto přehledném článku se zaměříme na biomarkery u skupiny axiálních spondyloartritid asociovaných s idiopatickými střevními záněty (enteropatické spondyloartritidy).
Je známo, že výskyt ISZ u pacientů se SpA je 6–14 %, ale téměř 60 % pacientů se SpA má subklinický makroskopický nebo mikroskopický střevní zánět (5–7). Z nich přibližně 5–20 % vyvine CD do 5 let (8, 9). U časných axSpA byla frekvence ISZ vypočítána na 2,6 %, tj. 1,7 % pro AS a 0,9 % pro neradiograficku axSpa (10). Bylo zhodnoceno, že riziko vzniku ISZ je výraznější v prvních letech od
stanovení diagnózy AS a postupně klesá v průběhu 10 let. Míra výskytu ISZ byla 5,3krát vyšší u pacientů s AS ve srovnání se zdravými kontrolami (4). Pro neradiografickou axSpA byly výsledky podobné (4). Naopak, axiální postižení bylo častěji pozorováno u CD (5–20 %) než u UC (2–6 %) a obvykle předcházelo střevním projevům (8, 9, 11, 12). Přítomnost mikroskopického střevního zánětu u axSpA byla nejčastěji asociována s mladším věkem, mužským pohlavím, s časným nástupem nemoci, vysokou aktivitou základního onemocnění a radiologicky přítomnou sakroiliitidou (7, 13).V posledních letech se objevilo několik nadějných markerů, které by u pacientů s axSpA asociovaných s ISZ mohly hrát zásadní roli. Biomarkery jsou důležitým ukazatelem rizikovosti dané nemoci, měly by být dostatečně přesné, reprodukovatelné a neinvazivní (14). Můžeme je rozdělit na genetické, biochemické, biomarkery aktivity onemocnění a strukturální progrese.
GENETICKÉ BIOMARKERY
HLA-B27 (human leukocyte antigen 27)
Doposud nejvýznamnějším genetickým faktorem asociovaným se SpA je human leukocyte antigen 27 (HLA-B27) (15). Jde o povrchový antigen třídy I kódovaný lokusem B v hlavním histokompatibilním komplexu (MHC) na chromozomu 6 (15). Nejsilnější vazbu má zejména u pacientů s AS, kde je pozitivní přibližně v 90 %. Výskyt antigenu HLA-B27 vykazuje významné geografické rozdíly, v oblasti střední Evropy je v populaci zdravých jedinců přítomen přibližně v 8 % (16, 17). Bylo zjištěno, že výskyt HLA-B27 u pacientů s AS asociovaných s ISZ se pohybuje mezi 50–80 %, což je podstatně méně, než je tomu u samotné AS (18–21). Gen HLA-B27 je rizikovým faktorem pro vznik SpA a podílí se pravděpodobně i na patogenezi samotné AS několika mechanismy. Ty zahrnují například artrigenní peptidovou teorii, aberantní formy, chybné složení a dimerizaci či nadměrnou alteraci střevního mikrobiomu (22).
ERAP (endoplasmic reticulum aminopeptidase)
Aminopeptidáza endoplazmatického retikula (ER) ERAP-1 (známá také pod názvem ARTS-1) a ERAP-2 je klíčový cytoplazmatický protein patřící do rodiny metaloproteináz (23). Její hlavní úlohou je zapracování ligandů do struktury MHC-I za přítomnosti jednonukleotidových polymorfismů (SNP) (24). Studie uvádějí, že asociace genové varianty ERAP-1 je omezena pouze na HLA-B27 pozitivní pacienty oproti genové variantě pro ERAP-2, kde se předpokládá riziko propuknutí choroby nezávisle na přítomností HLA-B27 (24, 25). Studie ukazují, že polymorfismus ERAP-1 (rs26653) u ISZ může být důležitým faktorem ovlivňujícím patogenezi UC u pacientů s axSpA (OR = 2,9) (14, 26). Kromě vývoje do AS je aminopeptidáza ERAP-1 a ERAP-2 spojena
s řadou jiných autoimunitních nemocí, například diabetem mellitem 1. typu, psoriázou, roztroušenou sklerózou a dalšími (24, 25).IL-23R polymorfismus
Byly identifikovány i další geny, které přímo souvisejí se SpA nebo ISZ. Z nich se jako nevýznamnější ukazují genové varianty související se signální kaskádou interleukin (IL) IL-17/IL-23 (27). Receptor IL-23 je exprimován velkým množstvím buněk včetně Th-17 lymfocytů, kde podporuje jejich diferenciaci a zvyšuje produkci IL-17, IL-21 a IL-22 (28). Tato deregulace hraje pravděpodobně zásadní roli při rozvoji AS (28). V samotných mitogenem aktivovaných lymfocytech je přibližně 24 variant sestřihu genu IL-23R. Mohou tedy existovat rozdíly v aktivaci Th17, což vede k různé imunitní odpovědi a regulaci zánětu (29). Přesná role polymorfismu IL-23 zůstává nadále neobjasněná. Dle některých studií je předpoklad, že tyto signální dráhy se mohou podílet jak na patogenezi AS, tak ISZ
(30, 31). Předpokládá se, že polymorfismus IL-23 může mít i protektivní význam jak pro vznik ISZ (OR = 0,38), tak pro AS (OR = 0,53–1,27) (14). Byly detekovány i další polymorfismy např. IL12B, LTBR-TNFRSF1A, CARD9), které mohou být zvýšeně exprimovány u SpA i ISZ (27).Polymorfismus NOD2/CARD15
Dalším významným genem je polymorfismus NOD2 (nucleotide-binding oligomerization domain 2), označovaný také jako CARD15 (caspase recruitment domain 15). NOD2 gen, umístěný na chromozomu 16 (16q12), kóduje protein patřící do rodiny Nod2-like receptorů, který je exprimovaný v monocytech, makrofázích, dentritických a Panethových buňkách (32). Tento intracelulární receptor hraje důležitou roli u vrozené imunitní odpovědi aktivací nukleárního faktoru-κB (NF-κB) (33–35). NF-κB je regulátor transkripce široké škály genů kódujících prozánětlivé cytokiny, růstové faktory a enzymy (32, 36–39). Výsledkem je NOD2 protein, který je odpovědný za pozitivní regulaci imunitní reakce ve střevech a indukci prozánětlivého stavu (32). Předpokládá se, že porušením této regulace dochází u nosičů genového polymorfismu NOD2/CARD15 k přetrvávajícímu slizničnímu zánětu (40–42).
Jako sekvenční varianty v NOD2 genu asociované s CD jsou označované dvě jednonukleotidové substituce p.R702W (rs139104022) a p.G908R (rs2066845), které vedou ke změně aminokyselinové sekvence v NOD2 proteinu a jednobázové inzerce cytosinu v sekvenci NOD2 genu p.L1007fs (rs2066847) (35, 43–45). Uvádí se, že přítomnost jedné ze sekvenčních variant v NOD2 genu je v porovnání se zdravými jedinci 2–4krát vyšší u heterozygotů a přibližně 17krát vyšší u nosičů dvou variant homozygotů či složených heterozygotů (35, 46).
Jiné eseje poukazují na riziko rozvoje CD u heterozygotů přibližně 3krát, u homozygotů a složených heterozygotů 33–44krát (14). NOD2/CARD15 současně souvisí s rozvojem sakroiliitidy u pacientů s ISZ (14, 38, 39, 47, 48). Přítomný genový polymorfismus NOD2/CARD15 predisponuje u AS ke zvýšenému riziku subklinického střevního zánětu (48). Na rozdíl od genu HLA-B27, gen NOD-2/CARD15 není spojen s rizikem vývojem SpA u pacientů s ISZ (49).
Celogenomová asociační studie (GWAS) poukázala na další geny, které se pojí s výskytem ISZ. Sem patří například gen ATG16L1, který je exprimován ve střevních epiteliálních buněčných liniích a zvyšuje riziko výskytu Crohnovy choroby (50, 51). U ulcerózní kolitidy byly popsány geny HLA-DRA, IRF5, FcGRIIa a IL-10, které u CD nebyly zaznamenány (52). S rizikem vzniku CD a UC je spojován také polymorfismus IRGM umístěný na chromozomu 5 (5q33) (35, 53).
Specifické sdílené geny
ISZ i SpA mohou vykazovat i sdílené specifické geny. To poukazuje na možný fakt, že existuji společné mechanismy patogeneze u obou nemocí. Mezi sdílené specifické geny v rámci osy IL-17/23 patří například IL23R, IL12B, JAK2, PUS 10, STAT3, PTGER4. U dráhy NF-κB jsou to například CARD9 či REL (tab. 1) (27). Studie popisují i další geny, které se pojí s rizikem vzniku SpA, mezi které patří DEFB4 (Defensin beta 4B), CDKAL1 (Cyclin dependent kinase 5 regulatory subunit associated protein 1 – like 1), KIF21B (Kinesin Family Member 21B), ORMDL3 (Orosomucoid 1 – like 3) a MST1 (Macrophage-stimulating protein 1), nicméně jejích význam a přesná role zůstávají neobjasněny (27).
Tab. 1. Stručný přehled chorobou sdílených specifických genů u AS a ISZ (27) 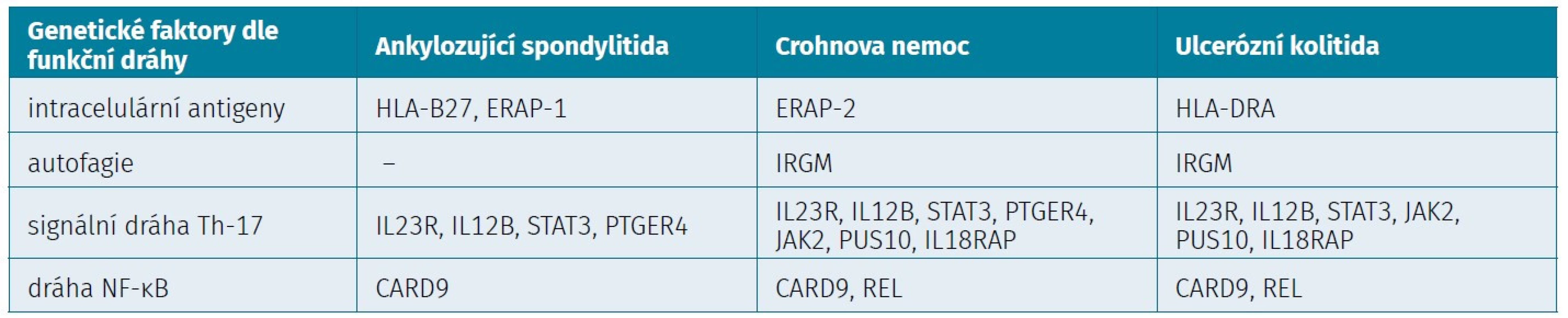
HLA-B27 – humaní leukocytární antigen 27, ERAP-1 – aminopeptidáza endoplasmitckého reticula 1, ERAP-2 – aminopeptidáza endoplasmatického retikula 2, HLA-DRA – heterodimer humánního leukocytárního antigenu řeťezců alfa, IRGM – gen pro imunitní M-protein z rodiny guanosin trifosfátázy, IL23R – receptor interleukinu 23, IL12B – interleukin 12β, STAT3 – signální transduktor a aktivátor transkripce 3, PTGER4 – genový receptor 4 prostaglandinu E (subtyp E4), JAK2 – Janusová kináza 2, PUS10 – pseudouridinová syntáza 10, IL18RAP – příslušný protein pro receptor interleukinu 18, NF-κB – nukleární faktor kappa B, CARD9 – kaspázový protein 9, REL – retikuloendotheliální onkogen, Th-17 – pomocné T-lymfocyty 17 (27) BIOMARKERY AKTIVITY ONEMOCNĚNÍ
Součástí vyšetření každého pacienta s axiální spondyloartritidou je numerické hodnocení aktivity onemocnění pomocí skórovacího systému. Klasickým kompozitním ukazatelem aktivity u AS je index BASDAI (Bath Ankylosing Spondylitis Disease Activity Index), který je součástí doporučení ASAS (54). S odstupem byl navržen nový kompozitní index ASDAS, který zahrnuje i hodnotu CRP a tím zvyšuje objektivitu hodnocení aktivity axSpA (55).
Biochemické biomarkery
Reaktanty akutní fáze
V současné klinické praxi patří mezi používané reaktanty akutní fáze C-reaktivní protein (CRP) a rychlost sedimentace erytrocytů (FW). CRP jako marker systémové zánětlivé odpovědi je základním parametrem pro hodnocení aktivity nemoci u pacientů s axSpA (AS a nr-SpA) a je součástí skórovacího systému ASDAS (14, 56).
Rutinní metody detekce CRP (např. turbidimetricky, nefelometricky) nejsou dostatečně senzitivní, proto byla vyvinuta metoda vysoce senzitivního CRP (hs-CRP), u kterého se prokázala lepší korelace s klinickými parametry odrážejícími aktivitu onemocnění u AS (56). U pacientů s IZS hladiny CRP korelovaly s aktivitou nemoci a s odpovědí na léčbu (57, 58). V současnosti jsou reaktanty akutní fáze zatím jediné biochemické markery používané k hodnocení aktivity onemocnění u AS (10).
Cytokiny
Jedním z nejdůležitějších mediátorů akutní fáze je cytokin IL-6 kódovaný genem IL6, působící přes cytokinový receptor typu I, který je umístěn na povrchu buněk (14). Zvýšené sérové hladiny IL-6 spolu s hladinami CRP byly zaznamenány u pacientů se SpA a ISZ (14). U pacientů se SpA byly pozorovány také zvýšené sérové koncentrace IL-23 ve srovnání se zdravými jedinci, nejvyšší koncentrace byly detekovány v synoviální tekutině (59–61). Sérová koncentrace IL-23 korelovala s aktivitou nemoci a současně korelovala s kompozitními indexy, jako jsou indexy BASDAI, BASFI (Bath Ankylosing Spondylitis Functional Index) a BASMI (Bath Ankylosing Spondylitis Metrology Index) (62). Zajímavé ale je, že pokusy o terapeutické ovlivnění hladin IL-23 preparátem risenkizumab (monoklonální protilátka proti p19 podjednotce IL-23) u pacientů s axSpA nebyly úspěšné (63). Malá studie zaznamenala významně zvýšené hladiny IL-23 u jedenácti pacientů se SpA/ISZ (67,73 ± 40,85 pg/ml) ve srovnání s 26 pacienty s ISZ (37,15 ± 10,37 pg/ml) (64). Byly detekovány i další markery, například IL-2, IL-6 a IL-11, IL-33, které korelovaly s aktivitou nemoci u pacientů s AS (59, 60, 65).
Sérový kalprotektin (sCLP)
Kalprotektin (CLP) je cytosolový leukocytární protein patřící do rodiny S100 proteinů a představuje přibližně 60 % bílkoviny obsažené v lidských neutrofilech (66, 67). Je považován za významný senzitivní diagnostický, ale nespecifický marker zánětlivých onemocnění (66). Role kalprotektinu v patogenezi, diagnostice a monitorování revmatických onemocnění si v posledních letech získala velkou pozornost (66). CLP je zvýšeně exprimován v synoviální tkáni nemocných se SpA. Tím nepřímo ukazuje přítomnost polymorfonukleárů a monocytů odpovědných za jeho produkci v synoviální tkáni (68). Ve dvouletém sledování nemocných s AS bylo zaznamenáno, že přetrvávající koncentrace sCLP > 0,5 mg/ml byly spojeny se zhoršením Modified Stoke Ankylosing Spondylitis Spine Score (MSASSS) (OR = 6,2 (95% CI: 1,6–24,2), p = 0,009) a vývojem či progresí syndesmofytů (OR = 4,0 (95% CI: 1,2–12,6), p = 0,020) (69). Hladiny sCLP byly podstatně vyšší u pacientů s axSpA, kteří měli radiologicky závažnější onemocnění, než u zdravých jedinců a je považován za nezávislý prediktor rentgenové progrese u axiální SpA (69–71). Hladiny sCLP korelovaly s hladinami CRP a FW (CRP: rs = 0,382,
p = 0,001, FW: rs = 0,401, p < 0,001) (66, 69). Nebyla nalezena téměř žádná korelace mezi sCLP a kompozitními indexy (ASDAS, BASDAI či BASFI) (5, 66, 69, 72–74).Fekální kalprotektin (fCLP)
Kalprotektin se nachází nejenom v synoviálních kloubech, ale je přítomen také v gastrointestinální sliznici. Je detekován ve vzorku stolice (fekální kalprotektin – fCLP) a jeho koncentrace odpovídá stupni zánětu GIT (14, 66, 75). Dle longitudinální pětileté studie byly popsány na kohortě 164 pacientů s AS vysoké koncentrace fCLP, se kterými korelovala i míra aktivity nemoci (70). Hodnota fCLP korelovala se zánětlivými parametry (CRP: p = 0,005, FW: p = 0,027) a současně s aktivitou nemoci u AS (ASDAS: p = 0,008, BASFI: p = 0,048) (71). Hodnoty fCLP navíc predikovaly možný vývoj do CN (kumulativní výskyt 1,5 % za 5 let) (14). Bylo poukázáno i na spojitost mezi kouřením, kde aktivní kuřáci měli v porovnání s nekuřáky podstatně vyšší hladiny fCLP (p = 0,026). Vyšší hladiny fCLP byly zaznamenány také u uživatelů NSAID (p = 0,011) (71). Hodnoty fCLP korelovaly s hladinami sCLP a byly významně vyšší u pacientů s mikroskopickým střevním zánětem (rs = 0,170, p = 0,030) (5, 71). Pouze část pacientů s vysokým fCLP vykazovala současně klinické či subklinické známky střevního zánětu (tab. 2) (71).
Tab. 2. Zánětlivé biomarkery a jejich vztah k aktivitě onemocnění 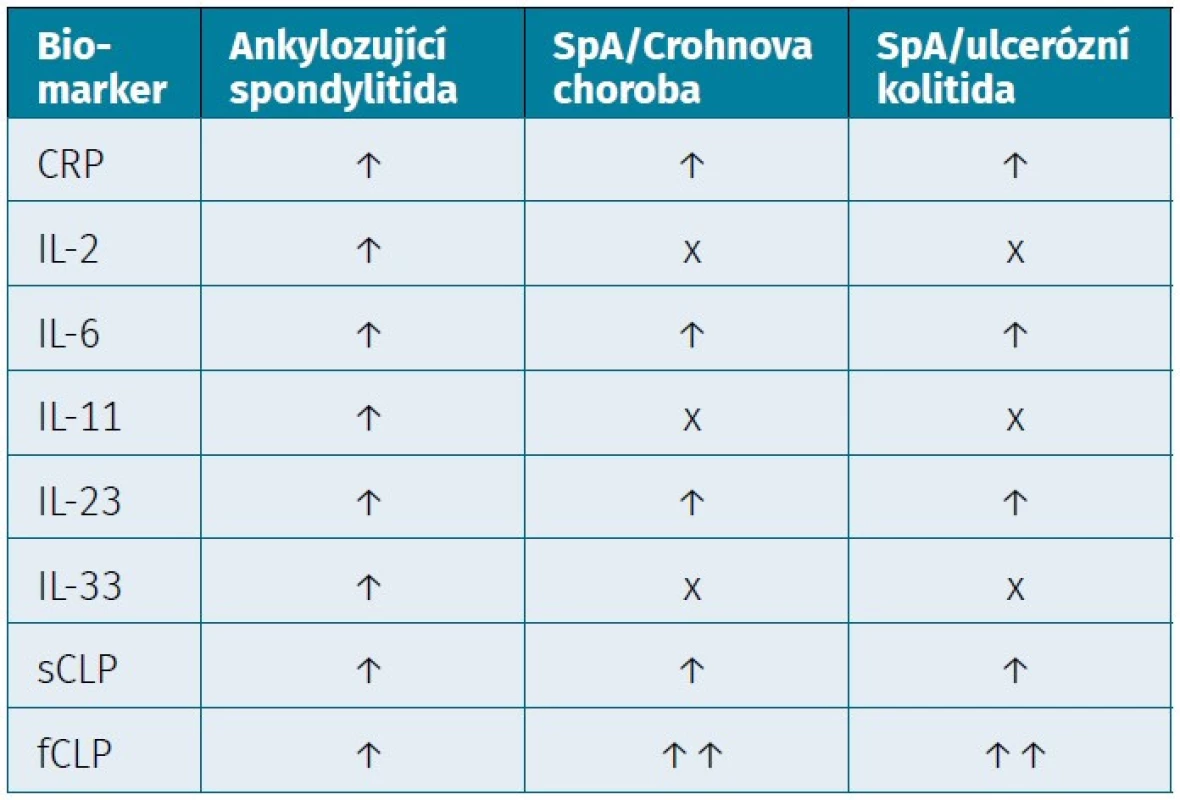
CRP – C-reaktivní protein, IL-6 – interleukin 6, IL-2 – interleukin 2, IL-11 – interleukin 11, IL-23 – interleukin 23, IL-33 – interleukin 33, sCLP – sérový kalprotektin, fCLP – fekální kalprotektin Fekální kalprotektin (fCLP)
Protilátky proti Saccharomyces cerevisiae (anti-ASCA) a perinukleární protilátky proti cytoplazmě neutrofilních granulocytů (pANCA)
U pacientů s ISZ bylo zkoumáno několik sérových protilátek, ze kterých diagnosticky nejnadějnější jsou protilátky ASCA IgG a IgA a protilátky pANCA (76). Tyto protilátky mají velký význam v diferenciální diagnostice mezi UC a CD. Přítomnost ASCA protilátek a chybění pANCA protilátek v séru pacienta má 49% senzitivitu a 97% specificitu pro CD, a naopak přítomnost pANCA protilátek a chybění ASCA protilátek má 57% senzitivitu a 99% specificitu pro UC (77, 78).
V kohortě 179 pacientů (52 pacientů s AS, 50 pacientů s UC, 51 pacientů s CN a 26 pacientů s ISZ a AS) byly protilátky ASCA nalezeny v 40 % u nemocných se SpA a CD, 30 % u samotné AS a 90 % u pacientů s CN (14, 79). Bylo ukázáno, že u pacientů se SpA byly hladiny ASCA protilátek ve třídě IgA vyšší než u zdravých kontrol, ale nesouvisely přímo s přítomností střevního zánětu (14). Později se potvrdilo, že ASCA IgA jsou vyšší u pacientů se SpA než u zdravých kontrol a jejich vyšší hladiny předpokládají i vyšší aktivitou onemocnění (80, 81). V kohortové studií 80 pacientů s AS bez přítomnosti ISZ byl zaznamenán výskyt ASCA IgA přibližně v 19 % a u ASCA IgG v 8 % (14, 79). Protilátky pANCA byly častěji nalezeny u pacientů s AS a se současnou UC (OR 8,2, 95% CI: 1,2–55,6) než u samotné AS (79). Je uváděno, že u pacientů s AS byl výskyt pANCA přibližně v 21 % (tab. 3) (79).
Tab. 3. Imunologické biomarkery a jejich vztah k aktivitě onemocnění 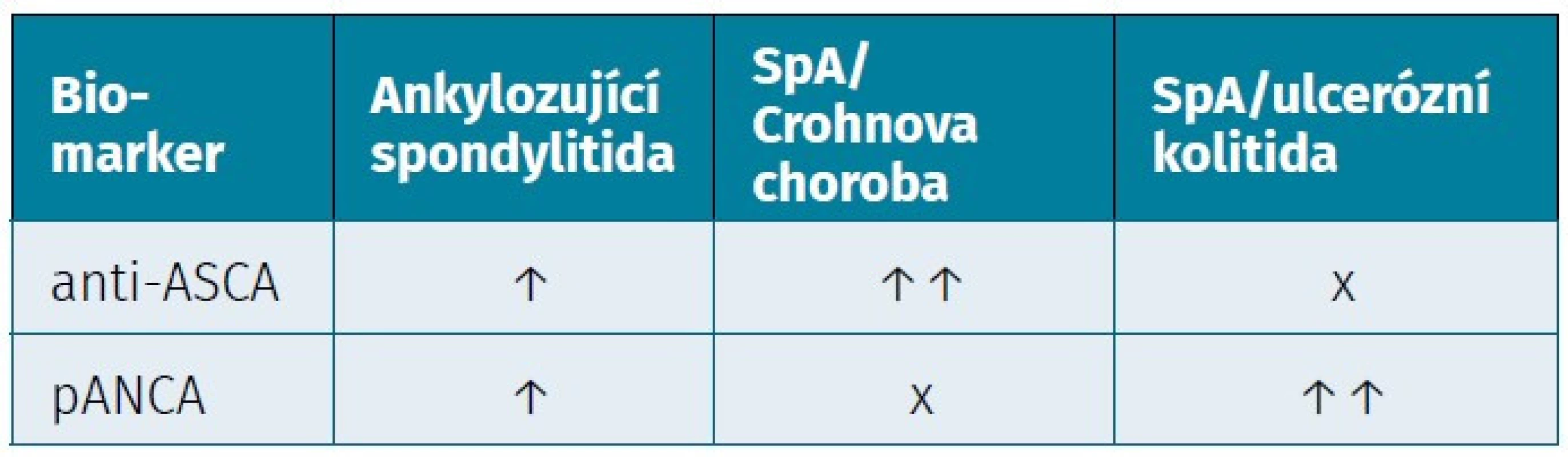
anti-ASCA – protilátky proti Saccharomyces cerevisiae, pANCA – perinukleární protilátky proti cytoplazmě neutrofilních granulocytů U pacientů se SpA a ISZ bylo zaznamenáno několik dalších protilátek, například komponentě Pseudomonas fluorescens (anti-I2), proti externímu membránovému proteinu (OmpC), proti bakteriálnímu flagelinu (anti-CBir1) a proti Klebsiella pneumoniae. Nicméně jejich klinicko-diagnostický význam je stále nejistý (82–85). Doposud nejpřínosnější nástrojem pro diagnostiku UC a CD je stanovení ASCA a pANCA protilátek (76). Novým nadějným markrem se ukazuje stanovení YKL-40, známý také pod názvem chitináza 3-like protein 1 (CHI3L1).
Je to glykoprotein produkovaný zánětlivými, kmenovými a rakovinovými buňkami (14). Zvýšené hodnoty YKL-40 byly zaznamenány častěji u pacientů se SpA a ISZ ve srovnání s pacienty s ISZ bez kloubních obtíží (AUC 0,82) (86).
BIOMARKERY K HODNOCENÍ STRUKTURÁLNÍCH ZMĚN
Dickkopf-related protein 1 (DKK-1)
Nedávné studie zdůraznily význam přímé regulace signální dráhy Wingless/Int (Wnt) cílenou na DKK-1 (87). DKK-1 je antagonista signální dráhy Wnt a faktor snižující snižující novotvorbu kostí (87). Ukazuje se, že vysoká cirkulující hladina DKK-1 může potlačit tvorbu syndesmofytů a fúzi sakroiliakálního skloubení oslabením signalizace dráhy Wnt (87–90). Marker DKK-1 tak byl identifikován jako slibný
indikátor tvorby syndesmofytů u pacientů s AS a jeho hladina byla nižší u pacientů s AS se syndesmofyty než u pacientů bez syndesmofytů (91–93).Sclerostin a anti-sclerostin
Dalším inhibitorem dráhy Wnt je sclerostin, který byl rozsáhle studován u pacientů se SpA. Byly zjištěny nižší sérové hladiny sklerostinu u pacientů s AS ve srovnání se zdravými kontrolami (94–96). Pacienti s axSpA a IZS měli významně nižší hladiny sklerostinu a vyšší hladiny anti-sklerostinu IgG ve srovnání s pacienty s periferní artritidou a ISZ (94). Nízké sérové koncentrace sklerostinu byly spojeny s tvorbou nových syndesmofytů (94). Bylo poukázáno, že sérové hladiny sklerostinu a hladiny anti-sklerostinu IgG tak mohou být přínosem k detekci axiální SpA u pacientů s ISZ (96).
Dalšími kandidátními ukazateli strukturálních změn u pacientů se SpA jsou například matrix metaloproteináza-3 (MMP-3), vaskulární endoteliální růstový faktor (VEGF), tenascin C (TNC) a CD74 IgG. Pouze několik z nich bylo současně nalezeno u pacientů SpA a ISZ (14, 97). MMP-3, exprimována v séru a kloubní tekutině u pacientů s AS, je považován za marker synoviálního zánětu (98–100). Vyšší sérové koncentrace MMP3 byly zaznamenány u pacientů s AS ve srovnání se zdravými jedinci a byly spojené s vyšší aktivitou nemoci a strukturální progresí (tab. 4) (59, 101). Zvýšené hladiny VEGF u pacientů s AS a axiální SpA korelovaly s hladinami sérového kalprotektinu a s radiografickou progresí (rs = 0,552, p < 0,001) (69, 102, 103). Dalším ukazatelem je extracelulární glykoprotein tenascin C k jehož uvolňování dochází především v zánětlivě změněné tkáni či kloubu (104–106). Zvýšené sérové koncentrace tenascinu byly zaznamenány u pacientů s AS v porovnání se zdravými jedinci a korelovaly s CRP (r = 0,479, p = 0,044), FW (r = 0,59, p = 0,009) a kompozitním indexem ASDAS-FW (r = 0,367, p = 0,028) (97). Dle některých studií je tenascin C považován za marker časné fáze onemocnění AS (97). Zvýšená detekce sérových hladin CD74 IgG byla zaznamenána u časných forem axSpA v porovnání s již dlouhodobě diagnostikovanou axSpA, nicméně nedávné studie tento poznatek zpochybnili (107, 108).
Tab. 4. Biomarkery strukturálních změn s tvorbou syndesmofytů 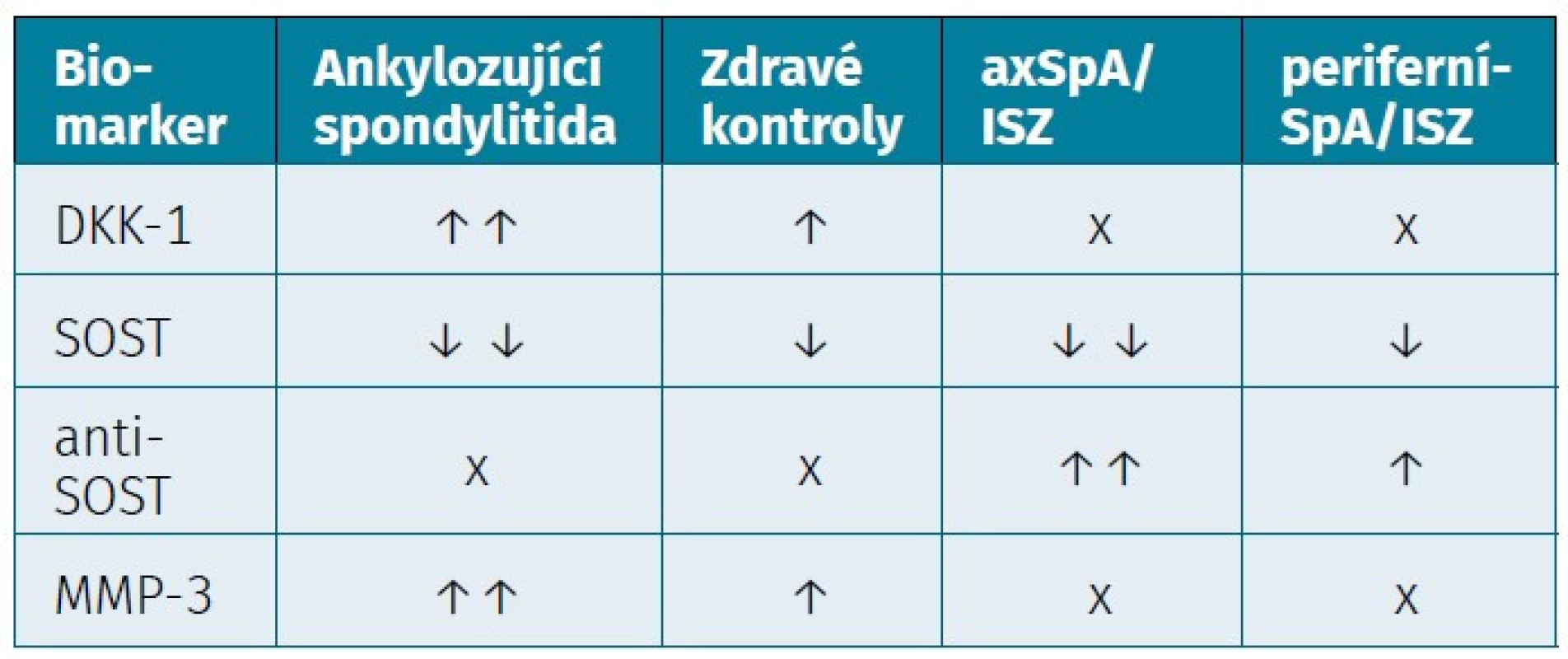
DKK-1 – Dickkopf-related protein 1, SOST – sklerostin, anti-SOST – antisklerostin, MMP-3 – matrix metaloproteináza-3, axSpA – axiální spondyloartritida, ISZ – idiopatický střevní zánět, SpA – spondyloartritida ZÁVĚR
Můžeme konstatovat, že biomarkery jsou důležitým ukazatelem, který může signalizovat časnou fázi nemoci ještě před její klinickou manifestací. Intenzivní výzkum v této oblasti v posledních letech vedl k identifikaci některých markerů, které by mohly hrát zásadní roli jak u axSpA, tak u ISZ. Genová vazba HLA-B27 u SpA a ISZ je v porovnání s AS podstatně menší (109–111). Silnou asociaci má zejména genová vazba CARD15/NOD2 s rizikem vzniku CD a s rozvojem sakroiliitidy u pacientů s ISZ (14). Přímou souvislost s rozvojem AS a ISZ mohou mít signální dráhy polymorfismu IL-23 a jejích různá imunitní odpověď (30, 31). Přítomnost mikroskopického střevního zánětu u axSpA je nejčastěji spojována s mladšími jedinci mužského pohlaví a s vysokou aktivitou základního onemocnění (13, 31). Nadále však probíhá intenzivní výzkum soustředěný na identifikaci dalších markerů, které by mohly mít důležitý vztah k patogenezi, aktivitě a prognóze onemocnění. Mezi základní ukazatele patří hladiny reaktantů akutní fáze, zejména vysoce senzitivního CRP, cytokinů a jejich receptorů (např. IL 6). Pozornost si zasluhuje především fekální kalprotektin, jehož vysoké hladiny korelovaly s aktivitou AS a část pacientů současně vykazovala klinické či subklinické známky střevního zánětu (71). Naopak vztah sérového kalprotektinu k rozvoji ISZ u axSpA je nadále diskutabilní (71, 72). Přítomnost pANCA protilátek byla zaznamenána u pacientů s AS a UC častěji než u samotné AS (79). Naopak přítomnost ASCA protilátek byla zjištěna u AS/CD (14). Při hodnocení strukturální radiografické progrese se jako nadějné faktory jeví stanovení DKK-1 (jako indikátoru tvorby syndesmofytů u pacientů s AS), sklerostin a anti-sklerostin jako ukazatele axSpA u pacientů s ISZ (91–93). Byly diskutovány další biomarkery, např. MMP, VEGF, TNC, CD74 IgG, nicméně pouze několik z nich bylo nalezeno u pacientů se SpA a ISZ (14, 97). Závěrem můžeme konstatovat, že u axSpA asociovaných s ISZ existuje několik kandidátních ukazatelů. I přes rozsáhlé analýzy však zůstává toto téma nadále předmětem výzkumu.
Seznam zkratek
MUDr. Lucia Ondrejčáková
Revmatologický ústav
Na Slupi 4
128 00 Praha 2
e-mail: ondrejcakova@revma.czAutoři prohlašují, že nejsou v konfliktu zájmů.
Do redakce doručeno: 14. 3. 2021
Zdroje
- Dougados M, Baeten D. Spondyloarthritis. Lancet 2011; 377(9783): 2127–2137.
- Rudwaleit M, Landewé R, van der Heijde D, Listing J, Brandt J, Braun J, et al. The development of Assessment of SpondyloArthritis international Society classification criteria for axial spondyloarthritis (part I): classification of paper patients by expert opinion including uncertainty appraisal. Ann Rheum Dis 2009; 68(6): 770–776.
- Rudwaleit M, van der Heijde D, Landewe R, Listing J, Akkoc N, Brandt J, et al. The development of Assessment of SpondyloArthritis international Society classification criteria for axial spondyloarthritis (part II): validation and final selection. Ann Rheum Dis 2009; 68(6): 777–783.
- Stolwijk C, Essers I, van Tubergen A, Boonen A, Bazelier MT, De Bruin ML, et al. The epidemiology of extra-articular manifestations in ankylosing spondylitis: a population-based matched cohort study. Ann Rheum Dis 2015; 74(7): 1373–1378.
- Cypers H, Varkas G, Beeckman S, Debusschere K, Vogl T, Roth J, et al. Elevated calprotectin levels reveal bowel inflammation in spondyloarthritis. Ann Rheum Dis 2016; 75(7): 1357–1362.
- Rudwaleit M, Baeten D. Ankylosing spondylitis and bowel disease. Best Pract Res Clin Rheumatol 2006; 20(3): 451–471.
- van Praet L, Van den Bosch FE, Jacques P, Carron P, Jans L, Colman R, et al. Microscopic gut inflammation in axial spondyloarthritis: a multiparametric predictive model. Ann Rheum Dis 2013; 72(3): 414–417.
- de Vos M, Mielants H, Cuvelier C, Elewaut A, Veys E. Long-term evolution of gut inflammation in patients with spondyloarthropathy. Gastroenterology 1996; 110(6): 1696–1703.
- Gilis E, Mortier C, Venken K, Debusschere K, Vereecke L, Elewaut D. The Role of the Microbiome in Gut and Joint Inflammation in Psoriatic Arthritis and Spondyloarthritis. J Rheumatol Suppl 2018; 94 : 36–39.
- Rudwaleit M, Haibel H, Baraliakos X, Listing J, Märker-Hermann E, Zeidler H, et al. The early disease stage in axial spondylarthritis: results from the German Spondyloarthritis Inception Cohort. Arthritis Rheum 2009; 60(3): 717–727.
- Salvarani C, Fries W. Clinical features and epidemiology of spondyloarthritides associated with inflammatory bowel disease. World J Gastroenterol 2009; 15(20): 2449–2455.
- Rothfuss KS, Stange EF, Herrlinger KR. Extraintestinal manifestations and complications in inflammatory bowel diseases. World J Gastroenterol 2006; 12(30): 4819–4831.
- Essers I, Ramiro S, Stolwijk C, Blaauw M, Landewé R, van der Heijde D, et al. Characteristics associated with the presence and development of extra-articular manifestations in ankylosing spondylitis: 12-year results from OASIS. Rheumatology (Oxford) 2015; 54(4): 633–640.
- Benfaremo D, Luchetti MM, Gabrielli A. Biomarkers in Inflammatory Bowel Disease-Associated Spondyloarthritis: State of the Art and Unmet Needs. J Immunol Res 2019; 2019 : 8630871.
- Khan MA. Remarkable polymorphism of HLA-B27: an ongoing saga. Curr Rheumatol Rep 2010; 12(5): 337–341.
- Schlosstein L, Terasaki PI, Bluestone R, Pearson CM. High association of an HL-A antigen, W27, with ankylosing spondylitis. N Engl J Med 1973; 288(14): 704–706.
- Brown MA, Pile KD, Kennedy LG, Calin A, Darke C, Bell J, et al. HLA class I associations of ankylosing spondylitis in the white population in the United Kingdom. Ann Rheum Dis 1996; 55(4): 268–270.
- Colombo E, Latiano A, Palmieri O, Bossa F, Andriulli A, Annese V. Enteropathic spondyloarthropathy: a common genetic background with inflammatory bowel disease? World J Gastroenterol 2009; 15(20): 2456–2462.
- Brewerton DA, Caffrey M, Nicholls A, Walters D, James DC. HL-A 27 and arthropathies associated with ulcerative colitis and psoriasis. Lancet 1974; 1(7864): 956–958.
- Dekker-Saeys BJ, Meuwissen SG, Van Den Berg-Loonen EM, De Haas WH, Meijers KA, Tytgat GN. Ankylosing spondylitis and inflammatory bowel disease. III. Clinical characteristics and results of histocompatibility typing (HLA B27) in 50 patients with both ankylosing spondylitis and inflammatory bowel disease. Ann Rheum Dis 1978; 37(1): 36–41.
- Mallas EG, Mackintosh P, Asquith P, Cooke WT. Histocompatibility antigens in inflammatory bowel disease. Their clinical significance and their association with arthropathy with special reference to HLA-B27 (W27). Gut 1976; 17(11): 906–910.
- Danve A, O’Dell J. The ongoing quest for biomarkers in Ankylosing Spondylitis. Int J Rheum Dis 2015; 18(8): 826–834.
- Saulle I, Vicentini C, Clerici M, Biasin M. An Overview on ERAP Roles in Infectious Diseases. Cells 2020; 9(3).
- Kenna TJ, Robinson PC, Haroon N. Endoplasmic reticulum aminopeptidases in the pathogenesis of ankylosing spondylitis. Rheumatology (Oxford) 2015; 54(9): 1549–1556.
- Reeves E, James E. The role of polymorphic ERAP1 in autoinflammatory disease. Biosci Rep 2018; 38(4).
- Laukens D, Georges M, Libioulle C, Sandor C, Mni M, Vander Cruyssen B, et al. Evidence for significant overlap between common risk variants for Crohn’s disease and ankylosing spondylitis. PLoS One 2010; 5(11): e13795.
- Reveille JD. Genetics of spondyloarthritis – beyond the MHC. Nat Rev Rheumatol 2012; 8(5): 296–304.
- Yago T, Nanke Y, Kawamoto M, Kobashigawa T, Yamanaka H, Kotake S. IL-23 and Th17 Disease in Inflammatory Arthritis. J Clin Med 2017; 6(9).
- Oppmann B, Lesley R, Blom B, Timans JC, Xu Y, Hunte B, et al. Novel p19 protein engages IL-12p40 to form a cytokine, IL-23, with biological activities similar as well as distinct from IL-12. Immunity 2000; 13(5): 715–725.
- Smith JA, Colbert RA. Review: The interleukin-23/interleukin-17 axis in spondyloarthritis pathogenesis: Th17 and beyond. Arthritis Rheumatol 2014; 66(2): 231–241.
- van Praet L, Van den Bosch F, Mielants H, Elewaut D. Mucosal inflammation in spondylarthritides: past, present, and future. Curr Rheumatol Rep 2011; 13(5): 409–415.
- Abraham C, Cho JH. Functional consequences of NOD2 (CARD15) mutations. Inflamm Bowel Dis 2006; 12(7): 641–650. al. Crohn’s disease and the NOD2 gene: a role for paneth cells. Gastroenterology. 2003; 125(1): 47-57.
- Lala S, Ogura Y, Osborne C, Hor SY, Bromfield A, Davies S, et al. Crohn’s disease and the NOD2 gene: a role for paneth cells. Gastroenterology. 2003; 125(1): 47-57.
- Ogura Y, Inohara N, Benito A, Chen FF, Yamaoka S, Nunez G. Nod2, a Nod1/Apaf-1 family member that is restricted to monocytes and activates NF-kappaB. J Biol Chem 2001; 276(7): 4812–4818.
- Kupka T, Simova J, Dvorackova J, Martinek L, Motyka O, Uvirova M, et al. Crohn’s disease – genetic factors and progress of the disease. Biomed Pap Med Fac Univ Palacky Olomouc Czech Republic 2018; 162(2): 139–143.
- Arvikar SL, Fisher MC. Inflammatory bowel disease associated arthropathy. Curr Rev Musculoskelet Med 2011; 4(3): 123–131.
- Voulgari PV. Rheumatological manifestations in inflammatory bowel disease. Ann Gastroenterol 2011; 24(3): 173–180.
- Brakenhoff LK, van der Heijde DM, Hommes DW, Huizinga TW, Fidder HH. The joint-gut axis in inflammatory bowel diseases. J Crohns Colitis 2010; 4(3): 257–268.
- Sheth T, Pitchumoni CS, Das KM. Management of Musculoskeletal Manifestations in Inflammatory Bowel Disease. Gastroenterol Res Pract. 2015; 2015 : 387891.
- Devlin SM, Yang H, Ippoliti A, Taylor KD, Landers CJ, Su X, et al. NOD2 variants and antibody response to microbial antigens in Crohn’s disease patients and their unaffected relatives. Gastroenterology 2007; 132(2): 576–586.
- Karban A, Dagan E, Eliakim R, Herman A, Nesher S, Weiss B, et al. Prevalence and significance of mutations in the familial Mediterranean fever gene in patients with Crohn’s disease. Genes Immun 2005; 6(2): 134–139.
- Kobayashi KS, Chamaillard M, Ogura Y, Henegariu O, Inohara N, Nuñez G, et al. Nod2-dependent regulation of innate and adaptive immunity in the intestinal tract. Science 2005; 307(5710): 731–734.
- Hugot JP, Zaccaria I, Cavanaugh J, Yang H, Vermeire S, Lappalainen M, et al. Prevalence of CARD15/NOD2 mutations in Caucasian healthy people. Am J Gastroenterol 2007; 102(6): 1259–1267.
- Pauleau AL, Murray PJ. Role of nod2 in the response of macrophages to toll-like receptor agonists. Mol Cell Biol 2003; 23(21): 7531–7539.
- Derakhshan F, Naderi N, Farnood A, Firouzi F, Habibi M, Rezvany MR, et al. Frequency of three common mutations of CARD15/NOD2 gene in Iranian IBD patients. Indian J Gastroenterol 2008; 27(1): 8–11.
- Economou M, Trikalinos TA, Loizou KT, Tsianos EV, Ioannidis JP. Differential effects of NOD2 variants on Crohn’s disease risk and phenotype in diverse populations: a metaanalysis. Am J Gastroenterol 2004; 99(12): 2393–2404.
- Bouma G, Strober W. The immunological and genetic basis of inflammatory bowel disease. Nat Rev Immunol 2003; 3(7): 521–533.
- Laukens D, Peeters H, Marichal D, Vander Cruyssen B, Mielants H, Elewaut D, et al. CARD15 gene polymorphisms in patients with spondyloarthropathies identify a specific phenotype previously related to Crohn’s disease. Ann Rheum Dis 2005; 64(6): 930–935.
- Ossum AM, Palm Ø, Lunder AK, Cvancarova M, Banitalebi H, Negård A, et al. Ankylosing Spondylitis and Axial Spondyloarthritis in Patients With Long-term Inflammatory Bowel Disease: Results From 20 Years of Follow-up in the IBSEN Study. J Crohns Colitis 2018; 12(1): 96–104.
- Rioux JD, Xavier RJ, Taylor KD, Silverberg MS, Goyette P, Huett A, et al. Genome-wide association study identifies new susceptibility loci for Crohn disease and implicates autophagy in disease pathogenesis. Nat Genet 2007; 39(5): 596–604.
- Hampe J, Franke A, Rosenstiel P, Till A, Teuber M, Huse K, et al. A genome-wide association scan of nonsynonymous SNPs identifies a susceptibility variant for Crohn disease in ATG16L1. Nat Genet 2007; 39(2): 207–211.
- McGovern DP, Gardet A, Törkvist L, Goyette P, Essers J, Taylor KD, et al. Genome-wide association identifies multiple ulcerative colitis susceptibility loci. Nat Genet 2010; 42(4): 332–337.
- McCarroll SA, Huett A, Kuballa P, Chilewski SD, Landry A, Goyette P, et al. Deletion polymorphism upstream of IRGM associated with altered IRGM expression and Crohn’s disease. Nat Genet 2008; 40(9): 1107–1112.
- Sieper J, Rudwaleit M, Khan MA, Braun J. Concepts and epidemiology of spondyloarthritis. Best Pract Res Clin Rheumatol 2006; 20(3): 401–417.
- Calin A, Garrett S, Whitelock H, Kennedy LG, O’Hea J, Mallorie P, et al. A new approach to defining functional ability in ankylosing spondylitis: the development of the Bath Ankylosing Spondylitis Functional Index. J Rheumatol 1994; 21(12): 2281–2285.
- Poddubnyy DA, Rudwaleit M, Listing J, Braun J, Sieper J. Comparison of a high sensitivity and standard C reactive protein measurement in patients with ankylosing spondylitis and non-radiographic axial spondyloarthritis. Ann Rheum Dis 2010; 69(7): 1338–1341.
- Chamouard P, Richert Z, Meyer N, Rahmi G, Baumann R. Diagnostic value of C-reactive protein for predicting activity level of Crohn’s disease. Clin Gastroenterol Hepatol 2006; 4(7): 882–887.
- Jürgens M, Mahachie John JM, Cleynen I, Schnitzler F, Fidder H, van Moerkercke W, et al. Levels of C-reactive protein are associated with response to infliximab therapy in patients with Crohn’s disease. Clin Gastroenterol Hepatol 2011; 9(5): 421–427. e1.
- Pedersen SJ, Sørensen IJ, Garnero P, Johansen JS, Madsen OR, Tvede N, et al. ASDAS, BASDAI and different treatment responses and their relation to biomarkers of inflammation, cartilage and bone turnover in patients with axial spondyloarthritis treated with TNFα inhibitors. Ann Rheum Dis 2011; 70(8): 1375–1381.
- Romero-Sanchez C, Jaimes DA, Londoño J, de Avila J, Castellanos JE, Bello JM, et al. Association between Th-17 cytokine profile and clinical features in patients with spondyloarthritis. Clin Exp Rheumatol 2011; 29(5): 828–834.
- Sveaas SH, Berg IJ, Provan SA, Semb AG, Olsen IC, Ueland T, et al. Circulating levels of inflammatory cytokines and cytokine receptors in patients with ankylosing spondylitis: a cross-sectional comparative study. Scand J Rheumatol 2015; 44(2): 118–124.
- Ugur M, Baygutalp NK, Melikoglu MA, Baygutalp F, Altas EU, Seferoglu B. Elevated serum interleukin-23 levels in ankylosing spondylitis patients and the relationship with disease activity. Nagoya J Med Sci 2015; 77(4): 621–627.
- Baeten D, Østergaard M, Wei JC, Sieper J, Järvinen P, Tam LS, et al. Risankizumab, an IL-23 inhibitor, for ankylosing spondylitis: results of a randomised, double-blind, placebo-controlled, proof-of-concept, dose-finding phase 2 study. Ann Rheum Dis 2018; 77(9): 1295–1302.
- Gheita TA, El G, II, El-Fishawy HS, Aboul-Ezz MA, Kenawy SA. Involvement of IL-23 in enteropathic arthritis patients with inflammatory bowel disease: preliminary results. Clin Rheumatol 2014; 33(5): 713–717.
- Liu F, Wang F, Wang CC, Li N, Li SF. Expression of IL-2 and IL-11 and its significance in patients with ankylosing spondylitis. Asian Pac J Trop Med 2013; 6(1): 76–78.
- Ometto F, Friso L, Astorri D, Botsios C, Raffeiner B, Punzi L, et al. Calprotectin in rheumatic diseases. Exp Biol Med (Maywood) 2017; 242(8): 859–873.
- Røseth AG, Fagerhol MK, Aadland E, Schjønsby H. Assessment of the neutrophil dominating protein calprotectin in feces. A methodologic study. Scand J Gastroenterol 1992; 27(9): 793–798
- Kruithof E, de Rycke L, Vandooren B, De Keyser F, FitzGerald O, McInnes I, et al. Identification of synovial biomarkers of response to experimental treatment in early-phase clinical trials in spondylarthritis. Arthritis Rheum 2006; 54(6): 1795–1804.
- Turina MC, Sieper J, Yeremenko N, Conrad K, Haibel H, Rudwaleit M, et al. Calprotectin serum level is an independent marker for radiographic spinal progression in axial spondyloarthritis. Ann Rheum Dis 2014; 73(9): 1746–1748.
- Hu H, Du F, Zhang S, Zhang W. Serum calprotectin correlates with risk and disease severity of ankylosing spondylitis and its change during first month might predict favorable response to treatment. Mod Rheumatol 2019; 29(5): 836–842.
- Klingberg E, Strid H, Ståhl A, Deminger A, Carlsten H, Öhman L, et al. A longitudinal study of fecal calprotectin and the development of inflammatory bowel disease in ankylosing spondylitis. Arthritis Res Ther 2017; 19(1): 21.
- Klingberg E, Carlsten H, Hilme E, Hedberg M, Forsblad-d’Elia H. Calprotectin in ankylosing spondylitis – frequently elevated in feces, but normal in serum. Scand J Gastroenterol 2012; 47(4): 435–444.
- de Rycke L, Baeten D, Foell D, Kruithof E, Veys EM, Roth J, et al. Differential expression and response to anti-TNFalpha treatment of infiltrating versus resident tissue macrophage subsets in autoimmune arthritis. J Pathol 2005; 206(1): 17–27.
- Duran A, Kobak S, Sen N, Aktakka S, Atabay T, Orman M. Fecal calprotectin is associated with disease activity in patients with ankylosing spondylitis. Bosn J Basic Med Sci 2016; 16(1): 71–74.
- Røseth AG, Schmidt PN, Fagerhol MK. Correlation between faecal excretion of indium-111-labelled granulocytes and calprotectin, a granulocyte marker protein, in patients with inflammatory bowel disease. Scand J Gastroenterol 1999; 34(1): 50–54.
- Prideaux L, De Cruz P, Ng SC, Kamm MA. Serological antibodies in inflammatory bowel disease: a systematic review. Inflamm Bowel Dis 2012; 18(7): 1340–1355.
- Hoffenberg EJ, Fidanza S, Sauaia A. Serologic testing for inflammatory bowel disease. J Pediatr 1999; 134(4): 447–452.
- Oshitani N, Hato F, Matsumoto T, Jinno Y, Sawa Y, Hara J, et al. Decreased anti-Saccharomyces cerevisiae antibody titer by mesalazine in patients with Crohn’s disease. J Gastroenterol Hepatol 2000; 15(12): 1400–1403.
- de Vries M, van der Horst-Bruinsma I, van Hoogstraten I, van Bodegraven A, von Blomberg BM, Ratnawati H, et al. pANCA, ASCA, and OmpC antibodies in patients with ankylosing spondylitis without inflammatory bowel disease. J Rheumatol 2010; 37(11): 2340–2344.
- Riente L, Chimenti D, Pratesi F, Delle Sedie A, Tommasi S, Tommasi C, et al. Antibodies to tissue transglutaminase and Saccharomyces cerevisiae in ankylosing spondylitis and psoriatic arthritis. J Rheumatol 2004; 31(5): 920–924.
- Romero-Sánchez C, Bautista-Molano W, Parra V, de Avila J, Rueda JC, Bello-Gualtero JM, et al. Gastrointestinal Symptoms and Elevated Levels of Anti-Saccharomyces cerevisiae Antibodies Are Associated with Higher Disease Activity in Colombian Patients with Spondyloarthritis. Int J Rheumatol 2017; 2017 : 4029584.
- O’Mahony S, Anderson N, Nuki G, Ferguson A. Systemic and mucosal antibodies to Klebsiella in patients with ankylosing spondylitis and Crohn’s disease. Ann Rheum Dis 1992; 51(12): 1296–1300.
- Tiwana H, Walmsley RS, Wilson C, Yiannakou JY, Ciclitira PJ, Wakefield AJ, et al. Characterization of the humoral immune response to Klebsiella species in inflammatory bowel disease and ankylosing spondylitis. Br J Rheumatol 1998; 37(5): 525–531.
- Tiwana H, Natt RS, Benitez-Brito R, Shah S, Wilson C, Bridger S, et al. Correlation between the immune responses to collagens type I, III, IV and V and Klebsiella pneumoniae in patients with Crohn’s disease and ankylosing spondylitis. Rheumatology (Oxford) 2001; 40(1): 15–23.
- Cooper R, Fraser SM, Sturrock RD, Gemmell CG. Raised titres of anti-klebsiella IgA in ankylosing spondylitis, rheumatoid arthritis, and inflammatory bowel disease. Br Med J (Clin Res Ed) 1988; 296(6634): 1432–1434.
- Bernardi D, Podswiadek M, Zaninotto M, Punzi L, Plebani M. YKL-40 as a marker of joint involvement in inflammatory bowel disease. Clin Chem 2003; 49(10): 1685–1688.
- Zou YC, Yang XW, Yuan SG, Zhang P, Ye YL, Li YK. Downregulation of dickkopf-1 enhances the proliferation and osteogenic potential of fibroblasts isolated from ankylosing spondylitis patients via the Wnt/β-catenin signaling pathway in vitro. Connect Tissue Res 2016; 57(3): 200–211.
- Huang J, Song G, Yin Z, Luo X, Ye Z. Elevated miR-29a expression is not correlated with disease activity index in PBMCs of patients with ankylosing spondylitis. Mod Rheumatol 2014; 24(2): 331–334.
- Uderhardt S, Diarra D, Katzenbeisser J, David JP, Zwerina J, Richards W, et al. Blockade of Dickkopf (DKK)-1 induces fusion of sacroiliac joints. Ann Rheum Dis 2010; 69(3): 592–597.
- Diarra D, Stolina M, Polzer K, Zwerina J, Ominsky MS, Dwyer D, et al. Dickkopf-1 is a master regulator of joint remodeling. Nat Med 2007; 13(2): 156–163.
- Daoussis D, Liossis SN, Solomou EE, Tsanaktsi A, Bounia K, Karampetsou M, et al. Evidence that Dkk-1 is dysfunctional in ankylosing spondylitis. Arthritis Rheum 2010; 62(1): 150–158.
- Kwon SR, Lim MJ, Suh CH, Park SG, Hong YS, Yoon BY, et al. Dickkopf-1 level is lower in patients with ankylosing spondylitis than in healthy people and is not influenced by anti-tumor necrosis factor therapy. Rheumatol Int 2012; 32(8): 2523–2527.
- Taylan A, Sari I, Akinci B, Bilge S, Kozaci D, Akar S, et al. Biomarkers and cytokines of bone turnover: extensive evaluation in a cohort of patients with ankylosing spondylitis. BMC Musculoskelet Disord 2012; 13 : 191.
- Klingberg E, Nurkkala M, Carlsten H, Forsblad-d’Elia H. Biomarkers of bone metabolism in ankylosing spondylitis in relation to osteoproliferation and osteoporosis. J Rheumatol 2014; 41(7): 1349–1356.
- Perrotta FM, Ceccarelli F, Barbati C, Colasanti T, De Socio A, Scriffignano S, et al. Serum Sclerostin as a Possible Biomarker in Ankylosing Spondylitis: A Case-Control Study. J Immunol Res 2018; 2018 : 9101964.
- Luchetti MM, Ciccia F, Avellini C, Benfaremo D, Guggino G, Farinelli A, et al. Sclerostin and Antisclerostin Antibody Serum Levels Predict the Presence of Axial Spondyloarthritis in Patients with Inflammatory Bowel Disease. J Rheumatol 2018; 45(5): 630–637.
- Gupta L, Bhattacharya S, Aggarwal A. Tenascin-C, a biomarker of disease activity in early ankylosing spondylitis. Clin Rheumatol 2018; 37(5): 1401–1405.
- Sun S, Bay-Jensen AC, Karsdal MA, Siebuhr AS, Zheng Q, Maksymowych WP, et al. The active form of MMP-3 is a marker of synovial inflammation and cartilage turnover in inflammatory joint diseases. BMC Musculoskelet Disord 2014; 15 : 93.
- Ribbens C, Andre B, Kaye O, Kaiser MJ, Bonnet V, Jaspar JM, et al. Synovial fluid matrix metalloproteinase-3 levels are increased in inflammatory arthritides whether erosive or not. Rheumatology (Oxford) 2000; 39(12): 1357–1365.
- Murphy G, Nagase H. Progress in matrix metalloproteinase research. Mol Aspects Med 2008; 29(5): 290–308.
- Mattey DL, Packham JC, Nixon NB, Coates L, Creamer P, Hailwood S, et al. Association of cytokine and matrix metalloproteinase profiles with disease activity and function in ankylosing spondylitis. Arthritis Res Ther 2012; 14(3): R127.
- Drouart M, Saas P, Billot M, Cedoz JP, Tiberghien P, Wendling D, et al. High serum vascular endothelial growth factor correlates with disease activity of spondylarthropathies. Clin Exp Immunol 2003; 132(1): 158–162.
- Poddubnyy D, Conrad K, Haibel H, Syrbe U, Appel H, Braun J, et al. Elevated serum level of the vascular endothelial growth factor predicts radiographic spinal progression in patients with axial spondyloarthritis. Ann Rheum Dis 2014; 73(12): 2137–2143.
- Udalova IA, Ruhmann M, Thomson SJ, Midwood KS. Expression and immune function of tenascin-C. Crit Rev Immunol 2011; 31(2): 115–145.
- Juneja SC, Veillette C. Defects in tendon, ligament, and enthesis in response to genetic alterations in key proteoglycans and glycoproteins: a review. Arthritis 2013; 2013 : 154812.
- Järvinen TA, Jozsa L, Kannus P, Järvinen TL, Kvist M, Hurme T, et al. Mechanical loading regulates tenascin-C expression in the osteotendinous junction. J Cell Sci 1999; 112 Pt 18 : 3157–3166.
- de Winter JJ, van de Sande MG, Baerlecken N, Berg I, Ramonda R, van der Heijde D, et al. Anti-CD74 antibodies have no diagnostic value in early axial spondyloarthritis: data from the spondyloarthritis caught early (SPACE) cohort. Arthritis Res Ther 2018; 20(1): 38.
- Baerlecken NT, Nothdorft S, Stummvoll GH, Sieper J, Rudwaleit M, Reuter S, et al. Autoantibodies against CD74 in spondyloarthritis. Ann Rheum Dis 2014; 73(6): 1211–1214.
- D’Incà R, Podswiadek M, Ferronato A, Punzi L, Salvagnini M, Sturniolo GC. Articular manifestations in inflammatory bowel disease patients: a prospective study. Dig Liver Dis 2009; 41(8): 565–569.
- Peeters H, Vander Cruyssen B, Mielants H, de Vlam K, Vermeire S, Louis E, et al. Clinical and genetic factors associated with sacroiliitis in Crohn’s disease. J Gastroenterol Hepatol 2008; 23(1): 132–137.
- Orchard TR, Holt H, Bradbury L, Hammersma J, McNally E, Jewell DP, et al. The prevalence, clinical features and association of HLA-B27 in sacroiliitis associated with established Crohn’s disease. Aliment Pharmacol Ther 2009; 29(2): 193–197.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2021 Číslo 2- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Stillova choroba: vzácné a závažné systémové onemocnění
- Bolest na hrudi v ordinaci revmatologa
-
Všechny články tohoto čísla
- Význam adherence k farmakoterapii u revmatických chorob
- Přehled biomarkerů a jejich vztah k axiálním spondyloartritidám asociovaným s idiopatickými střevními záněty
- NOVÁ DOPORUČENÍ PRO PACIENTY s dnou a zvýšenou hladinou kyseliny močové v krvi
- Doporučení České revmatologické společnosti pro farmakologickou léčbu axiálních spondyloartritid
- Nová doporučení pro léčbu lupusové nefritidy
- Jak ovlivňuje biologická léčba práceschopnost u nemocných s axiální spondyloartritidou – výsledky z Českého národního registru ATTRA
- Péče o reprodukční zdraví žen s revmatoidní artritidou, psoriázou a psoriatickou artritidou ve fertilním věku v běžné klinické praxi
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- NOVÁ DOPORUČENÍ PRO PACIENTY s dnou a zvýšenou hladinou kyseliny močové v krvi
- Nová doporučení pro léčbu lupusové nefritidy
- Doporučení České revmatologické společnosti pro farmakologickou léčbu axiálních spondyloartritid
- Přehled biomarkerů a jejich vztah k axiálním spondyloartritidám asociovaným s idiopatickými střevními záněty
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





