-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Cirkulující protein tepelného šoku 90 (HSP90) u pacientů s revmatoidní artritidou a axiální spondyloartritidou
Circulating Heat Shock Protein 90 (HSP90) in patients with rheumatoid arthritis and axial spondylarthritis
Introduction:
Heat Shock Protein 90 (HSP90) is involved in the regulation of immunological and inflammatory responses, and its inhibition has been effectively used in the treatment of several animal models of autoimmune diseases. The role of HSP90 in rheumatic diseases is not precisely known. The aim of our study was to analyze the levels of HSP90 in the serum of patients with rheumatoid arthritis (RA) and compare them with those in patients with axial spondylarthritis (AxSpA) and in healthy volunteers and to evaluate the association of these findings with disease activity.Methods:
HSP90 was analyzed in peripheral blood of 58 patients with RA, 68 patients with AxSpA and 30 healthy volunteers. Disease activity in patients with RA was assessed by the DAS28 score and in patients with AxSPA by BASDAI index. The concentration of serum C-reactive protein (CRP), autoantibodies (rheumatoid factors, anti-cyclic citrullinated peptides) and the presence of HLA-B27 were measured by standard methods.Results:
Although the serum levels of HSP90 were not different between the groups of patients and healthy controls, patients with RA treated with anti-TNF therapy had significantly lower HSP90 serum levels compared with those without this treatment (6.03, 95% CI 3,77-12,00 vs. 8.46, 95% CI 4.26 to 18.78 ng/ml, p = 0.016). No relationship between serum HSP90 and clinical activity of both diseases was observed, however, in RA patients a positive correlation between serum HSP90 and CRP was found (p = 0.017). Circulating HSP90 had no relationship to autoantibody activity in RA.Conclusion:
The results of this study highlight the potential significance of HSP90 in the regulation of the inflammatory process in rheumatoid arthritis.Key words:
Rheumatoid arthritis, axial spondylarthritis, Heat Shock Proteins, disease activity
Autoři: L. Procházková 1; J. Hulejová 2; P. Němec 1; L. Šenolt 2
Působiště autorů: Revmatologie, II. interní klinika, FN u sv. Anny, Brno 1; Revmatologický ústav a Revmatologická klinika, 1. LF UK, Praha 2
Vyšlo v časopise: Čes. Revmatol., 21, 2013, No. 4, p. 164-169.
Kategorie: Původní práce
Souhrn
Úvod:
Protein tepelného šoku 90 (HSP90) se podílí na regulaci imunologické a zánětlivé odpovědi a jeho inhibice je úspěšná v léčbě několika zvířecích modelů autoimunitních onemocnění. Role HSP90 u revmatických onemocnění není přesně známa. Cílem naší práce bylo stanovit hladiny HSP90 v séru pacientů s revmatoidní artritidou (RA) a porovnat je s těmi u pacientů s axiální spondyloartritidou (AxSpA) a u zdravých dobrovolníků a zhodnotit asociaci těchto nálezů s aktivitou onemocnění.Metodika:
HSP90 byl analyzován z periferní krve u 58 pacientů s RA, 68 pacientů s AxSpA a 30 zdravých dobrovolníků. Aktivita nemoci u pacientů s RA byla hodnocena podle DAS28 skóre, u pacientů s AxSPA podle indexu BASDAI. Standardní metodou byla měřena koncentrace sérového C-reaktivního proteinu (CRP), autoprotilátek (revmatoidní faktory, protilátky proti cyklickým citrulinovaným peptidům) a přítomnost antigenu HLA-B27.Výsledky:
Ačkoliv se mezi skupinami pacientů a zdravých kontrol sérové hladiny HSP90 nelišily, u pacientů s RA léčených anti-TNF terapií byly jeho hodnoty významně nižší v porovnání s jedinci bez této terapie (6,03, 95% CI 3,77–12,00 vs. 8,46, 95% CI 4,26–18.78 ng/ml; p = 0,016). Nebyl pozorován vztah sérového HSP90 s klinickou aktivitou obou nemocí, ale u pacientů s RA byla zjištěna pozitivní korelace cirkulujícího HSP90 se sérovým CRP (p = 0,017). Cirkulující HSP90 neměl vztah k autoprotilátkové aktivitě RA.Závěr:
Výsledky této práce poukazují na možný význam HSP90 v regulaci zánětlivého procesu u revmatoidní artritidy.Klíčová slova:
Rheumatoid arthritis, axial spondylarthritis, heat shock proteins, disease activityÚvod
Revmatoidní artritida (RA) je autoimunitní onemocnění způsobující preferenčně zánět synoviální membrány a následně kloubní poškození. Výsledkem může být těžké strukturální kloubní postižení, funkční hendikep, systémové komplikace a zvýšené riziko kardiovaskulárních onemocnění. RA vzniká na podkladě blíže neznámého narušení tolerance imunitních buněk vůči strukturám vlastních tkání. Jednou z oblastí výzkumu při studiu mechanizmů ztráty autotolerance jsou proteiny tepelného šoku (HSP) (1, 2, 3).
HSP jsou evolučně velmi konzervovanou skupinou peptidů, jejichž úlohou je ochrana prokaryotických i eukaryotických buněk před důsledky různých forem stresové zátěže. Vyskytují se intracelulárně, ale v podmínkách buněčného stresu jsou uvolňovány i do extracelulárního prostředí (4, 5). Mnoho těchto proteinů je vylučováno také konstitutivně, tedy nezávisle na aktivačním stavu buňky. HSP hrají roli tzv. molekulárních chaperonů – molekul, které kontrolují a zabezpečují správnou prostorovou strukturu proteinů a brání vzniku nesprávných vazeb. Vedle základní funkce v udržování buněčné homeostázy a ochraně před vnějšími stresovými faktory hrají některé molekulární chaperony důležitou roli i při transformaci nádorové buňky (6). V onkologii je velký význam přikládán peptidu HSP90, který bývá nazýván nádorovým chaperonem. Inhibitory HSP90 jsou již testovány v různých fázích klinických hodnocení u několika nádorových onemocnění (7).
Vlivem různých stresových situací se může HSP90 uvolňovat extracelulárně a hraje důležitou roli v procesu prezentace antigenu, indukce tvorby cytokinů buňkami monocyto-makrofágového systému, a aktivace vyzrávání dendritických buněk (8, 9, 10). Předpokládá se, že HSP90 hraje kromě nádorových onemocnění významnou roli i v patogenezi některých autoimunitních stavů (2, 11). Výsledky z poslední doby ukazují na pozitivní účinek inhibice HSP90 u experimentálních modelů RA, systémového lupus erythematodes nebo systémové sklerodermie (11, 12, 13). Přirozené inhibitory HSP90 blokují nitrobuněčnou signalizaci nukleárního faktoru (NF-κB) a některých proteinových kináz (např. Janusovy kinázy) a tím vedou k potlačení produkce cytokinů, růstových faktorů a katalytických enzymů makrofágy a dalšími buňkami imunitního systému (11, 14).
V synoviální tkáni RA pacientů byla popsána zvýšená exprese HSP90, který se podílí na regulaci tvorby cytokinů, apoptózy, a tak může podporovat agresivní růst synoviální membrány v místech kloubní destrukce (15). Již v minulosti byly popsány významně vyšší hladiny protilátek proti HSP90 u pacientů s RA (16), nicméně hladiny vlastního HSP90 zkoumány dosud nebyly. Cílem naší práce tak bylo stanovit sérové hladiny HSP90 u pacientů s RA, porovnat je s těmi s axiální spondyloartritidou (AxSpA) a u zdravých dobrovolníků a zhodnotit jejich asociaci s aktivitou onemocnění.
Metodika
Pacienti
V této práci byly studovány tři soubory jedinců, jednalo se o 58 pacientů s RA (diagnóza byla stanovena podle revidovaných ACR 1987 kritérií nebo ACR/EULAR 2010 klasifikačních kritérií), 68 pacientů s AxSpA dle modifikovaných newyorských kritérií nebo dle ASAS kritérií a 30 zdravých dobrovolníků. Pacienti byli rekrutováni z jednoho centra – revmatologické ambulance II. interní kliniky FN u sv. Anny v Brně. Zkušeným revmatologem bylo provedeno klinické revmatologické vyšetření a byl zhodnocen počet oteklých a bolestivých kloubů. Pacienti provedli hodnocení aktivity onemocnění na vizuální analogové škále (VAS). U pacientů s RA byla na základě získaných údajů provedena kalkulace DAS28 skóre. Pacienti s AxSpA provedli hodnocení aktivity onemocnění na VAS a podle standardizovaného indexu BASDAI (Bath Ankylosing Spondylitis Disease Activity Index). Všichni pacienti a zdraví jedinci udělili podepsaný informovaný souhlas s výzkumem v souladu s Helsinskou deklarací.
Laboratorní analýza
U všech jedinců byl nalačno proveden odběr periferní krve z kubitální žíly a následně bylo získáno sérum standardní technikou centrifugace při 3000 otáčkách/min. Byly stanoveny hladiny C-reaktivního proteinu (CRP). Běžnými laboratorními metodami byly u pacientů s RA stanoveny hladiny revmatoidních faktorů (RF) a protilátek proti citrulinovaným proteinům (anti-CCP). U pacientů s AxSpA byl stanoven antigen HLA-B27. Sérová koncentrace humánního HSP90 byla měřena na základě postupů doporučených výrobcem metodou ELISA za použití komerční soupravy ELISA Human HSP90 alpha (eBioscience, San Diego, USA). Analýzy byly vyhodnoceny pomocí ELISA readeru SUNRISE (Tecan, Salcburg, Austria) při vlnové délce 450 nm.
Statistika
Při statistickém zpracování byl při popisu spojitých dat stanovován průměr doplněný o směrodatnou odchylku a medián doplněný 5–95percentilovým rozptylem. Pro porovnání rozdílů mezi soubory statistických dat a výpočtu statistické významnosti byl u spojitých dat použit neparametrický Mann-Whitneyův U test. Za statisticky signifikantní byla považována 5% hladina významnosti. Korelace spojitých proměnných byly počítány pomocí Spearmanova korelačního koeficientu. Pro porovnání nezávislých výběrů byl použit neparametrický Kruskal-Wallisův test.
Výsledky
Pacienti a zdravé kontroly
Demografická data pacientů a zdravých dobrovolníků jsou uvedena v tabulce 1. V hodnoceném souboru pacientů s RA bylo zastoupeno 88 % žen, věkový průměr byl 50 let a délka trvání onemocnění byla průměrně 13 let. Průměrná aktivita onemocnění dle DAS28 byla 3,47. Téměř 90% pacientů mělo pozitivní RF a anti-CCP protilátky. 48 % pacientů bylo aktuálně léčeno některým z anti-TNFα preparátů (n = 28) a 17% tocilizumabem (n = 10). V souboru 68 pacientů s AxSpA bylo 31 % žen, věkový průměr pacientů byl 45 let a délka trvání onemocnění byla průměrně 12 let. Aktivita onemocnění dle BASDAI byla v průměru 39 %. Vysoké aktivity onemocnění podle BASDAI ≥ 40 dosáhlo 47 % pacientů. 88 % pacientů bylo HLA-B27 pozitivních. Diagnóza ankylozující spondylitidy na podkladě newyorských klasifikačních kritérií byla stanovena u 84 % pacientů a neradiografické AxSpA podle ASAS kritérií byla stanovena u 16 % pacientů. Aktuálně bylo léčeno anti-TNF terapií 59 % pacientů s AxSpA. V souboru 30 zdravých jedinců bylo 77 % žen, průměrný věk byl 49 let.
Tab. 1. Charakteristika pacientů a kontrolní skupiny. 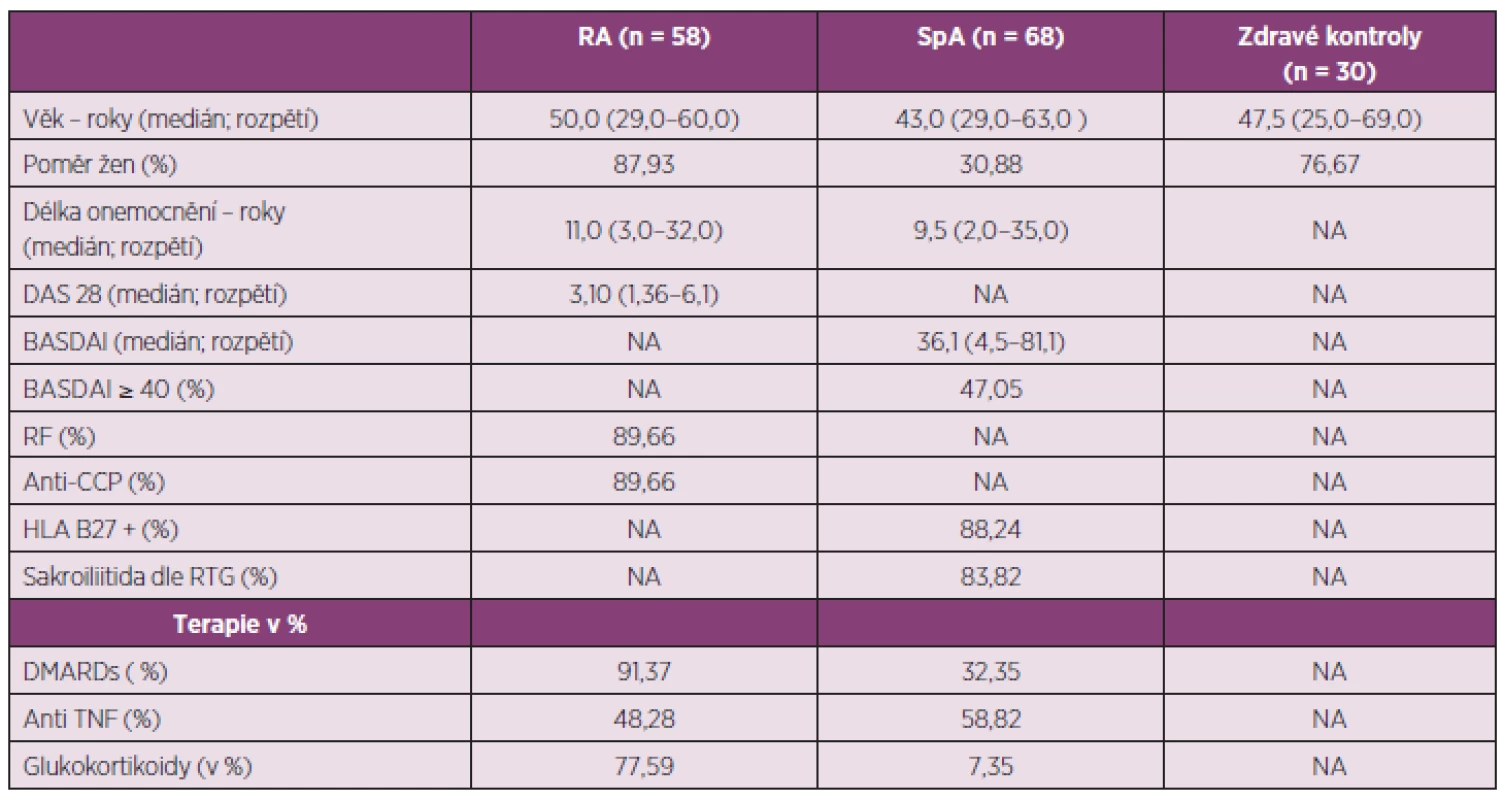
Hsp90 a aktivita onemocnění
Mezi skupinami testovaných jedinců nebyl v hladinách sérového HSP90 významný rozdíl (obr. 1). U pacientů s RA byla tendence k vyšším hladinám HSP90 v porovnání se skupinou zdravých dobrovolníků (p = 0,104) a hladiny sérového HSP90 byly v souboru pacientů s AxSpA srovnatelné se zdravými kontrolami (p = 0,394).
Obr. 1. Sérové koncentrace proteinu tepelného šoku HSP90 v souboru pacientů s revmatoidní artritidou (RA), axiální spondyloartritidou (AxSpA) a u zdravých dobrovolníků. 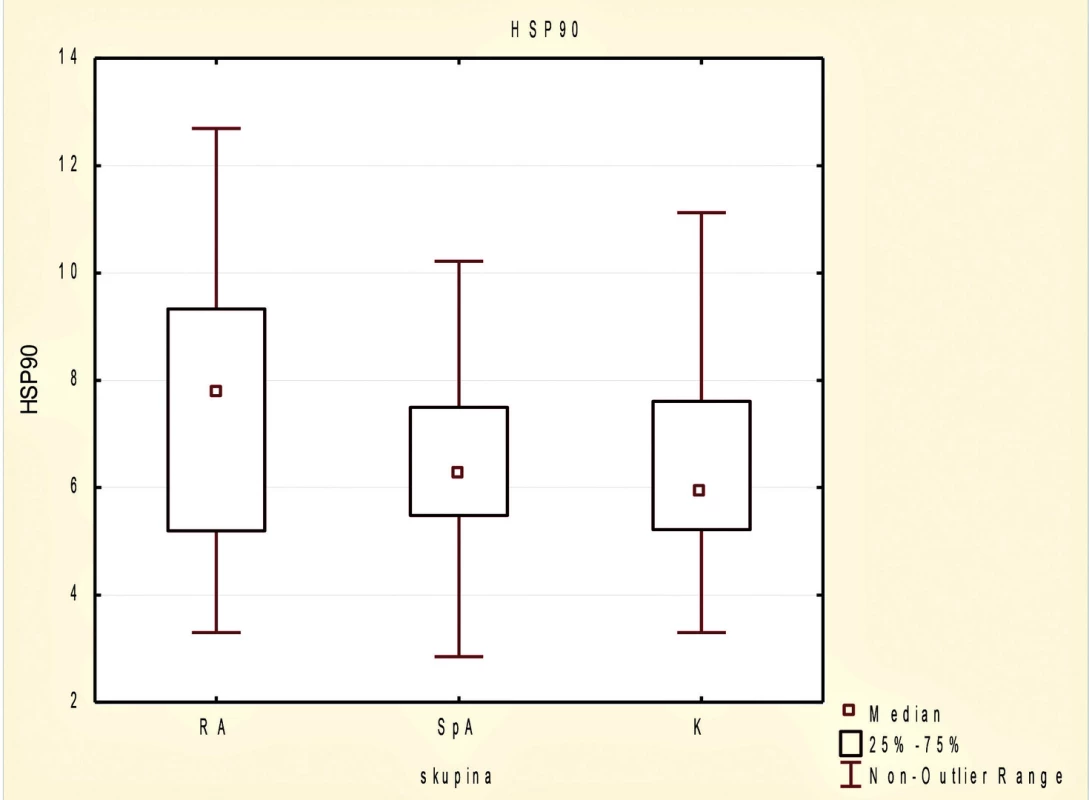
U pacientů s RA pozitivně korelovala koncentrace HSP90 s hladinou CRP (r = 0,313; p = 0,017), kdežto ve skupině AxSpA nebyl vzájemný vztah mezi hladinami HSP90 a laboratorní zánětlivou aktivitou nalezen. U pacientů s RA ale nebyla pozorována korelace mezi hladinami HSP90 a aktivitou onemocnění podle DAS28 (r = -0,026; p = 0,848) a stejně tak nebyla prokázána korelace sérového HSP90 s hladinou CRP (r = 0,104, p = 0,400) nebo aktivitou nemoci podle BASDAI u pacientů s AxSpA (r = -0,023; p = 0,849). Nebyl pozorován rozdíl v hladinách sérového HSP90 mezi AxSpA pacienty bez rentgenového a s rentgenovým průkazem postižení sakroiliakálních kloubů (p = 0,777).
Vliv léčby na hladiny sérového Hsp90
Při rozdělení pacientů s RA na 2 podsoubory podle anti-TNF terapie jsme prokázali statisticky významný rozdíl v hladinách HSP90 mezi těmito dvěma skupinami. Pacienti aktuálně léčení anti-TNF terapií měli nižší hladiny HSP90 (6,03, 95% CI 3,77–12,00 vs. 8,46, 95% CI 4,26–18,78 ng/ml; p = 0,016) (obr. 2). Na rozdíl od souboru pacientů s RA jsme ve skupině pacientů s AxSpA statisticky signifikantní rozdíl v hladinách HSP90 u léčených anti-TNF terapií oproti neléčeným neprokázali (7,34 ± 2,79 vs. 6,35 ± 2,43; p = 0,159).
Obr. 2. Sérové koncentrace HSP90 u pacientů s revmatoidní artritidou (RA) podle užívání biologické terapie anti-TNF p 0,05 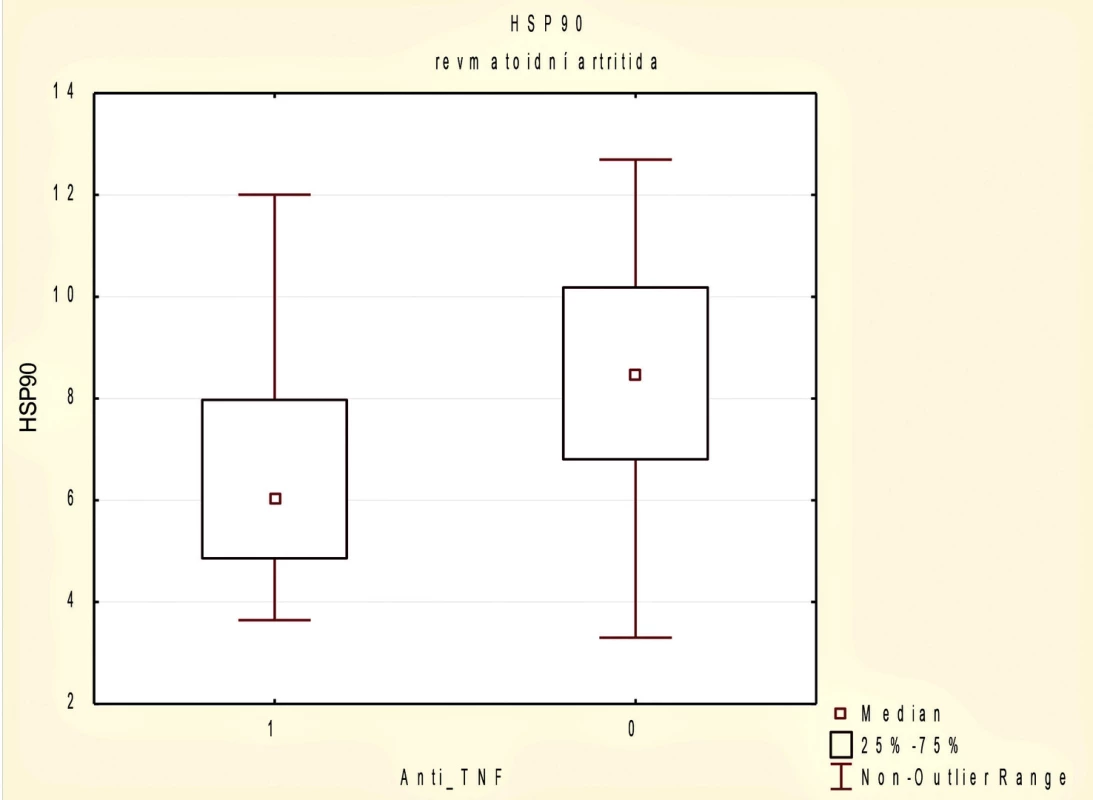
Diskuse
V této práci jsme pozorovali tendenci k vyšším hladinám sérového HSP90 u pacientů s RA oproti zdravým kontrolám. Sérové hladiny HSP90 byly významně vyšší ve skupině nemocných s RA, kteří nebyli léčení anti-TNF terapií. Přestože sérové hladiny HSP90 nekorelovaly s klinickou aktivitou nemoci, byl pozorován významný vztah HSP90 s mírou laboratorní zánětlivé aktivity RA. Naopak u jedinců s AxSpA nebyl rozdíl v sérových hladinách HSP90 proti zdravým dobrovolníkům, nebyl vztah s aktivitou nemoci, ani nebyl pozorován vliv biologické léčby na hladiny sérového HSP90.
HSP90 je zvýšeně tvořen buňkami RA synoviální tkáně, účastní se regulace přirozeného zániku buněk a může podporovat formaci agresivního pannu (17). Zvýšená exprese HSP90 v podmínkách zánětu stimuluje imunitní buňky a indukuje zvýšenou tvorbu prozánětlivých cytokinů, které jsou důležité v patogenezi RA a dále prodlužují a podporují zánětlivý stav (10, 15). Úlohu HSP90 v patogenezi RA podtrhuje fakt, že u pacientů s těžkou formou RA a plicním postižením byly recentně popsány specifické protilátky proti citrulinovanému HSP90 (18). Ačkoliv sérové hladiny HSP90 nebyly v naší práci významně vyšší proti zdravým kontrolám, byly zvýšené v podskupině jedinců s RA, kteří nebyli léčeni anti-TNF terapií. Lze tak předpokládat, že hladiny HSP90 jsou vyšší u pacientů s vyšší zánětlivou aktivitou, což podtrhuje průkaz pozitivní korelace mezi sérovým HSP90 a CRP. V souladu s našimi výsledky bylo nedávno prokázáno, že lokální exprese HSP90 ve střevní sliznici je zvýšena u nemocných s ulcerózní kolitidou a významně se snižuje po úspěšné léčbě (19). Nicméně se zdá, že ačkoliv sérové hladiny HSP90 mají vztah k laboratorní zánětlivé aktivitě nemoci, neodráží klinickou ani autoprotilátkovou aktivitu nemoci.
Na druhé straně jsme nepozorovali zvýšené hladiny HSP90 u jedinců s AxSpA a nebyl pozorován vztah k aktivitě nemoci, ani k sérové hladině CRP. Biologická léčba blokující TNF neměla u jedinců s AxSpA na hladinu HSP90 žádný vliv. Lze tak usuzovat, že HSP90 nemá v průběhu AxSpA podstatnou roli. Jedním z možných vysvětlení pro rozdílné hladiny HSP90 u RA a AxSpA je i odlišný charakter těchto dvou onemocnění. Počínaje odlišným genetickým podkladem obou nemocí, opačnou distribucí mezi pohlavími (u RA jsou častěji postiženy ženy oproti vyššímu výskytu AxSpA u mužů), přes přítomnost autoprotilátek u RA, zatímco u AxSpA nejsou specifické autoprotilátky prokazovány, až po rozdílné typy predominantního strukturálního postižení (u RA je typickým projevem osteoresorpce v podobě erozí, u AxSpA je dominantní osteoprodukce v podobě osifikací). Je tedy možné, že na základě rozdílnosti patofyziologických mechanismů vedoucích k odlišným imunologickým i klinickým projevům obou onemocnění je i souvislost HSP90 s těmito chorobami rozdílná. Nelze také vyloučit, že se HSP90 na patogenezi AxSpA podílí lokálně, aniž by docházelo k jeho nadměrnému uvolňování do krevního oběhu. Tuto hypotézu může podpořit zjištění u nemocných s bulózním pemfigoidem, kde zvýšená exprese HSP90 v postižené kůži není provázena zvýšenou sérovou koncentrací, naopak systémové hladiny HSP90 byly ještě nižší než u zdravých kontrol (20). Nevýhodou výše uvedené práce proti naší studii je významně menší počet studovaných pacientů. Na druhé straně je nevýhodou naší práce průřezový charakter studie a fakt, že HSP90 nebyl studován u pacientů s časnou RA, kteří dosud nebyli vystaveni vlivu žádné imunosupresivní léčby, která by potenciálně mohla hladiny HSP90 ovlivnit. To vše je předmětem našeho dalšího výzkumu. Dalším faktorem, který mohl přispět k těmto výsledkům, je relativně nízká aktivita nemoci ve studovaném souboru pacientů s RA a fakt, že pacienti s AxSpA mají obecně nižší laboratorní zánětlivou aktivitu nemoci ve srovnání s jedinci s RA.
Závěrem lze konstatovat, že jsme prokázali pozitivní asociaci mezi cirkulujícím HSP90 a sérovou hladinou CRP u pacientů s RA, ale ne u jedinců s AxSpA. Dále jsme zjistili, že u RA může mít vliv na hladiny systémového HSP90 biologická léčba anti-TNFα, která vede k jejich snížení. V současné době lze spíše než jako biomarker aktivity nemoci považovat HSP90 za molekulu, která může navodit prolomení imunitní tolerance (15) anebo se může stát cílem léčby autoimunitních onemocnění (11).
Poděkování: RNDr. M. Goldbergové za statistické zpracování dat.
Tato práce vznikla za podpory koncepčního rozvoje MZČR pro výzkumné organizace 023728
Adresa pro korespondenci:
MUDr. Leona Procházková , Ph.D.
Revmatologie, II. interní klinika, FN u sv. Anny Brno
Pekařská 53
656 91 Brno
e-mail: leona.prochazkova@fnusa.cz
Zdroje
1. Middleton GD. Prospects for Stopping the Runaway Train by Reintroduction of tolerance. J Clin Cell Immunol 2012; S6 : 004 .
2. Keijzer C, Wieten L, van Herwijnen M et al. Heat shock proteins are therapeutic targets in autoimmune diseases and other chronic inflammatory conditions. Expert Opin Ther Targets. 2012 Sep; 16(9): 849–57.
3. Shield A M, Panayi G S, Corrigall V M, A new-age for biologic therapies: long therm drug free therapy with Bip? Frontiers in imunology 2012; 3 : 17.
4. Srivastava P. Roles of heat-shock proteins in innate and adaptive immunity. Nature Reviews Immunology, 2002; 2(3): 185–194.
5. Barreto A, Gonzalez JM, Kabingu E, et al. Stress-induced release of HSC70 from human tumors. Cellular Immunology, 2003; 222(2): 97–104.
6. Calderwood SK, Stevenson MA, Murshid A. Heat shock proteins, autoimmunity, and cancer treatment. Autoimmune Dis. 2012; 2012 : 486069.
7. Růčková E, Müller P, Vojtěšek B. Hsp90 – a Target for Anticancer Therapy Klin Onkol 2011; 24(5): 329–337.
8. Tsan MF, Gao B. Heat shock protein and innate immunity. Cellular & Molecular Immunology, 2004; 1(4): 274–279.
9. Bae J, Munshi A, Li C, Samur M, et al. Heat shock protein 90 is critical for regulation of phenotype and functional activity of human T lymphocytes and NK cells. J Immunol. 2013; 190(3): 1360–71.
10. Shimp SK 3rd, Parson CD, Regna NL, et al. HSP90 inhibition by 17-DMAG reduces inflammation in J774 macrophages through suppression of Akt and nuclear factor-κB pathways. Inflamm Res. 2012; 61(5): 521–33.
11. Rice JW, Veal JM, Fadden RP, et al. Small Molecule Inhibitors of Hsp90 potently affect inflammatory disease pathways and exhibit activity in models of rheumatoid arthritis. Arthritis Rheum 2008; 581(12): 3765–3775.
12. Han JM, Kwon NH, Lee JY, et al. Identification of gp96 as a novel target for treatment of autoimmune disease in mice. PLoS One. 2010 Mar 23; 5(3): e9792.
13. Tomcik M, Zerr P, Pitkowski J, et al. Heat shock protein 90 (Hsp90) inhibition targets canonical TGF-β signalling to prevent fibrosis. Ann Rheum Dis. 2013 May 9. [Epub ahead of print].
14. Schoof N, von Bonin F, Trümper, L et al. HSP90 is essential for Jak-STAT signaling in classical Hodgkin lymphoma cells. Cell Communication and Signaling 2009; 7 : 17.
15. Huang QQ, Sobkoviak R, Jockheck-Clark AR, et al. Heat shock protein 96 is elevated in rheumatoid arthritis and activates macrophages primarily via TLR2 signaling. J Immunol. 2009; 182(8): 4965–73.
16. Hayem G, Bandt MD, Palazzo E, et al. Anti-heat shock protein 70 kDa and 90 kDa antibodiest in serum of patients with rheumatoid arthritis. Ann Rheum Dis 1999; 58 : 291–296.
17. Hashiramoto A, Murata M, Kawazoe T, et al. Heat shock protein 90 maintains the tumour-like character of rheumatoid synovial cells by stabilizing integrin-linked kinase, extracellular signal-regulated kinase and protein kinase B. Rheumatology (Oxford). 2011; 50(5): 852–61.
18. Harlow L, Rosas IO, Gochuico BR, et al. Identification of citrullinated hsp90 isoforms as novel autoantigens in rheumatoid arthritis-associated interstitial lung disease. Arthritis Rheum. 2013; 65(4): 869–79.
19. Tomasello G, Sciumè C, et al. Hsp10, Hsp70, and Hsp90 immunohistochemical levels change in ulcerative colitis after therapy. Eur J Histochem. 2011 October 19; 55(4): e38.
20.Tukaj S, Kleszczyński K, Vafia K, et al. Aberrant expression and secretion of heat shock protein 90 in patients with bullous pemphigoid. PLoS One. 2013; 8(7): e70496.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek Editorial
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2013 Číslo 4- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Editorial
- Cirkulující protein tepelného šoku 90 (HSP90) u pacientů s revmatoidní artritidou a axiální spondyloartritidou
- Regulační T-lymfocyty jako nástroj suprese imunitního systému
- Revmatická polymyalgie – je účinná biologická léčba?
- Souhrnná zpráva z kongresu EULAR 2013
- Biosimilars – současné poznatky o jejich zaměnitelnosti
- Obsah ročníku časopisu Česká revmatologie 21/2013
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Revmatická polymyalgie – je účinná biologická léčba?
- Regulační T-lymfocyty jako nástroj suprese imunitního systému
- Biosimilars – současné poznatky o jejich zaměnitelnosti
- Cirkulující protein tepelného šoku 90 (HSP90) u pacientů s revmatoidní artritidou a axiální spondyloartritidou
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



