-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Ultrazvuková diagnostika syndromu fetální zánětlivé odpovědi u žen s předčasným odtokem plodové vody
Ultrasound diagnosis of fetal inflammatory response syndrome in women with preterm premature rupture of membrane
Objective:
The aim of this review is to analyze the existing possibilities of using ultrasound in the diagnosis of the fetal inflammatory response.Design:
Review.Settings:
Gynekologicko-porodnická klinika, Fakultní nemocnice Ostrava.Methods:
Preterm delivery is defined as a delivery before completed 37 weeks of gestation. Approximately one-thirdof these cases is associated with preterm premature rupture of membranes. About forty percent of preterm premature rupture of membranes is complicated by the fetal inflammatory response syndrome, which is associated with the development of severe perinatal morbidity. Recent prenatal diagnosis of the fetal inflammatory response syndrome is based on the invasive methods (amniocentesis, cordocentesis), which are limited by several risk factors accompanying these procedures and technical difficulties. Therefore, there is an effort to replace them by non-invasive approach. The development of ultrasound, as a diagnostic method through the last decade, and knowledge of pathophysiological and morphological changes in fetal organs associated with the fetal inflammatory response may lead to more specific diagnosis in the future and improvement of neonatal outcome.Conclusion:
Early identification of fetuses affected by FIRS in pregnancies with PPROM is necessary for right management of these pregnancy pathology. At this moment, ultrasonography examination of fetal lineal vein and fetal echocardiography, seems to be suitable for diagnosing FIRS.Keywords:
interleukin-6, adrenal glands, amniotic fluid, heart, kidney, preterm delivery, spleen, thymus
Autoři: R. Špaček 1; I. Musilová 2
; K. Magdová 1; O. Šimetka 1
; M. Kacerovský 2
Působiště autorů: Gynekologicko-porodnická klinika FN, Ostrava přednosta doc. MUDr. O. Šimetka, Ph. D., MBA 1; Porodnická a gynekologická klinika FN, Hradec Králové přednosta doc. MUDr. J. Špaček, Ph. D., IFEPAG 2
Vyšlo v časopise: Ceska Gynekol 2017; 82(2): 145-151
Souhrn
Cíl práce:
Rozbor dosavadních možností využití ultrazvuku v diagnostice syndromu zánětlivé odpovědi plodu.Typ studie:
Přehledový článek.Název a sídlo pracoviště:
Gynekologicko-porodnická klinika, Fakultní nemocnice Ostrava.Metodika:
Předčasný porod je definován jako porod před 37. dokončeným týdnem gestace. V jedné třetině případů je spojen s předčasným odtokem plodové vody. Předčasný odtok plodové vody je asi ve 40 % případů komplikován syndromem zánětlivé odpovědi plodu, spojeným se závažnou perinatální morbiditou. Prenatální diagnostika syndromu zánětlivé odpovědi plodu je postavena na invazivních metodách (amniocentéza, kordocentéza), majících své limity (riziko spojené s výkonem, technická obtížnost). Je snahou tyto metody nahradit metodami neinvazivními. Rozvoj ultrazvukové diagnostiky v posledním desetiletí by spolu s detailní znalostí změn patofyziologie a morfologie orgánů, které syndrom zánětlivé odpovědi plodu doprovází, mohl znamenat cestu ke zpřesnění diagnostiky patologií a v budoucnu i zlepšení neonatálních výsledků.Závěr:
Časná identifikace plodů s rozvíjejícím se syndromem fetální zánětlivé odpovědi (FIRS) v těhotenstvích komplikovaných předčasným odtokem plodové vody je nezbytná ke správnému stanovení dalšího managementu této těhotenské patologie. Z ultrazvukových parametrů plodu k detekci FIRS se zatím zdají nadějná vyšetření toku v lienální žíle a echokardiografické vyšetření srdce.Klíčová slova:
interleukin-6, ledvina, nadledviny, předčasný porod, plodová voda, slezina, srdce, thymusÚVOD
Předčasný porod je podle WHO definován jako porod před dokončeným 37. týdnem těhotenství, respektive do 259 dnů nitroděložního vývoje [1]. Práce publikované v posledních dvou desetiletích se snaží na předčasný porod nenahlížet jako na jednotné onemocnění, ale jako na syndrom vznikající následkem mnoha mechanismů [49]. Předčasný porod můžeme rozdělit z několika pohledů – podle gestačního stáří v době porodu nebo podle etiologie vzniku. Etiologické rozdělení vychází z klinických podmínek, které předčasnému porodu předchází. Může se jednat se o lékařsky indukovaný (iatrogenní) předčasný porod, porod s předčasným odtokem plodové vody (PPROM), či o spontánní předčasný porod se zachovaným vakem blan [36].
PPROM je definován jako porušení plodových obalů s odtokem plodové vody předcházející nástupu pravidelné děložní činnosti před dokončeným 37. týdnem těhotenství. Představuje závažnou komplikaci těhotenství, která je příčinou přibližně jedné třetiny předčasných porodů [42]. V současné době PPROM stále představuje zcela neprediktabilní a nepreventabilní těhotenskou komplikaci. Nicméně v porovnání s předčasným porodem se zachovaným vakem blan PPROM představuje poměrně homogenní entitu. Přesto lze PPROM rozdělit na tři základní podskupiny:
- i) tzv. pravý PPROM, kde je hlavní příčinou předčasné stárnutí/vyzrávání plodových obalů;
- ii) PPROM spojený s abrupcí placenty či krvácením do choriodeciduálního prostoru;
- iii) PPROM spojený se změnami na děložním čípku [37].
Podle recentních studií je etiologie PPROM převážně neinfekční [4]. PPROM je ovšem často komplikován mikrobiální invazí do amniální dutiny (MIAC), intraamniálním zánětem (IAI) a histologickou chorioamnionitidou (HCA) [42].
Amniální dutina je považována za sterilní prostředí. Nález bakterií v plodové vodě je označován jako MIAC a ve většině případů je považován za nález patologický. Ovšem ne vždy musí být spojen s horšími perinatologickými výsledky. MIAC však může vést k rozvoji IAI, který je charakterizován vysokými hladinami zánětlivých mediátorů v plodové vodě [25]. Dochází k infiltraci placenty a plodových obalů neutrofily a dalšími imunokompetentními buňkami, tedy k rozvoji HCA [29].
U plodu může v této situaci dojít k rozvoji syndromu fetální zánětlivé odpovědi (FIRS) [15], který je ekvivalentem syndromu systémové zánětlivé odpovědi dospělých (SIRS). Ten byl u dospělé populace poprvé popsán v roce 1992 American College of Chest Physicians a Society of Critical Care Medicine jako komplexní skupina změn. Zahrnuje kardiovaskulární abnormality vznikající na podkladě systémové aktivace imunitního systému [3]. Vlivem cytokinů a dalších prozánětlivých mediátorů dochází k rozvoji typických klinických příznaků – horečky, tachykardie, hyperventilace. Laboratorně lze pozorovat zvýšení počtu elementů bílé krevní řady [57]. V roce 2001 byla definice SIRS doplněna o fakt, že je spojen se zvýšenou hladinou zánětlivých mediátorů – především interleukinu (IL)-6 [32].
SYNDROM FETÁLNÍ ZÁNĚTLIVÉ ODPOVĚDI
FIRS byl poprvé popsán Gomézem a kol. v roce 1997 [16]. U plodu v děloze však nelze k jeho diagnostice použít stejná klinická kritéria jako u dospělých jedinců (pomineme-li stanovení srdeční frekvence pomocí kardiotokografie). Laboratorní parametr pro diagnostiku FIRS však byl použit stejný jako u dospělých jedinců – tj. hladina IL-6 > 11,0 pg/mL v krvi plodu [15, 16].
U plodů s rozvojem FIRS je prokazatelně vyšší riziko závažné perinatální morbidity, proto je stanovení přesné diagnózy důležité pro další management těhotenství [15]. Je jasně prokázaná souvislost rozvoje FIRS a následně vzniku syndromu respirační tísně novorozence, sepse novorozence, pneumonie novorozence, bronchopulmonální dysplazie, intraventrikulárního krvácení, periventrikulární leukomalacie a nekrotizující enterokolitidy [5, 8, 15, 18]. Práce prokazují, že u plodů s rozvinutým FIRS je zvýšená morbidita bez ohledu na gestační týden v době porodu [47].
FIRS vzniká zejména jako následek infekčního inzultu [15, 16]. Vaisbuch a kol. ovšem popisují FIRS jako následek anémie plodu u Rh aloimunizace [54]. Recentní práce skupiny profesora Romera prokazují roli IAI a FIRS v rozvoji syndromu aspirace mekonia [28].
Většina prací však spojuje rozvoj syndromu FIRS u plodů s MIAC a/nebo s HCA [15, 16, 23]. Kacerovský a kol. ve své studii u žen s PPROM prokázal, že zánětlivá odpověď plodu a riziko následného rozvoje FIRS jsou závislé na současné přítomnosti MIAC a HCA. Silnější zánětlivá odpověď plodu a vyšší frekvence FIRS byla prokázána u těhotenství s PPROM komplikovaném současnou přítomností MIAC a HCA [23]. Stejná skupina autorů v recentní práci dokazuje, že fetální zánětlivá odpověď a incidence FIRS je nejvyšší u pacientek s PPROM komplikovaným přítomností IAI, bez ohledu na to, zda byl tento zánět indukovaný mikroby, či sterilní [38].
Diagnostikovat FIRS lze na úrovni prenatální či postnatální. Standardem pro provádění prenatální diagnostiky FIRS je stanovení IL-6 ve fetální plazmě či plodové vodě [15, 50]. Koncentrace IL-6 ve fetální plazmě vyšší než 11 pg/mL a v plodové vodě vyšší než 11 ng/mL jsou považovány za diskriminační hodnoty pro diagnostiku FIRS. Postnatální diagnostika FIRS může být provedena stanovením koncentrace IL-6 ve vzorku pupečníkové krve odebrané po porodu plodu (hodnota IL-6 nad 11 pg/mL svědčí pro FIRS), nebo histopatologickým vyšetřením placenty, pupečníku a plodových obalů. Histopatologickým obrazem FIRS je nález zánětu pupečníku a/nebo zánětu cév na choriové plotně [45]. Vzhledem ke komplikacím a možným technickým obtížím, které jsou s invazivní prenatální diagnostikou spojeny, probíhá neustále hledání možnosti neinvazivní diagnostiky FIRS. U pacientek s vysokým rizikem rozvoje FIRS (například pacientky s PPROM) by zavedení těchto metod mohlo pomoci zpřesnit diagnózu a určit další postup sledování těhotenství. Existují práce, které zkoumají vztah FIRS a biofyzikálního profilu plodu u pacientek s PPROM, srdeční frekvence plodu, laboratorního vyšetření krve matky [2, 31, 44, 56]. Žádná z těchto metod však neposkytuje dostatečně validní výsledky pro zavedení do rutinní praxe.
Vzhledem k technickému pokroku ve vývoji sonografických přístrojů se při dobré znalosti patofyziologie FIRS jeví ultrazvukové vyšetření plodu jako možný nástroj neinvazivní diagnostiky do budoucna. Tento přehledový článek se proto zabývá možnostmi predikce přítomnosti FIRS pomocí ultrazvukového vyšetření plodu se snahou popsat probíhající změny na některých orgánech plodu.
SLEZINA
Slezina plodu hraje důležitou roli v odpovědi plodu na nitroděložní infekci [41]. Práce zaměřené na ultrazvukové vyšetření sleziny plodu popisují změny průtoku na v. lienalis [40, 41]. Lienální žíla je jednou ze tří větví v. portae, která odvádí krev ze sleziny a z horní části velkého zakřivení žaludku. Za normálních podmínek je tok krve na v. lienalis plodu kontinuální [41]. Musilová a kol. popsali přítomnost pulzatilního toku na v. lienalis u plodů těhotenství s PPROM komplikovaných HCA či funisitidou [41]. Stejný tým publikoval v roce 2014 výsledky prospektivní studie zabývající se přítomností pulzatilního toku na v. lienalis plodu a intenzitou zánětlivé odpovědi plodu u těhotenství s PPROM [40]. Bylo vyšetřeno 129 žen s PPROM. Pulzatilní tok na v. lienalis byl popsán u 26 % a kontinuální tok u 74 % plodů. Plody s pulzatilním tokem na v. lienalis vykazovaly vyšší koncentraci IL-6 (medián 56,7 pg/mL) v pupečníkové krvi oproti skupině plodů s kontinuálním tokem (medián 5,6 pg/mL, p < 0,0001). Výskyt FIRS byl vyšší ve skupině plodů s pulzatilní v. lienalis (71 %) oproti skupině plodů s kontinuálním tokem na lienální žíle (35 %, p = 0,0005). Plody s pulzatilní v. lienalis měly po porodu vyšší incidenci časné novorozenecké sepse než plody s normálním tokem na lienální žíle (p = 0,02).
THYMUS
Thymus je umístěný v přední části mediastina a je hlavním místem vývoje T-lymfocytů. Představuje tak jeden z hlavních orgánů imunitního systému plodu [51]. Jeho vývoj během prenatálního období je dokončen kolem 20. týdne těhotenství [17]. Bylo publikováno několik prací, které se zabývaly ultrazvukovým posouzením vztahu změny velikosti thymu a přítomností zánětlivých těhotenských komplikací [7, 11, 12, 39, 51, 58]. Tyto práce vycházejí z předpokladu, že rozvoj HCA vede ke stimulaci osy hypothalamus – hypofýza – nadledviny s následným zvětšením nadledvin plodu a zvýšením hladiny hormonů nadledvin [6, 34, 43]. Následkem aktivace stresové osy pak dochází k involuci thymu [22]. Menší thymus byl také popsán u plodů s růstovou restrikcí [9], u plodů s trizomií 21. chromozomu [26] a u těhotenství komplikovaných rozvojem preeklampsie [35].
První práce zabývající se ultrazvukovým zobrazením thymu, byla publikována Felkerem a kol. v roce 1989 [13]. Následný rozvoj ultrasonografické techniky umožnil zobrazit thymus u naprosté většiny plodů během ultrazvukového vyšetření ve druhém trimestru [60]. Pomocí ultrazvuku lze thymus zobrazit jako velice dobře vymezený, hypoechogenní orgán v horním mediastinu na úrovni roviny tří velkých cév, mezi nimi a sternem. Metodika posouzení velikosti thymu není jednotná, byly používány různé techniky. První práce používala měření předozadního průměru thymu [13]. Další práce byly zaměřeny na měření obvodu thymu [11, 12, 58], příčnou šířku thymu [39], poměr thymus – hrudník [20] nebo objem thymu za pomoci 3D sonografie [33]. V současné době lze najít práce popisující vztah mezi změnou velikosti thymu a zánětlivými těhotenskými komplikacemi [7, 11, 12, 51, 58]. Musilová a kolektiv se zaměřili na příčný rozměr thymu u žen, jejichž těhotenství bylo komplikováno předčasným odtokem plodové vody [39]. Do studie bylo zahrnuto celkem 216 žen. U 62 % z nich byla diagnostikována HCA a u 19 % funisitida. Plody z těhotenství komplikovaných HCA měly menší příčný rozměr thymu než z těhotenství bez HCA (s HCA: medián 23,9 mm vs. bez HCA: medián 28,8 mm, p < 0,0001). U plodů s potvrzenou funisitidou byl také prokázán signifikantně menší příčný průměr thymu než u plodů bez funisitidy (s funisitidou: medián 20,1 mm vs. bez funisitidy: medián 27,5 mm, p < 0,0001) [39]. Senzitivita „malého“ příčného průměru thymu (tj. pod 5. percentil pro dané gestační stáří) pro predikci HCA byla v této práci 79 %, specificita 47 %, pozitivní prediktivní hodnota 71 % a negativní prediktivní hodnota 59 %. Senzitivita „malého“ příčného průměru thymu pro predikci funisitidy byla 88 %, specificita 35 %, pozitivní prediktivní hodnota 24 % a negativní prediktivní hodnota 92 % [39]. V další práci, která zahrnovala 40 žen s předčasným odtokem plodové vody, zkoumali autoři vztah mezi příčným rozměrem thymu a rozvojem časné novorozenecké sepse [7]. Přítomnost menšího příčného rozměru thymu mělo 100% senzitivitu, specificitu 73 %, pozitivní prediktivní hodnotu 55 % a negativní prediktivní hodnotu 100 % pro predikci novorozenecké sepse. Z dostupných výsledků vyplývá jistý rozpor pro použití v klinické praxi. Přestože prvotní studie provedené na menších souborech žen ukázaly, že ultrazvukový průkaz „malého“ příčného průměru thymu by mohl být slibným markerem rozvoje FIRS, nízká specificita vyšetření průměru thymu vyplývající z práce, kterou publikovala Musilová a kolektiv, zatím brání širšímu klinickému využití [39].
NADLEDVINY
V průběhu předčasného porodu dochází k abnormální aktivaci kaskády dějů, které spouštějí děložní činnost. Výsledkem je zvýšená produkce dehydroepiandrosteron sulfátu v centrální zóně nadledvin plodu, což vede k zvětšení celého orgánu [27]. Práce pojednávající o vztahu velikosti nadledvin plodu k předčasnému porodu se zaměřují na ultrazvukové posouzení velikosti orgánu ve 2D i 3D zobrazení a možnosti predikce zánětlivých komplikací nebo předčasného porodu [21, 27, 52, 53]. Turan a kolektiv ve své práci, která srovnávala použití 2D kalkulace objemu nadledvin oproti 3D kalkulaci, uvádějí jako výhodnější použití 3D techniky [52]. Při použití 2D techniky byla stanovena nižší senzitivita i specificita pro riziko předčasného porodu (senzitivita 75 %, specificita 89 %). Při stanovení objemu nadledvin plodu pomocí 3D techniky byly výsledky přesnější, byla zjištěna senzitivita 85 % a specifita 95 % [52]. Stejný tým v roce 2007 představil stanovení objemu nadledvin plodu pomocí 3D ultrasonografie jako nový možný ukazatel rizika předčasného porodu [53]. Vyšetřeno bylo v této studii 126 plodů. Správně identifikovat nadledviny plodu se podařilo v 87 % případů. Objem nadledvin větší než 422 mm3/kg odhadu váhy plodu byl stanoven jako nejvhodnější ukazatel vysokého rizika předčasného porodu v následujících pěti dnech. Senzitivita byla 92 % a specificita 99 %. Tato data potvrzuje také studie z roku 2015 zahrnující 75 těhotných žen. Závěrem studie bylo, že velikost nadledvin větší než 405 mm3/kg je spojena s vyšším rizikem předčasného porodu, se senzitivitou 93 %, specificitou 96 %, negativní prediktivní hodnotou 96 % a pozitivní prediktivní hodnotou 93 % [21]. Recentní práce na velkém souboru pacientek (n = 1697) však 3D měření objemu nadledvin u asymptomatických žen jako vhodný prediktor předčasného porodu nenalezla [19].
LEDVINY
Vztah mezi sníženým množstvím reziduální plodové vody a nástupem předčasného porodu byl předmětem zkoumání několika prací, jejichž výsledky jsou však v rozporu [14, 24, 30, 46, 55, 59]. Mimo únik plodové vody poškozenými obaly při předčasném odtoku plodové vody je oligohydramnion vysvětlován přítomností MIAC, která může vézt k rozvoji FIRS s následnou redistribucí krevního oběhu plodu, snížením perfuze ledvin a poklesem diurézy plodu, což se projeví rozvojem oligohydramnia [46].
První data o vztahu přítomnosti oligohydramnia a zánětlivé odpovědi plodu u žen s PPROM publikovali Yoon a kolektiv v roce 1999 [59]. Index množství plodové vody (AFI) pět centimetrů a méně byl spojen s vyšší incidencí MIAC a HCA, vyššími koncentracemi IL-6, IL-1b, tumor necrosis factorem α v plodové vodě a s IL-6 v pupečníkové krvi. Lee a kolektiv ve své práci zahrnující 205 žen s předčasným odtokem plodové vody nalezli vyšší incidenci oligohydramnia a snížené AFI u pacientek s MIAC než u pacientek bez MIAC (p = 0,01) [30]. Podobné výsledky prezentovali i další autoři [14, 46, 55]. Naopak Kacerovský a kolektiv ve své práci publikované v roce 2014 spojitost mezi oligohydramniem a vyšším výskytem MIAC nebo HCA nepotvrdili [24].
SRDCE
Princip ultrazvukového vyšetření srdce plodu, přes jisté rozdílnosti v imunitním systému plodu a dospělého člověka, vychází z předpokladu, že FIRS je v podstatě novorozeneckým protějškem SIRS [15]. Vzhledem k faktu, že vliv SIRS na srdeční činnost je velice dobře popsán, je předpoklad podobného vývoje změn srdeční funkce plodu během FIRS. To potvrdili Romero a kolektiv, kteří se ve své práci zaměřili na diastolickou dysfunkci srdce u plodů z PPROM těhotenství a u plodů z těhotenství s prokázanou MIAC [48]. V této práci, používající k posouzení srdeční funkce konvenční dopplerovské měření srdečních průtoků, byla prokázána zvýšená compliance levé komory u pacientek s PPROM komplikovaných přítomností MIAC [48]. Zavedení nových ultrazvukových zobrazovacích technik (tissue Doppler imaging, strain rate imaging) do vyšetřování plodů z těhotenství komplikovaných PPROM se zaměřením na pravou komoru srdce plodu (anatomicky i funkčně dominantní srdeční komora během nitroděložního vývoje) popisuje Di Naro a kolektiv [10]. Také tato práce prokazuje změny srdeční funkce plodů s PPROM ve smyslu změny systolického i diastolického výkonu srdce, což je charakterizováno zvýšenou diastolickou compliance, snížením systolické kontraktilní funkce a podélnou dyskinezí myokardu [10]. Tyto práce potvrzují předpoklad, že srdce plodu je během FIRS vystaveno podobným změnám jako srdce dospělých jedinců při syndromu SIRS. Podrobné vyšetření srdeční funkce plodů z těhotenství komplikovaných PPROM by tak mohlo vést k upřesnění diagnózy a stanovení dalšího postupu. Limitací se však jeví poměrně vysoká složitost ultrazvukového vyšetření plodu.
ZÁVĚR
Časná identifikace plodů s rozvíjejícím se FIRS v těhotenstvích komplikovaných PPROM je nezbytná ke správnému stanovení dalšího managementu této těhotenské patologie. Z ultrazvukových parametrů plodu k detekci FIRS se zatím zdají nadějná vyšetření toku v lienální žíle a echokardiografické vyšetření srdce. Vyšetření dalších ultrazvukových parametrů plodu se pro rozporuplné výsledky dosavadních studií nejeví klinicky relevantní.
Tab. 1. Souhrn změn ultrazvukem vyšetřovaných orgánů u plodů s předčasným odtokem plodové vody 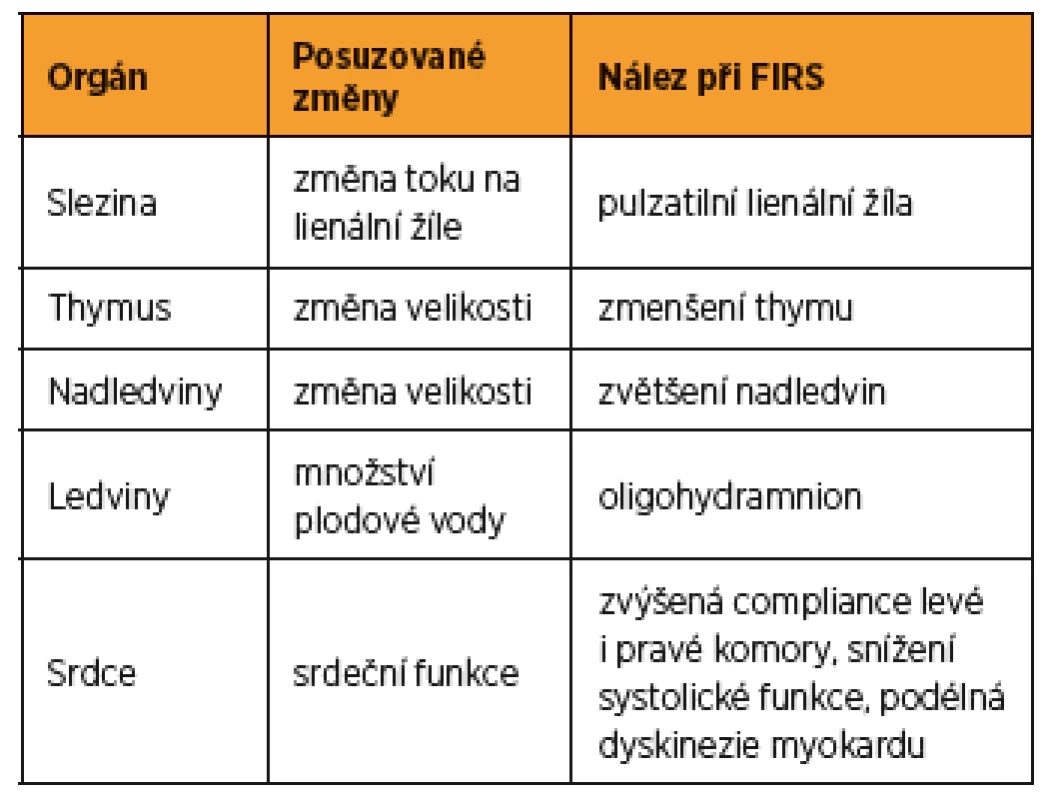
MUDr. Richard Špaček
Gynekologicko-porodnická klinika FN
17. listopadu 1790
708 52 Ostrava
e-mail: richard.spacek@fno.cz
Zdroje
1. The prevention of perinatal mortality and morbidity. Report of a WHO Expert Committee. World Health Organ Tech Rep Ser, 1970, 457, p. 1–60.
2. Aina-Mumuney, AJ., Althaus, JE., Henderson, JL., et al. Intrapartum electronic fetal monitoring and the identification of systemic fetal inflammation. J Reprod Med, 2007, 52, 9,p. 762–768.
3. Bone, RC., Balk, RA., Cerra, FB., et al. American-College of Chest Physicians Society of Critical Care Medicine Consensus Conference – Definitions for Sepsis and Organ Failure and Guidelines for the Use of Innovative Therapies in Sepsis. Crit Care Med, 1992, 20, 6, p. 864–874.
4. Bredeson, S., Papaconstantinou, J., Deford, JH., et al. HMGB1 promotes a p38MAPK associated non-infectious inflammatory response pathway in human fetal membranes. PLoS One, 2014, 9, 12, p. e113799.
5. Buhimschi, CS., Buhimschi, IA., Abdel-Razeq, S., et al. Proteomic biomarkers of intra-amniotic inflammation: relationship with funisitis and early-onset sepsis in the premature neonate. Pediatr Res, 2007, 61, 3, p. 318–324.
6. Buhimschi, CS., Turan, OM., Funai, EF., et al. Fetal adrenal gland volume and cortisol/dehydroepiandrosterone sulfate ratio in inflammation-associated preterm birth. Obstet Gynecol, 2008, 111, 3, p. 715–722.
7. Cetin, O., Dokurel Cetin, I., Uludag, S., et al. Serial ultrasonographic examination of the fetal thymus in the prediction of early neonatal sepsis in preterm premature rupture of membranes. Gynecol Obstet Invest, 2014, 78, 3, p. 201–207.
8. Cobo, T., Kacerovsky, M., Andrys, C., et al. Umbilical cord blood IL-6 as predictor of early-onset neonatal sepsis in women with preterm prelabour rupture of membranes. PLoS One, 2013, 8, 7, p. e69341.
9. Cromi, A., Ghezzi, F., Raffaelli, R., et al. Ultrasonographic measurement of thymus size in IUGR fetuses: a marker of the fetal immunoendocrine response to malnutrition. Ultrasound Obst Gyn, 2009, 33, 4, p. 421–426.
10. Di Naro, E., Cromi, A., Ghezzi, F., et al. Myocardial dysfunction in fetuses exposed to intraamniotic infection: new insights from tissue Doppler and strain imaging. Am J Obstet Gynecol, 2010, 203, 5.
11. Di Naro, E., Cromi, A., Ghezzi, F., et al. Fetal thymic involution: A sonographic marker of the fetal inflammatory response syndrome. Am J Obstet Gynecol, 2006, 194, 1, p. 153–159.
12. El-Haieg, DO., Zidan, AA., El-Nemr, MM. The relationship between sonographic fetal thymus size and the components of the systemic fetal inflammatory response syndrome in women with preterm prelabour rupture of membranes. BJOG, 2008, 115, 7, p. 836–841.
13. Felker, RE., Cartier, MS., Emerson, DS., Brown, DL. Ultrasound of the fetal thymus. J Ultras Med, 1989, 8, 12, p. 669–673.
14. Gauthier, DW., Meyer, WJ., Bieniarz, A. Biophysical profile as a predictor of amniotic fluid culture results. Obstet Gynecol, 1992, 80, 1, p. 102–105.
15. Gomez, R., Romero, R., Ghezzi, F., et al. The fetal inflammatory response syndrome. Am J Obstet Gynecol, 1998, 179, 1, p. 194–202.
16. Gomez, RG., Romero, R., Yoon, BW., et al. Two thirds of human fetuses with microbial invasion of the amniotic cavity have a detectable systemic cytokine response before birth. Am J Obstet Gynecol, 1997, 14, p. 176.
17. Gordon, J., Manley, NR. Mechanisms of thymus organogenesis and morphogenesis. Development, 2011, 138, 18, p. 3865–3878.
18. Hofer, N., Kothari, R., Morris, N., et al. The fetal inflammatory response syndrome is a risk factor for morbidity in preterm neonates. Am J Obstet Gynecol, 2013, 209, 6, p. 542, e541–542 e511.
19. Hoffman, MK., Turan, OM., Parker, CB., et al. Ultrasound measurement of the fetal adrenal gland as a predictor of spontaneous preterm birth. Obstet Gynecol, 2016, 127, 4, p. 726–734.
20. Chaoui, R., Heling, KS., Lopez, AS., et al. The thymic-thoracic ratio in fetal heart defects: a simple way to identify fetuses at high risk for microdeletion 22q11. Ultrasound Obstet Gynek, 2011, 37, 4, p. 397–403.
21. Ibrahim, MI., Sherif, A., El-Kady, M., et al. Can three-dimensional ultrasound measurement of fetal adrenal gland enlargement predict preterm birth? Arch Gynecol Obstet, 2015, 292, 3, p. 569–578.
22. Jondal, M., Pazirandeh, A., Okret, S. Different roles for glucocorticoids in thymocyte homeostasis? Trends Immunol, 2004, 25, 11, p. 595–600.
23. Kacerovsky, M., Cobo, T., Andrys, C., et al. The fetal inflammatory response in subgroups of women with preterm prelabor rupture of the membranes. J Matern Fetal Neona, 2013, 26, 8, p. 795–801.
24. Kacerovsky, M., Musilova, I., Andrys, C., et al. Oligohydramnios in women with preterm prelabor rupture of membranes and adverse pregnancy and neonatal outcomes. PLoS One, 2014, 9, 8, p. e105882.
25. Kacerovsky, M., Musilova, I., Khatibi, A., et al. Intraamniotic inflammatory response to bacteria: analysis of multiple amniotic fluid proteins in women with preterm prelabor rupture of membranes. J Matern Fetal Neona, 2012, 25, 10, p. 2014–2019.
26. Karl, K., Heling, KS., Sarut Lopez, A., et al. Thymic-thoracic ratio in fetuses with trisomy 21, 18 or 13. Ultrasound Obstet Gynecol, 2012, 40, 4, p. 412–417.
27. Langlois, D., Li, JY., Saez, JM. Development and function of the human fetal adrenal cortex. J Pediatr Endocrinol Metab, 2002, 15, Suppl. 5, p. 1311–1322.
28. Lee, J., Romero, R., Lee, KA., et al. Meconium aspiration syndrome: a role for fetal systemic inflammation. Am J Obstet Gynecol, 2016, 214, 3, p. 366, e361–369.
29. Lee, SD., Kim, MR., Hwang, PG., et al. Chorionic plate vessels as an origin of amniotic fluid neutrophils. Pathol Int, 2004, 54, 7, p. 516–522.
30. Lee, SE., Romero, R., Lee, SM., Yoon, BH. Amniotic fluid volume in intra-amniotic inflammation with and without culture-proven amniotic fluid infection in preterm premature rupture of membranes. J Perinat Med, 2010, 38, 1, p. 39–44.
31. Letti Muller, AL., Barrios Pde, M., Kliemann, LM., et al. Tei index to assess fetal cardiac performance in fetuses at risk for fetal inflammatory response syndrome. Ultrasound Obstet Gynecol, 2010, 36, 1, p. 26–31.
32. Levy, MM., Fink, MP., Marshall, JC., et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference. Intens Care Med, 2003, 29, 4, p. 530–538.
33. Li, L., Bahtiyar, MO., Buhimschi, CS., et al. Assessment of the fetal thymus by two - and three-dimensional ultrasound during normal human gestation and in fetuses with congenital heart defects. Ultrasound Obstet Gynecol, 2011, 37, 4, p. 404–409.
34. Miralles, R., Hodge, R., Kotecha, S. Fetal cortisol response to intrauterine microbial colonisation identified by the polymerase chain reaction and fetal inflammation. Arch Dis Child Fetal Neonatal Ed, 2008, 93, 1, p. F51–54.
35. Mohamed, N., Eviston, DP., Quinton, AE., et al. Smaller fetal thymuses in pre-eclampsia: a prospective cross-sectional study. Ultrasound Obstet Gynecol, 2011, 37, 4, p. 410–415.
36. Moutquin, JM. Classification and heterogeneity of preterm birth. BJOG, 2003, 110, Suppl. 20, p. 30–33.
37. Murtha, AP., Menon, R. Regulation of fetal membrane inflammation: a critical step in reducing adverse pregnancy outcome. Am J Obstet Gynecol, 2015, 213, 4, p. 447–448.
38. Musilova, I., Andrys, C., Drahosova, M., et al. Intraamniotic inflammation and umbilical cord blood interleukin-6 concentrations in pregnancies complicated by preterm prelabor rupture of membranes. J Matern Fetal Neona, 2016, p. 1–11.
39. Musilova, I., Hornychova, H., Kostal, M., et al. Ultrasound measurement of the transverse diameter of the fetal thymus in pregnancies complicated by the preterm prelabor rupture of membranes. J Clin Ultrasound, 2013, 41, 5, p. 283–289.
40. Musilova, I., Kacerovsky, M., Andrys, C., et al. The fetal splenic vein flow pattern and fetal inflammatory response in the preterm prelabor rupture of membranes. J Matern Fetal Neona, 2014, 27, 8, p. 770–774.
41. Musilova, I., Kacerovsky, M., Hornychova, H., et al. Pulsation of the fetal splenic vein – a potential ultrasound marker of histological chorioamnionitis and funisitis in women with preterm prelabor rupture of membranes. Acta Obstet Gynecol Scand, 2012, 91, 9, p. 1119–1123.
42. Musilova, I., Kutova, R., Pliskova, L., et al. Intraamniotic inflammation in women with preterm prelabor rupture of membranes. PLoS One, 2015, 10, 7, p. e0133929.
43. Naeye, RL., Harcke, HT., Jr., Blanc, WA. Adrenal gland structure and the development of hyaline membrane disease. Pediatrics, 1971, 47, 4, p. 650–657.
44. Newton, ER. Preterm labor, preterm premature rupture of membranes, and chorioamnionitis. Clin Perinatol, 2005, 32, 3, p. 571–600.
45. Pacora, P., Chaiworapongsa, T., Maymon, E., et al. Funisitis and chorionic vasculitis: the histological counterpart of the fetal inflammatory response syndrome. J Matern Fetal Neona, 2002, 11, 1, p. 18–25.
46. Park, JS., Yoon, BH., Romero, R., et al. The relationship between oligohydramnios and the onset of preterm labor in preterm premature rupture of membranes. Am J Obstet Gynecol, 2001, 184, 3, p. 459–462.
47. Rodriguez-Trujillo, A., Cobo, T., Vives, I., et al. Gestational age is more important for short-term neonatal outcome than microbial invasion of the amniotic cavity or intra-amniotic inflammation in preterm prelabor rupture of membranes. Acta Obstet Gynecol Scand, 2016, 95, 8, p. 926–933.
48. Romero, R., Espinoza, J., Goncalves, LF., et al. Fetal cardiac dysfunction in preterm premature rupture of membranes. J Matern Fetal Neona, 2004, 16, 3, p. 146–157.
49. Romero, R., Espinoza, J., Kusanovic, JP., et al. The preterm parturition syndrome. Bjog, 2006, 113, Suppl.3, p. 17–42.
50. Romero, R., Gomez, R., Ghezzi, F., et al. A fetal systemic inflammatory response is followed by the spontaneous onset of preterm parturition. Am J Obstet Gynecol, 1998, 179, 1, p. 186–193.
51. Sciaky-Tamir, Y., Hershkovitz, R., Mazor, M., et al. The use of imaging technology in the assessment of the fetal inflammatory response syndrome-imaging of the fetal thymus. Prenatal Diag, 2015, 35, 5, p. 413–419.
52. Turan, OM., Turan, S., Buhimschi, IA., et al. Comparative analysis of 2-D versus 3-D ultrasound estimation of the fetal adrenal gland volume and prediction of preterm birth. Am J Perinatol, 2012, 29, 9, p. 673–680.
53. Turan, OM., Turan, S., Funai, EF., et al. Fetal adrenal gland volume: a novel method to identify women at risk for impending preterm birth. Obstet Gynecol, 2007, 109, 4, p. 855–862.
54. Vaisbuch, E., Romero, R., Gomez, R., et al. An elevated fetal interleukin-6 concentration can be observed in fetuses with anemia due to Rh alloimmunization: implications for the understanding of the fetal inflammatory response syndrome. J Matern Fetal Neona, 2011, 24, 3, p. 391–396.
55. Vermillion, ST., Kooba, AM., Soper, DE. Amniotic fluid index values after preterm premature rupture of the membranes and subsequent perinatal infection. Am J Obstet Gynecol, 2000, 183, 2, p. 271–276.
56. Vintzileos, AM., Knuppel, RA. Fetal biophysical assessment in premature rupture of the membranes. Clin Obstet Gynecol, 1995, 38, 1, p. 45–58.
57. Weiss, M., Moldawer, LL., Schneider, EM. Granulocyte colony-stimulating factor to prevent the progression of systemic nonresponsiveness in systemic inflammatory response syndrome and sepsis. Blood, 1999, 93, 2, p. 425–439.
58. Yinon, Y., Zalel, Y., Weisz, B., et al. Fetal thymus size as a predictor of chorioamnionitis in women with preterm premature rupture of membranes. Ultrasound Obstet Gynecol, 2007, 29, 6, p. 639–643.
59. Yoon, BH., Kim, YA., Romero, R., et al. Association of oligohydramnios in women with preterm premature rupture of membranes with an inflammatory response in fetal, amniotic, and maternal compartments. Am J Obstet Gynecol, 1999, 181, 4, p. 784–788.
60. Zalel, Y., Gamzu, R., Mashiach, S., Achiron, R. The development of the fetal thymus: an in utero sonographic evaluation. Prenatal Diag, 2002, 22, 2, p. 114–117.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2017 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Cévní anatomie aortopelvického retroperitonea a její abnormality v souvislosti s radikální onkogynekologickou operativou – vlastní zkušenosti
- Těhotenství a porod žen s idiopatickými střevními záněty
- INFORMACE PRO LÉKAŘE VE SPECIALIZAČNÍ PŘÍPRAVĚ
- Trojčetné těhotenství se smíšenou chorionicitou po léčbě IVF: je fetoredukce vhodná?
- Abdominální těhotenství u pacientky po císařském řezu, oboustranné salpingektomii a embryotransferu
- Karcinoid apendixu v těhotenství
- Český překlad a validace dotazníku kvality pohlavního života u žen s prolapsem pánevních orgánů či inkontinencí moči nebo stolice – PISQ-IR
- Inverze dělohy
- Ultrazvuková diagnostika syndromu fetální zánětlivé odpovědi u žen s předčasným odtokem plodové vody
- Současné využití technik v diagnostice recidivujícího vulvovaginálního dyskomfortu
- Jsou nutné změny v regulaci přístupu žen bez partnera a homosexuálních osob k asistované reprodukci?
-
Spontánní předčasný porod
Doporučený postup -
Předčasný odtok plodové vody před termínem porodu
Doporučený postup -
Intrahepatální cholestáza v těhotenství
Doporučený postup - Doc. MUDr. Věra Rokytová, CSc.
- Osobní vzpomínka na prof. MUDr. Jiřího Skřivana, DrSc., k jeho nedožitým 90. narozeninám
- Zemřel doc. MUDr. Karel Janků, CSc.
-
Profesor MUDr. Jan Hořejší, DrSc.
6. 5. 1940 – 18. 11. 2016 - Vliv pooperačního podání oktreotidu na redukci lymforey a následně vzniku lymfocyst, lymfedému a lymfatického ascitu po lymfadenektomii u gynekologických malignit
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle-
Intrahepatální cholestáza v těhotenství
Doporučený postup -
Spontánní předčasný porod
Doporučený postup - Inverze dělohy
-
Předčasný odtok plodové vody před termínem porodu
Doporučený postup
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



