-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaŽírné buňky – nový pohled na staré známé
Mast cells – a new view of the old acquaintances
Mast cells are well known as the producers of histamine and major effectors of type1 hypersensitivity. They play however an important role in many other physiological and pathological processes. Lesser-known is their role in the processes such as a termination of pregnancy and initiation of delivery. The mast cells are considered as the modulators of endocrine signals on the local reactions in uterus. Many substances produced by the mast cells have the angiogenic effects known primarily for their role in tumour growth, but they influence also embryonal and postnatal growth or process of wound healing. Mast cells also participate in a number of compensatory reactions in the tissue response to the mechanical load, hypoxia or inflammation (airway remodelling in asthma, remodelling of pulmonary vessels in chronic hypoxia, myocardial hypertrophy, liver cirrhosis, chronic pancreatitis). This review describes recent concepts of their role in labour, non-cancerous angiogenesis and remodelling of pulmonary vasculature during chronic hypoxia.
Key words:
mast cells, mediators, labour, angiogenesis, remodelling, pulmonary vessels, hypoxia.
Autoři: H. Maxová; M. Vízek
Vyšlo v časopise: Čas. Lék. čes. 2010; 149: 319-323
Kategorie: Přehledový článek
Souhrn
Žírné buňky jsou v obecném povědomí spojovány především s uvolňováním histaminu během alergických reakcí, mají však velmi významnou roli v řadě dalších fyziologických i patologických reakcí organismu. K méně známým patří jejich úloha při ukončení těhotenství a zahájení porodu, kdy jsou považovány za zprostředkovatele vlivu endokrinních signálů na místní reakce v děloze. Řada látek produkovaných žírnými buňkami má angiogenní účinky, známé především u nádorového bujení, ovlivňují ale i embryonální a postnatální růst či proces hojení ran. Podílejí se též na řadě kompenzačních reakcí, jimiž tkáň reaguje na mechanickou zátěž, hypoxii či zánět (remodelace dýchacích cest u astmatu, plicních cév při chronické hypoxii, hypertrofie myokardu, jaterní cirhóza, chronická pankreatitida). Tento přehled je věnován novým poznatkům o jejich úloze během porodu, nenádorové angiogenezi a v remodelaci plicních cév při chronické hypoxii.
Klíčová slova:
žírné buňky, mediátory, porod, angiogeneze, remodelace, plicní cévy, hypoxie.Žírné buňky byly poprvé popsány Paulem Ehrlichem v jeho doktorské práci v roce 1878 (1). Od té doby jim byla věnována značná pozornost, především díky jejich roli v imunitních reakcích, zejména alergických (2). Tyto buňky ale hrají významnou roli v řadě dalších fyziologických i patologických reakcí organismu.
Pro náš přehled jsme si vybrali tři z nich: spouštění porodu, angiogenezi a remodelaci cévní stěny, o nichž informace v posledních letech rychle přibývají.
Typy žírných buněk
Žírné buňky se vyskytují prakticky ve všech savčích tkáních s výjimkou kompakty kostí, chrupavky a rohovky. Jejich počty jsou vyšší ve tkáních, které se stýkají se zevní prostředím – kůži, sliznicích. Žírné buňky jsou odvozeny od pluripotentní hematopoetické kmenové buňky kostní dřeně. Dřeň opouštějí jako progenitorové buňky a jejich maturace probíhá až v cílové tkáni, vlivem řady růstových faktorů a cytokinů (3). Proto se mohou žírné buňky v různých tkáních morfologicky i funkčně lišit.
Velikost žírných buněk je do značné míry závislá od stavu, v jakém se buňky nacházejí, tedy jaké obsahují množství sekrečních granul (4). Proto se údaje o rozměrech v literatuře značně liší. Obvykle se popisují jako buňky o rozměru mezi 10–15 μm s centrálně umístěným sférickým jádrem, cytoplazma je vyplněna sekrečními granuly s proteoglykanovou matrix o rozměrech 300–800 nm (5).
Buňky v aktivním stavu a naplněné sekrečními granuly, mohou dosahovat rozměrů i přes 20 μm, naopak buňky degranulované mohou být velmi malé kolem 8 μm (4). Při barvení toluidinovou modří vykazují tzv. metachromasii – purpurové zbarvení granul obsahujících kyselý heparin.
Lidské žírné buňky jsou klasifikovány nejčastěji histochemicky, podle obsahu proteáz v sekrečních granulech a rozlišují se dva subtypy (6, 7): MCT – obsahují tryptázu, která hraje klíčovou roli v zánětu a imunitní odpovědi, vyskytují se v místech často vystavených patogenům v blízkosti T-lymfocytů (proto jsou někdy označovány jako „imunitní“). Převládají ve střevní mukóze, v plicích ve stěně alveolů i bronších, v epiteliální vrstvě nosní sliznice a spojivky. V kůži je prakticky nenalezneme. MCTC – obsahují též tryptázu, ale navíc ještě chymázu, karboxypeptidázu a cathepsin G. Na rozdíl od prvního typu se hojně vyskytují v kůži a podkoží, dále ve střevní submukóze, v subepiteliální vrstvě nosní sliznice a spojivky. Nacházejí se též v srdci a účastní se remodelace tkáně a angiogeneze (8).
U jiných živočišných druhů jsou dělení žírných buněk odlišná. U hlodavců, nejčastěji používaných experimentálních zvířat, se podle lokalizace v organismu rozlišují dva základní subtypy: MMC (mucosal mast cells) nacházející se převážně ve sliznicích trávicího a respiračního traktu a CTMC (connective tissue mast cells) vyskytující se v pojivové tkáni různých orgánů (kůže, plíce, srdce, cévy, placenta).
Tyto subtypy se liší v mnoha parametrech (rozdílná velikost, délka života, závislost na T-lymfocytech, produkce mediátorů) (9). Rozdíly jsou i v možnostech farmakologického ovlivnění různých typů žírných buněk (10).
Žírné buňky produkují celou řadu mediátorů. Tyto mediátory plní typicky více než jednu funkci a ve svých funkcích se částečně překrývají. Zpravidla se dělí do tří skupin (11). První skupinu tvoří preformované mediátory uložené v sekrečních granulech – jako histamin, serotonin, proteoglykany, proteázy (chymáza, tryptáza, karboxypeptidáza A), preformovaný TNF-α (tumor necrosis factor α), jehož zásoby v žírných buňkách jsou větší než v neaktivovaných makrofázích a lymfocytech (12). Po aktivaci buněk jsou uvolňovány do okolního prostředí během vteřin či minut. Druhou skupinou jsou de novo syntetizované mediátory, odvozené od kyseliny arachidonové, jako PGD2 a PGE2 (prostaglandin D2 a E2).
Tyto mediátory jsou klíčové pro rozvoj zánětu. Jejich syntéza a uvolňování začíná po stimulaci během minut díky aktivaci fosfolipázy A2 a cyklooxygenáz 1 a 2. Do třetí skupiny se řadí nově tvořené cytokiny, chemokiny a růstové faktory, secernované později. Sem patří prozánětlivé faktory jako TNF-α (v tomto případě nově syntetizovaný) či interleukiny IL-3, IL-5, IL-6, IL-10, IL-8, a GM-CSF (granulocyte-macrophage colony-stimulating factor) i protizánětlivé působky – jako IL-4, IL-13, růstové faktory (NGF – nerve growth factor, VEGF – vascular endothelial growth factor, bFGF – basic fibroblast growth factor, TGF-ß – transforming growth factor ß) a nově i leptin (13). Mediátory produkované žírnými buňkami tedy mohou hrát roli ve všech významných fyziologických i patologických procesech ve tkáních. Na druhé straně jsou tyto mediátory produkovány i jinými buňkami a zjištění, že určitý mediátor má v dané reakci rozhodující úlohu, neprokazuje účast žírných buněk.
Žírné buňky a porod
Dnes je zřejmé, že se aktivita žírných buněk uplatňuje při ukončení těhotenství a zahájení porodu. Nedávno publikovaná teorie (14) považuje žírné buňky za zprostředkovatele vlivu endokrinních signálů na místní reakce v děloze vyvolávající porod. Tato teorie se opírá na jedné straně o nálezy zvýšené produkce působků uvolňovaných ze žírných buněk během porodu a na druhé straně o úvahy o aktivaci žírných buněk endokrinními změnami na počátku a během porodu.
Žírné buňky dělohy
Žírné buňky jsou v endometriu a děložním krčku (obr. 1) lokalizovány především v okolí krevních i mízních cév a nervů (15), mají ovšem úzký vztah i k buňkám hladkého svalu myometria. V experimentu na laboratorních potkanech Varayoud et al. (16) prokázali signifikantně vyšší množství žírných buněk v děložním krčku v první polovině březosti. Tyto buňky vykazovaly i vyšší degranulaci. Zastoupení imunitních (MCT) i neimunitních (MCTC) je stejné. Řada mediátorů uvolňovaných žírnými buňkami vyvolává kontrakci děložního svalstva. O tom není pochyb u histaminu, serotoninu, mediátorů odvozených od lipidů – jako PGD2, leukotrienů a PAF (platelet activating factor) (17). Navíc se účinky některých z nich, např. histaminu, serotoninu a PGF2α při současném výskytu potencují.
Obr. 1. Imunohistochemická detekce žírných buněk v děložním krčku potkana: A – pozitivně značené buňky (šipky) 12. den těhotenství lokalizované v okolí cév (trojúhelníky), B – naplněné buňky bez známek degranulace, C – degranulované buňky s vyprázdněnými částmi cytoplazmy (Bosquiazzo et al. Reproduction 2007; 133: 1045–1055. Reproduced by permission.) 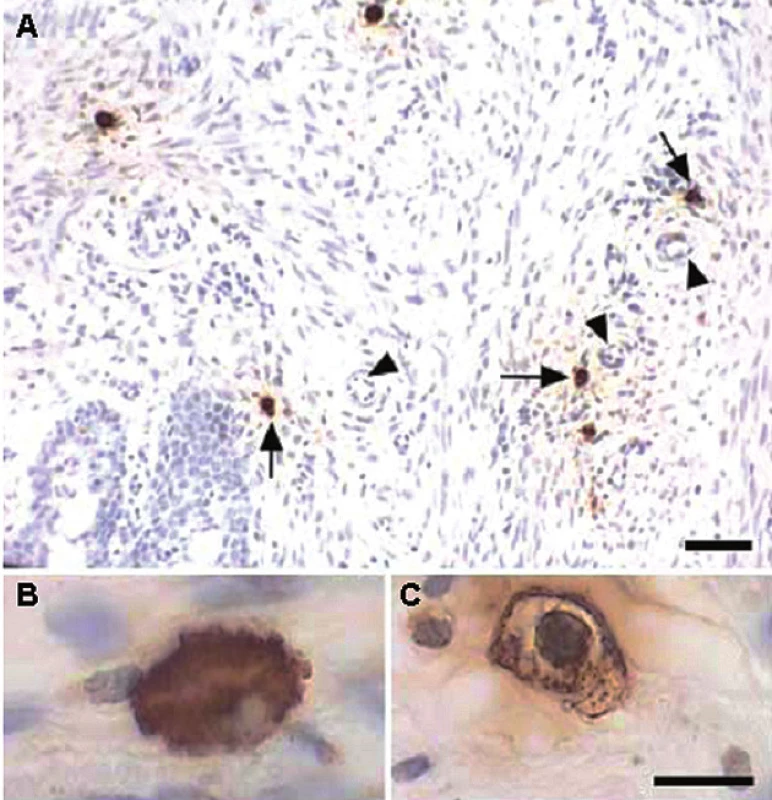
Yokoi et al. (18) sledovali průběh březosti na experimentálním modelu myší postrádajících žírné buňky (tzv. mi/mi genotyp charakterizovaný mikroftalmií, deficitem žírných buněk a osteopetrózou). Tyto myši na rozdíl od jiného typu mutace (tzv. op/op mající defekt pro M-CSF – macrophage colony-stimulating factor a vykazující infertilitu) zabřezly, ale četnost vrhu a hmotnosti plodů byly významně menší než u kontrol. Zajímavé je, že u těchto mi/mi deficitních myší došlo v 86 % k závažné komplikaci – poporodní inverzi dělohy.
Děložní žírné buňky uvolňují i cytokiny, růstové faktory a chemokiny spojené s aktivací zánětu, zodpovědné za „zánětlivé změny“ (inflammatory-state) v děloze během porodu, které opět vedou ke zvýšené citlivosti děložního svalstva ke kontraktilním podnětům. Z tohoto hlediska je nejvýznamnější TNF-α. Ten stimuluje expresi adhezivních molekul (E selektinu) endoteliemi cév myometria, pozorovanou během porodu (19), a tím akumulaci leukocytů (20). Makrofágy uvolňují reaktivní sloučeniny dusíku (RNS) a spolu s žírnými buňkami produkují reaktivní sloučeniny kyslíku (ROS) (21). Vztah ROS, RNS a jejich vliv na sekreční odpověď žírných buněk je podrobně zpracován v přehledu Swindle and Metcalfe (22). Oxid dusnatý (NO) stimuluje žírné buňky k produkci látek zvyšujících tonus děložního svalstva a svalové buňky k syntéze PGE2. RNS a ROS spolu vzájemně reagují, vzniká peroxynitrit, velmi silný aktivátor žírných buněk (23). Aktivované žírné buňky konečně uvolňují i tryptázu a tkáňové metaloproteinázy (24), které svou kolagenolytickou aktivitou přispívají ke zrání děložního hrdla a narušení plodových obalů.
Hormonální změny v těhotenství a žírné buňky
Z hormonů ovlivňujících průběh těhotenství a porodu mají prokázané účinky na žírné buňky estrogen, oxytocin a CRH (corticotropin releasing hormone). Zatímco estrogeny potencují degranulaci žírných buněk a uvolnění histaminu, progesteron sekreci inhibuje (25). Skutečnost, že převaha plazmatické hladiny estrogenu nad hladinou progesteronu rozhoduje o spuštění porodu a že histamin je jednou z látek vyvolávajících děložní kontrakce, svědčí pro významnou roli žírných buněk během porodu.
V regulaci děložních kontrakcí hraje důležitou roli i serotonin (jeho syntetický analog ergometrin se k vyvolání děložních kontrakcí klinicky používá), který navíc u potkanů zvyšuje tvorbu tkáňové metaloproteinázy MMP-13, a tím přispívá ke zrání děložního hrdla (26). Oxytocin zvyšuje extracelulární koncentraci serotoninu ve svalu dělohy inhibicí jeho vstupu do žírných buněk (27).
Posledním hormonem, jehož hladina se ke konci těhotenství výrazně mění a jehož účinky se dávají do vztahu k žírným buňkám, je CRH. Žírné buňky mohou nejen exprimovat receptory pro CRH, ale být i jeho zdrojem (28). CRH, pravděpodobně podobně jako další peptid se vztahem ke stresu – urocortin, zvyšuje děložní kontrakce vazbou na CRH receptor R2.
Žírné buňky a angiogeneze
Angiogeneze je komplikovaný proces, který je v příslušné tkáni kontrolovaný rovnováhou mezi pro - a antiangiogenními faktory. Jak popisuje ve svém review Norrby (29) jde o sled dějů zahájený aktivací endoteliálních buněk. Dochází ke změnám složení extracelulární matrix, proteolytické enzymy naruší bazální membránu. Mezi endoteliálními buňkami, na něž působí angiogenní stimuly, se vytváří lumen budoucí cévy. Novotvořené cévy se následně větví a vytvářejí síť. Tento přesně regulovaný proces má velký význam pro embryonální i postnatální růst, hojení ran i patologické procesy – jako nádorový růst (30).
Žírné buňky jsou zdrojem řady angiogenních faktorů: VEGF, bFGF , TGF-ß, TNF-α a IL-8. Navíc aktivace žírných buněk a uvolnění histaminu, prostaglandinů a leukotrienů (PGD2, LTB4, LTC4), VEGF a PAF vede ke zvýšení permeability kapilár, která má proangiogenní vliv (30).
Norrby et al. (31) byli pravděpodobně první, kteří schopnost žírných buněk vyvolat angiogenezi experimentálně prokázali. Jimi nově vyvinutou technikou pozorovali v krysím mezenteriu výraznou angiogenní odpověď po degranulaci žírných buněk vyvolané látkou 48/80 (vede k uvolnění vazoaktivních látek z granul žírných buněk). Stejnou odpověď pak nalezli i u myší (29). U morčat, jejichž žírné buňky na aplikaci 48/80 nereagovaly, se angiogeneze neobjevila. Látka 48/80 tedy sama o sobě angiogenní není. Následující studie o vlivu žírných buněk na novotvoření cév se rozdělily do dvou směrů: novotvorbu v tkáních postižených nádorovým bujením a v tkáních bez nádoru. Přes intenzivní výzkum v obou směrech, podíl žírných buněk na angiogenezi plně objasněn není, nicméně existuje věrohodná představa o mechanismech, jimiž se na ní podílejí (29). Podle ní:
- Histamin, uvolněný krátce po stimulaci žírných buněk, se naváže na H1 a H2 receptory endotelií a dalších buněk a aktivuje je.
- Stejně rychle uvolněné chemokiny přitahují makrofágy, leukocyty a lymfocyty, produkující cytokiny, které stimulují žírné buňky a ovlivňují angiogenezi.
- Proteázy žírných buněk odbourávají mimobuněčné struktury, a tím usnadňují migraci endoteliálních buněk a uvolňují na heparin vázané růstové faktory (VEGF, bFGF, TGF-ß).
- Proangiogenní faktory žírných buněk (výše zmíněné růstové faktory a TNF-α a IL-8) stimulují endotelie k sekreci proteáz, migraci k angiogennímu stimulu a proliferaci.
- Cytokiny uvolněné žírnými buňkami vyvolávají tvorbu proangiogenních faktorů fibroblasty a buňkami hladkého svalu a možná i protiangiogenních faktorů.
- Histamin, VEGF, prostaglandiny a leukotrieny zvyšují cévní permeabilitu, což má proangiogenní účinek.
- PAF ze žírných buněk působí agregaci a aktivaci destiček, z nichž se uvolňují proangiogenní faktory (VEGF, PDGF, LTC4 a bFGF), které převládnou nad antiangiogenním destičkovým faktorem 4.
- tromboxan A2 uvolněný žírnými buňkami působí antiangiogenně.
- Pokud jsou v tkáni nádorové buňky, tvoří VEGF a další faktory, které zvyšují počty žírných buněk, a stimulují je. Tím udržují v běhu angiogenezi nutnou pro růst nádoru a jeho případné maligní zvrhnutí. Pravděpodobným stimulem pro produkci VEGF je i hypoxie vznikající v rostoucím nádoru.
Žírné buňky a remodelace cévní stěny
Pojem remodelace zahrnuje všechny procesy, jež vedou ke strukturálním změnám tkáně počínaje růstem, přes diferenciaci až k jejímu zániku. Tyto děje jsou fyziologické (např. těhotenství, hojení ran), ale jsou i součástí řady patologických procesů včetně kompenzačních reakcí, jimiž tkáň reaguje na mechanickou zátěž, hypoxii či zánět (remodelace dýchacích cest u bronchiálního astmatu, plicních cév při chronické hypoxii, hypertrofie myokardu, jaterní cirhóza, chronická pankreatitida). Pro náš přehled jsme si vybrali změny týkající se primárně hypertrofie cévní medie.
Podstatou změn struktury tkáně jsou děje probíhající v extracelulární matrix (ECM) (32). ECM je komplikovanou strukturou složenou z kolagenu, elastinu, proteoglykanů a glykoproteinů. Vytváří jednak nosnou síť a mechanicky udržuje tkáň pohromadě, ale současně je prostředím, v němž probíhá mezibuněčná signalizace nezbytná ve všech fázích života buňky. Jednotlivé komponenty ECM jsou geneticky kódované, jejich produkce a degradace je udržována v rovnováze a právě žírné buňky mohou tuto rovnováhu narušit. Složení ECM napovídá, že je velice dobrým substrátem pro proteolytické enzymy – tkáňové metaloproteinázy (MMPs), především intersticiální kolegenázu a želatinázy (MMP-2 a MMP-9) produkované ve formě proenzymů žírnými buňkami typu CTMC. Tyto buňky současně uvolňují α-chymázu, jež pro-metaloproteinázy extracelulárně aktivuje (33). Již malé změny ve složení ECM mohou spustit reakce vedoucí k remodelaci dané tkáně. Poměrně dobře popsaným příkladem je průběh remodelace periferních plicních cév u zvířat vystavených chronické hypoxii, jejímž výsledkem je ztluštění medie plicních cév, zvýšení jejich odporu a vznik hypoxické plicní hypertenze (schéma 1) (34). Jakým mechanismem hypoxie ovlivňuje syntézu, degranulaci a migraci buněk, není známo. Předpokládá se vliv reaktivních sloučenin dusíku a kyslíku. V první fázi provázejí proliferaci fibroblastů a buněk hladkého svalu změny v pojivové matrix, na nichž se podílí enzymatická degradace kolagenu. Při tomto štěpení kolagenu se objevují specifické nízkomolekulární štěpy kolagenu typu I odpovídající působení intersticiální kolagenázy (35). Při pokračování hypoxie nastupuje druhá fáze, kdy tyto štěpy z tkáně vymizí a další rozšiřování medie ustává (36). Po ukončení expozice hypoxii nastupuje třetí fáze, kdy se cévní stěna opět přestavuje do své původní podoby a tlak v plicnici klesá. I v této fázi je metabolický obrat kolagenu zvýšený. Zdá se, že intersticiální kolagenáza se v podmínkách reoxygenace či hyperoxie chová odlišně než za hypoxie, kdy nízkomolekulární štěpy nevznikají (37).
Schéma 1. Rozvoj hypoxické plicní hypertenze 
Obr. 2. Žírné buňky v plicní tkáni laboratorního potkana. Purpurově zbarvené buňky se nacházejí především v okolí větvení bronchů a cév (na tlustém řezu 200 μm, barveno toluidinovou modří) 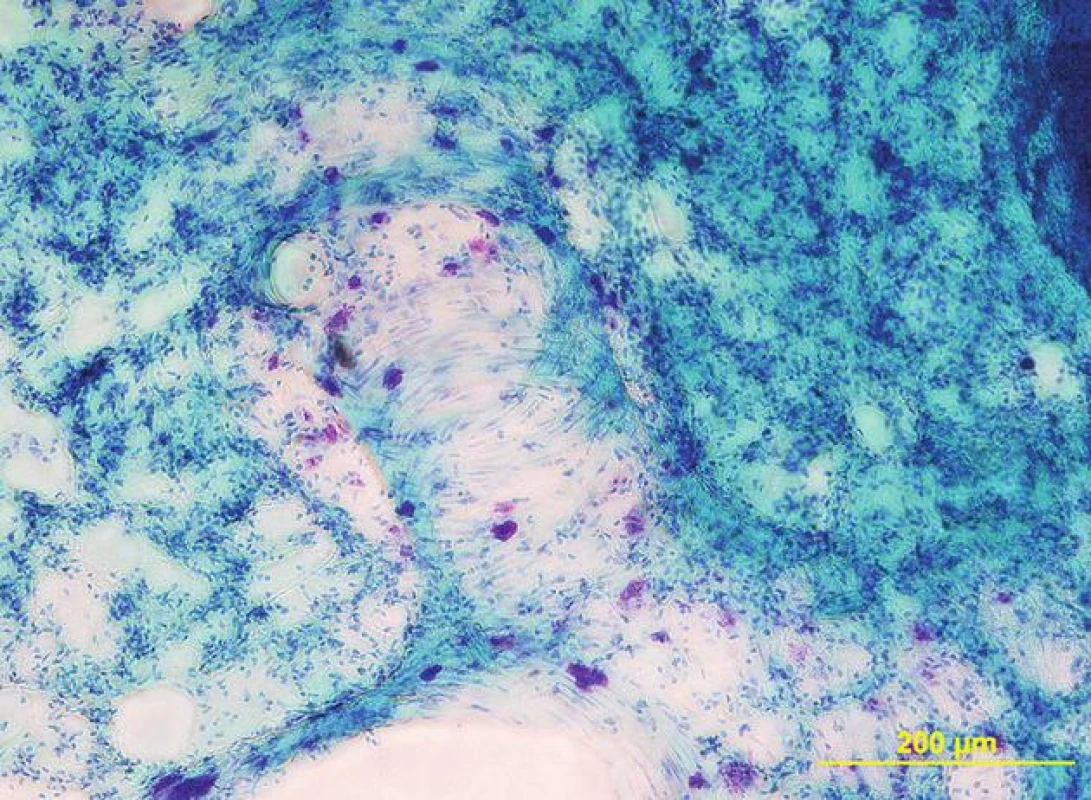
Předpokládá se, že se plicní žírné buňky (obr. 2) podílejí na obou přestavbách. O spoluúčasti žírných buněk na první fázi svědčí:
- zvýšené množství žírných buněk v plicní tkáni,
- změna jejich distribuce, při níž ze subpleurálních oblastí migrují do okolí periferních plicních cév (38),
- zvýšené množství „rodent-like“ intersticiální kolagenázy MMP-13 pozitivních granul v žírných buňkách izolovaných z plic laboratorního potkana a vystavených in vitro hypoxii (39),
- skutečnost, že antioxidant N-acetylcystein snižuje množství MMP-13 pozitivních granul v žírných buňkách vystavených in vitro hypoxii (40) a podaný in vivo zabrání vzniku hypoxické plicní hypertenze (41),
- zablokování degranulace žírných buněk kromoglykátem na počátku expozice chronické hypoxii oslabí rozvoj hypoxické plicní hypertenze (42).
Ve fázi přestavby cév po ukončení hypoxie převládá naopak degradace ECM – proteolýza a apoptóza. Tato fáze je prostudována podstatně méně, podíl žírných buněk potvrzuje:
- akumulace žírných buněk s vysokým obsahem MMP-13 v plicních cévách,
- mnohonásobně zvýšená proteolytická aktivita v plicní tkáni (43),
- zablokování degranulace žírných buněk kromoglykátem na počátku zotavení zpomalí pokles tlaku v plicnici (44).
Řada prací potvrzuje, že se žírné buňky modulací aktivity metaloproteináz podílejí i na remodelaci jiných orgánů, např. srdeční svaloviny vedoucí k selhání srdce (45) či pankreatu u lidí s chronickou pankreatitidou (46). Na druhé straně pokusy na myších a potkanech s výrazným deficitem v počtu žírných buněk ukázaly, že žírné buňky omezují remodelaci myokardu vyvolanou podáváním homocysteinu (47) či rozvoji intersticiální fibrózy v ledvinách po podání puromycinu (48).
Důkazů, že žírné buňky hrají roli jak ve spouštění porodu, tak angiogenezi a remodelaci cévní médie, je tedy dostatek. Ovlivnění jejich aktivity během těchto procesů by mohlo mít rozsáhlé terapeutické využití. Nejznámějším blokátorem degranulace žírných buněk je kromoglykát sodný. Pro své špatné farmakodynamické vlastnosti je ale používán převážně pro lokální aplikaci, perorálně se podává ve vysokých dávkách (vstřebá se asi 1 %) pouze u systémové mastocytózy (49). Další látkou je tranilast (derivát kyseliny anthranilové), u kterého proběhla rozsáhlá klinická studie zabývající se snížením výskytu restenózy po PTCA (perkutánní transluminární koronární angioplastika) (50). Podávání této látky bylo jednak spojeno se závažnými nežádoucími účinky (hyperurikémie, změny jaterních testů) a zároveň se ukázalo, že podání tranilastu u lidí po výkonu nemá patřičný efekt na rozdíl od preventivního podání zvířatům v experimentu (51). I když jsou známy látky, které uvolnění působků z žírných buněk brání, i látky, které žírné buňky aktivují, jejich širší klinické využití pro regulaci procesů, o nichž jsme v přehledu referovali, zatím možné není.
Zkratky
- bFGF – basic fibroblast growth factor
- CRH – corticotropin releasing hormone
- CTMC – connective tissue mast cells
- ECM – extracellular matrix
- GM-CSF – granulocyte-macrophage colony-stimulating factor
- IL – interleukin
- LTB4 – leukotrien B4
- LTC4 – leukotrien C4
- M-CSF – macrophage colony-stimulating factor
- MCT – žírné buňky obsahující tryptázu
- MCTC – žírné buňky obsahující tryptázu a chymázu
- MMC – mucosal mast cells
- MMPs – tkáňové metaloproteinázy
- MMP-2 – matrix metalloproteinase-2
- MMP-9 – matrix metalloproteinase-9
- MMP-13 – matrix metalloproteinase-13
- NGF – nerve growth factor
- NO – oxid dusnatý
- PAF – platelet activating factor
- PDGF – platelet derived growth factor
- PGD2 – prostaglandin D2
- PGE2 – prostaglandin E2
- PGF2 – prostaglandin F2
- PTCA – perkutánní transluminární koronární angioplastika
- RNS – reaktivní sloučeniny dusíku
- ROS – reaktivní sloučeniny kyslíku
- TGF-ß – transforming growth factor ß
- TNF-α – tumor necrosis factor .
- VEGF – vascular endothelial growth factor
Práce byla podpořena grantem GA ČR 305/08/0108 a Centrem výzkumu chorob srdce a cév MŠMT 1M0510.
Reprodukovaný materiál pochází z práce: Bosquiazzo et al. Reproduction 2007; 133 : 1045–1055. © Society for Reproduction and Fertility (2010). Reproduced by permission.
Adresa pro korespondenci:
MUDr. Hana Maxová Ph.D.
Ústav patologické fyziologie 2. UK LF
Plzeňská 221/130, 150 00 Praha 5
fax: +420 257 210 995, e-mail: hana.maxova@lfmotol.cuni.cz
Zdroje
1. Ehrlich P. Beiträge zur Theorie und Praxis der histologischen Färbung. Thesis, Liepzig University 1878.
2. Hakim-Rad K, et al. Mast cells: makers and breakers of allergic inflammation. Curr Opin Allergy Clin Immunol 2009; 9 : 427–430.
3. Metcalfe DD. Mast cells and mastocytosis. Blood 2008; 112 : 946–956.
4. Schulman ES, et al. Heterogeneity of human mast cells. J Immunol 1983; 131 : 1936–1941.
5. Tabares L, et al. Relationship between fusion pore opening and release during mast cell exocytosis studied with patch amperometry. Biochem Soc Trans 2003; 31 : 837–841.
6. Irani AA, et al. Two types of human mast cells that have distinct neutral protease compositions. Proc Natl Acad Sci USA 1986; 83 : 4464–4468.
7. Krishnaswamy G, et al. The human mast cell: an overview. Methods Mol Biol 2006; 315 : 13–34.
8. Janicki JS, et al. Cardiac mast cell regulation of matrix metalloproteinase-related ventricular remodeling in chronic pressure or volume overload. Cardiovasc Res 2006; 69 : 657–665.
9. Welle M. Development, significance, and heterogeneity of mast cells with particular regard to the mast cell-specific proteases chymase and tryptase. J Leukoc Biol 1997; 61 : 233–245.
10. Stenton GR, et al. Role of intestinal mast cells in modulating gastrointestinal pathophysiology. Ann Allergy Asthma Immunol 1998; 81 : 1–11.
11. Galli SJ, Tsai M. Mast cells: versatile regulators of inflammation, tissue remodeling, host defense and homeostasis. J Dermatol Sci 2008; 49 : 7–19.
12. Gordon JR, Galli SJ. Release of both preformed and newly synthesized tumor necrosis factor-α (TNF-α)/cachectin by mouse mast cells stimulated via the FcεRI. A mechanism for the sustained action of mast cell-derived TNF-α. during IgE-dependent biological responses. J Exp Med 1991; 174 : 103–107.
13. Taildeman J, et al. Human mast cells express leptin and leptin receptors. Histochem Cell Biol 2009; 131 : 703–711.
14. Rudolph MI, et al. Uterine mast cells: a new hypothesis to understand how we are born. Biocell 2004; 28 : 1–11.
15. Bosquiazzo VL, et al. Mast cell degranulation in rat uterine cervix during pregnancy correlates with expression of vascular endothelial growth factor mRNA and angiogenesis. Reproduction 2007; 133 : 1045–1055.
16. Varayoud J, et al. Mast cells degranulation affects angiogenesis in the rat uterine cervix during pregnancy. Reproduction 2004; 127 : 379–387.
17. Bytautiene E, et al. The effect of a mast cell degranulating agent on vascular resistance in the human placental vascular bed and on the tone of isolated placental vessels. Reprod Sci 2008; 15 : 26–32.
18. Yokoi H, et al. High incidence of uterine inversion in mast cell-deficient osteopetrotic mutant mice of mi/mi genotype. Biol Reprod 1994; 50 : 1034–1039.
19. Schmidt A, et al. Lovastatin-stimulated superinduction of E-selectin, ICAM-1 and VCAM-1 in TNF-alpha activated human vascular endothelial cells. Atherosclerosis 2002; 164 : 57–64.
20. Osman I, et al. Leukocyte density and pro-inflammatory cytokine expression in human fetal membranes, decidua, cervix and myometrium before and during labour at term. Mol Hum Reprod 2003; 9 : 41–45.
21. Huang J, et al. Cellular localization and hormonal regulation of inducible nitric oxide synthase in cycling mouse uterus. J Leukoc Biol 1995; 57 : 27–35.
22. Swindle EJ, Metcalfe DD. The role of reactive oxygen species and nitric oxide in mast cell-dependent inflammatory processes. Immunol Rev 2007; 217 : 186–205.
23. Konopka TE, et al. Nitric oxide synthase II gene disruption: implications for tumor growth and vascular endothelial growth factor production. Cancer Res 2001; 61 : 3182–3187.
24. Milne SA, et al. Co-localization of matrix metalloproteinase-1 and mast cell tryptase in the human uterus. Mol Hum Reprod 2001; 7 : 559–565.
25. Vasiadi M, et al. Progesterone inhibits mast cell secretion. Int J Immunopathol Pharmacol 2006; 19 : 787–794.
26. Hattori Y, et al. Vascular expression of matrix metalloproteinase-13 (collagenase-3) in basal cell carcinoma. Exp Mol Pathol 2003; 74 : 230–237.
27. Vega E, Rudolph MI. Characterization of oxytocin receptors and serotonin transporters in mast cells. Endocrine 2002; 18 : 167–172.
28. Kempuraj D, et al. Corticotropin-releasing hormone and its structurally related urocortin are synthesized and secreted by human mast cells. Endocrinology 2004; 145 : 43–48.
29. Norrby K. Mast cells and angiogenesis. Apmis 2002; 110 : 355–371.
30. Maltby S, et al. Mast cells in tumor growth: angiogenesis, tissue remodelling and immune-modulation. Biochim Biophys Acta 2009; 1796 : 19–26.
31. Norrby K, et al. Mast-cell-mediated angiogenesis: a novel experimental model using the rat mesentery. Virchows Arch B Cell Pathol Incl Mol Pathol 1986; 52 : 195–206.
32. Davis GE, Senger DR. Endothelial extracellular matrix: biosynthesis, remodeling, and functions during vascular morphogenesis and neovessel stabilization. Circ Res 2005; 97 : 1093–1107.
33. Tchougounova E, et al. A key role for mast cell chymase in the activation of pro-matrix metalloprotease-9 and pro-matrix metalloprotease-2. J Biol Chem 2005; 280 : 9291–9296.
34. Novotná J. Pojivové bílkoviny periferních plicních cév při chronické hypoxii. Čs Fyziol 2009; 2 : 49–52.
35. Novotná J, Herget J. Possible role of matrix metalloproteinases in reconstruction of peripheral pulmonary arteries induced by hypoxia. Physiol Res 2002; 51 : 323–334.
36. Herget J, et al. A possible role of oxidant tissue injury in the development of pulmonary hypertension. Physiol Res 2000; 49 : 493–501.
37. Novotná J, et al. Hyperoxia and recovery from hypoxia alter collagen in peripheral pulmonary arteries similarly. Physiol Res 2001; 50 : 153–163.
38. Vajner L, et al. Acute and chronic hypoxia as well as 7-day recovery from chronic hypoxia affects the distribution of pulmonary mast cells and their MMP-13 expression in rats. Int J Exp Pathol 2006; 87 : 383–391.
39. Maxova H, et al. In vitro hypoxia increases production of matrix metalloproteinases and tryptase in isolated rat lung mast cells. Physiol Res 2008; 57 : 903–910.
40. Maxová H, et al. Effect of N-acetylcysteine on tissue metalloproteinases activity in RBL-2H3 mast cells exposed to 24 hours of “in vitro” hypoxia. Phys Res 2004; 53 : 24P.
41. Lachmanova V, et al. N-acetylcysteine inhibits hypoxic pulmonary hypertension most effectively in the initial phase of chronic hypoxia. Life Sci 2005; 77 : 175–182.
42. Banasova A, et al. Prevention of mast cell degranulation by disodium cromoglycate attenuates the development of hypoxic pulmonary hypertension in rats exposed to chronic hypoxia. Respiration 2008; 76 : 102–107.
43. Riley DJ, et al. Role of proteolysis and apoptosis in regression of pulmonary vascular remodeling. Physiol Res 2000; 49 : 577–585.
44. Maxová H, et al. Prevention of mast cell degranulation by disodium cromoglycate delayed the regression of hypoxic pulmonary hypertension in rats. Respiration (Published online: April 10, 2010).
45. Hara M, et al. Evidence for a role of mast cells in the evolution to congestive heart failure. J Exp Med 2002; 195 : 375–381.
46. Esposito I, et al. Mast cell distribution and activation in chronic pancreatitis. Hum Pathol 2001; 32 : 1174–1183.
47. Joseph J, et al. Protective role of mast cells in homocysteine-induced cardiac remodeling. Am J Physiol Heart Circ Physiol 2005; 288: H2541–2545.
48. Miyazawa S, et al. Role of mast cells in the development of renal fibrosis: use of mast cell-deficient rats. Kidney Int 2004; 65 : 2228–2237.
49. Maxová H, et al. Kromoglykát sodný – blokátor degranulace žírných buněk v procesu tkáňové remodelace. Čs Fyziol 2010; 59 : 21–23.
50. Gopalan R, Goldberg S. Tranilast in the Therapy of Coronary Artery Disease. Curr Interv Cardiol Rep 2000; 2 : 149–156.
51. Shiota N, et al. Tranilast suppresses vascular chymase expression and neointima formation in balloon-injured dog carotid artery. Circulation 1999; 99 : 1084–1090.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Přerušovaný půst může mít významná zdravotní rizika
- Tři jsou více než jeden: Kombinace 3 vitaminů skupiny B prodlužuje délku neuritů
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Postgenomová éra a co příjde po ní?
- Žírné buňky – nový pohled na staré známé
- Změny ve složení mastných kyselin v lipidech plazmy a erytrocytů u kriticky nemocných v průběhu sepse
- Výskyt etanolu a dalších drog u smrtelných dopravních nehod v České republice v roce 2008
- Výskyt metabolického syndromu u žen se syndromem polycystických ovarií
- Biliární ileus – diagnostická i terapeutická výzva
- Pavel Jerie: Pro koho je medicína
- Odborně-edukační činnost České společnosti pro zdravotnickou techniku
- Tradiční setkání lékárníků
- Konference o kardiálních markerech
- 54. výroční sjezd českých a slovenských revmatologů
- Jana Korandová
- 5. středoevropský kurz estetické plastické chirurgie a celostátní sympozium s mezinárodní účastí
- Prof. MUDr. Jan Šmarda, DrSc., osmdesátiletý
- Pocta prof. MUDr. Jiřímu Záhejskému, DrSc.
- VYBRANÉ, KURZY, STÁŽE A SEMINÁŘE IPVZ – 2. POLOLETÍ ROKU 2010
- AKCE ODBORNÝCH SLOŽEK čLS JEP
- Vybíral Z, Roubal J. (eds.): Současná psychoterapie
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Biliární ileus – diagnostická i terapeutická výzva
- Žírné buňky – nový pohled na staré známé
- Prof. MUDr. Jan Šmarda, DrSc., osmdesátiletý
- Změny ve složení mastných kyselin v lipidech plazmy a erytrocytů u kriticky nemocných v průběhu sepse
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



