-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Aktuality v léčbě a prevenci klostridiové kolitidy
Clostridium difficile Infection: an update on treatment and prevention
Disruption of the colonic microflora is one of the most significant adverse effects of antibiotic (ATB) therapy. Excessive multiplication of toxigenic Clostridioides difficile strains is responsible for about 20 % of cases of post-antibiotic diarrhoea. The global trend of Clostridium colitis incidence, severity, mortality and in particular therapeutic failure keeps rising. At the Department of Infectious Diseases we work on long-term monitoring of the most important colitis-associated risk factors and evaluation of individual therapeutic and preventive procedures (selective ATB therapy, faecal bacteriotherapy). A diligent analysis of risk factors and knowledge of pathogenesis are a prerequisite to practical implementation of effective and rational precautions to curb spreading of this illness. In the future, we anticipate increased use of fecal microbiota transplant, improvements in faecal transplant administration, wider use of probiotics and selective ATBs and further introduction of passive and active immunization into practice.
Keywords:
Clostridioides difficile – fecal microbiota transplant – fidaxomicin – intestinal dysbiosis – passive immunotherapy – probiotics
Autoři: Roman Stebel; Lenka Vojtilová; Petr Husa
Působiště autorů: Klinika infekčních chorob LF MU a FN Brno, pracoviště Bohunice
Vyšlo v časopise: Vnitř Lék 2020; 66(2): 58-62
Kategorie: Přehledové články
Souhrn
Jedním z nejvýznamnějších nežádoucích účinků širokospektré antibiotické (ATB) terapie je narušení mikroflóry tlustého střeva. Zhruba 20 % postantibiotických průjmů je způsobeno přemnožením toxigenních kmenů Clostridioides difficile. Celosvětově stále pozorujeme u klostridiové kolitidy vzestupný trend incidence, závažnosti případů, mortality a zejména počtu léčebných selhání. Na Klinice infekčních chorob FN Brno, pracoviště Bohunice, dlouhodobě sledujeme kromě základních epidemiologických charakteristik i nejvýznamnější rizikové faktory asociované s rozvojem kolitidy a vyhodnocujeme účinnost jednotlivých terapeutických a preventivních postupů (selektivně působící ATB, fekální bakterioterapie). Jen na základě pečlivé analýzy rizikových faktorů a znalosti patogeneze lze v praxi realizovat účinná opatření omezující šíření této nemoci. Do budoucna lze předpokládat častější využití fekální bakterioterapie, zdokonalování způsobu podání fekálního transplantátu, širší využití probiotik a selektivně účinkujících ATB a dále zavedení pasivní a aktivní imunizace do praxe.
Klíčová slova:
Clostridioides difficile – fidaxomicin – pasivní imunoterapie – probiotika – střevní dysbióza – transplantace střevní mikroflóry
Úvod
Průjmy asociované s přemnožením toxigenních kmenů Clostridioides difficile (podle starší taxonomie Clostridium difficile) v tlustém střevě, v anglosaské literatuře označované jako „Clostridium difficile Infection“ (CDI), představují celosvětově nejčastější průjmové onemocnění vznikající během hospitalizace, jež se významně podílí i na absolutním počtu nozokomiálních nákaz (1). Jen ve Spojených státech je udáváno ročně více než 500000 případů CDI a 30000 úmrtí (2). V ČR pozorujme v poslední dekádě dramatický vzestup incidence CDI (graf 1), aktuálně se počet hlášených případů ustálil na asi 4500 ročně. Celosvětově stále sledujeme vzestupný trend zejména počtu léčebných selhání. Po první epizodě CDI dochází k recidivě přibližně u 20 % nemocných, u druhé a další epizody již riziko stoupá až k 65 % (3).
Patogeneze klostridiové kolitidy
Grampozitivní sporulující anaerobní tyčinka Clostridioides difficile nebo zkráceně jako C. difficile je přítomná jako saprofyt kosmopolitně. Je také běžným komenzálem tlustého střeva zvířat. U lidí literatura uvádí asymptomatickou kolonizaci tračníku v rozmezí 1–15 % populace. U hospitalizovaných jedinců a u zdravotníků stoupá riziko kolonizace na 25–50 % (4).
Vlastní patogenezi CDI můžeme rozdělit do 3 fází
První fáze představuje alteraci mikroflóry tlustého střeva v důsledku působení různých podnětů. Nejčastějším inzultem, který narušuje přirozenou diverzitu intestinálního ekosystému, je léčba širokospektrými ATB. Za nejrizikovější skupiny jsou v současnosti považovány aminopeniciliny, fluorochinolony, cefalosporiny a linkosamidy. Klostridia jsou k těmto ATB rezistentní, v prostředí s limitovanými zdroji živin tak získávají kompetetivní výhodu, množí se a snadněji se dostávají do kontaktu s epitelem tlustého střeva. Přehled rizikových ATB uvádí Tab. 1 (5). U pacientů působí prakticky vždy řada rizikových faktorů ve vzájemné součinnosti, komplexně. Patří k nim např. i porušená motilita střeva, celková imobilita pacientů, snížená kyselost žaludečního sekretu, vyšší věk, sekundární imunodeficience se sníženou tvorbou slizničních IgA protilátek a další (4).
Tab. 1. Přehled antibiotik rizikových z indukce klostridiové kolitidy. Upraveno podle (5) 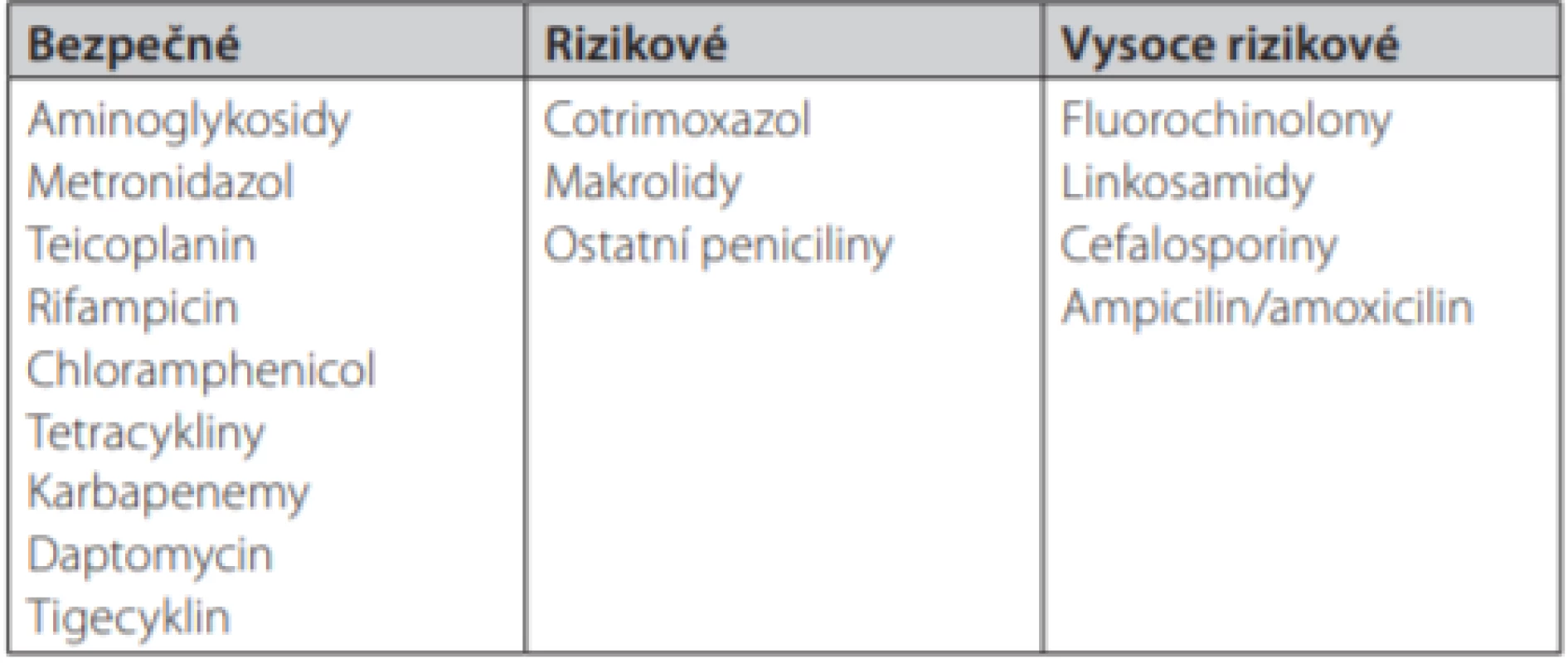
Za druhou fázi patogeneze můžeme považovat procesy vedoucí k vlastní klinické manifestaci onemocnění. Patogeneticky zde účinkují proteinové toxiny A (enterotoxin) a toxiny B (cytotoxin). Závažnost CDI kolísá od lehkých průjmů až po fulminantní pseudomembranózní kolitidu s potenciálně fatálními komplikacemi, jako jsou sepse, paralytický ileus a toxické megakolon (3).
Za třetí fázi patogeneze CDI je dnes považován určitý interval zvýšené „zranitelnosti“ střeva (the window of vulnerability) po ukončení léčby ataky CDI s extrémně vysokým rizikem rekurence. Tato perioda začíná již v okamžiku dosažení subinhibiční hladiny ATB použitého k léčbě CDI v tlustém střevě a končí až plnou restitucí střevní mikroflóry přibližně po 8 týdnech. K léčbě CDI v současnosti používáme ATB, která kromě účinku na Clostridioides difficile působí destruktivně i na řadu dalších bakterií, jež jsou součástí střevní mikrobioty. Klostridia ale i po léčbě přežívají ve střevě v podobě vysoce odolných spor. V terénu výrazně alterovaného střevního ekosystému se tyto spory mohou velmi rychle vyvinout do vegetativních forem a začít opětovně produkovat toxiny, mluvíme pak o relapsu CDI (3, 4).
Jedním z cílů farmaceutického průmyslu je vývoj nových antibiotických přípravků, které by působily selektivněji na Clostridioides difficile. Odlišným způsobem ochrany ekosystému tlustého střeva může v budoucnu být i použití specifických enzymů, které degradují v tenkém střevě nadbytečné molekuly ATB, ty následně již nepoškozují mikroflóru v aborálnějších etážích střeva. Přitom ale nedochází k ovlivnění účinku parenterálně podaného ATB. Klinické studie fáze 2 s enzymem ribaxamasou (SYN-004), který je podáván současně s intravenózními betalaktamovými ATB, vykazují slibné výsledky jednak ve snížení rizika indukce CDI, jednak v ochraně před kolonizací střeva multirezistentními kmeny bakterií (6). Období vulnerability střeva představuje rovněž nejvhodnější moment, kdy můžeme terapeuticky zasáhnout pomocí fekální bakterioterapie, event. pasivní imunoterapií.
Terapeutický algoritmus a novinky v léčbě CDI
Strategie léčby CDI je vždy individuální, léčebný postup je determinován zejména závažností kolitidy a počtem předchozích epizod onemocnění. Aktualizace algoritmu léčby CDI byla recentně publikována kolektivem holandských autorů (6). V publikaci je mimo jiné zpřesněna definice klostridiové kolitidy. Ataka CDI je nyní definována jako klinický obraz průjmového onemocnění (3 a více řídkých stolic za 24 hod nebo řídké stolice s větší frekvencí, než je u daného jedince obvyklé), ileózního stavu nebo toxického megakolon se současným průkazem volných toxinů nebo toxigenních kmenů Clostridioides difficile ve stolici. V případě nálezu toxigenního kmene klostridií (kultivačně či některou z metod založených na amplifikaci nukleových kyselin) definice nově vyžaduje i vyloučení alternativních příčin průjmového onemocnění či ileózního stavu (6). Aktuálně je panelem expertů z různých zemí v rámci studijní skupiny pro Clostridioides difficile (European Society of Clinical Microbiology and Infectious Diseases Study Group on Clostridioides difficile – ESGCD) připravován nový oficiální doporučený postup pro léčbu CDI.
V ČR jsou k léčbě CDI registrovány 3 přípravky: metronidazol, vankomycin a fidaxomicin. Před poslední aktualizací terapeutických algoritmů byl za úhelný kámen léčby nekomplikované první ataky CDI považován metronidazol, v případě závažné kolitidy pak perorální vankomycin. Podání proti Clostridioides difficile selektivněji účinkujícího fidaxomicinu bylo rezervováno pro případy rekurencí. Intravenózní administrace metronidazolu byla indikována v případech nemožnosti perorálního příjmu (metronidazol se téměř dokonale vstřebává již v horních částech trávicího traktu, do tračníku se dostává intestinální sekrecí) (7). Během posledních 5 let bylo nicméně publikováno několik studií, které prokázaly inferioritu metronidazolu oproti vankomycinu v léčbě i nezávažných prvních epizod CDI. Klinické studie prokazují jednak v řadě zemí nižší citlivost některých ribotypů Clostridioides difficile k metronidazolu a současně nedostatečnou intestinální koncentraci tohoto ATB v distálních etážích tračníku. V rámci ČR jsou případy rezistence k metronidazolu naštěstí stále raritní (méně než 5 % izolátů Clostridioides difficile). Zejména tak pro nedostatečnou koncentraci dosahovanou ve střevním obsahu, není metronidazol již považován za lék volby žádné z forem CDI (6). Odlišně je nyní přistupováno i k použití fidaxomicinu. Mechanismus jeho účinku spočívá v inhibici proteosyntézy na bakteriálních ribozomech, u CDI tedy současně zastavuje syntézu klostridiových toxinů. Klinické studie ve srovnání s vankomycinem prokazují u fidaxomicinu obdobné výsledky v léčbě ataky CDI, nicméně použití fidaxomicinu je spojeno se statisticky významně nižším rizikem rekurence (5–7). Guery et al v roce 2017 publikoval studii srovnávající počet rekurencí CDI u pacientů léčených vankomycinem (standardně 125 mg à 6 hod. po dobu 10 dnů) s fidaxomicinem podávaném v tzv. pulzním režimu (prvních 5 dnů klasicky 200 mg à 12 hod., následně 200 mg ob den 7.–25. den). Absence recidivy CDI během 30 dnů byla zaznamenána u 124 (70 %) ze 177 pacientů léčených fidaxomicinem, ve skupině léčených vankomycinem bylo bez rekurence 106 (59 %) ze 179 pacientů (p = 0,03). Fidaxomicin by měl být dnes zvažován i u prvních epizod CDI, zejména u polymorbidních pacientů s již vstupně vysokým rizikem recidivy. Nižší riziko rekurence CDI po léčbě fidaxomicinem je vysvětlováno zachováním přirozené rozmanitosti střevní mikroflóry (6).
V rámci klinických studií III. fáze bylo testováno několik nových léčiv. U přípravků surotomycin a cadazolid nebyla i přes slibné výsledky z předchozích fází studií prokázána non -inferiorita v léčbě CDI oproti vankomycinu. Další vývoj těchto léčiv byl ukončen. Na začátku klinické studie III. fáze je nyní ridinilazol, ATB s vysoce selektivním účinkem proti Clostridioides difficile (3, 6).
Samostatnou kapitolou je léčba nejtěžších forem CDI, včetně ileózního stavu a toxického megakolon. Lékem volby je v tomto případě perorální vankomycin spolu s metronidazolem intravenózně. V případě porušené peristaltiky lze dávkování vankomycinu navýšit na 250–500 mg à 6 hod. Vankomycin lze podávat i prostřednictvím nazogastrické sondy nebo v podobě retenčních klyzmat (500 mg à 4–12 hod.). V případech těžké kolitidy s rizikem rozvoje toxického megakolon indikujeme tzv. „bowel rest“ a ordinujeme parenterální výživu (7).
Alternativně je možné místo metronidazolu podat tigecyklin – širokospektré parenterální ATB patřící do skupiny glycylcyklinů. Jedná se o derivát tetracyklinového ATB minocyklinu, spektrum jeho účinku zahrnuje grampozitivní, gramnegativní, anaerobní i atypické agens, včetně některých multirezistentních kmenů. Výhodné může být jeho využití při koincidenci klostridiové kolitidy s jinou bakteriální infekcí. Mechanismus účinku spočívá v inhibici proteosyntézy, podobně jako fidaxomicin i tigecyklin tedy inhibuje syntézu toxinů Clostridioides difficile. Kombinace intravenózního tigecyklinu spolu s intrakolonicky aplikovaným vankomycinem by tak teoreticky měla představovat maximální konzervativní farmakologickou terapii CDI. Použití tigecyklinu je však prozatím podloženo pouze jednotlivými kazuistikami. Jedná se tak o podání tzv. off -label (6).
V okamžiku selhávání konzervativní terapie je na zvážení terapie chirurgická. Chirurgickým řešením je ve většině případů provedení subtotální kolektomie s vyvedením terminální ileostomie. Méně invazivní alternativu ke kolektomii představuje vyvedení derivační dvouhlavňové (axiální) ileostomie. Střevo pak může být peroperačně i pooperačně proplachováno v orálním i aborálním směru roztokem vankomycinu (3).
Primárně preventivní opatření
Pod pojmem primární prevence rozumíme opatření, která mají za cíl zabránit rozvoji primoataky CDI. Včasné rozpoznání pacientů s CDI a jejich následná izolace představují v nemocničním prostředí základní opatření zamezující přenos Clostridioides difficile na vnímavé jedince. V zahraničí se již můžeme setkat s automatizovanými screeningovými nástroji a dotazníky, které jsou vyhodnocovány při příjmu pacienta a dále pravidelně během hospitalizace s cílem co nejčasněji zachytit rozvoj CDI a zavést adekvátní izolační opatření (8). Jedná se zejména o izolaci pacienta na samostatném pokoji nebo v kohortě pacientů se stejným onemocněním. V rámci bariérového režimu ošetřování jsou používány jednorázové rukavice, pláště a vlastní vyšetřovací pomůcky.
Pokoje jsou vybaveny samostatným sociálním zařízením. Další opatření cílí na snížení kontaminace prostředí, standardem je úklid sporicidními prostředky. Běžně používané dezinfekce na bázi alkoholu a kvartérních amoniových sloučenin nejsou proti klostridiovým sporám účinné, podle některých autorů dokonce alkohol stimulují klíčení klostridií. V prevenci přenosu Clostridioides difficile, zejména ve formě spor, rukama pacientů a personálu se doporučuje mechanická očista rukou vodou a mýdlem a důkladné osušení (7).
Druhým pilířem primární prevence CDI je snížení rizika indukce kolitidy u již kolonizovaných u již kolonizovaných pacientů. Zde má klíčovou úlohu racionální ATB politika. V rámci ČR a Slovenska má v této oblasti velký význam činnost ATB středisek. Ty v rámci nemocničního sektoru konzultují a schvalují většinu ATB terapie podávané pacientům. Tzv. „antibiotický stewardship“ je pak v zahraničí často realizován infektology, kteří kromě mikrobiologických výsledků mohou při konziliárním vyšetření lépe vyhodnotit i anamnézu a aktuální klinický stav pacienta.
V posledních letech je velmi diskutovaná problematika použití probiotik v rámci prevence střevní dysmikrobie během a po ATB. Probiotika můžeme definovat jako živé mikroorganismy, které po podání v odpovídajícím množství poskytují hostiteli zdravotní benefit (2). Předpokládáme, že probiotika svým účinkem napomáhají k zachování kolonizační rezistence mikrobiálního ekosystému tlustého střeva. Shen et al recentně publikovali metaanalýzu studií hodnotících účinek probiotik v prevenci CDI u hospitalizovaných dospělých pacientů, kteří byli léčeni ATB. Metaanalýza zahrnovala 19 randomizovaných kontrolovaných studií, pacientům byla podávána probiotika obsahující kvasinku Saccharomyces boulardii, dále bakteriální kmeny z rodu Lactobacillus, Bifidobacterium a Streptococcus v kombinacích, nebo samostatně. Relativní riziko (RR) CDI ve skupině léčené probiotiky bylo 0,42 (95% interval spolehlivosti; CI 0,3–0,57) bez signifikantní heterogenity mezi studiemi (9). Nedostatky studií lze pozorovat ve výrazné variabilitě v použitých druzích bakterií a kvasinek. Předpokládá se totiž, že ochranný účinek probiotik je nejen druhově, ale i kmenově specifický. Nadějné výsledky vykazují kombinace probiotik s tzv. prebiotiky – nestravitelnými oligosacharidy, které slouží bakteriím jako substrát pro fermentaci (2). Důležitou otázkou zůstává bezpečnost probiotik u imunokompromitovaných osob a u pacientů s rozvinutou CDI. V literatuře byly popsány závažné komplikace s fungemií (event. bakteriemií) po translokaci kvasinek (resp. bakterií) do krevního oběhu přes zánětem porušenou střevní bariéru (1, 7). Komerčně vyráběná probiotika tak představují potravinové doplňky, které mohou napomoci zachovat diverzitu intestinální mikrobioty a snížit tím riziko ATB indukované střevní dysbiózy a postantibiotických průjmů. Jejich přínos je však velmi individuální, v praxi se setkáváme s řadou pacientů, u kterých i přes užívání probiotik dojde k rozvoji klostridiové kolitidy, na jejich ochranný efekt tak rozhodně nelze spoléhat. Aktuálně platné doporučené postupy paušální profylaktické používání probiotik nezahrnují (6, 7). V klinické praxi (zejména ambulantní) nicméně velmi často probiotika pacientům užívajícím ATB doporučujeme. Výjimku tvoří osoby imunokompromitované, u nich probiotika podáváme velmi opatrně a volíme přípravky bez kvasinek.
Mezi další faktory, které se s snažíme v rámci primární prevence CDI ovlivnit, patří léčba komorbidit spojených s poruchou slizniční imunity (mukositidy, nespecifické střevní záněty, ischemie střeva), dále snaha o pozitivní ovlivnění střevní motility a celkové mobility pacienta (časná vertikalizace po operacích a úrazech, dostatečná analgetizace). Rizikovými faktory jsou i nejrůznější sekundární imunodeficience (např. v rámci proteinenergetické malnutrice, terapie kortikoidy) a medikace snižující žaludeční aciditu, zejména léky ze skupiny inhibitorů protonové pumpy (5, 7).
Sekundární prevence
Pacient s opakovanými atakami CDI postupně fyzicky i psychicky strádá, rozvíjí se malnutrice, hypoalbuminemie, často zůstává imobilní na lůžku. Vázne rehabilitace, vznikají dekubity, prodlužuje se hospitalizace, často bývá nutný překlad na lůžko následné péče. Rozvíjí se postupně určitý bludný kruh, kdy recidivu CDI střídá jiná nozokomiální infekce s nutností další širokospektré ATB terapie. PPod pojmem sekundární prevence rozumíme opatření mající za cíl tento bludný kruh chronicky relabující CDI prolomit. Zasáhnout můžeme hned na několika úrovních, možné sekundárně preventivní postupy u CDI graficky znázorňuje schéma 1.
Schéma 1. Možnosti sekundární prevence rekurentní CDI 
Mezi specifické sekundárně preventivní postupy u CDI patří zejména obnova kolonizační rezistence tlustého střeva pomocí fekální bakterioterapie, dále také pasivní imunizace anti -toxin B monoklonální protilátkou. Řada dalších inovativních metod je ve stadiu vývoje. Jedná se např. o aktivní imunizaci toxoidovou vakcínou, použití bakteriofágů, kolonizaci střeva netoxigenními kmeny Clostridioides difficile nebo snahu o obnovení homeostázy žlučových kyselin ve střevě (2, 6).
Fekální bakterioterapie (FBT) je metoda mající za cíl dosáhnout restituce přirozené mikrobiální homeostázy v tlustém střevě pomocí stolice od zdravého dárce, která je přenesena do zažívacího traktu nemocného. Při FBT předpokládáme, že tímto přenosem stolice dokážeme „opravit“ narušenou rovnováhu ve střevním mikrobiálním ekosystému (týkající se jeho diverzity). Všechny mechanismy, jimiž FBT zabrání dalším rekurencím, do detailu zmapovány nejsou. U FBT se předpokládá komplexní účinek, který zahrnuje kompetici klostridií s ostatními bakteriemi o živiny, blokování adherence klostridií na povrch epitelu střeva, stimulaci hostitelské imunity, úpravu narušené homeostázy mezi primárními a sekundárními žlučovými kyselinami ve střevě, produkci imunomodulačních a baktericidních působků a další (10, 11). Účinnost FBT (absence rekurence CDI v intervalu 8 týdnů po podání fekálního transplantátu) se dle některých metaanalýz blíží 90 %, bez statisticky významného rozdílu v případě podání čerstvé nebo zamražené stolice. Statisticky významně vyšší účinnost byla pozorována při aplikaci fekálního transplantátu rektální cestou, v metaanalýzách byla nicméně zahrnuta zejména podání pomocí kolonoskopu do proximálních etáží tračníku (11, 12). V posledních letech se v rámci klinických hodnocení setkáváme s komerčně vyráběnými fekálními deriváty. Jedná se o složením přesně nedefinované, ale pečlivě kontrolované přípravky vyrobené ze stolice důkladně vyšetřených dárců. Fekální deriváty jsou upravovány pro možnost delšího skladování a jednoduššího podání pacientovi, stojí tak určitým způsobem na hranici mezi FBT a probiotiky.
Přípravek RBX2660 má podobu suspenze živých bakterií získaných ze stolice dárce, je skladován zamražený a podává se formou retenčního klyzmatu. Odlišný přístup využívá bakteriálních spor, které mohou být v podobě enterosolventních kapslí podány perorálně. Přípravek SER-109 obsahuje purifikované spory bakterií z kmene Firmicutes. Stále se ale jedná o přípravek relativně nedefinovaný s variabilním mikrobiálním složením. Stejná společnost vyvíjí i produkt SER-262, v tomto případě se již jedná o přípravek s definovaným složením, obsahuje 12 druhů bakterií ve formě spor (2).
Aktuálně široce diskutovanou problematikou je také úloha žlučových kyselin v patogenezi rCDI. Je známo, že primární žlučové kyseliny podporují germinaci spor Clostridioides difficile. Kyselina taurocholová se dokonce rutinně používá jako součást růstových médií určených ke kultivaci klostridií. Naopak sekundární žlučové kyseliny jsou potentním inhibitorem růstu i klíčení Clostridioides difficile. Jedná se zejména o kyselinu litocholovou, která vzniká v tlustém střevě činností střevních bakterií z kyseliny chenodeoxycholové. U pacientů s rCDI pozorujeme významně narušenou diverzitu intestinální mikrobioty, v tlustém střevě chybí i bakterie vybavené enzymovým komplexem 7α-dehydroxylázy. Tento enzym je klíčový pro přeměnu (dekonjugaci a dehydroxylaci) primární žlučových kyselin na sekundární. V literatuře nacházíme první kazuistická sdělení popisující léčebný účinek sekundárních žlučových kyselin. Jedná se zejména o podávání probiotických kmenů s prokázanou vysokou 7α-dehydroxylázovou enzymatickou aktivitou (Clostridium scindens) (2). Odlišný přístup by mohl spočívat v přímé aplikaci sekundárních žlučových kyselin do střeva. Již v roce 2016 byly publikovány první pokusy s podáním kyseliny ursodeoxycholové (ursodeoxycholic acid – UDCA) u pacientů s rCDI. UDCA přestavuje fyziologicky minoritně zastoupenou sekundární žlučovou kyselinu, která se v klinické praxi rutinně používá v léčbě cholestatických jaterních onemocnění. Hlavní limitací v použití u pacientů s rCDI je velmi rychlé zpětné vychytávání UDCA do enterohepatálního oběhu již v tenkém střevě, koncentrace UDCA v tračníku tak po perorálním podání zůstávají nízké. V publikované kazuistice byla UDCA podána u pacienta s refrakterním klostridiovým zánětem v oblasti ileopouchanální anastomózy. V tomto případě dosahovaly koncentrace žlučových kyselin v pouchi již dostatečných hladin, efektivně tak inhibovaly růst i germinaci spor Clostridioides difficile. Do budoucna lze očekávat vývoj derivátů sekundárních žlučových kyselin, které by nebyly absorbovány v tenkém střevě a byly by použitelné i v rámci sekundární profylaxe či léčby rCDI (13).
Odlišný přístup spočívá ve snaze posílit imunitní odpověď organizmu proti klostridiovým toxinům. V současnosti se jedná zejména o pasivní imunoterapii, na trhu je dostupná lidská monoklonální IgG1 protilátka bezlotoxumab, která neutralizuje toxin B Clostridioides difficile. Má biologický poločas přibližně 19 dnů a je charakteristická pasivním průnikem sliznicí do lumen střeva (zejména během zánětu). Výsledky registrační klinické studie prokázaly u bezlotoxumabu oproti placebu o 10 % nižší výskyt rekurence CDI (14). Po podání anti -toxin B protilátky se pacienti s rCDI stávají „asymptomatickými nosiči“, vzniká tak určitý časový prostor (determinován délkou účinku protilátky) bez rizika rekurence. Tím je umožněna fyziologická obnova ekosystému tlustého střeva, která trvá přibližně 8 týdnů (3).
Závěr
Kolitida vyvolaná bakterií Clostridioides difficile představuje v současnosti jedno z nejvýznamnějších infekčních onemocnění, které je kauzálně spojeno s poskytováním zdravotní péče. V rámci primární prevence je kladen důraz zejména na časnou diagnostiku CDI a izolaci nemocných, klíčovou úlohu má rovněž racionální ATB politika. Do budoucna lze očekávat zavedení aktivní imunizace rizikových pacientů rekombinantní toxoidovou vakcínou. Dnes již velmi dobře známe patogenezi CDI a víme, že rekurence jsou podmíněné zejména alterovanou intestinální mikroflórou. Terapie inklinuje k použití co nejselektivněji účinkujících ATB proti Clostridioides difficile. Z důvodů vysokého rizika selhání léčby by již neměl být jako lék volby CDI používán metronidazol. Cílem sekundární prevence je narušit pomyslný „circulus vitiosus“ chronicky relabující kolitidy. V budoucnu očekáváme rutinní využití FBT, zdokonalování způsobu administrace fekálního transplantátu (včetně perorálního podání v podobě enterosolventních kapslí), snahu o obnovení homeostázy žlučových kyselin ve střevě podáním specifických probiotických bakteriálních kmenů a v neposlední řadě i rozšíření pasivní imunizace.
Podpořeno MZ ČR – RVO (FNBr, 65269705).
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Roman Stebel,
Klinika infekčních chorob LF MU a FN Brno, pracoviště Bohunice
Jihlavská 20,
625 00 Brno
Cit. zkr: Vnitř Lék 2020; 66(E-2): e24–e28
Článek přijat redakcí: 27. 3. 2019
Článek přijat k publikaci: 20. 5. 2019
Zdroje
1. Al -Jashaami LS, Dupont HL. Management of Clostridium difficile Infection. Gastroenterol Hepatol 2016; 12 : 609–616.
2. Mills JP, Rao K, Young VB. Probiotics for prevention of Clostridium difficile infection. Curr Opin Gastroenterol 2018; 34 : 3–10.
3. Napolitano LM, Edmiston CE. Clostridium difficile disease: Diagnosis, pathogenesis, and treatment update. Surgery 2017; 162 : 325–348.
4. Yacyshyn B. Pathophysiology of Clostridium difficile -Associated Diarrhea. Gastroenterol Hepatol 2016; 12 : 558–560.
5. McDonald LC, Gerding DN, Johnson S et al. Clinical Practice Guidelines for Clostridium difficile Infection in Adults and Children. Clin Infect Dis 2018; 66 : 1–48.
6. Ooijevaar RE, Van Beurden YH, Terveer EM et al. Update of treatment algorithms for Clostridium difficile infection. Clin Microbiol Infect 2018; 24 : 452–462.
7. Beneš J, Husa P, Nyč O et al. Doporučený postup diagnostiky a léčby kolitidy vyvolané Clostridium difficile. Postgraduální gastroenterologie & hepatologie 2015; 1 : 304-313.
8. Pate K, Reece J, Smyre A A. Multifaceted Approach to the Prevention of Clostridioides (Clostridium) Difficile. Clin Nurse Spec 2019; 33 : 75–81.
9. Shen NT, Maw A, Tmanova LL et al. Timely Use of Probiotics in Hospitalized Adults Prevents Clostridium difficile Infection: A Systematic Review With Meta -Regression Analysis. Gastroenterology 2017; 152 : 1889–1900.
10. Hota SS, Sales V, Tomlinson G et al. Oral Vancomycin Followed by Fecal Transplantation Versus Tapering Oral Vancomycin Treatment for Recurrent Clostridium difficile Infection. Clin Infect Dis 2016; 64 : 265–271.
11. Li YT, Cai HF, Wang ZH et al. Systematic review with meta -analysis: long -term outcomes of faecal microbiota transplantation for Clostridium difficile infection. Aliment Pharmacol Ther 2016; 43 : 445–457.
12. Cammarota G, Ianiro G, Gasbarrini A Fecal microbiota transplantation for the treatment of Clostridium difficile infection: a systematic review. J Clin Gastroenterol 2014; 48 : 693–702.
13. Weingarden AR, Chen C, Zhang N et al. Ursodeoxycholic Acid Inhibits Clostridium difficile Spore Germination and Vegetative Growth, and Prevents the Recurrence of Ileal Pouchitis Associated With the Infection. J Clin Gastroenterol 2016; 50 : 624–630.
14. Wilcox MH, Gerding DN, Poxton IR et al. Bezlotoxumab for Prevention of Recurrent Clostridium difficile Infection. N Engl J Med 2017; 376 : 305–317.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2020 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Stárnutí cév a vaskulární paměť
- Co přináší internistům nové doporučení ESC – diabetes?
- Celiakie dospělých
- RECENZE KNIHY ÚVOD DO VNITŘNÍHO LÉKAŘSTVÍ – doc. MUDr. Jitka Mlíková Seidlerová, Ph.D., a kol.
- Pioglitazon
- Diferenciální diagnostika hypoglykemie
- Epidemiologie infekcí vyvolaných Clostridium difficile (CDI) v České republice
- Extraintestinální projevy celiakie
- Klinické aspekty depozice tuku v epikardu
- Adipocytokíny a tyreopatie
- Thymom – možnosti diagnostiky
- Aktuality v léčbě a prevenci klostridiové kolitidy
- Hypoxemie/hypoxie a nové koncepty oxygenoterapie v intenzivní péči
- Diabetes a kardiovaskulární onemocnění
- Relation between testosterone levels and body composition, physical functioning and selected biochemical parameters in adult males
- Inkretinová léčba diabetu a kardiovaskulární komplikace
- SGLT-2 inhibitory a jejich postavení v současné medicíně
- Cushingov syndróm a akromegália na podklade pikoadenómu hypofýzy
- Vrozený deficit C2 složky komplementu – variabilní klinická manifestace (kazuistiky a přehled problematiky)
- Obezita a kardiovaskulární onemocnění
- Diabetická noha
- Diosmin/hesperidin – spolupracující tandem nebo je diosmin klíčový a hesperidin jen neúčinnou příměsí?
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Diferenciální diagnostika hypoglykemie
- Hypoxemie/hypoxie a nové koncepty oxygenoterapie v intenzivní péči
- Thymom – možnosti diagnostiky
- Diosmin/hesperidin – spolupracující tandem nebo je diosmin klíčový a hesperidin jen neúčinnou příměsí?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




