-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Inkretinová léčba diabetu a kardiovaskulární komplikace
Incretin-based treatment of diabetes and cardiovascular complications
Cardiovascular complications are main cause of increased mortality in patients with type 2 diabetes. Decrease of overall cardiovascular risk and subsequently cardiovascular morbidity and mortality in type 2 diabetes patients is therefore an important treatment aim. To this end, intensive intervention of classical risk factors such as dyslipidemia, arterial hypertension, smoking along with lifestyle intervention is necessary. Good diabetes control optimally with the use of antidiabetic medication and smoking with positive effect on cardiovascular complication is of high importance as well.
Incretin-based therapy includes an approach based on an increase of endogenous GLP-1 concentrations by inhibition of its breakdown by dipeptidyl-peptidase 4 (DPP-4 inhibitors or gliptins) or he use of GLP-1 receptor agonists that owing to modified structure have much longer half-life than endogenous GLP-1 and act the use through stimulation of GLP-1 receptor.
The aim of this paper is to summarize the use of these two groups of antidiabetic drugs – gliptins and GLP-1 receptor agonists – in patients with type 2 diabetes focusing on the their cardiovascular effects and their influence on cardiovascular complications.
Keywords:
type 2 diabetes mellitus – cardiovascular complications – incretin‑based therapy – gliptins – GLP-1 receptor agonists
Autoři: Martin Haluzík
Působiště autorů: Centrum diabetologie IKEM a ÚLBLD 1. LF UK a VFN, Praha
Vyšlo v časopise: Vnitř Lék 2020; 66(2): 74-80
Kategorie: Hlavní téma
Souhrn
Kardiovaskulární komplikace jsou hlavní příčinou zvýšené mortality u nemocných s diabetem 2. typu. Proto je důležitým cílem léčby diabetiků 2. typu snížení jejich celkového kardiovaskulárního rizika a tím i kardiovaskulární morbidity a mortality. K tomu je nutná intenzivní intervence klasických rizikových faktorů, tedy léčba dyslipidemie, arteriální hypertenze, zákaz kouření a změna životního stylu. Velmi důležitá je také uspokojivá kompenzace diabetu a pokud možno i použití antidiabetik s pozitivním vlivem na kardiovaskulární komplikace. Inkretinová léčba zahrnuje přístup založený na zvýšení endogenních hladin antidiabeticky působícího glukagon‑like peptidu-1 (GLP-1) pomocí zablokování jeho štěpení dipeptidyl‑peptidázou 4 (DPP-4 inhibitory neboli gliptiny) nebo podávání GLP-1 agonistů, které mají díky modifikované struktuře podstatně delší poločas než endogenní GLP-1 a působí po vazbě na receptor pro GLP-1.
Cílem tohoto článku je shrnout použití těchto dvou lékových skupin – gliptinů a GLP-1 agonistů – u pacientů s diabetem 2. typu se zaměřením na jejich kardiovaskulární účinky a ovlivnění kardiovaskulárních komplikací.
Klíčová slova:
diabetes mellitus 2. typu – kardiovaskulární komplikace – inkretinová léčba – gliptiny – GLP-1 agonisté
Úvod
Stoupající prevalence obezity a diabetes mellitus 2. typu (DM 2. typu) je celosvětovým problémem, který se nevyhýbá ani České republice (1). Komplexní důvody tohoto stavu (nadměrný příjem energeticky bohaté stravy, snižující se fyzická aktivita, genetická zátěž) jsou dobře popsány, jejich účinné ovlivnění je však velmi obtížné a v praxi jen omezeně realizovatelné.
Obezita je zásadním rizikovým faktorem pro vznik inzulinové rezistence a u predisponovaných jedinců později pro rozvoj DM 2. typu (2). Zároveň obezita přispívá ke vzniku a rozvoji poruchy metabolismu lipidů, arteriální hypertenze, prokoagulačního stavu a řadě dalších odchylek, které jsou společně označovány jako metabolický syndrom či syndrom inzulinové rezistence (3). Přítomnost tohoto syndromu vede k významnému zvýšení kardiovaskulární morbidity a mortality, které se dále prohlubují u pacientů s neuspokojivou kompenzací DM 2. typu (4).
Současná léčba DM 2. typu dokáže u řady pacientů kompenzaci významně zlepšit. Klasická antidiabetika (inzulin, deriváty sulfonylurey, glinidy, pioglitazon) vedou často ke zvyšování hmotnosti a také k postupnému zhoršování funkce β‑buněk (5). Léčba deriváty sulfonylurey a inzulinem navíc zvyšuje riziko hypoglykemie, která může mít řadu závažných důsledků včetně prohloubení kardiovaskulárního rizika (6).
Inkretinová léčba zahrnuje přístup založený na zvýšení endogenních hladin antidiabeticky působícího glukagon‑like peptidu-1 (GLP-1) pomocí zablokování jeho štěpení dipeptidyl‑peptidázou 4 (DPP-4) – DPP-4 inhibitory neboli gliptiny – nebo podávání GLP-1 agonistů, které mají díky modifikované struktuře podstatně delší poločas než endogenní GLP-1 a působí po vazbě na receptor pro GLP-1 (7). Tato léčba byla také od svého uvedení na trh spojována s velkými nadějemi, jak pokud jde o snížení kardiovaskulárního rizika, tak i možnou ochranu beta‑buněk. Zpomalení progresivního úbytku beta‑buněk zatím v klinických studiích u inkretinové léčby potvrzeno nebylo. Zatímco u gliptinů byl prokázán neutrální vliv na kardiovaskulární komplikace jednoznačně potvrzeno nebylo, řada GLP-1 agonistů v kardiovaskulárních studiích snížila výskyt kardiovaskulárních komplikací a některé z nich i celkovou a kardiovaskulární mortalitu (8).
Antidiabetická léčba a kardiovaskulární komplikace
Antidiabetická léčba byla tradičně hodnocena na základě účinnosti při zlepšení kompenzace diabetu posuzované jako snížení glykovaného hemoglobinu (HbA1c) v kombinaci se sledováním bezpečnosti a nežádoucích účinků (vzestup hmotnosti, výskyt hypoglykemií atp.). Studie nutné k registraci nových antidiabetik nemusely být dlouhodobé (obvykle trvaly 6 měsíců, výjimečně 1 rok) a nebyl v nich systematicky sledován vliv na kardiovaskulární komplikace. Teprve v devadesátých letech a především v prvním desetiletí 21. století byly více prováděny studie primárně zaměřené na otázku, zda zlepšení kompenzace diabetu intenzivní antidiabetickou léčbou povede také ke snížení rizika kardiovaskulárních komplikací. Na základě jasné korelace mezi neuspokojivou kompenzací diabetu a zvýšením rizika kardiovaskulárních komplikací bylo předpokládáno, že strategie intenzivnější léčby diabetu vedoucí ke zlepšení kompenzace bude mít za následek i snížení četnosti kardiovaskulárních komplikací.
Zásadní informace o vlivu antidiabetik na kardiovaskulární komplikace (před zavedením inkretinové léčby a gliflozinů) tak pocházejí především z britské studie UKPDS a jejího prodloužení a ze studií ADVANCE, ACCORD a VADT. Studie UKPDS byla prováděna u pacientů s nově diagnostikovaným diabetem 2. typu dosud bez kardiovaskulárních komplikací (9). Tato studie prokázala, že časná intenzivní léčba diabetu vede ve srovnání s léčbou méně intenzivní ke snížení kardiovaskulární mortality i morbidity, a to již po deseti letech v případě metforminu, respektive po ještě delším časovém období (zjištěno až při prodlouženém sledování) v případě derivátů sulfonylurey či inzulinu. Do studie však bylo z dnešního pohledu zařazeno relativně málo pacientů, a tak její výsledky nejsou zejména v kardiologických kruzích považovány za dostatečně přesvědčivé.
Studie ADVANCE, ACCORD a VADT byly provedeny naopak u pacientů s delším trváním neuspokojivě kompenzovaného diabetu a s vysokým kardiovaskulárním rizikem (10–12). Tyto studie neprokázaly, že by intenzivní antidiabetická léčba pozitivně ovlivnila kardiovaskulární komplikace či mortalitu. Naopak výskyt mikrovaskulárních komplikací (zejména diabetické nefropatie) při intenzivnější léčbě významně poklesl. Diabetická větev studie ACCORD byla dokonce předčasně ukončena pro neočekávané zjištění zvýšené mortality u intenzivně léčených pacientů (13). Přesný důvod zvýšené mortality u intenzivně léčených pacientů nebyl dosud objasněn. Lze nicméně předpokládat, že se jednalo o zvýšení rizika hypoglykemie. Intenzivní léčba v těchto studiích totiž obvykle odpovídala nasazení či intenzifikací inzulinoterapie, což s sebou zvýšení rizika hypoglykemie nevyhnutelně přináší.
Zcela zásadním mezníkem v diskuzi o kardiovaskulární bezpečnosti antidiabetik byla metaanalýza publikovaná Nissenem a spoluautory 2007 prokazující zvýšení rizika kardiovaskulárních komplikací při léčbě tehdy oblíbeným a často využívaným antidiabetikem rosiglitazonem (agonista PPAR‑γ receptorů) (14). Na základě intenzivní debaty o kardiovaskulárních efektech rosiglitazonu přijaly regulační agentury – americká FDA i Evropská medicínská agentura doporučení, ukládající všem výrobcům antidiabetik nově uváděných na trh provedení studie potvrzující jejich kardiovaskulární bezpečnost. To je hlavní důvod, proč v případě inkretinové léčby i další nové skupiny antidiabetik gliflozinů mají prakticky všechny nové léky z těchto skupin provedenu prospektivní dvojitě slepou placebem kontrolovanou studii zaměřenou na kardiovaskulární bezpečnost.
Antidiabetické a další metabolické účinky gliptinů a GLP-1 agonistů
Inkretinová léčba je v rámci terapeutického algoritmu DM 2. typu léčbou druhé volby do kombinace k metforminu, který u diabetu 2. typu zůstává dle aktuálních doporučení lékem první volby (15). Schéma současného algoritmu léčby DM 2. typu vytvořeného na základě konsenzu Americké diabetologické asociace (ADA) a Evropské asociace pro studium diabetu (EASD) ukazuje obrázek 1.
Obr. 1. Algoritmus léčby DM 2. typu dle společného konsensu ADA a EASD aktualizovaného v roce 2020 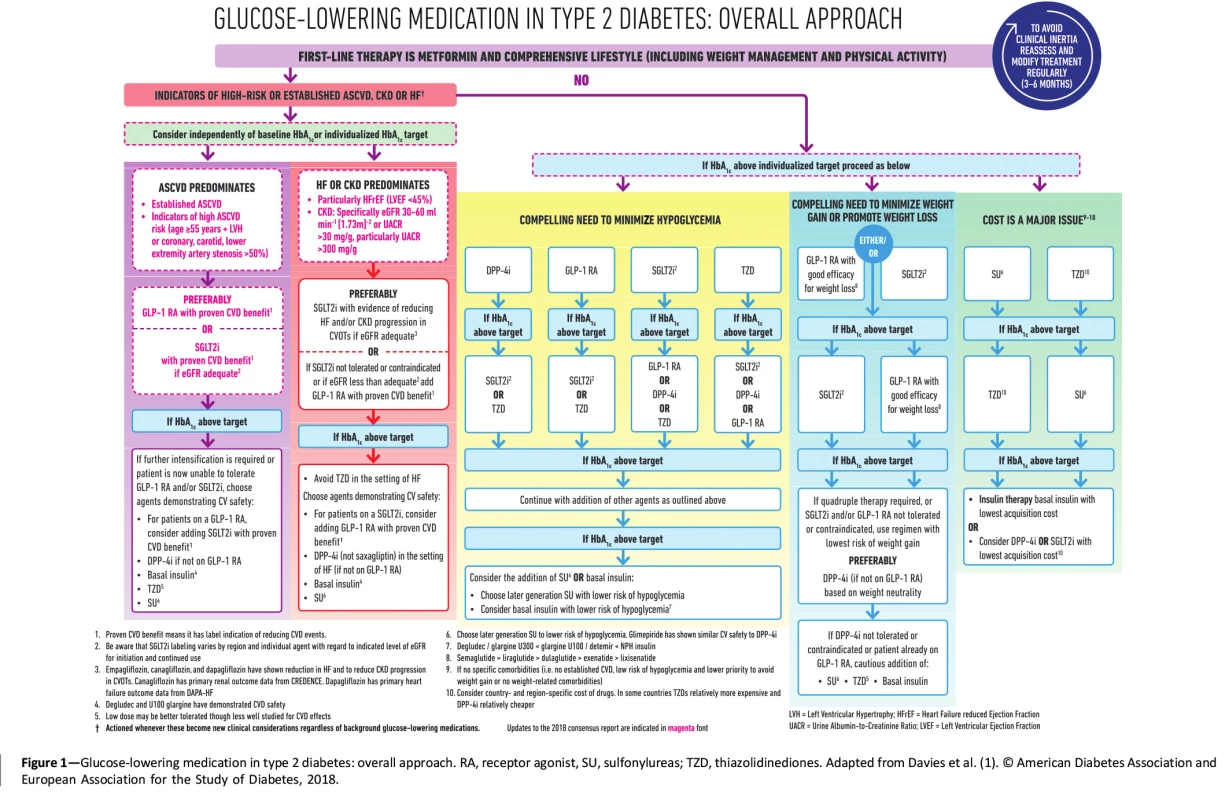
Antidiabetické účinky obou skupin inkretinových léků jsou založeny na působení zprostředkovaném GLP-1 receptory (16). U většiny diabetiků 2. typu je přítomna dysfunkce inkretinového systému projevující se nedostatečným vzestupem GLP-1 po příjmu potravy (kdy u zdravých jedinců výrazně stoupá jeho sekrece) (17). V případě gliptinů dochází inhibicí DPP-4 k normalizaci hladin GLP-1. GLP-1 agonisté dosahují při léčebném podávání vyšších až farmakologických hladin, což je důvodem, že mají některé účinky nad rámec působení gliptinů (18).
Gliptiny (v České republice je k dispozici sitagliptin, vildagliptin, saxagliptin, alogliptin a linagliptin) jsou účinná antidiabetika (účinnost je srovnatelná například s deriváty sulfonylurey), mezi jejichž výhody patří relativně nízký výskyt nežádoucích účinků a především fakt, že na rozdíl od derivátů sulfonylurey nevyvolávají hypoglykemii a nezvyšují tělesnou hmotnost (19). Zvýšení endogenního GLP-1 vede ke stimulaci sekrece inzulinu a snížení tvorby hyperglykemicky působícího glukagonu. Velmi výhodné je podávání gliptinů mimo jiné u starších pacientů a u nemocných s renální insuficiencí (20). Oblíbené je také jejich podávání ve fixních kombinacích s metforminem (21). Naděje na zpomalení progrese diabetu potlačením úbytku beta‑buněk však u gliptinů nebyly klinickými studiemi potvrzeny.
Synteticky připravení GLP-1 agonisté (v České republice je k dis ‑ pozici exenatid, lixisenatid, liraglutid, semaglutid a dulaglutid) mají dostatečně dlouhý poločas díky rezistenci k účinku DPP-4 a působí po vazbě na GLP-1 receptor (22, 23). Tyto léky vedou u diabetiků 2. typu k významnému zlepšení kompenzace diabetu podobně jako gliptiny díky stimulaci inzulinové sekrece a poklesu hladin glukagonu. Zároveň vedou k poklesu příjmu potravy, zpomalení vyprazdňování žaludku, ke snížení tělesné hmotnosti a také k mírnému poklesu systolického i diastolického krevního tlaku a zlepšení zejména postprandiální glykemie. Kombinace účinků GLP-1 agonistů je v rámci stávajícího portfolia antidiabetických léků včetně inzulinu unikátní. Mezi další výhody GLP-1 agonistů patří minimální výskyt hypoglykemií a také komplementarita jejich působení k účinkům dalších perorálních antidiabetik i inzulinu. Na rozdíl od gliptinů jsou GLP-1 agonisté podáváni injekčně (obvykle 1× denně nebo 1× týdně) a jejich aplikace je spojena s poněkud vyšším výskytem nežádoucích účinků – zejména gastrointestinálních (bolesti břicha, nauzea, zvracení, průjem) (24, 25). Tyto nežádoucí účinky se však obvykle nejvíce vyskytují na počátku léčby a po několika týdnech podávání se významně zmírňují až zcela mizí.
Kardiovaskulární účinky GLP-1, gliptinů a GLP-1 agonistů
Receptory pro GLP-1 jsou kromě gastrointestinálního traktu přítomny také v centrálním nervovém systému, v myokardu (zde zřejmě převážně v sinoatriálním nodu), v buňkách hladké svaloviny cév, v endoteliálních buňkách a v makrofázích (26). Navázání GLP-1 na receptor stimuluje produkci cyklického adenozin monofosfátu a aktivaci proteinkinázy A, což vede v myokardiálních buňkách ke zvýšení vychytávání glukózy a obecně k pozitivně inotropním účinkům. Podávání GLP-1 vedlo u diabetiků 2. typu ke snížení cévní rezistence a také ke zlepšení endoteliální dysfunkce (27). Kromě popsaných vlivů GLP-1 na myokard a endotel mohou být pozitivní účinky tohoto hormonu také zčásti zprostředkovány jeho působením na aterosklerotický proces (28).
Kromě studií zaměřených na podávání exogenního GLP-1 se po ‑ dobně efektivní zdá být i podání GLP-1 agonistů a v experimentu i některých gliptinů.
Kardiovaskulární studie s gliptiny a GLP-1 agonisty
V současné době jsou k dispozici výsledky 3 kardiovaskulárních studií, kde byl porovnáván vliv gliptinů vs. placeba na výskyt kardiovaskulárních komplikací u diabetiků 2. typu zároveň léčených standardní antidiabetickou léčbou (studie SAVOR‑TIMI se saxagliptinem (29), studie TECOS se sitagliptinem (30), studie EXAMINE s alogliptinem) (31). Výsledky pro všechny testované gliptiny byly stran kardiovaskulární bezpečnosti (kombinovaný endpoint smrti z kardiovaskulárních příčin, nefatálního infarktu myokardu a nefatálních cévních mozkových příhod) neutrální s výjimkou zvýšení rizika hospitalizace pro srdeční selhání ve studii SAVOR‑TIMI se saxagliptinem a naznačené podobné tendence s alogliptinem (29, 31). Za podrobnější zmínku stojí studie CAROLINA, která na rozdíl od předchozích tří studií neporovnávala účinky linagliptinu na kardiovasku ‑ lární komplikace s placebem, ale s derivátem sulfonylurey glimepiridem (32). Tato studie prokázala, že přidání linagliptinu u diabetiků 2. typu s vysokým kardiovaskulárním rizikem má na kombinovaný cíl – smrt z kardiovaskulárních příčin, nefatální infarkt myokardu a nefatální cévní mozkové příhody – srovnatelný vliv jako podávání derivátu sulfonylurey glimepiridu (32). Glimepirid byl sice spojen s významně vyšším výskytem hypoglykemií, ovšem toto zvýšení se nijak neprojevilo v ovlivnění kardiovaskulárních komplikací. Gliptiny tak lze obecně považovat za kardiovaskulárně bezpečné, ale nikoliv kardioprotektivní (33). V případě saxagliptinu a alogliptinu není dle SPC i aktuálních doporučení vhodné jejich podávání u pacientů s přítomností srdečního selhání (15, 34).
V současné době máme k dispozici výsledky 7 ukončených studií s podáváním GLP-1 agonistů – studie ELIXA (lixisenatid) (35), studie LEADER (liraglutid) (36), studie EXCEL (exenatid 1× týdně) (37), studie SUSTAIN 6 (semaglutid 1× týdně s.c) (38), studie REWIND (dulaglutid 1× týdně) (39), studie HARMONY (albiglutid 1× týdně) (40) a studie PIONEER 6 (semaglutid p. o. 1× denně) (41). Podrobnější charakteristiky jednotlivých studií jsou shrnuty v tabulce 1.
Tab. 1. Kardiovaskulární studie s GLP-1 agonisty 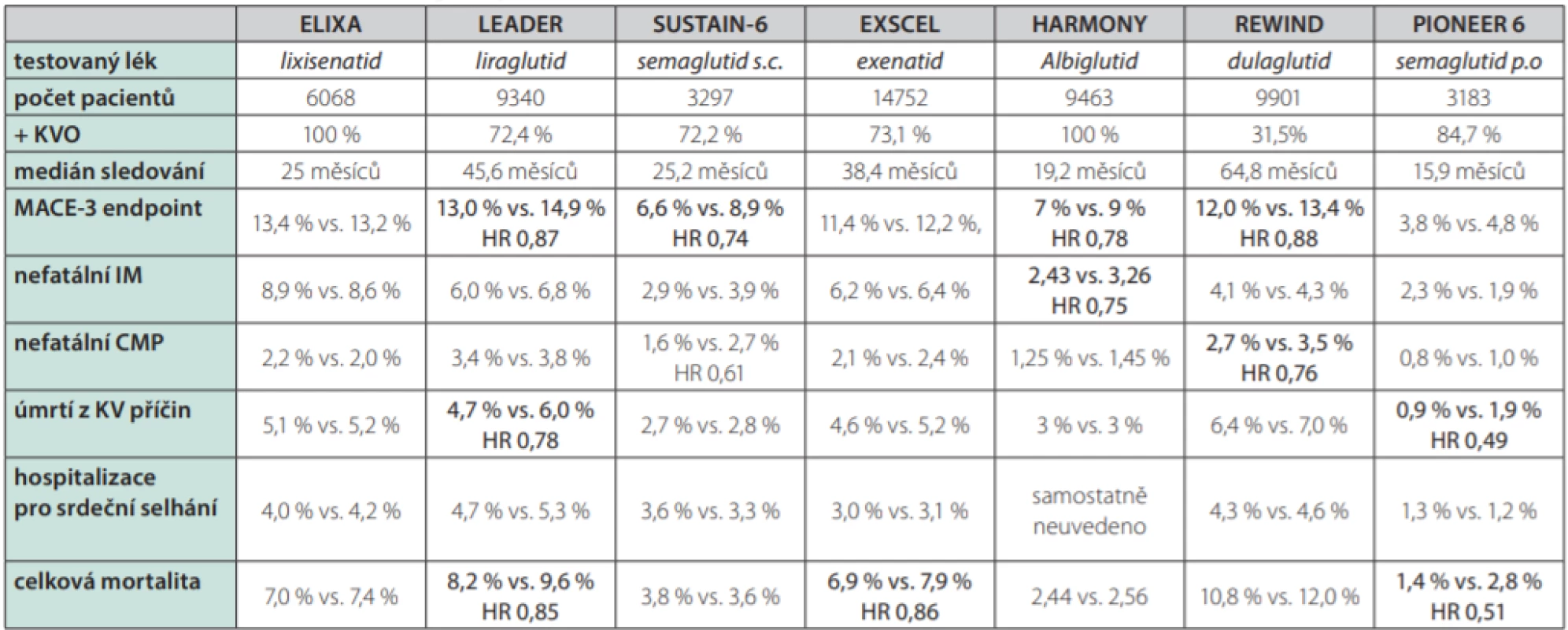
+ KVO – podíl nemocných s prokázaným kardiovaskulárním onemocněním, MACE-3 endpoint – výskyt KV úmrtí, nefatálních infarktů myokardu a nefatálních cévních mozkových příhod, IM – infarkt myokardu, CMP – cévní mozková příhoda.
Tučně jsou (spolu s HR – hazard ratio) zvýrazněny výsledky, kdy byly rozdíly v četnosti příhod mezi skupinou s testovaným lékem a placebem statisticky významné v případě studie, respektive horní limit 95 % intervalu spolehlivosti (CI) byl nižší než 1 (studie PIONEER 6)Je třeba zdůraznit, že šlo (s výjimkou studie REWIND) o studie primárně designované jako non‑inferioritní – tedy s cílem prokázat dle požadavku regulačních agentur, že kardiovaskulární bezpečnost podávaného GLP-1 agonisty je srovnatelná s placebem. Všechny studie byly dvojitě slepé a randomizované a účinná látka nebo placebo byly přidávány ke stávající antidiabetické léčbě. Cílem bylo dosažení optimální kompenzace diabetu u všech pacientů tak, aby se konečné hodnoty HbA1c mezi aktivní a placebovou skupinou významněji nelišily.
Studie ELIXA s lixisenatidem a studie EXCEL s exenatidem podávaným 1× týdně neprokázaly signifikantní vliv těchto látek na kombinovaný kardiovaskulární cíl (smrt z kardiovaskulárních příčin, nefatální infarkt myokardu, nefatální cévní mozkové příhody). V případě studie EXCEL však došlo ke snížení celkové mortality.
Ve studiích LEADER s liraglutidem, SUSTAIN 6 se subkutánně podávaným semaglutidem (Obr. 2.), i HARMONY s albiglutidem a REWIND s dulaglutidem (Obr. 3.) došlo k významnému poklesu kombinovaného kardiovaskulárního cíle. Ve studii PIONEER 6 srovnávající orální semaglutid s placebem byl vliv na kardiovaskulární komplikace numericky vyšší pro semaglutid a byla potvrzena non‑inferiorita, avšak nikoliv superiorita vůči placebu.
Obr. 2. Primární kardiovaskulární endpoint (smrt z KV příčin, nefatální infarkt myokardu, nefatální cévní mozkové příhody) ve studii SUSTAIN 6 (s.c. semaglutid vs. placebo) 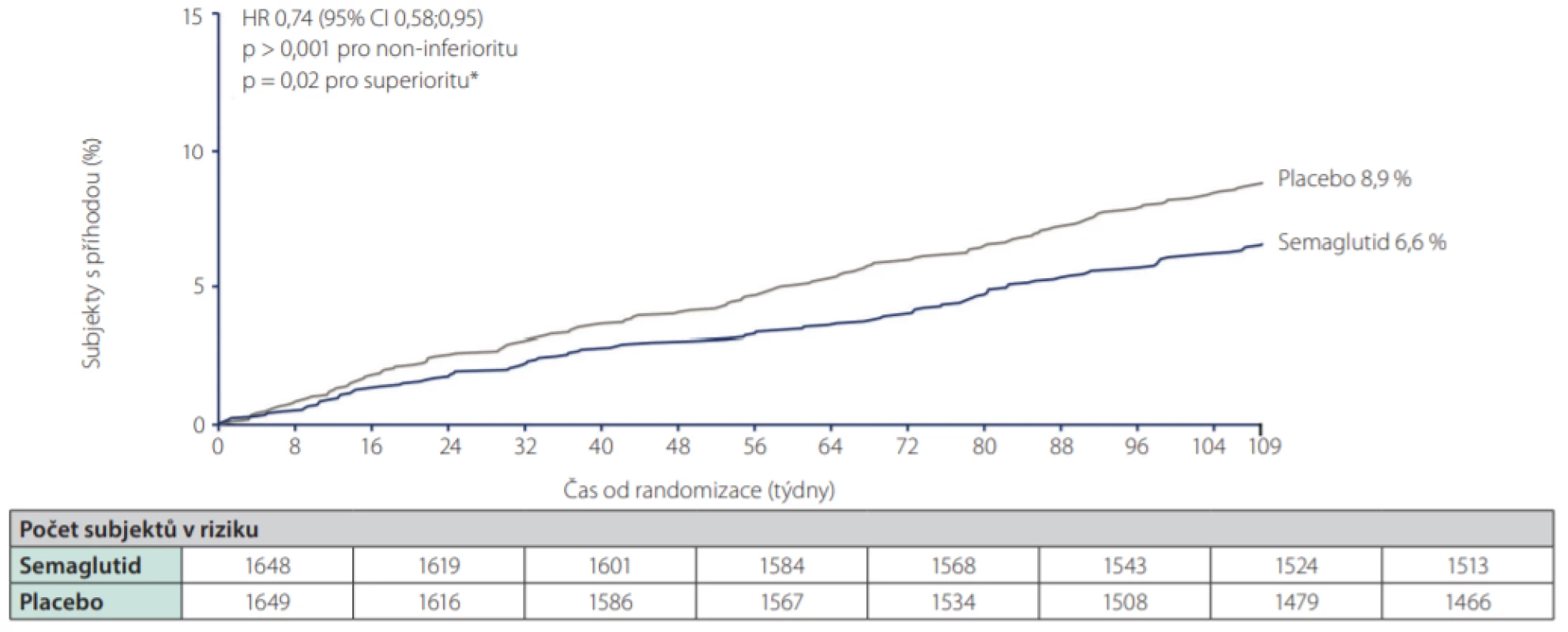
Obr. 3. Primární kardiovaskulární endpoint (smrt z KV příčin, nefatální infarkt myokardu, nefatální cévní mozkové příhody) ve studii REWIND (dulaglutid vs. placebo)
A Composite cardiovascular outcome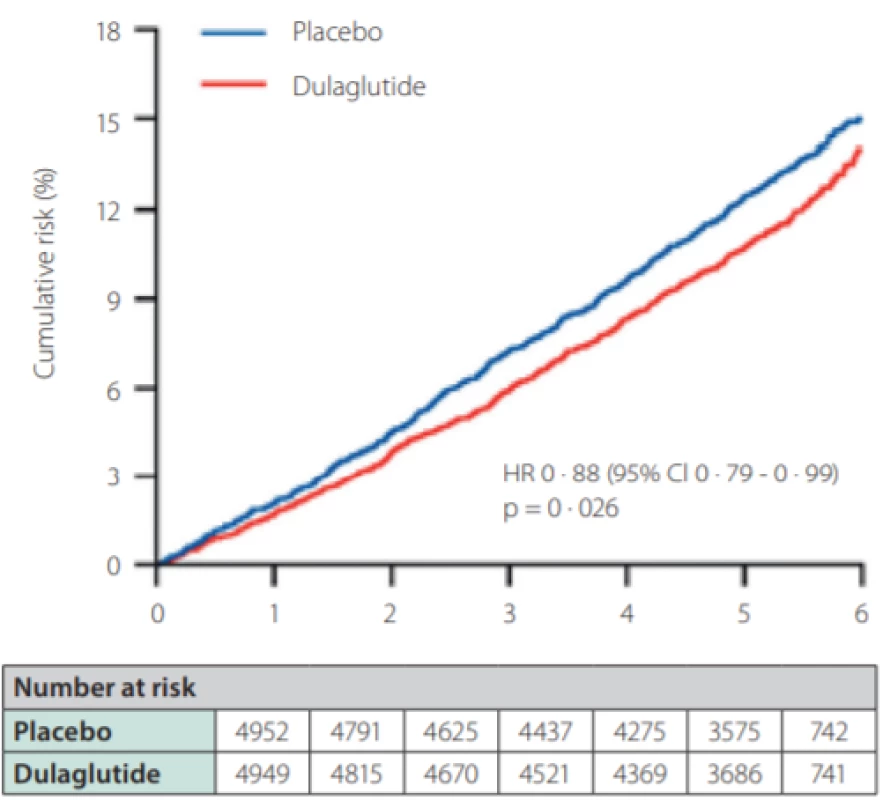
Ve studii LEADER (liraglutid) byla snížena celková i kardiovaskulární mortalita. V ostatních kardiovaskulárních studiích s GLP-1 agonisty nebyla celková ani kardiovaskulární mortalita významně ovlivněna.
Jak inkretinová léčba snižuje kardiovaskulární komplikace a je efekt přítomen jen u některých GLP-1 agonistů?
V uvedených kardiovaskulárních studiích s GLP-1 agonisty nedošlo ke snížení výskytu kardiovaskulárních komplikací v případě lixisenatidu a exenatidu, zatímco u ostatních GLP-1 agonistů byla kardioprotektivita přítomná. Lze tedy říci, že nejde o efekt celé třídy, ale pouze vybraných preparátů. Neutrální vliv podávání gliptinů lze zřejmě do určité míry vysvětlit nižšími dosaženými hladinami GLP-1 a nepřítomností pozitivních vlivů na tělesnou hmotnost, krevní tlak a lipidy.
Přesné vysvětlení rozdílů zodpovědných za různý efekt jednotlivých GLP-1 agonistů na kardiovaskulární komplikace je obtížné. Nabízí se poločas daného preparátu (významně kratší u lixisenatidu než u ostatních), adherence pacientů k léčbě (byla relativně nízká ve studii EXCEL asi z důvodu relativně komplikované aplikace), případně rozdíly ve struktuře jednotlivých GLP-1 agonistů (preparáty s nižší homologií s lidským GLP-1 – exenatid a lixisenatid – kardiovaskulární komplikace neovlivnily) a také určité rozdíly v populacích jednotlivých studií.
Rovněž přesný mechanismus účinku GLP-1 agonistů na snížení kardiovaskulárních komplikací není zcela jasný. Z tvaru a charakteru křivek výskytu kardiovaskulárních komplikací a jejich rozdílů mezi placebovou a léčenou skupinou vyplývá, že efekt nastupuje v řádu roku až několika let podobně jako například ve studiích se statiny. To naznačuje efekt na stabilitu a progresi aterosklerotického plátu, což potvrzují i výsledky řady experimentálních studií. Zda jde opravdu převážně o tento mechanismus nebo o kombinaci s jinými (vliv snížení hmotnosti, zlepšení dyslipidemie, poklesu krevního tlaku či zcela jiné mechanismy), ukáže až čas a výsledky dalších studií.
Z dalších možných mechanismů stojí za zmínku ještě nefroprotektivní efekt většiny GLP-1 agonistů. V řadě studií zejména s liraglutidem, semaglutidem a dulaglutidem bylo prokázáno zpomalení progrese diabetické nefropatie – zejména snížení progrese a nového vzniku albuminurie. Vzhledem k těsné souvislosti diabetické nefropatie a kardiovaskulárních komplikací může i toto snížení v dlouhodobějším horizontu přispívat ke kardioprotektivitě některých GLP-1 agonistů.
Interpretace výsledků kardiovaskulárních studií: co z nich plyne pro klinickou praxi?
K interpretaci výsledků uvedených studií je třeba vycházet z toho, že populace pacientů se v rámci jednotlivých studií dosti významně lišila, což může být zčásti zodpovědné za rozdílné výsledky. Studie se také do značné míry lišily počtem pacientů, délkou trvání a řadou dalších parametrů.
Zatímco do většiny studií byli zařazeni převážně nebo výhradně pacienti s anamnézou prodělané kardiovaskulární příhody, ve studii REWIND (dulaglutid) tvořili více než 68 % populace nemocní v primární prevenci. Tato populace byla naopak minoritní ve studii LEADER (liraglutid), SUSTAIN 6 (semaglutid s.c.), EXSCEL (exenatid 1× týdně) i PIONEER 6 (semaglutid p.o.). Studie HARMONY (albiglutid) a ELIXA zahrnovaly pouze pacienty v sekundární prevenci.
Z GLP-1 agonistů, které jsou k dispozici v České republice, tak máme pro liraglutid k dispozici důkazy o snížení výskytu kardiovaskulárních komplikací i kardiovaskulární a celkové mortality a pro subkutánně podávaný semaglutid a dulaglutid důkazy o snížení kardiovaskulárních komplikací (kompozit smrti z kardiovaskulárních příčin, nefatálních cévních mozkových příhod a nefatálního infarktu myokardu). Aktualizovaná doporučení Americké diabetologické asociace/Evropské asociace pro studium diabetu doporučují nasazení GLP-1 agonistů jako léků druhé volby k metforminu u diabetiků 2. typu s přítomností kardiovaskulárních komplikací (stav po infarktu myokardu, cévní mozkové příhodě atd.) i u nemocných s vysokým kardiovaskulárním rizikem, kde jsou díky studii REWIND důkazy o snížení kardiovaskulárních komplikací při podávání dulaglutidu i u nemocných v primární prevenci.
V případě liraglutidu i semaglutidu měla většina pacientů při zařazení do studie již anamnézu kardiovaskulární příhody, a výsledky lze tedy aplikovat především na pacienty v sekundární prevenci. Naopak v případě dulaglutidu byla většina populace ještě bez anamnézy kardiovaskulární příhody a pacienti tak odpovídali spíše populaci v primární prevenci. Lze předpokládat, že by působení všech tří GLP-1 agonistů mohlo být u obou populací (v primární i v sekundární prevenci) podobné, avšak jasná data z klinických studií pro tyto závěry zatím nemáme.
Zatímco GLP-1 agonisté se postupně propracovávají do čela algoritmu léčby diabetu 2. typu, gliptiny jsou vnímány jako spolehlivé léky s minimem nežádoucích účinků, ale bez přidané hodnoty nefro-či kardioprotektivity. Mohou se dobře uplatnit jako jednoduchá léčebná volba u nemocných, kde se chceme vyhnout nežádoucím účinkům a příliš komplikovanému léčebnému schématu. Jako velmi výhodné se jeví u nemocných bez komplikací v časných stadiích diabetu (zde bylo ve studii VERIFY v případě časného nasazení vildagliptinu prokázáno i zpomalení progrese diabetu oproti monoterapii metforminem (42) a také u starších pacientů a nemocných s poruchou renální či jaterní funkce.
Podpořeno MZ ČR – RVO („Institut klinické a experimentální medicíny – IKEM, IČ 00023001“) a RVO VFN 64165.
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Martin Haluzík, DrSc,
Centrum diabetologie IKEM ,
Vídeňská 1958/9,
140 21 Praha 4
Cit. zkr: Vnitř Lék 2020; 66(2): 74–80
Článek přijat redakcí: 16. 2. 2020
Článek přijat k publikaci: 20. 2. 2020
Zdroje
1. O‘Rahilly S. Science, medicine, and the future. Non‑insulin dependent diabetes mellitus: the gathering storm. Bmj. 1997; 314(7085): 955–959.
2. Bluher M. Adipose tissue dysfunction contributes to obesity related metabolic diseases. Best Pract Res Clin Endocrinol Metab. 2013; 27(2): 163–177.
3. Reaven G, Abbasi F, McLaughlin T. Obesity, insulin resistance, and cardiovascular disease. Recent Prog Horm Res. 2004; 59 : 207–223.
4. Haffner SM, Lehto S, Ronnemaa T, Pyorala K, Laakso M. Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction. N Engl J Med. 1998; 339(4): 229–234.
5. Chatterjee S, Khunti K, Davies MJ. Type 2 diabetes. Lancet. 2017.
6. Johnston SS, Conner C, Aagren M, Smith DM, Bouchard J, Brett J. Evidence linking hypoglycemic events to an increased risk of acute cardiovascular events in patients with type 2 diabetes. Diabetes Care. 2011; 34(5): 1164–1170.
7. Nauck MA. Glucagon‑like peptide 1 (GLP-1) in the treatment of diabetes. Horm Metab Res. 2004; 36(11–12): 852–858.
8. Davies MJ, D‘Alessio DA, Fradkin J, et al. Management of Hyperglycemia in Type 2 Diabetes, 2018. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2018; 41(12): 2669–2701.
9. Holman RR, Paul SK, Bethel MA, Matthews DR, Neil HA. 10-year follow‑up of intensive glucose control in type 2 diabetes. N Engl J Med. 2008; 359(15): 1577–1589.
10. Duckworth W, Abraira C, Moritz T, et al. Glucose control and vascular complications in veterans with type 2 diabetes. N Engl J Med. 2009; 360(2): 129–139.
11. Skyler JS, Bergenstal R, Bonow RO, et al. Intensive glycemic control and the prevention of cardiovascular events: implications of the ACCORD, ADVANCE, and VA Diabetes Trials: a position statement of the American Diabetes Association and a Scientific Statement of the American College of Cardiology Foundation and the American Heart Association. J Am Coll Cardiol. 2009; 53(3): 298–304.
12. Patel A, MacMahon S, Chalmers J, et al. Intensive blood glucose control and vascu ‑ lar outcomes in patients with type 2 diabetes. N Engl J Med. 2008; 358(24): 2560–2572.
13. Gerstein HC, Miller ME, Byington RP, et al. Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med. 2008; 358(24): 2545–2559.
14. Nissen SE, Wolski K. Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes. N Engl J Med. 2007; 356(24): 2457–2471.
15. Buse JB, Wexler DJ, Tsapas A, et al. 2019 Update to: Management of Hyperglycemia in Type 2 Diabetes, 2018. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2020; 43(2): 487–493.
16. Holst JJ, Deacon CF, Vilsboll T, Krarup T, Madsbad S. Glucagon‑like peptide-1, glucose homeostasis and diabetes. Trends Mol Med. 2008; 14(4): 161–168.
17. Holst JJ, Gromada J. Role of incretin hormones in the regulation of insulin secretion in diabetic and nondiabetic humans. Am J Physiol Endocrinol Metab. 2004; 287(2): E199–206.
18. Holst JJ, Deacon CF. Inhibition of the activity of dipeptidyl‑peptidase IV as a treatment for type 2 diabetes. Diabetes. 1998; 47(11): 1663–1670.
19. Scheen AJ. Safety of dipeptidyl peptidase-4 inhibitors for treating type 2 diabetes. Expert Opin Drug Saf. 2015; 14(4): 505–524.
20. Strain WD, Lukashevich V, Kothny W, Hoellinger MJ, Paldanius PM. Individualised treatment targets for elderly patients with type 2 diabetes using vildagliptin add‑on or lone therapy (INTERVAL): a 24 week, randomised, double‑blind, placebo‑controlled study. Lancet. 2013;382(9890): 409–416.
21. Mundra V. Evaluation of vildagliptin and fixed dose combination of vildagliptin and metformin on glycemic control and insulin dose over three months in patients with type 2 diabetes mellitus‘. Indian J Endocrinol Metab. 2012; 16(6): 1048.
22. Madsbad S. Exenatide and liraglutide: different approaches to develop GLP-1 recep ‑ tor agonists (incretin mimetics) – preclinical and clinical results. Best Pract Res Clin Endocrinol Metab. 2009; 23(4): 463–477.
23. Madsbad S, Kielgast U, Asmar M, Deacon C, Torekov SS, Holst JJ. An overview of once‑weekly GLP-1 receptor agonists – available efficacy and safety data and perspectives for the future. Diabetes Obes Metab. 2011.
24. Kuritzky L, Umpierrez G, Ekoe JM, Mancillas‑Adame L, Lando LF. Safety and efficacy of dulaglutide, a once weekly GLP-1 receptor agonist, for the management of type 2 diabetes. Postgrad Med. 2014; 126(6): 60–72.
25. Montanya E, Sesti G. A review of efficacy and safety data regarding the use of liraglu ‑ tide, a once‑daily human glucagon‑like peptide 1 analogue, in the treatment of type 2 diabetes mellitus. Clin Ther. 2009; 31(11): 2472–2488.
26. Pyke C, Heller RS, Kirk RK, et al. GLP-1 receptor localization in monkey and human tissue: novel distribution revealed with extensively validated monoclonal antibody. Endocrinology. 2014; 155(4): 1280–1290.
27. Aaboe K, Krarup T, Madsbad S, Holst JJ. GLP-1: physiological effects and potential the ‑ rapeutic applications. Diabetes Obes Metab. 2008; 10(11): 994–1003.
28. Arakawa M, Mita T, Azuma K, et al. Inhibition of monocyte adhesion to endothelial cells and attenuation of atherosclerotic lesion by a glucagon‑like peptide-1 receptor agonist, exendin-4. Diabetes. 2010; 59(4): 1030–1037.
29. Scirica BM, Bhatt DL, Braunwald E, et al. Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus. N Engl J Med. 2013; 369(14): 1317–1326.
30. Green JB, Bethel MA, Armstrong PW, et al. Effect of Sitagliptin on Cardiovascular Out ‑ comes in Type 2 Diabetes. N Engl J Med. 2015; 373(3): 232–242.
31. White WB, Cannon CP, Heller SR, et al. Alogliptin after acute coronary syndrome in pa ‑ tients with type 2 diabetes. N Engl J Med. 2013; 369(14): 1327–1335.
32. Rosenstock J, Perkovic V, Johansen OE, et al. Effect of Linagliptin vs Placebo on Major Cardiovascular Events in Adults With Type 2 Diabetes and High Cardiovascular and Renal Risk: The CARMELINA Randomized Clinical Trial. JAMA. 2019; 321(1): 69–79.
33. Tella SH, Rendell MS. DPP-4 inhibitors: focus on safety. Expert Opin Drug Saf. 2015; 14(1): 127–140.
34. Cosentino F, Grant PJ, Aboyans V, et al. 2019 ESC Guidelines on diabetes, pre‑diabetes, and cardiovascular diseases developed in collaboration with the EASD. Eur Heart J. 2020; 41(2): 255–323.
35. Pfeffer MA, Claggett B, Diaz R, et al. Lixisenatide in Patients with Type 2 Diabetes and Acute Coronary Syndrome. N Engl J Med. 2015; 373(23): 2247–2257.
36. Marso SP, Daniels GH, Brown‑Frandsen K, et al. Liraglutide and Cardiovascular Outco ‑ mes in Type 2 Diabetes. N Engl J Med. 2016; 375(4): 311–322.
37. Holman RR, Bethel MA, Mentz RJ, et al. Effects of Once‑Weekly Exenatide on Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2017; 377(13): 1228–1239.
38. Marso SP, Bain SC, Consoli A, et al. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med. 2016; 375(19): 1834–1844.
39. Gerstein HC, Colhoun HM, Dagenais GR, et al. Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double‑blind, randomised placebo‑controlled trial. Lancet. 2019; 394(10193): 121–130.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2020 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Stárnutí cév a vaskulární paměť
- Co přináší internistům nové doporučení ESC – diabetes?
- Celiakie dospělých
- RECENZE KNIHY ÚVOD DO VNITŘNÍHO LÉKAŘSTVÍ – doc. MUDr. Jitka Mlíková Seidlerová, Ph.D., a kol.
- Pioglitazon
- Diferenciální diagnostika hypoglykemie
- Epidemiologie infekcí vyvolaných Clostridium difficile (CDI) v České republice
- Extraintestinální projevy celiakie
- Klinické aspekty depozice tuku v epikardu
- Adipocytokíny a tyreopatie
- Thymom – možnosti diagnostiky
- Aktuality v léčbě a prevenci klostridiové kolitidy
- Hypoxemie/hypoxie a nové koncepty oxygenoterapie v intenzivní péči
- Diabetes a kardiovaskulární onemocnění
- Relation between testosterone levels and body composition, physical functioning and selected biochemical parameters in adult males
- Inkretinová léčba diabetu a kardiovaskulární komplikace
- SGLT-2 inhibitory a jejich postavení v současné medicíně
- Cushingov syndróm a akromegália na podklade pikoadenómu hypofýzy
- Vrozený deficit C2 složky komplementu – variabilní klinická manifestace (kazuistiky a přehled problematiky)
- Obezita a kardiovaskulární onemocnění
- Diabetická noha
- Diosmin/hesperidin – spolupracující tandem nebo je diosmin klíčový a hesperidin jen neúčinnou příměsí?
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Diferenciální diagnostika hypoglykemie
- Hypoxemie/hypoxie a nové koncepty oxygenoterapie v intenzivní péči
- Thymom – možnosti diagnostiky
- Diosmin/hesperidin – spolupracující tandem nebo je diosmin klíčový a hesperidin jen neúčinnou příměsí?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



