-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Infekce v rámci syndromu diabetické nohy
Diabetic foot infections
Diabetic foot infections (DFIs) are serious problems in persons with diabetes, about 10 to 25 % of patients with diabetes develop a foot ulcer and 60 % of them are infected. DFIs cause morbidity, limit mobility, worsen patients’ quality of life. Infections are classified as mild, moderate, or severe. Most DFIs are polymicrobial, with Gram-positive cocci (especially staphylococci), Gram-negative bacilli and obligate anaerobes. Successful therapy of DFI requires proper topical care and often includes surgical interventions but appropriate antibiotic treatment plays a key role. Initial antimicrobial therapy of these infections is usually empirical, the antibiotic regimen should be based on the severity of the infection. Definitive therapy should then be tailored according to the results of culture and susceptibility tests from a reliably obtained specimen.
Keywords:
culture findings – diabetic foot infections – empirical antibiotic therapy – osteomyelitis
Autoři: Lenka Ryšková
Působiště autorů: Ústav klinické mikrobiologie LF UK a FN Hradec Králové, přednostka doc. MUDr. Helena Žemličková, Ph. D.
Vyšlo v časopise: Vnitř Lék 2015; 61(6): 587-591
Kategorie: Diabetik – společný pacient diabetologa a ortopeda
Předneseno na mezioborovém sympoziu s postgraduálním zaměřením „Diabetik – společný pacient diabetologa a ortopeda“ 10. října 2014 v Hradci Králové.
Souhrn
Syndrom diabetické nohy je závažnou komplikací u pacientů s diabetes mellitus, ulcerace postihují 10–25 % diabetiků, infikováno je kolem 60 % ulcerací. Infekční komplikace jsou spojeny s nutností hospitalizace, s omezením hybnosti a se zhoršením kvality života. Infekční postižení se podle závažnosti rozlišuje na mírné, středně závažné a závažné. Ve většině případů se jedná o infekci polymikrobiální, s účastí grampozitivních koků (především stafylokoků), aerobních gramnegativních tyčinek a anaerobních mikroorganizmů. Terapie infekce musí být vždy komplexní, zahrnuje úpravu celkového stavu pacienta včetně lokální péče, často s chirurgickým ošetřením. Antibiotická terapie je významnou součástí celkové léčby. Iniciální antibiotická terapie je volena empiricky, volba se uskutečňuje především dle tíže onemocnění. Se znalostí kultivačních nálezů se antibiotická terapie upravuje na cílenou.
Klíčová slova:
empirická antibiotická terapie – infekce v terénu diabetické nohy – kultivační nálezy – osteomyelitidaÚvod
Syndrom diabetické nohy je závažnou komplikací u pacientů s diabetes mellitus. Ulcerace nebo destrukce tkání na podkladě diabetické neuropatie, angiopatie, s různým stupněm ischemie dolních končetin postihují v průběhu jejich života 10–25 % diabetiků [1]. Infekce v terénu ulcerací diabetické nohy jsou častou komplikací, uvádí se, že infikováno je kolem 60 % ulcerací. V 20–66 % jde o hlubokou infekci postihující kost [2]. Infekční komplikace jsou nejčastější příčinou obtížného hojení defektů, hospitalizace diabetiků a amputací (tvoří asi dvě třetiny všech amputací). Jsou spojeny s omezením hybnosti a zhoršením kvality života, v polovině případů může infekce do 3 let recidivovat [3]. Význam onemocnění stoupá se zvyšujícím se počtem diabetiků a prodlužujícím se průměrným věkem.
Postižení v rámci syndromu diabetické nohy se může lišit svou závažností, ta se odvíjí od míry postižení kůže, hlubokých struktur měkkých tkání, případně kosti. Prvním krokem je vznik povrchového defektu, který se začíná kolonizovat bakteriemi. V další fázi pak lokální ischemie a zhoršený stav imunity nedokáže zabránit množení pronikajících bakterií a rozvoji infekce. V méně závažných případech se jedná o infekci povrchovou, postihující kůži a podkoží. Těžší formou je infekce hlubokých měkkých tkání, případně i kosti. Nejzávažnější je infekce provázená celkovými příznaky [4].
Existuje několik možných klasifikací závažnosti postižení, např. dle Wagnera, IDSA (Infectious Diseases Society of America), SINBAD, PEDIS [5]. Klasifikace obtíží je důležitá pro správné zhodnocení aktuálního stavu pacienta. Klasifikace IDSA (tab. 1) je založena na posouzení hloubky ulcerace a přítomnosti infekce [5], predikuje nutnost hospitalizace a amputace postižené končetiny [6].
Tab. 1. Klasifikace IDSA pro posouzení tíže obtíží při syndromu diabetické nohy 
Etiologická agens
V převážné většině případů se jedná o infekci smíšenou s účastí aerobních i anaerobních mikroorganizmů [7]. Nejdůležitějším a nejčastěji izolovaným agens je Staphylococcus aureus, který je častou součástí polymikrobiálního nálezu, ale může onemocnění vyvolat i sám (uvádí se, že u infektů vyvolaných jediným agens je Staphylococcus aureus izolován v 70 %). Dále jsou často izolovány i další grampozitivní bakterie, především se jedná o streptokoky – Streptococcus pyogenes (betahemolytický streptokok skupiny A), Streptococcus agalactiae (betahemolytický streptokok skupiny B) a betahemolytické streptokoky skupin C a G. Enterokoky bývají izolovány spíše z chronických nebo recidivujících defektů pacientů již léčených antibiotiky, běžně se nachází u pacientů léčených cefalosporiny. Anaerobní bakterie (nejčastěji anaerobní grampozitivní koky – peptokoky, peptostreptokoky, dále Prevotella sp., Bacteroides sp., méně často pak Fusobacterium sp. a Clostridium sp.) jsou často izolovány z hlubokých nekrotických defektů, četnost jejich záchytu je závislá na optimální technice odběru, transportu a laboratorním zpracování vzorku. Aerobní gramnegativní tyčinky, především zástupci čeledi Enterobacteriaceae (Escherichia coli, Klebsiella pneumoniae, Enterobacter sp., Proteus sp.) jsou stejně jako enterokoky často patogeny chronických nebo již léčených defektů. Pseudomonas aeruginosa, zástupce nefermentujících tyčinek, bývá také spíše izolována od pacientů s chronickými defekty. Mnohdy se však jedná o pouhou kolonizaci defektu tímto mikrobem běžně se vyskytujícím ve vnějším prostředí než o infekci, a proto posouzení etiologické účasti Pseudomonas aeruginosa musí být uvážlivé.
Staphylococcus aureus a streptokoky jsou často izolovány jako původci akutních infekcí u pacientů dosud neléčených antibiotiky [5], naopak infekce chronických defektů bývá polymikrobiální, obsahující 3–5 bakteriálních druhů včetně anaerobních [8]. Faktory virulence (hemolyziny, proteázy, kolagenázy apod) produkované touto směsí mikrobů negativně ovlivňují hojení ran a přispívají k chronicitě infekce. V chronických defektech také může dojít k tvorbě biofilmu, který zvyšuje rezistenci bakterií k antibiotikům [9].
Vzorky ke kultivaci a laboratorní zpracování
Odběr vzorku ke kultivačnímu vyšetření by měl být za ideálních podmínek proveden u všech pacientů s podezřením na infekci ulcerace v terénu diabetické nohy (zarudnutí, otok, proteplení, bolest, purulentní sekrece, ulcerace starší než 30 dní) a samozřejmě před zahájením terapie antibiotiky. Výtěžnost kultivačního vyšetření je závislá na odběru adekvátních vzorků, rychlém transportu a správné laboratorní technice vhodné k záchytu aerobních i anaerobních bakterií.
U povrchových infekcí lze za adekvátní považovat stěr z ložiska provedený po ošetření povrchu s odstraněním nekrotické tkáně. U hlubších lézí se za vhodný vzorek považuje tkáň odebraná z hloubky infikovaného defektu [5,10]. Tkáňový vzorek je možné získat excizí při chirurgickém ošetření nebo perkutánní biopsií kosti. Takto se nejlépe předejde kontaminaci povrchovou kolonizující mikroflórou (koagulázanegativní stafylokoky, korynebakteria, gramnegativní tyčinky), jejíž nález může být zavádějící při rozhodování o volbě vhodných antibiotik. Riziko kontaminace je větší při odběru vzorku z povrchu defektu.
Míra shody kultivačních nálezů ze vzorků kosti biopsie v porovnání s kultivačními nálezy ve stěrech z povrchu defektu byla opakovaně studována, v závislosti na designu jednotlivých studií se pohybovala v širokém rozmezí 30–65 %. Průměrně se uvádí, že shoda je menší než 50 % [11–13]. Hodnoceny byly také kultivační nálezy vzorků získané aspirací hluboké tkáně přilehlé ke kosti tenkou jehlou. Bylo zjištěno, že vzorek odebraný tenkou jehlou může být kultivačně falešně negativní (pravděpodobně v důsledku menšího objemu vyšetřované tkáně, je nutné odebrat více vzorků), ale celkově je korelace s výsledky kultivace kostní biopsie lepší než u stěrů z povrchu [14]. Biopsie kosti se zdá být nezbytná při nejasnostech ohledně přítomnosti osteomyelitidy a při selhání empirické terapie.
Tkáňový vzorek se po odběru vkládá do sterilního kontejneru a transportuje se do lokální mikrobiologické laboratoře, ke zpracování vzorku by mělo dojít nejlépe do 2 hodin od odběru. Základem vyšetřovacího protokolu je kultivační vyšetření, vzorek se inokuluje na sadu kultivačních médií zajišťujících záchyt aerobních i anaerobních mikroorganizmů [15]. Používá se krevní agar, modifikovaný čokoládový agar pro záchyt růstově náročných mikroorganizmů, MacConkeyův agar, Schaedlerův agar pro záchyt anaerobních mikroorganizmů, Sabouraudův agar pro záchyt kvasinek, játrový bujón. Kultivační média jsou následně inkubována při 37 °C v aerobním i anaerobním prostředí po dobu obvykle 2 dnů. Součástí vyšetření bývá i provedení mikroskopického vyšetření dle Grama. Izolovaná agens jsou pak identifikována a je stanovena jejich citlivost k antibiotikům – metodou kvalitativní (diskový difuzní test) nebo kvantitativní (stanovení minimálních inhibičních koncentrací). PCR vyšetření není rutinní součástí vyšetření, současné prakticky dostupné molekulárně biologické metody nejsou v případě polymikrobiální infekce efektivní, ale mohlo by se uvažovat o průkazu bakteriální DNA metodou PCR (při použití primerů z oblasti 16SrRNA, která je společná všem bakteriím) a její následné sekvenční analýze u kultivačně negativních vzorků odebraných u pacientů léčených antibiotiky.
Léčba infekce v terénu diabetické nohy
Terapie infekce v terénu diabetické nohy musí být vždy komplexní a dlouhodobá, zahrnuje celkovou léčbu zaměřenou na kompenzaci diabetu a vazodilatační léčbu. Důležité jsou chirurgické zákroky (nekrektomie, amputace, revaskularizace) a lokální ošetřování chronického defektu. Pravděpodobnost úspěšné terapie pacientů je větší při včasné diagnostice a úpravě faktorů, které vedly k rozvoji ulcerace [5]. Důležité, ale i obtížné, je stanovit rozsah infekce. Hlubší defekty bývají provázeny osteomyelitidou, která je RTG prokazatelná až s odstupem několika týdnů, a přitom s postižením kosti se mění přístup k léčbě (volba antibiotik, chirurgické řešení).
Antibiotická terapie je v indikovaných případech významnou součástí celkové léčby. Bylo zjištěno, že pacienti léčení antibiotiky dle kultivace kosti dosáhli signifikantně lepších výsledků než pacienti léčení bez kultivačního podkladu. V retrospektivní studii Sennevilla [16] bylo sledováno 50 pacientů z 9 diabetických center léčených konzervativně pro osteomyelitidu v terénu diabetické nohy (průměrná délka podání antibiotik 11,5 ± 4,21 týdne), výsledek terapie byl hodnocen za rok po jejím ukončení. 22 pacientů bylo léčeno dle výsledků kultivačního vyšetření kostní biopsie a dosáhlo remise v 81,8 %, 28 pacientů bylo léčeno na podkladě kultivačního vyšetření stěrů a remise bylo dosaženo v 50 %.
Podání antibiotik není indikováno u kolonizovaných defektů bez známek infektu. V klinických studiích nebylo prokázáno, že by podání antibiotik zlepšilo hojení kolonizovaných, ale neinfikovaných defektů [17,18]. Naopak, neodůvodněné podání antibiotik (podpořené nálezem potenciálních patogenů při kultivačním vyšetření z kolonizovaného, ale neinfikovaného defektu) může vést k selekci multirezistentních bakterií [19].
Empirická antibiotická terapie
V úvodu onemocnění se antibiotika volí empiricky. Výběr antibiotik je ovlivněn tíží onemocnění, znalostí předchozích kultivačních nálezů, informací o již prodělané antibiotické terapii [20]. Rozhoduje se o způsobu podání antibiotika (perorální, parenterální), dle předpokládaných patogenů se volí spektrum antibiotika [5,7]. Musí se také vzít v úvahu možné alergie, renální dysfunkce apod.
Mírně probíhající onemocnění je možné léčit perorálními antibiotiky vybranými tak, aby působila proti očekávaným stafylokokům a streptokokům. Je možné zvolit např. amoxicilin klavulanát v dávce 1 g po 8 hod nebo klindamycin 300 mg po 6–8 hod.
Středně těžká infekce postihující hlubší struktury a povrchové infekce u pacientů s chronickým defektem už léčených antibiotiky (skupina pacientů, u kterých mohou být vyselektovány enterokoky, gramnegativní bakterie, u hlubších defektů anaeroby) vyžaduje parenterální antibiotikum s širším spektrem (s aktivitou vůči gramnegativním tyčinkám i anaerobním bakteriím) ve vyšší dávce, které dosáhne adekvátní tkáňové koncentrace. Je možné použít ampicilin sulbaktam 3 g po 6 hod i.v. nebo piperacilin tazobaktam v dávce 4,5 g po 6 hod i.v. Alternativní volbou je kombinace ciprofloxacinu (400–600 mg po 12 hod i.v. nebo 500–750 mg po 12 hod perorálně) s klindamycinem (600 mg po 6 hod i.v. nebo 300 mg po 6 hod perorálně).
Antibiotika empiricky pokrývající Pseudomonas aeruginosa (ceftazidim, cefepim, piperacilin tazobaktam, imipenem nebo meropenem) se vzhledem k jejímu nízkému patogennímu potenciálu nevolí standardně, často dojde ke klinickému zlepšení i v případech, v nichž byla podána antibiotika s užším spektrem. Podání protipseudomonádových antibiotik se doporučuje u těch pacientů, u nichž už došlo historicky k selhání antibiotické terapie s užším spektrem nebo u pacientů s těžkým průběhem onemocnění [21]. Empirické nasazení antibiotik účinných vůči MRSA (methicilin rezistentní Staphylococcus aureus) se také neprovádí standardně, doporučuje se u pacientů se známou infekcí nebo kolonizací defektu.
U pacientů s těžkým průběhem onemocnění a celkovými příznaky se podává parenterální terapie širokospektrými betalaktamovými antibiotiky s účinkem na anaeroby, např. meropenem 2 g po 8 hod nebo piperacilin tazobaktam 4,5 g po 6 hod. V úvodní fázi onemocnění je vhodné kombinovat je s aminoglykosidem (gentamicin 3–5 mg/kg/den, amikacin 15 mg/kg/den i.v.).
Cílená antibiotická terapie
Po několika dnech, se znalostí výsledků kultivačního vyšetření, by mělo dojít k přehodnocení empiricky podané antibiotické terapie. Může dojít k podání antibiotik s užším spektrem, nebo také k rozšíření spektra při záchytu rezistentních patogenů a špatné klinické odpovědi na empirickou terapii.
Výběr antibiotika a způsob jeho podání je stejně jako při empirické volbě ovlivněn tíží postižení a požadavkem na dosažení terapeutické koncentrace v cílové infikované tkáni. Příklady možných antibiotických režimů dle vykultivovaného agens jsou uvedeny v tab. 2 [7,20–22]. Důležité je diagnostikovat osteomyelitidu, která může být přítomna až u 66 % pacientů s hlubokou diabetickou ulcerací a nejvíce ovlivňuje výběr antibiotik díky omezenému průniku do kostní tkáně většiny z nich. Samozřejmě průnik do kosti je sám o sobě negativně ovlivněn při ischemickém postižení končetin.
Tab. 2. Antibiotika vhodná k cílené terapii infekcí v terénu diabetické nohy 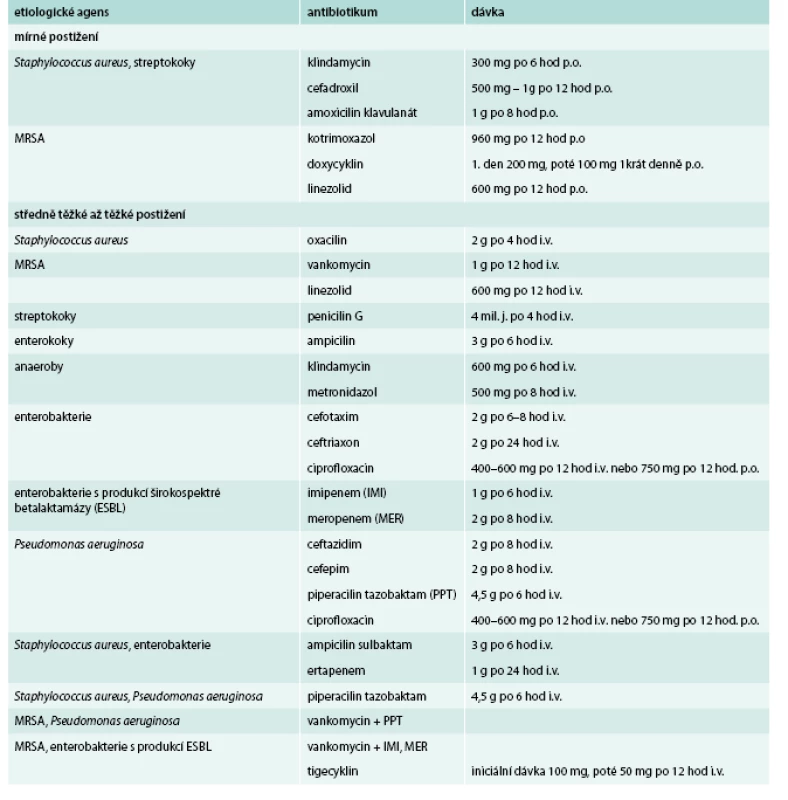
i.v. – intravenózní podání, p.o. – perorální podání K léčbě osteomyelitidy je možné podat především betalaktamová antibiotika (peniciliny, cefalosporiny, karbapenemy). Betalaktamová antibiotika pronikají do kosti pouze v rozmezí od 5 do 20 % sérových koncentrací [22]. Nicméně sérové koncentrace parenterálně podaných betalaktamových antibiotik jsou tak vysoké, že i jejich koncentrace v kosti přesahuje MIC (minimální inhibiční koncentrace) většiny etiologických agens. Sérové koncentrace betalaktamových antibiotik po perorálním podání však dosahují méně než 10 % ve srovnání s parenterálním podáním, a tak adekvátní koncentrace v kosti nedosáhnou. Podobně jako betalaktamová antibiotika i vankomycin penetruje do kosti špatně, nicméně při hladině > 35 µg/ml dosáhne cílové koncentrace.
Některá antibiotika mají dobrou biologickou dostupnost, po perorálním podání mohou dosáhnout v kosti koncentrace, která převyšuje MIC vyvolávajících agens, konkrétně se jedná o fluorochinolony, klindamycin, metronidazol, kotrimoxazol (7–10 mg/kg trimetoprimu). Linezolid, relativně nové antibiotikum, má dobrou biologickou dostupnost po perorálním podání, dobře proniká do kosti, působí efektivně i vůči MRSA. Flurochinolony by měly být užívány cíleně pro snadný vznik rezistence (u stafylokoků a Pseudomonas aeruginosa je známo, že může vzniknout rezistence i v průběhu terapie). Jejich nadužívání v komunitě i v nemocnicích může negativně ovlivnit vzestup rezistence vůči chinolonům u bakteriálních patogenů a mít tak záporný dopad na jejich použitelnost pro léčbu infekcí v terénu diabetické nohy.
Délka podání antibiotik
Doba trvání antibiotické terapie je závislá na tíži probíhajícího onemocnění a rozsahu chirurgického ošetření (débridement, amputace). Délka terapie antibiotiky se obecně pohybuje okolo 1–2 týdnů u mírně probíhajícího infektu, u středně těžce nebo těžce probíhajícího infektu se pak prodlužuje až na 3 týdny (při pomalém ústupu obtíží se může prodloužit až na 4 týdny, ukončuje se v nepřítomnosti známek infekce, nezávisí na zhojení ulcerace). Délka terapie antibiotiky u pacientů s prokázanou osteomyelitidou závisí na radikálnosti chirurgického zákroku, který je většinou součástí terapeutického postupu [5]. Po radikálním odstranění infikované tkáně (amputaci) je dostatečné podávat antibiotika pooperačně nejdéle 2–5 dní. Po výkonu, kdy dojde k ponechání reziduálních infikovaných měkkých tkání, se doporučuje pokračovat v podávání antibiotik ještě 2–4 týdny, při reziduální infekci kosti se navrhuje pokračovat delší dobu, tj. 4–6 týdnů. U pacientů s chronickou osteomyelitidou bez možnosti chirurgické revize je podání antibiotik obvykle dlouhodobé, minimálně by mělo trvat 3 měsíce [23].
Závěr
Infekce v terénu diabetické nohy je závažnou komplikací pacientů s diabetes mellitus, která může vést až k amputaci postižené končetiny, a tak ke snížení kvality života. Současné poznatky však říkají, že pokud se zahájí včas adekvátní antibiotická terapie podložená věrohodnými kultivačními nálezy, pak je šance na její vyléčení vyšší.
MUDr. Lenka Ryšková, Ph.D.
lenka.ryskova@fnhk.cz
Ústav klinické mikrobiologie LF UK a FN Hradec Králové
www.fnhk.cz
Doručeno do redakce 30. 12. 2014
Přijato po recenzi 20. 2. 2015
Zdroje
1. Lavery LA, Armstrong DG, Wunderlich RP et al. Risk factors for foot infections in individuals with diabetes. Diabetes Care 2006; 29(6): 1288–1293.
2. Jeffcoate WJ, Lipsky BA Controversies in diagnosing a managing osteomyelitis of the foot in diabetes. Clin Infect Dis 2004; 39(Suppl 2): S115-S122.
3. Frykberg RG. A summary of guidelines for managing the diabetic foot. Adv Skin Wound Care 2005; 18(4): 209–214.
4. Beneš J. Infekční lékařství. Galén: Praha 2009. ISBN 978–80–7262–644–1.
5. Lipsky BA, Berendt AR, Cornia PB et al. Executive summary: 2012 Infectious Diseases Society of America Clinical Practice Guideline for the Diagnosis and Treatment of Diabetic Foot Infections. Clin Infect Dis 2012; 54(12): 1679–1684.
6. Lavery LA, Armstrong DG, Murdoch DP et al. Validation of the Infectious Diseases Society of America’s diabetic foot infection classification system. Clin Infect Dis 2007; 44(4): 562–565.
7. Jindrák V, Hedlová D, Urbášková P et al. Antibiotická politika a prevence infekcí v nemocnici. Mladá fronta: Praha 2014 : 334–335. ISBN 978–80–204–2815–8.
8. Citron DM, Goldstein EJC, Merriam CV et al. Bacteriology of moderate-to-severe diabetic foot infections and in vitro activity of antimicrobial agents. J Clin Microbiol 2007; 45(9): 2819–2828.
9. Bowler PG, Duerden BI, Armstrong DG. Wound microbiology and associated approaches to wound management. Clin Microbiol Rev 2001; 14(2): 244–269.
10. Akinyoola AL, Adegbehingbe OO, Aboderin AO. Therapeutic decision in chronic osteomyelitis: sinus track culture versus intraoperative bone culture. Arch Orthop Trauma Surg 2009; 129(4): 449–453.
11. Mutluoglu M, Uzun G, Turhan V et al. How reliable are cultures of specimens from superficial swabs compared with those of deep tissue in patients with diabetic foot ulcers? J Diabetes Complications 2012; 26(3): 225–229.
12. Zuluaga AF, Galvis W, Jaimes F et al. Lack of microbiological concordance between bone and non-bone specimens in chronic osteomyelitis: an observational study. BMC Infect Dis 2002; 2 : 8. Dostupné z DOI: <http://doi: 10.1186/1471–2334–2–8>.
13. Malone M, Bowling FL, Gannass et al. Deep wound cultures correlate well with bone biopsy culture in diabetic foot osteomyelitis. Diabetes Metab Res Rev 2013; 29(7): 546–550.
14. Senneville E, Morant H, Descamps D et al. Needle puncture and transcutaneous bone biopsy cultures are inconsistent in patients with diabetes and suspected osteomyelitis of the foot. Clin Infect Dis 2009; 48(7): 888–893.
15. Votava M et al. Lékařská mikrobiologie. Vyšetřovací metody. Neptun: Brno 2010 : 253–254. ISBN 978–80–86850–04–7.
16. Senneville E, Lombart A, Beltrand E et al. Outcome of diabetic foot osteomyelitis treated nonsurgically: a retrospective cohort study. Diabetes Care 2008; 31(4): 637–642.
17. Gardner S. Cultures of diabetic foot ulcers without clinical signs of infection do not predict outcomes. Diabetes Care 2014; 37(10): 2693–2701.
18. Chantelau E, Tanudjaja T, Altenhofer F et al. Antibiotic treatment for uncomplicated neuropathic forefoot ulcers in diabetes: a controlled trial. Diabet Med 1996; 13(2): 156–159.
19. Hartemann-Heurtier A, Robert J, Jacqueminet S et al. Diabetic foot ulcer and multidrug-resistant organisms: risk factors and impact. Diabet Med 2004; 21(7): 710–715.
20. Lazzarini L, Lipsky BA, Mader JT. Antibiotic treatment of osteomyelitis: what have we learned from 30 years of clinical trials? Int J Infect Dis 2005; 9(3): 127–138.
21. Matsuura GT, Barg N. Update on the Antimicrobial Management of Foot Infections in Patients With Diabetes. Clin Diabetes 2013; 31(2): 59–65.
22. Spellberg B, Lipsky BA. Systemic antibiotic therapy for chronic osteomyelitis in adults. Clin Infect Dis 2012; 54(3): 393–407.
23. Lew DP, Waldvogel FA. Osteomyelitis. Lancet 2004; 364(9431): 369–379.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Niekoľko osobných spomienokČlánek Petr Svačina jubilujícíČlánek Perioperační péče a diabetesČlánek Diabetická neuropatieČlánek Diagnostika a terapie dnyČlánek Mezioborové sympozium s postgraduálním zaměřením Diabetik – společný pacient diabetologa a ortopeda
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2015 Číslo 6- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Primář MUDr. Petr Svačina, šéfredaktor časopisu Vnitřní lékařství, sedmdesátiletý
- Niekoľko osobných spomienok
- Sedmdesátníkem? Neuvěřitelné. Zralý věk primáře Petra Svačiny
- Petr Svačina jubilující
- Diagnostika a terapie dny – editorial
- Echinokokové infekce – vzácná postižení jater – editorial
- Pegasus – Tikagrelor v sekundární prevenci u nemocných po infarktu myokardu
- Diagnostika a terapie dny
- Neobvyklý případ cystického postižení jater – alveolární echinokokóza jater
- „Stresová dovolená“ aneb takotsubo kardiomyopatie
- Doporučení České společnosti pro trombózu a hemostázu České lékařské společnosti J. E. Purkyně pro bezpečnou léčbu novými perorálními antikoagulancii (NOAC) – dabigatran etexilátem, apixabanem a rivaroxabanem
- Za profesorem Milošem Štejfou
- Richard Češka, Tomáš Freiberger, Martina Vaclová, Vladimír Bláha, Zuzana Urbanová. Familiární hypercholesterolemie
- Eva Kašáková, Martin Vokurka, Jan Hugo. Výkladový slovník pro zdravotní sestry
- Mezioborové sympozium s postgraduálním zaměřením Diabetik – společný pacient diabetologa a ortopeda
- Zobrazení muskuloskeletálních projevů a komplikací diabetes mellitus
- Pokračující periferní nervové blokády – přínos pro ortopedické pacienty s diabetes mellitus?
- Perioperační péče a diabetes
- Komplikace endoprotéz u diabetiků
- Obezita a ortopedické operace aneb existují mechanické komplikace obezity?
- Akutní a chronická antikoagulační léčba u kloubních náhrad
- Diabetická neuropatie
- Infekce v rámci syndromu diabetické nohy
- Vybrané kožní změny typu necrosis lipoidica a kožní a slizniční mykotické afekce u diabetes mellitus
- Uplatnění kmenových buněk v ortopedii
- Ortopedická operační léčba syndromu diabetické nohy
- Základní principy a úskalí rehabilitace u diabetiků po amputaci
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Diagnostika a terapie dny
- „Stresová dovolená“ aneb takotsubo kardiomyopatie
- Echinokokové infekce – vzácná postižení jater – editorial
- Doporučení České společnosti pro trombózu a hemostázu České lékařské společnosti J. E. Purkyně pro bezpečnou léčbu novými perorálními antikoagulancii (NOAC) – dabigatran etexilátem, apixabanem a rivaroxabanem
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



