-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaIgA nefropatie: co by měl vědět lékař v praxi?
Autoři: MUDr. Vachek Jan; Mha 1,2; MUDr. Oulehle Kateřina; Mba 2; PhDr. MUDr. Zakiyanov Oskar; Ph.D. 1; MUDr. Ciferská Hana; Ph.D. 3; prof. MUDr. Maixnerová Dita; prof. MUDr. Tesař Vladimír, DrSc.; Mba; Fasn 1
Působiště autorů: Klinika nefrologie 1. LF UK a VFN v Praze 1; Interní oddělení a HDS Klatovy 2; Revmatologický ústav a Revmatologická klinika, 1. LF UK, Praha 3
Vyšlo v časopise: Svět praktické medicíny, 5, 2023, č. 1, s. 73-77
Kategorie: Medicína v ČR: přehledový článek
Souhrn
IgA nefropatie (IgAN) je nejčastějším typem glomerulonefritidy v Asii a západním světě. U většiny pacientů má asymptomatický až oligosymptomatický průběh a případný úbytek glomerulární filtrace (GFR) je pomalý, přesto po 20 letech od diagnózy 40 % pacientů vyvine terminální selhání ledvin. Základem léčby je proto optimalizovaná podpůrná péče, tj. opatření, která snižují krevní tlak, snižují proteinurii, minimalizují rizikové faktory životního stylu a jinak pomáhají omezit nespecifické inzulty ledvin. Indikace k imunosupresivní terapii se podstatně zúžily a před zahájením ev. imunosuprese, například při rychle progredující formě onemocnění, by měla být pečlivě posouzena rizika (diabetes, riziko infekce, osteoporóza). Kromě toho se nežádoucí účinky spojené s léčbou kortikosteroidy výrazně zvyšují s poklesem GFR. Jiné typy imunosuprese, snad s výjimkou mykofenolátu u asijských pacientů, u IgA nefropatie nefungují. Z novějších možností terapie je třeba zmínit inovativní enterosolventní formu glukokortikoidů. Preparát s budesonidem se statutem orphan drug se uvolňuje v blízkosti Peyerových plátů v ileu s použitím dvoustupňové technologie. Ta umožňuje, aby účinná látka prošla žaludkem a střevem, aniž by se vstřebala, a uvolňuje se v pulzech až po dosažení ilea. Subanalýza velké renální studie DAPA-CKD, která zahrnovala 270 pacientů s diagnózou IgA nefropatie, poskytla první důkazy o tom, že dapagliflozin může být bezpečným a účinným doplňkem současného standardu péče u IgA nefropatie. Nyní probíhá značné množství klinických studií, které snad v budoucnu umožní cílenější terapii vysoce rizikových pacientů s progresivní IgAN.
IgA nefropatie (IgAN) je celosvětově nejčastější příčinou glomerulonefritidy s geografickou variabilitou výskytu. Jako modelový pacient s IgAN se obvykle uvádí mladý muž z Asie s makrohematurií v souvislosti s infekcí. V asijských zemích tvoří IgA nefropatie přibližně 40 % všech glomerulonefritid. Pro srovnání – v Evropě a Severní Americe je prevalence 10 až 20 % všech glomerulonefritid, oproti tomu v subsaharské Africe je IgA nefropatie raritou. IgA nefropatie se vyskytuje dvakrát častěji u mužů než u žen. Vrchol onemocnění je v mladší dospělosti, takže IgAN není obvykle zachycena screeningovými programy, které se zaměřují na starší populaci.
Podezření na IgA nefropatii je obvykle vysloveno při vyšetření arteriální hypertenze nebo při běžných vyšetřeních (mikrohematurie, event. smíšený močový nález – mikrohematurie s proteinurií). Ještě před několika lety vedl nález mikrohematurie nebo proteinurie u branců při odvodu k iniciaci dalších vyšetření (např. renální biopsie). Důležitou roli v diagnostice IgA nefropatie hrají praktičtí lékaři, kteří často zachytí patologický močový nález jako první – typicky vyšetření odhalí mikrohematurii a zvýšení krevního tlaku.
V případě výskytu hematurie je možné doplnit vyšetření erytrocytů ve fázovém kontrastu (v zástinu), kdy se posuzuje poměr izomorfních a dysmorfních forem a množství akantocytů. Při převaze dysmorfních forem nebo akantocyturii je pravděpodobný glomerulární původ erytrocyturie. Pravděpodobnost glomerulární erytrocyturie zvyšuje také nález mírné až střední proteinurie (0,5 až 2 g/ den). Je-li přítomna izolovaná erytrocyturie (a není-li dostupné vyšetření erytrocyturie ve fázovém kontrastu), je třeba zvažovat i „urologický“ původ (litiáza, tumory ledvin a vývodných cest močových, traumata, záněty). Diferenciální diagnostika mikroskopické hematurie je uvedena v tabulce 1.
Tab. 1. Diferenciální diagnostika mikroskopické hematurie 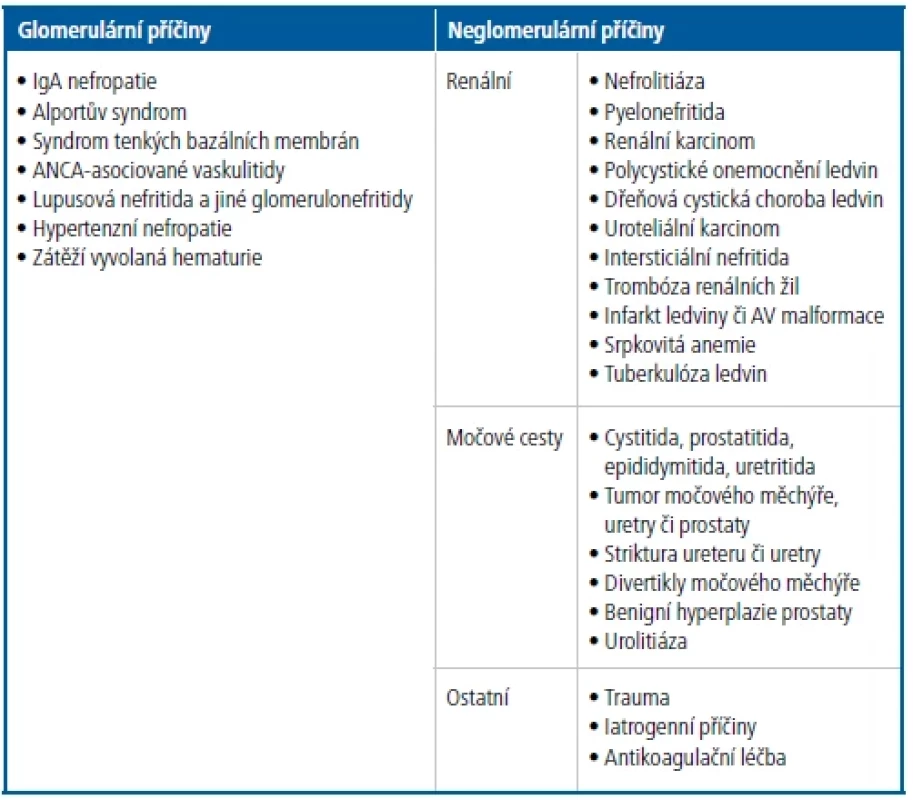
[Upraveno podle: Trach F, Reich O, Cohen C. Jak postupovat při hematurii? Krok za krokem. Svět praktické medicíny 2020;2:19–23.] Dalším příznakem je arteriální hypertenze, která je obvykle přítomna u pokročilejších forem onemocnění. Hypertenzi (a dokonce hypertrofii LK) ale mohou mít i pacienti s IgAN a normální renální funkcí. Funkce ledvin je narušena pouze v pozdějších stadiích onemocnění nebo u rychle progredující formy. Makrohematurie se vyskytuje u 40–50 % pacientů a téměř vždy je spojena s infekcí horních cest dýchacích (současně nebo o několik dní později), je chápána jako příznivý prognostický faktor. S definitivní platností lze diagnózu stanovit pouze histologicky, protože rozhodující je nález depozit IgA v glomerulárním mezangiu.
Klinický obraz a prognóza
Klinický průběh IgA nefropatie je značně heterogenní a sahá od oligosymptomatického klinického obrazu až po rozvoj rychle progredující glomerulonefritidy s nástupem terminálního selhání ledvin. U pacientů, kteří mají pouze mikrohematurii a/nebo minimální proteinurii, ale normální funkci ledvin (asi 70 % pacientů), je průběh obvykle dlouhodobě stabilní – často po desetiletí. Spontánní remise může nastat až u 20–30 % případů, 15–30 % pacientů trpí chronickým progresivním zhoršováním funkce ledvin. Až u 50 % postižených pacientů lze v průběhu 20 až 25 let pozorovat pomalou progresi do konečného stadia onemocnění ledvin. I u stabilních pacientů se doporučují každoroční nefrologické kontroly, protože benigní IgA nefropatie může i po letech přejít v chronické selhání ledvin.
Příležitostně se IgA nefropatie vyskytuje v kontextu Henochovy-Schönleinovy purpury (podle nové nomenklatury IgA vaskulitidy), která zahrnuje kromě mezangiálních IgA depozit také vaskulitické střevní léze s následnými břišními obtížemi, artralgie a purpuru, zejména v oblasti dolních končetin. Henochova - Schönleinova purpura se vyskytuje nejčastěji u dětí (chlapců) ve věku 3–15 let.
V případě přítomnosti nefrotického syndromu (až 10 %) je riziko žilní trombózy významně zvýšeno. To se může projevit jako trombóza ledvinných žil. V takovém případě může jít o koincidenci s nemocí minimálních změn (minimal change disease), která dobře reaguje na kortikosteroidy.
S IgA nefropatií může být spojena řada dalších onemocnění (Tab. 2). Patogeneze O autoimunitní genezi onemocnění se diskutuje již dlouho. Přibližně 50 % pacientů s IgA nefropatií vykazuje zvýšené hladiny IgA v plazmě, přičemž monomerní forma tvoří hlavní podíl IgA v séru. Polymerní IgA detekovaný v mezangiálních depozitech je však pro patogenezi klíčový. Důležitou fyziologickou funkcí molekuly IgA je obrana proti antigenům vstřebaným inhalací nebo orálně. Narušená slizniční bariéra může vést k migraci plazmatických buněk ze sliznice do kostní dřeně se zvýšenou produkcí IgA s chyběním terminální galaktózy v tzv. ohybové (hinge) oblasti molekuly IgA (IgA s deficitem galaktózy). Vývoj klinicky symptomatické IgA nefropatie je založen na hypotéze více faktorů (multiple-hit), tj. než se onemocnění projeví, musí se sejít několik faktorů. Zpočátku jsou v krevním systému pacienta přítomny molekuly IgA1 s nedostatkem galaktozylace (Gd-IgA1), proti nimž vznikají protilátky. Cirkulující komplexy autoprotilátek se ukládají v glomerulárním mezangiu. Depozice imunitních komplexů autoprotilátek aktivuje systém komplementu, indukuje proliferaci mezangia a akumulaci matrix. Vylučují se prozánětlivé mediátory, které mohou sekundárně vyvolat fibrózu. Pacienti se zánětlivým střevním onemocněním nebo celiakií jsou predisponováni ke vzniku IgA nefropatie kvůli narušené slizniční bariéře. Pozitivní vliv zde mohou mít dietní opatření. V souvislosti s vývojem autoprotilátek proti galaktózo-deficientnímu IgA1 se diskutuje o vlivu virové infekce. Bylo prokázáno, že infekce viry nebo gramnegativními bakteriemi předchází tvorbě autoprotilátek.
Tab. 2. Onemocnění, která mohou být často spojena s IgA nefropatií 
Zajímavé je, že 40–50 % nejbližších rodinných příslušníků pacienta má zvýšené hladiny galaktózo-deficientního IgA1, ale ne u všech se vyvine typický klinický obraz IgA nefropatie. Nápadná geografická variabilita v prevalenci také svědčí pro genetické faktory onemocnění. Celogenomové asociační studie (GWAS) identifikovaly rizikové alely, čímž posílily důkazy o genetické příčině. Velká část genů kóduje proteiny podílející se na regulaci slizniční imunitní odpovědi a udržování slizniční bariéry.
Morfologická diagnóza
Histomorfologická klasifikace IgA nefropatie vychází z oxfordské klasifikace MEST-C, která má prognostický význam. Pro vyhodnocení je nutná trojí diagnostika – světelné, imunologické a elektronové mikroskopické vyšetření bioptického materiálu.
Histologický obraz může být velmi variabilní a může zahrnovat minimální změny, jako je mírná mezangiální expanze, ale i obraz pokročilého onemocnění – tvorba srpků. Často se zjišťuje difuzní mezangioproliferativní glomerulonefritida a fokální segmentální glomeruloskleróza. Přítomnost posledně jmenovaných změn, případně nález globálních glomerulárních jizev, svědčí pro dlouhodobé onemocnění. Kromě toho lze zjistit hypertenzní léze ve smyslu hypertenzní nefrosklerózy.
Imunohistochemické nálezy zahrnují mezangiální depozita IgA, navíc obvykle pozitivitu C3 faktoru komplementu a méně orientačně depozita C1q a IgM. Až v 70 % případů se IgG ukládá také v glomerulu. Detekce fibrinu je známkou segmentální nekrózy.
Elektronová mikroskopie odhalí imunitní komplexy v oblasti periferních bazálních membrán.
Rizikové faktory progrese
Identifikace faktorů progrese je nezbytná pro posouzení progrese onemocnění a volbu terapie. Byly zjištěny následující rizikové faktory progrese onemocnění (Tab. 3): mužské pohlaví, dysfunkce funkce ledvin již v době diagnózy, arteriální hypertenze a přetrvávající proteinurie > 1,5 g/den. Dalšími modifikovatelnými rizikovými faktory jsou obezita, hyperlipidemie, hyperurikemie a abúzus nikotinu. Kromě klinických faktorů se k posouzení prognózy používají i histopatologické nálezy.
Tab. 3. Klinické faktory rozvoje selhání ledvin 
V současné době neexistuje žádný specifický sérologický marker pro identifikaci imunologické aktivity, proto se ke sledování aktivity onemocnění používají klinické parametry. Přetrvávající mikrohematurie je známkou imunologické aktivity, ale ne nutně markerem progrese. Přetrvávající proteinurie nad 1 g/ den a nedostatečně regulovaný krevní tlak jsou důležitými rizikovými faktory progrese onemocnění. Zvýšená proteinurie však může být spojena s aktivitou onemocnění i sekundárně se závažným poškozením glomerulů způsobeným neimunologickým procesem.
Diferenciální diagnóza
V případě klinické triády mikrohematurie, mírné proteinurie a hypertenze je třeba zvážit řadu diferenciálních diagnóz. I při biopticky potvrzených IgA depozitech v mezangiu mohou být přítomny různé další nozologické jednotky, například Henochova-Schönleinova purpura, lupusová nefritida či monoklonální IgA gamapatie. Variabilní šířka bazální membrány může svědčit pro hereditární nefritidu typu Alportova syndromu. U syndromu tenké bazální membrány se může objevit mikrohematurie a mírná proteinurie.
Diagnózu je proto třeba vždy stanovit ve spojení s klinickým a histologickým, případně genetickým vyšetřením a pacient s příslušným močovým nálezem by měl být referován nefrologovi.
Terapie
Před zahájením léčby by měly být vyloučeny sekundární příčiny IgA nefropatie a je třeba zohlednit tíži proteinurie, eGFR, krevní tlak a histologický vzhled. Cílem léčby je navodit remisi a zabránit vzniku komplikací. Ke zvládnutí proteinurie a snížení krevního tlaku se používají inhibitory angiotenzin konvertujícího enzymu (ACEI) nebo blokátory angiotenzinových receptorů. Ke kontrole krevního tlaku se doporučuje příjem soli pod 6 g/den. Cílová hodnota krevního tlaku je 130/80 mmHg.
Ke snížení rychlosti progrese se používá imunosuprese kortikosteroidy nebo steroidy šetřícími látkami. Steroidy mají největší přínos, pokud je přítomna těžká proteinurie. K dispozici jsou různé režimy perorálního prednisolonu a metylprednisolonu. Pokud existují kontraindikace pro steroidy nebo pokud rizika léčby převažují nad očekávaným přínosem steroidní terapie, lze zvážit výjimečně steroid sparing drugs (cyklofosfamid). Mykofenolát mofetil již nehraje roli v terapii IgA glomerulonefritidy, částečně proto, že výsledky o účinnosti terapie mykofenolát mofetilem (MMF) u IgA nefropatie byly rozporuplné. Dvojitě zaslepená, placebem kontrolovaná studie (Hogg et al., 2015) o použití MMF u IgA nefropatie neprokázala žádný rozdíl v léčebných ramenech, pokud jde o proteinurii.
Dojde-li k rozvoji konečného stadia onemocnění ledvin (ESRD), přichází v úvahu transplantace ledviny. U transplantované ledviny však je riziko rekurence IgA nefropatie ve štěpu. Léčba inhibitorem angiotenzin konvertujícího enzymu nebo blokátorem angiotenzinových receptorů může u alograftu oddálit progresi rekurentního onemocnění.
Nejdůležitější součástí jakéhokoli plánu léčby je pravidelné sledování krevního tlaku, proteinurie, hematurie, eGFR a adherence k léčbě. Kortikosteroidy by se neměly používat déle než šest měsíců kvůli závažným nežádoucím účinkům.
Navzdory podpůrným opatřením, která zpomalují rychlost progrese chronického onemocnění ledvin u IgA nefropatie, mnoho pacientů stále progreduje do konečného stadia onemocnění ledvin. V současné době používané imunosupresivní strategie postrádají přesvědčivé údaje o účinnosti, přičemž existují důkazy o toxicitě léčby. V tomto světle jsou zvláště zajímavé a perspektivní dvě nové terapeutické modality.
V roce 2021 byla publikována subanalýza studie Dapagliflozin and Prevention of Adverse Outcomes in Chronic Kidney Disease Trial (DAPA-CKD), která zahrnula 270 pacientů s diagnózou IgA nefropatie. V současné době se hlavně zdůrazňuje přínos optimalizované udržovací terapie (maximální tolerovaná dávka ACEI, resp. maximální doporučená dávka), inhibitory SGLT2 (sodíko-glukózového kotransportéru 2) představují obohacení podpůrné léčby. Dapagliflozin je u těchto pacientů od 1. 8. 2022 hrazen – při albuminurii vyjádřené jako ACR nad 200 mg/g (nad 22,6 g/mol) do 5000 mg/g (565 g/mol) a eGFR v pásmu 25–55 ml/min/1,73 m2 bez ohledu na přítomnost diabetu.
Studie byla předčasně ukončena, protože ve skupině s dapagliflozinem dosáhli pacienti signifikantně méně primárních cílových ukazatelů. V rameni s dapagliflozinem došlo ke snížení poměru albumin/ kreatinin o 26 % oproti skupině s placebem a bylo zaznamenáno méně závažných nežádoucích účinků. Studie s dapaglifozinem u pacientů s IgAN potvrdila bezpečné snížení rizika zhoršení onemocnění ledvin. Dapagliflozin snížil riziko selhání ledvin a prodloužil dobu přežívání u jedinců s chronickým onemocněním ledvin se současně přítomným DM 2. typu i bez DM 2. typu včetně pacientů s IgAN. Jsou tak k dispozici důkazy o tom, že dapagliflozin může být bezpečným a účinným doplňkem současného standardu péče u IgA nefropatie.
Recentně bylo FDA uděleno urychlené schválení inovativního preparátu s budesonidem se zpožděným uvolňováním ke snížení proteinurie u dospělých s primární IgAN s rizikem rychlé progrese onemocnění. Týž přípravek byl zcela nedávno schválen Komisí EU pod názvem Kinpeygo pro léčbu primární IgA nefropatie u dospělých s rizikem rychlé progrese onemocnění s poměrem bílkovin/kreatininu v moči ≥ 1,5 g/g. Měkké tobolky obsahují 4 mg budesonidu.
Účinek přípravku na proteinurii byl hodnocen v randomizované, dvojitě zaslepené studii u účastníků studie s IgA nefropatií, sníženou funkcí ledvin a proteinurií, kteří užívali stabilní dávku maximálně tolerované léčby inhibitory systému renin-angiotenzin (RAS). Účastníci dostávali enterosolventní budesonid 16 mg jednou denně nebo placebo po dobu devíti měsíců, po níž následovalo dvoutýdenní období vysazování aktivní léčby (8 mg) jednou denně nebo placeba. Primárním koncovým ukazatelem bylo procentuální snížení poměru bílkovin ke kreatininu v moči (PCR) po devíti měsících ve srovnání se začátkem studie. Po devíti měsících došlo u účastníků studie v aktivní větvi k průměrnému snížení PCR o 34 %, zatímco u účastníků, kteří dostávali placebo, došlo k průměrnému snížení PCR o 5 %. Současně došlo ke stabilizaci glomerulární filtrace.
Kortikosteroid má vést k supresi B slizničních buněk v tenkém střevě a inhibovat jejich proliferaci a diferenciaci v plazmatické buňky, které produkují protilátky IgA1 s nedostatkem galaktózy. To vede k tomu, že se v ledvinách již nemohou ukládat imunitní komplexy a dojde ke zpomalení zánětlivého procesu a další ztrátě funkce ledvin.
Kinpeygo je tvrdá tobolka s upraveným uvolňováním účinné látky. Podle informací o přípravku je složení navrženo tak, aby budesonid účinkoval v ileu. Systémová biologická dostupnost je nízká v důsledku vysokého metabolismu při prvním průchodu játry, proto lze očekávat podstatně menší míru nežádoucích účinků než při systémové kortikoterapii. Terapie nespecifických střevních zánětů enterosolventním budesonidem je dobře etablována již několik let.
Doporučená dávka je 16 mg jednou denně ráno, nejméně jednu hodinu před jídlem, po dobu devíti měsíců. Pokud má být léčba přerušena, měla by být dávka snížena na 8 mg jednou denně po dobu dvou týdnů. Dávka může být poté snížena na 4 mg jednou denně po dobu dalších dvou týdnů podle uvážení lékaře. Opakování léčby lze zvážit na základě rozhodnutí ošetřujícího lékaře.
Závěr
IgA nefropatie je častou formou glomerulonefritidy a je spojena s mikrohematurií a/nebo proteinurií různého stupně. Je známo velké množství rizikových faktorů, z nichž mnohé lze ovlivnit (např. obezita, abúzus nikotinu). Základem terapeutických opatření jsou podpůrné strategie. Léčba inhibitory ACE nebo blokátory angiotenzinových receptorů vedoucí ke snížení intraglomerulárního tlaku a optimální regulaci krevního tlaku by měla vždy předcházet imunosupresivní léčbě, součástí léčby CKD jsou v současnosti i SGLT2i (dapagliflozin). Je třeba usilovat o zlepšení komponent metabolického syndromu a o abstinenci od nikotinu.
Údaje o léčbě IgA nefropatie imunosupresí jsou stále omezené. Ve studii Stop-IgAN byly poprvé k dispozici údaje z rozsáhlejší randomizované kontrolované klinické studie. Iniciálně je indikována podpůrná léčba. U pacientů s proteinurií mezi 0,75 a 3,5 g denně může léčba steroidy významně snížit proteinurii. Vliv imunosuprese na průběh funkce ledvin je však sporný a imunosuprese je spojena s vyšším výskytem nežádoucích účinků.
V případě rychle progredujícího onemocnění nebo závažných histologických příznaků zánětu s tvorbou glomerulárních srpků lze výběrově při absenci rizikovosti tohoto postupu zvážit pulzní terapii steroidy nebo kombinovanou imunosupresivní terapii (cyklofosfamid). U pokročilého onemocnění s výraznou fibrózou a glomerulosklerózou se však imunosuprese nedoporučuje. Terapeutický přístup by měl být zvolen individuálně po zvážení příslušných přínosů a rizik.
K dispozici jsou již novější léčebné modality, z nichž je třeba zmínit inovativní enterosolventní formu glukokortikoidů (budesonid). Subanalýza velké renální studie DAPA-CKD, která zahrnula 270 pacientů s diagnózou IgA nefropatie, poskytla první důkazy o tom, že dapagliflozin může být bezpečným a účinným doplňkem současného standardu péče u IgA nefropatie. Nyní probíhá značné množství klinických studií, které snad v budoucnu umožní cílenější terapii vysoce rizikových pacientů s progresivní IgAN.
Proto již není důvod k terapeutickému nihilismu, který byl někdy dosud s diagnózou IgA nefropatie spojen. Podle zkušeností autorů je relativně velký počet nemocných s IgA nefropatií mimo aktivní nefrologické sledování, což především ty nemocné s aktivním průběhem choroby připravuje o možnost inovativní léčby či účasti v klinických studiích. Podobně jako u jiných vzácných onemocnění by měli tito pacienti být soustředěni na pracovištích, kde jim může být poskytnuta komplexní péče, nabídnuta v případě potřeby renální rebiopsie apod.
Zdroje
1. Ballardie FW, Roberts IS. Controlled prospective trial of prednisolone and cytotoxics in progressive IgA nephropathy. J Am Soc Nephrol 2002;13(1):142–148.
2. Barratt J, Floege J. SGLT‑2 inhibition in IgA nephropathy: the new standard of care? Kidney Int 2021;100(1):24–26. doi: 10.1016/j.kint.2021.04.002.
3. Berthoux F, Mohey H, Laurent B, et al. Predicting the risk for dialysis or death in IgA nephropathy. J Am Soc Nephrol 2011;22(4):752–761. doi: 10.1681/ ASN.2010040355.
4. Berthoux F, Suzuki H, Thibaudin L, et al. Autoantibodies targeting galactose - deficient IgA1 associate with progression of IgA nephropathy. J Am Soc Nephrol 2012;23(9):1579–1587. doi: 10.1681/ASN.2012010053.
5. Feehally J, Coppo R, Troyanov S, et al. Tonsillectomy in a European cohort of 1,147 patients with IgA nephropathy. Nephron 2016;132(1):15–24. doi: 10.1159/000441852.
6. Fellström BC, Barratt J, Cook H, et al. Targeted-release budesonide versus placebo in patients with IgA nephropathy (NEFIGAN): a double-blind, randomised, placebo-controlled phase 2b trial. Lancet 2017;389(10084):2117 – 2127. doi: 10.1016/S0140–6736(17)305 50–0.
7. Floege J, Feehally J. The mucosa-kidney axis in IgA nephropathy. Nat Rev Nephrol 2016;12(3):147–156. doi: 10.1038/nrneph.2015.208.
8. Harden PN, Geddes C, Rowe PA, et al. Polymorphisms in angiotensin-converting - enzyme gene and progression of IgA nephropathy. Lancet 1995;345(8964):1540–1542. doi: 10.1016/s0140–6736(95)910 88–3.
9. Hogg RJ, Bay RC, Jennette JC, et al. Randomized controlled trial of mycophenolate mofetil in children, adolescents, and adults with IgA nephropathy. Am J Kidney Dis 2015;66(5):783–791. doi: 10.1053/j. ajkd.2015.06.013.
10. Bhachu J, Molyneux K, Barratt J, et al., FC049: Nefecon® (budesonide) is an epigenetic modifier in IgA nephropathy. Nephrology Dialysis Transplantation 2022;37 (Suppl. 3). gfac107.001, https://doi.org/10.1093/ndt/gfac107.001.
11. Kanno Y, Okada H, Saruta T, et al. Blood pressure reduction associated with preservation of renal function in hypertensive patients with IgA nephropathy: a 3‑year follow‑up. Clin Nephrol 2000;54 : 360–365.
12. Kim YC, Chin HJ, Koo HS, Kim S. Tacrolimus decreases albuminuria in patients with IgA nephropathy and normal blood pressure: a double-blind randomized controlled trial of efficacy of tacrolimus on IgA nephropathy. PLoS One 2013;8(8):e71545. Published 2013.
13. Knoop T, Vikse BE, Mwakimonga A, et al. Long-term outcome in 145 patients with assumed benign immunoglobulin A nephropathy. Nephrol Dial Transplant 2017;32(11):1841–1850. doi: 10.1093/ndt/gfx242.
14. Lafayette RA, Canetta PA, Rovin BH, et al. A randomized, controlled trial of rituximab in IgA nephropathy with proteinuria and renal dysfunction. J Am Soc Nephrol 2017;28(4):1306–1313. doi: 10.1681/ASN.2016060640.
15. Liu H, Xu X, Fang Y, et al. Comparison of glucocorticoids alone and combined with cyclosporine a in patients with IgA nephropathy: a prospective randomized controlled trial. Intern Med 2014;53(7):675–681. doi: 10.2169/ internalmedicine.53.1136.
16. Natale P, Palmer SC, Ruospo M, et al. Immunosuppressive agents for treating IgA nephropathy. Cochrane Database Syst Rev 2020;3(3):CD003965. Published 2020 Mar 12. doi: 10.1002/14651858.CD003965.pub3.
17. Pozzi C, Andrulli S, Pani A, et al. Addition of azathioprine to corticosteroids does not benefit patients with IgA nephropathy. J Am Soc Nephrol 2010;21(10):1783–1790. doi: 10.1681/ASN.2010010117.
18. Rauen T, Eitner F, Fitzner, C, et al. Intensive supportive care plus immunosuppression in IgA nephropathy. N Engl J Med 2015;373 : 2225–2236.
19. Rizk DV, Maillard N, Julian BA, et al. The emerging role of complement proteins as a target for therapy of IgA nephropathy. Front Immunol 2019;10 : 504. Published 2019 Mar 19. doi: 10.3389/fimmu.2019.00504.
20. Rovin BH, Caster DJ, Cattran DC, et al. Management and treatment of glomerular diseases (part 2): conclusions from a Kidney Disease: Improving Global Outcomes (KDIGO) Controversies Conference. Kidney Int 2019;95 : 281–295.
21. Schimpf JI, Klein T, Fitzner C, et al. Renal outcomes of STOP-IgAN trial patients in relation to base-line histology (MEST-C scores). BMC Nephrol 2018;19(1):328. Published 2018 Nov 19. doi: 10.1186/ s12882–018–1128–6.
22. Tesar V, Troyanov S, Bellur S, et al. Corticosteroids in IgA nephropathy: a retrospective analysis from the VALIGA Study. J Am Soc Nephrol 2015;26(9):2248–2258. doi: 10.1681/ASN.2014070697.
23. Trimarchi H, Barratt J, Cattran DC, et al. Oxford Classification of IgA nephropathy 2016: an update from the IgA Nephropathy Classification Working Group. Kidney Int 2017;91(5):1014–1021. doi: 10.1016/j.kint.2017.02.003.
24. Tumlin JA, Lohavichan V, Hennigar R. Crescentic, proliferative IgA nephropathy: clinical and histological response to methylprednisolone and intravenous cyclophosphamide. Nephrol Dial Transplant 2003;18(7):1321–1329. doi: 10.1093/ndt/gfg081.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek vyšel v časopiseSvět praktické medicíny
Nejčtenější tento týden
2023 Číslo 1- Nitrofurantoin s řízeným uvolňováním – osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Jak včas rozpoznat vzácné onemocnění? S diagnostickou rozvahou pomůže accelRare
-
Všechny články tohoto čísla
- Úvodní slovo
- Komentář k článku Péče o lidi bez domova
- Komentář k článku Péče o lidi bez domova
- Očkování proti chřipce vakcínou Efluelda v seniorské populaci
- Současné možnosti prevence proti pneumokokovým onemocněním
- Long COVID v pediatrii: klinický obraz a jeho patofyziologie
- Včasná diagnostika a možnosti léčby HIV
- Poskytování indikované lékařské péče HIV pozitivním pacientům v běžné klinické praxi
- Rozhovor s MUDr. Josefem Štolfou: „Nechci řešit jen vysoký tlak, diabetes, angíny a kašlíčky“
- Dexibuprofen v léčbě bolesti
- Malé molekuly s velkými cíli – selektivní inhibice Janusovy kinázy 1 v terapii psoriatické artritidy
- Přínos fixní dvojkombinace magnezia a vitaminu B6 v léčbě silného stresu
- Význam fixních kombinací blokátorů RAAS v léčbě arteriální hypertenze
- Novinky v oblasti léčby chronického onemocnění ledvin
- Nové registrace na evropském poli
- IgA nefropatie: co by měl vědět lékař v praxi?
- Diagnostika a léčba obezity napříč specializacemi – tělovýchovné lékařství (1. část)
- Znalostní test: 2 kredity ČLK
- Péče o lidi bez domova
- Svět praktické medicíny
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Očkování proti chřipce vakcínou Efluelda v seniorské populaci
- Dexibuprofen v léčbě bolesti
- IgA nefropatie: co by měl vědět lékař v praxi?
- Včasná diagnostika a možnosti léčby HIV
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



