-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vliv dehiscence anastomózy na onkologické výsledky u resekčních výkonů pro karcinom rekta
Impact of anastomotic leakage on oncological outcomes after rectal cancer resection
Introduction:
The aim of the study was to determine the impact of anastomotic leakage on long-term outcomes after curative surgery for rectal cancer.Material and methods:
The study included 174 patients who underwent elective, potentially curative open or laparoscopic resection with anastomoses for rectal cancer at the Department of Surgery of the University Hospital Ostrava from 1 January 2001 to 31 December 2009. Anastomotic leakage was defined as clinically or radiologically confirmed signs of local or diffuse peritonitis, gas, pus or stool from the drain, rectoscopy signs of anastomotic insufficiency, or rectovesical or rectovaginal fistula.
The Cox proportional hazards model with forward selection was used to determine the influence of predefined baseline characteristics on overall, disease-free survival and recurrence. The results are presented as Hazard Ratio (HR) with 95% Confidence Interval (CI).Results:
Based on the Cox model, anastomotic leakage was not identified as a factor with a significant impact on overall or disease-free survival. Anastomotic leakage, however, has remained an independent risk factor for a higher local recurrence rate (Hazard Ratio: 6.621, 95% CI 1.289–34.020, p=0.024). On the contrary, anastomotic leakage was not identified as a statistically significant prognostic factor for the incidence of distant metastases.Conclusion:
Anastomotic leakage represents an independent risk factor for a higher local recurrence rate after curative resection for rectal cancer.Keywords:
rectal cancer – anastomotic leakage – local recurrence – survival
Autoři: P. Guňková; I. Guňka; L. Martínek
; V. Richter; P. Vávra; P. Ihnát; M. Mazur; J. Dostalík; P. Zonča
Působiště autorů: Lékařská fakulta Ostravské Univerzity, Chirurgická klinika FN Ostrava přednosta: Doc. MUDr. P. Zonča, PhD., FRCS.
Vyšlo v časopise: Rozhl. Chir., 2013, roč. 92, č. 5, s. 244-249.
Kategorie: Původní práce
Souhrn
Úvod:
Cílem práce bylo zjistit, zda dehiscence anastomózy u pacientů s resekčními výkony na rektu má negativní vliv na onkologické výsledky.Materiál a metodika:
Do studie bylo zařazeno 174 pacientů, kteří podstoupili na Chirurgické klinice Fakultní nemocnice Ostrava v období od 1. 1. 2001 do 31. 12. 2009 elektivní, potenciálně kurativní otevřenou nebo laparoskopickou resekci s anastomózou pro karcinom rekta. Do skupiny pacientů s anastomotickým leakem byli zařazeni ti pacienti, kteří měli klinické či zobrazovacími metodami potvrzené známky cirkumskriptní či difuzní peritonitidy, odchod plynu, hnisu či stolice z drénu, dále pacienti s rektoskopicky prokázanou insuficiencí anastomózy nebo rektovaginální či rektovezikální píštěl. K prokázání vlivu definovaných proměnných na přežití, přežití bez známek onemocnění a riziko výskytu recidiv byl použit Coxův model proporcionálního rizika. Výsledky jsou prezentovány jako poměr rizik (HR – Hazard Ratio) s příslušným 95% intervalem spolehlivosti (CI – Confidence Interval).Výsledky:
Na základě Coxova modelu nebyla dehiscence anastomózy identifikována jako faktor, který významně ovlivňuje celkové přežívání ani přežívání bez známek onemocnění. Anastomotický leak však zvyšuje riziko vzniku lokální recidivy 6,621krát (95 % CI 1,289-34,020, p=0,024). Naopak v případě vzdálených recidiv nebyl anastomotický leak identifikován jako statisticky významný prognostický faktor.Závěr:
Anastomotický leak po kurativních resekcích pro adenokarcinom rekta je nezávislým rizikovým faktorem vzniku lokální recidivy.Klíčová slova:
karcinom rekta – dehiscence anastomózy – lokální recidiva – přežitíÚvod
Technický pokrok zejména ve staplerové technice, předoperační radiochemoterapie u vyšších stadií tumoru a zkracování doporučené bezpečnostní vzdálenosti od okrajů tumoru zvýšily počty sfinkter šetřících operací pro karcinom rekta. Resekční výkony na rektu z důvodů specifického cévního zásobení a technické obtížnosti však znamenají potenciální riziko dehiscence anastomózy, která je považována za jednu z nejzávažnějších komplikací v kolorektální chirurgii. Incidence se podle literatury pohybuje mezi 3–21 % [1–6], klinicky nevyjádřená insuficience anastomózy se ale může objevovat až u 33–51 % pacientů [2,7]. Protektivní stomie nezabrání vzniku radiologicky prokazatelného leaku, ale mohou redukovat klinicky manifestní leak a s ním spojenou morbiditu [8].
Poměrně velké rozpětí výskytu této komplikace souvisí s různými definicemi leaku v jednotlivých studiích, přičemž jednotná, všeobecně akceptovaná definice neexistuje. Ve většině publikovaných prací se jedná o dehiscenci anastomózy vyjádřenou klinicky. Obecně lze leak definovat jako defekt integrity střevní stěny, který vede ke komunikaci mezi intra a extraluminálním prostorem [9]. Je rozdělen do 3 kategorií [9]: leak, který nevyžaduje aktivní terapeutickou intervenci, leak, který vyžaduje aktivní léčebný zásah, ale bez nutnosti laparotomie, a leak, který vyžaduje relaparotomii. Procentuální zastoupení symptomatického anastomotického leaku je také považováno za jeden z indikátorů kvality chirurgické léčby.
V literatuře je publikováno velké množství prací, které hodnotily potenciální, nezávislé rizikové faktory pro vznik anastomotického leaku [1,2,7,10,11]. Riziko vzniku dehiscence anastomózy se zvyšuje se zmenšující se vzdáleností od anokutánní linie. Jako rizikové jsou považovány zejména anastomózy ve vzdálenosti 4 cm [3,12,13] až 7 cm [2] od anokutánní linie. Na základě publikovaných metaanalýz nebyl zjištěn rozdíl ve výskytu dehiscencí rektálních anastomóz mezi ručně šitými a technicky správně provedenými staplerovými anastomózami [14,15]. Stejně tak nebyl prokázán statisticky významný rozdíl mezi laparoskopickým a otevřeným přístupem při konstrukci anastomóz [2]. Za rizikový faktor vzniku dehiscence anastomózy je většinou autorů považováno mužské pohlaví [3,16,17].
Dehiscence anastomózy je hlavní příčinou pooperační morbidity a letality u pacientů po sfinkter šetřících výkonech pro karcinom rekta [9,18]. Letalita spojená s leakem se pohybuje mezi 6 a 22 % [2,19]. Anastomotický leak však nezvyšuje jen pooperační letalitu, ale je také zodpovědný za vyšší výskyt lokálních recidiv a zkrácení celkového přežívání pacientů po kurativních resekcích pro karcinom rekta [2,20]. Zejména u pacientů s dehiscencí anastomózy, která si vynutila reoperaci, je signifikantně vyšší četnost lokálních recidiv a kratší celkové přežití [19,21,22]. Je to vysvětlováno teorií, že pokud jsou přítomny viabilní nádorové buňky ve střevním lumen v době operace, vzrůstá riziko vzniku mikrometastáz v případě dehiscence anastomózy [23]. Důsledkem dehiscence anastomózy je prodloužení samotného pooperačního období, čímž je později zahájena následná onkologická léčba, nebo vůbec k jejímu zahájení nedojde. Stejně tak u těchto pacientů mohou být negativně ovlivněny dlouhodobé funkční výsledky.
Cílem této práce bylo zjistit, zda dehiscence anastomózy u pacientů s resekčními výkony na rektu má negativní vliv na onkologické výsledky (celkové pětileté přežívání, pětileté přežívání bez známek onemocnění a problematika recidiv).
Materiál a metodika
Do této studie byli zařazeni všichni pacienti starší 18 let, kteří podstoupili na Chirurgické klinice Fakultní nemocnice Ostrava v období od 1. 1. 2001 do 31. 12. 2009 elektivní, potenciálně kurativní otevřenou nebo laparoskopickou resekci s anastomózou pro karcinom rekta. Z analýzy byli vyloučeni pacienti s generalizovaným onemocněním, nádorovou duplicitou, s malignitou v osobní anamnéze v intervalu kratším 5 let, dále pacienti operováni akutně, pacienti, u kterých byla provedena T.E.M. excize, a ti, kteří zemřeli do 30 dnů od primární operace. Operace byly prováděny 7 chirurgy se zkušeností v otevřené i laparoskopické kolorektální chirurgii a volba operačního přístupu (laparoskopicky či otevřeně) závisela na rozhodnutí operatéra a přání pacienta. Pacienti byli podrobně edukováni a podepsali informovaný souhlas, který byl součástí chorobopisu. Do skupiny laparoskopických operací byly zařazeny výkony laparoskopicky asistované, manuálně asistované (MALCH – manuálně asistovaná laparoskopická chirurgie) a konvertované operace na základě principu záměru léčby (intention to treat).
Na našem pracovišti jsou karcinomy dolního rekta definovány jako léze ve vzdálenosti 0–7,9 cm od anokutánního přechodu při rigidní rektoskopii, karcinomy středního rekta ve vzdálenosti 8–11,9 cm a karcinomy horního rekta ve 12–16 cm. Je to rozdělení vycházející z práce Ptoka (21).
Vždy byly dodržovány zásady onkologické radikality s časným podvazem cévního svazku, totální mezorektální excizí u karcinomu dolní a střední třetiny rekta a transekcí mezorekta 5 cm pod tumorem v případě lokalizace na horní třetině rekta. Anastomózy byly konstruovány pomocí staplerové techniky. Těsnost anastomóz byla kontrolována vzduchovou zkouškou pod vodní hladinou. V případě nejistoty ohledně bezpečnosti anastomózy byla vyšita protektivní ileostomie. V ostatních případech rozhodnutí o provedení protektivní ileostomie záviselo na rozhodnutí operatéra, stejně tak rekonstrukce pánevního dna. Drenáž operačního pole byla prováděna vždy.
Do skupiny pacientů s anastomotickým leakem byli zařazeni ti pacienti, kteří měli klinické či zobrazovacími metodami potvrzené známky cirkumskriptní či difuzní peritonitidy, odchod plynu, hnisu či stolice z drénu, dále pacienti s rektoskopicky prokázanou insuficiencí anastomózy nebo rektovaginální či rektovezikální píštělí. Vzhledem k tomu, že na našem pracovišti není rutinně ověřována patentnost anastomózy rentgenovým kontrastním vyšetřením, nejsou zařazeni pacienti s případnými rentgenologickými známkami insuficience anastomózy bez korelace s klinickými příznaky.
Studie byla klinická, prospektivní, unicentrická, nezaslepená. Samozřejmostí byla ochrana dat pacientů.
Analyzovány byly následující parametry: celkové přežívání, přežívání bez známek onemocnění a výskyt recidiv. Celkové přežívání bylo definováno jako časový interval mezi operací a úmrtím z jakékoliv příčiny. Žijící pacienti byli cenzorováni v čase poslední kontroly. Přežívání bez onemocnění bylo definováno jako časový interval mezi operací a úmrtím z jakékoliv příčiny nebo výskytem recidivy, přičemž žijící pacienti bez známek onemocnění byli cenzorováni v čase poslední kontroly. Lokální recidiva byla definována jako opětovný výskyt malignity v místě anastomózy nebo operačního pole. Vzdálené recidivy pak byly definovány jako metastatická ložiska v jiných orgánech, peritoneální diseminace nebo nádorové postižení neregionálních lymfatických uzlin. Délka následného sledování byla definována jako časový interval mezi operací a poslední klinickou kontrolou. Poslední revize dlouhodobých výsledků je datována k 31. 8. 2011.
Základní charakteristika souboru pacientů, klinicko-patologická a perioperační data, byla zpracována metodami popisné statistiky (průměr, směrodatná odchylka, medián, rozmezí a relativní četnost). K prokázání vlivu definovaných proměnných na přežití a riziko výskytu recidiv byl použit Coxův model proporcionálního rizika (Cox proportional hazards model). Jednotlivé proměnné byly do modelu přidávány postupně dopřednou metodou a kritériem k ponechání proměnné v modelu byl její vliv na věrohodnostní poměr (LR – likelihood ratio). Faktory, které v Coxově regresní analýze dosáhly významnosti p-value 0,05, byly považovány za statisticky významné. Výsledky jsou prezentovány jako poměr rizik (HR – Hazard Ratio) s příslušným 95% intervalem spolehlivosti (CI – Confidence Interval). Softwarem, který byl použit, byly programy Statistica verze 9 (StatSoft Inc., Tulsa, USA) a PASW Statistics verze 18.0 (SPSS Inc., Chicago, Illinois, USA).
Výsledky
V období od 1. 1. 2001 do 31. 12. 2009 bylo do studie zařazeno celkem 174 pacientů. Ve skupině pacientů s dehiscencí anastomózy bylo 12 pacientů (6,9 %), ve skupině bez dehiscence anastomózy 162 pacientů (93,1 %).
Střední délka následného pooperačního sledování u pacientů s karcinomem rekta byla 61 měsíců (1–127 měsíců).
Základní demografické charakteristiky pacientů jsou uvedeny v Tab. 1. Byl zjištěn statisticky významný rozdíl (p=0,037) v zastoupení mužů a žen ve skupině pacientů s a bez dehiscence anastomózy.
Tab. 1. Základní demografické charakteristiky souboru Tab. 1: Baseline demographics of the patients 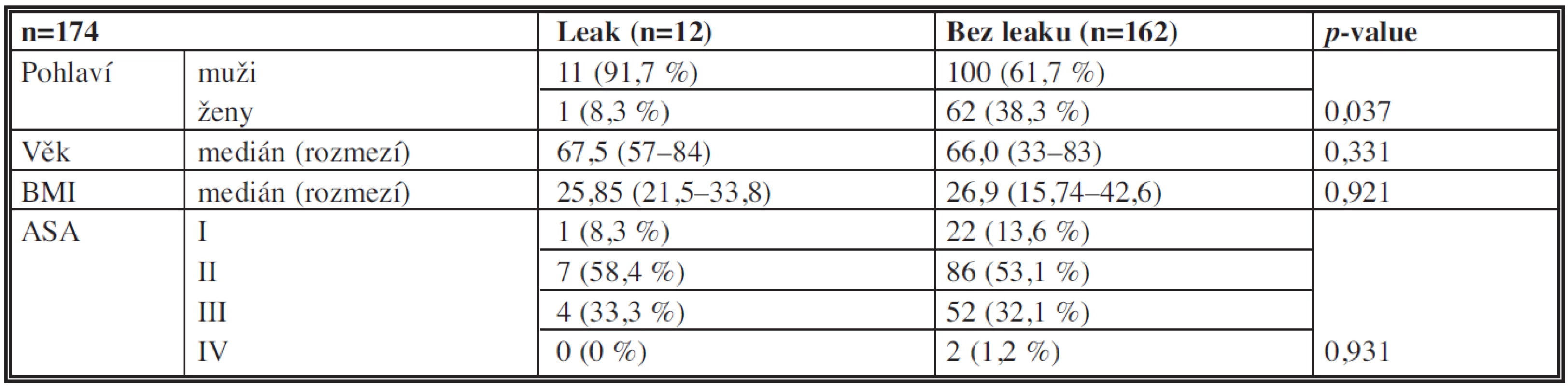
Charakteristiky lokalizace, histopatologické diferenciace, TNM klasifikace primárního tumoru jsou uvedeny v Tab. 2.
Tab. 2. Charakteristiky tumoru Tab. 2: Characteristics of the tumour (localization, histopathological differentiation, TNM classification) 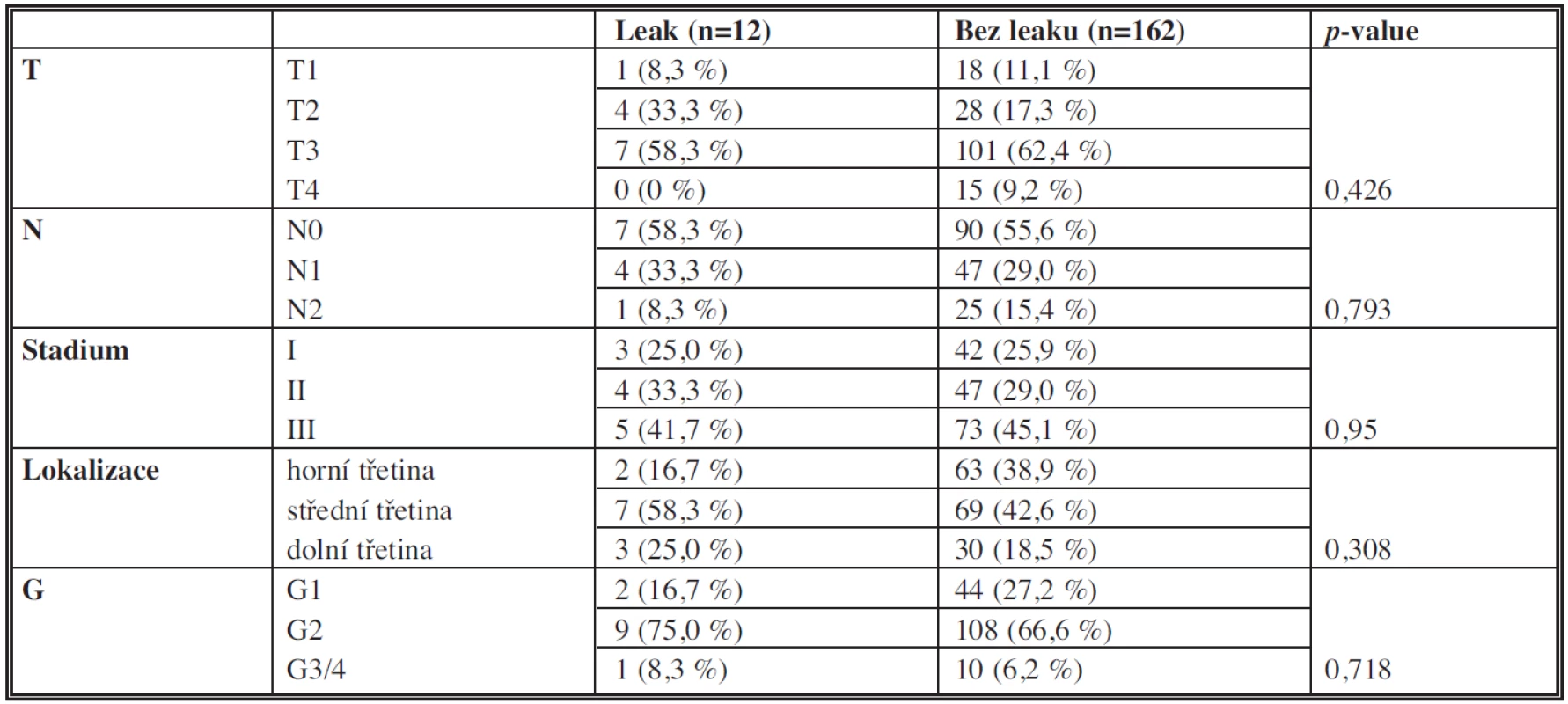
Četnost konverzí v případě laparoskopického přístupu byla 10,3 %. Předoperační neoadjuvantní terapie byla relativně častěji indikována ve skupině laparoskopicky operovaných pacientů (24,4 %) ve srovnání s otevřeně operovanou skupinou (18,4 %). V laparoskopické větvi studie byly resekční výkony zastoupeny v 71,8 %, amputace pak ve 28,2 %, v otevřené větvi studie byly resekční výkony provedeny v 64,3 %, amputační výkony pak ve 35,7 %.
Nebyl prokázán statisticky významný rozdíl (p=0,734) v počtu dehiscencí anastomóz ve skupině laparoskopicky operovaných pacientů (8 pacientů s dehiscencí anastomózy, 100 pacientů bez dehiscence anastomózy) a otevřeně operovaných pacientů (4 pacienti s dehiscencí anastomózy a 62 pacientů bez dehiscence anastomózy). Ve skupině pacientů s leakem byla ileostomie již při primární operaci založena ve 2 případech (16,7 %) a ve skupině pacientů bez leaku v 10 případech (6,2 %). V tomto parametru rovněž nebyl prokázán statisticky významný rozdíl (p=0,166).
Dehiscence anastomózy byla konzervativně řešena u 2 pacientů (16,7 %) a reoperací u 10 pacientů (83,3 %). V 8 případech byla založena ileostomie (80 %) a ve 2 případech doplněna amputace rekta (20 %).
Analýza celkového pětiletého přežívání, pětiletého přežívání bez známek onemocnění, vzniku lokálních, vzdálených a celkových recidiv vypočítané na základě Kaplan-Meierovy metodiky je uvedena v Tab. 3. Bylo zjištěno statisticky významné (p=0,019) zkrácení celkového přežívání ve skupině pacientů, u kterých došlo k dehiscenci anastomózy proti skupině bez dehiscentní anastomózy, stejně tak statisticky významné (p=0,047) zkrácení pětiletého přežívání bez známek onemocnění u pacientů s dehiscencí anastomózy. Signifikantně vyšší (p=0,049) byl i výskyt lokálních recidiv ve skupině pacientů s leakem.
Tab. 3. Pětileté celkové přežívání, přežívání bez známek onemocnění, recidivy Tab. 3: Five-year overall survival, disease-free survival, recurrence rate 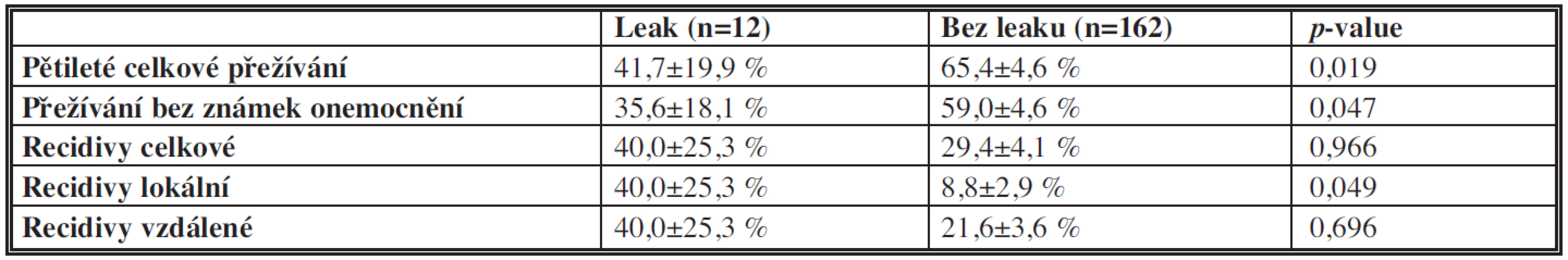
Pomocí Coxova modelu proporcionálního rizika byly identifikovány věk (p=0,043), N2 pozitivita lymfatických uzlin (p=0,001) a více než 3 podané krevní převody (p=0,001) jako statisticky významné faktory celkového přežívání po resekci pro karcinom rekta. Míra, s jakou tyto faktory ovlivní celkové přežití, je následující: zvýší-li se věk o rok, zvýší se riziko úmrtí 1,035krát (95 % CI 1,000–1,072). N2 pozitivita lymfatických uzlin zvyšuje riziko úmrtí 6,025krát (95 % CI 2,695–13,476) a více než 3 podané krevní převody zvyšují riziko úmrtí 5,784 (95 % CI 2,587–12,931). Na základě Coxova modelu nebyla dehiscence anastomózy identifikována jako faktor, který významně ovlivňuje celkové přežívání.
Jako významné prognostické faktory přežívání bez známek onemocnění po resekční léčbě pro karcinom rekta určil Coxův model N1 pozitivitu lymfatických uzlin (p=0,010), která zvyšuje riziko úmrtí nebo vzniku recidivy 2,279krát (95 % CI 1,214–4,277), dále N2 pozitivitu lymfatických uzlin (p=0,001), při které je riziko úmrtí nebo vzniku recidivy 5,501krát vyšší (95 % CI 2,735–11,067), a více než 3 podané krevní převody (p=0,002), které zvyšují riziko úmrtí nebo vzniku recidivy 3,296krát (95 % CI 1,567–6,930). Stejně jako u celkového přežívání ani u přežívání bez známek onemocnění Coxův model neurčil anastomotický leak jako prognostický faktor.
Co se týká lokálních recidiv, na základě Coxova modelu proporcionálního rizika byly identifikovány jako významné prognostické faktory anastomotický leak, který zvyšuje riziko vzniku lokální recidivy 6,621krát (95 % CI 1,289-34,020, p=0,024). Dále to byla nízká diferenciace tumoru (G3/4), která zvyšovala v našem souboru riziko vzniku lokální recidivy 12,661krát (95 % CI 2,275–70,468, p=0,004).
V případě vzdálených recidiv nebyl anastomotický leak identifikován jako statisticky významný prognostický faktor. Jako významný prognostický faktor byla označena pozitivita lymfatických uzlin. V případě N1 postižení riziko vzniku vzdálené recidivy bylo 3,666krát vyšší (95 % CI 1,545-8,701, p=0,003). U N2 postižení se riziko zvyšuje 6,227krát (95 % CI 2,446–15,854, p≤0,001).
Diskuze
Dehiscence anastomózy po resekčních výkonech pro karcinom rekta mají závažný dopad nejen na bezprostřední pooperační období, kdy se v důsledku těžkých septických stavů zvyšuje pooperační morbidita a letalita, prodlužuje se doba pooperační hospitalizace [17], ale je ovlivněno i zahájení následné onkologické léčby. Stejně závažný je dopad dehiscence anastomózy na výsledky onkologické. V důsledku zlepšení perioperační péče totiž stále více pacientů přežije septické komplikace spojené s anastomotickým leakem, a tudíž se dlouhodobé onkologické výsledky u skupiny těchto pacientů stávají předmětem mnoha studií.
Z hlediska celkového přežití a přežití bez známek onemocnění je některými autory [18] anastomotický leak považován za nezávislý prognostický faktor. Lin [18] uvádí pětileté přežití ve skupině pacientů bez dehiscence anastomózy 74,2 % a ve skupině pacientů s dehiscentní anastomózou 52,9 %. Tento rozdíl vykazuje známky statistické významnosti. Rovněž prokázal statisticky významné zkrácení přežívání bez známek onemocnění u pacientů s anastomotickým leakem (52,2 %) proti pacientům bez této komplikace (76,2 %). Naopak v jiných publikovaných pracích stejně jako v našem souboru pacientů nebyla dehiscence anastomózy analyzována jako nezávislý prognostický faktor [24].
V souvislosti s anastomotickým leakem je závažná zejména problematika lokálních recidiv karcinomu rekta. Vznik lokálních recidiv je obecně spojován se stadiem primárního tumoru, jeho histologickou diferenciací, typem provedené operace, přítomnosti obstrukce či perforace v době operace, vzdáleností resekčních linií, venózní invazí, adjuvantní terapií a v neposlední řadě i zkušeností chirurga. 36–80 % těchto recidiv je detekováno v prvních 2 letech po operaci [18,21]. Pouze 30–50 % lokálních recidiv je indikováno k chirurgické intervenci, přičemž R0 resekce je možná jen u 8–37 % [21] a jen 20–30 % pacientů přežívá bez tumoru 5 let [21].
Vznik lokálních recidiv v souvislosti s anastomotickým leakem je vysvětlován přítomností viabilních nádorových buněk ve střevním lumen nebo ve staplerové linii, čímž v případě dehiscence anastomózy vzrůstá riziko vzniku mikrometastáz [23]. Dále septický stav, spojený s leakem vede k akcelerované systémové zánětlivé odpovědi a uvolněné prozánětlivé cytokiny mohou způsobit růst reziduálních či implantovaných nádorových buněk.
Ve většině publikovaných prací ve shodě s námi provedenou analýzou je anastomotický leak po kurativních resekcích pro adenokarcinom rekta nezávislým rizikovým faktorem vzniku lokální recidivy [17,19,21]. V práci Junga [16] byla incidence celkových recidiv 19,9 %, lokálních recidiv 3,7 % a kromě anastomotického leaku se častěji recidivy vyskytovaly v případě postižení lymfatických uzlin a lymfovaskulární invaze. Rovněž Law (25) publikoval statisticky vyšší výskyt lokálních recidiv u pacientů s leakem (12,9 %) ve srovnání s pacienty bez leaku (5,7 %).
Existují ale práce, ve kterých netěsnost anastomózy nebyla spojena se statisticky významným vyšším výskytem lokálních recidiv [24]. Multicentrická studie, na které se podílelo 5 evropských zemí [26], nezjistila korelaci mezi anastomotickým leakem a lokálními či vzdálenými recidivami, ale bylo zjištěno statisticky významné zkrácení celkového přežívání i přežívání bez známek onemocnění u skupiny pacientů s leakem.
Pozornost je věnována i srovnání skupin pacientů, u kterých byl leak léčen konzervativně nebo chirurgicky. Jörgren [27] nezjistil rozdíl v počtu lokálních ani vzdálených recidiv mezi oběma skupinami pacientů. Naproti tomu v práci Ptoka [21], u pacientů s anastomotickým leakem, kteří potřebovali chirurgickou reintervenci, byla vyšší četnost lokálních recidiv (17,5 % versus 10,1 %). Pacienti s leakem, u kterých nebyla indikována reoperace, nevykazovali horší onkologické výsledky.
Vzhledem k závažnému negativnímu dopadu anastomotického leaku zejména na problematiku lokálních recidiv je důležitá problematika nejen prevence jeho vzniku, ale i jeho včasná diagnostika a včasná a správně indikovaná intervence.
Obecně známým cílem a zlatým standardem je v případě resekčních výkonů na rektu vytvořit dobře prokrvenou anastomózu bez napětí. Proto někteří autoři doporučují rutinní mobilizaci lienální flexury. Např. Karanjia [28] publikoval výsledky své práce, kde se anastomotický leak objevuje ve 22 %, pokud není lienální flexura plně mobilizovaná, ve srovnání s 9 % při plné mobilizaci. Dalším argumentem pro mobilizaci lienální flexury je, že plně mobilizované levé kolon vyplní pánev, čímž zlepší hemostázu a tím snižuje riziko vzniku pánevního abscesu. Stejně tak je samozřejmostí provedení intraoperační zkoušky těsnosti [18].
Naopak nebylo zjištěno, že omentoplastika redukuje četnost dehiscencí anastomóz na rektu, tudíž se rutinně nepoužívá [20]. Sporné jsou i názory na peritonealizaci pánevního dna. Samotný výkon neredukuje četnost leaku, ale na druhé straně může zánětlivý proces ohraničit na pánev bez vzniku difuzní peritonitidy. Pánevní absces pak u indikovaných pacientů může být řešen bez reoperace, drenáží pod CT kontrolou [20].
Drenáž po nízké resekci rekta má nejen signální funkci, ale zároveň může být součástí konzervativní terapie leaku. Správně umístěný drén může být prevencí vzniku hematomu v pánvi, jehož infekce vede ke vzniku pánevního abscesu, který může arodovat anastomózu. Peeters [29] zjistil, že potřeba chirurgických reintervencí při leaku je signifikantně nižší u pacientů s existující pánevní drenáží než u pacientů bez ní.
Kontroverzní nadále zůstává otázka, zda u všech pacientů s anastomózou v oblasti středního a dolního rekta má být provedena pojistná stomie, či k jejímu založení má být přistupováno selektivně [6,17]. Law [30] hodnotil soubor 196 pacientů s totální mezorektální excizí pro karcinom rekta a prokázal statisticky významnou redukci klinického leaku při založení pojistné stomie. Karanjia [28] rovněž prokázal zvýšený leak u pacientů bez protektivní stomie (18 % versus 8 %), a proto doporučuje založit pojistnou stomii vždy, když je anastomóza v menší vzdálenosti než 6 cm od anokutánní linie. Ale byly publikovány i práce [31], které doporučují k založení pojistné stomie přistupovat selektivně, neboť rekonstrukce vyžaduje další operaci a s ní spojenou morbiditu a letalitu. Založení pojistné stomie je doporučováno, když intraoperační zkouška prokáže netěsnost.
Na našem pracovišti indikujeme založení pojistné stomie u pacientů s tumory lokalizovanými v oblasti střední a dolní třetiny rekta, u pacientů po neoadjuvantní terapii a pokud vzduchová zkouška pod vodní hladinou prokáže netěsnost.
Závěrem lze říci, že dehiscence anastomózy po sfinkter šetřících operacích je závažnou komplikací, která negativně ovlivňuje jak bezprostřední pooperační průběh, tak dlouhodobé onkologické výsledky, zejména četnost lokálních recidiv.
MUDr. Petra Guňková, Ph.D.
Dlouhá 7
736 01 Havířov
e-mail: gunkovap@volny.cz
Zdroje
1. Komen N, Dijk JW, Lalmahomed Z, Klop K, Hop W, Kleinrensink GJ, Jeckel H, Schouten WR, Lange JF. After - hours colorectal surgery: a risk factor for anastomotic leakage. Int J Colorectal Dis 2009;24 : 789–795.
2. Taflampas P, Christodoulakis M, Tsiftsis DD. Anastomotic leakage after low anterior resection for rectal cancer. facts, obscurity and fiction. Surg Today 2009;39 : 183–188.
3. Wang L, Gu J. Risk factors for symptomatic anastomotic leakage after low anterior resection for rectal cancer with 30 Gy/10f/2 in preoperative radiotherapy. World J Surg 2010;34 : 1080–1085.
4. Walker KG, Bell SW, Rickard MJ, Mehanna D, Dent OF, Chapuis PH, Bokey EL. Anastomotic leakage is predictive of diminished survival after potentially curative resection for colorectal cancer. Ann Surg 2004;240 : 255–259.
5. Lim M, Akhtar S, Sasapu K, Harris K, Burke D, Sagar P, Finan P. Clinical and subclinical leaks after low colorectal anastomosis: a clinical and radiologic study. Dis Colon Rectum 2006;49 : 1611–1619.
6. Kanellos D, Pramateftakis MG, Vrakas G, Demetriades H, Kanellos I, Mantzoros I, Agelopoulos S, Lazaridis C. Anastomotic leakage following low anterior resection for rectal cancer. Tech Coloproctol 2010;14 : 35–37.
7. Kruechewski M, Rieger H, Pohlen U, Hotz HG, Buhr HJ. Risk factors for clinical anastomotic leakage and postoperative mortality in elective surgery for rectal cancer. Int J Colorectal Dis 2007;22 : 919–927.
8. Gastinger I, Marusch F, Steinert R, Wolff S, Koeckerling F, Lippert H. Protective defunctioning stoma in low anterior resection for rectal carcinoma. Br J Surg 2005;92 : 1137–1142.
9. Novák P, Liška V, Třeška V, Kopalová J, Vyčítal O, Brůha J. Klinické prognostické faktory kolorektálního karcinomu po jeho radikální léčbě. Rozhl Chir 2012;91 : 219–222.
10. Borowski DW, Kelly SB, Bradburn DM, Wilson RG, Guan A, Ratcliffe AA. Impact of surgeon volume and specialization on short - term outcomes in colorectal cancer surgery. Br J Surg 2007;94 : 880–889.
11. Jesus EC, Karliczek A, Matos D, Castro AA, Atallah AN. Prophylactic anastomotic drainage for colorectal surgery. Cochrane Database syst Rev 2004;18,4:CD002100.
12. Kim NK, Kim YW, Min BS, Lee KY, Sohn SK, Cho CH. Operative safety and oncologic outcomes of anal sphincter - preserving surgery with mesorectal excision for rectal cancer: 931 consecutive patients treated at a single institution. Ann Surg Oncol 2009;16 : 900–909.
13. Shin US, Kim CW, Yu CS, Kim JC. Delayed anastomotic leakage following sphincter - preserving surgery for rectal cancer. Int J Colorectal Dis 2010;25 : 843–849.
14. MacRae HM, McLeod RS. Handsewn vs stapled anastomoses in colon and rectal surgery: a meta-amalysis. Dis Colon Rectum 1998;41 : 180–189.
15. Lustosa SA, Matos D, Atallah AN, Castro AA. Stapled versus handsewn methods for colorectal anastomosis surgery: a systematic review of randomized controlled trials. Sao Paulo Med J 2002;120,5 : 132–136.
16. Jung SH, Yu CS, Choi PW, Kim DD, Park IJ, Kim HC, Kim JC. Risk factors and oncologic impact of anastomotic leakage after rectal cancer surgery. Dis Colon Rectum 2008;51 : 902–908.
17. McArdle CS, McMillan DC, Hole DJ. Impact of anastomotic leakage on long - term survival of patients undergoing curative resection for colorectal cancer. Br J Surg 2005;92 : 1150–1154.
18. Lin JK, Yueh TCh, Chang SC, Lin CC, Lan YT, Wang HS, Yang SH, Jiang JK, Chen WS, Lin TC. The influence of fecal diversion and anastomotic leakage on survival after resection of rectal cancer. J Gastrointest Surg 2011;15 : 2251–2261.
19. Branagan G, Finnis D. Prognosis after anastomotic leakage in colorectal surgery. Dis Colon Rectum 2005;48 : 1021–1026.
20. Mantzoros I. Oncologic impact of anastomotic leakage after low anterior resection for rectal cancer. Tech Coloproctol 2010;14 (Suppl 1):S39–S41.
21. Ptok H, Marusch F, Meyer F, Schuber D, Gastinger I, Lippert H. Impact of anastomotic leakage on oncological outcome after rectal cancer resection. Br J Surg 2007;94 : 1548–1554.
22. Bell SW, Walker KG, Rickard MJ, Sinclair G, Dent OF, Chapuis PH, Bokey EL. Anastomotic leakage after curative anterior resection results in a higher prevalence of local recurrence. Br J Surg 2003;90 : 1261–1266.
23. Park IJ. Influence of anastomotic leakage on oncological outcome in patients with rectal cancer. J Gastrointest Surg 2010; 14 : 1190–1196.
24. Lee WS, Yun SH, Roh YN, Yun HR, Lee WY, Cho YB, Chun HK. Risk factors and clinical outcome for anastomotic leakage after total mesorectal excision for rectal cancer. World J Surg 2008;32 : 1124–1129.
25. Law WL, Choi HK, Lee YM, Ho JW, Seto CL. Anastomotic leakage is associated with poor long - term outcome in patients after curative colorectal resection for malignancy. J Gastrointest Surg 2007;11 : 8–15.
26. den Dulk M, Marijnen CA, Collette L. Multicentre analysis of oncological and survival outcomes following anastomotic leakage after rectal cancer surgery. Br J Surg 2009;96 : 1066–1075.
27. Jörgren F, Johansson R, Damber L, Lindmark G. Anastomotic leakage after surgery for rectal cancer: a risk factor for local recurrence, distant metastasis and reduced cancer - specific survival? Colorectal Dis 2011;13,3 : 272–83.
28. Karanjia ND, Corder AP, Bearn P, Heald RJ. Leakage from stapled low anastomosis after total mesorectal excision for carcinoma of the rectum. Br J Surg 1994;81 : 1224–1226.
29. Peeters K, Tollenar RA, Marijnen CA, Kranenbarg E, Steup WH, Wiggers T. Risk factors for anastomotic failure after total mesorectal excision of rectal cancer. Br J Surg 2005;92 : 211–216.
30. Law WI, Chu KW, Ho JW, Chan CW. Risk factors for anastomotic leakage after low anterior resection with total mesorectal excision. Am J Surg 2000;179 : 92–96.
31. Valero G, Lujan JA, Hernandez Q, De Las Heras M, Pellicer M, Serrana A. Neoadjuvant radiation and chemotherapy in rectal cancer does not increase postoperative complications. Int J Colorectal Dis 2003;18 : 495–499.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Intenzivní péče v chirurgiiČlánek Elektrotrauma
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2013 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Intenzivní péče v chirurgii
- Vakuová drenáž jako varianta terapie infektu cévní infrainguinální protetické rekonstrukce – zkušenosti z našeho pracoviště a shrnutí problematiky
- Vliv dehiscence anastomózy na onkologické výsledky u resekčních výkonů pro karcinom rekta
- Hodnocení lymfatických uzlin v resekátech tlustého střeva s kolorektálním karcinomem
- Artrodéza ramene zevním fixatérem v léčbě chronických zánětlivých komplikací zlomenin proximálního humeru
- Zemřel profesor Jindřich Šebor
- Břišní aktinomykóza – 3 kazuistiky a přehled literatury
- Významné životní jubileum profesora Jana Schütznera
- Několik poznámek k současným principům léčby termických úrazů
- Chirurgické výkony v léčbě popáleninového traumatu
- Možnosti náhrady kože v 21. storočí
- Současné podmínky přípravy a použití biologických kožních krytů pro léčbu popálenin v České republice
- Kožní náhrada Integra® v klinické praxi
- Elektrotrauma
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Chirurgické výkony v léčbě popáleninového traumatu
- Hodnocení lymfatických uzlin v resekátech tlustého střeva s kolorektálním karcinomem
- Elektrotrauma
- Kožní náhrada Integra® v klinické praxi
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



