-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vakuová drenáž jako varianta terapie infektu cévní infrainguinální protetické rekonstrukce – zkušenosti z našeho pracoviště a shrnutí problematiky
Vacuum-assisted closure as a treatment modality for infrainguinal vascular prosthetic graft infection: our experience and take-home message
Introduction:
Infection of the prosthetic graft represents one of the biggest challenges for practising vascular surgeons. The patient is jeopardized with possible future limb loss or, in the most serious cases, even death due to this complication. The incidence in the infrainguinal area amounts to a maximum of 6% of all arterial surgical procedures.Material and methods:
Between January 2010 and December 2011, the authors performed a total of 689 vascular surgical reconstructions, of which 311 were performed in the infrainguinal area where 7 cases (2.25%) of graft infection occurred.Results:
None of the patients died or lost a limb due to this complication. Two patients with an infected infrainguinal prosthetic graft were successfully treated with vacuum-assisted closure (VAC) system.Conclusion:
The prosthetic vascular graft infection is the most feared complication in vascular surgery. The generally recognized principles of the traditional surgical approach are well-known and widely accepted. However, in selected cases of infrainguinal vascular prosthetic infection, both the affected limb and the patent graft may be saved and successfully treated with the use of vacuum-assisted closure.Key words:
prosthetic graft infection – infection in vascular surgery – vacuum-assisted closure – VAC
Autoři: M. Pirkl 1,2; T. Daněk 1; Michal Černý 1
; A. Formelová 1
Působiště autorů: Oddělení cévní a plastické chirurgie, Chirurgická klinika, Pardubická krajská nemocnice, a. s. přednosta: Doc. MUDr. J. Šiller, PhD. 1; Fakulta zdravotnických studií Univerzity Pardubice, děkan: prof. MUDr. A. Pellant, DrSc. 2
Vyšlo v časopise: Rozhl. Chir., 2013, roč. 92, č. 5, s. 237-245.
Kategorie: Souhrnné sdělení
Souhrn
Úvod:
Infekce cévní protézy je jednou z největších výzev, se kterou se cévní chirurg ve svém praktickém životě potýká. Nemocného tato komplikace ohrožuje ztrátou revaskularizované oblasti (nejčastěji dolní končetiny), v závažnějších případech přímo na životě. Incidence se pohybuje v infrainguinální oblasti do 6 %.Materiál a metodika:
V období 01/2010–12/2011 bylo na pracovišti autorů provedeno celkem 689 tepenných chirurgických rekonstrukcí, z toho 311 v infrainguinální oblasti s výskytem 7 případů (2,25 %) infekce cévní protézy.Výsledky:
Žádný nemocný v souvislosti s touto komplikací nezemřel ani nepřišel o končetinu. Dva pacienti byli úspěšně léčeni semikonzervativně pomocí lokální vakuové drenáže.Závěr:
Protetický infekt představuje nejzávažnější komplikaci v cévní chirurgii. Její tradiční léčba se řídí obecně přijatými chirurgickými postupy, spočívajícími zpravidla v částečném či úplném odstranění infikovaného implantátu. V konkrétních případech ale lze v infrainguinální oblasti docílit záchrany končetiny a vyléčení této komplikace pomocí vakuové drenáže při ponechání protetického materiálu a zachování průchodnosti původního bypassu.Klíčová slova:
infekt protetického bypassu – infekce v cévní chirurgii – vakuově asistovaná drenáž – VACÚvod
Incidence infektů cévních protéz se pohybuje mezi 1 a 6 % v pětiletém sledování a narůstá s distálním umístěním periferního napojení. Udávaná incidence se tak u aortoilických rekonstrukcí pohybuje mezi 0,5 a 1 %, u aortofemorálních bypassů do 2,5 % a u infrainguinálních pak stoupá k 6 % [1]. Antibiotická perioperační profylaxe je jediným prokázaným mechanismem snížení rizika infektu cévní protézy [2].
Infekce cévní protézy představuje závažný medicínský i lidský problém pro lékaře i pacienta. Důsledky pro nemocného s infektem infrainguinálně umístěného protetického bypassu mohou být děsivé, měřeno literárními údaji: 30–41% riziko ztráty končetiny a až 18% mortalita [3].
Materiál a metodika
Soubor nemocných
V období 01/2010–12/2011 bylo na pracovišti autorů provedeno celkem 689 cévních tepenných chirurgických rekonstrukcí, z toho 311 v infrainguinální oblasti s výskytem 7 případů (2,25 %) infekce cévní protézy. Žádný z nemocných v souvislosti s touto komplikací nezemřel ani nepřišel o končetinu. Dva z nemocných byli úspěšně léčeni semikonzervativně pomocí vakuové drenáže při ponechání průchodné původně infikované protetické rekonstrukce.
Kazuistika 1
Devětapadesátiletý pacient s léčenou arteriální hypertenzí a s bohatou vaskulární anamnézou (st.p. PTA společné pánevní tepny vpravo a následně st.p. rePTA a stentu, st.p. femoropopliteálním proximálním protetickém bypassu polyesterovou pletenou protézou (Polymaille® C, Perouse Medical, Francie) oboustranně před 2 a 3 roky – podle dokumentace byl perioperační průběh při všech cévních rekonstrukcích a intervencích bez jakýchkoliv komplikací) byl přijat na naše oddělení v 07/11 (tedy 19 měsíců od cévní rekonstrukce) pro periprotetický infekt bypassu vpravo.Vstupně byl pacient se septickými teplotními špičkami, schvácený, v lokálním nálezu pak dominovalo zarudnutí a otok proximálního stehna vpravo s maximem medioventrálně, kde byl sonograficky průkazný periprotetický lem tekutiny. Bypass byl průchodný, periferie prokrvená s pulzacemi na pedálních tepnách. Nález byl verifikován punkcí a aspirací hnisu. Nemocný byl v den přijetí indikován k operaci a byla nasazena zprvu empirická, později zacílená ATB terapie (kultivačně Stapphylococcus aureus). Při operační revizi byl nalezen lokalizovaný periprotetický infekt pletené protézy při proximální části Hunterova kanálu, kde byl asi 7 cm dlouhý úsek protézy nevhojen. Větší část protézy byla pevně překryta jizevnatou tkání a vhojena (Obr. 1). Provedli jsme debridement a k protéze jsme zavedli proplachové drény, jimiž byla následně abscesová dutina lavážována roztokem Betadinu. Za této terapie došlo k rychlému ústupu celkové alterace stavu nemocného, který byl dále afebrilní, bez známek pokračující sepse. Po třech dnech pak lokální nález umožnil aplikaci vakuové drenáže. Použili jsme systém VivanoTec™ (Hartmann, SRN) a nevhojenou část protézy překryli houbou WhiteFoam™ (K.C.I., USA). Aplikovali jsme kontinuální podtlak 125 mmHg podle platných doporučení. K dalšímu převazu a výměně systému jsme přistoupili po 4 dnech. Lokální nález byl velice příznivý ve smyslu přegranulovávání protetického materiálu, ústupu sekrece a laboratorně došlo ke snížení hodnot zánětlivých markerů. Kultivace z tohoto převazu již byly negativní. Při dalším převazu za dalších 5 dnů byla protéza bypassu prakticky přegranulována (Obr. 2), lokálně bez známek infektu. Mikrobiální kultivace vyšly negativně, a bylo tedy přistoupeno k sekundární sutuře rány s Redonovou drenáží (Obr. 3), která byla následně po 2 dnech odstraněna. Po celou dobu byl bypass průchodný, pacient afebrilní a nevyskytly se krvácivé ani jiné komplikace v souvislosti s vakuovou drenáží rány. Nemocný byl propuštěn do ambulantní péče 20. den hospitalizace. V antibiotické léčbě jsme pokračovali dalších 20 dnů (ciprofloxacin). Nemocný je dále sledován v cévní poradně a klinický obraz i výsledky laboratorních vyšetření nesvědčí pro pokračující nebo relabující infekční proces (Obr. 4). Na kontrolním CT AG po půl roce od propuštění byl bypass průchodný a nebyly známky periprotetického infiltrátu nebo tekutinové kolekce (Obr. 5).
Obr. 1. První převaz před naložením vakuové drenáže Fig. 1: The first revision before vacuum drainage application 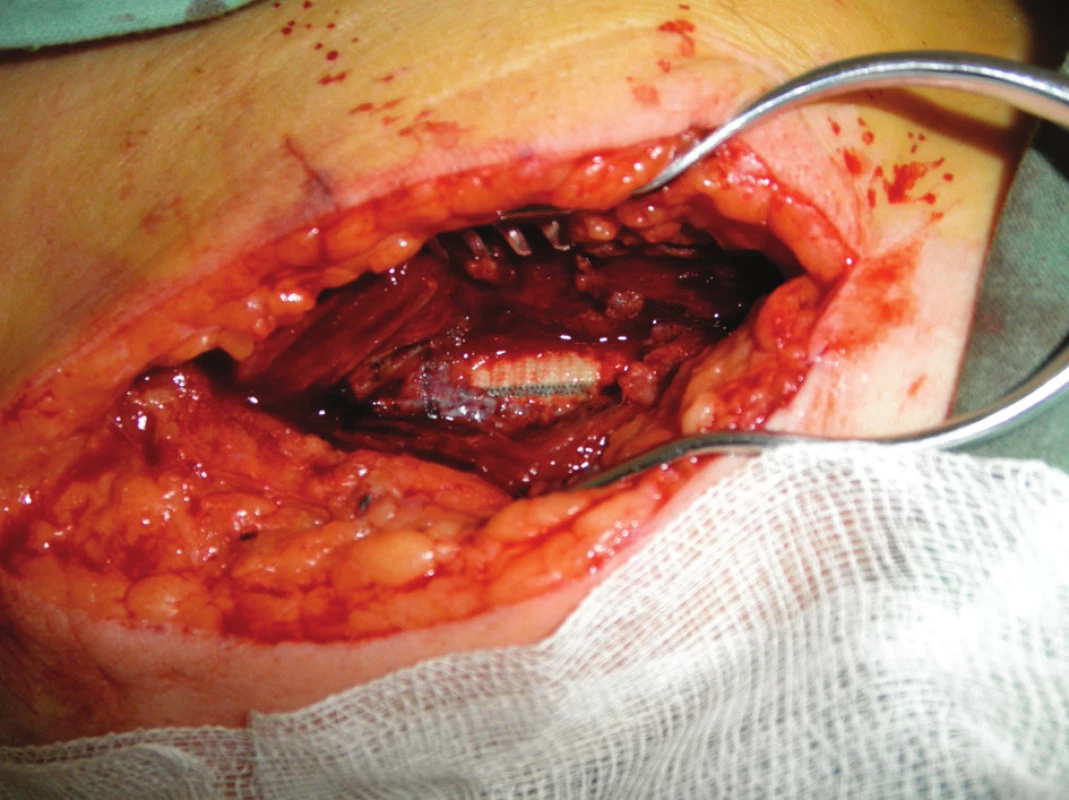
Obr. 2. Stav po 8 dnech aplikace vakuové drenáže Fig. 2: Result at 8 days following vacuum drainage application 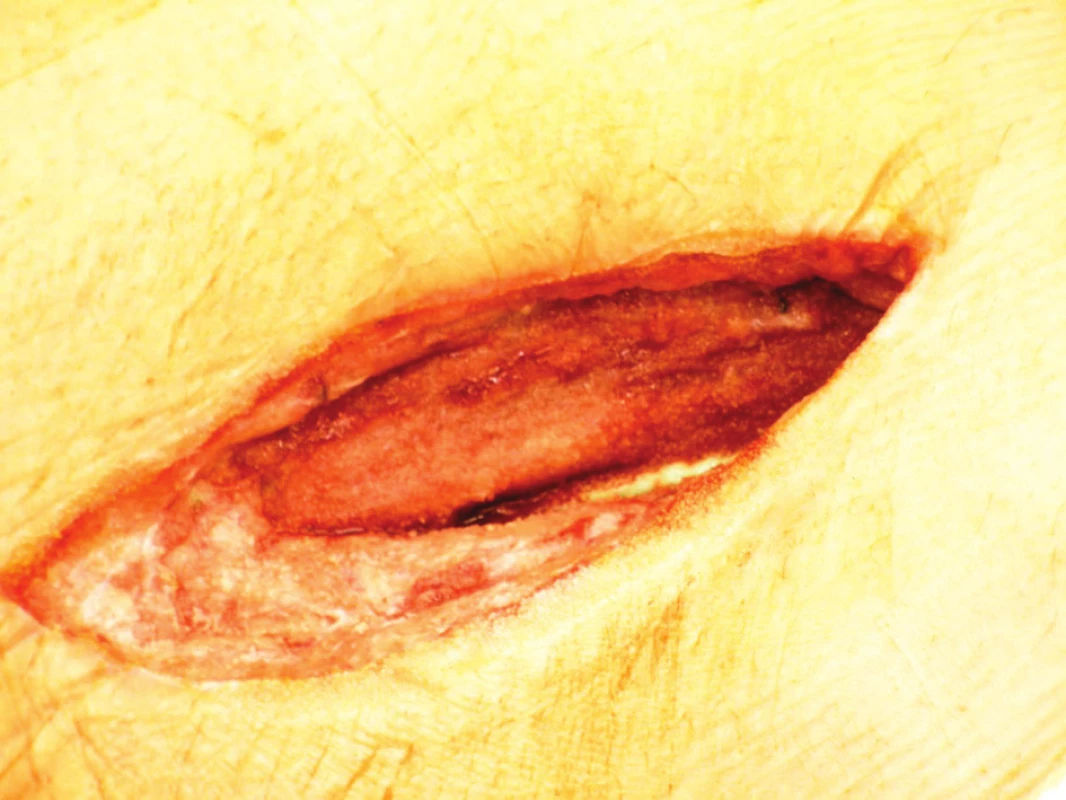
Obr. 3. Uzávěr rány s Redonovou drenáží Fig. 3: Closure of the wound using Redon´s drains 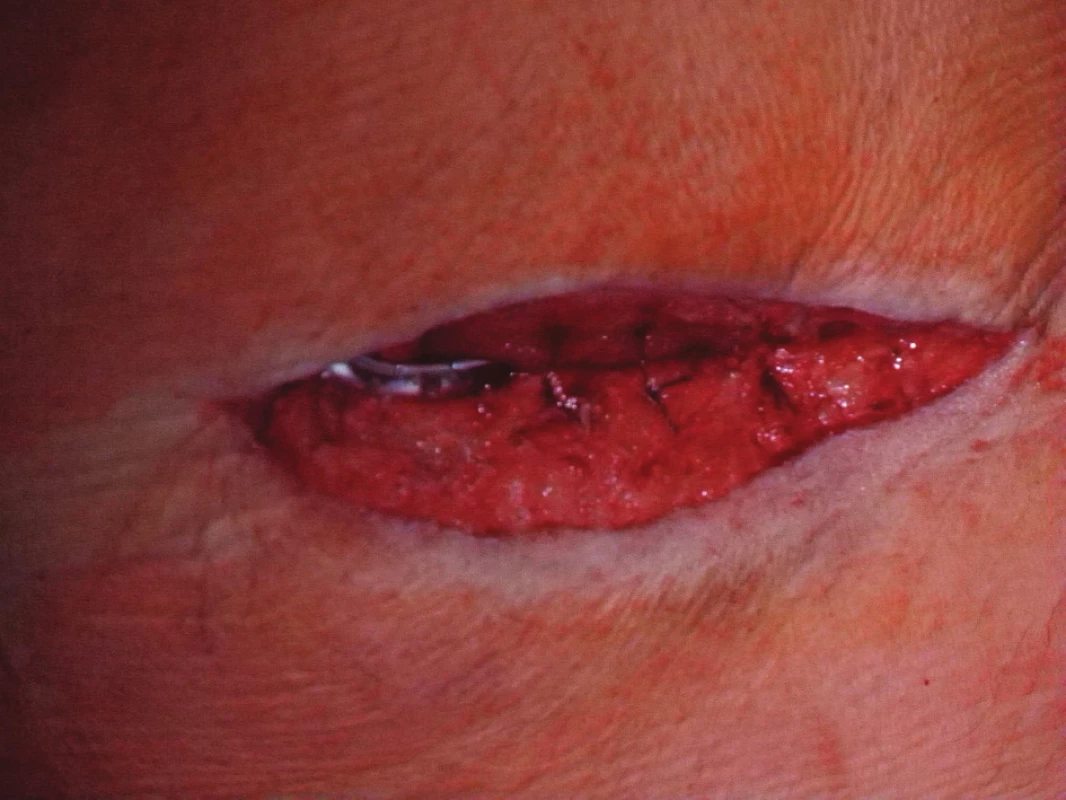
Obr. 4. Stav po půl roce Fig. 4: Result after six months 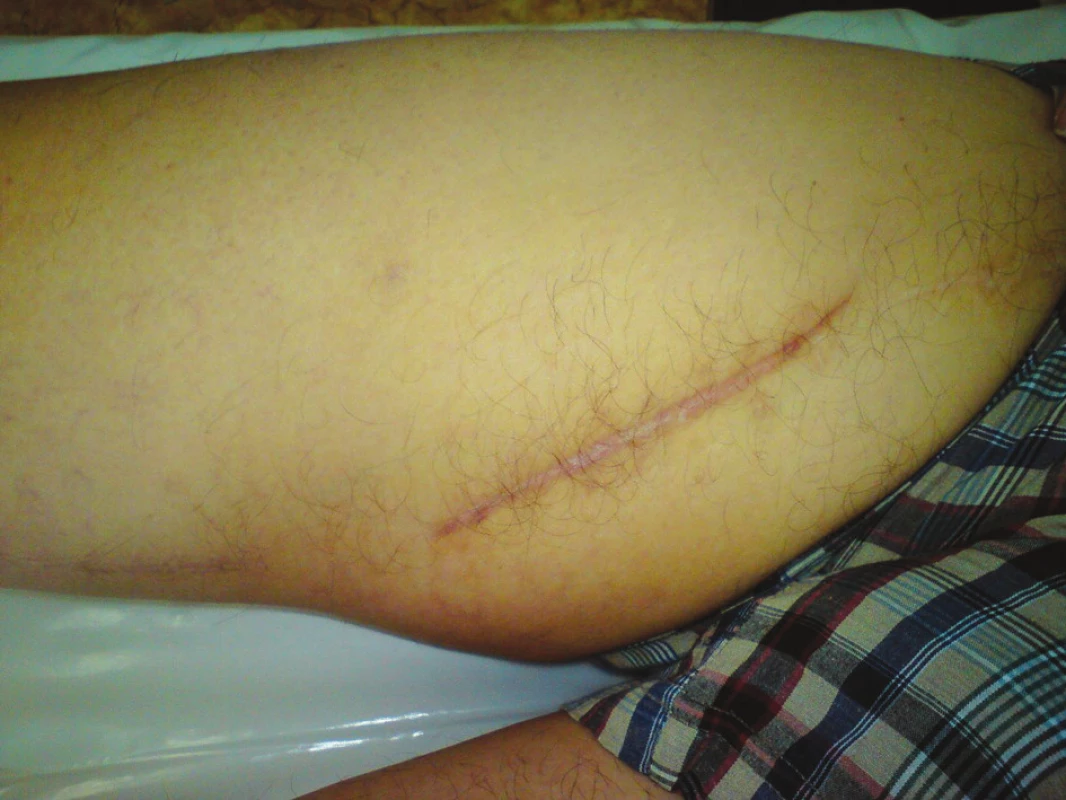
Obr. 5. CT AG dolních končetin po půl roce od infektu FP bypassu Fig. 5: CT angiogram of the lower limbs after 6 months following femoropopliteal bypass infection 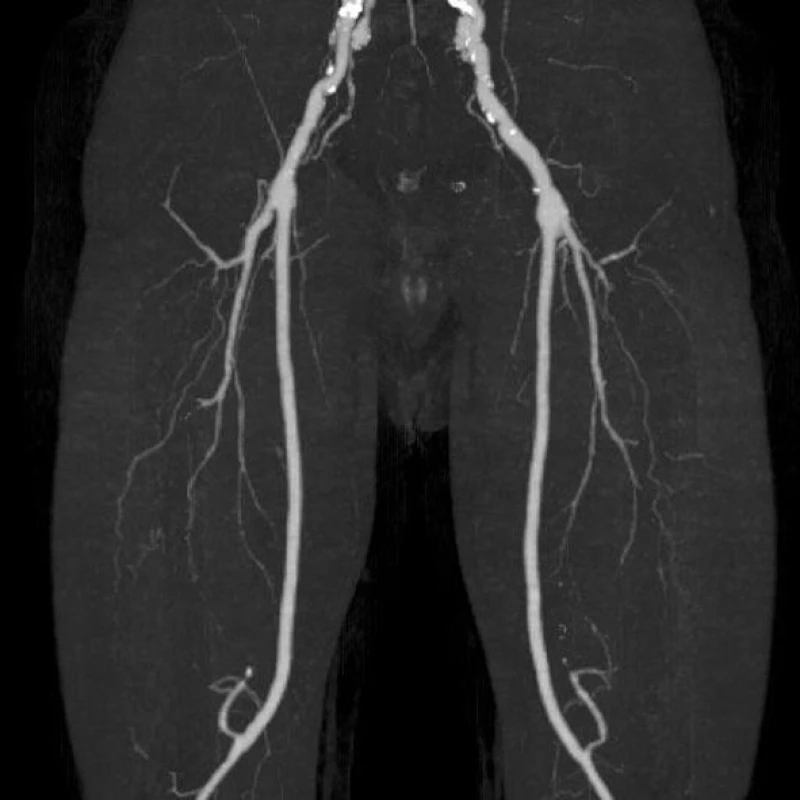
Kazuistika 2
Osmašedesátiletému nemocnému s anamnézou alkoholické hepatání léze, arteriální hypertenze a kuřácké bronchitidy byl na našem pracovišti v 02/12 proveden zvyklým způsobem (vč. ATB profylaxe) proximální femoropopliteální bypass polyesterovou pletenou cévní protézou (Polymaille® C, Perouse Medical, Francie) pro klaudikační stadium ICHDK Fontaine IIB. V pooperačním období se průběh komplikoval drobnou lymfatickou píštělí v distální operační ráně na mediální straně levého stehna. Mikrobiální kultivace byly opakovaně negativní a bylo postupováno konzervativně včetně ATB zajištění clindamycinem. V dalším průběhu došlo k zatažení píštěle. Pacient byl afebrilní, bypass průchodný s pulzacemi do periferie, lokálně i celkově bez známek zánětu a 15. pooperační den byl nemocný propuštěn v celkově dobrém stavu do domácí péče.
Nemocný byl přijat zpět na naše oddělení po 13 dnech od dimise se suspekcí na periprotetický infekt. Byl febrilní, bez celkové alterace, bypass byl průchodný, pulzace v periferii hmatné. Lokálně bylo v distální operační ráně, která byla jinak zhojena, zarudnutí a proteplení. Sonograficky byla vyjádřena suspekce na tekutinovou kolekci periproteticky, kterou jsme verifikovali punkcí a aspirací. Proto byl v den přijetí revidován, kdy jsme v distální ráně nalezli nevhojený úsek protézy v délce cca 10 cm. Zbylá část protézy byla v obou směrech překryta granulačně-jizevnatou tkání (Obr. 6). V periprotetickém serózním sekretu jsme kultivačně verifikovali Pseudomonas putrida masivně a Staphylococcus epidermidis. Byla provedena evakuace, drenáž a založena proplachová drenáž Betadinem, bypass byl ponechán in situ. Zprvu byla nasazena ATB terapie empiricky, následně cíleně podle výsledků kultivací. Následující den byl nemocnému do rány aplikován vakuový drenážní systém VivanoTec™ (Hartmann, SRN) s krytím protézy houbou WhiteFoam™ (K.C.I., USA) (Obr. 7). Bylo pokračováno v ATB terapii. Další převazy a výměny systému byly provedeny 2. a 6. den, přičemž během převazů jsme nalézali postupné přerůstání protézy granulacemi a ústup sekrece (Obr. 8). Kultivace od poslední výměny vakuového systému byly již opakovaně negativní. Pacient byl afebrilní, bypass průchodný, pulzace v periferii byly hmatné. Devátý den byl lokální nález při převazu natolik příznivý, že byla zrušena vakuová drenáž rány a byla provedena její sekundární sutura s Redonovou drenáží, která byla po dalších třech dnech odstraněna. Nemocný byl propuštěn do naší ambulantní péče po 15 dnech hospitalizace v celkově dobrém stavu, na měsíc ještě s perorálními antibiotiky (amoxiklav, doxycyklin). Nemocný dochází k dalším kontrolám do naší poradny, kde je celkově, lokálně i laboratorně bez známek relapsu infektu (Obr. 9), bypass je funkční, nemocný je bez klaudikací a na kontrolní CT AG po 5 měsících byl bez známek periprotetické tekutinové kolekce.
Obr. 6. První převaz před naložením vakuové drenáže Fig. 6: The first revision before vacuum drainage application 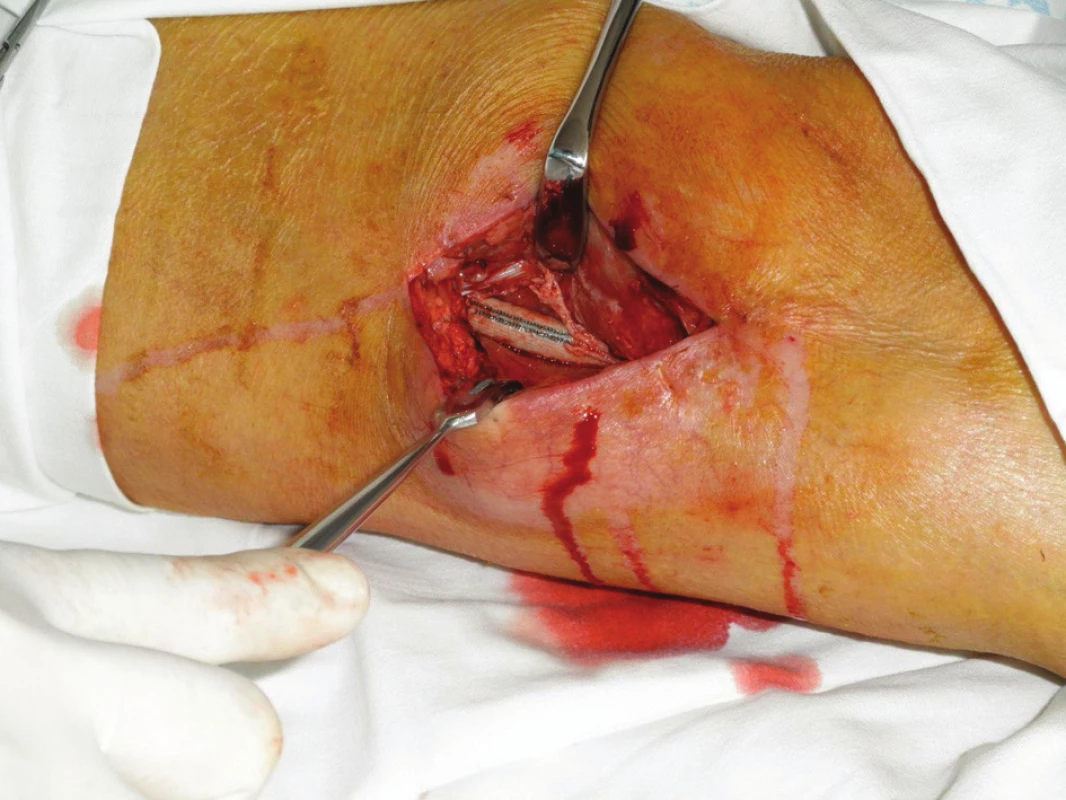
Obr. 7. Aplikace systému VivanoTec™, Hartmann, SRN Fig. 7: Application of the VivanoTec™ system, Hartmann, Germany 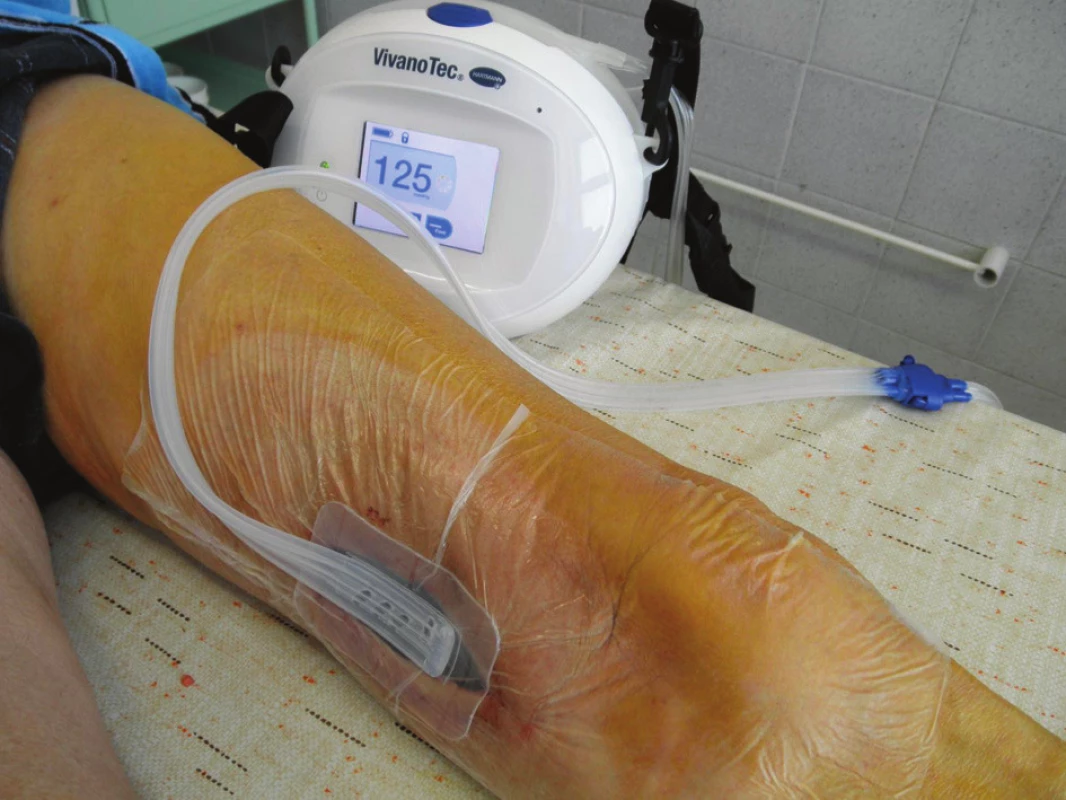
Obr. 8. Stav po 6 dnech aplikace vakuové drenáže Fig. 8: Result at 6 days following vacuum drainage application 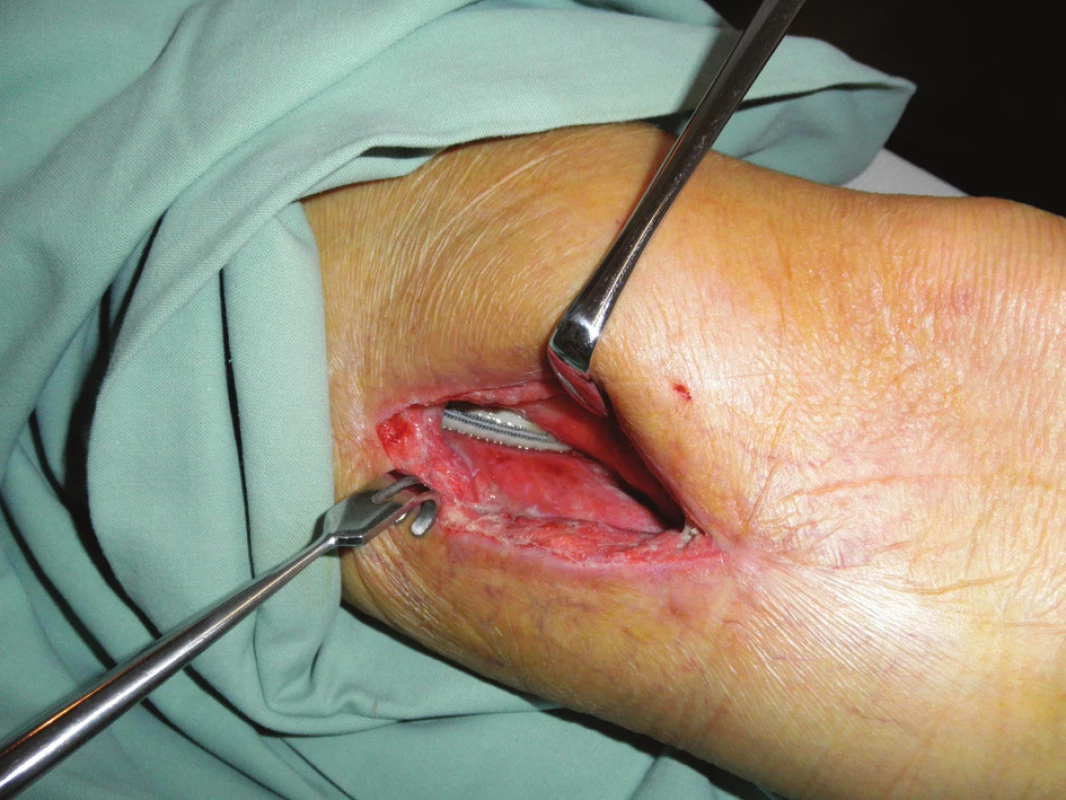
Obr. 9. Stav končetiny při propuštění Fig. 9: Condition of the limb at discharge 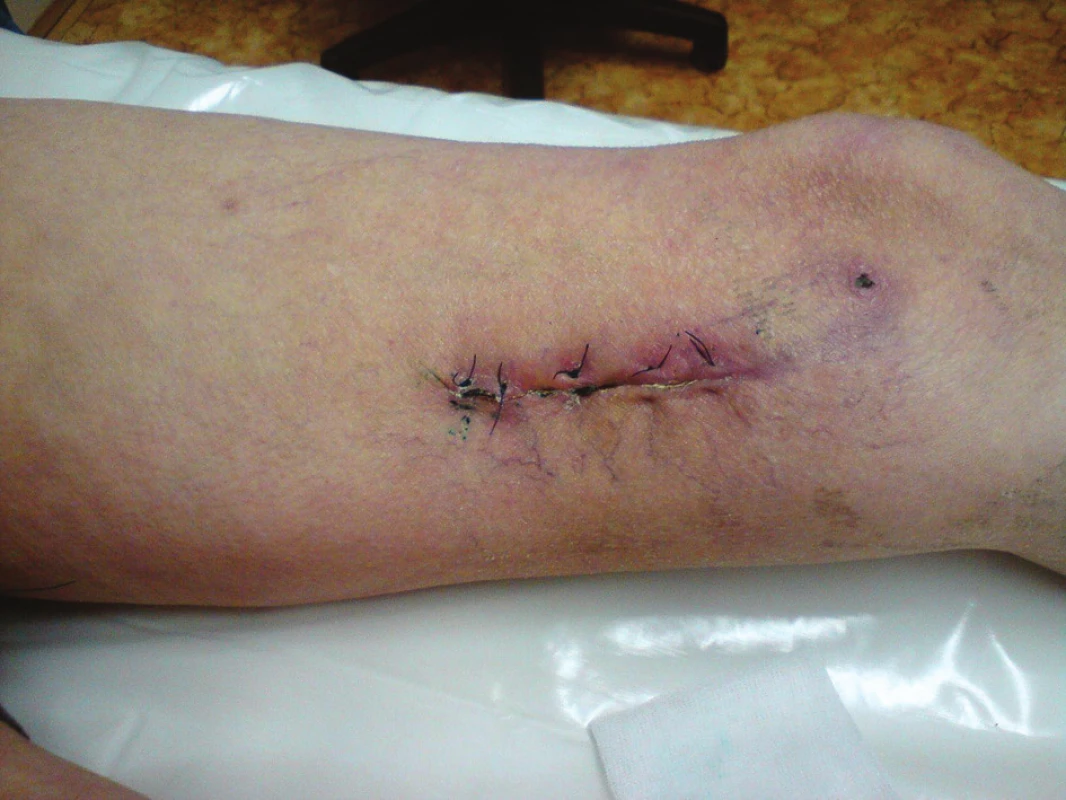
Diskuze
Etiologie
Původce infektu je nejčastěji inokulován perioperačně. Dále může dojít k infektu při operačních revizích a radiointervenčních výkonech [4]. Uvádí se i možnost inokulace v důsledku bakteriemie z jiné příčiny. Pravděpodobnost infektu cévní protézy stoupá tehdy, kdy je revaskularizována končetina s infektem, nebo když dojde v pooperačním období k hojení rány per secundam intentionem, v to počítaje případnou lymfatickou píštěl a hematom v operační ráně. Amputace dříve revaskularizované končetiny pomocí cévní protézy představuje další z rizik [5]. Mikrobiálně osídlené tromby nativního řečiště (literárně mezi 13–40 % případů) představují další možný zdroj [6]. K riziku protetické infekce přispívají závažná celková onemocnění s potenciálně imunosupresivním účinkem (diabetes mellitus a metabolický syndrom včetně obezity, neoplazie, chronické steroidní terapie, chronické renální insuficience apod.).
Jako významný faktor zvyšující pravděpodobnost infektu se jeví ten operační výkon, kde je incize lokalizována v třísle, kde je též největší procento sekundárních hojení ran. Toto jistě souvisí s častější bakteriální kolonizací v této lokalitě, častým výskytem různých tineí a intertriga – obzvlášť právě u diabetiků, obézních nemocných a starších lidí. Infektů ran a lymatických píštělí v ráně v třísle se literárně udává kolem 6,4 % [7]. Pět procent ran v tříslech se v cévně-rekonstrukční chirurgii komplikuje v intervalu 5 let falešnými výdutěmi nebo infektem [8].
V 60 % případů jsou za infekt graftu odpovědné Staphylococcus aureus, Staphylococus epidermidis a Escherichia coli, méně častí původci jsou pak např. pseudomonády, Klebsiella, Proteus, Enterobacter aj. Literární prameny udávají od 1/4 do 1/3 případů, kdy nebyl bakteriální původce infektu určen vůbec. Je známo, že např. Staphylococcus aureus vytváří na infikované ploše biofilm, který brání jeho úspěšnému kultivačnímu průkazu. Přes některé moderní techniky používané k izolaci patogenního kmene (UZ rozrušení biofilmu, genetická typizace...) se stále zdaleka neblížíme ke stoprocentní úspěšnosti určení etiologického agens [1,9].
Diagnostika
Diagnostika infektu cévní protézy je mnohdy velice svízelná. Relativně často je tato diagnóza stanovena až perioperačně při revizi pro uzávěr rekonstrukce nebo pro pseudoaneuryzmatickou formaci anastomózy. V anamnéze nemocného pátráme po přítomnosti trofického defektu končetiny při revaskularizaci, po předchozích invazivních výkonech se vstupem v tepenném povodí i po febrilních stavech. V klinickém obraze hledáme místní a celkové příznaky chronického zánětu či sepse, sledujeme hodnoty i dynamiku laboratorních markerů zánětu (KO včetně diferenciálního, CRP, PCT…). V případě krvácení do horního GIT je u pacientů s anastomózou umístěnou aortálně vždy nutno nejprve vyloučit aorto - (resp. protezo-) enterální (nejčastěji duodenální) píštěl [10]. Z běžných zobrazovacích metod lze zmínit jak UZ, CT AG, tak MR AG, kdy nás na možnost infektu upozorní především tekutinová periprotetická kolekce, případně s přítomným plynem a dále pseudoaneuryzma (PSA) anastomóz. Jak CT AG, tak MR AG mají kolem 96 % senzitivitu a 85–90 % specificitu [11]. Základní nevýhodou CT AG a MR AG je fakt, že nejsou schopny rozlišit sterilní tekutinovou kolekci od infikované. Ze zobrazovacích metod se v tomto ohledu nejslibněji jeví pozitronová emisní tomografie v kombinaci s CT s užitím (18-) fluorodeoxyglukózy (FDG-PET CT), která se zprvu osvědčila v diagnostice infektu měkkých a kostních tkání a následně se uplatnila i v diagnostice infekce cévních implantátů se senzitivitou 90 % a specificitou přesahující 96 % [12].
Prognóza nemocných
Prognóza nemocného a možnosti záchrany končetiny i zachování průchodné cévní protézy je odvislá od mnoha faktorů. Svou roli hrají zejména: celkový stav pacienta, přítomnost sepse či MODS, přidružená onemocnění, lokalizace a rozsah infektu, typ infikovaného graftu, časový odstup od implantace, průchodnost graftu, pokročilost aterosklerotického postižení a ovšemže původce infektu: gramnegativní bakterie bývají virulentnější (Pseudomonas) a klinický průběh zejména v případě kultivace několika bakteriálních kmenů těžší a stran možnosti záchovné operace málo nadějný. V těchto případech je zpravidla nutné odstranit celou cévní protézu [13]. Naopak větší naději pro zachování implantátu mají nemocní, u nichž je jako původce infektu izolován Staphylococcus epidermidis, či kde výsledky kultivačního vyšetření budou negativní [14].
Udává se, že ePTFE lité protézy jsou vůči infekci odolnější nežli protézy pletené či tkané z polyesterového vlákna [15]. Pro takové tvrzení nicméně neexistuje jednoznačná evidence [16].
Terapie
Terapie je zaměřená na dva cíle – zbavit organismus fokusu infektu a udržet oblast bypassem perfundovanou viabilní. Nejčastějším způsobem je přístup zcela chirurgický, kdy je excidován graft, provedeno debridement okolních tkání a nová revaskularizace cílového orgánu. Reperfuze cílového orgánu je možná buď in situ cévní rekonstrukcí, nebo extranatomicky. K autologní žilní rekonstrukci použijeme žilní štěp z povrchového systému (VSM, VSP, VB)[17] nebo z vena femoralis superficialis [18]. V centrech s dostupností tkáňových bank jsou pak s výhodou užívány kadaverózní arteriální čerstvé nebo kryoprezervované allografty [19]. Další možností je in situ rekonstrukce s užitím antibiotiky [20] nebo stříbrem impregnované cévní protézy; toto řešení je přípustné pouze jako nouzové či dočasné řešení v případech neprokázaného mikrobiálního původce nebo původce málo virulentního (Staphylococcus epidermidis aj.). Klasickou chirurgickou variantou obnovené revaskularizace cílového orgánu po explantaci infikované protézy jsou extraanatomické bypassy, především v případech infektu v aortoilické oblasti nebo v inguinální oblasti [21,22].
Další možností je lokální ošetření při zachování funkční protetické rekonstrukce spočívající v sanaci ložiska (nejčastěji v třísle), debridement a v případném překrytí ponechané cévní protézy svalovým lalokem z m. gracilis, m. rectus abdominis, m. sartorius apod. [23,24] či přesunutým lalokem z předstěry nebo z měkkých tkání břicha (Flag-flap) [25,26]. Samozřejmostí je ve všech případech intenzivní protišoková a antibiotická terapie. Rekurence infektu při ponechané cévní protéze se pohybuje kolem 18–35 %, přičemž jde většinou maximálně o střednědobá sledování [3,27].
Terapie s užitím VAC
Moderní metody využití různých lavážních systémů či vakuově asistovaných uzávěrů ran dnes nacházejí všestranné uplatnění v mnoha chirurgických oborech [28]. Vakuová drenáž jako modalita terapie chronické rány byla prvně publikována v roce 1997 [29] a od té doby zaznamenala tato léčebná metoda výrazné rozšíření i v České republice. Obecné principy jejího účinku jsou především: zvýšení hyperemie, podpora angioproliferace a růstu granulační tkáně, odvod exsudátu, transsudátu a proteolytických enzymů z rány, snížení bakteriální kontaminace a zachování principu vlhkého hojení rány [30].
Dnes tato metoda doznala širokého užití v oblasti léčby chronických ran různých etiologií, popálenin, v metodě uzávěru břišní stěny formou laparostomatu, v modifikované formě k léčbě entorokutánních píštělí, anastomotických leaků po nízkých resekcích rekta apod.
Hojně diskutována je i finanční stránka této terapie, jelikož vstupy při užití této metody jsou jednorázově vyšší, ale vzhledem k tomu, že převazy není nutné provádět denně či dokonce několikrát denně, jako je tomu u „klasického“ vlhkého ošetřování ran, celkové náklady na léčbu mohou být až poloviční a doba do zhojení až třetinová oproti hojení za užití „tradičních“ technik [30,31]. S definitivními závěry stran „cost-effectiveness“ bude nicméně nutné počkat na velkou randomizovanou studii [32].
Zkušeností s vakuovým systémem drenáže rány existuje relativně mnoho i v cévní chirurgii. Od léčby diabetických ulcerací při syndromu diabetické nohy až po ranné infekty. V terapii ranných komplikací s užitím VAC se však často tato technika v literárních souborech kombinuje ještě s překrytím cévní protézy svalovým lalokem [33,34]. Klinické údaje o přímé aplikaci vakuového drenážního systému na implantát jsou poměrně sporé [35,36]. Díky povrchnímu uložení může být tato metoda snadno užita u terapie infektu ePTFE arteriovenózního hemodialyzačního shuntu [37].
I podle údajů výrobců těchto systémů by se měla cévní protéza ještě krýt dalším k tomu speciálně určeným materiálem, který se vkládá pod polyuretanovou houbu, aby se zamezilo přímému působení podtlaku na pletivo implantátu. Z této indikace je doporučován kontinuální podtlak 125 mmHg, přičemž převazy a výměny systému by měly být prováděny v asi třídenních intervalech.
Největší soubor nemocných s infektem infrainguinálně uložené cévní protézy, léčených touto metodou, publikovali Svensson et al., kteří ve sledovaném období operovali 28 pacientů s celkem 33 rannými infekty v tříslech. V případě 21 umělých implantátů šlo 13krát o dacron a 8krát o ePTFE. 27 třísel (82 %) bylo zahojeno a 6 (18 %) ne. Dvakrát bylo zaznamenáno krvácení v asociaci s VAC a 4krát pozdní reinfekce (3krát u protetického materiálu a 1krát u autovenózního štěpu). V práci se autoři zabývají i finanční stránkou věci, kdy medián ceny za léčbu celkem se pohyboval kolem 26 000 eur, z čehož náklady na VAC činily 2,7 % z celkových nákladů [35].
Závěr
Závěrem lze postulovat určitá indikační kritéria, kdy pacient s infektem protetického bypassu v infrainguinální lokalitě může profitovat z užití VAC k terapii. Tu lze doporučit v následujících případech:
- časný infekt s rannou komplikací, nebo pozdní infekt s lokalizovaným postižením protetického materiálu,
- nesmí být postižena anastomóza,
- graft musí být samozřejmě průchodný,
- nejsou pseudoaneuryzmatické formace,
- nejsou vyjádřeny krvácivé komplikace v ráně,
- dobrý stav pacienta s rychle zvládnutou sepsí, bez šoku,
- relativně méně virulentní agens.
Při nezvládnutí infektu nebo při krvácivé komplikaci, která je nejspíše největším rizikem tohoto postupu, je nevyhnutné chirurgické řešení podle všech zvyklostí. V dlouhodobém horizontu je pak obávaným možným důsledkem paliativního postupu pozdní relaps infektu.
Seznam užitých zkratek:
PTA – perkutánní transluminální angioplastika
CT AG – CT angiografie
MR AG – angiografie magnetickou rezonancí
KO – krevní obraz
CRP – C-reaktivní protein
PCT – prokalcitonin
MODS – Multiple organ dysfunction syndrome
VSM – vena saphena magna
VSP – vena saphena parva
VB – vena basilica
VAC – vakuum-assisted closure
ICHDK – ischemická choroba dolních končetin
UZ – ultrazvuk
FP bypass – femoropopliteální bypass
MUDr. Miloslav Pirkl
Šafaříkova 682
534 01 Holice
e-mail: miloslav.pirkl@nemocnice-pardubice.cz
Zdroje
1. Seeger JM. Management of patients with prostehtic vascular graft infection. Am Surg 2000;66 : 166–77.
2. Stewart A, Eyers PS, Earnshaw JJ. Prevention of infection in arterial reconstruction. Cochrane Database Of Systematic Reviews. 2006;3.
3. McCready RA, Bryant A, Divelbiss J, Wack MF, Mattison HR. Case Study: Chronic femoropopliteal prosthetic graft infection with exposed graft. Vasc Endovasc Surg 2009;43,3 : 291–294.
4. Kolakowski S Jr, Dougherty MJ, Calligaro KD. Does the timing of reoperation influence the risk of graft infection? J Vasc Surg 2007;45,1 : 60–4.
5. Brothers TE, Robison JG, Elliott BM. Predictors of prosthetic graft infection after infrainguinal bypass. J Am Coll Surg 2009;208,4 : 557–61.
6. Yeager RA, Porter JM. Arterial and prosthetic graft infection, Ann Vasc Surg 1992;6 : 485–91.
7. Newington DP, Houghton PWJ, Baird RN, Horrocks M. Groin wound infection after arterial surgery. Br J Surg 1991;78 : 617–9.
8. Exton RJ, Galland RB. Major groin complications following the use of synthetic grafts. Eur J Vasc Endovasc Surg 2007;34 : 188–90.
9. Frei E, Hodgkiss-Harlow K, Rossi PJ, Edmisson CE Jr, Bandyk DF. Microbial pathogenesis of bacterial biofilms: A causative factor of vascular surgical site infection. Vasc Endovasc Surg 2011;45,8 : 688–96.
10. Swain TW, Calligaro KD, Gougherty MD, Management of infected aortic prosthetic graft. Vasc Endovasc Surg 2004;38,1 : 75–82.
11. Bandyk DF. Infection in prosthetic vascular grafts. In: Rutherford RB. Vascular Surgery. Philadelphia, WB Saunders 2000 : 733–751.
12. Spacek M, Belohlavek O, Votrubova J, Sebesta P, Stadler P. Diagnostics of „non-acute“ vascular prothesis infection using 18F-FDG PET/CT: our experience with 96 prostheses. 2009;36 : 850–8.
13. Calligaro KD, Veith FJ, Schwartz ML, Dougherty MJ, DeLaurentis DA. Differences in early versus late extracavitary arterial graft infections. J Vasc Surg 1995;22 : 680–8.
14. Bandyk DF, Novotney ML, Back MR, Johnson BL, Schmacht DC. Expanded application of in situ replacement for prosthetic graft infection. J Vasc Surg 2001;34,3 : 411–9.
15. Miller JH. Partial replacement of an infected arterial graft by new prosthetic polytetrafluoroethylene segment: a new therapeutic option, J Vasc Surg 1993;17 : 546–58.
16. Carbonell AM, Matthews BD, Dreau D, Foster M, Austin CE, Kercher KW, Sing RF, Heniford BT. The susceptibility of prosthetic biomaterials to infection. Surg Endosc 2005;19 : 430–5.
17. Barbon B, Militello C, DeRossi A, Martella B, Ballotta E. Autologous great saphenous vein tailored graft to replace an infected prosthetic graft in the groin. Vasc Endovasc Surg 2007; 41,4 : 358–61.
18. Kaczynski J, Gibbons CP. Experience with femoral vein grafts for infra-inguinal bypass. Eur J Vasc Endovasc Surg 2011; 41,5 : 676–8.
19. Šebesta P, Štádler P, Šedivý P, Zdráhal P, El Samman K, Jindrák V, Syrůček M. Radikální operace infekce cévní protézy v aortofemorální pozici s pomocí čerstvého tepenného allograftu: naše střednědobé zkušenosti. Rozhl Chir 2011;90,1 : 4–13.
20. Topel I, Audebert F, Betz T, Steinbaeur MG. Microbial spectrum and primary resistance to rifampicin in infectious compliactions in vascular surgery: Limits to the use of rifampicin-bonded prosthetic grafts. Angiology 2010;61,5 : 423–6.
21. Patel A, Taylor SM, Langan EM, Snyder BA, Cull DL, Sullivan TM, et al. Obturator bypass: A classic aproach for the treatment of contemporary groin infection. Am Surg 2002;68,8 : 653–9.
22. Engin C, Posacioglu H, Ayik F, Apaydin AZ. Management of vascular infection in the groin. Texas Heart Institute Journal 2005;32,4 : 529–34.
23. Schutzer R, Hingorani A, Ascher E, Markevich N, Kallakuri S, Jacob T. Early transposition of the sartorius muscle for exposed patent infrainguinal bypass grafts. Vas Endovas Surg 2005;39,2 : 159–62.
24. Seify H, Moyer HR, Jones GE, Busquets A, Brown K, Salam A, Losken A, Culbertson J, Hester TR. The role of muscle flaps in wound salvage after vascular graft infections: the Emory experience. Plast Reconstr Surg 2006;117,4 : 1325–33.
25. Impellizzeri P, Dardik H, Shah HJ, Brotman-O’Neil, Ibrahim IM. Vacuum-assisted closure therapy with omental transposition for salvage of infected prosthetic femoral-distal bypass involving the femoral anastomosis. J Vasc Surg 2011;54,4 : 1154–6.
26. Fodor M, Fodor L, Ciuce C. Simultaneous extra-anatomic bypass and abdominal flag flap for lower limb salvage in a patient with severe post-bypass anastomotic groin infection. Acta Chir Belg 2008;108,6 : 738–40.
27. Taylor SM, Weatherford DA, Langan EM, Lokey JS. Outcomes in the management of vascular prostethic graft infections confined to the groin: a reappraisal. Ann Vasc Surg 1996;10 : 117–22.
28. Pinocy J, Albes JM, Wicke C, Ruck P, Ziemer G. Treatment of periprosthetic soft tissue infection of the groin fllowing vascular surgical procedures by means of a polyvinyl alcohol-vacuum sponge system. Wound Rep Reg 2003;11 : 104–9.
29. Morykwas MJ, et al. Vacuum assisted closure: a new method for wound control and treatment: animal studies and basic foundation. Ann Plast Surg 1997;38 : 553–562.
30. Lambert KV, Hayes P, McCarthy M. Vacuum assisted closure: A review of development and current applications. Eur J Vasc Endovasc Surg 2005;29 : 219–26.
31. Philbeck TE, et al. The clinical and cost effectiveness of externally applied negative pressure wound therapy in the treatment of wounds in home healthcare medicare patients. Ostomy Wound Manag 1999;45,11 : 41–50.
32. Vikatmaa P, Juutilainen V, Kuukasjarvi P, Malmivaara A. Negative pressure wounf therapy: A systematic review on effectiveness and safety. Eur J Vasc Endovascr Surg 2008;36 : 438–48.
33. Colwell AS, Donaldson MC, Belkin M, Orgill DP. Management of early groin vascular bypass graft infections with sartorius and rectus femoris flaps. Ann Plast Surg 2004;52 : 49–53.
34. Kotsis T, Lioupis C. Use of vacuum assisted closure in vascular graft infection confined to the groin. Acta Chir Belg 2007;107 : 37–44.
35. Svensson S, Monsen C, Kolbel T, Acosta S. Predictors for Outcome after Vacuum Assisted Closure Therapy of Peri-vascular Surgical Site Infections in the Groin. Eur J Vasc Endovasc Surg 2008;36 : 84–89.
36. Delaney KO, Smead W, Gordillo GM. Vacuum assisted closure of an exposed prosthetic femoral graft. OPUS 12 Scientist 2008;2,4 : 1–3.
37. Vallet C, et al. Vacuum-assisted conservative treatment for the management and salvage of exposed prosthetic hemodialysis access. Eur J Vasc Endovasc Surg 2004;28 : 397–9.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Intenzivní péče v chirurgiiČlánek Elektrotrauma
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2013 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Intenzivní péče v chirurgii
- Vakuová drenáž jako varianta terapie infektu cévní infrainguinální protetické rekonstrukce – zkušenosti z našeho pracoviště a shrnutí problematiky
- Vliv dehiscence anastomózy na onkologické výsledky u resekčních výkonů pro karcinom rekta
- Hodnocení lymfatických uzlin v resekátech tlustého střeva s kolorektálním karcinomem
- Artrodéza ramene zevním fixatérem v léčbě chronických zánětlivých komplikací zlomenin proximálního humeru
- Zemřel profesor Jindřich Šebor
- Břišní aktinomykóza – 3 kazuistiky a přehled literatury
- Významné životní jubileum profesora Jana Schütznera
- Několik poznámek k současným principům léčby termických úrazů
- Chirurgické výkony v léčbě popáleninového traumatu
- Možnosti náhrady kože v 21. storočí
- Současné podmínky přípravy a použití biologických kožních krytů pro léčbu popálenin v České republice
- Kožní náhrada Integra® v klinické praxi
- Elektrotrauma
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Chirurgické výkony v léčbě popáleninového traumatu
- Hodnocení lymfatických uzlin v resekátech tlustého střeva s kolorektálním karcinomem
- Elektrotrauma
- Kožní náhrada Integra® v klinické praxi
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



