-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaMetalothionein a jeho vztah k protinádorové léčbě na bázi platinových komplexů
Metallothionein and its relation to anticancer treatment by platinum complexes
Metallothionein:
It is a small protein with high content of cysteine, whose sulfhydryl groups give metallothionein its unique properties. In organism metallothionein transports metal ions (Zn, Cu), but it can even bind and eliminate toxic metal ions (Cd, Pb, Hg, etc.). Metallothionein helps to cells handle oxidative stress and it regulates level of expression and enzymatic activity.Cytostatics based on platinum:
This type of cytostatics belongs to the oldest and most used. They are based on platinum complexes with changing ligands. The oldest member of this group, cisplatine, has more effective analogues (platinum complexes of second and third generation, carboplatin and oxaliplatin, and new are under development). Nevertheless cisplatin is still widely used. At some patients it developed phenomena of resistance of tumour cells, which of course lower effectiveness of treatment.Induction of resistance and its mechanisms:
Resistance of tumour cell to cytostatics is complex process which involves many mechanisms. Some of them are relatively known to us; first of all it is regulation of intracellular concentration of drug and its efflux, complexation by intracellular thiols (glutathione and metallothionein) and mechanisms for repairing of damaged DNA.Conclusion:
Research of this problems progresses very quickly and new information wait ahead us not only about influence of metallothionein on induction of resistance. It is one of preconditions for more effective treatment and understanding of metabolism of tumour disease.Key words:
Metallothionein, cisplatin, resistance, tumour disease.
Autoři: I. Fabrik 1; J. Kukačka 2; V. Adam 1; R. Průša 2; T. Eckschlager 3; R. Kizek 1
Působiště autorů: Laboratoř molekulární biochemie a bioelektrochemie Ústav chemie a biochemie, Mendelova zemědělská a lesnická univerzita Brno Děkan: prof. Ing. Ladislav Zeman, CSc. 1; Ústav klinické biochemie a patobiochemie II. LF UK, Praha Přednosta: prof. MUDr. Richard Průša, CSc. 2; Klinika dětské hematologie a onkologie II. LF UK, Praha Přednosta: prof. MUDr. Jan Starý, DrSc. 3
Vyšlo v časopise: Prakt. Lék. 2008; 88(2): 90-93
Kategorie: Postgraduální vzdělávání
Souhrn
Metalothionein:
Jedná se o malý protein s vysokým obsahem cysteinu, jehož sulfhydrylové skupiny mu propůjčují unikátní vlastnosti. V organismu se stará o transport iontů kovů (Zn, Cu), má ale i detoxikační funkci, protože dokáže vázat i toxické těžké kovy (Cd, Pb, Hg aj.). Buňkám pomáhá také zvládat oxidativní stres a reguluje hladinu exprese či enzymatickou aktivitu.Cytostatika na bázi platiny:
Tento typ cytostatik patří k nejdéle používaným a nejúčinnějším. Zakládají se na komplexech platiny s obměňováním ligandů. Nejstarší zástupce, cisplatina, má dnes již účinnější analogy (léčiva druhé a třetí generace, karboplatinu a oxaliplatinu, a ve vývoji jsou další), nicméně stále je hojně využívána. U některých nemocných se ale vyskytuje fenomén rezistence nádorových buněk, což samozřejmě snižuje efektivitu léčby.Vznik rezistence a její mechanismy:
Rezistence nádorových buněk vůči cytostatikům je komplexní děj, který v sobě zahrnuje několik mechanismů. Z nám známých to jsou především regulace intracelulární koncentrace léku a jeho eflux, komplexace intracelulárními thioly (glutathion, metalothionein) a mechanismy pro reparaci poškozené DNA.Závěr:
Výzkumy v této problematice postupují velice rychle a jistě se dočkáme mnoha zlomových poznatků, nejen o zapojení metalothioneinu do vzniku rezistence. Je to jedna z podmínek pro efektivnější zvládnutí léčby a pochopení metabolismu nádorového onemocnění.Klíčová slova:
Metalothionein, cisplatina, rezistence, nádorové onemocnění.Metalothionein
Metalothionein náleží do rodiny metaloproteinů, které jsou široce rozšířeny v živočišné říši, nicméně podobné typy proteinů byly popsány i u bakterií rostlin a hub. Metalothioneiny popsali poprvé Margoshes a Valee v roce 1957, kteří je izolovali z koňských ledvin (1). Existuje spousta izoforem, ale strukturní rysy jsou v drtivé většině stejné. Jedná se o nízkomolekulární (6-10 kDa) na cysteiny bohaté proteiny, které neobsahují žádné aromatické aminokyseliny. Primární struktura je založena na určité repetici motivů, v nichž hlavní roli hraje aminokyselina cystein. Takto jsou vytvořena dvě rezidua, která vytváří cysteinové klastry. První z nich, β doména, má vazebné místo pro tři ionty dvojmocných kovů, druhá α doména potom až pro čtyři ionty. Celkově je tedy metalothionein schopen vázat až 7 dvojmocných iontů nebo 12 jednomocných (2).
Metalothionein se v organismech vyskytuje v několika izoformách;
- MT-1,
- MT-2,
- MT-3, a
- MT-4 ( ).
Široce rozšířené jsou především izoformy MT-1 a MT-2, přičemž zastoupení formy MT-2 ve tkáních je častější; forma MT-3 je nejhojněji exprimována v moz-ko-vé tkáni (4). Nejméně prozkoumanou formou je MT-4, výskyt genů ukazuje na její výskyt v šupinkovém epitelu (5). In vitro bylo prokázáno, že buňky mají schopnost sekrece forem MT-1 a MT-2 (6).
Funkce metalothioneinu
Funkcí má metalothionein mnoho. Předně je to významný přenašeč iontů kovů, jak již bylo naznačeno v úvodu. Nejčastěji váže Zn, ale velkou afinitu má i k Cu, čímž udržuje homeostatickou hladinu těchto kovů v organismu (7). V případě Cu tímto také reguluje hladinu radikálů kyslíku vzniklých Fentonovou reakcí (8). Při výskytu toxických kovů v organismu je metalothionein schopen je navázat a přenést na místo detoxikace, s největší pravděpodobností do ledvin (9). Tímto mechanismem je tělo schopno se bránit proti iontům Cd, Hg, Pb a dalších těžkých kovů.
MT má také významnou antioxidativní roli. Spolu s GSH vytváří oxidačně redukční dvojici, která reguluje výskyt volných kyslíkových radikálů. Napomáhá tak chránit nukleové kyseliny před účinky ionizujícího záření, fosfolipidy membrán před oxidací a zajišťuje pro buňku redukční prostředí (10, 11, 12). V nedávné době bylo poukázáno též na regulační vlastnosti MT. Jakožto nosič Zn a Cu může sloužit jako zásobník těchto kovů pro důležité transkripční faktory a apoenzymy účastnící se v expresi proteinů (například p53) (13–16).
Exprese metalothioneinu
Regulace exprese metalothioneinu je také spjata s výskytem iontů kovů. Transkripce do mRNA je zahájena po navázání MTF-1 (metal-regulatory transcription factor-1), což je zinkový prst o hmotnosti okolo 70-80 kDa, na MRE (metal responsive element), který leží na promotoru genu pro metalothionein (17, 18, 19). Za normálních okolností je na MTF-1 navázán MTI, což je inhibitor, který zabraňuje navázání MTF-1 na MRE. Po vstupu iontu kovu do intracelulárního prostoru buňky se vytvoří vazba mezi tímto iontem a MTI. Tím se MTF-1 uvolní a indukuje expresi metalothioneinu (19). Tohoto faktu se využívá například při treatmentu intoxikace těžkým kovem, kdy je pacientovi podáván zinek, který takto aktivuje expresi genu pro metalothionein, a ten je poté schopen vyvazovat zdroj intoxikace (20).
Metalothionein a nádorová onemocnění
Vztah metalothioneinu k nádorovému onemocnění nebyl doposud uspokojivě osvětlen, nicméně protein hraje roli v kancerogenezi. Při experimentech s MT-1/MT-2 knockout myšmi bylo ukázáno, že jsou citlivější k indukci nádorového onemocnění způsobeným olovem než běžní jedinci (21). V mnoha studiích byla zkoumána hladina metalothioneinu v závislosti na lokalizaci nádorového onemocnění, stádia a klasifikace nemoci, stáří pacientů a mnoha jiných faktorech. Takto bylo zjištěno, že buňky nádorů vzešlých z paraxiálního mesodermu (osteosarkom, aj.) a z entodermu (karcinomy jater, močového měchýře, tračníku, aj.) mají gen pro MT-1E v indukované formě a gen pro MT-1F je inhibován.
Opačná situace panuje u nádorů ektodermálního (karcinom mléčné žlázy, aj.), středně mezodermálního (karcinom ledvin, aj.) a laterálně mezodermálního (zhoubný nádor lymfatické tkáně) původu. Všechno nasvědčuje tomu, že zvýšená exprese metalothioneinů u pacientů s indukovaným genem pro MT-1F ukazuje na zhoršenou prognózu a overexprese u pacientů s indukovaným genem pro MT-1E naopak na lepší prognostické vyhlídky (22).
Cytostatika na bázi platiny
Účinky nejznámějšího zástupce této skupiny látek, cisplatiny (cis-diammindichlorplatnatý komplex), byly objeveny náhodou, když Rosenberg a van Camp zkoumali vliv elektrického proudu na kolonii mikroorganismů (E. coli) (23). Pro materiál elektrod zvolili platinu a po několika pokusech pozorovali, že mikroorganismy se již nedělí. Výzkumníci zjistili, že je to způsobeno cisplatinou, která vznikala elektrolýzou platinových elektrod. Následně se Rosenberg rozhodl vyzkoušet cytostatické vlastnosti této látky na krysách se sarkomem a výsledky potvrdily, že ji účinky řadí mezi nejlepší cytostatika té doby
Mechanismus účinku cisplatiny
Uběhlo téměř 50 let od pozorování efektu cisplatiny na buňky, ale ani to nemění nic na faktu, že je dodnes hojně využívána. Nicméně kvůli mnoha vedlejším efektům léčby je dnes pomalu vytlačována deriváty platnatých komplexů druhé generace, jako je karboplatina či ještě nověji komplex třetí generace, kam se řadí oxaliplatina (obr. 1).
Obr. 1. Strukturní vzorce platnatých komplexů využívaných jako cytostatika (a) cisplatina, (b) karboplatina, (c)oxaliplatina. 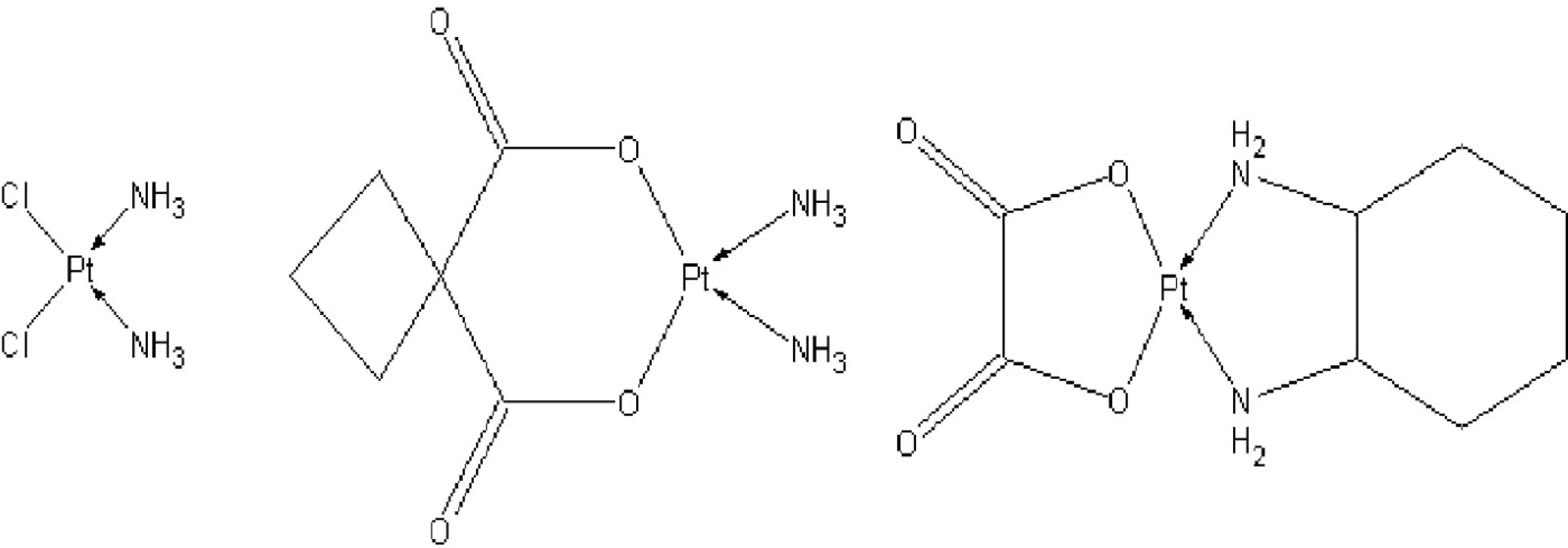
V čem spočívá léčebný efekt této látky? Mnoho studií se tímto jevem zaobíralo, takže dnes máme relativně ucelené znalosti problematiky. Komplex cisplatiny jako takový nemá cytostatické účinky, nicméně po vstupu do buňky, děje se tak přes membránový transport, se hydrolyzují vazby Pt-Cl a vytvoří se aqua platnaté komplexy, které následně za odštěpení H+ iontů vytvoří diammindihydroxyplatnatý komplex, který se již cytotoxickou aktivitou vyznačuje (obr. 2).
Obr. 2. Schéma aktivace cisplatiny po vstupu do buňky (hydrolýza vazeb Pt-Cl) 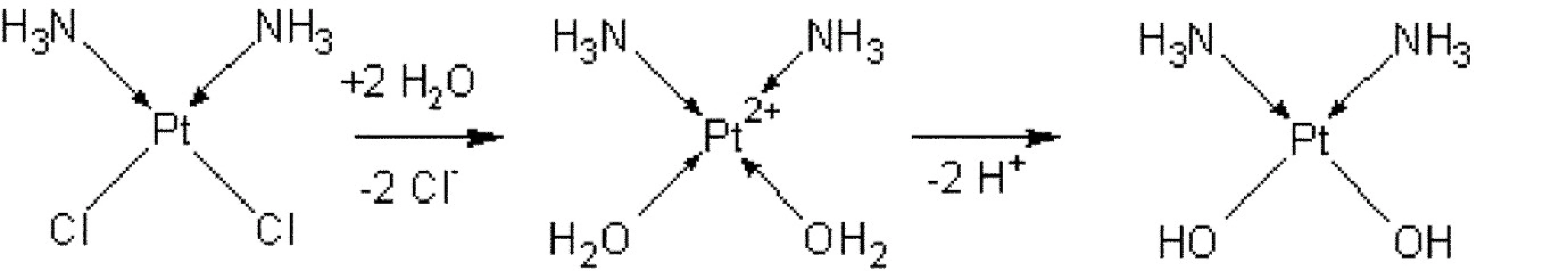
Aktivovaná cisplatina je elektrofil, který ochotně reaguje s DNA, zejména s purinovými bázemi a kovalentně se na ně váže za tvorby DNA aduktů (24). Bylo popsáno několik DNA-ciplatinových komplexů, nicméně nejhojnější se zdá být komplex ciplatiny a dvou sousedních guaninů – až 65 % (obr. 3) (25). Tím je znemožněna replikace DNA. Za zmínku stojí také fakt, že transizomer cisplatiny (trans-diammindichlorplatnatý komplex) není schopen vytvářet DNA-adukty jako cisizomer a v praxi se v chemoterapii nevyužívá. Důvodem je vznik odlišných DNA aduktů, které nejsou pro funkci buňky tolik závažné.
Obr. 3. Navázání cisplatiny na dva guaniny sousedící v DNA struktuře 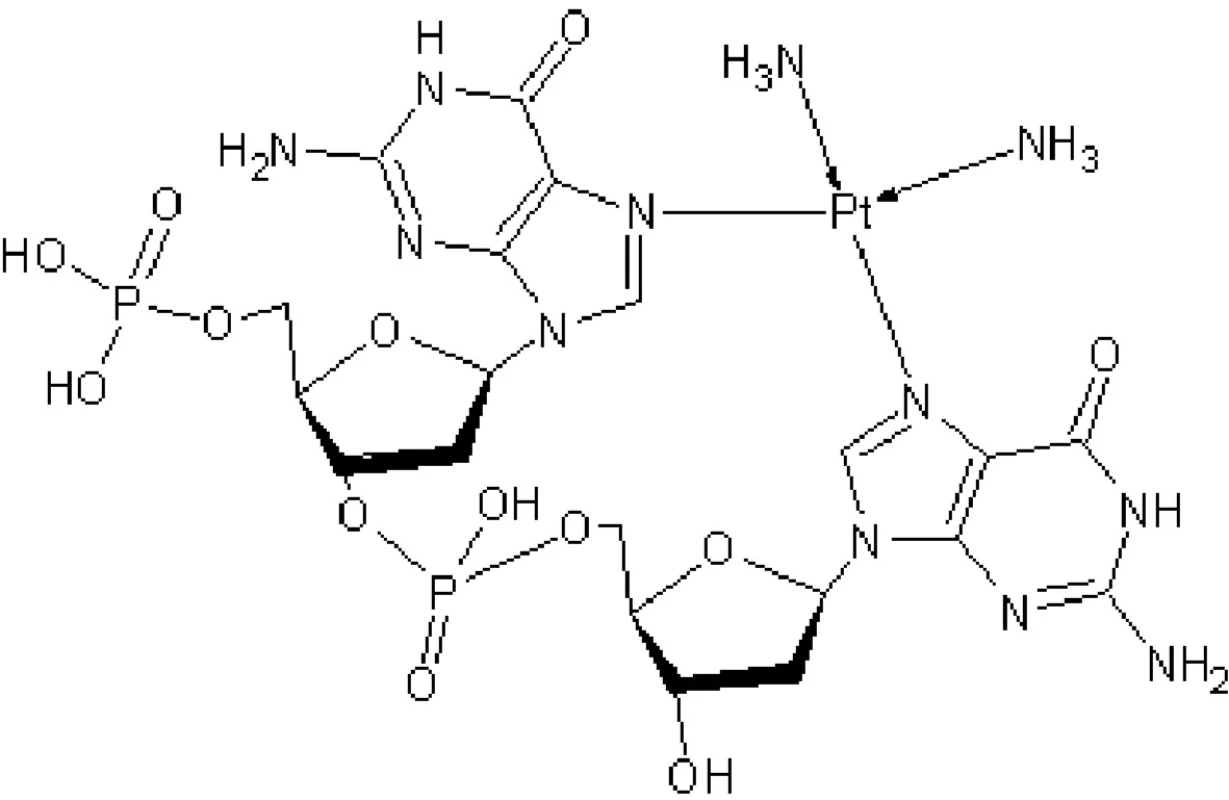
Dalším důvodem využívání cisplatiny v nádorové léčbě je její schopnost indukovat apoptózu. V této oblasti není příliš dostatečných informací. Nejuznávanější teorie se přiklání k možnosti, že DNA-adukty jsou rozpoznány opravnými proteiny (hMSH2 – homolog bakteriálního MutS a hMLH1, hPMS1 a hPMS2, což jsou homology MutL), nicméně pokud je poškození vážné, nedokážou již tyto poruchy opravit a je spuštěna apoptóza (26, 27).
Vznik rezistence a její mechanismus
Výzkumy ukazují, že některé nádorové linie se stávají odolné vůči cytostatikům. Tím se samozřejmě snižuje efektivita léčby a samozřejmě se zvyšuje riziko poškození zdravých buněk. I u platnatých komplexů byl tento jev rezistence pozorován. Obecně se zdá, že buňka má asi tři možnosti obrany.
Prvním z nich je aktivní transport léčiva pryč z intracelulárního prostoru a jeho akumulace mimo buňku. V několika studiích byl navržen systém efluxu za pomoci transportních proteinů mědi CTR1, ATP7A a ATP7B. Byla pozorována korelace mezi úrovní resistence buněk vůči cisplatině a expresí těchto přenašečů (28). U některých tumorových buněk byla pozorována zvýšená exprese proteinů, které by tento transport mohly zapříčiňovat.
Další překážkou v cestě platiny za apoptózou jsou obecně thioly. Jsou to většinou nízkomolekulární látky jevící afinitu k iontům kovů a mající též antioxidační aktivitu. Bylo prokázáno, že některé thioly se vyznačují velkou afinitou právě k cisplatině; nejvýznamnější jsou glutathion a metalothionein (25). Cisplatina komplexovaná thioly již není nebezpečná pro DNA a bývá z buňky odstraňována, detoxifikace pravděpodobně probíhá v ledvinách, nicméně mechanismus je neprobádán (9).
Poslední možností obrany buňky je oprava poškozené DNA. Obecně se předpokládá, že největší roli při opravě hrají HMG proteiny (high mobility group) a proteiny označované jako Mismatch repair proteins. Posledně jmenované nedokážou přímo defektní DNA opravit, nicméně se snaží na nepoškozeném vlákně DNA vložit „správné“ nukleotidy komplementární k DNA-aduktu, tím celou molekulu učiní velice nestabilní, a to může být jeden z důvodů spuštění apoptoických drah v buňce. Předpokládá se, že rezistentní nádorové linie buněk mají buď mutace právě v genech kódující tyto opravné proteiny, či snesou daleko větší poškození DNA, kterou by normální buňku přimělo ke spuštění apoptózy.
HMG proteiny jsou nehistonové proteiny vyskytující se v chromatinu. Tyto proteiny rovněž nedokáží opravit cisplatinou napadenou DNA, nicméně dokáží rozeznat tyto adukty a navázat se na ně (2). Zatím není příliš jasné, jaká je přesně spojitost s rezistivitou nádorových buněk těmito proteiny, nicméně bylo navrženo několik možností. Jedna z nich je, že navázáním HMG proteinu na vzniklý adukt DNA a cisplatiny je tato struktura „ukryta“ před opravnými proteiny. Tím samozřejmě narůstá počet chybných úseků na DNA, ale stoupá i rezistivita buňky, neboť opravné proteiny poté nemohou spustit apoptotické dráhy. Ve věci indukce fenoménu rezistence si mnoho studií protiřečí ve výsledcích a je jasné, že rezistence vznikne kooperací několika opravných mechanismů, z nichž je každý zastupitelný. Postupně se tak do vzniku rezistivity zapojuje eflux cytostatika, jeho inaktivace thioly a jako poslední proteiny opravující defektní strukturu DNA, způsobenou právě navázáním cisplatiny (29).
Thioly obecně jsou látky obsahující volné -SH skupiny aminokyseliny cysteinu. Tento velice účinný nukleofil je výborným ligandem u komplexotvorných reakcí. Další vlastností sulfhydrylové skupiny je, že je velice jednoduše oxidovatelná (30). Ve vzniku rezistence nádorových buněk vůči cisplatině hrají největší vliv dva thioly; a to sice glutathion (GSH) a metalothionein (MT). Prvně jmenovaný je malý tripeptid (γ-glutamylcysteinylglycin), jedna z nejrozšířenějších molekul v buňce s řadou funkcí. Pokud se zaměříme čistě na interakci s cisplatinou, glutathion se na ni naváže (v poměru 2 : 1) a poté se, podle obecně uznávané teorie, tento komplex aktivně transportuje do extracelulárního prostoru (31).
Cesty exkrece cisplatiny nebyly ještě plně prozkoumány, jedním z předpokládaných způsobů je vyloučení močí, v plazmě je pak cisplatina inaktivována plazmatickými proteiny či se navazuje do tkání (9).
Dalším příspěvkem GSH k obraně buňky před cisplatinou je jeho možná spojitost přímo s opravnými mechanismy DNA. Ukázalo se, že se snížením množství GSH v buňce pomocí buthioninu sulfoximinu (BSO), což je syntetická aminokyselina používající se v kombinaci s chemoterapeutiky – inhibuje syntézu GSH, podařilo inhibovat i reparační procesy na DNA (32). Navíc, GSH slouží také jako účinný antioxidant; jeho sulfhydrylové skupiny mohou být oxidovány (za vytvoření disulfidické vazby – S-S-) namísto jiných důležitých molekul citlivých k oxidačnímu stresu. Tím je zajištěno dostatečně redukční prostředí pro biochemické reakce. Pro některé proteiny z HMG rodiny je pro jejich správnou funkci potřebné, aby byly v redukovaném stavu. Tato podmínka je zaručena dostatečným množstvím GSH v buňce.
Za zmínku ještě stojí regulační vlastnosti GSH vůči transkripčním faktorům c-jun a c-fos, které jsou potenciálně zodpovědné za regulaci exprese opravných proteinů pro DNA. Tyto transkripční faktory jsou onkogeny uplatňující se při diferenciaci a proliferaci buněk a apoptóze. Jejich transkripce je zřejmě indukována oxidačním efektem ultrafialového záření, přičemž molekuly GSH jsou účinné zhášeče volných radikálů a regulací jejich hladiny dokáže zároveň ovlivňovat i úroveň exprese těchto transkripčních faktorů. Vliv GSH na vznik rezistence je komplexní záležitost a studie této problematiky je těmito aspekty velice znesnadněna (33).
Další thiolem spjatým s buněčnou obranou proti cisplatině je metalothionein (MT). MT se v normálním fyziologickém stavu stará o transport esenciálních iontů kovů, zejména pak Zn a Cu. Avšak v případě intoxikace těžkým kovem je schopen jej navázat a transportovat mimo buňku. Nejvíce prací vztažených k tomuto jevu bylo věnováno interakci MT-Cd (34). Cisplatina patří do skupiny látek, které mohou být takto metalothioneinem navázány (metalothionein je schopen navazovat i transplatinu). MT má k cisplatině větší afinitu než k zinku, a reakce mezi cisplatinou a MT nesoucím zinek má za důsledek uvolnění Zn2+ mimo protein. Volné ionty potom mohou opět indukovat expresi metalothioneinu a amplifikovat reakci. MT může také hrát roli v regulaci exprese dalších proteinů, potenciálně obranných (35).
Závěr
Plné porozumění fenoménu rezistence je zásadní pro zefektivnění protinádorové léčby a stejně tak pro pochopení samotného fungování nádorových buněk. Celá problematika je značně komplexní a pro získání nových údajů ohledně vztahu metalothioneinu k karcinogenezi, hlavně na poli molekulárně-genetickém, je velmi nutné pokračovat ve výzkumu na buněčných liniích nádorových buněk, zejména pak resistentních.
Poděkování
Práce na tomto projektu byla podpořena projektem Grantové Agentury AV ČR IAA401990701.
Doc. Ing. René Kizek, Ph.D.
Laboratoř molekulární biochemie a bioelektrochemie,
Ústav chemie a biochemie,
Mendelova zemědělská
a lesnická univerzita v Brně
Zemědělská 1,
613 00 Brno,
e-mail: kizek@sci.muni.cz
tel: +420-5-4513-3350
fax: +420-5-4521-2044
Zdroje
1. Margoshes, M., Vallee, B.L. A cadmium protein from equine kidney cortex. J. Am. Chem. Soc. 1957, 79, 17, p. 4813-4814.
2. Coyle, P., Philcox, J.C., Carey, L.C., Rofe, A.M. Metallothionein: The multipurpose protein. Cell Mol. Life. Sci. 2002, 59, 4, p. 627-647.
3. Miles, A.T., Hawksworth, G.M., Beattie, J.H., Rodilla, V. Induction, regulation, degradation, and biological significance of mammalian metallothioneins. Critical Reviews in Biochemistry and Molecular Biology 2000, 35, 1, p. 35-70.
4. Masters, B.A., Quaife, C.J., Erickson, J.C. et al. Metallothionein-Iii is expressed in neurons that sequester zinc in synaptic vesicles. J. Neurosci. 1994, 14, 10, p. 5844-5857.
5. Quaife, C.J., Findley, S.D., Erickson, J.C. et al. Induction of a new metallothionein isoform (Mt-Iv) occurs during differentiation of stratified squamous epithelia. Biochemistry 1994, 33, 23, p. 7250-7259.
6. Trayhurn, P., Duncan, J.S., Wood, A.M., Beattie, J.H. Metallothionein gene expression and secretion in white adipose tissue. Am. J. Physiol-Regul. Integr. Comp. Physiol. 2000, 279, 6, p. R2329-R2335.
7. Thirumoorthy, N., Kumar, K.T.M., Sundar, A.S., Panayappan, L., Chatterjee, M. Metallothionein: An overview. World Journal of Gastroenterology 2007, 13, 7, p. 993-996.
8. Murray, R.K., Granner, D.K., Mayes, P.A., Rodwell, V.W. Harper’s Illustrated Biochemistry. New York: Lange Medical Books/McGraw-Hill Medical Publishing Division, 2003.
9. Peng, B., English, M.W., Boddy, A.V. et al. Cisplatin pharmacokinetics in children with cancer. Eur. J. Cancer 1997, 33, 11, p. 1823-1828.
10. Maret, W., Vallee, B.L. Thiolate ligands in metallothionein confer redox activity on zinc clusters. Proc. Natl. Acad. Sci. USA 1998, 95, 7, p. 3478-3482.
11. Hanada, K., Sawamura, D., Tamai, K. et al. Novel function of metallothionein in photoprotection: Metallothionein-null mouse exhibits reduced tolerance against ultraviolet B injury in the skin. J. Invest. Dermatol. 1998, 111, 4, p. 582-585.
12. Hansen, C., Ablett, E., Green, A. et al. Biphasic response of the metallothionein promoter to ultraviolet radiation in human melanoma cells. Photochem. Photobiol. 1997, 65, 3, p. 550-555.
13. Bataineh, Z.M., Nusier, M.K. Metallothionein expression in human prostate gland. Saudi Med. J. 2003, 24, 11, p. 1246-1249.
14. Ejnik, J., Munoz, A., Gan, T., Shaw, C.F., Petering, D.H. Interprotein metal ion exchange between cadmium-carbonic anhydrase and apo - or zinc-metallothionein. J. Biol. Inorg. Chem. 1999, 4, 6, p. 784-790.
15. Cherian, M.G., Apostolova, M.D. Nuclear localization of metallothionein during cell proliferation and differentiation. Cell Mol. Biol. 2000, 46, 2, p. 347-356.
16. Zeng, J., Heuchel, R., Schaffner, W., Kagi, J.H.R. Thionein (apometallothionein) can modulate DNA-binding and transcription activation by zinc finger containing factor-Sp1. FEBS Lett. 1991, 279, 2, p. 310-312.
17. Klassen, R.B., Crenshaw, K., Kozyraki, R. et al. Megalin mediates renal uptake of heavy metal metallothionein complexes. Am. J. Physiol-Renal Physiol. 2004, 287, 3, p. F393-F403.
18. Ghoshal, K., Jacob, S.T. Regulation of metallothionein gene expression. Progress in Nucleic Acid Research and Molecular Biology Vol 66. San Diego: Academic Press Inc, 2001: p. 357-384.
19. Gunes, C., Heuchel, R., Georgiev, O. et al. Embryonic lethality and liver degeneration in mice lacking the metal-responsive transcriptional activator MTF-1. Embo. J. 1998, 17, 10, p. 2846-2854.
20. Santon, A., Irato, P., Medici, V., D‘Inca, R., Albergoni, V., Sturniolo, G.C. Effect and possible role of Zn treatment in LEC rats, an animial model of Wilson‘s disease. Biochem. Biophys. Acta-Mol, Basis Dis. 2003, 1637, 1, p. 91-97.
21. Waalkes, M.P., Liu, J., Goyer, R.A., Diwan, B.A. Metallothionein-I/II double knockout mice are hypersensitive to lead-induced kidney carcinogenesis: Role of inclusion body formation. Cancer Res. 2004, 64, 21, p. 7766-7772.
22. Jasani, B., Schmid, K.W. Significance of metallothionein overexpression in human. Histopathology 1997, 31, 3, p. 211-214.
23. Rosenber.B, Vancamp, L., Krigas, T. Inhibition of cell division in Escherichia coli by electrolysis products from a platinum electrode. Nature 1965, 205, 4972, p. 698-707.
24. Perez, R.P. Cellular and molecular determinants of cisplatin resistance. Eur. J. Cancer 1998, 34, 10, p. 1535-1542.
25. Chu, G. Cellular-responses to cisplatin - the roles of DNA-binding proteins and DNA-repair. J. Biol. Chem. 1994, 269, 2, p. 787-790.
26. Searle, J., Kerr, J.F.R., Bishop, C.J. Necrosis and apoptosis - distinct modes of cell-death with fundamentally different significance. Pathol. Annu. 1982, 17, p. 229-259.
27. Searle, P.F., Stuart, G.W., Palmiter, R.D. Building a metal-responsive promoter with synthetic regulatory elements. Mol. Cell Biol. 1985, 5, 6, p. 1480-1489.
28. Safaei, R., Howell, S.B. Copper transporters regulate the cellular pharmacology and sensitivity to Pt drugs. Crit. Rev. Oncol/Hematol. 2005, 53, 1, p. 13-23.
29. Stordal, B., Davey, M. Understanding cisplatin resistance using cellular models. IUBMB Life 2007, 59, 11, p. 696-9.
30. Wlodek, L. Beneficial and harmful effects of thiols. Pol. J. Pharmacol. 2002, 54, 3, p. 215-23.
31. Meister, A., Anderson, M.E. Glutathione. Annu. Rev. Biochem. 1983, 52, p. 711-760.
32. Mistry, P., Kelland, L.R., Abel, G., Sidhar, S., Harrap, K.R. The relationships between glutathione, glutathione-S-transferase and cytotoxicity of platinum drugs and melphalan in 8 human ovarian-carcinoma cell-lines. Br. J. Cancer 1991, 64, 2, p. 215-220.
33. Soriani, M., Hejmadi, V., Tyrrell, R.M. Modulation of c-jun and c-fos transcription by UVB and UVA radiations in human dermal fibroblasts and KB cells. Photochem. Photobiol. 2000, 71, 5, p. 551-558.
34. Kagi, J.H.R. Overview of Metallothionein. Method. Enzymol. 1991, 205, p. 613-626.
35. Cherian, M.G., Howell, S.B., Imura, N. et al. Contemporary-Issues in toxicology - role of metallothionein in carcinogenesis. Toxicol. Appl. Pharmacol. 1994, 126, 1, p. 1-5.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek Paměť a její poruchyČlánek Fantomy na psacích stolech
Článek vyšel v časopisePraktický lékař
Nejčtenější tento týden
2008 Číslo 2- Nitrofurantoin s řízeným uvolňováním – osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
-
Všechny články tohoto čísla
- O lidech, kteří hromadí věci a zvířata
- Současné přístupy k očkování konjugovanou pneumokokovou vakcínou
- Akutní toxická hepatitida po bylinném přípravku
- Kdy je pacient nebezpečný sobě?
- Stavovský oční lékař J. A. Ryba a budování oční kliniky na pražské univerzitě
- Miniportréty slavných českých lékařů Profesor Václav Piťha neurolog, budovatel tří klinik
- Fantomy na psacích stolech
- Hrozí zneužití – diskreditace lékařské genetiky
- Sanofi-Pasteur podává v Evropě žádost o registraci první vakcíny proti sezónní chřipce aplikované intradermální mikroinjekcí
- Činnost dobrovolníků DC Lékořice v oddělení LDN1-A2 FTNsP Praha Krč
- Transparentní zodpovědnost (accountability) v medicíně a zodpovědnost etických komisí
- Současné možnosti a problémy antiretrovirové terapie
- Etiopatogeneze autismu z pohledu buněčné a molekulární biologie
- Paměť a její poruchy
- Metalothionein a jeho vztah k protinádorové léčbě na bázi platinových komplexů
- Hodnocení dynamiky transportní funkce a remodelace levé srdeční síně po úspěšné endoskopické mikrovlnné epikardiální izolaci plicních žil. Pilotní studie.
- Praktický lékař
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Paměť a její poruchy
- Současné možnosti a problémy antiretrovirové terapie
- Miniportréty slavných českých lékařů Profesor Václav Piťha neurolog, budovatel tří klinik
- Akutní toxická hepatitida po bylinném přípravku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



