-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaHodnocení dynamiky transportní funkce a remodelace levé srdeční síně po úspěšné endoskopické mikrovlnné epikardiální izolaci plicních žil. Pilotní studie.
Left atrial structural remodelling and restoration of atrial contraction after successful thoracoscopic epicardial microwave pulmonary vein isolation.
Aim:
Atrial fibrillation (AF) is accompanied by the lack of contractile function and successive progression of atrial volumes. Endoscopic microwave pulmonary isolation represents a new technique of AF ablation (the isolation of pulmonary veins by epicardial approach). The aim of the study was to assess the function and size of left atrium (LA) after successful procedure.Methods:
11 patients with symptomatic paroxysmal or persistent AF were prospectively studied. All of them underwent an ablation procedure. The efficacy of the procedure was assessed by 48 h. Holter recordings 1 and 3 months after the procedure, only 9 patients with full restoration and maintenance of sinus rhythm were analyzed. Echocardiography was performed before (baseline), then 1 and 3 months following the procedure. Parameters studied were:
left LA diameter (DS),
maximal volume of LA during ventricular systole (ESV),
minimal volume of LA during ventricular diastole (EDV), and
ejection fraction of LA (LAEF).
Peak velocity of atrial contraction (A velocity), velocity time integral of the A wave (AVTI) and peak velocity of mitral annular motion in late diastole (Aa) were measured by Doppler or tissue Doppler respectively.Results:
Compared with baseline values, EDV volume decreased significantly 3 months after the procedure (EDV 53,9±14,9 ml vs. 47,4±16,2 ml, p<0.05). Furthermore, transient decrease of LA mechanical function (LAEF, Aa, A velocity) was observed one month after procedure with the recovery at 3 m. (LA EF 35,3±5,2 % vs. 32,4±7,8 %, Aa 6,52±0,83 cm/s vs. 6,55±1,16 cm/s, Avel: 0,55±0,04 m/s vs. 0,55±0,1 m/s, all p=n.s.).Conclusion:
The successful restoration and maintenance of sinus rhythm by EndoMaze procedure is associated with progressive decrease of EDV. However, the contractile function of LA is transiently decreased shortly after procedure.Key words:
atrial fibrillation, ablation, pulmonary vein isolation, left atrium, mechanical function of left atrium.
Autoři: Z. Peroutka 1; Z. Straka 2; P. Osmančík 1; M. Pěnička 1; H. Línková 1; M. Herold 1
Působiště autorů: III. Interní - Kardiologická klinika Přednosta: prof. MUDr. Petr Widimský, DrSc. 1; Kardiochirurgická klinika Přednosta: prof. MUDr. Zbyněk Straka, CSc. Kardiocentrum Fakultní nemocnice Královské Vinohrady a 3. lékařské fakulty Univerzity Karlovy, Praha 2
Vyšlo v časopise: Prakt. Lék. 2008; 88(2): 94-100
Kategorie: Z různých oborů
Souhrn
Cíl:
Posouzení dynamiky transportní funkce a remodelace levé síně po úspěšném provedení endoskopické mikrovlnné epikardiální izolace plicních žil u pacientů s paroxysmální či perzistující fibrilací síní.Soubor a metodika:
Vyšetřili jsme 11 pacientů s paroxysmální či perzistující fibrilací síní, u kterých byla provedena izolace plicních žil. Úspěšnost zákroku byla posouzena klinicky a třemi 48 hodinovými holterovskými záznamy za 1 měsíc a za 3 měsíce po operaci. Echokardiografická vyšetření byla provedena před operací a dále s odstupem 1 a 3 měsíců po zákroku. Funkce levé síně (LS) byla hodnocena jen u 9 pacientů, u kterých došlo k nastolení a udržení sinusového rytmu. Sledované echokardiografické parametry byly:
– průměr LS (DS),
– maximální objem LS v systole komor (ESV),
– minimální objem LS v diastole komor (EDV), a
– ejekční frakce (EF) LS (z 2D projekcí).
Z Dopplerovských parametrů pak vrcholová rychlost vlny A (A velocity) a časově rychlostní integrál vlny A (AVTI). Tkáňovou Dopplerovskou echokardiografií byla měřena vrcholová rychlost pohybu mitrálního anulu v pozdní diastole (Aa).Výsledky:
Ve srovnání s pfiedoperačními hodnotami, 3 měsíce po zákroku EDV poklesl z 53,9±14,9 na 47,4±16,2 (p<0,05). Transportní funkce LS se za 1 měsíc po zákroku zhoršila, s následným zlepšením v dalším průběhu, přdoperačněû oproti hodnotám za 3 měsíce (LSEF 35,3±5,2 % na 32,4±7,8 %, Aa 6,52±0,83 m/s na 6,55±1,16 m/s, A velocity 0,55±0,04 m/s na 0,55±0,1 m/s, všechna p=n.s.).Závěr:
Úspěšná izolace plicních žil s nastolením a udržením sinusového rytmu je spojena s poklesem objemu levé síně v end-diastole. Transportní funkce levé síně vykazuje pokles za měsíc od zákroku s následným zlepšením.Klíčová slova:
fibrilace síní, ablace, izolace plicních žil, levá síň, transportní funkce levé síně.Úvod
Fibrilace síní (FS) je nejčastější poruchou srdečního rytmu se zvyšující se prevalencí. FS je charakteristická komplexní fyziologií, je nezávislým prediktorem morbidity a mortality, zvyšuje riziko tromboembolických komplikací, které významně stoupají s přidruženými rizikovými faktory (1). Terapie FS je zaměřena buď na kontrolu a udržení sinusového rytmu, nebo na kontrolu a optimalizaci srdeční frekvence a dále na prevenci tromboembolických komplikací. V současné době je při neefektivitě farmakologické terapie u vysoce symptomatických pacientů volen kurativní nefarmakologický výkon (2). U pacientů s nutností komplexního chirurgického zákroku je indikován perioperační výkon, u zbývajících připadají v úvahu katetrizační ablace a nyní, v období rozvoje endoskopických metod, i minimálně invazívní kardiochirurgický zákrok (3–7).
U pacientů s FS dochází k postupné remodelaci a zhoršení transportní funkce levé síně. Ztráta koordinované síňové kontrakce spolu s dalšími zvažovanými faktory jako je hyperkoagulační stav, vytváří předpoklad pro vznik trombu uvnitř srdečních síní, především v oušku levé síně. Doposud jsou k dispozici data pouze jedné nerandomizované klinické studie prezentující snížení mortality a morbidity po katetrizační ablaci FS v důsledku redukce cévních mozkových příhod (CMP) a srdečního selhání (8). Redukce četnosti CMP byla popsána i některých studiích po MAZE proceduře s korekcí strukturálního srdečního onemocnění (9–11). V těchto studiích však bylo u některých pacientů navíc resekováno ouško levé síně, v některých případech byla trvalá antikoagulační léčba nutná přes úspěšné provedení MAZE zákroku pro přidružený kardiochirurgický výkon.
I když vztah transportní a čerpací funkce levé síně k riziku tromboembolických příhod po ablaci FS není doposud jednoznačně objasněn, nelze vyloučit, že mimo obnovení atrioventrikulární synchronie by i účinná kontrakce levé síně mohla být spojena s nižším rizikem tromboembolických komplikací. Transportní funkce levé srdeční síně po provedené endoskopické izolaci plicních žil nebyla doposud v nám dostupné literatuře hodnocena. V naší studii jsme testovali hypotézu, zda úspěšná endoskopická epikardiální izolace plicních žil bude spojena s obnovením transportní funkce levé síně.
Metodika
Soubor nemocných
Bylo vyšetřeno celkem 11 pacientů. Jednalo se o symptomatické pacienty s paroxysmální či perzistující fibrilací síní, rezistentní k farmakologické terapii (FS byla přítomna i přes podávání alespoň jednoho antiarytmika), kteří prodělali operační zákrok v rozmezí od dubna do září 2007. Vylučovacími kritérii byla přítomnost významné chlopenní vady, ischemická choroba srdeční bez předchozí kompletní revaskularizace, hypertyreóza, těžká systolická dysfunkce levé komory srdeční s ejekční frakcí levé komory srdeční (EF LKS) pod 30 %, větší než stopový perikardiální výpotek, dále těžší chronická obstrukční choroba plicní a přítomnost pneumotoraxu v anamnéze.
Z analýzy byli dále vyloučeni 2 pacienti, u kterých jsme po 3 měsících od operace dokumentovali recidivu supraventrikulární (SV) arytmie (1x FS a 1x flutter síní).
Analyzováno bylo tedy nakonec celkem 9 pacientů, 8 mužů a 1 žena o průměrném věku 55,8±9 let. Průměrná délka trvání arytmie byla 4,0±2,5 roku. Echokardiograficky byla přítomna nejvýše malá mitrální insuficience (1/4 semikvantitativním hodnocením). EF LKS byla u 8 pacientů v rozmezí 60–65 %, u jednoho pacienta činila EF LKS 30 %. Ve vyšetřeném souboru bylo 6 hypertoniků, žádný pacient netrpěl diabetem, nikdo ze souboru pacientů neměl v anamnéze CMP. Pacienti byli po operaci dále sledováni v arytmologické ambulanci Kardiocentra FNKV, kontrola byla u všech pacientů provedena za jeden měsíc a za tři měsíce po operaci. Antikoagulační (warfarin s cílovým INR 2,0–3,0) i anti-arytmická (1x sotalol 160mg/den, v ostatních případech amiodaron 200 mg/den) medikace byla ponechána minimálně po 3 měsíce po operaci, další postup byl individuální dle symptomatologie pacienta a výsledků holterovské monitorace při respektování CHADS 2 kritérií (2).
Pacienti jsou v prezentované analýze rozděleni na skupinu s předoperačně přítomnou paroxysmální fibrilací síní (4 pacienti, 44,4 %), tito měli v našem souboru při předoperačním vyšetření všichni sinusový rytmus (SR), a na skupinu s předoperačně přítomnou perzistující fibrilací síní (5 pacientů, 55,6 %), tito měli v našem souboru při předoperačním vyšetření i v době nástupu k operaci přítomnou fibrilaci síní.
Uvedený soubor pacientů jsme porovnali s kontrolní skupinou 10 věkem podobných zdravých jedinců (věk 54,4±6,2; 8 mužů a 2 ženy).
Hodnocení úspěšnosti zákroku
Úspěšnost byla hodnocena dle klinického vyšetření (anamnéza palpitací a jiných klasických symptomů) a holterovským monitorováním EKG. U všech pacientů byla provedena holterovská monitorace EKG za 1 (jeden 24 hodinový záznam) a za 3 měsíce po operaci (dva 48 hodinové záznamy) záznamníkem CARDIETTE GiOtto. Protože po ablaci FS jinými metodami je popisován velmi častý výskyt jiných SV arytmií či recidiv FS v časném období po zákroku, nebyla přítomnost SV arytmií či FS do 1 měsíce po zákroku považována za neúspěch izolace plicních žil (12). Jako neúspěšný byl zákrok hodnocen, pokud přetrvávala FS déle než jeden měsíc po operaci (tedy naopak, jako úspěšný byl hodnocen tehdy, pokud byl pacient po jednom měsíci od operace zcela asymptomatický a oba 48 hod. Holter EKG za 3 měsíce po zákroku byly zcela bez záchytu FS).
Studie byla schválena Etickou komisí FNKV a od každého pacienta byl získán informovaný souhlas.
Operační technika
Při endoskopické epikardiální mikrovlnné ablaci plicních žil je v celkové anestézii po supraselektivní intubaci levého bronchu po zajištění přístupu pomocí 3 portů v pravém hemitoraxu provedena perikardiotomie nad odstupem nervus frenicus, po preparačním uvolnění dutých žil je za pomoci flexibilního endoskopického jaterního retraktoru zavedena okolo vyústění plicních žil mikrovlnná sonda FLEX 10 (Guidant Corporation) a po uložení do správné pozice provedena postupná sekvenční mikrovlnná ablace energií 65 W opakovaně po dobu 120 a 90 sec. okolo společného vyústění všech plicních žil v oblasti zadní stěny levé síně (box lesion). U pacientů s při operaci přítomným sinusovým rytmem je úspěšnost izolace plicních žil hodnocena perioperačním elektrofyziologickým vyšetřením. Všichni pacienti byli operováni na kardiochirurgické klinice Fakultní nemocnice Královské Vinohrady.
Echokardiografické vyšetření
Echokardiografická vyšetření byla provedena v období jednoho až dvou měsíců před kardiochirurgickým zákrokem, dále v odstupu jednoho a tří měsíců od provedené endoskopické mikrovlnné ablace echokardiografickým přístrojem Vivid 7, General Electric Medical System, Horten Norway vybaveném sondou o frekvenci 3,5 MHz s harmonickým zobrazením a hodnocena na měřící stanici Echopack 5.1.1. U pacientů s FS byl hodnocen průměr z 5 měření, u pacientů se SR byl hodnocen průměr ze 3 měření. Byla provedena tato vyšetření:
Standardní transtorakální echokardiogram
Hodnocení průměru LKS v diastole (M mode), end-systolického průměru levé síně (DS) (M-mode z parasternální projekce na dlouhou osu), EF LKS (biapikální Simpson), semikvantitativní hodnocení stupně mitrální regurgitace metodou barevného dopplerovského mapování (CFM).
Hodnocení objemu a mechanické funkce levé síně
Objem levé srdeční síně (LSESV) – maximální objem levé síně v systole levé komory srdeční, a (LSEDV) – minimální objem levé síně v diastole levé komory srdeční, byly měřeny z apikální čtyřdutinové (A4C) a apikální dvoudutinové (A2C) projekce, výsledný objem byl spočítán metodou sumace disků (biapikální Simpson) (13, 14). Tepový objem levé síně (LSTO) byl měřen jako rozdíl LSESV a LSEDV (LSESV – LSEDV). LSEF byla měřena jako (LSESV – LSEDV) /LSESVx100.
U pacientů s FS byl LSESV definován jako největší objem levé síně při uzavřené mitrální chlopni v průběhu komorové systoly a LSEDV jako nejmenší objem levé síně při otevřené mitrální chlopni v průběhu komorové diastoly.
Pulzně dopplerovská echokardiografie (u pacientů se sinusovým rytmem)
U pacientů byly měřeny:
- vrcholová rychlost plnění levé komory v časné diastole (E velocity),
- vrcholová rychlost plnění levé komory při síňovém stahu (A velocity),
- časově rychlostní integrál vlny A (AVTI ), a
- vlny E (EVTI ).
Měření bylo provedeno z A4C projekce při umístění vzorkovacího objemu mezi okraje mitrálních cípů na konci výdechu při převíjecí rychlosti 100 mm/sec. Byl hodnocen průměr ze 3 měření.
Pulzní tkáňová dopplerovská echokardiografie – TDI
Byla měřena vrcholová rychlost pohybu mitrálního anulu v pozdní diastole v závislosti na kontrakci levé síně-Aa na konci výdechu při převíjecí rychlosti 100 mm/sec (15). Vzorkovací objem pulzního TDI byl umístěn na síňovou stranu mitrálního prstence v bazální části mezisíňového septa z A4C projekce. Velká péče byla věnována minimalizaci incidenčního úhlu mezi analyzovaným vektorem pohybu prstence a kurzorem. Byl hodnocen průměr ze 3 měření.
Intra - a interindividuální variabilita měření objemů levé síně, vlny A a E transmitrálního průtoku i Aa z mitrálního prstence byla hodnocena 2 zkušenými operátory. Intra - a interindividuální variabilita byla při měření
- LSEDV 7,2 % a 7,8 %,
- LSESV 7 % a 7,6 %,
- u LD 2,5 % a 2 %,
- A velocity 3,4 % a 4 %,
- AVTI 4,6 % a 5,3 %,
- Aa 3,6 % a 4,1 %.
Za hemodynamicky účinnou kontrakci levé síně jsme považovali A velocity nad 0,2 m/s, tato hodnota byla stanovena arbitrárně. Uvedenou metodiku hodnocení transportní funkce levé síně jsme zvolili pro její snadnou reprodukovatelnost a možnost opakovaného použití v běžné klinické praxi na našem pracovišti.
Statistická analýza
Data byla testována na normální rozložení Kolmogorov-Smirnovovým testem. Párová porovnání výsledků v čase byla hodnocena párovým (dvouvýběrovým) t-testem. Porovnání souborů pacientů se skupinou zdravých dobrovolníků bylo provedeno nepárovým t-testem či Mann-Whitney U testem. Statistické vyhodnocení bylo provedeno v NCSS 2007. P<0,05 bylo hodnoceno jako významné. Data jsou uváděna jako aritmetický průměr±směrodatná odchylka.
Výsledky
Operace
Operační zákrok proběhl bez komplikací u 8 pacientů. U jednoho pacienta ze souboru bylo nutné provedení revize pro hemoperikard. V jednom případě jsme dokumentovali pooperační perikarditidu s benigním průběhem. Průměrná doba hospitalizace byla 6±2 dny. V časném pooperačním průběhu byla provedena u 6 pacientů verze antiarytmiky, u jednoho pacienta pak elektrická kardioverze. U žádného z pacientů nebyla přítomna porucha hojení rány.
Klinické a holterovské hodnocení efektu zákroku
V hodnoceném souboru jsme na holterovském EKG 1 měsíc od zákroku u 3 pacientů (30 %) dokumentovali paroxysmy fibrilace síní, ostatních 6 pacientů mělo na záznamu trvale sinusový rytmus bez záchytu FS. 2 pacienti bez Holter EKG dokumentované arytmie udávali palpitace. Žádný z pacientů neprodělal ve sledovaném období CMP.
Echokardiografie
Ejekční frakce levé síně (graf 2 B) byla předoperačně hodnocena u pacientů s paroxysmální FS a s při předoperačním vyšetření přítomným SR (v našem souboru byl přítomen SR u všech pacientů s paroxysmální FS). Pacienti s perzistující FS měli předoperačně přítomnou FS a LSEF nemohla u nich tedy být hodnocena.
Graf 1. Parametry transportní funkce levé síně Hodnoty u souboru operovaných pacientů jsou znázorněny jako průměr±standardní odchylka. Pro názornost jsou zobrazeny odděleně dvě skupiny pacientů: pacienti vstupně s FS černě vyplněným trojúhelníkem, pacienti vstupně se SR prázdným kolečkem.. * p<0,05 při srovnání předoperačních hodnot s hodnotami v daném čase měření, statistika počítána pro celý soubor. + p<0,05 při srovnání hodnot kontrolního souboru zdravých jedinců s hodnotami pacientů po úspěšné izolaci plicních žil za 3 měsíce od operace. Hodnoty u kontrolního souboru zdravých jedinců (kontrola) jsou znázorněny jako medián s 25-75. percentilem A vel.-A velocity–maximální rychlost vlny A, AVTI-časově rychlostní integrál vlny A, Aa-vrcholová rychlost pohybu mitrálního anulu v pozdní diastole v závislosti na kontrakci levé síně. LSEF-ejekční frakce levé síně. Kontrola-kontrolní soubor zdravých jedinců. 
U všech pacientů s předoperačně perzistující FS došlo po zákroku k obnovení čerpací funkce LS. LSEF předoperační činila 35,3±5,2 %, za jeden měsíc od operace poklesla na 27,6±6,6 % (p=0,004646). Po 3 měsících od operace jsme zaznamenali zlepšení LSEF na 32,4±7,8 %. (LSEF se za 1 a 3 měsíce po operaci významně nelišila u pacientů s paroxysmální nebo perzistující FS). V porovnání s kontrolním souborem zdravých jedinců byla LSEF signifikantně nižší (u zdrav˘ch 50,9±4,1 %; p<0,001).
Zaznamenali jsme signifikantní pokles LSEDV (graf 1 C) z 53,9±14,9 ml předoperačně v celém souboru pacientů na 47,4±16,2 ml za 3 měsíce po operaci (p=0,047296). Oba rozmûry byly ov‰em signifikantnû vût‰í neÏ LSEDV u kontrol-ní skupiny (19,6±3,9 ml; p≤0,001).
Podobný pokles byl patrný i pro LSESV (graf 1 B), (p=0,011507) a zaznamenali jsme tren 1d k poklesu DS (pfiedoperaãnû 42,4±3,3, za 3 mûsíce po operaci pak 41,6±3,7; p=0,051609), (graf 1 A)
Změny těchto parametrů (LS ESV, LD) však nepovažujeme vzhledem k velikosti souboru a variabilitě měření za signifikantní. V uvedeném časovém úseku nedocházelo k negativní remodelaci LS (graf 1, tabulka 1).
Graf 2. Průměr a objem levé síně Hodnoty u souboru operovaných pacientů jsou znázorněny jako průměr±standardní odchylka. Pro názornost jsou zobrazeny odděleně dvě skupiny pacientů: pacienti vstupně s FS černě vyplněným trojúhelníkem, pacienti vstupně se SR prázdným kolečkem. * p<0,05 při srovnání předoperačních hodnot s hodnotami v daném čase měření, statistika počítána pro celý soubor. + p<0,05 při srovnání hodnot kontrolního souboru zdravých jedinců s hodnotami souboru pacientů po úspěšné izolaci plicních žil za 3 měsíce po zákroku. Hodnoty u kontrolního souboru zdravých jedinců (kontrola) jsou znázorněny jako medián s 25-75. percentilem DS-průměr levé síně v end-systole, LSESV-maximální objem levé síně v komorové systole, LSEDV-maximální objem levé síně v komorové diastole. 
Tab. 1. Průměr a objem levé síně, hodnoty u jednotlivých pacientů. 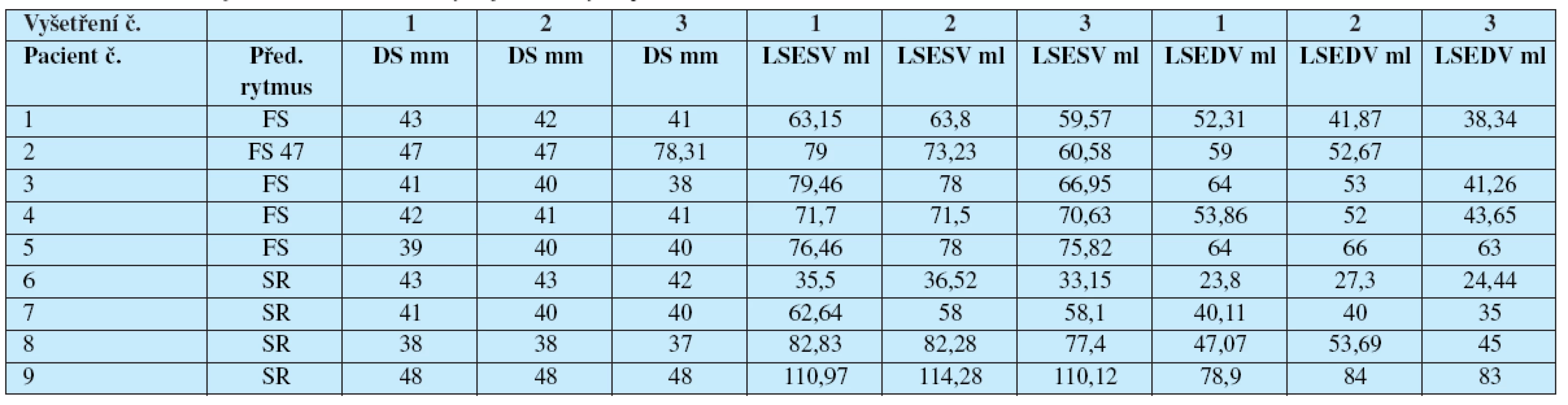
1-předoperační vyšetření, 2-vyšetření za 1 měsíc po operaci, 3-vyšetření za 3 měsíce po operaci DS-průměr levé síně v end-systole, LSESV-maximální objem levé síně v komorové systole, LSEDV-maximální objem levé síně v komorové diastole. Obdobně hodnoty parametrů kontraktilní funkce vykazovaly po 1 měsíci od operace pokles (Aa; p=0,029325), nebo trend k poklesu (A vel; p=0,059507), za 3 měsíce od izolace plicních žil došlo oproti 1. pooperačnímu vyšetření ke zlepšení (graf 2A–2C) (Aa 6,55±1,16 cm/s; p=0,002838, A velocity 0,55±0,1 m/s; p<0,001, AVTI 5,81±1,55 cm; p= 0,003997). I tyto hodnoty v‰ak byly signifikantně nižší než u zdravých jedinců (u zdravých Aa 9,15±1,13 cm/s; p≤0,001, A velocity 0,77±0,14 m/s; p=0,002, AVTI 10,07±3,3 cm; p=0,004). (Graf 2, tabulka 2). V parametrech LSTO, E velocity, EVTI jsme nezjistili signifikantní rozdíl.
Tab. 2. Parametry transportní funkce levé síně, hodnoty u jednotlivých pacientů 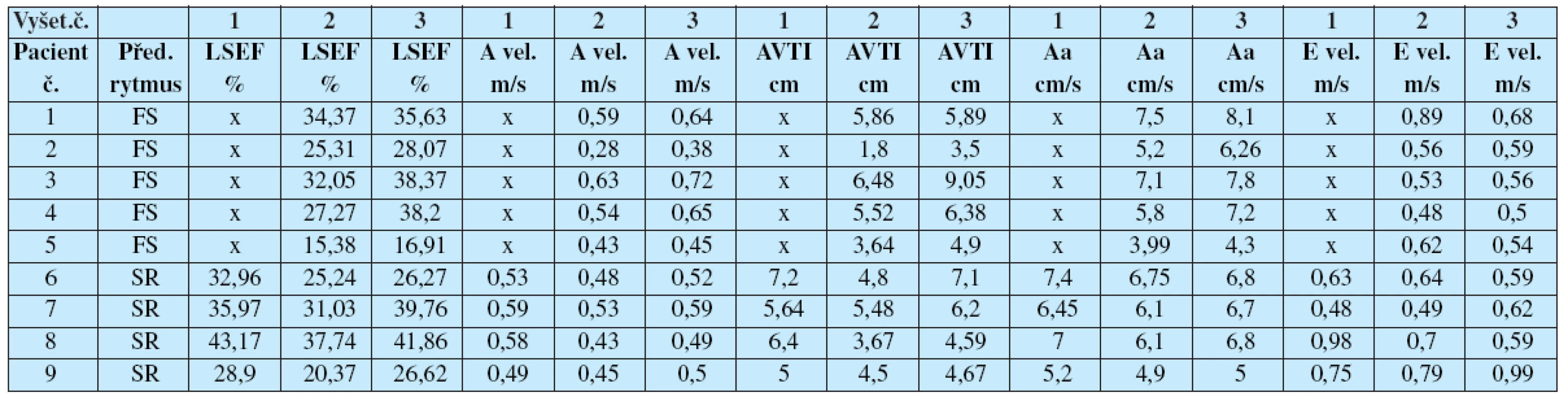
1-předoperační vyšetření, 2-vyšetření za 1 měsíc po operaci, 3-vyšetření za 3 měsíce po operaci x – parametr nelze hodnotit LSEF-ejekční frakce levé síně, A vel.-A velocity–maximální rychlost vlny A, AVTI-časově rychlostní integrál vlny A, Aa-vrcholová rychlost pohybu mitrálního anulu v pozdní diastole v závislosti na kontrakci levé síně, E vel.-E velocity-maximální rychlost vlny E Diskuse
Naše studie ukázala, že po úspěšné mikrovlnné epikardiální izolaci plicních žil dochází časně po zákroku ke zhoršení mechanické funkce levé síně a následně k jejímu postupnému zlepšení. Hemodynamicky účinná kontrakce levé síně je však přítomna u všech pacientů s udržujícím se SR. Zároveň ve sledovaném období neprogreduje dilatace LS a v některých parametrech dochází ke zmenšení objemu levé síně. Ve srovnání s kontrolním souborem zdravých jedinců ovšem stále nedosahují mechanické parametry levé síně hodnot zdravých jedinců.
Hodnocení velikosti a kontraktility síně po chirurgických či katetrových ablacích pro FS bylo předmětem několika klinických studií. Zmenšení velikosti levé síně po ablaci fibrilace síní otevřenou chirurgickou cestou pomocí MAZE procedury bylo dokumentováno ve více pracích. Yuda a kol. prokázali pokles velikosti levé síně do 6 měsíců od operace (MAZE s korekcí mitrální vady) (16). Regresi velikosti levé síně zaznamenali i Jessurun a kol. (17), ovšem pouze u pacientů, u kterých byl MAZE zákrok spojen s korekcí strukturálního srdečního onemocnění, většinou mitrální vady. V některých pracích se nejdůležitějším prediktorem regrese velikosti LS jevilo nastolení a udržení SR (18). V některých studiích docházelo s časovým odstupem od zákroku ke zlepšení transportních parametrů srdečních síní, což je v souladu s našimi výsledky (20, 21). Zde ovšem na rozdíl od naší práce nedošlo k obnovení transportní funkce LS u všech pacientů (byť po úspěšném zákroku, tedy s udržujícím se SR). V souladu s našimi výsledky zůstávala transportní funkce levé srdeční síně signifikantně nižší při srovnání se zdravou populací (18, 22). Obdobně i Yamanaka a kol. dokumentovali vyšetřením pomocí výpočetní tomografie (CT) zhoršenou čerpací funkci LS u pacientů po operaci mitrální chlopně s MAZE ve srovnání s pacienty po aortokoronárním bypassu bez zákroku na levé síni (23).
Výsledky těchto prací nelze ovšem dostatečně dobře srovnávat s námi prezentovanými výsledky. Jednak dochází MAZE zákrokem k pravděpodobně k většímu poškození levé síně, jednak byl v těchto studiích MAZE doplněn dalším výkonem (často zákrokem na mitrální chlopni) a nelze tedy určit, zda ke zmenšení objemu síně došlo jen ablací FS s nastolením a udržením sinusového rytmu, či zmenšením (odstraněním) mitrální insuficience.
Pro naše srovnání zajímavější data existují od pacientů, u kterých byl proveden izolovaný MAZE či jeho modifikace bez korekce strukturálního srdečního onemocnění (pacienti s lone FS, kde MAZE operace byla kurativním zákrokem FS). Zde regrese velikosti LS korelovala s nastolením a udržením SR (24). Ve studii L. Thomas a kol. došlo k regresi velikosti LS pouze u pacientů s po operaci se udržujícím SR, u pacientů s přetrvávající FS velikost LS naopak progredovala (17).
Vhodnou skupinou k porovnání s naším souborem jsou i studie hodnotící velikost a funkci levé síně po provedení katetrové ablace. Pappone a kol. prokázali, že po radiofrekvenční (RF) izolaci plicních žil s nastolením SR dochází ke zmenšení velikosti LS v odstupu 10 měsíců od zákroku (25). Zmenšení LS bylo výraznější, pokud byl zákrok úspěšný, tedy pokud byl spojen s trvalým udržením SR. Naopak u pacientů s neúspěšným zákrokem docházelo k negativní remodelaci a k progresi velikosti levé síně. Obdobně i Reant a kol. zaznamenali pokles velikosti LS po úspěšně RF ablaci (26). Také v dalších studiích byl zaznamenán pokles velikost LS po úspěšně RF ablaci FS (27-32), nebo alespoň nedocházelo k její další dilataci (33). Velikost LS v těchto případech byla ale hodnocena většinou v delším časovém úseku od operace než v naší práci.
Nutnou podmínkou k regresi velikosti LS zde bylo nastolení a udržení SR, naopak ve většině studií po neúspěšném zákroku docházelo k progresi negativní remodelace a tedy i velikosti LS. V hodnocení transportní funkce levé síně po RF ablaci FS se výsledky rozcházejí. Reant a kol. (26) prokázali, že echokardiograficky hodnocená LSEF se po úspěšné ablaci za 11 měsíců signifikantně nelišila od předoperačního vyšetření. V práci Vermy a kol., kde byla transportní funkce LS hodnocena pomocí electron beam CT a echokardiograficky dokonce došlo oproti předoperačním vyšetření k mírné-mu vzestupu hodnocených parametrů (32). Naopak Lemola a kol. popisují zhoršení parametrů mechanické funkce levé síně (hodnocených pomocí CT) po 6 měsících od RFA (34).
V současné době je známo, že přetrvávající FS vede k další negativní remodelaci a zhoršení transportních parametrů LS. Zmenšení velikosti LS či zamezení další progrese dilatace LS po kurativní léčbě FS může být způsobeno i samotným zákrokem (jizvení), vzhledem k nutnosti udržujícího se SR jako podmínky docílení výše uvedeného efektu ve většině prací nelze vyloučit reverzní remodelaci síně.
Dokumentované zhoršení parametrů transportní funkce LS za 1 měsíc po zákroku přičítáme efektu vlastní ablace s poškozením myokardu levé síně a následným reparačním procesům. Nelze samozřejmě vyloučit možnost ovlivnění transportní funkce LS v časném pooperačním období probíhajícími paroxysmy SVT. V úvahu připadá i možnost mechanické izolace zadní stěny levé síně po provedení mikrovlnné ablace. Accord a kol. ale ve své práci na souboru 3 zemřelých pacientů, majících v anamnéze epikardiální mikrovlnnou ablaci plicních žil, dokumentují výrazně převažující netransmurální charakter ablačních lézí levé síně (35). V daném případě však byla mikrovlnná energie aplikována po kratší dobu než u našich pacientů. Konečně Okada a kol. popisují u významné části pacientů po RF ablaci FS přechodné ztluštění stěn LS způsobené zřejmě otokem LS (36). V této práci sice nebylo zaznamenáno zhoršení transportní funkce LS, tato byla ovšem hodnocena echokardiograficky pouze pomocí vrcholové rychlosti plnění levé komory při síňovém stahu. Případný negativní vliv otoku LS na transportní funkci LS po RF ablaci ani existenci obdobného jevu u pacientů po epikardiální mikrovlnné ablaci FS (kde obdobná studie doposud neproběhla) rovněž nelze zcela vyloučit.
Závěr
Hemodynamicky účinná kontrakce levé síně je po úspěšné endoskopické mikrovlnné epikardiální izolaci plicních žil přítomna v celém souboru vyšetřovaných pacientů, transportní funkce levé síně se po zhoršení patrném časně po zákroku v odstupu 3 měsíců od operace výrazněji neliší od předoperačních hodnot. V uvedeném časovém intervalu nedochází k další negativní remodelaci levé síně, v některých parametrech objemu LS je patrný pokles.
Tato práce byla podpořena Výzkumným záměrem Univerzity Karlovy v Praze č. MSM 00 21620817, uděleným Ministerstvem školství, mládeže a tělovýchovy České republiky a schválena Etickou komisí FNKV.
MUDr. Zdeněk Peroutka
Kardiocentrum,
III. Interní – kardiologická klinika
FNKV a 3. LF UK Praha
Šrobárova 50
100 34 Praha 10
E-mail: zýdenekperoutka@gmail.com
Zdroje
1. Fuster, V., Rydén, L.E., Cannom, D.S. et al., American College of Cardiology; American Heart Association task force on practice guidelines; European Society of Cardiology Comittee for practice guidelines; European Heart Rhythm Association; Heart Rhythm Society. ACC/AHA/ /ESC. Guidelines for the managment of patients with atrial fibrillation. Europace 2006, 8(9), p. 651-745.
2. Calkins, H., Brugada, J., Packer, D.L. et al. European Heart Rhythm Association (EHRA); European Cardiac Arrhythmia Society (ECAS); American College of Cardiology (ACC); American Heart Association (AHA); Society of Thoracic Surgeons (STS); HRS/EHRA/ECAS expert Consensus Statement on catheter and surgical ablation of atrial fibrillation: recommendations for personnel, policy, procedures and follow-up. A report of the Heart Rhythm Society (HRS) Task force on catheter and surgical ablation of atrial fibrillation. Heart Rhythm 2007, 4(6), p. 816-861.
3. La Meir, M., De Roy L., Blommaert, M.D., Buche M. Treatment of lone atrial fibrillation with a right thoracoscopic approach. Ann. Thorac. Surg. 2007, 83(6), p. 2244-2245.
4. Pruitt, J.C., Lazzara, R.R., Dworkin, G.H., et al. Totally endoscopic ablation of lone atrial fibrillation: initial clinical experience. Ann. Thorac. Surg. 2006, 81(4), p. 1325-1330.
5. Sagbas, E., Akpinar, B., Sanisoglu , I., et al. Video-assisted bilateral epicardial pulmonary vein isolation for the treatment of lone atrial fibrillation. Ann. Thorac. Surg. 2007, 83(5), p.1724-1730.
6. Wolf, R.K., Schneeberger, E.W., Osterday, R., et al. Video assisted bilateral pulmonary vein isolation and left atrial appendage exclusion for atrial fibrillation. J. Thorac. Cardiovasc Surg. 2005, 130(3), p. 797-802.
7. Bisleri, G., Manzato, A., Argenziano, M., et al. Thoracoscopic epicardial pulmonary vein ablation for lone paroxysmal atrial fibrillation. Europace 2005, 7(2), p. 145-148.
8. Pappone, C., Rosanio, S., Augello, G., et al. Mortality, morbidity, and quality of life after circumferential pulmonary vein ablation for atrial fibrillation: outcomes from a controlled nonrandomized long–term study. J. Am. Coll. Cardiol. 2003, 42, p. 185-197.
9. Cox, J.L., Ad, N., Palazzo, T. Impact of the maze procedure on the stroke rate in patiens with atrial fibrillation. J. Thorac. Cardiovasc. Surg. 1999, 118(5), p. 833-840.
10. Bando, K., Kobayashi, J., Kosakai, Y., et al. Impact of Cox Maze procedure on outcome in patiens with atrial fibrillation and mitral valve disease. J. Thorac. Cardiovasc. Surg. 2002, 124(3), p. 575-583.
11. Handa, N., Schaff, H.V., Morris, J.J., et al. Outcome of valve repair and the Cox maze procedure for mitral regurgitation and associated atrial fibrillation . J. Thorac. Cardiovasc. Surg. 1999, 118(4), p. 628-635.
12. Fiala, M., Chovančík, J., Moravec, R. a kol. Recidivující arytmie po katetrové ablaci původně paroxysmální fibrilace síní a výsledky opakované ablace. Vnitř. lék. 2007, 53(12), s. 1248-1254.
13. Ujino, K., Barnes, M.E., Cha, S.S., et al. Two-dimensional echocardiographic methods for assessment of left atrial volume. Am .J. Cardiol. 2006, 98(9), p. 1185-1188.
14. Kircher, B., Abbott, J.A., Pau, S., et al. Left atrial volume determination by biplane-two dimensional echocardiography: validation by cine computed tomography. Am. Heart. J. 1991, 121(3, Pt 1), p. 864-871.
15. Thomas, L., Levett, K., Boyd, A., et al. Changes in regional left atrial function with aging: evaluation by Doppler tissue imaging. Eur. J. Echocardiogr. 2003, 4, p. 92-100.
16. Yuda, S., Nakatani, S., Kosakai, Y., et al. Long-term follow-up of atrial contraction after the maze procedure in patients with mitral valve disease. J. Am. Coll. Cardiol. 2001, 37(6), p. 1622-1627.
17. Jessurun, E.R., van Hemel, N.M., Kelder J.C., et al. The effect of maze operations on atrial volume. Ann. Thorac. Surg. 2003, 75(1), p. 51-56.
18. Thomas, L., Boyd, A., Thomas, S.P., et al. Atrial structural remodelling and restoration of atrial contraction after linear ablation for atrial fibrillation. Eur. Heart. J. 2003, 24(21), p. 1942-1951.
19. Yuda, S., Nakatani, S., Isobe, F., et al. Comparative efficacy of the maze procedure for restoration of atrial contraction in patiens with and without giant left atrium associated with mitral valve disease. J. Am..Coll. Cardiol.1998, 31, p. 1097-1102.
20. Lee, J.W., Choo, J.S., Kim, K.I., et al. Atrial fibrillation surgery simplified with cryoablation to improve left atrial function. Ann. Thorac. Surg. 2001, 72(5), p. 1479-1483.
21. Yashima, N., Nasu, M., Kawazoe, K., Hiramori, K. Serial evaluation of atrial function by Doppler echocardiography after the maze procedure for chronic atrial fibrillation. Eur. Heart. J. 1997, 18(3), p. 496-502.
22. Feinberg, M.S., Waggoner, A.D., Kater, K.M., et al. Restoration of atrial function after the maze procedure for patiens with atrial fibrillation. Assessment by Doppler echocardiography. Circulation 1994, 90(5, Pt 2), p. 285-292.
23. Yamanaka, K., Fujita, M., Doi, K., et al. Multislice computed tomography accurately quantifies left atrial size and function after the MAZE procedure. Circulation 2006, 114 (1 Suppl), p. I5-9.
24. Lönnerholm, S., Blomström, P., Nilsson, L., Blomström-Lundqvist, C. Atrial size and transport function after the Maze III procedure for paroxysmal atrial fibrillation. Ann. Thorac. Surg. 2002, 73(1), p. 107-111.
25. Pappone, C., Oreto, G., Rosanio, S., et al. Atrial electroanatomic remodelling after circumferential radiofrequency pulmonary vein ablation: efficacy of an anatomic approach in a large cohort of patients with atrial fibrillation. Circulation 2001, 104(21), p. 2539-2544.
26. Reant, P., Lafitte, S., Jaïs, P., et al. Reverse remodelling of the left cardiac chambers after catheter ablation after 1 year in a series of patiens with isolated atrial fibrillation. Circulation 2005, 112 (19), 2896-2903.
27. Beukema, W.P., Elvan, A., Sie, H.T., et al. Successful radiofrequency ablation in patients with previous atrial fibrillation results in a significant decrease in left atrial size. Circulation 2005, 112(14 ), p. 2089-2095.
28. Tops, L.F., Bax, J.J., Zeppenfeld, K., et al. Effect of radiofrequency catheter ablation for atrial fibrillation on left atrial cavity size. Am. J. Cardiol. 2006, 97(8), p. 1220-1222.
29. Oral, H., Pappone, C., Chugh, A., et al. Circumferential pulmonary-vein ablation for chronic atrial fibrillation. N. Engl. J. Med. 2006, 354(9), p. 934-941.
30. Takahashi, Y., O‘Neill, M.D., Hocini, M., et al. Effects of stepwise ablation of chronic atrial fibrillation on atrial electrical and mechanical properties. J. Am. Coll. Cardiol. 2007, 49(12), p. 1306-1314.
31. Lemola, K., Sneider, M., Desjardins, B., et al. Effects of left atrial ablation of atrial fibrillation on size of the left atrium and pulmonary veins. Heart Rhythm 2004, 1(5), p. 576-581.
32. Verma, A., Kilicaslan, F., Adams, J.R., et al. Extensive abation during pulmonary vein antrum isolation has no adverse impact on left atrial function: an echocardiography and cine computed tomography analysis. J. Cardiovasc. Electrophysiol. 2006, 17(7), p. 741-746.
33. Tsao, H.M., Wu, M.H., Juany B.H., et al. Morphologic remodeling of pulmonary veins and left atrium after catheter ablation of atrial fibrillation: insight from long-term follow-up of three-dimensional magnetic resonance imaging. J. Cardiovasc. Electrophysiol. 2005, 16(1), p. 7-12.
34. Lemola, K., Desjardins, B., Sneider, M., et al. Effect of left atrial circumferential ablation for atrial fibrillation on left atrial transport function. Heart Rhythm 2005, 2(9), p. 923-928.
35. Accord, R.E., van Zuzlen R.J., van Brakel, T.J., Maessen, J.G. Post-mortem histologic evaluation of microwave lesions after epicardial pulmonary vein isolation for atrial fibrillation. Ann. Thorac. Surg. 2005, 80(3), p. 881-887.
36. Okada, T., Yamada, T., Murakami, Y., et al. Prevalence and severity of left atrial edema detected by electron beam tomography early after pulmonary vein ablation. J. Am. Coll. Cardiol. 2007, 49(13), p. 1436-1442.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek Paměť a její poruchyČlánek Fantomy na psacích stolech
Článek vyšel v časopisePraktický lékař
Nejčtenější tento týden
2008 Číslo 2- Nitrofurantoin s řízeným uvolňováním – osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
-
Všechny články tohoto čísla
- O lidech, kteří hromadí věci a zvířata
- Současné přístupy k očkování konjugovanou pneumokokovou vakcínou
- Akutní toxická hepatitida po bylinném přípravku
- Kdy je pacient nebezpečný sobě?
- Stavovský oční lékař J. A. Ryba a budování oční kliniky na pražské univerzitě
- Miniportréty slavných českých lékařů Profesor Václav Piťha neurolog, budovatel tří klinik
- Fantomy na psacích stolech
- Hrozí zneužití – diskreditace lékařské genetiky
- Sanofi-Pasteur podává v Evropě žádost o registraci první vakcíny proti sezónní chřipce aplikované intradermální mikroinjekcí
- Činnost dobrovolníků DC Lékořice v oddělení LDN1-A2 FTNsP Praha Krč
- Transparentní zodpovědnost (accountability) v medicíně a zodpovědnost etických komisí
- Současné možnosti a problémy antiretrovirové terapie
- Etiopatogeneze autismu z pohledu buněčné a molekulární biologie
- Paměť a její poruchy
- Metalothionein a jeho vztah k protinádorové léčbě na bázi platinových komplexů
- Hodnocení dynamiky transportní funkce a remodelace levé srdeční síně po úspěšné endoskopické mikrovlnné epikardiální izolaci plicních žil. Pilotní studie.
- Praktický lékař
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Paměť a její poruchy
- Současné možnosti a problémy antiretrovirové terapie
- Miniportréty slavných českých lékařů Profesor Václav Piťha neurolog, budovatel tří klinik
- Akutní toxická hepatitida po bylinném přípravku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



