-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Změny respirace plicních fibroblastů in vitro po opakované krátkodobé hyperoxické expozici
Changes in pulmonary fibroblasts respiration in vitro after repeated short-term hyperoxic exposure
Study aims to evaluate effects of repeated exposure to HBO on mitochondrial respiration assessed by high-resolution respirometry (HRR), cell viability estimated by PrestoBlue® reaction, morphology analyzed by routine phase contrast and fluorescent microscopy, and superoxide dismutase (SOD) and citrate synthase (CS) activities using human lung fibroblasts. The cells were exposed to HBO (3 ATA) for 2 hours per day for 5 consecutive days. One day after the last exposure, HBO cells displayed significantly smaller area and perimeter, compromised viability and elevated SOD activity. No changes were detected in CS activity or quality of mitochondrial network. HRR revealed impaired mitochondrial oxygen consumption manifested by increased leak respiration, decreased activity of complex II and compromised ATP-related oxygen consumption when fatty acids were oxidized. Our findings document that in conditions mimicking chronic intermittent exposure to HBO, lung fibroblasts suffer from compromised mitochondrial respiration linked to complex II and impaired cellular growth in spite of increased antioxidant defense. Underlying mechanism of this HBO-induced mitochondrial dysfunction should be further explored.
Keywords:
hyperbaric hyperoxia – high resolution respirometry – human fetal lung fibroblasts – mitochondria – superoxide dismutase
Autoři: J. Dejmek 1,2; M. Marková 2,3; M. Kripnerová 4; M. Čedíková 2,3; Z. Tůma 2; V. Babuška 5; L. Bolek 1,2; J. Kuncová 1,2,3
Působiště autorů: Ústav biofyziky, Lékařská fakulta v Plzni, Univerzita Karlova, Plzeň, vedoucí doc. MUDr. Jitka Kuncová, Ph. D. 1; Biomedicínské centrum, Lékařská fakulta v Plzni, Univerzita Karlova, Plzeň, vědecký ředitel doc. MUDr. Milan Štengl, Ph. D. 2; Ústav fyziologie, Lékařská fakulta v Plzni, Univerzita Karlova, Plzeň, vedoucí doc. MUDr. Milan Štengl, Ph. D. 3; Ústav biologie, Lékařská fakulta v Plzni, Univerzita Karlova, Plzeň, vedoucí doc. RNDr. Martin Pešta, Ph. D. 4; Ústav lékařské chemie a biochemie, Lékařská fakulta v Plzni, Univerzita Karlova, Plzeň, vedoucí prof. MUDr. Jaroslav Racek, DrSc. 5
Vyšlo v časopise: Pracov. Lék., 70, 2018, No. 3-4, s. 130-135.
Kategorie: Hyperbarická medicína - původní práce
Souhrn
Studie se zaměřuje na hodnocení účinku opakované expozice HBO na mitochondriální respiraci lidských fetálních plicních fibroblastů (HFL1). Mitochondriální spotřeba kyslíku byla hodnocena metodou high-resolution respirometry (HRR), životaschopnost buněk hodnocena PrestoBlue®, morfologie analyzovaná rutinní fluorescenční mikroskopií a fázovým kontrastem a byla zhodnocena aktivita superoxid dismutázy (SOD) a citrát syntázy (CS). Buňky byly vystaveny HBO (3 ATA) 2 hodiny denně po dobu 5 po sobě jdoucích dní. Den po poslední HBO expozici vykazovaly buňky podstatně menší plochu a obvod, sníženou životaschopnost a zvýšenou aktivitu SOD. Nebyly zjištěny žádné změny v aktivitě CS ani v kvalitě mitochondriální sítě. HRR odhalila sníženou mitochondriální spotřebu kyslíku, která se projevila snížením aktivity komplexu II a sníženou spotřebou kyslíku při oxidací mastných kyselin. Naše zjištění dokládají, že v podmínkách napodobujících intermitentní expozici HBO, trpí plicní fibroblasty zhoršenou mitochondriální respirací spojenou s komplexem II a poruchou buněčného růstu i při zvýšené antioxidační obraně. Mechanismus této HBO-indukované mitochondriální dysfunkce je nutné hlouběji prozkoumat.
Klíčová slova:
hyperbarická hyperoxie – respirometrie s vysokým rozlišením – lidské fetální plicní fibroblasty – mitochondrie – superoxiddismutáza
ÚVOD
Hyperbarická oxygenoterapie (HBO), tj. dýchání čistého kyslíku za normálního atmosférického tlaku nebo přetlaku 250–300 kPa je využívána jako primární či podpůrná léčba řady onemocnění, jako např. dekompresní choroby, léčba chronických a nehojících se ran a vředů, postradiačního poškození, anaerobní infekce, poranění páteře či otravy oxidem uhelnatým [2, 3, 6, 11, 16]. V odborné literatuře je však popsána řada nežádoucích účinků oxygenoterapie, které její bezpečnou aplikaci omezují, ale jejichž podstata na tkáňové, buněčné, subcelulární a molekulární úrovni není přesně známa. Cílem naší studie bylo zhodnotit účinky intermitentní HBO na základní buněčné parametry, zejména na mitochondriální respiraci plicních fibroblastů.
SOUBOR A METODIKA
Příprava buněčného materiálu probíhala v mikrohyperbarické komoře (uHBK2), což je jedinečný biofyzikální reaktor vyvinutý ve spolupráci Univerzity Palackého v Olomouci a Univerzity Karlovy v Praze. Zařízení o vnitřním objemu 0,5 l umožňuje zvýšení tlaku v komoře až do 15 MPa, změny ve složení atmosféry, a přesné regulace vnitřní teploty.
Použitá buněčná linie fetálních lidských plicních fibroblastů (HFL1) byla získána z ATCC (American Type Culture Collection, Rockville, Maryland, USA) a kultivována podle doporučení výrobce při 37 °C v inkubátoru s 5% koncentrací CO2.
Hyperbarická hyperoxická expozice probíhala po dobu 5 dní v mikrohyperbarické komoře při tlaku 5 kPa CO2 a 295 kPa O2, teplotě 37 °C a 100% relativní vlhkosti. Po dvouhodinové expozici byly buňky vráceny do inkubátoru a kultivovány za standardních podmínek. Kontrolní buňky byly po celou dobu experimentu udržovány v normobarických podmínkách (vzduch + 5% CO2). Po opakované expozici byla u buněk pomocí Bürkerovy hemocytometrické metody sledována růstová křivka. Životaschopnost buněk exponovaných HBO byla hodnocena s použitím PrestoBlue® viability reagent podle doporučení výrobce (Invitrogen, Life Technologies, Prague, CZ) a základní morfologické hodnocení bylo provedeno rutinním fázovým kontrastním mikroskopickým pozorováním (Olympus IX 81, kamera u Hamamatsu Orca-ER, Japan). Pro vyhodnocení fotografií byl použit software QuickPHOTO Industrial 2.3. Buněčný cytoskelet byl analyzován pomocí metody nepřímé fluorescence. Vzorky byly zpracovány pomocí fixační/permeabilizační sady Image-iT® a značeny primárními protilátkami Anti-Vinculin (V9131), Anti Vimentin (V5255) a sekundárními protilátkami IgG-Atto 488 (62197) a IgM-FITC (F9259). Pro značení aktinu byl použit Phalloidin-Atto 488 (49409). Buněčná mitochondriální síť byla vizualizována pomocí MitoTracker™ Red CMXRos. Základní zpracování vzorků bylo následováno fluorescenční mikroskopií při zvětšení 100krát (Olympus IX81, Japan). Respirometrické experimenty byly prováděny ve 2ml skleněných komorách přístroje Oxygraph2k (OROBOROS) při 37 °C. Buňky byly injikovány v přibližném počtu ~ 5 × 105 buněk na komoru a spotřeba kyslíku byla měřena v respiračním médiu MIR0 [13]. Po uzavření komor byla buněčná membrána permeabilizována digitoninem (5 μg/ml) a byly analyzovány jednotlivé respirační stavy (ROUTINE, OXPHOS, LEAK, ROX) navozené kombinací substrátů, inhibitorů a rozpřahovače. Respirační aktivita byla hodnocena při použití dvou titračních protokolů:
1. digitonin, malát, palmitoylkarnitin, ADP, cytochrom c, glutamát, pyruvát, sukcinát, FCCP, rotenon, antimycin A a askorbát/TMPD (Dig, M, Pcar, D, c, G, P, S, u, Rot, AmA, As, TM); 2. digitonin, malát, glutamát, ADP, cytochrom c, pyruvát, sukcinát, oligomycin, FCCP, rotenon, antimycin A a askorbát/TMPD (Dig, M, G, D, c, P, S, Omy, u, Rot, AmA, As, TM.
Spotřeba kyslíku byla analyzována softwarem DatLab (Oroboros Instruments, Innsbruck, Rakousko) jako negativní časová derivace koncentrace kyslíku v komoře, vyjádřená v pmol O2/(s.106 buňkách) a korigovaná na ROX, přístrojovéa chemické pozadí. Aktivita enzymu citrátsyntázy byla stanovena spektrofotometricky a vyjádřena v mIU na 106 buněk a aktivita superoxiddismutázy byla analyzována pomocí SOD determination kit podle pokynů výrobce.
Všechna data byla statisticky zhodnocena v softwaru OriginPro 2017. Po testování normálnosti distribuce a homogenity odchylek byla provedena srovnání pomocí Studentova t-testu nebo Mannova-Whitneova U testu.
VÝSLEDKY
Buňky vystavené přerušované HBO vykazovaly tendenci k pomalejšímu růstu; počet buněk se však významně nelišil od kontrolních buněk (obr. 1A).
Obr. 1. A-C. Hodnocení změn buněčné morfologie HFL1
A – rychlost růstu vyjádřená počtem buněk na 1 ml se mezi kontrolní a HBO fibroblasty nelišila
B, C – HFL1 ve fázovém kontrastu při zvětšení 60krát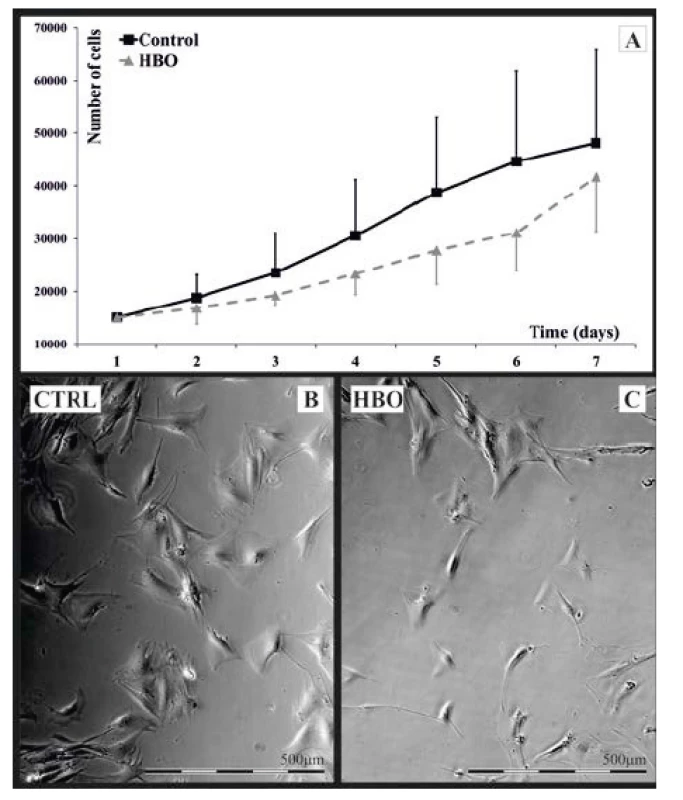
Životaschopnost buněk byla stanovena činidlem PrestoBlue® ve fluorescenčních jednotkách (FU). U buněk HFL1 vystavených HBO jsme pozorovali signifikantně nižší hodnotu signálu (25,77 ± 8,84 FU) ve srovnání s kontrolními buňkami (34,56 ± 9,59 FU). Vyšší hodnoty fluorescence korelují s větší celkovou metabolickou aktivitou a životaschopností (p < 0,001). Pomocí rutinní mikroskopie ve fázovém kontrastu se ukázaly rozdíly v morfologii buněk mezi kontrolní a HBO skupinou (obr. 1B, C). Všechny fibroblasty měly typický mezenchymální tvar buňky; nicméně v kontrolní skupině vykazovaly větší plochu (10,432 ± 4119 μm2 proti 5199 ± 1863 μm2 v buňkách HBO, p < 0,001), větší obvod (606 ± 84 μm vs. 506 ± 130 μm v buňkách HBO, p < 0,001) a vyšší indexy cirkularity než u HBO buněk (0,39 ± 0,16 vs. 0,28 ± 0,12; kontrol vs. HBO; p < 0,001). Za účelem porovnání morfologie cytoskeletu byly fibroblasty značeny protilátkami proti základním proteinům cytoskeletu. Analýza ukázala, že obě skupiny buněk měly typickou mezenchymální morfologii bez viditelných rozdílů. Jádra obou skupin buněk byla převážně elipsoidní a většina z nich byla lokalizována centrálně (obr. 2A až F). Kvalitativní analýza mitochondrií pomocí fluorescenčního značení MitoTracker™ Red CMXRos neodhalila žádné zjevné rozdíly ve velikosti, lokalizaci či struktuře jak mitochondrií samotných, tak i mitochondriálních sítí (obr. 2G–H).
Obr. 2. A-H. Fluorescenční mikroskopické snímky lidských fibroblastů HFL1 (CTRL A, C, E, G), (HBO, B, D, F, H)
Vizualizace fokálních adhezí a cytoskeletu (A-F): aktinová vlákna (A, B, zvětšení 200krát), vimentin (C, D, zvětšení 200krát), vinculin (E, F; zvětšení 40krát). Buňky měly normální mezenchymální morfologii bez viditelných rozdílů. Kvalitativní analýza mitochondrií při zvětšení 160krát (G, H) neprokázala žádné zjevné změny v množství a lokalizaci organel nebo v struktuře mitochondriálních sítí.
Rutinní respirace intaktních kontrolních fibroblastů (stav ROUT) se významně nelišila od buněk vystavených HBO. Stav LEAK (L), který je hodnocen po permeabilizaci buněčné membrány digitoninem a za současného přidání substrátů malátu a palmitoylcarnitinu, byl významně vyšší u HBO buněk (20,2 ± 6,9 pmol/(s.106 bb)) ve srovnání s kontrolními fibroblasty (10,9 ± 4,0 pmol/(s.106 bb) p <0,001). Hyperoxická expozice však významně neovlivnila stavy OXPHOS (PAL), OXPHOS (PalG), OXPHOS (PalGP), OXPHOS (PalGPS), ETS (PalGPS), ani CIV (obr. 3B). Stav ETS (S), tj. mitochondriální kapacita eletrontransportního řetězce pro přenos elektronů, byl po inhibici komplexu I rotenonem signifikantně nižší u HBO fibroblastů (72,0 ± 21,4 pmol/s 106 bb) ve srovnání s kontrolami (98,6 ± 29,1 pmol/s .106 bb), p < 0,05). Poměr L (LEAK)/P (OXPHOS) byl zvýšen u HBO ve srovnání s kontrolními buňkami (0,42 ± 0,16 a 0,18 ± 0,06, respektive p < 0,001). Přestože se nelišila spotřeba kyslíku nutná pro fosforylaci a přenos elektronů (parametry OXPHOS (PalGPS) a ETS (PalGPS)), zvýšená kapacita E-P, stanovená jako rozdíl mezi respiračními stavy ETS (PalGPS) a OXPHOS byla výrazně nižší u buněk vystavených HBO. Mitochondriální kapacita tvorby ATP při utilizaci mastných kyselin byla nižší u HBO fibroblastů (30,4 ± 17,5 pmol/(s.106 cells) než u kontrolních fibroblastů (56,8 ± 22,8 pmol/(s.106 bb), p < 0,05). V buňkách vystavených HBO byla rovněž nižší respirační rezerva, stanovená jako rozdíl mezi maximálním možnou respirační spotřebou, ROUT a LEAK respirací (RR = OXPHOS (PalGPS) – ROUT-LEAK) (36,2 ± 19,6 pmol/(s.106 bb) ve srovnání s kontrolními fibroblasty (67,7 ± 33,3 pmol/(s.106 bb), p < 0,01; obr. 3D).
Obr. 3. A-D. Mitochondriální respirace A – Příklad titračního protokolu substrátů-rozpřahovačů pro kontrolní HFL1 buňky se substráty pro elektron-transferující flavoprotein (ETF), Komplex I a Komplex II. Černá křivka = spotřeba kyslíku vyjádřená na 106 kontrolních buněk
Substráty: Dig = digitonin, M = malát, Pal = palmitoylcarnitin, D = ADP, c = cytochrom c, G = glutamát, P = pyruvát, S = sukcinát, u = FCCP, Rot = rotenon, AmA = antimycin A.
B – základní respirační stavy
C – poměry respiračních stavů
D – rozdíly respiračních stavů (P-OXPHOS, L-LEAK, E-ETS)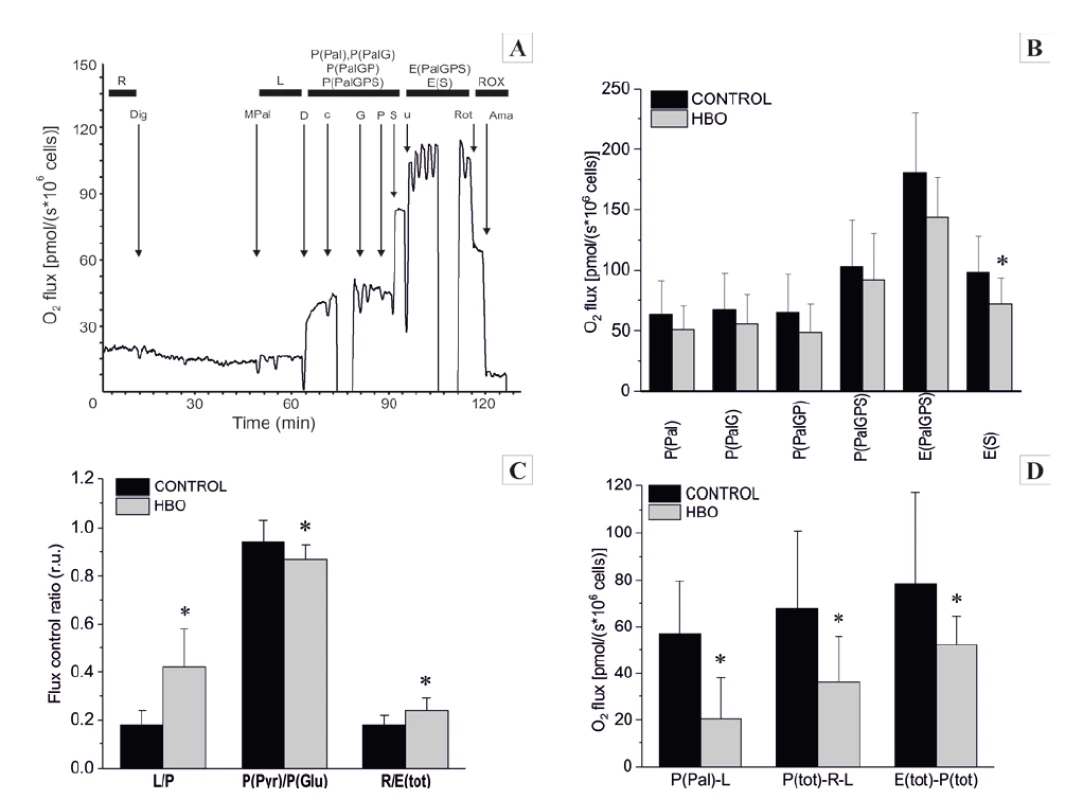
Aktivita enzymu citrátsyntázy se významně nelišila u kontrolních buněk (126 ± 36 mIU/106 bb) a buněk vystavených intermitentní expozici hyperoxii (124 ± 57 mIU/106 bb), což naznačuje, že HBO neovlivňuje množství mitochondrií v buňkách. Naproti tomu aktivita enzymu superoxiddismutázy byla podstatně vyšší u buněk HBO (20,6 ± 2,7%) ve srovnání s buňkami kontrolními (14,7 ± 2,5%, p < 0,001).
DISKUSE
Tato studie popisuje účinky opakované expozice HBO na buněčnou a mitochondriální morfologii, buněčnou proliferaci, viabilitu, antioxidační kapacitu a mitochondriální respiraci u lidských plicních fibroblastů. Jedním z důležitých závěrů naší studie bylo pozorování vlivu HBO na mitochondriální spotřebu kyslíku, zejména respirační stav. Tento stav odráží mitochondriální účinnost a produkci reaktivních forem kyslíku ROS [8] a může tak představovat až 38 % bazálního metabolismu u savců [19]. Superoxidový anion (O2-) je primární kyslíkový radikál vytvořený elektronovým transportním řetězcem [8], který je tvořen zejména respiračními komplexy I a III. Následně je redukován na peroxid vodíku pomocí enzymu superoxiddizmutázy (SOD) jakožto hlavním antioxidačním obranným systémem [5]. Aktivita SOD u pacientů léčených HBO je pak často zvýšená společně se zvýšenou produkcí ROS a dalšími markery oxidativního stresu [17]. Všechny parametry spojené s potenciální schopností buněk zvýšit spotřebu kyslíku a tvorbu ATP byly významně nižší u buněk vystavených HBO ve srovnání s kontrolními buňkami, což naznačuje, že ovlivněné fibroblasty mají sníženou schopnost vyrovnat se s metabolickými potřebami během procesů náročných na energii, jako je růst a dělení. Parametry kvantifikující celkovou morfologii buněk byly u HBO buněk výrazně nižší než u kontrol. I když se na konci experimentu počet HBO a kontrolních buněk významně nelišil, test buněčné viability kvantifikující redukci nefluorescenčního resazurinu na fluorescenční resorufin pomocí mitochondriálních a cytoplazmatických enzymů naznačoval, že vlivem HBO došlo pravděpodobně k narušení buněčného metabolismu. Mezi HBO a kontrolními fibroblasty nebyly odhaleny žádné viditelné rozdíly v množství ani struktuře mitochondrií a mitochondriálních sítí.
Snížená aktivita komplexu II pozorovaná u buněk vystavených HBO může mít několik zajímavých důsledků. Respirační komplex II je v mitochondriálním elektronovém transportním systému jediný propojující prvek s metabolismem trikarboxylových kyselin. Předpokládá se, že by mohl být zdrojem rezervní respirační kapacity v reakci na různé metabolické senzory, jako je AMP-dependentní kináza nebo pyruvátdehydrogenáza (PDH) prostřednictvím mechanismu závislého na sirtuin-3 [14]. Přestože jsme neanalyzovali aktivitu PDH ani její expresi, lze účinek pyruvátu odvodit z respirometrického protokolu. Pyruvát měl významný inhibiční účinek na mitochondriální spotřebu kyslíku indukovanou substráty ETF a komplexu I, tj. malát, palmitoylcarnitine a glutamát. Hodnota vychází z poměru OXPHOS (PalGP)/OXPHOS (PalG), která byla nižší v HBO buňkách ve srovnání s kontrolou. Tento děj je jednoznačně zprostředkován PDH, která mění svoji aktivitu v reakci na oxidaci mastných kyselin [7, 10, 15] a je regulován PDH kinázami [14]. Stimulace PDH prostřednictvím inaktivace PDK dichloracetátem by mohla významně zvýšit nejen spotřebu kyslíku související s komplexem I, ale také aktivitu komplexu II. Naše výsledky ukazují, že HBO podmínky by mohly interferovat s regulací mitochondriální respirace částečnou inhibicí aktivity komplexu II. Bylo prokázáno, že komplex II by mohl ovlivňovat produkci superoxidu jinými komplexy elektronového transportního systému a jeho činnost by mohla být inhibována peroxidem vodíku [4, 12]. Na druhou stranu, inhibice komplexu II by mohla sloužit v různých patologických stavech jako ochrana proti oxidativnímu stresu [1, 9, 18].
ZÁVĚR
Tato studie ukazuje, že opakované vystavení plicních fibroblastů HBO mělo za následek narušení mitochondriální spotřeby kyslíku, které se projevilo zvýšenou respirací ve stavu LEAK, sníženou aktivitou komplexu II a pravděpodobně také sníženou utilizací mastných kyselin. Detailnější výzkum vlivu HBO na metabolickou plasticitu buněk a tkání a její časový průběh by mohl přinést nové poznatky užitečné pro vyhodnocení rizika a prospěchu oxygenoterapie u některých metabolických onemocnění.
Poděkování
Studie byla podpořena Výzkumným fondem Univerzity Karlovy (Progres Q39), Národním programem udržitelnosti I (NPUI) č. LO1503 poskytované MŠMT ČR, projekt č. CZ.02.1.01 /0.0/0.0/16_019/0000787 "Fighting INfectious Diseases", udělený MŠMT ČR, financovaný z EFRR a specifický studijní výzkumný projekt č. 260394/2017 Univerzity Karlovy v Praze.
Do redakce došlo dne 5. 9. 2018.
Do tisku přijato dne 11. 9. 2018.
Adresa pro korespondenci:
Ing. Jiří Dejmek, Ph.D.
Biomedicínské centrum, UK a LF v Plzni
alej Svobody 1655/76
323 00 Plzeň
e-mail: jiri.dejmek@lfp.cuni.cz
Zdroje
1. Adebiyi, A., McNally, E. M., Jaggar, J. H. Sulfonylurea receptor-dependent and -independent pathways mediate vasodilation induced by ATP-sensitive K+ channel openers. Molecular Pharmacology, 2008, 74, p. 736–743.
2. Bosco, G., Casarotto, A., Nasole, E., Camporesi, E., Salvia, R., Giovinazzo, F., Zanini, S., Malleo, G., Di Tano, A., Rubini, A., Zanon, V., Mangar, D., Bassi, C. Preconditioning with Hyperbaric Oxygen in Pancreaticoduodenectomy: a Randomized Double-blind Pilot Study. Anticancer Res., 2014, 34, p. 2899–2906.
3. Brem, H., Tomic-Canic, M. Cellular and molecular basis of wound healing in diabetes. The Journal of Clinical Investigation, 2007, 117, p. 1219–1222.
4. Dröse, S., Bleier, L., Brandt, U. A common mechanism links differently acting complex II inhibitors to cardioprotection: modulation of mitochondrial reactive oxygen species production. Molecular Pharmacology, 2011, 79, p. 814–822.
5. Fukai, T., Ushio-Fukai, M. Superoxide Dismutases: Role in Redox Signaling, Vascular Function, and Diseases. Antioxidants & Redox Signaling, 2011, 15, p. 1583–1606.
6. Huang, C. C., Ho, C. H., Chen, Y.C., Lin, H. J., Hsu, C. C., Wang, J. J., Bin Su, S., Guo, H.R. Hyperbaric Oxygen Therapy Is Associated With Lower Short - and Long-Term Mortality in Patients With Carbon Monoxide Poisoning. Chest, 2017, 152, p. 943–953.
7. Chicco, A., Gutman, R., Lombardo, Y. B. Biochemical abnormalities in the heart of rats fed a sucrose-rich diet: is the low activity of the pyruvate dehydrogenase complex a result of increased fatty acid oxidation? Metabolism: Clinical and Experimental, 1991, 40, p. 15–21.
8. Jastroch, M., Divakaruni, A.S., Mookerjee, S., Treberg, J. R., Brand, M. D. Mitochondrial proton and electron leaks. Essays In Biochemistry, 2010, 47, p. 53–67.
9. Jodeiri Farshbaf, M., Kiani-Esfahani, A. Succinate dehydrogenase: Prospect for neurodegenerative diseases. Mitochondrion, 2017.
10. Kelley, D. E., Mokan, M., Simoneau, J. A., Mandarino, L. J. Interaction between glucose and free fatty acid metabolism in human skeletal muscle. The Journal of Clinical Investigation. 1993, 92, p. 91–98.
11. Moon, K. C., Han, S. K., Lee, Y. N., Jeong, S. H., , Dhong, E. S., Kim, W. K. Effect of normobaric hyperoxic therapy on tissue oxygenation in diabetic feet: a pilot study. Journal of Plastic, Reconstructive & Aesthetic Surgery, 2014, 67, p. 1580–1586.
12. Nulton-Persson, A.C., Szweda, L. I. Modulation of Mitochondrial Function by Hydrogen Peroxide. Journal of Biological Chemistry, 2001, 276, p. 23357–23361.
13. Pesta, D., Gnaiger, E. High-Resolution Respirometry: OXPHOS Protocols for Human Cells and Permeabilized Fibers from Small Biopsies of Human Muscle. Methods in molecular biology, 2012, 810, p. 25–58.
14. Pfleger, J., He, M., Abdellatif, M. Mitochondrial complex II is a source of the reserve respiratory capacity that is regulated by metabolic sensors and promotes cell survival. Cell Death & Disease, 2015, 6, p. e1835–e1835.
15. Scholz, R., Olson, M. S., Schwab, A. J., Schwabe, U., Noell, C., Braun, W. The Effect of Fatty Acids on the Regulation of Pyruvate Dehydrogenase in Perfused Rat Liver. Eur. J. Biochem, 1978, 86, p. 519–530.
16. Schreml, S., Szeimies, R. M., Prantl, L., Karrer, S., Landthaler, M., Babilas, P. Oxygen in acute and chronic wound healing. British Journal of Dermatology, 2010, 163, p. 257–268.
17. Simsek, K., Ay, H., Topal, T., Ozler, M., Uysal, B., Ucar, E., Acikel, Ch., Yesilyurt, O., Korkmaz, A., Oter, S., Yildiz, S. Long-term exposure to repetitive hyperbaric oxygen results in cumulative oxidative stress in rat lung tissue. Inhalation Toxicology, 2011, 23, p. 166–172.
18. Wojtovich, A. P., Brookes, P. S. The complex II inhibitor atpenin A5 protects against cardiac ischemia-reperfusion injury via activation of mitochondrial KATP channels. Basic Research in Cardiology, 2009, 104, p. 121–129.
19. Brand, Martin D., Lee Feng Chien, Edward K. Ainscow, David F. S. Rolfe, Richard K. Porter The causes and functions of mitochondrial proton leak [online]. 30. srpen 1994. [vid. 2018-05-06]. ISBN 0005-2728. Dostupné z: doi:10.1016/0005-2728(94)90099-X.
Štítky
Hygiena a epidemiologie Hyperbarická medicína Pracovní lékařství
Článek vyšel v časopisePracovní lékařství
Nejčtenější tento týden
2018 Číslo 3-4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- V ČR chybí specializovaná péče o pacienty s nervosvalovým onemocněním
- Historický milník v renoprotekci − účinnost kombinace trandolapril + verapamil ve studii BENEDICT
-
Všechny články tohoto čísla
- Stanovenie rizika z expozície zamestnancov vibráciám pri práci v manipulačno-expedičných skladoch – časť 1: vedecký základ
- Stanovenie rizika z expozície zamestnancov vibráciám pri práci v manipulačno-expedičných skladoch – časť 2: výsledky štúdie
- Noční práce a kardiovaskulární onemocnění
- Předmluva k článkům na témata hyperbarické medicíny
- Změny respirace plicních fibroblastů in vitro po opakované krátkodobé hyperoxické expozici
- Telemetrické meranie potkanov počas experimentálnych ponorov v hyperbarickej komore – pilotná štúdia
- Aktuální vědecké důkazy účinnosti hyperbarické oxygenoterapie u vybraných chronických indikací – přehled systematických review
- Efektivita hyperbarické oxygenoterapie u pacientů s komplexním regionálním syndromem bolestivosti – protokol systematického review
- Poškození plic (lung squeeze) při freedivingu
- Vývoj in vitro modelu pre štúdium vplyvu hyperbarickej oxygenoterapie na antimikrobiálne účinky vybraných antibiotik
- VZDĚLÁVACÍ AKCE IPVZ
- Hygienické limity pro uznávání nemocí z povolání
- Ekzémová onemocnění rukou*
- Vývoj prevalence kuřáctví a poskytování krátkých intervencí u zaměstnanců Fakultní nemocnice Královské Vinohrady a 3. lékařské fakulty Univerzity Karlovy
- Vliv noční práce na výskyt kardiovaskulárních onemocnění zdravotníků
- Skutečná účinnost respirátorů při ochraně dýchacích cest
- Pracovní lékařství
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Skutečná účinnost respirátorů při ochraně dýchacích cest
- Poškození plic (lung squeeze) při freedivingu
- Ekzémová onemocnění rukou*
- Stanovenie rizika z expozície zamestnancov vibráciám pri práci v manipulačno-expedičných skladoch – časť 1: vedecký základ
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



