-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaVplyv inhibície HSP90 na viabilitu a bunkový cyklus v závislosti od stavu p53
Impact of HSP90 Inhibition on Viability and Cell Cycle in Relation to p53 Status
Background:
Chaperone system inhibition is a recent promising strategy for cancer treatment that exploits increased metabolic needs required for rapid proliferation as well as higher level of proteotoxic stress in neoplastic cells. Chaperone HSP90 plays a key role in proper folding of many de novo synthesized proteins, so-called clients, including tumor suppressor p53 which is commonly mutated in majority of cancers. Aim of this work was therefore to understand the impact of HSP90 inhibition by NVP-AUY922 on breast cancer cell lines with wild-type and mutated p53.Methods:
Flow cytometry was used to analyze cell viability by fluorescein diacetate assay and changes in cell cycle. Western blotting was used to analyze expression of p53 and p21 proteins.Results:
Analysis of cell viability after HSP90 inhibition revealed higher sensitivity of cell line with wild-type p53. Cell cycle analysis then showed that both cell lines undergo increase in G2/M block of the cell cycle, but wild-type cell line had also substantial decrease in proliferative capacity of treated cells. We also observed increased expression of negative cell cycle regulator p21 in cell line with wild-type p53.Conclusions:
Since p21 is directly regulated by p53, our results suggest that mutation status of p53 can be important factor in treatment of breast cancer cells by HSP90 chaperone inhibition and that wild-type p53 can increase sensitivity to HSP90 inhibition.Key words:
breast cancer – cell cycle – chaperone – HSP90 – TP53 – p21 – p53 – NVP-AUY922
This work was supported by the project MEYS – NPS I – LO1413.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
6. 5. 2016Accepted:
17. 5. 2016
Autoři: M. Pastorek; P. Müller; B. Vojtěšek
Působiště autorů: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno
Vyšlo v časopise: Klin Onkol 2016; 29(Supplementum 4): 40-45
Kategorie: Původní práce
doi: https://doi.org/10.14735/amko20164S40Souhrn
Východiská:
Inhibícia chaperónového systému je sľubnou protinádorovou stratégiou, ktorá využíva zvýšené metabolické nároky neoplastických buniek potrebné pre ich rýchlu proliferáciu a kompenzáciu vysokej miery proteotoxického stresu. V súčasnosti sa v klinických štúdiách nachádza niekoľko inhibítorov HSP90, chaperónu, ktorý hrá kľúčovú úlohu pri nadobudnutí správnej konformácie širokého spektra de novo syntetizovaných proteínov. Jedným z jeho klientov je aj tumor supresorový proteín p53, ktorého mutácia je spoločným znakom väčšiny nádorových ochorení. Cieľom tejto práce bolo preto porovnať efekt inhibície HSP90 pomocou inhibítora NVP-AUY922 na modeli bunkovej línie karcinómu prsníka s aktívnou formou p53 a z nej odvodenej línie, kde bol p53 mutáciou inaktivovaný.Metódy:
Prietoková cytometria bola použitá na analýzu viability pomocou fluorescein diacetate (FDA) assay a na analýzu bunkového cyklu. Western blotting bol použitý na analýzu expresie proteínov p53 a p21.Výsledky:
Analýza viability a bunkového cyklu ukázala vyššiu senzitivitu na inhibíciu HSP90 u línie s wild-type p53, ktorá sa na rozdiel od línie s mutovaným p53 prejavila nielen blokom v G2/M, ale aj v zníženej schopnosti proliferácie buniek. Po inhibícii HSP90 sme vo wild-type línii oproti línii s mutovaným p53 pozorovali tiež indukciu proteínu p21.Záver:
V regulácii bunkového cyklu v podmienkach zvýšeného proteotoxického stresu spôsobeného inhibíciou HSP90 pravdepodobne hrá úlohu aj proteín p53, čo podporuje aj vo wild-type línii pozorované zvýšenie hladiny negatívneho regulátora bunkového cyklu p21, ktorého expresia je priamo kontrolovaná aktivitou p53. Naše výsledky naznačujú, že status mutácie p53 v nádoroch prsníka môže ovplyvniť liečbu pomocou inhibítorov chaperónu HSP90.Kľúčové slová:
karcinom prsníka – bunkový cyklus – chaperon – HSP90 – TP53 – p21 – p53 – NVP-AUY922Úvod
HSP90 je molekulárny chaperón s ATP - ázovou aktivitou, ktorý tvorí 2–3 % celkových proteínov v bunke a jeho primárnou úlohou je asistencia tzv. klientom k nadobudnutiu správnej konformácie a udržaniu ich stability. Nedávne štúdie ukazujú, že HSP90 je súčasťou mnohých chaperónových komplexov a v nich pomáha asistovať k dosiahnutiu funkčného stavu min. 10 % všetkých proteínov aspoň v niektorých fázach ich expresie [1–3]. Proteóm závislý na HSP90 sa zúčastňuje mnohých kľúčových procesov, ktoré sú spojené s vývojom a udržaním proteínovej homeostázy ako v normálnych, tak i v nádorových bunkách. V nádorových bunkách je HSP90 využívaný hlavne dvoma spôsobmi – na podporu aktivovaných alebo labilných foriem onkoproteínov, vrátané mnohých kináz a transkripčných faktorov, ktoré sú mutované, nadexprimované alebo translokované počas vzniku malignít [4] a na pufrovanie zvýšenej miery stresu, ktorá je spôsobená zmeneným metabolizmom nádorových buniek [5,6]. Vďaka zvýšeným metabolickým nárokom nádorovej bunky a faktu, že mnoho klientov HSP90 sú onkoproteíny, si nádorové bunky vytvárajú „závislosť” na tomto chaperóne. Následkom vytvorenej závislosti je zvýšená potreba HSP90 v nádorových oproti normálnym bunkám [7]. Inhibícia aktivity HSP90 je potenciálnym terapeutickým cieľom a v súčasnosti sa viacero inhibítorov HSP90 nachádza v klinických skúškach [5,8]. Z toho vyplýva, že na inhibíciu HSP90 môžu veľmi silne odpovedať nádory, ktoré majú vysokú závislosť na onkoproteíne, ktorý je zároveň klientom HSP90. Zaujímavým príkladom u nádorov prsníka je tyrozín - kinázový receptor HER2, ktorý bol identifikovaný ako klient HSP90, a oproti ostatným klientom je veľmi citlivý na inhibíciu chaperónov [9,10]. Senzitivita klientskych proteínov k inhibícii HSP90 môže výrazne prispievať ku klinickej efektivite inhibítorov HSP90, no však iba v prípade, že je nádor na danom klientovi závislý. Medzi ďalšie klientske proteíny HSP90 patria kinázy regulujúce mitózu, ako napr. CDK, Plk, alebo ChK1 [11] a významným klientom HSP90 je aj tumor supresorový proteín p53, transkripčný faktor regulujúci široké spektrum bunkových procesov od indukcie apoptózy po reguláciu opravy DNA. Zaujímavým faktom je, že väčšina mutantných bunkových línií derivovaných z nádorov má defektnú formu p53 neschopnú väzby na DNA, čo implikuje silný selektívny tlak na znefuknčnenie p53 počas procesu tumorigenézy [12]. To pravdepodobne súvisí s transaktivačnou schopnosťou p53 spustiť expresiu génov, ktoré riadia a spúšťajú proces apoptózy [13–17]. Jedným z dejov, ktoré môžu zároveň indukovať zastavenie bunkového delenia, ale aj p53 regulovanú apoptózu je aj zvýšená miera proteotoxického stresu. Keďže HSP90 kontroluje kvalitu veľkého množstva klientov a p53 reguluje široké spektrum bunkových procesov, je zrejmé, že inaktivácia p53 môže mať po ovplyvnení inhibítormi HSP90 rozdielny výsledok v závislosti od použitého experimentálneho modelu, koncentrácie inhibítora alebo doby ovplyvnenia. Z tohto dôvodu sme si zvolili model bunkovej línie karcinómu prsníka MCF-7 a z nej derivovanej mutantnej línie MCF-7dd9, ktorá má inaktivovanú DNA väzobnú doménu p53 a ovplyvnenie inhibítorom NVP-AUY922 sme aplikovali po dobu viacerých dní v niekoľkých koncentráciách.
Materiál a metódy
Použité bunkové línie a kultivácia
V práci boli použité bunková línia karcinómu prsníka MCF-7 a bunková línia MCF-7dd9 derivovaná z parentálnej línie MCF-7 stabilnou transfekciou s pCMV-neoDDp53 plazmidom, ktorý kóduje dominantne negatívny skrátený myší proteín p53, s aminokyselinovými reziduami 1–14 a 302–390 pod kontrolou CMV (cytomegalovírus) promótora. Tento plazmid poskytol prof. D. P. Lane. Obe bunkové línie boli kultivované v D-MEM médiu s 10% FBS pri 37 °C a po založení na experiment ovplyvňované NVP-AUY922 (Selleckchem, USA) po 24hodinové kultivácii.
Analýza bunkovej viability
Po skončení ovplyvnenia boli bunky tryp - sinizované, premyté v PBS a inkubované s 10 nM FDA (fluorescein diacetate; Sigma, USA) po dobu 20 min pri izbovej teplote a následne k nim bol pridaný PI (propidium iodide; Sigma, USA) v koncentrácii 10 µg/ml. Vzorky boli analyzované na prietokovom cytometri BD FACSVerseTM (Beckton-Dickinson, USA), na excitáciu bol použitý 488 nm laser a fluorescenčný signál pre FDA bol zachytený 572/32 nm filtrom a pre PI 586/42 nm filtrom. Dáta boli spracované pomocou softwaru FCS Express 5 Flow Cytometry Software (De Novo Software, USA), pričom najprv bola pomocou FSC a SSC identifikovaná populácia buniek, z ktorej boli vybraté jednotlivé bunky pomocou analýzy pomeru FSC-A a FSC-H a podľa intenzity fluorescencie identifikované jednotlivé populácie na základe ich viability. Živá populácia bola charakterizovaná ako pozitívna na farbenie FDA, nekrotická ako pozitívna na farbenie PI a apoptotická ako negatívna na obe farbenia.
Analýza bunkového cyklu
Po skončení ovplyvnenia boli bunky tryp - sinizované, premyté v PBS a inkubované s 0,05% Tritonom X-100 v PBS pri 37 °C po dobu 30 min. Po skončení inkubácie bol k vzorkám pridaný PI v koncentrácii 100 μg/ml a RNáza v koncentrácii 10 μg/ml po dobu 5 min. Následne boli vzorky analyzované na prietokovom cytometri BD FACSVerseTM (Beckton-Dickinson, USA), na excitáciu bol použitý 488 nm laser a fluorescenčný signál pre bol zachytený PI 586/42 nm filtrom. Dáta boli spracované pomocou softwaru FCS Express 5 Flow Cytometry Software (De Novo Software, USA), pričom najprv bola pomocou FSC a SSC identifikovaná populácia buniek, z ktorej boli vybraté jednotlivé bunky na základe pomeru PE-A a PE-H a jednotlivé fázy bunkového cyklu boli identifikované pomocou modelu 6 multicycle plug-in pre De Novo Software.
Analýza proliferácie buniek
Pre analýzu proliferácie buniek sme ku všetkým vzorkám pridali 5-etynyl-2’-deoxyuridine (Santa Cruz, USA) o výslednej koncentrácii 10 µM 1 hod pred skončením ovplyvnenia a inkubovali pri 37 °C. Pri ďalšom spracovaní sme postupovali podobne ako pri analýze bunkového cyklu s rozdielom pridania 2 µM Sulfo-Cyanine 5 azide (Lumiprobe, Germany) a inkubáciou po dobu 10 min. Vzorky sme následne analyzovali na prietokovom cytometri BD FACSVerseTM (Beckton-Dickinson, USA), na excitáciu a zachytenie fluorescenčného signálu pre PI boli použité 488 nm laser s 586/42 nm filtrom a pre Sulfo-Cyanine 5 azide bol použitý 635 nm laser s 660/10 nm. Dáta boli spracované pomocou softwaru FCS Express 5 Flow Cytometry Software (De Novo Software, USA), pričom najprv bola pomocou FSC a SSC identifikovaná populácia buniek, z ktorej boli vybraté jednotlivé bunky pomocou analýzy pomeru PE-A a PE-H a jednotlivé fázy bunkového cyklu boli identifikované podobne ako pri analýze bunkového cyklu, pričom proliferujúca populácia buniek bola identifikovaná ako pozitívna na farbenie Sulfo-Cyanine 5 azidom.
Western blotting analýza
Bunky sme po skončení ovplyvnenia lyzovali v RIPA pufri s PMSF a proteázovými inhibítormi a získané proteíny sme separovali pomocou SDS-PAGE a následne preniesli na nitrocelulózovú membránu. Nami sledované proteíny sme vizualizovali pomocou primárnych protilátok riedených 1 : 1 000 proti p21 (ab118, Abcam UK), p53 (DO-1, Santa Cruz Biotechnology, USA) a aktínu (Santa Cruz Biotechnology, USA) a sekundárnej anti-mouse protilátky riedenej 1 : 2 000 (Santa Cruz Biotechnology, USA) konjugovanej s peroxidázou. Naviazané protilátky boli detekované chemiluminiscenčne.
Výsledky
Analýza viability
Mutácia tumor-supresorového proteínu p53 je prítomná vo viac ako polovici nádorov a spôsobuje viaceré fenotypové a metabolické zmeny nádorových buniek, ako napr. spustenie apoptotického programu, indukciu senescencie či bloku v bunkovom cykle. IC50 inhibítora NVP-AUY922 vypočítanej z miery prežívania a indukcie apoptózy sme u oboch línií stanovili pomocou prietokovej cytometrie s využitím FDA v kombinácii s PI. Princípom metódy je odštiepenie fluoresceínu od diacetátu esterázami metabolicky aktívnych buniek, ktoré sú následne vizualizované pomocou prietokového cytometra. V prípade straty metabolickej aktivity a negatívneho farbenia jadier na PI je populácia buniek nepriamo považovaná za apoptotickú, pri pozitívnom farbení PI za nekrotickú. Za výsledný efekt inhibície HSP90 sme pre účely stanovenia IC50 považovali nárast apoptotickej a nekrotickej populácie oproti kontrole (tab. 1). Nami vybrané bunkové línie MCF-7 a MCF-7dd9 sme po dobu 24, 48 a 72 hod ovplyvňovali NVP-AUY922 v koncentráciách 5–100 nM. Z našich pozorovaní je zjavné, že inhibícia HSP90 má vo všetkých časoch silnejší efekt na zníženie viability buniek s wild-type p53, k čomu môže prispievať aj zvýšená miera apoptózy zrejme spôsobená indukciou down-stream mechanizmov p53 a to aj po 72 hod od ovplyvnenia (graf 1).
Tab. 1. Tabulka znázorňuje hodnoty IC50 po 24, 48 a 72 hod ovplyvnení NVP-AUY922. V kratších časových intervaloch má inaktivácia p53 protektívnu úlohu pri inhibícii HSP90. 
Graf 1. Efekt NVP-AUY922 v koncentráciách 5, 10, 20, 50 a 100 nM na viabilitu buniek po ovplyvnení na dobu 24, 48 a 72 hod a nárast apoptotickej populácie po 72 hod. 
Analýza bunkového cyklu
Pre analýzu bunkového cyklu sme pomocou prietokovej cytometrie vizualizovali jednotlivé fázy cyklu na základe fluorescenčného signálu PI, ktorý je priamo úmerný množstvu DNA. Obe bunkové línie MCF-7 a MCF-7dd9 sme opäť ovplyvňovali NVP-AUY922 v koncentráciách 5–100 nM po dobu 24, 48 a 72 hod. Vo všetkých časových intervaloch sme u oboch línií pozorovali nárast G2/M bloku, ktorý rástol úmerne so zvyšujúcou sa koncentráciou NVP-AUY922. Najvýraznejší rozdiel medzi oboma líniami bol zistený po 24 hod, kedy dochádzalo k pozorovateľne vyššiemu nárastu G2/M bloku u parentálnej línie MCF-7 oproti línii MCF-7dd9 s mutovaným p53 (graf 2).
Graf 2. Efekt NVP-AUY922 v koncentráciách 5, 10, 20, 50 a 100 nM na zmenu G2/M fázy bunkového cyklu po ovplyvnení na dobu 24, 48 a 72 hod. Obe línie zaznamenali porovnateľný nárast hladiny G2/M fázy, jediný rozdiel bol pozorovaný vo vyššej miere G2/M bloku po 24 hod u línie MCF-7. 
Analýza bunkového cyklu tiež ukázala mierny nárast v G1 fáze bunkového cyklu po inhibícii HSP90 a to najmä v prípade parentálnej línie MCF-7 s wild-type p53. Tento jav sme ďalej skúmali pomocou analýzy proliferácie, ktorej princípom je inkorporácia 5-etynyl-2’-deoxyuridinu do buniek, v ktorých práve prebieha replikácia DNA. Podobne ako v predchádzajúcich experimentoch sme bunky analyzovali v časoch 24, 48 a 72 hod a ovplyvňovali koncentráciami NVP-AUY922 5–100 nM. V prípade línie MCF-7 s wild-type p53 dochádzalo k výraznejšiemu poklesu podielu proliferujúcich buniek a nárastu G1 fázy, čo môže byť spôsobené práve aktiváciou p53 závislých mechanizmov negatívne regulujúcich priebeh bunkového cyklu. Tento jav bol pozorovaný vo všetkých časových intervaloch, pričom významné rozdiely v proliferácii kontrolných vzoriek oboch bunkových línií pozorované neboli (graf 3).
Graf 3. Efekt NVP-AUY922 v koncentráciách 5, 10, 20, 50 a 100 nM na zmenu proliferáciu buniek vyjadrenú zmenou v S fáze bunkového cyklu po dobu 24, 48 a 72 hod. Obe línie zaznamenali zníženie proliferácie po inhibícii HSP90, no u parentálnej línie MCF-7 nastal v skoršom čase výraznejší pokles už po použití nižších koncentrácií NVP-AUY922 oproti mutantnej línii MCF-7dd9. 
Z výsledkov získaných z analýzy viability a najmä priebehu bunkového cyklu sú zrejmé rozdiely v odpovedi oboch skúmaných línií na inhibíciu HSP90. Rýchlejšie zastavenie bunkového delenia a zvýšená miera apoptózy poukazuje na to, že rozdiel v odpovedi môže byť spôsobený práve stavom p53, ktorý nepriamo reguluje bunkový cyklus pomocou indukcie p21. Proteín p21 je silným inhibítorom cyklín-dependentných kináz a inhibuje aktivitu komplexov CDK1, CDK2 a CDK4/6, vďaka čomu funguje ako regulátor prechodu G1 a S fázami bunkového cyklu. Keďže je p21 veľmi silne regulovaný transkripčnou aktivitou p53, rozhodli sme sa analyzovať zmeny v jeho hladine. Nakoľko zmeny v bunkovom cykle boli výrazné už po jednom dni, obe línie sme na 24 hod ovplyvnili 10 a 50 nM NVP-AUY922 a expresiu p21 sme porovnali pomocou Western blotting analýzy. Zo získaných výsledkov je evidentné, že inhibícia HSP90 spôsobuje nárast hladiny p21, ktorý je mediovaný p53, keďže k zvýšeniu hladiny p21 došlo len v prípade bunkovej línie MCF-7 a u línie MCF-7dd9 p21 pozorovaný nebol (obr. 1).
Obr. 1. Indukcia p21 po ovplyvnení 10 a 50 nM NVP-AUY922 po dobu 24 hod. U parentálnej línie MCF-7 bol po ovplyvnení NVP-AUY922 pozorovaný výrazný nárast hladiny p21 oproti kontrole, čo vysvetľuje indukciu G1 bloku po inhibícii HSP90. U línie MCF-7dd9 s mutovanou p53 nebol pozorovaný nárast expresie p21, čo naznačuje, že zmena jeho hladiny po inhibícii HSP90 je p53 závislá. 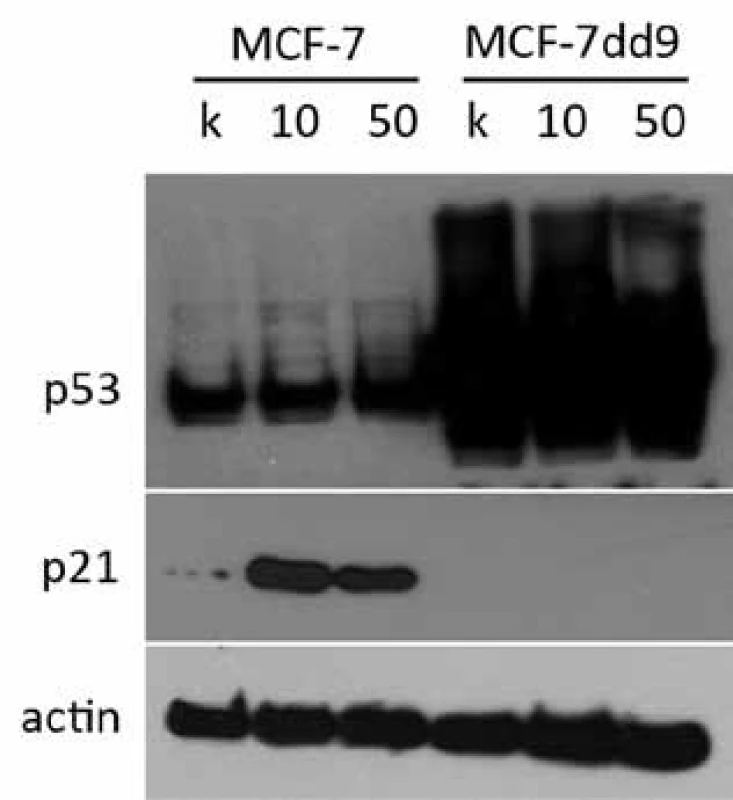
Diskusia
Z našich experimentov vyplýva, že v prípade nádorov s wild-type p53 môže p53 následkom inhibície HSP90 a tým vzniknutého proteotoxického stresu indukovať apoptotický program. Rozdiely v mortalite buniek po inhibícii HSP90 u línie MCF-7 a MCF-7dd9 sú viditeľné vo všetkých časových intervaloch, no zaujímavé je zistenie, že rozdiel v koncentrácii potrebnej na dosiahnutie dávky IC50 sa so stúpajúcim časom inhibície zmenšuje. Po 24 hod je IC50 pre NVP-AUY922 u parentálnej línie približne 5-krát nižšia, ako u línie MCF-7dd9, po 48 hod sa tento rozdiel zníži na približne 3,5-násobok a po 72 hod je potrebná už len 2-násobná dávka na dosiahnutie rovnakého efektu. Tento fenomén by mohol byť vysvetlený spustením apoptotického programu regulovaného p53 ako reakciu na vznik proteotoxického stresu po inhibícii HSP90. Avšak keďže p53 je klientom HSP90, je možné, že inhibícia tohto chaperónu počas dlhšieho časového obdobia má za následok destabilizáciu p53 a tým aj zníženie jej aktivity ako transkripčného faktora. Je totiž známe, že v prípade nesprávneho foldingu prichádza p53 ireverzibilne o schopnosť väzby na DNA [18–20], pretože HSP90 špecificky ovplyvňuje DNA väzbovú aktivitu a transkripčnú aktivitu p53 in vivo za bežných fyziologických podmienok [21] a väzba HSP90 na p53 je podmienená rozpoznaním konformácie p53 [18]. Ako je vidno z výsledkov merania fáz bunkového cyklu, u oboch bunkových línií dochádza ku vzniku G2/M bloku v závislosti od koncentrácie inhibítora HSP90. Ďalším možným mechanizmom účinku inhibície HSP90 tak môže byť aj smrť mitotickou katastrofou, čo podporuje fakt, že veľké množstvo proteínov zapojených do regulácie mitózy je klientmi HSP90 [22–25]. Na našom modeli bola však miera G2/M bloku podobná u oboch línií nezávisle na stave p53, čo znamená, že smrť mitotickou katastrofou neprispieva k pozorovaným rozdielom v cytotoxicite spôsobenej inhibíciou HSP90. Po inhibícii HSP90 sme tiež pozorovali výrazný pokles proliferujúcej časti populácie a to hlavne u línie s wild-type p53. Analýza expresie ukázala, že pravdepodobnou príčinou je p53 indukovaná expresia p21, ktorá spôsobí zástavu bunkového cyklu a blok v G1 fáze. Toto zistenie je prekvapujúce, keďže zástava buniek v G1 fáze cyklu by mohla mať protektívny účinok a ochrániť bunky pred smrťou mitotickou katastrofou. Sú známe prípady, kedy bolo po inhibícii HSP90 pozorované zvýšenie hladiny wild-type p53 či už na modeli chronickej lymfocytickej leukémie [26], alebo neuroblastómu [27]. Lin et al [26] navyše uvádzajú, že po inhibícii HSP90 dochádzalo v prípade línie s mutovaným p53 odvodenej od chronickej lymfocytickej leukémie naopak k zníženiu hladiny mutovanej p53, no napriek tomu bol cytotoxický účinok inhibície HSP90 rovnaký bez ohľadu na status p53. V našom prípade sme po inhibícii HSP90 nepozorovali zmeny v expresii či už wild-type, alebo mutovaného p53. Na modeli bunkových línií karcinómu prsníka sme teda ukázali, že prítomnosť wild-type p53 má vplyv na zvýšenú mortalitu buniek po inhibícii HSP90, avšak mechanizmus, akým sa tak deje, si zasluhuje podrobnejšie skúmanie.
Záver
Napriek intenzívnemu skúmaniu úlohy p53 pri vzniku a progresii nádorových ochorení nie je úplne známe, ako stav tohto proteínu ovplyvňuje citlivosť nádoru na nové liečebné modality indukujúce proteotoxický stres v nádorových bunkách. V našej práci sme sa preto zamerali na vplyv inhibície HSP90, ktorej účinok bol vyšší v prípade buniek s wild-type p53, napriek schopnosti p53 sprostredkovať zástavu v bunkovom cykle, ktorá by mala pre bunku pôsobiť protektívne. Možnou odpoveďou na pozorované rozdiely v toxicite inhibítorov HSP90 na bunky s wild-type a mutovanou p53 by mohla byť indukcia apoptózy sprostredkovaná p53, avšak na potvrdenie tejto teórie sú potrebné ďalšie dôkazy. Nami pozorované zníženie proliferácie a vyššia mortalita buniek línie odvodenej z karcinómu prsníka s wild-type p53 teda ukazujú, že v prípade karcinómu prsníka by mohol mať stav proteínu p53 výrazné implikácie pre potenciálnu terapiu inhibítormi HSP90.
Práce byla podpořena projektem MŠMT – NPU I – LO1413.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Michal Pastorek, Ph.D.
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: michal.pastorek@mou.cz
Obdrženo: 6. 5. 2016
Přijato: 17. 5. 2016
Zdroje
1. Nathan DF, Vos MH, Lindquist S. In vivo functions of the Saccharomyces cerevisiae Hsp90 chaperone. PNAS 1997; 94 (24): 12949–12956.
2. Echeverria PC, Bernthaler A, Dupuis P et al. An interaction network predicted from public data as a discovery tool: Application to the Hsp90 molecular chaperone machine. PLoS One 2011; 6 (10): e26044. doi: 10.1371/journal.pone.0026044.
3. Taipale M, Krykbaeva I, Koeva M et al. Quantitative analysis of HSP90-client interactions reveals principles of substrate recognition. Cell 2012; 150 (5): 987–1001. doi: 10.1016/j.cell.2012.06.047.
4. Pearl LH, Prodromou C, Workman P. The Hsp90 molecular chaperone: an open and shut case for treatment. Biochem J 2008; 410 (3): 439–453. doi: 10.1042/BJ20071640.
5. Workman P, Burrows F, Neckers L et al. Drugging the cancer chaperone HSP90: combinatorial therapeutic exploitation of oncogene addiction and tumor stress. Ann N Y Acad Sci 2007; 1113 : 202–216.
6. Trepel J, Mollapour M, Giaccone G et al. Targeting the dynamic HSP90 complex in cancer. Nat Rev Cancer 2010; 10 (8): 537–549.
7. Parimi S, Tsang RY. Hsp90 inhibitors in oncology: ready for prime time? Curr Oncol 2014; 21 (5): e663–e667. doi: 10.3747/co.21.2163.
8. Miyata Y, Nakamoto H, Neckers L. The therapeutic target Hsp90 and cancer hallmarks. Curr Pharm Des 2013; 19 (3): 347–365.
9. Mimnaugh EG, Chavany C, Neckers L. Polyubiquitination and proteasomal degradation of thep185c-erbB-2 receptor protein-tyrosine kinase induced by geldanamycin. J Biol Chem 1996; 271 (37): 22796–22801.
10. Chavany C, Mimnaugh E, Miller P et al. p185erbB2 binds toGRP94 in vivo. Dissociation of the p185erbB2/ GRP94 heterocomplex by benzoquinoneansamycins precedes depletion of p185erbB2. J Biol Chem 1996; 271 (9): 4974–4977.
11. Vartholomaiou E, Echeverría PC, Picard D. Unusual suspects in the twilight zone between the Hsp90 interactome and carcinogenesis. Adv Cancer Res 2016; 129 : 1–30. doi: 10.1016/bs.acr.2015.08.001.
12. Fridman JS, Lowe SW. Control of apoptosis by p53. Oncogene 2003; 22 (56): 9030–9040.
13. Attardi LD, Lowe SW, Brugarolas J et al. Transcriptional activation by p53, but not induction of the p21 gene, is essential for oncogene-mediated apoptosis. EMBO J 1996; 15 (14): 3693–3701.
14. Chen X, Ko LJ, Jayaraman L et al. p53 levels, functional domains, and DNA damage determine the extent of the apoptotic response of tumor cells. Genes Dev 1996; 10 (19): 2438–2451.
15. el-Deiry WS. Regulation of p53 downstream genes. Semin Cancer Biol 1998; 8 (5): 345–357.
16. Sax JK, el-Deiry WS. p53 downstream targets and chemosensitivity. Cell Death Differ 2003; 10 (4): 413–417.
17. Yu J, Zhang L, Hwang PM et al. Identification and classification of p53-regulated genes. PNAS 1999; 96 (25): 14517–14522.
18. Müller L, Schaupp A, Walerych D et al. Hsp90 regulates the activity of wild type p53 under physiological and elevated temperatures. J Biol Chem 2004; 279 (47): 48846–48854.
19. Bell S, Klein C, Müller L et al. p53 contains large unstructured regions in its native state. J Mol Biol 2002; 322 (5): 917–927.
20. Dawson R, Müller L, Dehner A et al. The N-terminal domain of p53 is natively unfolded. J Mol Biol 2003; 332 (5): 1131–1141.
21. Walerych D, Kudla K, Gutkowska M et al. Hsp90 chaperones wild-type p53 tumor suppressor protein. J Biol Chem 2004; 279 (47): 48836–44845.
22. Burrows F, Zhang H, Kamal A. Hsp90 activation and cell cycle regulation. Cell Cycle 2004; 3 (12): 1530–1536.
23. Munoz MJ, Jimenez J. Genetic interactions between Hsp90 and the Cdc2 mitotic machinery in the fission yeast Schizosaccharomyces pombe. Mol Gen Genet 1999; 261 (2): 242–250.
24. Aligue R, Akhavan-Niak H, Russell P. A role for Hsp90 in cell cycle control: wee1 tyrosine kinase activity requires interaction with Hsp90. EMBO J 1994; 13 (24): 6099–6106.
25. Goes FS, Martin J. Hsp90 chaperone complexes are required for the activity and stability of yeast protein kinases Mik1, Wee1 and Swe1. Eur J Biochem 2001; 268 (8): 2281–2228.
26. Lin K, Rockliffe N, Johnson GG et al. Hsp90 inhibition has opposing effects on wild-type and mutant p53 and induces p21 expression and cytotoxicity irrespective of p53/ATM status in chronic lymphocytic leukaemia cells. Oncogene 2008; 27 (17): 2445–2455.
27. Regan PL, Jacobs J, Wang G et al. Hsp90 inhibition increases p53 expression and destabilizes MYCN and MYC in neuroblastoma. Int J Oncol 2011; 38 (1): 105–112.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Editorial
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2016 Číslo Supplementum 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Vícestupňový proces vzniku vzdálených metastáz u karcinomů
- Mechanizmy regulace proteinové homeostázy ve vývoji nádorových onemocnění
- Chaperony endoplazmatického retikula na povrchu nádorové buňky a v extracelulárním prostředí
- Editorial
- Proteiny Rab, vnitrobuněčný transport a nádorová onemocnění
- Vplyv inhibície HSP90 na viabilitu a bunkový cyklus v závislosti od stavu p53
- Molekulární podstata kancerogeneze epiteliálních ovariálních karcinomů
- Tvorba hmotnostne spektrometrických spektrálnych knižníc nádorových bunečných línií
- Využití metody vodík/deuteriové výměny v biofarmaceutickém průmyslu
- Nádorové buňky jako dynamický systém – molekulární a fenotypové změny v průběhu vzniku, progrese a šíření nádoru
- Nové metody studia metylace DNA – MS-HRM analýza a elektrochemie
- Úloha PD-1/PD-L1 signalizace v protinádorové imunitní odpovědi
- Nemalobuněčný karcinom plic – od imunobiologie k imunoterapii
- Nové technologie používané pro in vivo diagnostiku nádorů
- Pokroky ve vývoji PET radiofarmak pro pacienty v České republice
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Úloha PD-1/PD-L1 signalizace v protinádorové imunitní odpovědi
- Nemalobuněčný karcinom plic – od imunobiologie k imunoterapii
- Nádorové buňky jako dynamický systém – molekulární a fenotypové změny v průběhu vzniku, progrese a šíření nádoru
- Nové metody studia metylace DNA – MS-HRM analýza a elektrochemie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



