-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaImunitní systém u pacientů s nádory hlavy a krku
Immune System in Patients with Head and Neck Carcinoma
The insight into the biological nature of head and neck squamous cell carcinoma has evolved significantly in the last few years. Tobacco use and alcohol consumption are proven risk factors of head and neck squamous cell carcinoma. Cancer patients possessing such a tumor are generally elderly, mostly in fifth or sixth decade of life. In addition, significant association of head and neck squamous cell carcinoma with infection by human papillomavirus (HPV) was proven. HPV is now considered to be one of the most important risk factors, particularly for oropharyngeal carcinoma. HPV ‑ positive tumors of oropharynx are associated with significantly better prognosis. Experimental and clinical data indicate that HPV ‑ positive and HPV ‑ negative tumors can be considered as two different entities and it has not been clarified which factors are crucial for better prognosis of HPV ‑ positive tumors. The character of immune reaction, which contributes to distinct prognosis, may be one of the important factors. This review summarizes current knowledge concerning various aspects of anti‑tumor immune responses in HPV ‑ positive and HPV ‑ negative tumors. Recent studies have shown that a broad repertoire of tumor ‑ infiltrating HPV ‑ specific T-cells is detectable in almost all patients with HPV ‑ positive tumors. Despite this, there is a development of tumor, which may be facilitated by abnormalities in antigen processing, T-cell dysfunction or prevalence of immunosuppressive cells. Nonetheless, the immunologic profile of HPV ‑ positive vs. HPV ‑ negative head and neck squamous cell carcinoma is associated with better outcome, and HPV ‑ specific immune response is suggested to play an essential role in the better response to conventional therapy of HPV ‑ positive patients. We also discuss HPV ‑ specific antitumor immunotherapy approaches, which are now tested in clinical trials.
Key words:
head and neck cancer – human papillomavirus – immune system – T-lymphocytes – immunotherapy
This study was supported by grant Internal Grant Agency of the Czech Ministry of Health No. NT 11542, FH Motol – grant No. 00064203 and by grants SVV 266513, UNCE 204013 and PRVOUK 27-1.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
31. 7. 2015Accepted:
22. 8. 2015
Autoři: S. Partlová 1,2; J. Bouček 3; K. Kloudová 1,2; M. Zábrodský 3; R. Špíšek 1,2; A. Fialová 2
Působiště autorů: Sotio a. s., Praha 1; Ústav imunologie, 2. LF UK a FN v Motole, Praha 2; Klinika otorinolaryngologie a chirurgie hlavy a krku 1. LF UK a FN v Motole, Praha 3
Vyšlo v časopise: Klin Onkol 2015; 28(Supplementum 4): 86-94
Kategorie: Speciální část
doi: https://doi.org/10.14735/amko20154S86Souhrn
V posledních několika letech se významně změnil pohled na biologickou podstatu nádorů v oblasti hlavy a krku. Klasickými prokázanými rizikovými faktory nádorů v oblasti hlavy a krku jsou kouření a konzumace alkoholu, resp. jejich kombinace. Pacienti s nádory vzniklými na podkladě této etiologie se pohybují ve vyšších věkových skupinách, nejčastěji v pátém a šestém decéniu. Dále byla v posledních přibližně 15 letech prokázána souvislost s infekcí lidským papillomavirem (HPV), který je dnes považován za jeden z nejvýznamnějších rizikových faktorů, zejména pro karcinom orofaryngu. HPV pozitivní nádory orofaryngu jsou spojeny s významně lepší prognózou onemocnění. Výzkumná i klinická data ukazují, že HPV pozitivní a negativní nádory lze v mnoha ohledech považovat za dvě rozdílné entity a dosud není zcela objasněno, jaké faktory jsou klíčové pro lepší prognózu HPV pozitivní nádorů. Jedním z důležitých faktorů, který se podílí na rozdílné prognóze, může být charakter imunitní reakce. Tento článek shrnuje současné poznatky o různých aspektech protinádorové imunitní reakce u HPV pozitivních a negativních nádorů. Současné studie udávají, že téměř u všech HPV pozitivních pacientů byly detekovány významné počty HPV specifických T lymfocytů, v nádorové tkáni. I navzdory tomu však dochází k rozvoji nádoru, což může být způsobeno abnormalitami v antigenní prezentaci, dysfunkcemi T lymfocytů či přítomností různých populací imunosupresivních buněk. Imunologický profil HPV pozitivních, resp. HPV negativních nádorů v oblasti hlavy a krku přesto jednoznačně koreluje s terapeutickými výsledky a HPV specifická imunitní odpověď má pravděpodobně zásadní význam při lepší odpovědi HPV pozitivních pacientů na konvenční léčbu. Diskutujeme také vyvíjené postupy HPV specifické protinádorové imunoterapie, které jsou nyní ve fázi klinických zkoušek.
Klíčová slova:
nádory hlavy a krku – lidský papillomavirus – imunitní systém – T lymfocyty – imunoterapieÚvod
V posledních několika letech se velmi významně změnil pohled na biologickou podstatu celé řady onkologických onemocnění, nádory v oblasti hlavy a krku nevyjímaje, na podkladě přibývajících informací z oblasti molekulární genetiky, biologie a imunologie [1]. Některé z těchto znalostí se již přímo uplatnily v klinické praxi, některé vykazují slibný potenciál do budoucnosti.
Nádory hlavy a krku jsou šestou nejčastější skupinou onkologických onemocnění, zahrnující celou řadu histologických typů malignit, ale ve zhruba 95 % jsou zastoupeny dlaždicobuněčné karcinomy (head and neck squamous cell carcinoma – HNSCC) [2]. Celosvětově se udává incidence mezi 550 000 a 600 000 případy za rok [3], z nichž nejpočetnější jsou nádory orofaryngu, hrtanu a dutiny ústní. Zhruba 300 000 pacientů každoročně v souvislosti s tímto onemocněním zemře. Klasickými prokázanými rizikovými faktory HNSCC je kouření a konzumace alkoholu, resp. jejich kombinace. Pacienti s nádory vzniklými na podkladě této etiologie se pohybují ve vyšších věkových skupinách, nejčastěji v pátém a šestém decéniu [4]. Incidence nádorů podmíněných kouřením a/ i alkoholem pomalu klesá. U nádorů orofaryngu byla v posledních přibližně 15 letech prokázána souvislost s infekcí lidským papillomavirem (HPV), který je dnes považován za jeden z nejvýznamnějších rizikových faktorů. Zastoupení HPV asociovaných nádorů roste relativně i absolutně a v této souvislosti je používán termín „epidemie“ šířící se zejména ve skupině mladších pacientů, mužů bílé pleti, nekuřáků [4]. Je známo více než 100 kmenů HPV, karcinomy v oblasti hlavy a krku jsou způsobeny zejména HPV 16, který je dnes považován za primární příčinu většiny spinocelulárních karcinomů tonzily v Evropě a v Severní Americe.
HPV
Infekce lidským papillovirem je sexuálně přenosné onemocnění postihující cervix, orofarynx, vulvu, konečník a penis. Význam HPV pro ano genitální nádory byl znám již poměrně dlouho, v onkologii hlavy a krku se ale souvislost prokazuje až v posledních přibližně 15 letech [5,6]. Více než 130 typů HPV se dle maligního potenciálu rozděluje na low ‑ a high‑risk typy, asi 15 z nich vykazuje onkogenní potenciál. U orofaryngeálních karcinomů dominuje HPV 16. Více než 50 % nádorů tonzil a kořene jazyka je prokazatelně způsobeno přítomností HPV (literární údaje se pohybují v rozmezí od 10 do 90 %) [7]. V Evropě je procento orofaryngeálních nádorů způsobených HPV nejvyšší ve Skandinávii (až 90 %), naopak v zemích s vysokým zastoupením kuřáků v populaci, např. v Itálii, je nižší než 20 % [7]. Rutinní HPV detekce u nádorů orofaryngu je součástí moderních klinických doporučených postupů. Nejvyšší prognostická významnost byla prokázána pro detekci transkripčně aktivní virové infekce pomocí HPV mRNA (nejčastěji HPV 16 E6 mRNA) [8]. K detekci HPV je možné použít celou řadu dalších laboratorních technik, pro spolehlivé stanovení by mělo být kombinováno více metod. V současnosti je používáno klasické PCR k detekci HPV DNA, RT‑PCR kvantifikující virovou nálož nebo detekující transkripčně aktivní virovou infekci pomocí E6/ E7 mRNA, typově specifická DNA in situ hybridizace, detekce sérových protilátek proti virovým onkoproteinům E6/ E7 nebo imunohistochemická detekce p16 (inhibitoru cyclindependentní kinázy p16ink4a, tumor supresorového proteinu). PCR detekce HPV DNA v kombinaci s imunohistochemickou detekcí p16 (velmi silně korelující s HPV statutem) nebo s detekcí HPV specifických E6/ E7 protilátek jsou dnes doporučovány jako možné standardy pro určení orofaryngeálních nádorů asociovaných s HPV infekcí [9].
Genetické rozdíly HNSCC různých etiologií
Rozdílná etiologie se promítá i do nejčastěji detekovaných genetických mutací a změněných signalizačních drah. Velký posun znamenalo zavedení techniky whole ‑ exome sequencing, první práce u HNSCC byla publikována v roce 2011 [10]. Expozice klasickým karcinogenům, jako jsou kouření a alkohol, vede k postupnému hromadění genetických změn. Téměř vždy je u této skupiny nádorů mutován gen TP53, který kóduje p53 protein, onkosupresorový protein, někdy nazývaný „strážce genomu“. Za fyziologických podmínek se jeho množství začíná zvyšovat v odpovědi na stresové stimuly nebo v případě poškození DNA. Nahromadění vede k zastavení buněčného cyklu umožňující DNA opravu nebo spustí apoptotickou signalizační kaskádu. Většina mutací TP53 je tzv. missence mutace, kdy vzniká stabilní protein, ale s poškozenou vazebnou strukturou. Je prokázána korelace vyššího výskytu mutací TP53 a snížení celkového přežívání, zvýšení procenta loko regionálních rekurencí a snížení citlivosti na terapii [11,12]. Druhý nejčastěji mutovaný tumor supresorový gen u HPV negativních HNSCC je CDKN2A (gen pro inhibitor cyklin‑dependentní kinázy 2A),poškozený u zhruba 10 – 12 % nádorů. Jeho dva alternativním sestřihem vzniklé proteiny (p14ARF a p16INK4A) negativně ovlivňují funkci p53, zasahují do regulace buněčného cyklu a stimulují růstovou progresi nádorových buněk.
Naopak u HPV pozitivních nádorů je spektrum nacházených genetických změn podstatně menší. Postihuje zejména PIK3CA (katalytická podjednotka phosphatidylinositol 3 - kinázy [13], jehož mutaci nacházíme jen u 6 – 21 % HNSCC. PIK3 je součástí signalizační dráhy aktivované vazbou ligandu na povrchový membránový receptor, např. pro EGFR (receptor pro epidermální růstový faktor). EGFR je overexprimován až u 90 % HNSCC [14] a je v přímé korelaci s větším množstvím lokálních rekurencí a horším celkovým přežitím pacientů. Množství mutovaného PI3K přímo koreluje s vyšším stagingem HNSCC, potencuje buněčný růst, proliferaci a inhibuje apoptózu. Další genetickou změnou nacházenou zejména v HPV pozitivních HNSCC je mutace TRAF3 (TNF receptor‑associated factor 3), který je součástí přirozené i specifické protivirové imunitní reakce (HPV, EBV, HIV) a jehož inaktivace vede ke zvýšení NF-κB signalizace a inhibici apoptózy. Poslední častou genetickou změnou u HPV+ HNSCC je amplifikace genu E2F1, transkripčního faktoru aktivujícího buněčný cyklus.
Biologické rozdíly
Biologická odlišnost HPV pozitivních a negativních HNSCC funkčně odráží genetickou podstatu a spočívá zejména ve zvýšené degradaci p53, inaktivaci dráhy pRb (retinoblastomový protein) a v upregulaci p16. Nefunkčnost onkosupresorového proteinu p53 v druhém kontrolním bodu buněčného cyklu (ve fázi G2) je prokázána u většiny HNSCC, molekulární podstata této poruchy se však liší. Na rozdíl od HPV negativních HNSCC, která je téměř vždy podmíněna mutací genu, u HPV pozitivních je naopak p53 vázán virovým onkoproteinem E6, a tím je spuštěna jeho degradace. Buněčný cyklus se tak nezastaví v druhém kontrolním bodě, nemůže proběhnout oprava DNA a nemůže ani dojít ke spuštění apoptózy mediované p53. Regulace buněčného cyklu v prvním kontrolním bodě (v přechodu mezi fází G1 a S) je naopak narušena prostřednictvím pRb a cyklinu D1. HPV pozitivní nádory orofaryngu vykazují aktivaci buněčného cyklu transkripčním faktorem E2F, který je za fyziologických podmínek vázán na Rb. Poté, co virový E7 onkoprotein vytvoří komplexy s nízce fosforylovanou formou onkosupresorového proteinu pRb, dojde ke snížení hladiny Rb a jeho uvolnění z vazby na E2F. Uvolněný E2F aktivuje cyklin E a CDK2 (cyklin dependentní kinázu 2). Je tak umožněn přechod z G1 do S fáze buněčného cyklu. Zpětně je indukovaná overexprese CDKN2A genu, který kóduje p16 a p14. Za normálních okolností p16 inhibuje cyklin D1 a CDK1/ 6 (které fyziologicky fosforylací pRb uvolňují E2F) a zablokuje buněčný cyklus. V případě HPV infikovaných buněk je ale pRb inaktivován v komplexu s E7 a nemůže již buněčný cyklus negativně ovlivňovat vazbou s E2F [15].
Klinický význam HPV
Přestože HPV velmi silně zasahuje a ovlivňuje buněčný cyklus, nádory vykazující vysokou aktivitu HPV mají lepší prognózu než nádory s nízkým virovým loadem nebo ty, které jsou HPV negativní. Pacienti s HPV pozitivními nádory, přestože mají častěji metastatické postižení regionálních lymfatických uzlin, a tedy pokročilejší stadia, lépe odpovídají na chemoterapii, radioterapii i chirurgickou léčbu. Klinická odpověď je podmíněna aktivací imunitního systému proti HPV antigenům [16], tedy nikoliv odlišností v samotném biologickém chování HPV pozitivních a HPV negativních nádorových buněk [17].
Zatím není ale zodpovězena otázka, proč u menší části pacientů HPV vyvolá chronickou infekci a následně nádorové onemocnění, přestože většina populace se s HPV infekcí během života setká, ale imunitní systém ji efektivně eliminuje a neumožní žádné dlouhodobé obtíže.
Imunitní systém u pacientů s nádory hlavy a krku
Únikové mechanizmy HNSCC nádorových buněk
Pro rozvoj onemocnění je zřejmě velmi důležité, že nádorové buňky mohou postupně vyvinout strategie, kterými dokáží uniknout dohledu imunitního systému. Nádorové buňky HNSCC tyto mechanizmy využívají, i když se jedná o značně heterogenní skupinu nádorů. Více než u poloviny nádorů hlavy a krku byla popsána úniková strategie způsobená sníženou expresí nebo úplnou ztrátou lidského leukocytárního antigenu I. třídy (HLA I) a/ nebo narušení mechanizmu antigenní prezentace, které jsou nezbytné pro zahájení účinné protinádorové odpovědi založené na cytotoxických T lymfocytech [18]. Dalším z možných mechanizmů způsobujících nedostatečnou imunitní odpověď je schopnost HNSCC nádorů potlačit expresi B7 kostimulačních molekul (CD80 a CD86). Nízká exprese kostimulačních molekul znamená, že nádorové buňky nemohou samy o sobě aktivovat protinádorovou imunitní odpověď, především T lymfocyty. Výzkum posledních let navíc ukázal, že nádorové buňky jsou schopné do nádorové tkáně aktivně atrahovat různé populace imunosupresivních buněk. Imunosupresivní buňky aktivně a velmi účinně potlačují protinádorovou imunitní reakci, a „chrání“ tedy nádorovou tkáň před útokem imunitního systému. Patří mezi ně především regulační T lymfocyty (Treg), myeloidní supresorové buňky (MDSC) nebo nádorové makrofágy (TAM) [19]. V neposlední řadě dochází díky expresi inhibičních molekul (FasL, PD ‑ L1 a PD ‑ L2), jež byly prokázány na nádorových buňkách, k apoptóze či utlumení aktivovaných cytotoxických lymfocytů a uvolnění inhibičních faktorů do nádorového mikroprostředí [20].
T lymfocyty a jejich vliv na prognózu pacientů s nádory hlavy a krku
Ačkoliv se protinádorové imunitní odpovědi účastní různé populace imunitních buněk, v současnosti se přikládá největší význam různým populacím efektorových T lymfocytů, které jsou považovány za buňky mající klíčovou roli v obraně proti nádorům.
Mnoho studií zaměřených na analýzu zastoupení lymfocytů infiltrujících nádorovou tkáň (tumor ‑ infiltrating lymphocytes – TILs) u pacientů s různými typy nádorových onemocnění, včetně HNSCC, prokázalo jasnou souvislost výskytu TILs (především CD3+ T lymfocytů, CD8+ cytotoxických lymfocytů a CD45RO+ paměťových T buněk) s delším přežíváním pacientů [21]. Při bližším zkoumání T lymfocytů u pacientů v pokročilém stadiu onemocnění HNSCC Reichert et al [22] navíc ukázali, že nízká exprese či úplná ztráta ζ řetězce v CD3+ T lymfocytech, který má klíčovou roli pro přenos signálu do buňky, predikuje horší prognózu, než je tomu u pacientů, kteří mají expresi ζ řetězce normální. Důležitost ζ řetězce byla potvrzena i další studií, ve které cirkulující CD4+ a CD8+ T lymfocyty a NK buňky vykazovaly nižší expresi tohoto řetězce na lymfocytech v krvi pacientů s HNSCC v porovnání se zdravými kontrolami. Navíc pacienti s agresivními nádory a ti, kteří v posledních dvou letech prodělali relaps onemocnění, exprimovali nejnižší hladiny řetězce ζ [23]. Z výsledků Hoffmanna et al [24] dále vyplývá, že se dysfunkce imunitních buněk pacientů s HNSCC v pozdních stadiích onemocnění netýká pouze nádorového mikroprostředí, ale také periferní krve. U pacientů s pokročilým onemocněním byly oproti zdravým kontrolám v periferní krvi pozorovány jak funkční defekty lymfocytů, tak signifikantně vyšší podíl lymfocytů, které spontánně podléhaly apoptóze.
Na rozdíl od CD8+ T lymfocytů není prognostický význam dalších populací imunitních buněk, jako jsou B lymfocyty, NK buňky, MDSC, makrofágy a populace pomocných T lymfocytů (Th2, Th17, Treg) zcela konzistentní a liší se na základě typu nádoru či jeho stadia [21]. U nádorů hlavy a krku byl již dříve popsán prognostický význam různých populací CD4+ T lymfocytů (jako jsou CD4+CD25+, CD4+CD69+ a CD4+FoxP3+ T buňky), které infiltrují nádorovou tkáň [25]. S lepší prognózou byly spojovány vysoké hladiny CD4+CD69+ buněk a zajímavé je, že vysoké počty CD4+FoxP3+ T lymfocytů pozitivně korelovaly s lepší loko regionální kontrolou pacientů [25]. Přítomnost FoxP3+ T lymfocytů v nádorové tkáni u pacientů s nazofaryngeálním karcinomem navíc korelovala s delším přežíváním a celkovým bezpříznakovým přežitím [26]. Výsledky studie Straussové et al [27] dále ukázaly, že populace CD4+CD25highFoxP3+ Treg izolovaná z nádorové tkáně je schopna inhibovat proliferaci CD4+CD25– T lymfocytů, přičemž tento efekt není závislý na buněčném kontaktu, nýbrž na produkci cytokinů IL‑10 a TGF‑β. Úloha Th17 lymfocytů byla již dříve velmi dobře popsána v souvislosti s autoimunitními onemocněními, nicméně jejich funkce v nádorech, včetně nádorů hlavy a krku, stále není zcela jasná. Část studií se přiklání k názoru, že je přítomnost Th17 lymfocytů v nádorové tkáni pro pacienta prospěšná, neboť zesiluje protinádorovou imunitní odpověď. Jiné studie naopak tvrdí, že Th17 buňky napomáhají nádorové angiogenezi, čímž umožňují nádoru růst a šířit se do vzdálenějších míst [21,28]. Pro objasnění významu Th17 buněk u pacientů s HNSCC je nyní potřeba další výzkum, který by byl zaměřen na bližší prozkoumání mechanizmů, kterými tyto buňky působí v nádorovém mikroprostředí, či jakým způsobem může naopak nádorové prostředí ovlivňovat jejich vznik nebo zastoupení.
Potenciální vliv HPV na imunitní systém HNSCC pacientů
Únikové mechanizmy a HPV
Ve většině případů jsou buňky infikované HPV spontánně eliminovány imunitním systémem. Virus HPV však vyvinul řadu mechanizmů, kterými je schopen lidský imunitní systém obejít a vyvolat perzistující infekci, nezbytnou pro vznik nádorového onemocnění. HPV infikuje keratinocyty, které exprimují virové proteiny pouze minimálně, a tak buňky infikované virem nejsou lyzovány. Díky tomu neposkytuje HPV imunitnímu systému hostitele tzv. signály nebezpečí, které jsou k zahájení účinné imunitní odpovědi zásadní. Vzhledem k tomu, že nedochází k lýze buňky, neuvolňují se tak ani prozánětlivé cytokiny, které jsou důležitou složkou při aktivaci a migraci dendritických buněk. Virus HPV se navíc nešíří krví, takže je imunitnímu systému vystaveno pouze malé množství replikujícího se viru, a ten se tak pro pacientův imunitní systém stává téměř neviditelným. Dalšími z možných únikových mechanizmů je schopnost HPV onkoproteinů vyhnout se účinkům interferonu typu I, který je v protivirové imunitě klíčovou složkou [29], či schopnost virového E6 onkoproteinu blokovat diferenciaci monocytů do příslušných antigen prezentujících buněk [30]. HPV dokáže také potlačit expresi hlavního histokompatibilního komplexu třídy I nebo transportéru pro antigenní peptidy (TAP) [29]. Tyto změny dále snižují prezentaci virových peptidů na povrchu nádorových buněk. Z výsledků Kanodia et al [29] navíc vyplývá, že virus HPV dokáže modulovat produkci chemokinů (potlačit expresi MCP ‑ 1, omezit uvolňování IL‑8 nebo CCL20) a prozánětlivých cytokinů (snížit expresi IL‑18) či inhibovat Th1 odpověď posunem od Th1 směrem k Th2 odpovědi.
Virus HPV a imunitní systém
Virus HPV infikuje epiteliální tkáně a jeho životní cyklus je tak závislý na diferenciaci epitelu hostitele. Na rozdíl od mukózního epitelu, který se nachází na ostatních místech běžně infikovaných virem HPV 16 (cervix, anogenitální oblast), je v orofaryngu dlaždicový epitel ve velmi těsném vztahu k lymfatické tkáni, která má klíčovou imunologickou funkci v obraně proti patogenům vstupujícím do těla z vnějšího prostředí. Je tedy pravděpodobné, že imunitní odpověď v orofaryngu namířená proti HPV bude odlišná od imunitní reakce probíhající na jiných místech v organizmu.
Přestože se ukázalo, že HPV pozitivní pacienti odpovídají lépe na standardní léčbu kombinující chirurgický zákrok s radio ‑ a chemoterapií, HPV pozitivní nádorové linie byly k ozáření a cisplatině rezistentnější v porovnání s HPV negativními buňkami in vitro. Nicméně v in vivo pokusech na imunokompetentních myších se naopak prokázalo, že HPV pozitivní nádory byly k radio a chemoterapii citlivější. Zajímavé je, že ani radioterapie ani cisplatina nedokázaly vyléčit imunokompromitované myši, což přispívá k pochopení, že u HPV pozitivních pacientů hraje zásadní roli imunitní systém [17]. I přesto, že nedávno publikované výsledky Kimpla et al [31] dokazují zvýšenou citlivost HPV pozitivních nádorových linií k ozáření, tato zjištění nevysvětlují, proč mají lepší prognózu také HPV pozitivní pacienti léčení pouze chirurgickým zákrokem.
Z dosavadních výsledků vyplývá, že je nezbytné důkladně porozumět vzájemné souhře mezi adaptivním imunitním systémem, HPV a nádorovým mikroprostředím, a to obzvláště v souvislosti s vývojem nových léčebných postupů založených na aktivaci protinádorové imunitní reakce. Kromě toho se studium specifické imunity ukázalo být významným prognostickým nástrojem u různých typů nádorů, a dokonce se uvažuje, že by u některých nádorových onemocnění mohlo být relevantnějším nástrojem než v současné době využívaný „staging“ nádorů [32].
Vliv specifické imunity na vznik a progresi nádorů asociovaných s HPV – Imunoprofilování jako prognostický nástroj?
Efektorové T lymfocyty a jejich prognostický význam
Role specifické imunity v rozvoji neoplazií je stále kontroverzní. Nicméně studie prováděné na imunokompetentních myších, včetně myších modelů s orofaryngeálním karcinomem, dokazují zásadní význam specifické imunity v obraně proti nádorům a potlačení nádorového růstu [17]. Také klinická data ukazují, že k rozvoji nádorů dochází častěji u imunosuprimovaných pacientů [33]. Zvýšená incidence HPV a s ním asociovaných nádorů byla pozorována např. u HIV pozitivních pacientů a pacientů po transplantacích [34]. Bylo prokázáno, že infiltrující lymfocyty potlačují růst nádorů a jejich přítomnost je asociována s lepší prognózou pacientů s různými typy nádorů [35].
V současné době existuje několik prací, které se zabývají analýzou imunitního systému v souvislosti s HPV a s ohledem na celkové přežití či prognózu pacienta. Aby dokázali posoudit klinický význam adaptivní imunity na pacientovu prognózu, analyzovali Wansom et al [36] periferní krev HNSCC pacientů, v níž detekovali zvýšený výskyt CD8+ T buněk a nižší poměr CD4+/ CD8+ T buněk u HPV 16 pozitivních pacientů ve srovnání s HPV negativními nádory. Procento CD8+ T lymfocytů se příliš nelišilo mezi skupinami kuřáků a nekuřáků, což přispívá k hypotéze, že jsou rozdíly v zastoupení CD8+ T buněk připisovány spíše HPV infekci než kouření. Vzhledem k tomu, že přítomnost CD8+ T lymfocytů predikovala lepší odpověď na léčbu než samotný HPV status, dalo by se říci, že by cirkulující CD8+ T lymfocyty mohly sloužit jako prognostický faktor a posílením adaptivní imunity by bylo pravděpodobně možné pozitivně ovlivnit prognózu HPV 16 pozitivních pacientů. V další studii byl zjištěn vyšší výskyt paměťových efektorových a efektorových T buněk (oproti naivním a paměťovým centrálním T buňkám) u HPV pozitivních nádorů ve srovnání s HPV negativními nádory [37]. Podobných výsledků bylo dosaženo na úrovni genové exprese, kdy většina HPV pozitivních vzorků vykazovala profil odpovídající silné specifické imunitní odpovědi v porovnání s HPV negativními vzorky, kde převažovala přirozená imunita. Tato genová analýza se také ukázala být účinnějším prognostickým faktorem než HPV status samotný [38].
V rámci lepšího porozumění lokální imunitní odpovědi se některé studie zabývaly analýzou imunitních buněk v nádorech in situ. Ve většině případů jsou imunitní buňky v nádoru detekovány pomocí imunohistochemických metod (IHC), jejichž výhodou je určení přesné lokalizace buněk. Nevýhodou však je, že nevypovídá nic o jejich funkčnosti či aktuálním stavu. Fakt, že je výskyt CD8+ T lymfocytů považován za pozitivní prognostický marker, potvrdila u pacientů s HNSCC také data Nasmana et al [39], z jejichž výsledků vyplývá, že infiltrace nádoru CD8+ T lymfocyty a vysoký podíl CD8+/ FoxP3+ T buněk pozitivně koreluje s klinickým stavem HPV pozitivních i HPV negativních pacientů. Jak již bylo popsáno výše, Wansom et al [36] detekovali zvýšené hladiny cirkulujících CD8+ T lymfocytů v krvi HPV pozitivních pacientů. Pokud ale použili IHC značení vzorků nádorové tkáně, neviděli žádné rozdíly s ohledem na HPV status.
Analýza populací imunitních buněk v nádoru pomocí průtokové cytometrie ukázala výrazně vyšší zastoupení leukocytů, a to zejména CD8+ T lymfocytů, u HPV pozitivních pacientů. Zajímavé také je, že tyto CD8+ T buňky v HPV pozitivních nádorech měly navíc schopnost produkovat signifikantně vyšší hladiny IFN-γ a IL‑17 v porovnání s HPV negativními vzorky. U ostatních populací T buněk, jako jsou Th1 buňky, Treg, či Th17 buňky, nebyly pozorovány výrazné rozdíly mezi HPV pozitivními a negativními nádory [40].
Skupina Badoualové et al [41] pozorovala významně delší celkové přežití HPV pozitivních pacientů, jejichž nádory byly silně infiltrovány PD ‑ 1+CD4+ a PD ‑ 1+CD8+ T lymfocyty. Již dříve bylo publikováno, že exprese PD ‑ 1 receptoru na T buňkách je spojována jak s aktivovaným, tak i s takzvaným vyčerpaným fenotypem T buněk [42]. Badoualová et al [41] překvapivě zjistili, že PD ‑ 1+ T lymfocyty infiltrující HPV pozitivní nádory exprimují výrazně vyšší hladiny aktivačních markerů HLA‑DR a CD38, a nejde tudíž o vyčerpané buňky, jak autoři původně předpokládali.
V současné době stále nejsou k dispozici studie, které by se zabývaly detailní analýzou funkce CD8+ T lymfocytů u HNSCC pacientů. Je potřeba získat více informací o nádorových a virových antigenech, které infiltrující CD8+ T lymfocyty rozpoznávají, a poznat tak cíle imunitní odpovědi, které jsou důležité pro růst a přežívání nádorových buněk. To povede k vývoji cílených postupů protinádorové imunoterapie. Nejen kvantitativní, ale také kvalitativní analýza imunitních buněk v nádoru bude tedy zásadní pro identifikaci nových, klinicky relevantních prognostických faktorů.
Treg a jejich prognostický význam
Treg patří mezi CD4+ buňky, jejichž hlavní funkcí je potlačovat potenciálně nebezpečné autoreaktivní T lymfocyty, které unikly centrální toleranci v thymu. Tím brání vzniku autoimunitních onemocnění, nastolují periferní toleranci a udržují imunitní homeostázu. Většina vědeckých skupin zaměřujících se na analýzu nádorových CD4+ T lymfocytů jako potenciálního prognostického markeru se zabývá také studiem Treg. Zdá se, že se úloha Treg v nádorové imunologii liší v závislosti na typu a etiologii nádoru. Na jednu stranu Treg potlačují imunitní odpověď proti nádorové tkáni a vysoké hladiny Treg jsou často spojovány se špatnou prognózou pacientů s různými nádorovými onemocněními [43]. Na druhou stranu byla přítomnost Treg popsána jako pozitivní prognostický marker např. u kolorektálního karcinomu či lymfomů [44,45]. Zvýšené hladiny Treg byly popsány také v nádorové tkáni a periferní krvi pacientek s cervikálním karcinomem a jejich zastoupení navíc korelovalo s klinickým stavem pacientek. Pokud však byly Treg z periferní krve HPV 16 pozitivní pacientek in vitro depletovány, došlo k zesílení CD4+ T buněčné odpovědi vůči E6 a E7 peptidům [46]. Úloha Treg u pacientů s nádory hlavy a krku není zcela jednoznačná. Některé studie ukazují pozitivní korelaci vysokého zastoupení Treg v nádoru s loko regionální kontrolou nádorového růstu [25]. Tuto hypotézu také podporují výsledky dalších skupin, ve kterých zastoupení Treg pozitivně koreluje s celkovým přežitím pacientů [47]. V současné době se však velký význam přikládá stanovení poměru Treg a cytotoxických CD8+ T lymfocytů. Data Nasmana et al [39] uvádějí, že pacienti s nádory infiltrovanými vysokým počtem CD8+ T lymfocytů a s vysokým podílem CD8+/ Treg měli delší celkové přežití, a to jak ve skupině HPV pozitivních, tak HPV negativních pacientů. Zajímavá je také studie Boučka et al [48], v níž autoři prokázali, že vysoké hladiny Treg v periferní krvi v době diagnózy mohou predikovat časnou recidivu onemocnění.
Systémová a lokální T buněčná HPV specifická odpověď u pacientů s HNSCC
Systémová odpověď
Vzhledem k tomu, že nádorové buňky infikované virem HPV mohou na svém povrchu exprimovat antigeny odvozené z E6 a E7 onkoproteinů, nabízí se otázka možnosti detekce specifických T lymfocytů namířených proti těmto antigenům. Ukázalo se, že CD4+ a CD8+ T buňky specifické k HPV 16 jsou skutečně častěji detekovány v periferní krvi pacientů, kteří jsou HPV pozitivní, oproti HPV negativním či zdravým kontrolám [49]. Například Heusinkveld et al [49] testovali mononukleární buňky periferní krve (peripheral blood mononuclear cells – PBMC) pacientů na přítomnost T lymfocytů specifických k peptidům derivovaným z HPV 16 onkoproteinů. U 7 z 11 (63,6 %) HPV pozitivních pacientů detekovali specifickou HPV odpověď, na rozdíl od HPV negativních pacientů, kde jich odpovídalo pouze 7 z 28 (25 %). Avšak pouze u 5 ze 17 pacientů byla proliferační aktivita lymfocytů doprovázena produkcí IFN-γ a překvapivě čtyři z těchto pěti nádorů byly HPV negativní. Podobně Albers nebo Hoffmann et al [16,50] detekovali vyšší hladiny HPV 16 E7 specifických T lymfocytů u HPV pozitivních pacientů ve srovnání s HPV negativními nádory a zdravými kontrolami.
Lokální odpověď
Heusinkveld et al [49] dále studovali lokální odpověď vyvolanou přímo v nádorové tkáni a metastatické uzlině, přičemž specifickou T odpověď zjistili skoro u všech pacientů s HPV pozitivními nádory, ale nebyli schopni ji detekovat u žádného z HPV negativních pacientů. Vzhledem k tomu, že systémovou odpověď detekovali pouze u některých pacientů, je evidentní, že analýza pouze samotných PBMC není dostačující a je nutné sledovat především lokální imunitní odpověď přímo v nádoru. Při bližší analýze HPV 16 specifické T buněčné odpovědi se ukázalo, že sestávala z repertoáru CD4+ pomocných T lymfocytů typu 1 a 2, CD4+ Treg a CD8+ lymfocytů reagujících vůči některým HPV 16 E6 a E7 epitopům. T lymfocyty z nádoru navíc produkovaly spektrum Th1 a Th2 cytokinů, jako jsou IFN ‑ γ, TNF‑α, IL‑4 a IL‑5 [49].
Možnosti imunoterapie pro HPV asociované nádory
V současné době probíhá výzkum mnoha různých druhů imunoterapií určených pro léčbu pacientů s nádory hlavy a krku. Výčet všech možných přístupů by přesahoval rámec tohoto přehledu, proto jsou zde uvedeny pouze některé názorné příklady (obr. 1).
Obr. 1. Možnosti imunoterapie a dalších léčebných postupů u pacientů s nádory hlavy a krku. 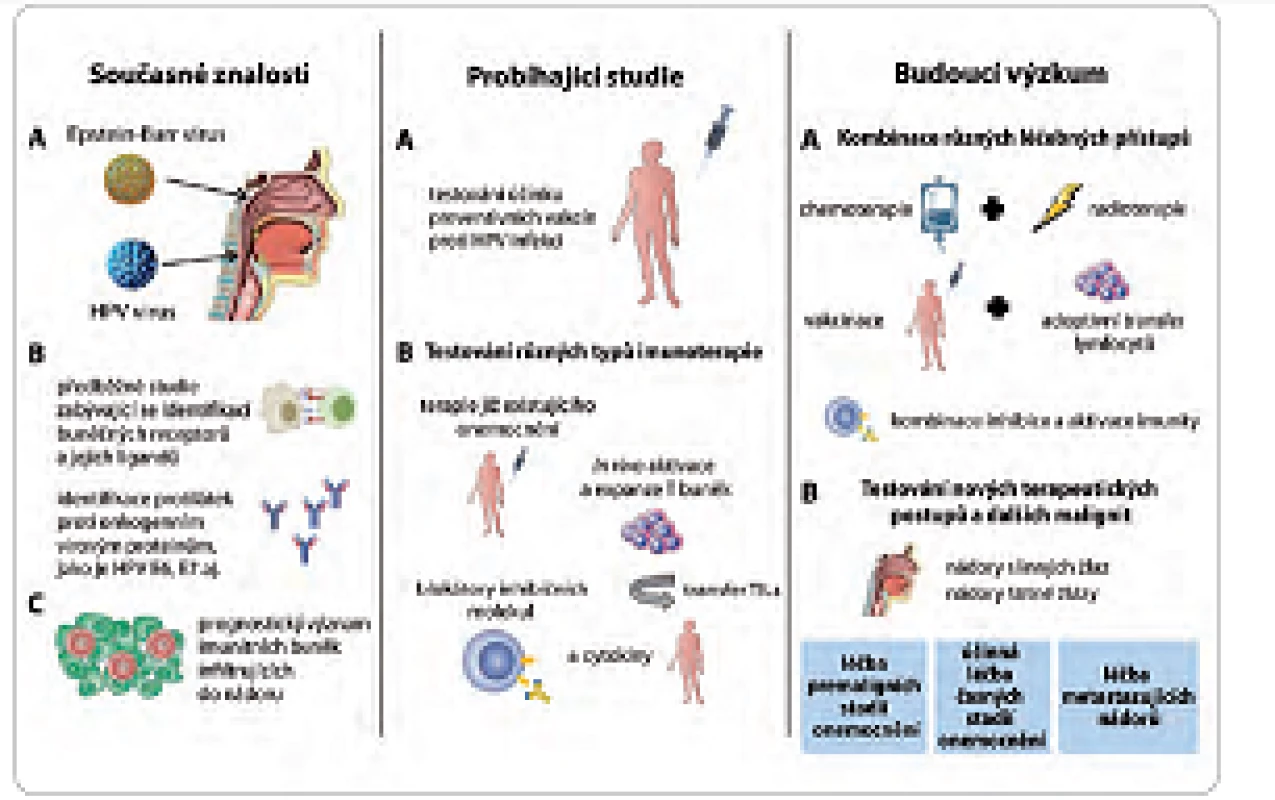
V současné době je již známa: A. role onkogenních virů HPV a EBV při vzniku nádorů orofaryngu a nazofaryngu; B. byly identifi kovány imunologické markery na HNSCC a detekovány protilátky proti virovým antigenům; C. na základě těchto studií se uvažuje, že by imunitní buňky mohly sloužit jako prognostické markery předpovídající odpověď na klasickou terapii. V současné době probíhají studie: A. určující přínos profylaktických vakcín; B. probíhá testování jednotlivých imunoterapeutických přístupů, jako jsou terapeutické vakcinace, adoptivní transfer T lymfocytů či blokování inhibičních molekul. Budoucí výzkum bude zaměřen na: A. testování kombinací různých léčebných přístupů využívajících potenciální synergický efekt mezi imunoterapií a radio- a/nebo chemoterapií; B. vývoj nových postupů a využití imunoterapie i v dalších fázích onemocnění a pro jiné typy nádorů. Profylaktické typy vakcín jsou založeny na principu prevence vzniku virové infekce v epiteliálních buňkách pomocí protilátkové odpovědi, která je namířená proti virovým kapsidovým proteinům. Nicméně strategie tohoto typu nejsou účinné pro léčbu již probíhající infekce virem HPV nebo onemocnění asociovaných s touto infekcí. V těchto případech vyžaduje léčba aktivaci buněčné imunity, převážně CD4+ a CD8+ T lymfocytů, které dokáží rozpoznat a eliminovat buňky infikované virem.
Pro vývoj nových imunoterapeutických protokolů je nezbytné identifikovat antigeny, které by byly pro daný nádor specifické a které by určovaly specificitu požadované imunitní odpovědi. Virové onkoproteiny E6 a E7 by mohly být vhodným modelem nádorových antigenů z několika důvodů. Jednak jsou tyto virové proteiny pro tělo cizí, a tudíž více imunogenní v porovnání s proteiny tělu vlastními, které jsou u nádorových buněk často mutovány (např. protein p53). Ale také jsou exprimovány všemi buňkami, které virus infikoval, a tudíž každým nádorem, který daný virus indukoval. Vzhledem k tomu, že jsou E6 a E7 proteiny vyžadovány pro vznik a zachování maligního fenotypu, jsou nepřetržitě exprimovány nádorovými buňkami a zdá se být nepravděpodobné, že by nádorové buňky tlumily jejich expresi za účelem vyhnout se imunitnímu systému [51].
Slibné výsledky přinesla II. fáze klinické studie testující přístup založený na podání vakcíny obsahující HPV 16 E6 a E7 peptidy ve Freundově adjuvans, která byla podávána pacientkám s vulvární intraepiteliální neoplazií (VIN). Po 12 měsících pozorovali autoři studie kompletní klinickou odpověď u 47 % pacientek, přičemž u všech se jednalo o T buněčnou odpověď indukovanou podáním vakcíny [52].
V současné době nejsou k dispozici data z klinických studií založených na principu HPV vakcín pro pacienty s nádory hlavy a krku. Nicméně právě probíhá hodnocení klinické studie fáze I pro pacienty v pokročilých stadiích onemocnění a po prokázání recidivy (vč. HNSCC pacientů) využívající terapii na principu adoptivního transferu, kde jsou PBMC in vitro stimulovány peptidy E6 a E7 (https:/ / clinicaltrials.gov/ ct2/ show/ study/ NCT00019110).
Adoptivní transfer jako léčebný postup byl testován také u pacientů s pokročilým nazofaryngeálním karcinomem, který je známý tím, že exprimuje EBV (Epstein‑Barr virus) antigeny. T lymfocyty, které rozpoznávaly EBV antigeny, byly aktivovány a expandovány pomocí autologních EBV transformovaných B buněk. Léčba byla pacienty dobře snášena, přičemž 60 % pacientů vykazovalo kontrolu progrese onemocnění [53]. Podobný přístup založený na přípravě T lymfocytů namířených proti nádoru byl popsán také u pacientů s HNSCC [54].
Aktivace a proliferace T lymfocytů vyvolané antigenem jsou regulované mimo jiné také vazbou kostimulačních a inhibičních receptorů. Signalizace prostřednictvím receptorů ovlivňuje zahájení, průběh i celkový výsledek imunitní odpovědi. Pokud by na buňkách nebyly tyto inhibiční molekuly exprimovány, T lymfocyty by byly dlouhodobě aktivované, což by mohlo vést k poškození tkání či vzniku autoimunit. Nicméně v kontextu nádorové imunologie, kde probíhá specifická imunitní reakce proti nádorovým antigenům, představují inhibiční molekuly jednu z hlavních překážek, protože by mohlo dojít k navození tolerance vůči nádoru. Bylo vynaloženo mnoho úsilí na výzkum blokátorů těchto inhibičních molekul a jejich využití se dnes zdá být přínosem pro léčbu pacientů s různým nádorovým onemocněním. Mezi dva nejznámější a nejstudovanější inhibiční T buněčné receptory patří CTLA ‑ 4 (cytotoxic T‑lymphocyte‑associated protein-4) a PD ‑ 1 (programmed cell death ‑ 1), od nichž odvozené monoklonální protilátky jsou v současné době již používány v klinické praxi.
Vzhledem k výsledkům současných terapeutických postupů a také faktu, že je konvenční léčba často spojována se značnými nežádoucími účinky, je potřeba soustředit pozornost na výzkum méně toxických a lépe cílených terapií. S narůstajícími znalostmi týkajícími se dysfunkcí imunitního systému pacientů s nádory hlavy a krku a také díky pokrokům v oblasti identifikace HNSCC nádorových antigenů se využití imunoterapie zdá být atraktivním léčebným přístupem snad již blízké budoucnosti.
Práce byla podpořena IGA MZ ČR č. NT 11542, FN Motol – grant č. 00064203 a dále grant SVV 266513, UNCE 204013 a PRVOUK 27-1.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Simona Partlová
Sotio a. s.
Jankovcova 1518/2
170 00 Praha 7
e-mail: partlova@sotio.com
Obdrženo: 31. 7. 2015
Přijato: 22. 8. 2015
Zdroje
1. Guo T, Califano JA. Molecular biology and immunology of head and neck cancer. Surg Oncol Clin N Am 2015; 24(3): 397 – 407. doi: 10.1016/ j.soc.2015.03.002.
2. Psyrri A, Burtness B, Harari PM et al. Head and neck cancer. J Oncol 2009; 2009 : 358098. doi: 10.1155/ 2009/ 358098.
3. Ferlay J, Shin HR, Bray F et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer 2010; 127(12): 2893 – 2917. doi: 10.1002/ ijc.25516.
4. Young D, Xiao CC, Murphy B et al. Increase in head and neck cancer in younger patients due to human papillomavirus (HPV). Oral Oncol 2015; 51(8): 727 – 730. doi: 10.1016/ j.oraloncology.2015.03.015.
5. D‘Souza G, Kreimer AR, Viscidi R et al. Case ‑ control study of human papillomavirus and oropharyngeal cancer. N Engl J Med 2007; 356(19): 1944 – 1956.
6. Tachezy R, Klozar J, Saláková M et al. HPV and other risk factors of oral cavity/ oropharyngeal cancer in the Czech Republic. Oral Dis 2005; 11(3): 181 – 185.
7. Marur S, D‘Souza G, Westra WH et al. HPV‑associated head and neck cancer: a virus‑related cancer epidemic. Lancet Oncol 2010; 11(8): 781 – 789. doi: 10.1016/ S1470 ‑ 2045(10)70017 ‑ 6.
8. Klozar J, Tachezy R. What are the implications of human papillomavirus status in oropharyngeal tumors for clinical practice? Curr Opin Otolaryngol Head Neck Surg 2014; 22(2): 90 – 94. doi: 10.1097/ MOO.0000000000000030.
9. Sepiashvili L, Bruce JP, Huang SH et al. Novel insights into head and neck cancer using next ‑ generation „omic“ technologies. Cancer Res 2015; 75(3): 480 – 486. doi: 10.1158/ 0008 ‑ 5472.CAN ‑ 14 ‑ 3124.
10. Stransky N, Egloff AM, Tward AD et al. The mutational landscape of head and neck squamous cell carcinoma. Science 2011; 333(6046): 1157 – 1160. doi: 10.1126/ science.1208130.
11. Poeta ML, Manola J, Goldwasser MA et al. TP53 mutations and survival in squamous ‑ cell carcinoma of the head and neck. N Engl J Med 2007; 357(25): 2552 – 2561.
12. Skinner HD, Sandulache VC, Ow TJ et al. TP53 disruptive mutations lead to head and neck cancer treatment failure through inhibition of radiation‑induced senescence. Clin Cancer Res 2012; 18(1): 290 – 300. doi: 10.1158/ 1078 ‑ 0432.CCR ‑ 11 ‑ 2260.
13. Cancer Genome Atlas Network. Comprehensive genomic characterization of head and neck squamous cell carcinomas. Nature 2015; 517(7536): 576 – 582. doi: 10.1038/ nature14129.
14. Mrhalova M, Plzak J, Betka J et al. Epidermal growth factor receptor – its expression and copy numbers of EGFR gene in patients with head and neck squamous cell carcinomas. Neoplasma 2005; 52(4): 338 – 343.
15. Leemans CR, Braakhuis BJ, Brakenhoff RH. The molecular biology of head and neck cancer. Nat Rev Cancer 2011; 11(1): 9 – 22. doi: 10.1038/ nrc2982.
16. Albers A, Abe K, Hunt J et al. Antitumor activity of human papillomavirus type 16 E7 - specific T cells against virally infected squamous cell carcinoma of the head and neck. Cancer Res 2005; 65(23): 11146 – 11155.
17. Spanos WC, Nowicki P, Lee DW et al. Immune response during therapy with cisplatin or radiation for human papillomavirus‑related head and neck cancer. Arch Otolaryngol Head Neck Surg 2009; 135(11): 1137 – 1146. doi: 10.1001/ archoto.2009.159.
18. Duray A, Demoulin S, Hubert P et al. Immune suppression in head and neck cancers: a review. Clin Dev Immunol 2010; 2010 : 701657. doi: 10.1155/ 2010/ 701657.
19. Allen CT, Judd NP, Bui JD et al. The clinical implications of antitumor immunity in head and neck cancer. Laryngoscope 2012; 122(1): 144 – 157. doi: 10.1002/ lary.21913.
20. Russell S, Angell T, Lechner M et al. Immune cell infiltration patterns and survival in head and neck squamous cell carcinoma. Head Neck Oncol 2013; 5(3): 24.
21. Fridman WH, Pagès F, Sautès ‑ Fridman C et al. The immune contexture in human tumours: impact on clinical outcome. Nat Rev Cancer 2012; 12(4): 298 – 306. doi: 10.1038/ nrc3245.
22. Reichert TE, Day R, Wagner EM et al. Absent or low expression of the zeta chain in T cells at the tumor site correlates with poor survival in patients with oral carcinoma. Cancer Res 1998; 58(23): 5344 – 5347.
23. Kuss I, Saito T, Johnson JT et al. Clinical significance of decreased zeta chain expression in peripheral blood lymphocytes of patients with head and neck cancer. Clin Cancer Res 1999; 5(2): 329 – 334.
24. Hoffmann TK, Dworacki G, Tsukihiro T et al. Spontaneous apoptosis of circulating T lymphocytes in patients with head and neck cancer and its clinical importance. Clin Cancer Res 2002; 8(8): 2553 – 2562.
25. Badoual C, Hans S, Rodriguez J et al. Prognostic value of tumor ‑ infiltrating CD4+ T ‑ cell subpopulations in head and neck cancers. Clin Cancer Res 2006; 12(2): 465 – 472.
26. Zhang YL, Li J, Mo HY et al. Different subsets of tumor infiltrating lymphocytes correlate with NPC progression in different ways. Mol Cancer 2010; 9 : 4. doi: 10.1186/ 1476 ‑ 4598 ‑ 9 ‑ 4.
27. Strauss L, Bergmann C, Szczepanski M et al. A unique subset of CD4+CD25highFoxp3+ T cells secreting interleukin‑10 and transforming growth factor‑beta1 mediates suppression in the tumor microenvironment. Clin Cancer Res 2007; 13(15 Pt 1): 4345 – 4354.
28. Kesselring R, Thiel A, Pries R et al. Human Th17 cells can be induced through head and neck cancer and have a functional impact on HNSCC development. Br J Cancer 2010; 103(8): 1245 – 1254. doi: 10.1038/ sj.bjc.6605891.
29. Kanodia S, Fahey LM, Kast WM. Mechanisms used by human papillomaviruses to escape the host immune response. Curr Cancer Drug Targets 2007; 7(1): 79 – 89.
30. Iijima N, Goodwin EC, Dimaio D et al. High‑risk human papillomavirus E6 inhibits monocyte differentiation to Langerhans cells. Virology 2013; 444(1 – 2): 257 – 262. doi: 10.1016/ j.virol.2013.06.020.
31. Kimple RJ, Harari PM, Torres AD et al. Development and characterization of HPV ‑ positive and HPV ‑ negative head and neck squamous cell carcinoma tumorgrafts. Clin Cancer Res 2013; 19(4): 855 – 864. doi: 10.1158/ 1078 ‑ 0432.CCR ‑ 12 ‑ 2746.
32. Galon J, Pagès F, Marincola FM et al. Cancer classification using the immunoscore: a worldwide task force. J Transl Med 2012; 10 : 205. doi: 10.1186/ 1479 ‑ 5876 ‑ 10 ‑ 205.
33. Leiding JW, Holland SM. Warts and all: human papillomavirus in primary immunodeficiencies. J Allergy Clin Immunol 2012; 130(5): 1030 – 1048. doi: 10.1016/ j.jaci.2012.07.049.
34. Kreimer AR, Alberg AJ, Daniel R et al. Oral human papillomavirus infection in adults is associated with sexual behavior and HIV serostatus. J Infect Dis 2004; 189(4): 686 – 698.
35. Kim ST, Jeong H, Woo OH et al. Tumor ‑ infiltrating lymphocytes, tumor characteristics, and recurrence in patients with early breast cancer. Am J Clin Oncol 2013; 36(3): 224 – 231. doi: 10.1097/ COC.0b013e3182467d90.
36. Wansom D, Light E, Worden F et al. Correlation of cellular immunity with human papillomavirus 16 status and outcome in patients with advanced oropharyngeal cancer. Arch Otolaryngol Head Neck Surg 2010; 136(12): 1267 – 1273. doi: 10.1001/ archoto.2010.211.
37. Turksma AW, Bontkes HJ, van den Heuvel H et al. Effector memory T ‑ cell frequencies in relation to tumour stage, location and HPV status in HNSCC patients. Oral Dis 2013; 19(6): 577 – 584. doi: 10.1111/ odi.12037.
38. Thurlow JK, Peña Murillo CL, Hunter KD et al. Spectral clustering of microarray data elucidates the roles of microenvironment remodeling and immune responses in survival of head and neck squamous cell carcinoma. J Clin Oncol 2010; 28(17): 2881 – 2888. doi: 10.1200/ JCO.2009.24.8724.
39. Nasman A, Romanitan M, Nordfors C et al. Tumor infiltrating CD8+ and Foxp3+ lymphocytes correlate to clinical outcome and human papillomavirus (HPV) status in tonsillar cancer. PLoS One 2012; 7(6): e38711. doi: 10.1371/ journal.pone.0038711.
40. Partlova S, Bouček J, Kloudová K et al. Distinct patterns of intratumoral immune cell infiltrates in patients with HPV‑associated compared to non‑virally induced head and neck squamous cell carcinoma. Oncoimmunology 2015; 4(1): e965570.
41. Badoual C, Hans S, Merillon N et al. PD ‑ 1 - expressing tumor ‑ infiltrating T cells are a favorable prognostic biomarker in HPV‑associated head and neck cancer. Cancer Res 2013; 73(1): 128 – 138. doi: 10.1158/ 0008 ‑ 5472.CAN ‑ 12 ‑ 2606.
42. Sauce D, Almeida JR, Larsen M et al. PD ‑ 1 expression on human CD8 T cells depends on both state of differentiation and activation status. AIDS 2007; 21(15): 2005 – 2013.
43. Curiel TJ, Coukos G, Zou L et al. Specific recruitment of regulatory T cells in ovarian carcinoma fosters immune privilege and predicts reduced survival. Nat Med 2004; 10(9): 942 – 949.
44. Salama P, Phillips M, Grieu F et al. Tumor ‑ infiltrating FOXP3+ T regulatory cells show strong prognostic significance in colorectal cancer. J Clin Oncol 2009; 27(2): 186 – 192. doi: 10.1200/ JCO.2008.18.7229.
45. Alvaro T, Lejeune M, Salvadó MT et al. Outcome in Hodgkin‘s lymphoma can be predicted from the presence of accompanying cytotoxic and regulatory T cells. Clin Cancer Res 2005; 11(4): 1467 – 1473.
46. Piersma SJ, Jordanova ES, van Poelgeest MI et al. High number of intraepithelial CD8+ tumor ‑ infiltrating lymphocytes is associated with the absence of lymph node metastases in patients with large early‑stage cervical cancer. Cancer Res 2007; 67(1): 354 – 361.
47. Bron L, Jandus C, Andrejevic ‑ Blant S et al. Prognostic value of arginase ‑ II expression and regulatory T ‑ cell infiltration in head and neck squamous cell carcinoma. Int J Cancer 2013; 132(3): E85 – E93. doi: 10.1002/ ijc.27728.
48. Boucek J, Mrkvan T, Chovanec M et al. Regulatory T cells and their prognostic value for patients with squamous cell carcinoma of the head and neck. J Cell Mol Med 2010; 14(1 – 2): 426 – 433.
49. Heusinkveld M, Goedemans R, Briet RJ et al. Systemic and local human papillomavirus 16 - specific T ‑ cell immunity in patients with head and neck cancer. Int J Cancer 2012; 131(2): E74 – E85. doi: 10.1002/ ijc.26497.
50. Hoffmann TK, Arsov C, Schirlau K et al. T cells specific for HPV16 E7 epitopes in patients with squamous cell carcinoma of the oropharynx. Int J Cancer 2006; 118(8): 1984 – 1991.
51. Best SR, Niparko KJ, Pai SI. Biology of human papillomavirus infection and immune therapy for HPV‑related head and neck cancers. Otolaryngol Clin North Am 2012; 45(4): 807 – 822. doi: 10.1016/ j.otc.2012.04.005.
52. Kenter GG, Welters MJ, Valentijn AR et al. Vaccination against HPV ‑ 16 oncoproteins for vulvar intraepithelial neoplasia. N Engl J Med 2009; 361(19): doi: 10.1056/ NEJMoa0810097.
53. Comoli P, Pedrazzoli P, Maccario R et al. Cell therapy of stage IV nasopharyngeal carcinoma with autologous Epstein‑Barr virus ‑ targeted cytotoxic T lymphocytes. J Clin Oncol 2005; 23(35): 8942 – 8949.
54. Chang AE, Li Q, Jiang G et al. Generation of vaccine ‑ primed lymphocytes for the treatment of head and neck cancer. Head Neck 2003; 25(3): 198 – 209.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2015 Číslo Supplementum 4- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Nežádoucí účinky moderní imunoterapie a jejich řešení v klinické praxi
- Terapeutický efekt a tolerance ipilimumabu u metastatického maligního melanomu v dětském věku – kazuistika
- Protinádorové zbraně imunitního systému
- Úloha regulačních T buněk v protinádorové imunitní odpovědi
- Únikové strategie nádorů pozornosti imunitního systému
- Editorial
- Role imunoterapie v dětské onkologii
- Nádorová imunoterapie: Jsme na úsvitu nové éry?
- Chimérický antigenní receptor T lymfocytů – genová terapie budoucnosti u nádorových onemocnění?
- Význam imunogenní buněčné smrti v protinádorové imunitě
- Význam imunitního systému a možnosti imunoterapie u maligního melanomu
- Imunoterapie renálního karcinomu
- Význam imunitního systému a možnosti imunoterapie u karcinomu prostaty
- Dosavadní zkušenosti a perspektivy imunoterapie bronchogenního karcinomu
- Imunoterapie u bronchogenního karcinomu a její perspektivy
- Historie imunoterapie – od Coley toxinů ke kontrolním bodům imunitní reakce
- Immunoscore a jeho prediktivní hodnota u kolorektálního karcinomu
- Imunitní systém u pacientů s nádory hlavy a krku
- Imunoterapie uroteliálního karcinomu močového měchýře – od BCG vakcín k cílené imunoterapii
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nežádoucí účinky moderní imunoterapie a jejich řešení v klinické praxi
- Imunoterapie uroteliálního karcinomu močového měchýře – od BCG vakcín k cílené imunoterapii
- Únikové strategie nádorů pozornosti imunitního systému
- Význam imunogenní buněčné smrti v protinádorové imunitě
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



