-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Léčebné možnosti pro nemocné s chronickou lymfocytární leukemií a významnými přidruženými chorobami
Therapeutic Options for „Slow ‑ go“ Patients with Chronic Lymphocytic Leukemia
Chronic lymphocytic leukemia is a disease of older patients, most of them suffering from significant comorbidities or functional limitations (so ‑ called ’slow ‑ go’ patients). Unfortunately, clinical trials in chronic lymphocytic leukemia have until recently focused mainly on the subgroup of younger patients in good overall condition (‘go ‑ go’ patients). Clinico ‑ biological parameters, such as performance status, calculated creatinine clearance, the number and severity of comorbidities along with individual clinical assessment can help guide decisions relating to the objectives and ultimately the intensity of treatment. Two large randomized studies have recently demonstrated that the addition of monoclonal antibodies against CD20 (obinutuzumab, rituximab and ofatumumab) to chlorambucil in untreated ‘slow ‑ go’ patients resulted in a significant increase in the number of complete remissions, progression‑free survival and even overall survival (for obinutuzumab and rituximab) with an acceptable safety profile. Chemoimmunotherapy combining chlorambucil with anti‑CD20 antibody is thus the new standard 1st line therapy in this group of patients. Treatment of relapsed/ refractory chronic lymphocytic leukemia in ‘slow ‑ go’ patients is very difficult and specific data is sparse. In this indication, we have witnessed an extraordinary breakthrough by means of small oral inhibitors interfering with B ‑ cell receptor downstream signaling pathways: ibrutinib, the Bruton‘s tyrosine kinase inhibitor, and idelalisib, the inhibitor of phosphatidylinositol 3 - kinase δ. Both drugs radically changed the approach to the treatment of relapsed/ refractory chronic lymphocytic leukemia; relatively mild toxicity also predetermines their use in elderly/ comorbid patients. Other treatment options for relapsed/ refractory chronic lymphocytic leukemia in this subgroup include alemtuzumab, ofatumumab, high‑dose glucocorticoids + antiCD20 antibodies, or bendamustine + rituximab regimen. This review summarizes current data regarding the treatment of elderly and comorbid patients with chronic lymphocytic leukemia.
Key words:
chronic lymphocytic leukemia – comorbidity – geriatric assessment – obinutuzumab – rituximab – ofatumumab – ibrutinib – idelalisib
This work was supported by the grant IGA MH CZ NT13412-4/2012, MH CZ – DRO (UHHK, 00179906) and by the programme PRVOUK P37/08.
I declare that, in connection with the above-mentioned contribution, which I am an author, I have a conflict of interest with the typed the following companies: Roche, Janssen-Cilag , Gilead and GlaxoSmithKline (honoraria for lectures or consultations, travel grants).
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
23. 7. 2015Accepted:
29. 7. 2015
Autoři: L. Smolej
Působiště autorů: IV. interní hematologická klinika LF UK a FN Hradec Králové
Vyšlo v časopise: Klin Onkol 2015; 28(Supplementum 3): 30-38
doi: https://doi.org/10.14735/amko20153S30Souhrn
Chronická lymfocytární leukemie je onemocnění starších nemocných, z nichž většina trpí významnými přidruženými onemocněními či funkčním omezením (tzv. slow ‑ go nemocní). Klinická hodnocení u chronické lymfocytární leukemie se donedávna bohužel zaměřovala zejména na podskupinu mladších nemocných v dobrém celkovém stavu („go ‑ go“). Klinicko‑biologické parametry jako výkonnostní stav, vypočtená clearance kreatininu, počet a závažnost přidružených onemocnění a další nám společně s individuálním klinickým posouzením mohou být vodítkem při rozhodování o cílech a intenzitě léčby. Dvě velké randomizované studie prokázaly, že přidání monoklonálních protilátek proti CD20 (obinutuzumab, rituximab a ofatumumab) k chlorambucilu u neléčených starších/ komorbidních nemocných vedlo k významnému zvýšení počtu kompletních remisí, přežití bez progrese a dokonce i celkového přežití (v případě obinutuzumabu a rituximabu) s přijatelným bezpečnostním profilem. Chemoimunoterapie kombinující chlorambucil s anti‑CD20 protilátkou je tedy nový standard léčby 1. linie u této skupiny nemocných. Léčba relabující/ refrakterní chronické lymfocytární leukemie je u „slow ‑ go“ nemocných velmi obtížná a specifických dat je málo. V této indikaci jsme svědky revolučního průlomu zaváděním nových, perorálně dostupných malých molekul působících na principu inhibice signálních drah B buněčného receptoru: ibrutinibu, inhibitoru Brutonovy tyrozinkinázy a idelalisibu, inhibitoru fosfatidylinositol ‑ 3 kinázy δ. Oba tyto léky radikálně změnily přístup k léčbě relabující/ refrakterní chronické lymfocytární leukemie; relativně mírná toxicita je předurčuje také pro použití u starších/ komorbidních nemocných. Další možnosti léčby relabující/ refrakterní chronické lymfocytární leukemie pro „slow ‑ go“ nemocné zahrnují alemtuzumab, ofatumumab, vysokodávkované glukokortikoidy + rituximab či ofatumumab a režim bendamustin + rituximab. Tento přehledný článek shrnuje současné poznatky o léčbě starších a komorbidních nemocných s chronickou lymfocytární leukemií.
Klíčová slova:
chronická lymfocytární leukemie – přidružená onemocnění – geriatrické hodnocení – obinutuzumab – rituximab – ofatumumab – ibrutinib – idelalisibÚvod
Chronická lymfocytární leukemie (CLL) je nejčastější leukemie dospělých v euroamerické populaci [1 – 3]. Hlavní charakteristikou je neobyčejná rozmanitost individuální prognózy, kdy celkové přežití (overall survival – OS) sahá od několika měsíců po desítky let [4 – 7]. CLL je považována za onemocnění běžnými přístupy nevyléčitelné. V současnosti skýtá jedinou možnost trvalého vyléčení alogenní transplantace krvetvorných kmenových buněk. Ta je však proveditelná pouze u velmi malé podskupiny mladších nemocných s vysoce nepříznivou prognózou v dobrém klinickém stavu [8,9]. Chemoimunoterapeutický režim FCR (fludarabin, cyklofosfamid, rituximab) je nyní standard léčby 1. linie u mladších nemocných v dobrém stavu („go ‑ go“ dle nomenklatury Německé CLL skupiny) [10]. Medián věku při stanovení diagnózy CLL se však pohybuje mezi 65 a 72 lety [3,6,7,11,12]. Randomizované studie fáze III zveřejněné mezi lety 2004 a 2013 ale léčily nemocné zpravidla o 5 – 10 let mladší (tab. 1) [10,13,14 – 28]. Drtivá většina výsledků z velkých CLL studií tak není přímo aplikovatelná pro neselektovanou populaci CLL nemocných, natož pro „slow ‑ go“ nemocné. Bylo prokázáno, že léčba starších nemocných plnodávkovanými režimy na bázi fludarabinu (FC, FCR) vyústila v nepřijatelnou hematologickou a infekční toxicitu [29,30]. Vyšší věk byl opakovaně prokázán jako nezávislý prediktor kratšího OS u CLL [31 – 36]. Retrospektivní analýza barcelonských autorů ukázala, že OS se v historickém srovnání významně prodloužilo pouze u nemocných mladších 70 let v době stanovení diagnózy [6]. Lze tedy konstatovat, že až do nedávné doby byl klinický přínos moderních režimů chemoterapie a chemoimunoterapie prokázán pouze u mladších a fit („go ‑ go“) nemocných.
Tab. 1. Počet nemocných a medián věku v randomizovaných CLL studiích publikovaných mezi lety 2004 a 2013. 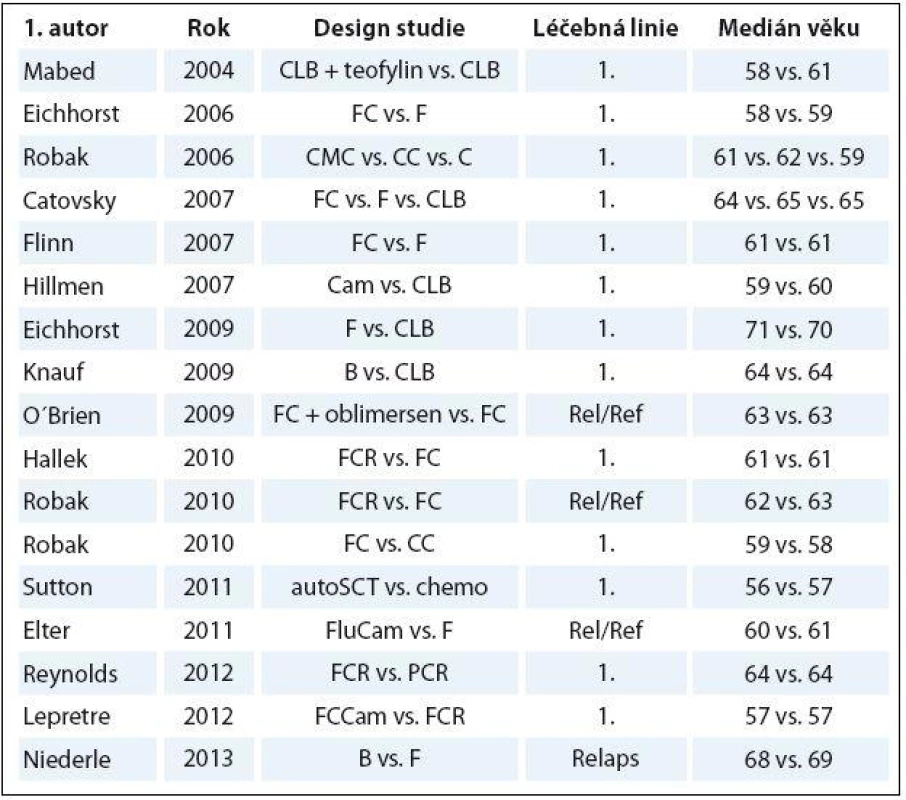
CLB – chlorambucil, F – fl udarabin, FC – fl udarabin + cyklofosfamid, B – bendamustin, FCR – fl udarabin + cyklofosfamid + rituximab, CC – kladribin + cyklofosfamid, chemo – chemoterapie, CMC – kladribin + cyklofosfamid + mitoxantron, PCR – pentostatin + cyklofosfamid + rituximab, Cam – alemtuzumab, FluCam – fl udarabin + alem - tuzumab, FCCam – fl udarabin + cyklofosfamid + alemtuzumab, autoSCT – autologní transplantace krvetvorných kmenových buněk, Rel/Ref – relabující/refrakterní onemocnění Význam posouzení funkce ledvin a přidružených onemocnění
Renální funkce se postupně zhoršuje s přibývajícím věkem díky fyziologickému stárnutí, přidruženým onemocněním (např. arteriální hypertenze, diabetes mellitus) a užívání nefrotoxických léků [37 – 39]. Protože svalové hmoty ubývá a vylučování kreatininu klesá obdobnou rychlostí, může zůstat koncentrace sérového kreatininu téměř konstantní po dlouhou dobu i přes zhoršující se funkci ledvin. Proto je u starších nemocných přesnější hodnotit funkci ledvin pomocí glomerulární filtrace [37,38]. Vyhodnocení funkce ledvin je zásadní pro dávkování cytostatik, jako např. fludarabinu a cyklofosfamidu, která jsou vylučována převážně renální cestou [40,41]. Glomerulární filtrace může být jednoduše zhodnocena pomocí rovnic pro vypočtenou clearance kreatininu, např. dle Cockcrofta a Gaulta [42], která je v současné době široce používána v rámci klinických studií s CLL. Ve studii CALGB 9011 se ukázalo, že clearance kreatininu ≤ 80 ml/ min byla spojena s vyšší toxicitou léčby u pacientů s CLL léčených v 1. linii fludarabinem v monoterapii [43].
Přidružená onemocnění mají obecně nepříznivý vliv na OS pacientů s malignitami včetně lymfoproliferací [44 – 47]. Dat týkajících se komorbidit u CLL je však dosud velmi málo. V unicentrické retrospektivní analýze z Mayo Clinic byla přítomnost závažného přidruženého onemocnění spojena s významně kratším OS [32]; velká analýza nemocných léčených v rámci dvou randomizovaných studií fáze III německé CLL skupiny ukázala, že přítomnost dvou či více komorbidit byla nezávislým prediktorem přežití bez progrese (progression‑free survival – PFS) i OS nezávisle na věku [36]. Zdá se tedy, že věk i přidružená onemocnění hrají důležitou úlohu v prognóze pacientů s CLL, ale je třeba vyčkat výsledků dalších prospektivních studií.
Indikace k léčbě CLL
Podle mezinárodně uznávaných doporučení International Workshop on CLL je vhodné zahájení léčby pouze v případě klinické aktivity CLL (masivní či progresivní lymfadenopatie/ splenomegalie, progresivní anémie a/ nebo trombocytopenie, systémové příznaky nebo krátký zdvojovací čas lymfocytů), což platí i pro „slow ‑ go“ nemocné [48]. U nemocných s mírnou, asymptomatickou anémií a/ nebo trombocytopenií je možno zahájení léčby odložit až do zřetelného zhoršování [49], což platí zejména pro velmi staré nebo těžce komorbidní nemocné, u nichž jsou léčebné možnosti značně omezené.
Individuální posouzení nemocného a stanovení léčebného cíle
Nejdůležitějším faktorem při rozhodování o intenzitě léčby je stanovení cíle léčby v závislosti na stavu nemocného (zejména věk, zdatnost, funkční schopnosti a přidružená onemocnění). Maximalizace terapeutické odpovědi a prodloužení OS je jasný cíl u mladších, zdatných pacientů („go ‑ go“ dle Německé CLL skupiny) [50]. Na opačném pólu spektra stojí těžce komorbidní nemocní („no ‑ go“), jejichž přidružená onemocnění budou mít rozhodující vliv na OS. Proto z hlediska léčby CLL vyžadují symptomatický, paliativní přístup s minimálními vedlejšími účinky při zachování kvality života jako hlavního cíle. Mezi těmito dvěma extrémy se nachází početná a heterogenní skupina nemocných s významnými komorbiditami („slow ‑ go“). Nedořešeným problémem stále zůstává, jak nejlépe tyto tři podskupiny oddělit. Vzhledem k tomu, že kalendářní věk je velmi nespolehlivý ukazatel, je nutno zhodnotit tzv. biologický věk. Výkonnostní stav dle Eastern Cooperative Oncology Group (ECOG) slouží jako základní nástroj. Je však též možné posouzení funkční kapacity nemocného, přidružených onemocnění a dalších parametrů pomocí komplexního geriatrického hodnocení (comprehensive geriatric assessment – CGA) [51]. Německá CLL skupina (DCLLSG) jako první navrhla použití systému Cumulative Illness Rating Scale (CIRS) k posuzování komorbidit [52]. Tento systém skóruje počet a závažnost postižení v každém ze 14 orgánových systémů. Byl ověřen v geriatrické populaci [53] a jeho význam byl prokázán u pacientů se solidními nádory i maligními lymfomy [54 – 56]. DCLLSG použila hranici 6 bodů pro definici „go ‑ go“ nemocných [10], ≥ 7 bodů pro definici „slow ‑ go“ a ≥ 18 pro „no ‑ go“ nemocné [57]. Jde však o arbitrární rozdělení a dosud neexistují přesvědčivá prospektivní data prokazující prognosticko/ prediktivní význam tohoto systému. Jiným příkladem je index komorbidit dle Charlsona (CCI) [58], který je široce používán u solidních nádorů [59], kde několik studií prokázalo jeho užitečnost u maligních lymfomů [46,47,60].
Kvalita života a funkční zdatnost jsou mimořádně důležitými faktory u starších/ komorbidních nemocných s CLL vzhledem k chronickému průběhu, nevyléčitelnosti onemocnění a možným závažným vedlejším účinkům léčby. Několik publikací ukázalo, že CLL je spojena s významným narušením kvality života a dosažení kvalitní léčebné odpovědi vede k jejímu zlepšení [61 – 67]. Zajímavým zjištěním je, že zhoršení kvality života a funkční zdatnosti mohou být závislé na pohlaví – ve dvou studiích měly ženy tyto ukazatele významně horší než muži [61,66]. Celkově vzato je vhodné před zvolením terapeutických cílů a výběru nejvhodnější intenzity léčby komplexní individuální posouzení každého jednotlivého pacienta. Podrobné hodnocení pomocí indexů komorbidit, CGA a funkční hodnocení by měla být v maximální možné míře prováděna v rámci prospektivních klinických studií. Individuální klinické posouzení nemocného, jeho očekávání a priority v současné době zůstávají úhelným kamenem pro běžnou praxi.
Léčba 1. linie „slow‑ go“ nemocných s CLL
Alkylační látka chlorambucil (CLB) byla léčba volby u CLL po více než 40 let [68]. Je známo mnoho schémat dávkování, ale schémata německé (0,4 – 0,8 mg/ kg 1. a 15. den, opakování à 4 týdny) [20,57] a britské (10 mg/ m2 1. – 7. den s opakováním à 4 týdny) jsou nejvíce používána v běžné praxi [17,69]. Celková léčebná odpověď (objective response rate – ORR) a PFS se pohybovaly mezi 37 a 72 % v 9 – 20 měsících v závislosti na studijních populacích. Kompletní remise (complete remission – CR) jsou vzácné. Není zřejmé, které dávkování je nejlepší, ale britské schéma s vyšší dávkou na cyklus dosáhlo vyšších ORR v historickém porovnání [70]. První randomizovaná studie specificky zaměřená na starší nemocné s CLL byla studie CLL5 srovnávající fludarabin s chlorambucilem v monoterapii u 193 neléčených pacientů starších 65 let. Zatímco fludarabin dosáhl významně vyšší ORR/ CR, nebyl prokázán rozdíl v PFS a OS [20]. Naproti tomu subanalýza britské studie CLL4 ukázala, že FC kombinace přinesla lepší ORR, CR i PFS (ne však OS) než chlorambucil ve všech skupinách, včetně pacientů ve věku ≥ 70 let. Toto bylo dosaženo za cenu vyšší myelotoxicity, ale nikoliv závažných infekcí [17].
Kombinace anti‑CD20 protilátek s CLB u „slow ‑ go“ pacientů byla zkoumána v několika studiích. Britská studie fáze II prokázala slibnou účinnost a bezpečnost kombinace chlorambucilu a rituximabu (R ‑ CLB) u 100 pacientů (tab. 2). Zásadní však byly výsledky velké randomizované studie CLL11 u 589 nemocných s významnými komorbiditami (kumulativní CIRS skóre ≥ 7 a/ nebo clearance kreatininu < 70 ml/ min), kteří byli randomizováni mezi CLB (0,5 mg/ kg v den 1 a 15, pro max. 6 cyklů), CLB + rituximab (R ‑ CLB, 375 mg/ m2 i.v. den 1 v 1. cyklu, 500 mg/ m2 den 1 v cyklech 2 – 6) a CLB + obinutuzumab (GA101), novou humanizovanou anti‑CD20 protilátku II. typu s upravenou glykosilací, vyznačující se zvýšenou přímou indukcí buněčné smrti a na protilátce závislou cytotoxicitou (G ‑ CLB, 100 mg i.v. v den 1, 900 mg v den 2, 1 000 mg dny 8 a 15 v 1. cyklu, 1 000 mg den 1 v cyklech 2 – 6). Obě kombinace byly výrazně lepší než CLB ve smyslu CR a PFS. Kromě toho u pacientů léčených G ‑ CLB v porovnání s CLB bylo dosaženo významně delšího OS (kombinace R ‑ CLB prokázala významné prodloužení OS vůči CLB při aktualizaci dat). Rozdíly v počtu CR a PFS byly také významně lepší u G ‑ CLB vs. R ‑ CLB. Nemocní léčení G ‑ CLB měli významně častější projevy závažné infuzní toxicity v porovnání s rituximabem (21 vs. 4 %) a také častější závažné neutropenie než R ‑ CLB nebo CLB (34 vs. 25 vs. 15 %); výskyt závažných infekcí byl obdobný ve všech ramenech [57]. Mezinárodní studie fáze III COMPLEMENT ‑ 1 randomizovala 447 neléčených pacientů CLL považovaných za nezpůsobilé pro léčbu FCR mezi CLB a kombinaci CLB + ofatumumab, plně humánní anti‑CD20 protilátku se zvýšenou cytotoxicitou závislou na komplementu (O ‑ CLB, 300 mg i.v. den 1 a 1 000 mg den 8 v 1. cyklu, 1 000 mg den 1 v cyklech 2 – 12, opakování à 4 týdny). Režim O ‑ CLB přinesl podstatně lepší ORR/ CR a delší PFS, ale ne OS [71]. Tabulka 2 shrnuje klíčové údaje ze studií kombinujících anti-CD20 protilátky s chlorambucilem. Na základě studií CLL11 a COMPLEMENT ‑ 1 se stala kombinace CLB a anti‑CD20 monoklonální protilátky novým standardem pro léčbu „slow ‑ go“ nemocných s CLL v 1. linii léčby. Chlorambucil v monoterapii by měl být vyhrazen pouze pro extrémně komorbidní nemocné ve špatném stavu („no ‑ go“).
Tab. 2. Srovnání klíčových dat ze studií kombinujících anti-CD20 protilátku a chlorambucil. 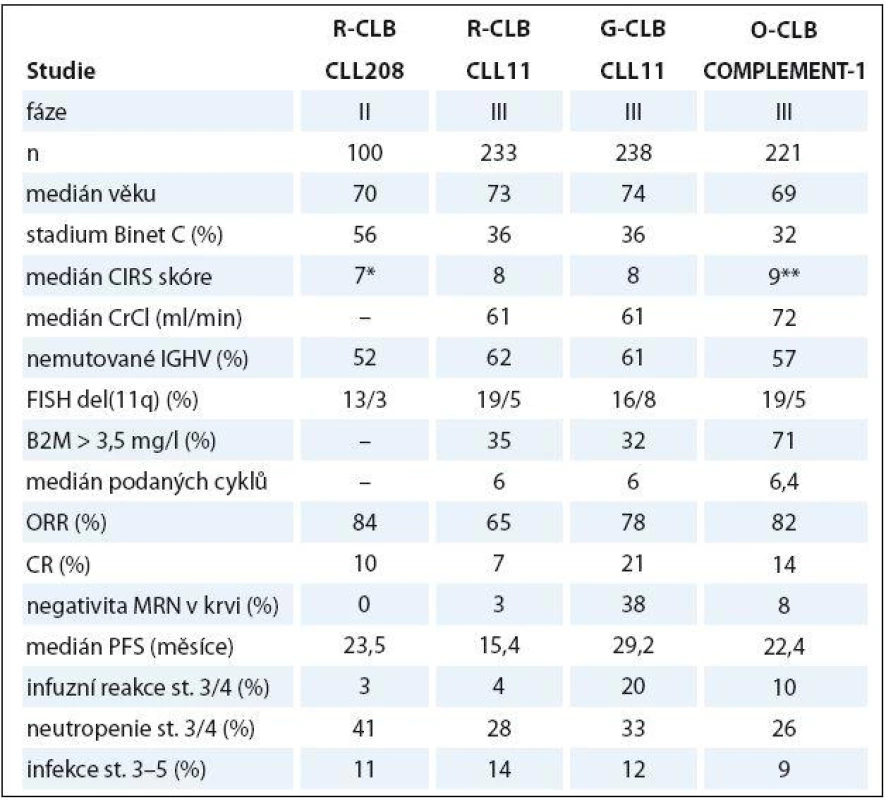
G – obinutuzumab, R – rituximab, O – ofatumumab, B2M – β2-mikroglobulin, IGHV – variabilní oblast těžkého řetězce imunoglobulinu, FISH – fl uorescenční in situ hybridizace, MRN – minimální reziduální nemoc, CrCl – clearance kreatininu, PB – periferní krev, PFS – přežití bez progrese *počet komorbidit, **včetně 4 bodů za CLL u každého nemocného Bendamustin je bifunkční cytostatikum s kombinovanými vlastnostmi alkylační látky a purinového analoga. Randomizovaná studie fáze III léčila v rámci 1. linie 305 nemocných s CLL bendamustinem (100 mg/ m2 i.v. dny 1 – 2 cyklu, opakování à 4 týdny) vs. chlorambucilem (0,8 mg/ kg dny 1 a 15). Bendamustin prokázal významně lepší ORR/ CR (68/ 30 vs. 39/ 2 %) i PFS (21,7 vs. 9,3 měsíce) [21]. Na základě těchto výsledků byl bendamustin schválen pro 1. linii léčby nemocných s CLL nevhodných k režimu FCR navzdory skutečnosti, že průměrný věk ve studii byl poměrně nízký (63 vs. 63,6 let) a nebylo prováděno posouzení komorbidit. Bendamustin byl úspěšně použit v kombinaci s rituximabem ve studii fáze II. Celkem 117 pacientů s mediánem věku 64 roků obdrželo bendamustin (90 mg/ m2 i.v. dny 1 – 2 cyklu, opakování à 4 týdny) plus rituximab do šesti cyklů. Bylo dosaženo ORR/ CR v 88 a 23 %; medián přežití bez události byl 27 měsíců; závažná neutropenie a infekce se vyvinuly až u 20 a 8 % [72]. V současné době jsou s velkým napětím očekávány výsledky francouzské studie MaBLe porovnávající režim BR s kombinací R ‑ CLB.
Jak již bylo uvedeno dříve, použití plnodávkovaných fludarabinových režimů u starších nemocných může být spojeno s nepřijatelně vysokým výskytem myelotoxicity a/ nebo závažných infekcí [29,30]. Logický postup s cílem snížit toxicitu a zachovat léčebnou účinnost je snížení dávek fludarabinu a cyklofosfamidu. Několik pilotních studií publikovalo slibnou účinnost a přijatelnou toxicitu nízkodávkovaného režimu FC [73,74]. Účinnost a bezpečnost nízkých dávek FCR byla posuzována v rámci projektu „Q‑lite“ České skupiny pro CLL. V rámci 1. linie bylo léčeno 108 neléčených nemocných s CLL/ SLL. Dávky fludarabinu byly sníženy na 50 % (12 mg/ m2 i.v. nebo 20 mg/ m2 p.o.) a cyklofosfamidu na 60 % (150 mg/ m2 i.v. nebo p.o. den 1 – 3 cyklu). Rituximab byl podán v klasické dávce pro CLL. ORR/ CR (včetně klinické CR a CRi) bylo dosaženo v 81 a 37 %. Medián PFS byl 28 měsíců a mediánu OS nebylo dosaženo. Toxicita byla přijatelná (závažná neutropenie 56 %, avšak těžké infekce v 15 %) [75]. Australská studie OFOCIR randomizovala 120 neléčených pacientů s CLL ve věku ≥ 65 let s CIRS skóre ≤ 6 mezi plnodávkovaný FCR, kombinaci fludarabin + rituximab a nízkodávkovaný FCR (fludarabin 24 mg/ m2 a cyklofosfamid 150 mg/ m2 p.o. v den 1 – 3, rituximab ve standardní dávce). ORR byla obdobná ve všech ramenech, (FCR, FR a low‑dose FCR 97, 95 a 95 %), ale počet CR byl nejvyšší u plnodávkovaného FCR (79, 38 a 51 %). V 18 měsících byla PFS a OS srovnatelná [76]. Tabulka 3 shrnuje nejdůležitější data studií Q‑lite a OFOCIR. Nízkodávkovaný režim FCR se ukazuje být další možností léčby pro starší/ komorbidní nemocné s CLL; je však zapotřebí dalších studií, ideálně randomizovaných vůči chemoimunoterapii na bázi chlorambucilu.
Tab. 3. Účinnost a bezpečnost nízkodávkovaného FCR u starších/komorbidních nemocných s CLL. 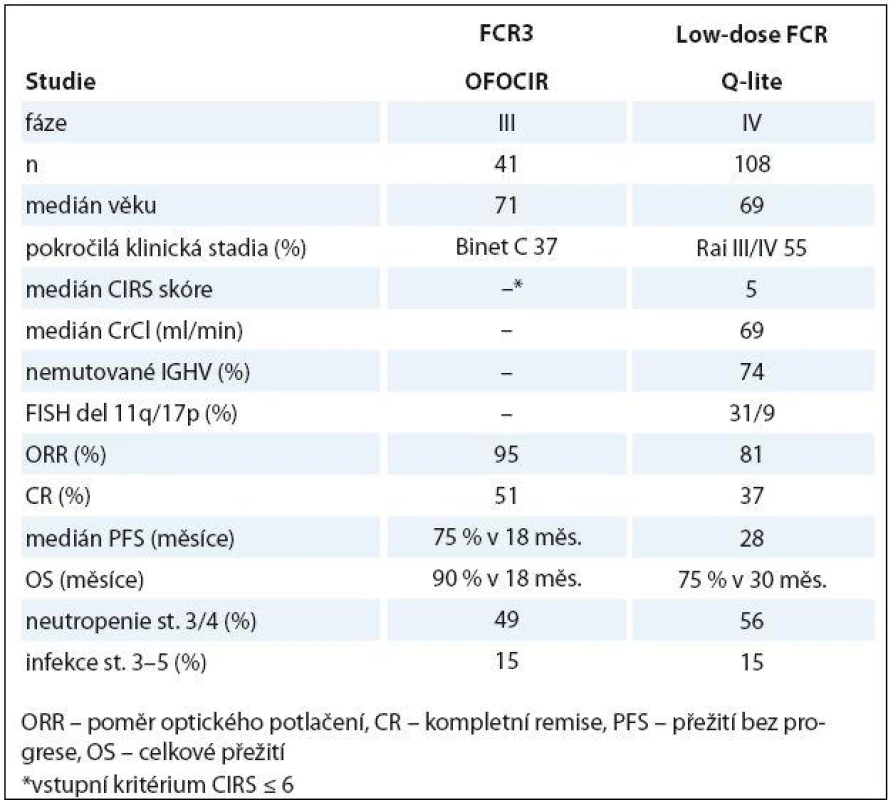
ORR – poměr optického potlačení, CR – kompletní remise, PFS – přežití bez progrese, OS – celkové přežití *vstupní kritérium CIRS ≤ 6 Léčba relapsu/ refrakterní CLL
Dle současných mezinárodních doporučení [48] je možno v případě relapsu CLL opakovat předchozí linii léčby, pokud bylo dosaženo dostatečně dlouhého trvání léčebné odpovědi (≥ 12 měsíců při použití monoterapie, např. chlorambucil či fludarabin, ≥ 24 měsíců v případě kombinovaných režimů, např. FCR). Nemocné s kratším PFS je nutno léčit jako refrakterní CLL a léčebný přístup tedy změnit. Léčba pacientů s refrakterní CLL (nedosažení léčebné odpovědi či relaps do šesti měsíců od dokončení léčby) představuje extrémně náročný úkol, protože tito pacienti se vyznačují častým výskytem chemorezistence, oportunních infekcí a zhoršujícím se celkovým stavem [77]. Navíc je bohužel velmi málo dat týkajících se specificky „slow ‑ go“ nemocných. Humanizovaná monoklonální anti‑CD52 protilátka alemtuzumab může být použita u fludarabin‑refrakterních nemocných, zejména při masivní infiltraci kostní dřeně. ORR lze očekávat kolem 30 – 40 %, ale léčebná odpověď obvykle trvá méně než 12 měsíců, účinnost v případě objemné lymfadenopatie je nízká a vzrůstá riziko oportunních infekcí [78,79]. Nemocní s tzv. dvojitě‑refrakterní CLL (tj. na fludarabin i alemtuzumab) mají extrémně nepříznivou prognózu [80]. Ofatumumab je jediný preparát schválený pro léčbu těchto nemocných, a to na základě studie fáze II, ve které bylo léčeno 95 dvojitě refrakterních nemocných (průměrný věk 64 let, medián předchozích linií 5). Léčba se skládala z osmi týdenních (1 × 300 mg + 7 × 2 000 mg) a následně čtyř měsíčních i.v. infuzí (2 000 mg). ORR (hodnocené po osmi týdnech léčby) bylo dosaženo v 51 %, medián PFS činil 5,5 měsíce a medián OS 14,2 měsíce. Infuzní reakce se vyskytly u 63 % nemocných, většina však stupně I/ II; těžké infekce byly pozorovány u 24 % [81]. Zkušenost s režimem bendamustin + rituximab (BR) byla publikována u 78 nemocných (medián věku 66,5 roku, 28 % fludarabin‑refrakterní). Bendamustin byl podáván v dávce 70 mg/ m2 i.v. den 1 – 2, à 4 týdny). Bylo dosaženo ORR/ CR v 59 a 9 % včetně 46 % u fludarabin‑refrakterních, ale pouze u 7 % nemocných s del 17p. Medián PFS a OS činily 15 a 34 měsíců; k závažné neutropenii a infekcím došlo v 23 a 13 % [82]. Kombinace vysoké dávky kortikosteroidů s monoklonálními protilátkami je další možností léčby relabující/ refrakterní CLL. Použití extrémně vysokých dávek metylprednisolonu (1 g/ m2 i.v. den 1 – 5) v kombinaci s rituximabem se ukázalo účinné, ale dosti toxické (steroidní diabetes, těžké infekce až u 50 % nemocných, časná úmrtí na léčbě) v pilotních studií [83,84]. Nedávná unicentrická retrospektivní studie hodnotila nižší dávky kortikosteroidů (dexametazon 40 mg p.o. ve dny 1 – 4 ± 10 – 13, klasická dávka rituximabu, opakování à 3 týdny) u 60 nemocných s relabující/ refrakterní CLL (medián věku 66 roků, medián předchozí terapie 2; 50 % fludarabin‑refrakterní). ORR/ CR bylo dosaženo v 73 a 5 % s mediánem PFS a OS 8 a 26 měsíců. Závažné infekce byly zaznamenány u 27 % nemocných [85]. Výše uvedené léčebné přístupy jsou poměrně dobře využitelné i u starších/ komorbidních nemocných s relabující/ refrakterní CLL, společným jmenovatelem však je krátké trvání léčebné odpovědi.
Nové léky
Dva nové preparáty interferující se signálními drahami B buněčného receptoru přinesly zásadní průlom v léčbě relabující/ refrakterní CLL. Ibrutinib je perorálně dostupný kovalentní inhibitor Brutonovy tyrozinkinázy, což způsobuje narušení komunikace maligních lymfocytů s výhodným mikroprostředím mízních uzlin a snížení jejich proliferace. Ve studii fáze IB/ II byla použita monoterapie ibrutinibem v dávce 840 mg (n = 34) či 420 mg (n = 51) v dlouhodobém podávání do progrese či nepřijatelné toxicity u 85 nemocných (medián věku 66 let) s těžce předléčenou (medián 4 předchozí linie). ORR/ CR byly dosaženy v 71 a 2 %; dalších 20 a 15 pacientů mělo tzv. částečnou odpověď s lymfocytózou, typickým projevem léčby ibrutinibem způsobeným redistribucí CLL buněk z lymfatických uzlin do periferní krve. PFS a OS ve 26 měsících byly 75 a 83 %. Průjem byl nejčastější nežádoucí účinek (49 %, ale pouze 2 % stupně 3/4). Těžká neutropenie a infekce byly pozorovány u 15 a 41 %. U 7 z 11 pacientů s progresí byla zjištěna Richterova transformace [86]. V následné randomizované studii fáze III prokázal ibrutinib v dávce 420 mg vyšší účinnost v porovnání s ofatumumabem z hlediska ORR, PFS i OS. Závažné nežádoucí příhody byly častější v rameni s ibrutinibem, včetně průjmu (4 vs. 0 %) a fibrilace síní (3 vs. 0 %). Krvácivé komplikace byly také častější u ibrutinibu (celkem 44 vs. 12 %), ale významné krvácivé příhody byly vzácné a srovnatelné mezi oběma rameny (1 vs. 2 %) [87].
Idelalisib je perorálně dostupný inhibitor fosfatidylinositol 3 - kinázy (PI3K) δ, čímž narušuje interakci CLL buněk s mikroprostředím, což vede ke snížené přežití leukemických lymfocytů. Po slibných výsledcích studie fáze I u těžce předléčených nemocných s CLL [88] byl idelalisib hodnocen v randomizované, dvojitě zaslepené, placebem kontrolované studii fáze III v kombinaci s rituximabem vs. kombinaci rituximab + placebo u starších pacientů s relabující/ refrakterní CLL považovaných za nevhodné k chemoterapii. Dávka idelalisibu byla 150 mg 2krát denně až do progrese či nepřijatelné toxicity; rituximab byl použit v neobvyklém režimu (pět infuzí à 2 týdny + tři infuze à 4 týdny, celkem tedy osm dávek). Kombinace idelalisib + rituximab kombinace dosáhla vyšší ORR, delšího PFS i OS. Obdobně jako u ibrutinibu bylo pozorováno nové spektrum nežádoucích účinků: průjem/ kolitida v 19 % (závažné v 5 %), zvýšení transamináz v 35 % (stupně 3/4 v 5 %); a poléková pneumonitida ve 4 % [89]. Výsledky ibrutinibu a idelalisibu ve studiích fáze III jsou shrnuty v tab. 4.
Tab. 4. Porovnání stěžejních dat ibrutinibu a idelalisibu v léčbě relapsu/refrakterní CLL. 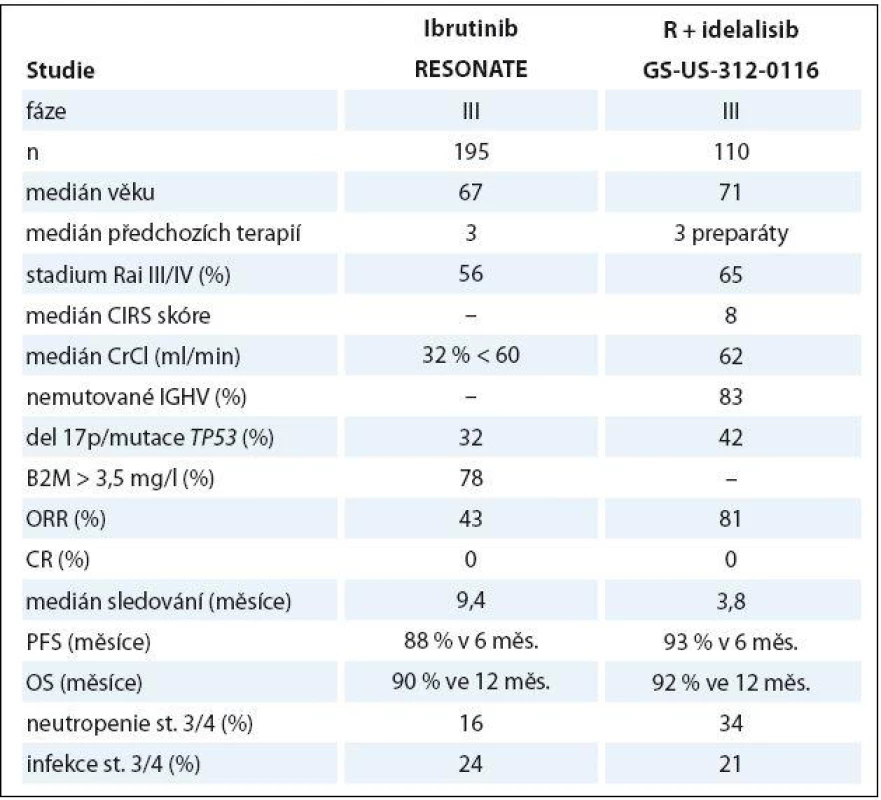
ORR – poměr optického potlačení, CR – kompletní remise, PFS – přežití bez progrese, OS – celkové přežití Závěr
Léčba starších/ komorbidních („slow ‑ go“) nemocných s CLL se až v nedávné době dostala do centra pozornosti odborníků a farmaceutických společností. Pro ideální volbu cílů léčby a léčebné intenzity je nesmírně důležitá snaha co nejpřesněji zhodnotit celkový stav, funkční zdatnost a přidružená onemocnění. Kombinace chlorambucilu s anti‑CD20 protilátkami (obinutuzumab, rituximab a ofatumumab) se stala novým standardem pro 1. linii léčby těchto nemocných. Kombinace bendamustinu s rituximabem či ofatumumabem nebo nízkodávkovaný FCR mohou být užitečné u vybraných nemocných. Situace u relabující/ refrakterní CLL je dosti nepřehledná vzhledem k nedostatku specifických studií pro „slow ‑ go“ nemocné. Možnosti léčby v této indikaci zahrnují alemtuzumab, ofatumumab, vysokodávkované kortikoidy v kombinaci s anti‑CD20 protilátkou či režim bendamustin + rituximab. Zásadní změnu pro léčbu relabující/ refrakterní CLL znamená příchod nových selektivních inhibitorů – ibrutinibu a idelalisibu. Tyto perorální preparáty podávané revolučním způsobem (dlouhodobě do progrese či nepřijatelné toxicity) dosáhly výsledků PFS a OS dříve nemyslitelných u konvenčních postupů. Vzhledem k velmi krátkému období sledování a odlišnému profilu závažné toxicity (krvácení a fibrilace síní u ibrutinibu, kolitidy, zvýšení transamináz a pneumonitidy u idelalisibu), jsou nutné další, dlouhodobé údaje o účinnosti a bezpečnosti, aby bylo možno ibrutinib a idelalisib optimálním způsobem zařadit do stávajících léčebných algoritmů. Velmi nízké počty celkových léčebných odpovědí však již nyní ukazují, že léčba těmito preparáty v monoterapii či v kombinaci se samotnými monoklonálními protilátkami nemá kurativní potenciál. Je též nutno vzít v úvahu vysokou finanční náročnost léčby těmito preparáty. Řada klinických studií v současnosti zkoumá ibrutinib a idelalisib v kombinaci s chemoimunoterapií i další cílené léky, které by mohly být vhodné pro starší/ komorbidní nemocné (tab. 5) [90]. Díky tomu můžeme do budoucna očekávat další zlepšení léčebných výsledků u „slow ‑ go“ nemocných s CLL ve smyslu prodloužení období do progrese i celkového přežití pomocí kombinací nových léků s klasickými preparáty či dokonce kombinacemi cílených léků zcela bez chemoterapie.
Tab. 5. Nové léky ve vývoji pro relabovanou/refrakterní CLL. 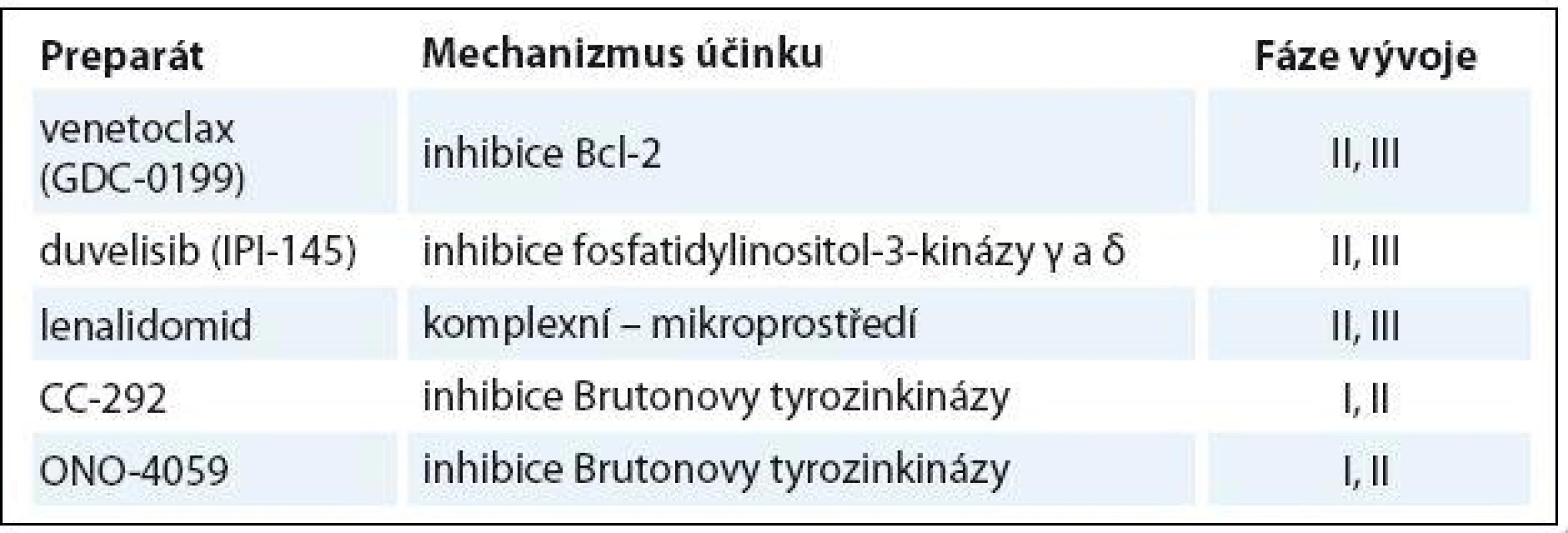
Tato práce byla podpořena grantem IGA MZČR NT13412-4/2012, RVO MZ ČR (FNHK, 00179906) a programem PRVOUK P37/08.
Prohlašuji, že v souvislosti s výše uvedeným příspěvkem, jehož jsem autorem, mám střet zájmů s níže vypsanými společnostmi: Roche, Janssen-Cilag, Gilead a GlaxoSmithKline (honoraria za přednáškovou činnost či konzultace, cestovní granty).
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Lukáš Smolej, Ph.D.
IV. interní hematologická klinika
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: lukas.smolej@fnhk.cz
Obdrženo: 23. 7. 2015
Přijato: 29. 7. 2015
Zdroje
1. Dores GM, Anderson WF, Curtis RE et al. Chronic lymphocytic leukaemia and small lymphocytic lymphoma: overview of the descriptive epidemiology. Br J Haematol 2007; 139(5): 809 – 819.
2. Linet MS, Schubauer ‑ Berigan MK, Weisenburger DD et al. Chronic lymphocytic leukaemia: an overview of aetiology in light of recent developments in classification and pathogenesis. Br J Haematol 2007; 139(5): 672 – 686.
3. Pfeil AM, Imfeld P, Pettengell R et al. Trends in incidence and medical resource utilisation in patients with chronic lymphocytic leukaemia: insights from the UK Clinical Practice Research Datalink (CPRD). Ann Hematol 2015; 94(3): 421 – 429. doi: 10.1007/ s00277 ‑ 014 ‑ 2217 ‑ 7.
4. Rai KR, Sawitsky A, Cronkite EP et al. Clinical staging of chronic lymphocytic leukemia. Blood 1975; 46(2): 219 – 234.
5. Binet JL, Auquier A, Dighiero G et al. A new prognostic classification of chronic lymphocytic leukemia derived from a multivariate survival analysis. Cancer 1981; 48(1): 198 – 206.
6. Abrisqueta P, Pereira A, Rozman C et al. Improving survival in patients with chronic lymphocytic leukemia (1980 – 2008): the Hospital Clinic of Barcelona experience. Blood 2009; 114(10): 2044 – 2050. doi: 10.1182/ blood ‑ 2009 ‑ 04 ‑ 214346.
7. Panovska A, Doubek M, Brychtova Y et al. Chronic lymphocytic leukemia and focusing on epidemiology and management in everyday hematologic practice: recent data from the Czech Leukemia Study Group for Life (CELL). Clin Lymphoma Myeloma Leuk 2010; 10(4): 297 – 300. doi: 10.3816/ CLML.2010.n.061.
8. Dreger P, Corradini P, Kimby E et al. Indications for allogeneic stem cell transplantation in chronic lymphocytic leukemia: the EBMT transplant consensus. Leukemia 2007; 21(1): 12 – 17.
9. Dreger P, Schetelig J, Andersen N et al. Managing high‑risk CLL during transition to a new treatment era: stem cell transplantation or novel agents? Blood 2014; 124(26): 3841 – 3849. doi: 10.1182/ blood ‑ 2014 ‑ 07 ‑ 586826.
10. Hallek M, Fischer K, Fingerle ‑ Rowson G et al. Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: a randomized, open ‑ label, phase 3 trial. Lancet 2010; 376(9747): 1164 – 1174. doi: 10.1016/ S0140 ‑ 6736(10)61381 ‑ 5.
11. Diehl LF, Karnell LH, Menck HR. The American College of Surgeons Commission on Cancer and the American Cancer Society. The National Cancer Data Base report on age, gender, treatment, and outcomes of patients with chronic lymphocytic leukemia. Cancer 1999; 86(12): 2684 – 2692.
12. Molica S, Levato D. What is changing in the natural history of chronic lymphocytic leukemia? Haematologica 2001; 86(1): 8 – 12.
13. Robak T, Dmoszynska A, Solal ‑ Celigny P et al. Rituximab plus fludarabine and cyclophosphamide prolongs progression‑free survival compared with fludarabine and cyclophosphamide alone in previously treated chronic lymphocytic leukemia. J Clin Oncol 2010; 28(10): 1756 – 1765. doi: 10.1200/ JCO.2009.26.4556.
14. Mabed M, Aref S, Fouda M et al. Chlorambucil plus theophylline vs chlorambucil alone as a front line therapy for B ‑ cell chronic lymphatic leukemia. Leuk Lymphoma 2004; 45(10): 2029 – 2035.
15. Eichhorst BF, Busch R, Hopfinger G et al. Fludarabine plus cyclophosphamide versus fludarabine alone in first‑line therapy of younger patients with chronic lymphocytic leukemia. Blood 2006; 107(3): 885 – 891.
16. Robak T, Blonski JZ, Gora ‑ Tybor J et al. Cladribine alone and in combination with cyclophosphamide or cyclophosphamide plus mitoxantrone in the treatment of progressive chronic lymphocytic leukemia: report of a prospective, multicenter, randomized trial of the Polish Adult Leukemia Group (PALG CLL2). Blood 2006; 108(2): 473 – 479.
17. Catovsky D. Assessment of fludarabine plus cyclophosphamide for patients with chronic lymphocytic leukaemia (the LRF CLL4 Trial): a randomised controlled trial. Lancet 2007; 370(9583): 230 – 239.
18. Flinn IW. Phase III trial of fludarabine plus cyclophosphamide compared with fludarabine for patients with previously untreated chronic lymphocytic leukemia: US Intergroup Trial E2997. J Clin Oncol 2007; 25(7): 793 – 798.
19. Hillmen P, Skotnicki AB, Robak T et al. Alemtuzumab compared with chlorambucil as first‑line therapy for chronic lymphocytic leukemia. J Clin Oncol 2007; 25(35): 5616 – 5623.
20. Eichhorst BF, Busch R, Stilgenbauer S et al. First‑line therapy with fludarabine compared with chlorambucil does not result in a major benefit for elderly patients with advanced chronic lymphocytic leukemia. Blood 2009; 114(16): 3382 – 3391. doi: 10.1182/ blood ‑ 2009 ‑ 02 ‑ 206185.
21. Knauf WU, Lissichkov T, Aldaoud A et al. Phase III randomized study of bendamustine compared with chlorambucil in previously untreated patients with chronic lymphocytic leukemia. J Clin Oncol 2009; 27(26): 4378 – 4384. doi: 10.1200/ JCO.2008.20.8389.
22. O‘Brien S, Moore JO, Boyd TE et al. 5‑year survival in patients with relapsed or refractory chronic lymphocytic leukemia in a randomized, phase III trial of fludarabine plus cyclophosphamide with or without oblimersen. J Clin Oncol 2009; 27(31): 5208 – 5212. doi: 10.1200/ JCO.2009.22.5748.
23. Robak T, Jamroziak K, Gora ‑ Tybor J et al. Comparison of cladribine plus cyclophosphamide with fludarabine plus cyclophosphamide as first‑line therapy for chronic lymphocytic leukemia: a phase III randomized study by the Polish Adult Leukemia Group (PALG ‑ CLL3 Study). J Clin Oncol 2010; 28(11): 1863 – 1869. doi: 10.1200/ JCO.2009.25.9630.
24. Sutton L, Chevret S, Tournilhac O et al. Autologous stem cell transplantation as a first‑line treatment strategy for chronic lymphocytic leukemia: a multicenter, randomized, controlled trial from the SFGM ‑ TC and GFLLC. Blood 2011; 117(23): 6109 – 6119. doi: 10.1182/ blood ‑ 2010 ‑ 11 ‑ 317073.
25. Elter T, Gercheva ‑ Kyuchukova L, Pylylpenko H et al. Fludarabine plus alemtuzumab versus fludarabine alone in patients with previously treated chronic lymphocytic leukaemia: a randomised phase 3 trial. Lancet Oncol 2011; 12(13): 1204 – 1213. doi: 10.1016/ S1470 ‑ 2045(11)70242 ‑ X.
26. Reynolds C, Di Bella N, Lyons RM et al. A Phase III trial of fludarabine, cyclophosphamide, and rituximab vs. pentostatin, cyclophosphamide, and rituximab in B ‑ cell chronic lymphocytic leukemia. Invest New Drugs 2012; 30(3): 1232 – 1240. doi: 10.1007/ s10637 ‑ 011 ‑ 9737 ‑ y.
27. Lepretre S, Aurran T, Mahé B et al. Excess mortality after treatment with fludarabine and cyclophosphamide in combination with alemtuzumab in previously untreated patients with chronic lymphocytic leukemia in a randomized phase 3 trial. Blood 2012; 119(22): 5104 – 5110. doi: 10.1182/ blood ‑ 2011 ‑ 07 ‑ 365437.
28. Niederle N, Megdenberg D, Balleisen L et al. Bendamustine compared to fludarabine as second‑line treatment in chronic lymphocytic leukemia. Ann Hematol 2013; 92(5): 653 – 660. doi: 10.1007/ s00277 ‑ 012 ‑ 1660 ‑ 6.
29. Shvidel L, Shtalrid M, Bairey O et al. Conventional dose fludarabine‑based regimens are effective but have excessive toxicity in elderly patients with refractory chronic lymphocytic leukemia. Leuk Lymphoma 2003; 44(11): 1947 – 1950.
30. Ferrajoli A, O’Brien S, Wierda W et al. Treatment of patients with CLL 70 years old and older: a single center experience of 142 patients. Leuk Lymphoma 2005; 46 (Suppl 1): S86: abstr. P95.
31. Wierda WG, O‘Brien S, Wang X et al. Prognostic nomogram and index for overall survival in previously untreated patients with chronic lymphocytic leukemia. Blood 2007; 109(11): 4679 – 4985.
32. Thurmes P, Call T, Slager S et al. Comorbid conditions and survival in unselected, newly diagnosed patients with chronic lymphocytic leukemia. Leuk Lymphoma 2008; 49(1): 49 – 56. doi: 10.1080/ 10428190701724785.
33. Wierda WG, O‘Brien S, Wang X et al. Characteristics associated with important clinical end points in patients with chronic lymphocytic leukemia at initial treatment. J Clin Oncol 2009; 27(10): 1637 – 1643. doi: 10.1200/ JCO.2008.18.1701.
34. Shanafelt TD, Jenkins G, Call TG et al. Validation of a new prognostic index for patients with chronic lymphocytic leukemia. Cancer 2009; 115(2): 363 – 372. doi: 10.1002/ cncr.24004.
35. Pflug N, Bahlo J, Shanafelt TD et al. Development of a comprehensive prognostic index for patients with chronic lymphocytic leukemia. Blood 2014; 124(1): 49 – 62. doi: 10.1182/ blood ‑ 2014 ‑ 02 ‑ 556399.
36. Goede V, Cramer P, Busch R et al. Interactions between comorbidity and treatment of chronic lymphocytic leukemia: results of German Chronic Lymphocytic Leukemia Study Group trials. Haematologica 2014; 99(6): 1095 – 1100. doi: 10.3324/ haematol.2013.096792.
37. Lindeman RD. Changes in renal function with aging. Implications for treatment. Drugs Aging 1992; 2(5): 423 – 431.
38. Fliser D. Ren sanus in corpore sano: the myth of the inexorable decline of renal function with senescence. Nephrol Dial Transplant 2005; 20(3): 482 – 485.
39. Presta P, Lucisano G, Fuiano L et al. The kidney and the elderly: why does the risk increase? Int Urol Nephrol 2012; 44(2): 625 – 632. doi: 10.1007/ s11255 ‑ 011 ‑ 0063 ‑ 2.
40. Plunkett W, Gandhi V, Huang P et al. Fludarabine: pharmacokinetics, mechanisms of action, and rationales for combination therapies. Semin Oncol 1993; 20 (5 Suppl 7):2 – 12.
41. Moore MJ. Clinical pharmacokinetics of cyclophosphamide. Clin Pharmacokinet 1991; 20(3): 194 – 208.
42. Cockcroft DW, Gault MH. Prediction of creatinine clearance from serum creatinine. Nephron 1976; 16(1): 31 – 41.
43. Martell RE, Peterson BL, Cohen HJ et al. Analysis of age, estimated creatinine clearance and pretreatment hematologic parameters as predictors of fludarabine toxicity in patients treated for chronic lymphocytic leukemia: a CALGB (9011) coordinated intergroup study. Cancer Chemother Pharmacol 2002; 50(1): 37 – 45.
44. Piccirillo JF, Tierney RM, Costas I et al. Prognostic importance of comorbidity in a hospital‑based cancer registry. JAMA 2004; 291(20): 2441 – 2447.
45. Janssen ‑ Heijnen ML, van Spronsen DJ, Lemmens VE et al. A population‑based study of severity of comorbidity among patients with non‑Hodgkin‘s lymphoma: prognostic impact independent of International Prognostic Index. Br J Haematol 2005; 129(5): 597 – 606.
46. Kobayashi Y, Miura K, Hojo A et al. Charlson Comorbidity Index is an independent prognostic factor among elderly patients with diffuse large B ‑ cell lymphoma. J Cancer Res Clin Oncol 2011; 137(7): 1079 – 1084. doi: 10.1007/ s00432 ‑ 010 ‑ 0973 ‑ x.
47. Wieringa A, Boslooper K, Hoogendoorn M et al. Comorbidity is an independent prognostic factor in patients with advanced‑stage diffuse large B ‑ cell lymphoma treated with R ‑ CHOP: a population‑based cohort study. Br J Haematol 2014; 165(4): 489 – 496. doi: 10.1111/ bjh.12765.
48. Hallek M, Cheson BD, Catovsky D et al. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute ‑ Working Group 1996 guidelines. Blood 2008; 111(12): 5446 – 5456. doi: 10.1182/ blood ‑ 2007 ‑ 06 ‑ 093906.
49. Cheson BD, Bennett JM, Grever M et al. National Cancer Institute ‑ sponsored Working Group guidelines for chronic lymphocytic leukemia: revised guidelines for diag-nosis and treatment. Blood 1996; 87(12): 4990 – 4997.
50. Cramer P, Hallek M. Prognostic factors in chronic lymphocytic leukemia ‑ what do we need to know? Nat Rev Clin Oncol 2011; 8(1): 38 – 47. doi: 10.1038/ nrclinonc.2010.167.
51. Extermann M, Hurria A. Comprehensive geriatric assessment for older patients with cancer. J Clin Oncol 2007; 25(14): 1824 – 1831.
52. Linn BS, Linn MW, Gurel L. Cumulative illness rating scale. J Am Geriatr Soc 1968; 16(5): 622 – 626.
53. Parmelee PA, Thuras PD, Katz IR et al. Validation of the Cumulative Illness Rating Scale in a geriatric residential population. J Am Geriatr Soc 1995; 43(2): 130 – 137.
54. Extermann M, Overcash J, Lyman GH et al. Comorbidity and functional status are independent in older cancer patients. J Clin Oncol 1998; 16(4): 1582 – 1587.
55. Wedding U, Rohrig B, Klippstein A et al. Age, severe comorbidity and functional impairment independently contribute to poor survival in cancer patients. J Cancer Res Clin Oncol 2007; 133(12): 945 – 950.
56. Nabhan C, Smith SM, Helenowski I et al. Analysis of very elderly (≥80 years) non‑hodgkin lymphoma: impact of functional status and co ‑ morbidities on outcome. Br J Haematol 2012; 156(2): 196 – 204. doi: 10.1111/ j.1365 ‑ 2141.2011.08934.x.
57. Goede V, Fischer K, Busch R et al. Obinutuzumab plus chlorambucil in patients with CLL and coexisting conditions. N Engl J Med 2014; 370(12): 1101 – 1110. doi: 10.1056/ NEJMoa1313984.
58. Charlson ME, Pompei P, Ales KL, MacKenzie CR. A new method of classifying prognostic comorbidity in longitudinal studies: development and validation. J Chronic Dis 1987; 40(5): 373 – 383.
59. Sarfati D. Review of methods used to measure comorbidity in cancer populations: no gold standard exists. J Clin Epidemiol 2012; 65(9): 924 – 933. doi: 10.1016/ j.jclinepi.2012.02.017.
60. Lin TL, Kuo MC, Shih LY et al. The impact of age, Charlson comorbidity index, and performance status on treatment of elderly patients with diffuse large B cell lymphoma. Ann Hematol 2012; 91(9): 1383 – 1391. doi: 10.1007/ s00277 ‑ 012 ‑ 1463 ‑ 9.
61. Holzner B, Kemmler G, Kopp M et al. Quality of life of patients with chronic lymphocytic leukemia: results of a longitudinal investigation over 1 yr. Eur J Haematol 2004; 72(6): 381 – 389.
62. Else M, Smith AG, Cocks K et al. Patients‘ experience of chronic lymphocytic leukaemia: baseline health‑related quality of life results from the LRF CLL4 trial. Br J Haematol 2008; 143(5): 690 – 697. doi: 10.1111/ j.1365 ‑ 2141.2008.07407.x.
63. Shanafelt TD, Bowen D, Venkat C et al. Quality of life in chronic lymphocytic leukemia: an international survey of 1482 patients. Br J Haematol 2007; 139(2): 255 – 264.
64. Eichhorst BF, Busch R, Obwandner T et al. Health‑related quality of life in younger patients with chronic lymphocytic leukemia treated with fludarabine plus cyclophosphamide or fludarabine alone for first‑line therapy: a study by the German CLL Study Group. J Clin Oncol 2007; 25(13): 1722 – 1731.
65. Else M, Cocks K, Crofts S et al. Quality of life in chronic lymphocytic leukemia: 5‑year results from the multicenter randomized LRF CLL4 trial. Leuk Lymphoma 2012; 53(7): 1289 – 1298. doi: 10.3109/ 10428194.2011.649479.
66. Pashos CL, Flowers CR, Kay NE et al. Association of health‑related quality of life with gender in patients with B ‑ cell chronic lymphocytic leukemia. Support Care Cancer 2013; 21(10): 2853 – 2860. doi: 10.1007/ s00520 ‑ 013 ‑ 1854 ‑ z.
67. van den Broek EC, Oerlemans S, Nijziel MR et al. Impact of active surveillance, chlorambucil, and other therapy on health‑related quality of life in patients with CLL/ SLL in the Netherlands. Ann Hematol 2015; 94(1): 45 – 56. doi: 10.1007/ s00277 ‑ 014 ‑ 2161 ‑ 6.
68. Altman SJ, Haut A, Cartwright GE et al. Early experience with p ‑ (N, N ‑ di ‑ 2 - chloroethyl)-aminophenylbutyric acid (CB 1348), a new chemotherapeutic agent effective in the treatment of chronic lymphocytic leukemia. Cancer 1956; 9(3): 512 – 517.
69. Hillmen P, Gribben JG, Follows GA et al. Rituximab plus chlorambucil as first‑line treatment for chronic lymphocytic leukemia: Final analysis of an open ‑ label phase II study. J Clin Oncol 2014; 32(12): 1236 – 1241. doi: 10.1200/ JCO.2013.49.6547.
70. Catovsky D, Else M, Richards S. Chlorambucil – still not bad: a reappraisal. Clin Lymphoma Myeloma Leuk 2011; 11 (Suppl 1): S2 – S6. doi: 10.1016/ j.clml.2011.02.006.
71. Hillmen P, Robat T, Janssens A et al. Ofatumumab + chlorambucil versus chlorambucil alone in patients with untreated chronic lymphocytic leukemia (CLL): results of the phase III Study Complement 1 (OMB110911). ASH Annual Meeting abstracts. Blood 2013; 122(21): 528.
72. Fischer K, Cramer P, Busch R et al. Bendamustine in combination with rituximab for previously untreated patients with chronic lymphocytic leukemia: a multicenter phase ii trial of the German Chronic Lymphocytic Leukemia Study Group. J Clin Oncol 2012; 30(26): 3209 – 3216. doi: 10.1200/ JCO.2011.39.2688.
73. Marotta G, Bigazzi C, Lenoci M et al. Low‑dose fludarabine and cyclophosphamide in elderly patients with B ‑ cell chronic lymphocytic leukemia refractory to conventional therapy. Haematologica 2000; 85(12): 1268 – 1270.
74. Forconi F, Fabbri A, Lenoci M et al. Low‑dose oral fludarabine plus cyclophosphamide in elderly patients with untreated and relapsed or refractory chronic lymphocytic. Leukaemia Hematol Oncol 2008; 26(4): 247 – 251. doi: 10.1002/ hon.868.
75. Smolej L, Brychtova Y, Doubek M et al. Low‑dose FCR is a safe and effective treatment option for elderly/ comorbid patients with chronic lymphocytic leukemia/ small lymphocytic lymphoma. Updated Results of Project Q ‑ Lite By Czech CLL Study Group. ASH Annual Meeting Abstracts. Blood 2014; 124(21): 4670.
76. Mulligan SP, Gill D, Turner P et al. A Randomised dose De ‑ Escalation Study of oral fludarabine ± oral cyclophosphamide and intravenous rituximab as first‑line therapy of fit patients with chronic lymphocytic leukaemia (CLL) aged ≥65 years: final analysis of response and toxicity. ASH Annual Meeting Abstracts. Blood 2014; 124(21): 3325.
77. Keating MJ, O‘Brien S, Kontoyiannis D et al. Results of first salvage therapy for patients refractory to a fludarabine regimen in chronic lymphocytic leukemia. Leuk Lymphoma 2002; 43(9): 1755 – 1762.
78. Keating MJ. Therapeutic role of alemtuzumab (Campath ‑ 1H) in patients who have failed fludarabine: results of a large international study. Blood 2002; 99(10): 3554 – 3561.
79. Fiegl M, Stauder R, Steurer M et al. Alemtuzumab in chronic lymphocytic leukemia: final results of a large observational multicenter study in mostly pretreated patients. Ann Hematol 2014; 93(2): 267 – 277. doi: 10.1007/ s00277 ‑ 013 ‑ 1966 ‑ z.
80. Tam CS, O‘Brien S, Lerner S et al. The natural history of fludarabine ‑ refractory chronic lymphocytic leukemia patients who fail alemtuzumab or have bulky lymphadenopathy. Leuk Lymphoma 2007; 48(10): 1931 – 1939.
81. Wierda WG, Kipps TJ, Mayer J et al. Ofatumumab as single‑agent CD20 immunotherapy in fludarabine ‑ refractory chronic lymphocytic leukemia. J Clin Oncol 2010; 28(10): 1749 – 1755. doi: 10.1200/ JCO.2009.25.3187.
82. Fischer K, Cramer P, Busch R et al. Bendamustine combined with rituximab in patients with relapsed and/ or refractory chronic lymphocytic leukemia: a multicenter phase II trial of the German Chronic Lymphocytic Leukemia Study Group. J Clin Oncol 2011; 29(26): 3559 – 3566. doi: 10.1200/ JCO.2010.33.8061.
83. Bowen DA, Call TG, Jenkins GD et al. Methylprednisolone ‑ rituximab is an effective salvage therapy for patients with relapsed chronic lymphocytic leukemia including those with unfavorable cytogenetic features. Leuk Lymphoma 2007; 48(12): 2412 – 2417.
84. Pileckyte R, Jurgutis M, Valceckiene V et al. Dose‑dense high‑dose methylprednisolone and rituximab in the treatment of relapsed or refractory high‑risk chronic lymphocytic leukemia. Leuk Lymphoma 2011; 52(6): 1055 – 1065. doi: 10.3109/ 10428194.2011.562572.
85. Šimkovič M, Motyčková M, Belada D et al. Five years of experience with rituximab plus high‑dose dexamethasone for relapsed/ refractory chronic lymphocytic leukemia. Arch Med Sci. In press 2016; 12: (2).
86. Byrd JC, Furman RR, Coutre SE et al. Targeting BTK with ibrutinib in relapsed chronic lymphocytic leukemia. N Engl J Med 2013; 369(1): 32 – 42. doi: 10.1056/ NEJMoa1215637.
87. Byrd JC, Brown JR, O‘Brien S et al. Ibrutinib versus ofatumumab in previously treated chronic lymphoid leukemia. N Engl J Med 2014; 371(3): 213 – 223. doi: 10.1056/ NEJMoa1400376.
88. Brown JR, Byrd JC, Coutre SE et al. Idelalisib, an inhibitor of phosphatidylinositol 3 - kinase p110δ, for relapsed/ refractory chronic lymphocytic leukemia. Blood 2014; 123(22): 3390 – 3397. doi: 10.1182/ blood ‑ 2013 ‑ 11 ‑ 535047.
89. Furman RR, Sharman JP, Coutre SE et al. Idelalisib and rituximab in relapsed chronic lymphocytic leukemia. N Engl J Med 2014; 370(11): 997 – 1007. doi: 10.1056/ NEJMoa1315226.
90. ClinicalTrials.gov [homepage on the Internet]. Chronic lymphocytic leukemia. [cited 2015 July 20]. Available from: http:/ / clinicaltrials.gov/ ct2/ results?term=chronic+lymphocytic+leukemia&recr=Open&no_unk=Y&type=Intr&phase=12&pg=1.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek EditorialČlánek Folikulární lymfom
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2015 Číslo Supplementum 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Současné možnosti imunoterapie nádorových onemocnění
- Význam minimální zbytkové nemoci u chronické lymfocytární leukemie
- Monoklonální protilátky v léčbě chronické lymfocytární leukemie v roce 2015
- Editorial
- Léčebné možnosti pro nemocné s chronickou lymfocytární leukemií a významnými přidruženými chorobami
- Léčba chronické lymfocytární leukemie s aberací TP53
- Malé molekuly v léčbě chronické lymfocytární leukemie v roce 2015 a v blízké budoucnosti
- Aktuality v podpůrné léčbě chronické lymfocytární leukemie
- Maligní lymfomy − minulost, současnost a budoucnost
- Molekulární prognostické markery chronické lymfocytární leukemie a jejich klinický význam
- Difuzní velkobuněčný B lymfom – moderní způsoby diagnostiky a molekulárně cílené léčby
- Folikulární lymfom
- Lymfom z plášťových buněk – současný stav poznání a možnosti léčby
- Hodgkinův lymfom – vývoj léčebných přístupů a současné trendy
- Záchranná léčba a role transplantací u lymfomů
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Difuzní velkobuněčný B lymfom – moderní způsoby diagnostiky a molekulárně cílené léčby
- Folikulární lymfom
- Lymfom z plášťových buněk – současný stav poznání a možnosti léčby
- Hodgkinův lymfom – vývoj léčebných přístupů a současné trendy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



