-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Malé molekuly v léčbě chronické lymfocytární leukemie v roce 2015 a v blízké budoucnosti
Small Molecules in the Treatment of Chronic Lymphocytic Leukemia in 2015 and in the Near Future
Chronic lymphocytic leukemia is one of the most common lymphoid malignancies and is characterized by a highly heterogeneous clinical course. Combined regimens, such as fludarabine, cyclophosphamide, and rituximab have led to improvements in survival in younger patients with chronic lymphocytic leukemia and have become the standard of care in fit patients. However, the majority of chronic lymphocytic leukemia patients are elderly and not all patients are eligible for aggressive chemoimmunotherapy. In addition, patients with poor ‑ risk cytogenetics have inferior responses to standard treatments with often shorter durations of response. Furthermore, the treatment outcomes of refractory disease are dismal. Nevertheless, there has been a dramatic change in therapeutic paradigms in the past year. Several new drugs have been approved for the treatment of chronic lymphocytic leukemia, including ibrutinib and idelalisib. These new molecules are orally active agents and both target the B ‑ cell receptor associated kinases. Ibrutinib is a selective, irreversible inhibitor of Bruton tyrosine kinase, whereas idelalisib selectively targets phosphatidylinositol ‑ 3 - kinase (PI3K) δ isoform. These agents have demonstrated remarkable activity in patients with relapsed/ refractory chronic lymphocytic leukemia, as well as patients with high‑risk deletion of the 17p chromosome and/ or TP53 mutation. This review focuses on some of the novel small molecules that are currently approved or in advanced clinical development.
Key words:
chronic lymphocytic leukemia – ibrutinib – idelalisib – rituximab – ABT ‑ 199
This study was supported by funds from the elementary science program PRVOUK P27/LF1/1.
I declare that, in connection with the above-mentioned contribution, which I am an author, I have a conflict of interest with the typed the following companies: Gilead, Janssen-Cilag and Roche (honoraria for lectures, travel grants).
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
28. 7. 2015Accepted:
2. 8. 2015
Autoři: M. Špaček
Působiště autorů: Ústav lékařské biochemie a laboratorní diagnostiky, 1. LF UK a VFN v Praze I. interní klinika – klinika hematologie 1. LF UK a VFN v Praze
Vyšlo v časopise: Klin Onkol 2015; 28(Supplementum 3): 45-49
doi: https://doi.org/10.14735/amko20153S45Souhrn
Chronická lymfocytární leukemie je jedna z nejčastějších lymfoidních malignit a je charakteristická svým vysoce variabilním klinickým průběhem. Kombinované režimy jako fludarabin, cyklofosfamid a rituximab vedly ke zlepšení přežití mladších pacientů s chronickou lymfocytární leukemií a staly se standardem léčby u nemocných v dobrém stavu. Chronická lymfocytární leukemie však postihuje zejména starší nemocné a ne všichni pacienti jsou vhodní pro intenzivní chemoimunoterapii. Navíc nemocní s prognosticky nepříznivou cytogenetikou hůře odpovídají na standardní léčbu a remise mívá často krátké trvání. Rovněž léčebná úspěšnost u refrakterních onemocnění je velmi špatná. Avšak v posledním roce došlo ke změně terapeutického paradigmatu. Několik nových léků bylo schváleno pro terapii chronické lymfocytární leukemie, včetně ibrutinibu a idelalisibu. Jedná se o perorálně účinkující látky cílené na kinázy asociované s B buněčným receptorem. Ibrutinib je selektivní ireverzibilní inhibitor Brutonovy tyrozinkinázy, zatímco idelalisib selektivně inhibuje δ izoformu fosfatidylinositol 3-kinázy (PI3K). Obě tyto látky prokázaly významnou účinnost u relabujících/ refrakterních chronické lymfocytární leukemie, stejně jako u vysoce rizikových pacientů s delecí 17p a/ nebo mutací TP53. V tomto článku podáváme přehled některých nových malých molekul, které jsou již schváleny pro léčbu nebo jsou v pokročilém klinickém vývoji.
Klíčová slova:
chronická lymfocytární leukemie – ibrutinib – idelalisib – rituximab – ABT ‑ 199Úvod
Chronická lymfocytární leukemie (CLL) je častý typ zralé maligní proliferace z B lymfocytů. Jedná se o onemocnění s velmi variabilním klinickým průběhem. Základem léčby CLL jsou v současnosti chemoterapeutické režimy s anti‑CD20 protilátkou, u mladších nemocných v dobrém stavu je standardem režim FCR (fludarabin, cyklofosfamid, rituximab). Zavedení monoklonálních protilátek a kombinovaných imunochemoterapeutických režimů vedlo k výraznému zlepšení léčebných výsledků. U značné části pacientů s CLL ale není možné tyto intenzivní léčebné přístupy použít. Onemocnění totiž typicky postihuje zejména starší pacienty, medián věku při diagnóze je 72 let a přibližně pouze třetina nemocných je diagnostikována ve věku do 65 let [1]. Při výběru optimální léčby pro konkrétního pacienta je nutné zohlednit celou řadu faktorů. Vyšší věk, aktuální celkový stav, přítomnost komorbidit, renální insuficience apod. často limituje aplikaci standardní chemoterapie. Navíc vysoce rizikoví nemocní s přítomností CLL klonu s prognosticky nepříznivou delecí 17p (del(17p)) a/ nebo mutací TP53 vykazují značnou rezistenci ke standardní genotoxické chemoterapii. Rovněž pacienti s relapsem CLL mají často omezené terapeutické možnosti z důvodu rezistence na předchozí standardní terapii či pro přetrvávající následky toxicity podané léčby. Je zde proto velká potřeba nových terapeutických přístupů, které budou účinné i u vysoce rizikových pacientů a zároveň budou dostatečně bezpečné s nízkou toxicitou. Na základě narůstajících poznatků o patogenezi CLL se vyvíjí a začíná uplatňovat celá řada léků, které cíleně zasahují do specifických signálních drah či ovlivňují mikroprostředí kolem nádorových buněk. Díky tomu jsme v poslední době svědky přelomových změn v terapii CLL. Nové malé molekuly mají velice dobrou účinnost i u relabujících a refrakterních CLL, včetně pacientů s prognosticky nepříznivými cytogenetickými abnormalitami. Mimo to mají při selektivnějším působení nižší toxicitu proti standardní chemoterapii.
V tomto článku se detailněji zaměříme zejména na následující nové malé molekuly: ibrutinib (inhibitor BTK), idelalisib (inhibitor PI3Kδ) a ABT ‑ 199 (Bcl2 inhibitor).
Ibrutinib
Zásadní a přímou roli má v patogenezi CLL B buněčný receptor (BCR). Jedná se o transmembránový protein, který se skládá ze dvou částí: z antigen ‑ specifického membránového imunoglobulinu (Ig) a z intracelulární části složené z Ig ‑ α/ Ig‑β řetězců (CD79α/ CD79β). Stimulace BCR vede k aktivaci několika intracelulárních signálních drah, včetně aktivace Brutonovy tyrozinkinázy (BTK) a fosfatidylinositol 3-kinázy (PI3K). Tyto tyrozinkinázy dále propagují BCR signální dráhy, včetně mobilizace kalcia, aktivace AKT kinázy, ERK 1/ 2, NF‑κB cesty a další. Na funkci BCR se tedy podílí celá řada kináz, které mohou být využity jako cíle pro novou terapii. První takovou schválenou látkou pro použití u CLL byl v roce 2014 ibrutinib, následovaný ve stejném roce idelalisibem.
Ibrutinib (PCI ‑ 32765) je perorální inhibitor BTK, který v preklinických studiích prokázal u CLL buněk proapoptotické a antiproliferativní působení i vliv na nádorové stroma [2]. Byrd et al [3] publikovali data ze studie fáze IB/ II u pacientů s relapsem/ refrakterní CLL nebo lymfomem z malých lymfocytů (small lymphocytic lymphoma – SLL). Použito bylo dvojí dávkování ibrutinibu u celkem 85 pacientů (51 nemocných dostávalo 420 mg a 34 pacientů 840 mg) s mediánem věku 66 let (rozmezí 37 – 82 let). Většina pacientů měla rizikové onemocnění s mediánem 4 předchozí linie léčby, 81 % mělo nemutovaný stav IgVH, del(17p) byla detekována u 33 % nemocných a v 52 % případech byla přítomna masivní lymfadenopatie (> 5 cm). Celková odpověď na léčbu (objective response rate – ORR) podle současných kritérií byla v obou kohortách 71 %. Dalších 15 pacientů (18 %) dosáhlo parciální remise (partial remission – PR) s perzistující lymfocytózou. Rychle nastupující lymfocytóza po zahájení léčby, která přetrvává různě dlouhou dobu, je fenomén přítomný u všech BCR inhibitorů. Je způsoben lymfocytární redistribucí a odpovídá dosažení PR, ačkoli podle konvenčních kritérií se jako PR nedá hodnotit. Terapeutická odpověď byla nezávislá na rizikových faktorech, včetně klinického stadia, počtu předchozích terapií či přítomnosti chromozomálních aberací. Například pacienti s del(17p) odpověděli na léčbu v 68 % (z toho jedna kompletní remise (complete remission – CP). Přežití bez progrese (progression‑free survival – PFS) bylo ve 26 měsících 75 % a celkové přežití (overall survival – OS) 83 %. Vedlejší účinky byly převážně stupně 1/ 2 dle CTCAE (Common Terminology Criteria for Adverse Events) a zahrnovaly přechodný průjem (47 %), únavu (28 %) a infekce horních cest dýchacích (33 %).
V této studii byla také zahrnuta druhá skupina 29 pacientů nad 65 let s dříve neléčenou CLL a dva pacienti s dosud neléčeným SLL [3]. Medián věku byl 71 let (rozmezí 65 – 84 let). Recentně byla publikována data po tříletém sledování [4], přičemž 81 % pacientů stále pokračovalo s terapií ibrutinibem a medián délky na léčbě byl 30 měsíců (rozmezí 0,3 – 44 měsíce). ORR na léčbu byla 84 %, z toho 23 % byly CR. Důležité je, že kvalita i četnost odpovědí se zvyšovala s časem na terapii (medián dosažení CR 21 měsíců). Medián PFS nebyl dosažen a OS ve 30 měsících bylo 96 %. Nejčastější nežádoucí účinky během tříletého sledování byly hypertenze (23 %), průjem (16 %), infekce včetně pneumonie (13 %) a fibrilace síní (6 %). Cytopenie se vyskytly v méně než 5 % případů. Zajímavé je, že frekvence cytopenií, infekcí, průjmů i další vedlejších účinků se snižovala s délkou léčby. Pouze 10 % pacientů ukončilo léčbu pro nežádoucí účinky a jeden pacient měl progresi onemocnění.
V roce 2014 byla publikována data z registrační studie fáze III RESONATE, která porovnávala ibrutinib s ofatumumabem u předléčených pacientů s CLL [5]. Celkově bylo randomizováno 391 pacientů do ramene s ibrutinibem (420 mg p.o. 1krát denně) nebo intravenózním ofatumumabem (iniciální dávka 300 mg, dále 2 000 mg týdně 7krát a dále po 4 týdnech 16 týdnů). Medián věku byl 67 let v obou ramenech, medián předchozích terapií byl 3 u ibrutinibu a 2 u ofatumumabu. Celková odpověď byla 43 % v rameni s ibrutinibem a 4 % u ofatumumabu. Navíc dalších 20 % pacientů léčených ibrutinibem dosáhlo PR s lymfocytózou. Rovněž rozdíl v PFS byl signifikantně lepší u ibrutinibu (medián nedosažen) proti ofatumumabu (medián 9,4 měsíce). Ve 12 měsících bylo OS 90 % u ibrutinibu a 81 % u ofatumumabu. Stejná četnost odpovědí na léčbu byla u všech pacientů bez ohledu na základní charakteristiky a prognostické faktory. Nežádoucí účinky stupně ≥ 3 častější v rameni s ibrutinibem zahrnovaly průjem (4 vs. 2 %) a fibrilaci síní (3 vs. 0 %). Nežádoucí účinky zahrnující všechny krvácivé příhody byly častější u ibrutinibu (44 %) proti ofatumumabu (12 %), avšak zahrnovaly převážně petechie a ekchymózy a nebyl rozdíl v incidenci závažných krvácivých příhod stupně ≥ 3 (dva pacienti na ibrutinibu a tři pacienti na ofatumumabu). Nutno ale poznamenat, že ze studie byli vyloučeni pacienti na warfarinu, nicméně jiná antikoagulace či antiagregace byla povolena.
Výsledky uvedených prací vedly v únoru 2014 v USA úřad FDA (Food and Drug Administration – Úřad pro kontrolu léčiv) ke schválení použití ibrutinibu pro léčbu pacientů s CLL, kteří podstoupili alespoň jednu předchozí terapii, a v červenci 2014 pak bylo schválení rozšířeno na pacienty s del(17p) v 1. linii. V Evropě je v současnosti rovněž schválena indikace ibrutinibu v monoterapii u pacientů s CLL, kteří již podstoupili alespoň jednu předchozí terapii, nebo v 1. linii u pacientů s del(17p) nebo mutací TP53, u nichž není vhodná chemoimunoterapie (tab. 1).
Tab. 1. Malé molekuly schválené k terapii CLL. 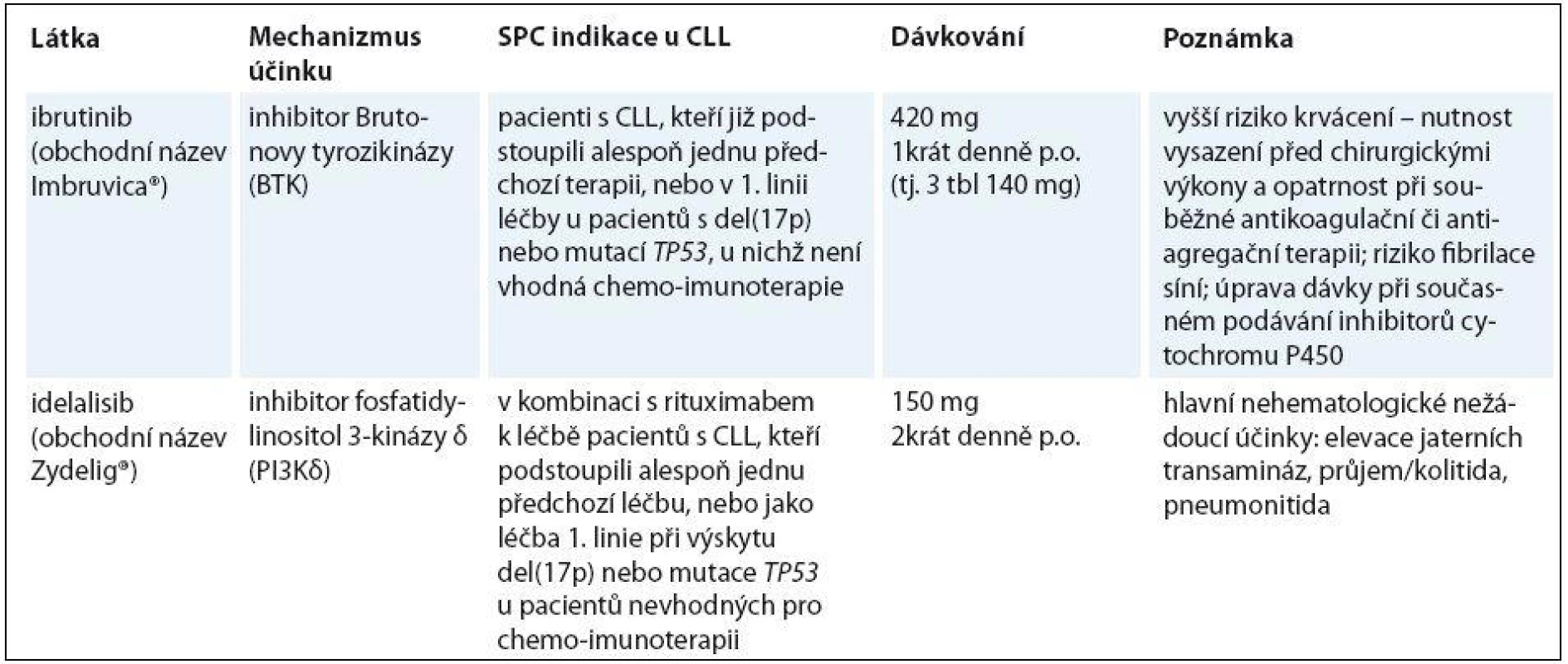
CLL – chronická lymfocytární leukemie Idelalisib
Jedním z dalších klíčových hráčů v přenosu BCR signálu je zmíněná cytoplazmatická tyrozinkináza PI3K. Izoforma PI3Kδ je exprimována pouze v buňkách hematopoetického původu, přičemž signální dráha PI3Kδ je často hyperaktivní u B lymfocytárních malignit, včetně CLL [6]. Idelalisib (CAL ‑ 101, GS ‑ 1101) je první selektivní perorální PI3Kδ inhibitor vysoce indukující apoptózu CLL buněk. Na rozdíl od pan ‑ PI3K inhibitorů nevykazuje idelalisib významnou cytotoxicitu k normálním NK buňkám a T lymfocytům [6]. Kromě přímého účinku na CLL buňky antagonizuje i podpůrné faktory nádorového mikroprostředí a inhibuje tak chemotaxi či migraci CLL buněk.
Studie fáze I na 54 pacientech s relabující/ refrakterní CLL prokázala účinnost idelalisibu v monoterapii v dávkování 50 – 350 mg 1 – 2krát denně [7]. Pacienti byli výrazně předléčení s mediánem 5 předchozích linií léčby (rozmezí 2 – 14), 70 % nemocných bylo refrakterních na poslední terapii a většina byla s prognosticky nepříznivým nemutovaným stavem IgVH (91 %), s masivní lymfadenopatií (80 %) či s del(17p)/ mutací TP53 (24 %). ORR byla 72 %, medián doby do první odpovědi byl 1,9 měsíce a medián PFS byl 15,8 měsíce. Mezi nejčastější nežádoucí účinky jakéhokoli stupně patřila únava (31 %), průjem (30 %), teploty (28 %), vyrážka (22 %), infekce horních cest dýchacích (22 %) a pneumonie (22 %). Mezi nejčastěji pozorované nežádoucí účinky stupně ≥ 3 patřily pneumonie (20 %), febrilní neutropenie (11 %) a průjem (6 %).
Následující registrační studie fáze III u pacientů s relapsem CLL byla multicentrická, randomizovaná, dvojitě zaslepená a placebem kontrolovaná [8]. Celkem 220 pacientů bylo rozděleno do dvou léčebných ramen: rituximab s idelalisibem a rituximab s placebem. Iniciální dávka intravenózního rituximabu byla 375 mg/ m2, následovaná čtyřmi dávkami 500 mg/ m2 každé dva týdny a dále třemi dávkami každé čtyři týdny. Idelalisib byl podáván perorálně v dávce 150 mg 2krát denně. Mezi zařazovací kritéria patřila progrese CLL do 24 měsíců po poslední terapii a nevhodnost podání cytotoxické terapie z důvodu myelosuprese jako následku předchozí léčby, snížené renální funkce nebo přítomnost významných komorbidit.
Medián věku zařazených pacientů byl 71 let (rozmezí 48 – 90 let), 85 % nemocných mělo komorbidní skóre CIRS > 6 (medián CIRS 8 v obou ramenech) a 40 % středně těžkou renální dysfunkci (clearance kreatininu < 60 ml/ min). Pacienti měli medián tři předchozí linie terapie (rozmezí 1 – 12), které vesměs zahrnovaly rituximab, cyklofosfamid, fludarabin či bendamustin. Z negativních biologických prognostických znaků mělo přes 80 % pacientů nemutovaný stav IgVH a více než 40 % mělo del(17p) nebo mutaci TP53.
V době publikované analýzy byl medián podávání idelalisibu pouze 3,8 měsíce a 81 % pacientů v rameni s idelalisibem stále pokračovalo v terapii. Medián PFS byl 5,5 měsíce ve skupině s placebem a nebyl dosažen ve skupině s idelalisibem. Ve 12 měsících bylo OS 92 % u pacientů dostávajících idelalisib vs. 80 % u ramene s placebem (p = 0,02), ORR (vše PR) 81 u idelalisibu vs. 13 % u placeba.
Mezi pět nejčastějších nežádoucích účinků u pacientů léčených idelalisibem s rituximabem patřila teplota, únava, nevolnost, zimnice a průjem. Průjem stupně ≥ 3 dle CTCAE se vyskytl u čtyř pacientů s idelalisibem a u žádného v případě placeba. Závažné nežádoucí účinky se objevily u 40 % pacientů s idelalisibem a rituximabem, zatímco v rameni s rituximabem a placebem to bylo ve 35 % případů. Nejčastější závažné nežádoucí účinky (výskyt ≥ 5 %) v rameni s idelalisibem zahrnovaly pneumonii (6 %), teploty (6 %), febrilní neutropenii (5 %) a v rameni s placebem pneumonii (8 %) a febrilní neutropenii (6 %). Nežádoucí účinky vedly k přerušení léčby u devíti pacientů (8 %) ve skupině s idelalisibem a u 11 pacientů (10 %) ve skupině s placebem. Elevace transamináz stupně ≥ 3 se vyskytla u šesti pacientů (5 %) v rameni s idelalisibem, ale v žádném z případů to nevedlo k ukončení terapie.
Výsledky práce Furmana et al vedly v roce 2014 k rychlému schválení FDA pro použití kombinace idelalisibu s rituximabem u pacientů s relapsem CLL, kteří nejsou vhodní k podání chemoterapie [8]. Evropská komise pak schválila kombinaci s rituximabem k léčbě pacientů s CLL, kteří podstoupili alespoň jednu předchozí léčbu, nebo jako léčbu 1. linie při výskytu del(17p) anebo mutace TP53 u pacientů nevhodných pro imunochemoterapii (tab. 1).
ABT‑ 199
Kromě inhibice BCR je dalším slibným terapeutickým cílem protein Bcl ‑ 2 (B ‑ cell lymphoma 2). Jedná se o důležitý antiapoptotický protein a v současné době je testována řada jeho inhibitorů. ABT ‑ 199 (venetoclax, GDC ‑ 0199) je perorální selektivní Bcl ‑ 2 inhibitor. V prvních studiích prokázal významnou klinickou aktivitu, ale také zvýšené riziko syndromu nádorového rozpadu (tumor lysis syndrome – TLS), vedoucí k nutnosti zahajování léčby s eskalací dávky za pečlivé monitorace. Seymour et al prezentovali data ze studie ABT ‑ 199 v monoterapii ve fázi I/ II [9]. Dávka ABT ‑ 199 byla po týdnu navyšována z 20 mg na 50, 100, 200 a finálních 400 mg. Zařazeno bylo 84 pacientů s mediánem času ve studii 14,7 měsíce. V 57 % se jednalo o fludarabin rezistentní CLL, u 27 % pacientů byla prokázána del(17p). Nejčastější nežádoucí účinky byly průjem (37 %), nevolnost (36 %), neutropenie (35 %), infekce horních cest dýchacích (29 %) a únava (27 %). Nežádoucí účinky stupně 3/ 4 byly neutropenie (32 %), anémie (8 %), TLS (8 % včetně 1krát stupeň 5) a febrilní neutropenie, trombocytopenie, hyperglykemie a hypokalemie (vše 6 %). Léčbu přerušilo 28 nemocných, z toho 18 pro progresi CLL, osm kvůli nežádoucím účinkům a dva z jiného důvodu. Odpověď na léčbu byla 79 % (CR/ CRi 22 %) s mediánem trvání 20,5 měsíce u 63 hodnotitelných pacientů. V případě del(17p) byla ORR 78 % a u fludarabin refrakterních 79 %.
ABT ‑ 199 vede k vysokému počtu dlouhodobých remisí u pacientů s relabující/ refrakterní CLL, včetně nemocných refrakterních na fludarabin či s přítomností del(17p). Cílená inhibice Bcl ‑ 2 se jeví jako slibný terapeutický cíl a dá se očekávat, že ABT ‑ 199 bude pravděpodobně v blízké době další schválenou látkou v léčbě CLL.
Ostatní malé molekuly
Kromě ibrutinibu a idelalisibu se v současné době testuje řada dalších malých molekul působících na úrovni inhibice signální dráhy BCR. Prezentována byla např. slibná data z klinického hodnocení fáze I u relabujících/ refrakterních CLL léčených BTK inhibitorem ONO ‑ 4059 [10]. Rovněž je ve vývoji několik nových inhibitorů PI3K. Duvelisib (IPI ‑ 145) je nový perorální PI3K ‑ δ, γ inhibitor, který ve studii fáze I prokázal účinnost u vysoce předléčených pacientů s relabující/ refrakterní CLL, včetně prognosticky nepříznivých CLL [11]. Další potenciálně terapeuticky ovlivnitelnou tyrozinkinázou, která se účastní BCR signalizace, je Syk (Spleen tyrosine kinase). Prvním klinicky testovaným Syk inhibitorem u CLL byl fostamatinib (R406), jeho použití je ale limitováno nízkou specificitou [12]. Sharman et al recentně publikovali data z fáze II klinického hodnocení nového perorálního selektivního inhibitoru Syk entospletinibu (GS ‑ 9973) [13]. Léčeno bylo 41 pacientů s relapsem/ refrakterní CLL, medián PFS byl 13,8 měsíce a ORR 61 %, přičemž 29 % nemocných mělo závažné nežádoucí účinky.
Závěr
Současným standardem léčby u mladších nemocných s CLL v dobrém stavu zůstává imunochemoterapie FCR, kterou ale nelze pro významnou toxicitu použít u starších či komorbidních pacientů. Také její účinnost u vysoce rizikových pacientů s CLL s přítomností del(17p) a/ nebo mutací TP53 je omezená. Rovněž osud nemocných s relapsem po FCR je velmi nepříznivý [14]. Výzkum v oblasti patogeneze CLL přinesl nové poznatky o důležitosti signálních drah BCR, které se tak staly zdrojem pro vývoj cílené terapie. Mezi nové malé molekuly již schválené k terapii CLL patří ibrutinib (inhibitor BTK) a idelalisib (inhibitor PI3Kδ), v ČR však zatím nemají stanovenou úhradu ze zdravotního pojištění (stav v srpnu 2015). Pacienty potenciálně profitující z nové cílené léčby je vhodné odesílat do hematologických center, kde jim mnohdy může být nabídnuta i účast v klinických studiích s novými léky. Provedené klinické studie prokázaly vysokou účinnost obou nových preparátů v léčbě pacientů s CLL při poměrně nízké toxicitě, která jinak bývá spojena s intenzivními imunochemoterapeutickými režimy. Velmi dobrých a dlouhodobých léčebných odpovědí dosahují také u opakovaně relabujících nemocných s CLL, u pacientů refrakterních na standardní chemoterapii i v případě vysoce rizikových CLL s del(17p) a/ nebo mutací TP53. Dosud publikovaná data, svědčící o jednoznačné účinnosti kinázových inhibitorů, již vedou ke změnám v léčebných doporučeních u CLL, a to včetně plánování a indikace alogenní transplantace kostní dřeně [15,16]. V dohledné době můžeme pravděpodobně očekávat schválení dalšího cíleného léku ABT ‑ 199, který působí na úrovni inhibice Bcl ‑ 2. Ve vývoji jsou také nové generace inhibitorů BTK, PI3K a Syk, které mají potenciál dále posunout terapeutické možnosti u CLL. V současné době probíhá mnoho klinických studií, na jejichž základě bychom měli získat odpovědi na další otázky spojené s cílenou léčbou, jako je výběr optimální léčebné kombinace pro terapii 1. linie a v relapsu, bezpečnost a účinnost při dlouhodobém podávání apod.
Práce byla podpořena prostředky z programu PRVOUK P27/LF1/1.
Prohlašuji, že v souvislosti s výše uvedeným příspěvkem, jehož jsem autorem, mám střet zájmů s níže vypsanými společnostmi: Gilead, Janssen-Cilag a Roche (honoraria za přednáškovou činnost, cestovní granty).
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Martin Špaček, Ph.D.
I. interní klinika – klinika hematologie
1. LF UK a VFN v Praze
U Nemocnice 2
128 08 Praha 2
e-mail: m.spacek@centrum.cz
Obdrženo: 28. 7. 2015
Přijato: 2. 8. 2015
Zdroje
1. Howlader N, Noone AM, Krapcho et al. SEER cancer statistics review 1975 – 2009 (Vintage 2009 Populations). Bethesda: National Cancer Institute 2011.
2. Ponader S, Chen SS, Buggy JJ et al. The Bruton tyrosine kinase inhibitor PCI ‑ 32765 thwarts chronic lymphocytic leukemia cell survival and tissue homing in vitro and in vivo. Blood 2012; 119(5): 1182 – 1189. doi: 10.1182/ blood ‑ 2011 ‑ 10 ‑ 386417.
3. Byrd JC, Furman RR, Coutre SE et al. Targeting BTK with ibrutinib in relapsed chronic lymphocytic leukemia. N Engl J Med 2013; 369(1): 32 – 42. doi: 10.1056/ NEJMoa1215637.
4. Byrd JC, Furman RR, Coutre SE et al. Three‑year follow‑up of treatment ‑ naive and previously treated patients with CLL and SLL receiving single‑agent ibrutinib. Blood 2015; 125(16): 2497 – 2506. doi: 10.1182/ blood ‑ 2014 ‑ 10 ‑ 606038.
5. Byrd J, Brown J, O’Brien S et al. Ibrutinib versus ofatumumab in previously treated chronic lymphoid leukemia. N Engl J Med 2014; 371(3): 213 – 223. doi: 10.1056/ NEJMoa1400376.
6. Herman SE, Gordon AL, Wagner AJ et al. Phosphatidylinositol 3 - kinase ‑ delta inhibitor CAL ‑ 101 shows promising preclinical activity in chronic lymphocytic leukemia by antagonizing intrinsic and extrinsic cellular survival signals. Blood 2010; 116(12): 2078 – 2088. doi: 10.1182/ blood ‑ 2010 ‑ 02 ‑ 271171.
7. Brown R, Furman RR, Flinn I et al. Final results of a phase Istudy of idelalisib (GSE 1101) a selective inhibitor of PI3K {delta}, in patients with relapsed or refractory CLL. J Clin Oncol 2013; abstr. 7003.
8. Furman RR, Sharman JP, Coutre SE et al. Idelalisib and rituximab in relapsed chronic lymphocytic leukemia. N Engl J Med 2014; 370(11): 997 – 1007. doi: 10.1056/ NEJMoa1315226.
9. Seymour JF, Davids MS, Pagel JM et al. ABT ‑ 199 (GDC ‑ 0199) in relapsed/ refractory (R/ R) chronic lymphocytic leukemia (CLL) and small lymphocytic lymphoma (SLL): high completeresponse rate and durable disease control. J Clin Oncol 2014; 32: abstr. 7015.
10. Fegan C, Bagshawe J, Salles J et al. The Bruton’s tyrosine kinase (BTK) inhibitor ONO ‑ 4059: promising single agent activity and well tolerated in patients with high risk chronic lymphocytic leukaemia. American Society of Hematology ASH Annual Meeting and Exposition, December 2014; San Francisco. Abstr. 3328.
11. Flinn I, Patel M, Kahl BS et al. Preliminary safety and efficacy of IPI ‑ 145, a potent inhibitor of PI3Kdg, in patients with CLL. American Society of Hematology 55th Annual Meeting and Exposition, December 7 – 10, 2013; New Orleans, LA. Abstr. 677.
12. Friedberg JW, Sharman J, Sweetenham J et al. Inhibition of Syk with fostamatinib disodium has significant clinical activity in non‑Hodgkin lymphoma and chronic lymphocytic leukemia. Blood 2010; 115(13): 2578 – 2585. doi: 10.1182/ blood ‑ 2009 ‑ 08 ‑ 236471.
13. Sharman J, Hawkins M, Kolibaba K et al. An open ‑ label phase 2 trial of entospletinib (GS ‑ 9973), a selective spleen tyrosine kinase inhibitor, in chronic lymphocytic leukemia. Blood 2015; 125(15): 2336 – 2343. doi: 10.1182/ blood ‑ 2014 ‑ 08 ‑ 595934.
14. Panovska A, Smolej L, Lysak D et al. The outcome of chronic lymphocytic leukemia patients who relapsed after fludarabine, cyclophosphamide, and rituximab. Eur J Haematol 2013; 90(6): 479 – 485. doi: 10.1111/ ejh.12106.
15. Hallek M. Chronic lymphocytic leukemia: 2015 update on diagnosis, risk stratification, and treatment. Am J Hematol 2015; 90(5): 446 – 460. doi: 10.1002/ ajh.23979.
16. Dreger P, Schetelig J, Andersen N et al. Managing high‑risk CLL during transition to a new treatment era: stem cell transplantation or novel agents? Blood 2014; 124(26): 3841 – 3849. doi: 10.1182/ blood ‑ 2014 ‑ 07 ‑ 586826.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2015 Číslo Supplementum 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Současné možnosti imunoterapie nádorových onemocnění
- Význam minimální zbytkové nemoci u chronické lymfocytární leukemie
- Monoklonální protilátky v léčbě chronické lymfocytární leukemie v roce 2015
- Editorial
- Léčebné možnosti pro nemocné s chronickou lymfocytární leukemií a významnými přidruženými chorobami
- Léčba chronické lymfocytární leukemie s aberací TP53
- Malé molekuly v léčbě chronické lymfocytární leukemie v roce 2015 a v blízké budoucnosti
- Aktuality v podpůrné léčbě chronické lymfocytární leukemie
- Maligní lymfomy − minulost, současnost a budoucnost
- Molekulární prognostické markery chronické lymfocytární leukemie a jejich klinický význam
- Difuzní velkobuněčný B lymfom – moderní způsoby diagnostiky a molekulárně cílené léčby
- Folikulární lymfom
- Lymfom z plášťových buněk – současný stav poznání a možnosti léčby
- Hodgkinův lymfom – vývoj léčebných přístupů a současné trendy
- Záchranná léčba a role transplantací u lymfomů
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Difuzní velkobuněčný B lymfom – moderní způsoby diagnostiky a molekulárně cílené léčby
- Folikulární lymfom
- Lymfom z plášťových buněk – současný stav poznání a možnosti léčby
- Hodgkinův lymfom – vývoj léčebných přístupů a současné trendy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



