-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Infantilní hemangiomy.
Současné léčebné postupy
Infantile hemangiomas.
Current treatment proceduresInfantile hemangiomas are the most common benign tumors that affect between 10–12% of infants, a higher incidence in premature and immature children. There are three basic types – superficial, deep and mixed. Most hemangiomas do not require any treatment, stagnation and involution occur after the phase of intense growth in the first 4 to 5 months of life. About half of the hemangiomas persist in more or less significant residues. Around 10% of hemangiomas can cause serious complications – endangering vital functions (eyelid, nose, etc.), exudation, bleeding and severe cosmetic impairment. The first-line drug is the non-selective betablocker propranolol administered at a dose of 2–3 mg/kg/day for 6 months. Propranolol acts as a vasoconstrictor of capillary hemangiomas, blocking vascular endothelial growth factor (VEGF) promoting vascular development and promoting apoptosis (natural death of vascular cells). Propranolol induces involution of hemangioma and residues after treatment are significantly lower and less severe. The most common complications are sleep disorder (up to 20% of children). Treatment should be performed in centers where a pediatric dermatologist, oncologist, cardiologist, radiologist, and surgeon are provided with the appropriate specializations to resolve residual lesions.
KEY WORDS:
hemangioma, infantile hemangioma, propranolol
Autoři: J. Mališ 1; V. Stará 2; K. Bláhová 2; H. Bučková 3; R. Faberová 3; J. Štěrba 4; S. Klovrzová 5; M. Kynčl 6; Michal Černý 7
; R. Hrdlička 8
; M. Mojžíšová 9; M. Vaculík 10; J. Kozák 10; R. Katra 11; I. Michalusová 12; A. Sukop 13; M. Rygl 14; J. Hercogová 15; P. Arenberger 16; R. Šmucler 17; Š. Čapková 18
Působiště autorů: Klinika dětské hematologie a onkologie 2. LF UK a FN Motol, Praha 1; Pediatrická klinika 2. LF UK a FN Motol, Praha 2; Dětské kožní oddělení Pediatrické kliniky FN Brno 3; Klinika dětské onkologie LF MU a FN Brno 4; Nemocniční lékárna FN Motol, Praha 5; Klinika zobrazovacích metod 2. LF UK a FN Motol, Praha 6; Novorozenecké oddělení Gynekologicko-porodnické kliniky 2. LF UK a FN Motol, Praha 7; Dětské oddělení nemocnice, Kolín 8; Dětské oddělení nemocnice, Hořovice 9; Neurochirurgická klinika dětí a dospělých 2. LF UK a FN Motol, Praha 10; Klinika ušní, nosní a krční 2. LF UK a FN Motol, Praha 11; Stomatologická klinika dětí a dospělých 2. LF UK a FN Motol, Praha 12; Klinika plastické chirurgie 3. LF UK a FN Královské Vinohrady, Praha 13; Klinika dětské chirurgie 2. LF UK a FN Motol, Praha 14; Dermatovenerologická klinika 2. LF UK a Nemocnice Na Bulovce, Praha 15; Dermatovenerologická klinika 3. LF UK a FN Královské Vinohrady, Praha 16; Asklepion, Praha 17; Dermatologické oddělení pro děti, FN Motol, Praha 18
Vyšlo v časopise: Čes-slov Pediat 2017; 72 (4): 245-254.
Kategorie: Postgraduální článek
Souhrn
Infantilní hemangiomy jsou nejčastější benigní nádory, které postihují 10–12 % kojenců, vyšší incidence je u nedonošených a nezralých dětí. Rozlišují se tři základní typy – superficiální, hluboký a smíšený. Většina hemangiomů nevyžaduje žádnou léčbu, po fázi intenzivního růstu v prvních 4 až 5 měsících života nastává stagnace a po ní involuce. Asi u poloviny hemangiomů přetrvává více či méně významné reziduum. Kolem 10 % hemangiomů může způsobovat závažné komplikace – ohrožení vitálních funkcí (postižení víček, nosu apod.), exulcerace, krvácení a závažné kosmetické postižení. Lékem první volby je neselektivní betablokátor propranolol podávaný ve formě perorálního roztoku, v dávce 2–3 mg/kg/den po dobu 6 měsíců. Propranolol způsobuje vazokonstrikci kapilár hemagiomů, blokuje produkci endogenních faktorů (VEGF – vaskuloendothelial growth factor) podporujících novotvorbu cév a podporuje apoptózu (přirozenou smrt cévních buněk). Propranolol navodí involuci hemangiomu a rezidua po léčbě jsou významně nižší a méně závažná. Nejčastějšími nežádoucími účinky jsou poruchy spánku (až u 20 % dětí). Léčbu je nutné provádět v centrech, kde je k dispozici dětský dermatolog, onkolog, kardiolog, radiolog a chirurg příslušné specializace k řešení reziduálních lézí.
Klíčová slova:
hemangiom, infantilní hemangiom, propranololÚVOD
Infantilní hemangiomy (IH) představují nejčastější nádory dětského věku. Vznikají proliferací endoteliálních buněk kapilár. Naprostá většina z nich nevyžaduje žádnou léčbu, protože nepůsobí žádné obtíže nebo komplikace a v průběhu měsíců až let spontánně involují [1, 2]. Avšak asi v 10–15 % případů mohou působit komplikace: obstrukce, ulcerace nebo závažné kosmetické vady, což vyžaduje léčbu, často neodkladnou.
IH zařazujeme do široké skupiny cévních anomálií, kdy je nutné je odlišit od cévních strukturálních malformací, které jsou vrozené a od narození až do konce života se nemění. Naproti tomu jsou IH charakterizovány abnormální proliferací endoteliálních buněk a novotvorbou cév, růstem a progresí a následnou involucí, která může být úplná (tzn. že IH zcela vymizí), anebo zanechá trvalé reziduum.
Klasifikaci vaskulárních anomálií řeší Mezinárodní společnost pro studium cévních anomálií (International Society for Study of Vascular Anomalies – ISSVA) z roku 2014 (tab. 1) [3].
Tab. 1. Klasifikace kožních cévních anomálií. 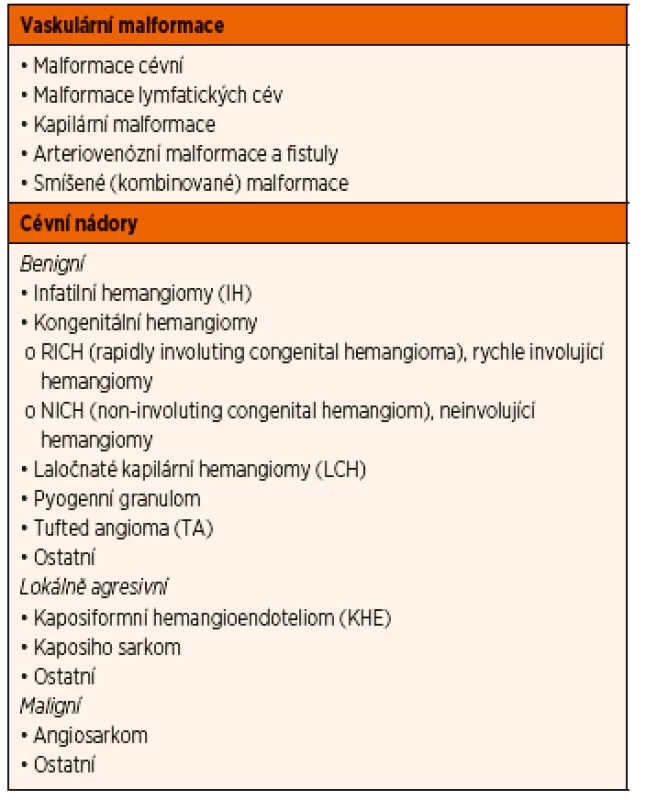
EPIDEMIOLOGIE
Prevalence IH u zralých novorozenců a kojenců se pohybuje mezi 4–5 % a jsou až 3x častější u dívek. Incidence stoupá se snižujícím se gestačním věkem a porodní hmotností, kdy dosahuje 20–25 % u nedonošených jedinců [1]. Celkově tedy IH postihují 10–12 % kojenců. Mezi další rizikové faktory patří opakované těhotenství, vyšší věk matky, in vitro fertilizace, preeklampsie a placentární anomálie.
PATOGENEZE
Infantilní hemangiom je výsledkem dysregulace vaskulogeneze. Ale jaké impulzy tento proces aktivují, to je předmětem hypotéz. Nejpravděpodobnějším spouštěcím signálem je hypoxický stres, který indukuje zvýšenou expresi angiogenních faktorů, jako je VEGF (vaskuloendoteliální růstový faktor), výsledkem jeho nadměrné exprese je proliferace nezralých endoteliálních buněk (exprimujících CD 31), ale také dendritických a mezenchymálních buněk. Endoteliální buňky exprimují GLUT1 (erytrocytární glukózu transportující protein), který je přítomen ve všech fázích proliferace hemangiomu [4].
KLINICKÉ PROJEVY A PŘIROZENÝ VÝVOJ
IH se obvykle objevují v prvním až druhém týdnu života, avšak nikoliv po 12. týdnu. Výjimečně je IH patrný již při narození, ale prekurzorové léze (tzn. změny na kůži, které ještě nelze označit jednoznačně jako IH, ale při retrospektivním hodnocení představují počínající stadium IH) jsou patrné již při narození až v 65 % případů. Nejrychlejší růst (fáze proliferace) je patrný v prvních 12 týdnech života a tato rychlost postupně klesá mezi 4.–6. měsícem života. Až 80 % IH dosahuje své definitivní velikosti koncem 4. měsíce věku. Avšak některé segmentální a hluboké hemangiomy, např. v oblasti parotis, vykazují růstovou aktivitu i ve 2. až 3. roce života. Po proliferační fázi následuje klidové stadium trvající několik měsíců, které postupně přechází v involuci (obr. 1, graf 1). Až 90 % IH spontánně involuje mezi 2. až 6. rokem. Některé hluboké nebo smíšené hemangiomy však involují pomaleji a delší dobu, a to až do 8. nebo 9. roku. Involuce ovšem neznamená, že hemangiom vymizí bez jakéhokoliv rezidua (teleangiektázie, fibrózně-tuková tkáň, atrofie kůže) (obr. 2, 7). Největší šanci na bezreziduální involuci mají superficiální IH, ale i tak se jedná jen o zhruba 30 % hemangiomů. Smíšené nebo hluboké hemangiomy zanechávají rezidua mnohem častěji, segmentální zanechávají více či méně závažné reziduum téměř vždy [5, 6]. Při mnohočetném výskytu hemangiomů na kůži (5 až 10 ložisek) nebo hemangiomatóze (nad 10) bývají postiženy také některé viscerální orgány – nejčastěji játra. Jindy postihují sliznice dutiny ústní, horních a dolních cest dýchacích [7, 8].
Obr. 1. Části obličeje při postižení segmentálním IH. 1 – frontotemporální, 2 – maxilární, 3 – mandibulární, 4 – frontonazální Fig. 1. Areas of face involvement by segmental hemangioma. 1 – frontotemporal, 2 – maxillar, 3 – mandibullar, 4 – frontonasal 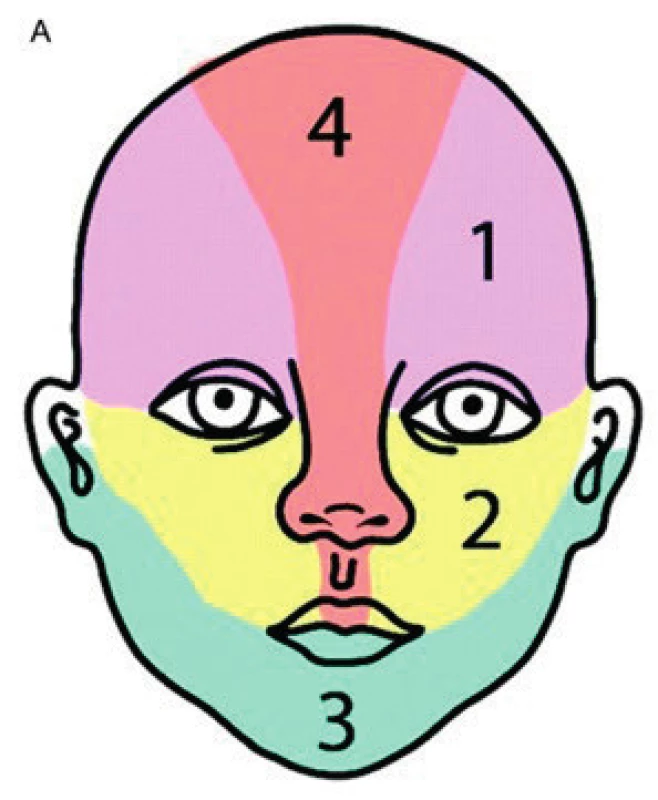
Obr. 2. Reziduum neléčeného hemangiomu. Fig. 2. Residue of untreated hemangioma. 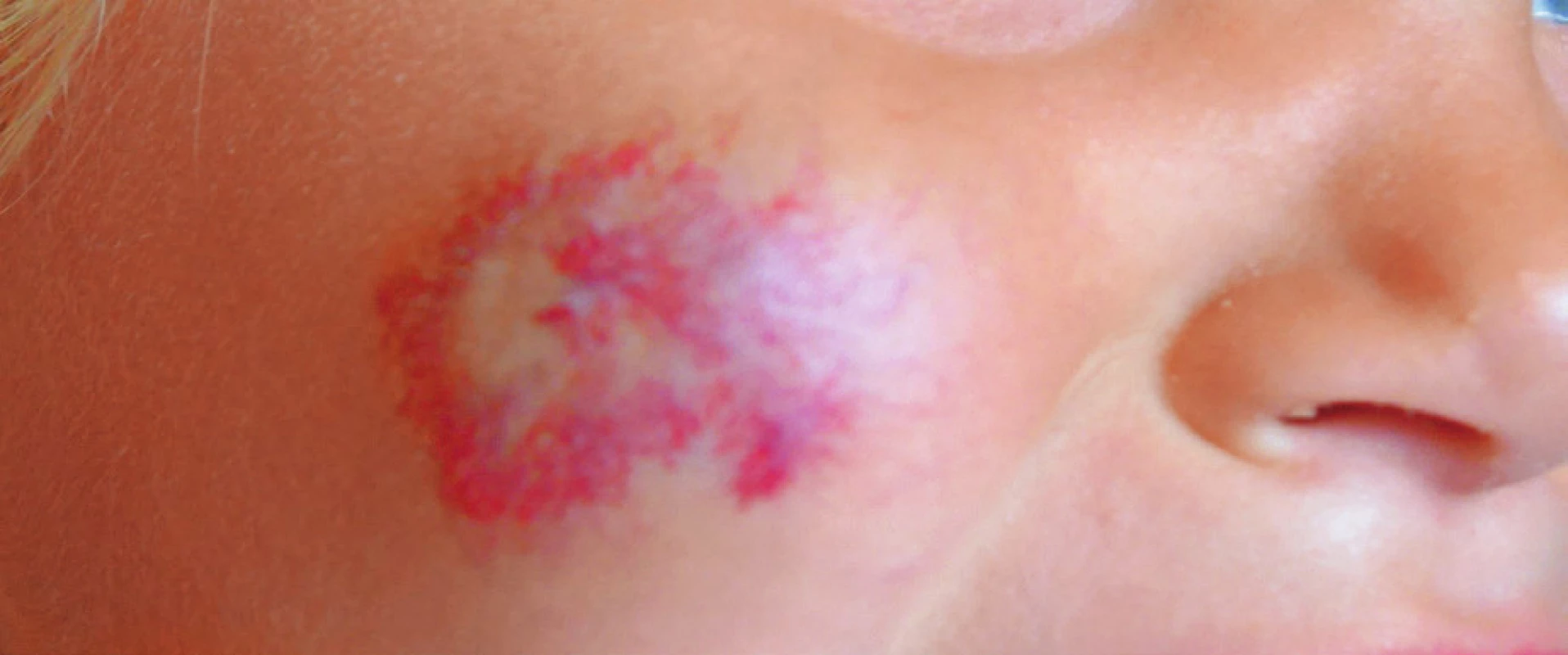
Graf 1. Růstové fáze hemangiomu. 
Hemangiomy mohou být součástí závažnějších syndromů: PHACE (tab. 2) – kombinace hemagiomů, intrakraniálních, očních a kardiovaskulárních cévních anomálií, je u dívek 9x častější než u chlapců. Vyskytuje se u 20–31 % velkých nebo segmentálních hemangiomů v obličeji [9, 10]. PELVIS (tab. 3) představuje přítomnost infantilního hemangiomu na perineu a současně kongenitální malformace v genitálu, konečníku, vylučovacího traktu a páteře[11].
KLASIFIKACE HEMANGIOMŮ
IH jsou charakterizovány značnou variabilitou velikostí, počtem ložisek i jejich tvarem a postižením jednotlivých vrstev kůže nebo podkoží. Z těchto projevů vychází také jejich dělení [12].
Podle hloubky postižení jednotlivých vrstev kůže (epidermis, corium, tela subcutanea) rozlišujeme: superficiální (povrchový) (obr. 4), hluboký (v podkoží, zcela překryt kůží) (obr. 5) a smíšený (obr. 3), kdy je na povrchu viditelná pouze část hemangiomu a v podkoží je skrytá jeho další část.
Obr. 3. Superficiální hemangiom. Fig. 4. Superficial hemangioma. 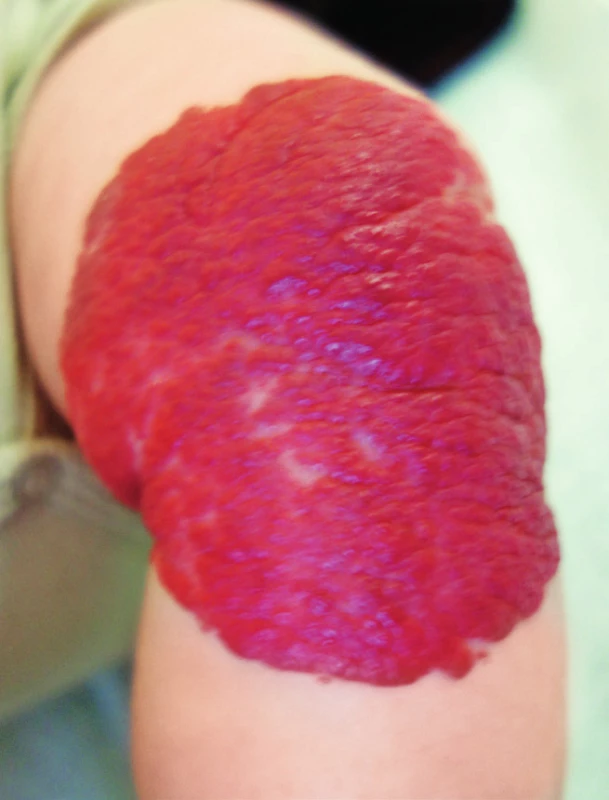
Obr. 4. Hluboký hemangiom v oblasti parotis. Fig. 5. Deep hemangioma in the area of gl. parotis. 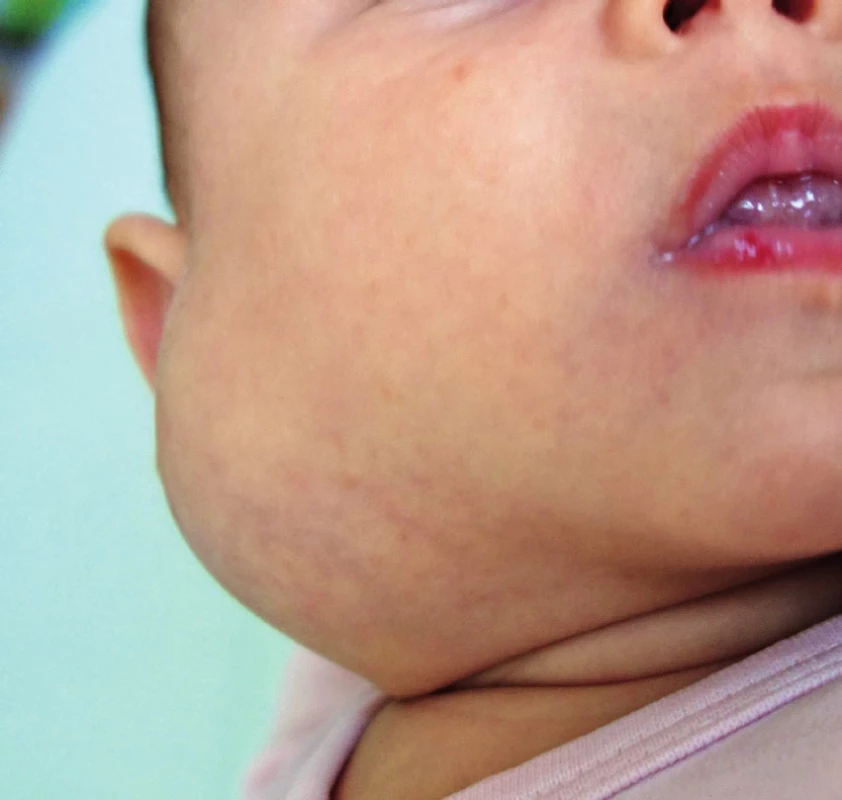
Obr. 5. Smíšený hemangiom. Fig. 3. Mixed hemangioma. 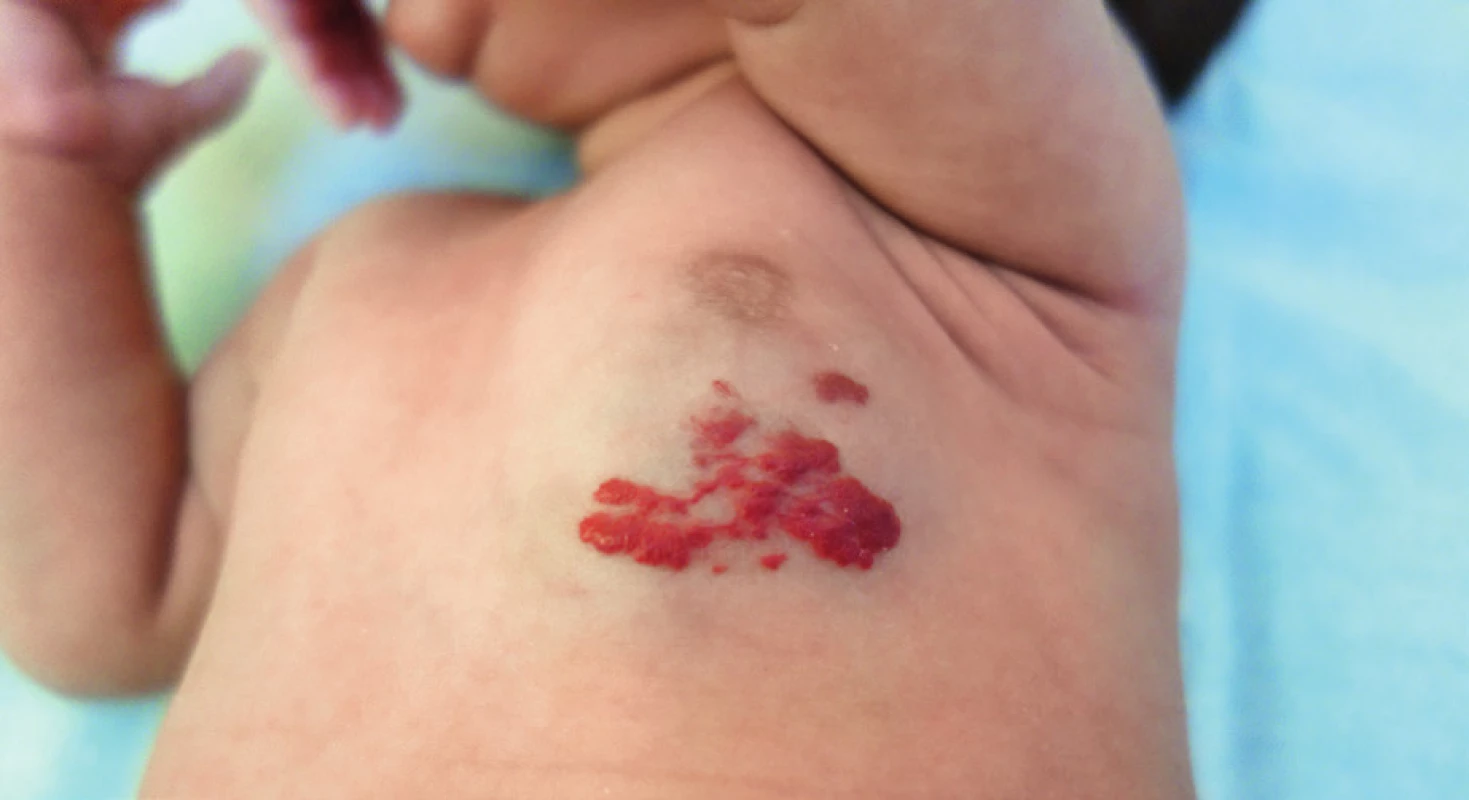
Podle distribuce rozlišujeme: hemangiom segmentální, lokalizovaný a multifokální, z nichž lokalizovaných je nejvíce (67 %), segmentálních (13 %) a nejméně je multifokálních (3 %). Ty léze, které nelze jednoznačně zařadit do jednotlivých kategorií podle distribuce, se označují jako neurčité (neurčitelné) a je jich až 17 %.
Podle lokalizace je nejvíce IH na hlavě a krku (60 %), zbytek se vyskytuje na ostatních částech těla.
Podle počtu lézí rozlišujeme: vícečetné hemangiomy – více než 5, ale méně než 10 ložisek a hemangiomatózy – nad 10 lézí.
Segmentální IH na obličeji se rozdělují podle postižené části na frontotemporální, maxilární, mandibulární a frontonazální (obr. 1).
VYŠETŘENÍ A DIFERENCIÁLNÍ DIAGNOSTIKA
Většina IH je diagnostikována klinicky na základě klinického obrazu, anamnézy a průběhu. Anamnesticky se zjišťují průběh gravidity, perinatální období a vývoj IH. Je třeba diferenciálně diagnosticky odlišit prekurzorové léze IH od kapilární malformace, naevus anemicus, naevus hypochromicus a traumatu. Hemangiomy jsou obvykle jasně červené vystouplé útvary, při doteku teplejší než okolní kůže. Zpočátku jsou v úrovni kůže, avšak následně se mohou plasticky měnit a vystupovat nad úroveň okolní kůže. S postupující stagnací a involucí sytě červená barva ustupuje, hemangiom bledne a objevují se šedobělavé ostrůvky, které posléze převažují. Tyto ostrůvky začínají později splývat a pokud hemangiom involuje úplně, přemění se zcela v normální kůži. Naprostá většina IH postihuje kůži, ale mohou přestupovat na sliznice (rty, nosní otvory, perianální oblast). V některých lokalizacích je potřeba indikovat zobrazovací metody k posouzení rozsahu hemangiomu a jeho vztahu k okolí: velké podkožní hemangiomy, především v oblasti parotis, subglotické a paratracheální oblasti – ultrazvuk (UZ), případně magnetická rezonance (MR). Středočarové hemangiomy na hlavě (čelo, vlasatá část) je vhodné vyšetřit u malých kojenců ultrazvukem přes neuzavřenou fontanelu. V situacích nejasného nálezu nebo podezření na intrakraniální šíření je nezbytná magnetická rezonance. Při postižení orbit, hlubokých struktur krku je magnetická rezonance jednoznačně indikovaná. V některých situacích je potřeba vyšetření dalších orgánů, např. UZ vyšetření jater při větším počtu kožních lézí (5 až 10 lézí), jakož i u hemangiomatóz (více než 10 kožních lézí), echokardiografické vyšetření u dětí s mnohočetnými a objemnými nádory pro možnost oběhového selhání či nedostatečnosti. U těchto dětí by měl být proveden také screening na hypotyreózu. Segmentální hemangiomy na krku a na obličeji mohou být asociovány s cerebrovaskulárními nebo kardiovaskulárními anomáliemi, proto je u těchto lokalizací prováděna MRI mozku, bez ohledu, zda jsou, nebo nejsou přítomny známky PHACE syndromu. Někdy mohou na přítomnost hemangiomatózy upozornit i klinické příznaky: stridor, kašel, ztráta hlasu u hemangiomů, krvácení do gastrointestinálního traktu, srdeční selhání, dechové obtíže či hypothyreóza [13, 14].
Většinu hemangiomů lze snadno odlišit od vaskulárních malformací podle tří základních kritérií:
- věku manifestace, kdy malformace jsou patrné již při narození, kdežto IH mají většinou jen drobné prekurzorové léze;
- proliferace, která u malformací chybí;
- regrese, která je pro IH typická a u malformací k ní nedochází.
Kromě cévních anomálií mohou hemangiomy připomínat i jiné závažné nádorové afekce: nádory měkkých tkání novorozenců a kojenců (např. rabdomyosarkomy očnice), kožní metastázy neuroblastomu nebo jiné závažné nádorové procesy postihující kůži [15].
Většina hemangiomů je schopna spontánní involuce bez nutnosti jakéhokoliv léčebného zákroku, nicméně 10–15 % dokáže způsobovat závažné komplikace, které vyžadují léčbu, podle některých studií se uvádí jejich výskyt až ve 22 % případů.
Komplikace u IH lze rozdělit do tří skupin: ulcerace, postižení funkčních schopností (často život ohrožujících) a kosmeticky nepřijatelný rozsah. Klasifikace IH podle rizika a komplikací je uvedena v tabulce 4.
Tab. 4. Komplikace a indikace neodkladné léčby hemangiomů. 
- Ulcerace – nejčastější komplikace IH, vznikne až v 10 % všech IH a až 25 % z nich vyžaduje léčbu. Predilekční místa jsou dolní ret, krk, anogenitální oblast. Častěji se ulcerace objevují u velkých segmentálních IH, vznikají obvykle v průběhu růstové fáze (med. 4 měsíce věku) a může se objevit i krvácení z povrchu IH, sekundární infekce a bolest.
- Postižení funkčních schopností – periorbitální lokalizace může postihnout zrakové funkce až se vznikem amblyopie, astigmatismu nebo strabismu. Nazální IH mohou působit obstrukci dýchacích cest, velké hemangiomy na krku mohou omezovat pohyblivost krku a je možný i vznik tortikolis. Kojenci s mnohočetnými hemangiomy (nad 5 – mnohočetné hemangiomy, nad 10 – hemangiomatózy) by měli podstoupit vyšetření jater ultrazvukem k vyloučení event. viscerálních hemangiomů. Rozsáhlé a objemné IH mohou způsobovat městnání v srdečním oběhu, stejně tak mohou být přítomny známky dysfunkce štítné žlázy.
- Kosmeticky závažné, někdy znetvořující hemangiomy – postihující jakoukoliv oblast na obličeji, především nos, rty, čelo, tváře, ušní boltce. Asi 50 % z nich zanechá závažné následky – jizvy, změny kožního povrchu nebo teleangiektázie. Tito jedinci mají významně zhoršenou kvalitu života. Podle posledních studií trpí ztrátou sebevědomí nejvíce děti ve věku 3–7 let [16].
LÉČBA HEMANGIOMŮ
Problematika léčby IH vyžaduje komplexní přístup a je vždy individuální. U většiny hemangiomů není nutná žádná terapie, jde především o drobné hemangiomy mimo viditelné oblasti (hlavně mimo obličej), které spontánně involují, většinou v průběhu druhého roku života. Superficiální IH většinou nezanechají reziduum, ovšem smíšené nebo hluboké nemusí zcela vymizet [17]. Hemangiomy se strukturovaným povrchem (cobblestone) mohou rovněž zanechat závažné reziduum [33].
Strategie aktivní observace – většina hemangiomů nevyžaduje žádnou léčebnou intervenci. Jedná se o IH malé rozsahem a nezávažné lokalizací.
Rizikové lokalizace malých hemangiomů, které vyžadují pečlivou monitoraci, protože jsou sice velikostí nevýznamné, ale jsou umístěny nepříznivě a při dalším růstu mohou působit závažné komplikace – oblast rtů, víček, nosních průduchů. Tyto IH mohou ulcerovat, krvácet – krk, případně ohrožovat pozdější fyziologický vývoj (mléčná žláza). V těchto situacích se děti sledují v častějších intervalech. Obvyklé doporučení je, že intervaly vyšetření (v týdnech) se rovnají věku dítěte (v měsících). Fotodokumentace jednoznačně může dokumentovat případný růst a podpořit rozhodování o zahájení terapie.
Absolutní indikace k terapii IH zahrnují:
- Potencionálně letální hemangiomy nebo hemangiomy, které mohou vést k postižení vitálních funkcí (obr. 6A–C; 9A–C).
- Ulcerované hemangiomy doprovázené bolestí, které neodpovídají na léčbu metodami moderního krytí.
- Hemangiomy s rizikem jizvení a znetvoření (obr. 8A–B; 10A–E) [18].
Obr. 6A. Hemangiom na kořeni nosu. Fig. 6A. Hemangioma on the root of nose. 
Obr. 6B. Hemangiom na kořeni nosu po 2 měsících léčby. Fig. 6B. Hemangioma on the root of nose after two months treatment. 
Obr. 6C. Hemangiom na kořeni nosu po 5 měsících léčby. Fig. 6C. Hemangioma on the root of nose after five months treatment. 
Obr. 6. Reziduum neléčeného hemangiomu u 2letého dítěte. Fig. 7. Residue of untreated hemangioma in two years old child. 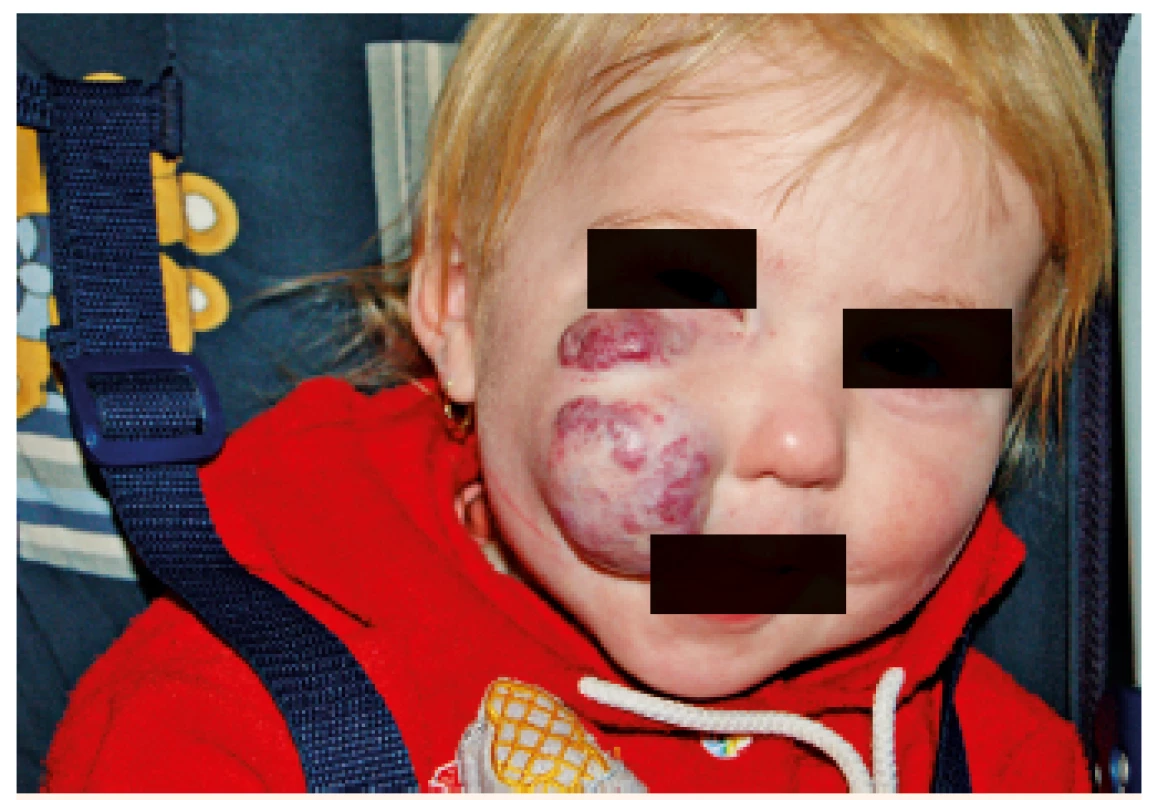
Obr. 8A. Smíšený hemangiom na hrudníku. Fig. 8A. Mixed hemangioma on the chest. 
Obr. 8B. Smíšený hemangiom na hrudníku po 6 měsících léčby. Fig. 8B. Mixed hemangioma on the chest after six months treatment. 
Obr. 9A. Hemangiom smíšený na křídle nosním. Fig. 9A. Mixed hemangioma on nasal wing. 
Obr. 9B. Hemangiom smíšený na křídle nosním. Fig. 9B. Mixed hemangioma on nasal wing. 
Obr. 9C. Hemangiom smíšený na křídle nosním po 3 měsících léčby. Fig. 9C. Mixed hemangioma on nasal wings after three months treatment. 
Obr. 9D. Hemangiom smíšený na křídle nosním po 8 měsících léčby. Fig. 9D. Mixed hemangioma on nasal wings after eight months treatment. 
Obr. 10A. Hemangiom superficiální na obličeji - měsíční kojenec. Fig. 10A. Superficial hemangioma on face in a month old infant. 
Obr. 10B. Hemangiom superficiální na obličeji po 6 týdnech léčby. Fig. 10B. Superficial hemangioma on face after six weeks treatment. 
Obr. 10C. Hemangiom superficiální na obličeji – po třech měsích léčby. Fig. 10C. Superficial hemangioma on face after three months treatment. 
Obr. 10D. Hemangiom superficiální na obličeji – po pěti měsících léčby. Fig. 10D. Superficial hemangioma on face after five months treatment. 
Obr. 10E. Hemangiom superficiální na obličeji – po osmi měsících léčby. Fig. 10E. Superficial hemangioma on face after eight months treatment. 
SYSTÉMOVÁ TERAPIE
V minulosti bylo v léčbě hemangiomů používáno mnoho léčebných prostředků. Šlo především o kortikoidy podávané po dobu několika týdnů až měsíců, často ve vysokých dávkách. Léčba kortikoidy byla často doprovázena nežádoucími účinky a účinnost byla dosažena asi jen u třetiny pacientů. Dále se využívaly interferon alfa, někdy i cytostatika (vinkristin), později sirolimus. V roce 2008 publikovala Cristine Labreze překvapivě účinnou terapii hemangiomů propranololem. Po dalším klinickém zkoušení propranololu v léčbě IH, jakož i po testování léku v mezinárodních klinických studiích, se propranolol stal první volbou ve všech situacích, kdy byl přirozený vývoj hemangiomů komplikován při postižení životně důležitých funkcí, při ulceracích a u rozsáhlých, kosmeticky závažných lézí.
Propranolol není novým lékem v klinické praxi, jako β-blokátor se používá při léčbě kardiomyopatie, hypertyroidismu nebo migréně. Podávat se začal již v roce 1964 a v uvedených indikacích se dávky pohybovaly mezi 6–8 mg/kg/den. Při jeho použití pro léčbu kardiomyopatie bylo právě poprvé pozorováno, že dokáže příznivě ovlivnit vývoj hemangiomu. C. Labreze svoji zkušenost prezentovala na 9 dětech, které se podařilo, díky perorální aplikací propranololu, vyléčit [19]. Následně bylo publikováno množství prací, které tento první, náhodný terapeutický efekt potvrdily [20, 21]. Retrospektivní komparativní studie prokázaly, že propranolol v porovnání s kortikoidy je efektivnější, lépe se toleruje, chirurgické odstranění reziduí je nižší a spektrum vedlejších projevů léčby je užší a významně nižší. Propranolol vykazuje rychlejší terapeutický efekt [22, 23].
Mechanismus účinku propranololu
Jsou známy tři podstatné patofyziologické kroky, které vysvětlují příznivý účinek propranololu na infantilní hemangiomy: vazokonstrikce je prvním patrným efektem po zahájení terapie, klinicky se jeví jako vyblednutí hemangiomu, druhý nejpodstatnější krok je ten, že je zablokována produkce VEGF, které podporují novotvorbu cévních kapilár, a posledním krokem je podpora přirozené smrti buněk drobných kapilár. Klinickým výsledkem je přestavba progredujícícho hemangiomu na vazivové reziduum, které v porovnání s přirozeným vývojem hemangiomu je nepoměrně menší, méně výrazné.
První zprávy o použití propranololu uvádějí různé dávky v rozmezí od 1 do 4 mg/kg a den podávané ve 2–3 denních dávkách v celkové době léčby od 2 měsíců až do jednoho roku. Posléze provedené randomizované studie doložily, že optimální dávka je 2–3 mg/kg a den ve dvou denních dávkách po dobu 6 měsíců. Při těchto dávkách je incidence vedlejších účinků terapie minimální a v případě, že se objeví, jsou nezávažné a je možné je dobře zvládnout.
Komplikace a vedlejší projevy léčby
Poruchy spánku, somnolence a podrážděnost jsou nejčastějšími vedlejšími účinky vyskytující se u 15–25 % dětí. Propranolol je vysoce lipofilní látka, která může dobře prostupovat přes hematoencefalickou bariéru, a proto nelze vyloučit možné účinky na rozvoj neurologických funkcí a kognitivní schopnosti, ale žádná studie toto neprokázala. Ostatní vedlejší projevy jsou velmi vzácné (bronchospazmus, snížená tepová frekvence, průjmy, nebo zácpa, hypoglykémie) (tab. 5).
Tab. 5. Komplikace při léčbě propranololem. 
Terapeutická doporučení
Od roku 2008 probíhala řada mezinárodních klinických sledování s propranololem při léčbě IH. V rámci klinických studií došlo k jasné definici používané denní dávky a délky léčby a následně k registraci léku Hemangiol®(propranolol) v Evropě i v USA. Hemangiol®(propranolol) je jediný lék, který má schválenu indikaci v léčbě proliferujícího infantilního hemangiomu. V roce 2014 udělila EMA (European Medicines Agency) tomuto léku PUMA certifikaci (paediatric-use marketing authorisation), specifikující danou indikaci léčby a danou formu léku vhodnou pro pediatrickou populaci. Tento lék je od května 2017 kategorizován i v České republice (stanovena cena a úhrada SÚKLem). Pro lék Hemangiol® je k dispozici edukační brožura (schválená SÚKLem) pro management případných nežádoucích účinků spojených s léčbou. LP Hemangiol® proto umožňuje standardizovanou léčbu infantilních hemangiomů. Při používání individuálně připravovaných magistraliter léků se uvádí až trojnásobně vyšší chybovost při podávání [34]. V České republice je léčba hrazena ve 4 centrech (FN Motol, FN Královské Vinohrady, FN Brno a FN Ostrava).
Vstupní vyšetření před léčbou propranololem
Cílem je odhalit případné kontraindikace terapie betablokátory. Vstupní EKG a kardiologické vyšetření je vhodné, i když někteří autoři nutnost těchto vyšetření zpochybňují a indikují jej jen u těch, kteří mají v anamnéze bradykardii nebo arytmie. Tyto ale mohou u kojenců probíhat skrytě, proto je kardiologické vyšetření vhodné u všech dětí s uvažovanou systémovou léčbou. V případě nejasných nálezů nebo podezření na anatomickou nebo funkční vadu je indikované echokardiografické vyšetření. U všech dětí je nutné vyšetření klidové tepové frekvence [25].
Věk vhodný pro zahájení léčby propranololem
Nejpodstatnějším faktorem, který dokáže zastavit růst hemangiomu a navodit involuci, je blokáda VEGF a ostatních faktorů, které podporují novotvorbu cévních kapilár, tzn. růst hemangiomu. Tato proliferativní fáze dosahuje nejvyšší rychlosti mezi 1. až 3. měsícem věku, pak zpomaluje a na konci 5. měsíce dosahuje 80 % hemangiomů své finální velikosti a tvaru. Proto prvních 5 měsíců života je nejvhodnějším okamžikem k terapii. Pozdější zahájení léčby se může uplatnit snad jen u hlubokých a smíšených hemangiomů, které dosahují fáze stagnace později. Nasazení propranololu ve druhé polovině prvního roku života kojence je schopno navodit spíše jen vazokonstrikci, ale nespustí proces involuce.
Iniciace terapie a dávkování
Cílové dávky lze dosáhnout dvěma režimy – při několikadenní hospitalizaci, kde lze dosáhnout cílové dávky v průběhu 3 až 4 dnů, nebo ambulantně, kdy se dávka zvyšuje vždy o jeden mg/kg/den v týdenních intervalech. Po zahájení podávání propranololu se obvykle objeví mírné, asymptomatické snížení krevního tlaku a tepové frekvence, které trvá většinou kolem 3 dnů a v průběhu další terapie není již patrné. Z těchto důvodů je nutná monitorace tepové frekvence a krevního tlaku za 1 a 2 hodiny po podání propranololu a při každém dalším navýšení dávky. V případě bradykardie nebo hypotenze je vhodné dávku nenavyšovat, případně ji naopak snížit a potřebné navýšení dávky odložit až do úpravy sledovaných parametrů. Hypoglykémie a hypoglykemické křeče jsou nejzávažnější komplikací při této léčbě. Jsou extrémně vzácné a opatrnost je nezbytná především u nedonošených kojenců a u těch, kteří mají sklony k hypoglykémii. Jako nejúčinnější prevence se jeví podávání léku v souvislosti s jídlem a v případě, že dítě opakovaně zvrací, má průjmy nebo jiné poruchy vstřebávání potravy a zažívání, je vhodné terapii přerušit (tab. 6) [26].
Tab. 6. Kontraindikace terapie IH propranololem. 
V některých situacích je hospitalizace nutná, protože v průběhu eskalace dávek se mohou objevit některé nepředpokládané komplikace. Jde především o tyto situace:
- Všechny děti mladší 3 měsíců (věk korigované prematurity) a kojenci pod 3,5 kg pro nutnou monitoraci krevního tlaku a tepové frekvence v průběhu eskalace dávky.
- Kojenci s IH, které ohrožují vitální funkce – subglotické, útlak dýchacích cest.
- Kojenci s přidruženými závažnými chorobami kardiovaskulárního nebo respiračního systému či poruchami glukózového metabolismu.
- Děti ze špatných sociálních poměrů.
Počet dávek byl ve většině studií 3x denně, ale farmakokinetické studie ukázaly, že při podávání 2x denně je plazmatická hladina propranololu vyšší po jednotlivé dávce jen o 12 % v porovnání s hladinou po podání stejné denní dávky rozdělené do 3 dávek. Proto denní aplikace ve dvou dávkách se ukazuje jako stejně účinná, bezpečná a především pohodlnější pro rodiče při dlouhodobém podávání. Časový odstup mezi dvěma podáními by měl být 9 hodin.
Délka terapie propranolem
Standardní doba terapie je 6 měsíců, ale některé situace vyžadují delší trvání léčby, někdy až 12 měsíců. Např. jestliže hemangiom ustupuje pozvolna, ale involuce se ještě nezastavila. Obvyklé množství relapsů po půlroční terapii se pohybuje mezi 17–20 %, zatímco po 12měsíční terapii je to kolem 5 %. Je vhodné upravovat dávku podle hmotnosti dítěte v intervalu jednoho měsíce, častější intervaly jsou vhodné u dětí s nižší hmotností. Léčbu je nezbytné přerušit při respiračních infektech, když se objeví příznaky bronchospazmu, nejčastěji při obstrukční bronchitidě, jsou-li indikována bronchodilatační farmaka. Stejně tak je vhodné léčbu přerušit při gastroinstestinálních obtížích (zvracení, průjmy), kdy by mohlo dojít k poruše vstřebávání a vyššímu sklonu k hypoglykémiím.
Terapii propranololem je vhodné zakončit postupným snižováním denních dávek v průběhu asi 2 týdnů, byť některá doporučení toto pozvolné vysazování nezdůrazňují. Po skončení léčby je vhodné dítě vyšetřit v odstupu 3 a 6 měsíců pro detekci případného relapsu [27, 28].
Lokální léčba propranololem
Po prvních zprávách o příznivém efektu systémově podávaného propranololu na infantilní hemangiomy, ale také po prvních informacích o vedlejších projevech této terapie, se začal propranolol používat lokálně (topicky) v podobě masti nebo gelu. Efekty tohoto způsobu terapie však nebyly hodnoceny žádnou kontrolovanou randomizovanou studií. Tato forma aplikace navíc není zcela bezpečná, protože nelze odhadnout množství léku, které se vstřebá. Jde především o situace, kdy je lokálně aplikovaný propranolol používán na hemangiomy, které jsou např. na krku, hýždích, intergluteu v kožních záhybech. Při této aplikaci se může vstřebat větší, nepředpokládané množství léku a jsou již popsány případy závažné bradykardie právě po topické aplikaci propranololu na kůži. Z farmakokinetického hlediska je závažná i ta skutečnost, že je touto aplikací vyřazen důležitý metabolický krok v játrech, kterým se následně dostává do řečiště vlastní metabolit propranololu. Lokální aplikaci propranololu lze připustit u drobných superficiálních hemangiomů, ovšem za předpokladu pravidelné monitorace. Objeví-li se nekontrolovaná progrese, tak je potřeba okamžitě přejít k systémové terapii [29, 30].
Ostatní terapeutické možnosti
Chirurgická léčba je rezervovaná pro řešení reziduálních lézí po systémové terapii, k řešení závažných komplikací, např. při neztišitelném krvácení, u některých velkých reziduí přetrvávajících u neléčených hemangiomů, nebo u vzácných stopkatých hemangiomů. Jako metoda první volby je vhodná u pendulujících hemangiomů, IH ulcerovaných, bolestivých, utlačujících struktury oka či další části obličeje [18].
Laserová terapie
Fotoselektivní lasery jsou u infantilního hemangiomu jako terapie první linie indikovány jen u velmi drobných lézí, které lze s jistotou jedním ošetřením odstranit, u ostatních slouží k doléčení zbytkových lézí. Laser je vynikající metodou léčby reziduí po systémové terapii, především k léčbě teleangiektázií (obr. 11). K léčbě laserem se nedoporučuje přistupovat bezprostředně po skončené systémové terapii, ale až s dostatečným odstupem, kdy ponecháváme stále čas na možnou přirozenou involuci. Laserová terapie, která se použije iniciálně a pro nedostatečný efekt je pak nahrazena systémovou terapií propranololem, významně snižuje šanci na úplné vyléčení hemangiomu, protože zjizvené cévy neumožní dostatečné působení propranololu a výsledkem jsou často trvalé jizvy a rezidua. Laserovou terapii lze také použít u ulcerovaných, sekundárně změněných hemangiomů [31, 32].
Obr. 7. Obr. 11. Reziduum po léčbě propranololem vhodné k laserové terapii. Fig. 11. Residue after propranolol therapy indicated for laser treatment. 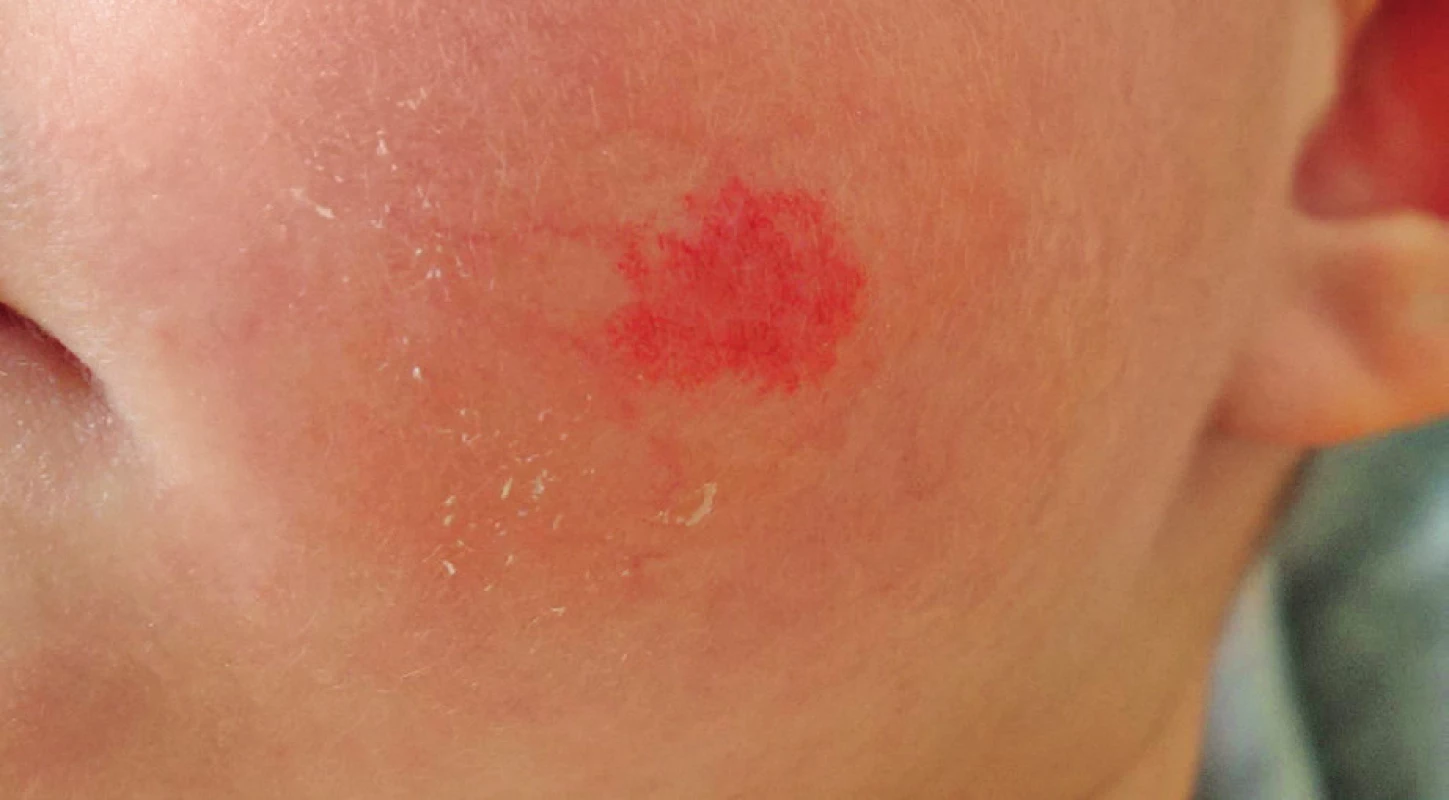
ZÁVĚR
Ačkoliv převažující část infantilních hemangiomů nevyžaduje žádnou terapii, přibližně desetina dětí vyžaduje aktivní a často neodkladnou léčbu. Perorální roztok propranololu se díky své účinnosti a profilu nežádoucích účinků stal v systémové léčbě infantilního hemangiomu lékem první volby. Podstatným faktorem je správná diagnóza hemangiomů a vyloučení všech lézí, které se mohou IH podobat. Dále odhalení všech faktorů, které by mohly léčbu betablokátory kontraindikovat a v neposlední řadě i potřebná monitorace v průběhu titrace pro dosažení cílové terapeutické dávky, jakož i sledování pacienta v průběhu celé léčby. Z uvedených důvodů by měla léčba probíhat na pracovištích, která disponují všemi potřebnými specialisty, konkrétně dětským dermatologem, dětským onkologem, kardiologem, radiologem, pediatrem a chirurgem s potřebnou specializací.
Podpořeno MZ ČR – RVO, FN Motol 00064203.
MUDr. Josef Mališ
Klinika dětské hematologie a onkologie 2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: josef.malis@fnmotol.cz
Zdroje
1. Munden A, Butschek R, Tom WL, et al. Prospective study of infantile haemangiomas: incidence, clinical characteristics and association with placental anomalies. Br J Dermatol 2014; 170 : 907–913.
2. Goelz R, Poets CF. Incidence and treatment of infantile haemangioma in preterm infants. Arch Dis Child Fetal Neonatal Ed 2015; 100: F85–91.
3. International Society for the Study of Vascular Anomalies. ISSVA classification of vascular anomalies. 2014. Available at: issva.org/classification. Accessed April 2015.
4. Drolet BA, Frieden IJ. Characteristics of infantile hemangiomas as clues to pathogenesis: does hypoxia connect the dots. Arch Dermatol 2010; 146 : 1295–1299.
5. Baselga E, Roe E, Coulie J, et al. Risk factors for degree and type of sequelae after involution of untreated hemangiomas of infancy. JAMA Dermatol 2016 Nov 1; 152 (11): 1239–1243.
6. Leaute-Labreze C, Prey S, Ezzedine K. Infantile haemangioma: Part I. Pathophysiology, epidemiology, clinical features, life cycle and associated structural abnormalities. J Eur Acad Dermatol Venereol 2011; 25 : 1245–1260.
7. Horii KA, Drolet BA, Frieden IJ, et al. Prospective study of the frequency of hepatic hemangiomas in infants with multiple cutaneous infantile hemangiomas. Pediatr Dermatol 2011; 28 : 245–253.
8. Vredenborg AD, Janmohamed SR, de Laat PCJ, et al. Multiple cutaneous infantile haemangiomas and the risk of internal haemangioma. Br J Dermatol 2013; 169 : 188–191.
9. Metry DW, Haggstrom AN, Drolet BA, et al. A prospective study of PHACE syndrome in infantile hemangiomas: demographic features, clinical findings, and complications. Am J Med Genet A 2006; 140 : 975–986.
10. Metry DW, Dowd CF, Barkovich AJ, Frieden IJ. The many faces of PHACE syndrome. J Pediatr 2001; 139 (1): 117–123.
11. Girard C, Bigorre M, Guillot B, Bessis D. PELVIS syndrome. Arch Dermatol 2006; 142 (7): 884–888.
12. Haggstrom AN, Drolet BA, Baselga E, et al. Prospective study of infantile hemangomas: clinical characteristics predicting complications and treatment. Pediatrics 2006; 118 : 882–887.
13. Horii KA, Drolet BA, Frieden IJ, et al. Prospective study of the frequency of hepatic hemangiomas in infants with multiple cutaneous infantile hemangiomas. Pediatr Dermatol 2011; 28 : 245–253.
14. Vredenborg AD, Janmohamed SR, de Laat PCJ, et al. Multiple cutaneous infantile haemangiomas and the risk of internal haemangioma. Br J Dermatol 2013; 169 : 188–191.
15. Krenova Z, Kren L, Blatny J, et al. Extraosseal Ewing sarcoma as a rare cause of the blueberry muffin baby syndrome: a case report and the review of the literature. Am J Dermatopathol 2011 Oct; 33 (7): 733–735.
16. Chamlin SL,Mancini AJ, Lai JS, et al. Development and validation of a quality-of-life instrument for infantile hemangioma. J Invest Dermatol 2015; 135 (6): 1533–1539.
17. Léaute-Labrèze C, Boccara O. Safety of oral Propranolol for the treatment of infantile hemangioma: A systematic review. Pediatrics 2016 Oct; 138 (4): 1–19.
18. Baselga E, et al. Spanish consensus on infantile haemangioma. An Pediatr 2016; 85 : 256–265.
19. Léauté-Labrèze C. Propranolol for severe hemangiomas of infancy. N Engl J Med 2008; 358 (24): 2649–2651.
20. Hermans DJ, Bauland CG, Zweegers J, et al. Propranolol in a case series of 174 patients with complicated infantile haemangioma: indications, safety and future directions. Br J Dermatol 2013; 168 : 837–843.
21. Mališ J. Hemangiomy kojenců. Čes Dermatovenerol 2014; 4 (1): 8–14.
22. Puttgen KB. Multifocal infantile hepatic hemangiomas—imaging strategy and response to treatment after propranolol and steroids including review of the literature. Eur J Pediatr 2012; 171 : 1023–1028.
23. Xu SQ, Jia RB, Zhang W, et al. Beta-blockers versus corticosteroids in the treatment of infantile hemangioma: an evidence-based systematic review. World J Pediatr 2013 Aug; 9 (3): 221–229.
24. Mališ J, Stará V, et al. Betablokátory v léčbě hemangiomů dětského věku. Čes-slov Pediat 2014; 69 (5): 274–282.
25. Blei F, McElhinney DB, Guarini A, Presti S. Cardiac screening in infants with infantile hemangiomas before propranolol treatment. Pediatr Dermatol 2014; 31 (4): 465–470.
26. Léauté-Labrèze C, Hoeger P, et al. A randomized controlled trial of oral propranolol in infantile hemangioma. N Engl J Med 2015; 372 : 735–746.
27. Marqueling AL, Oza V, Frieden IJ, Puttgen KB. Propranolol and infantile hemangiomas four years later: a systematic review. Pediatr Dermatol 2013; 30 : 182–191.
28. Léauté-Labrèze C, Harper JI, Hoeger PH. Infantile haemangioma. Published: 12 January 2017. DOI: http://dx.doi.org/10.1016/S0140-6736(16)00645-0
29. McMahon P, Oza V, Frieden IJ. Topical timolol for infantile hemangiomas: putting a note of caution in „cautiously optimistic“. Pediatr Dermatol 2012; 29 : 127–130.
30. Qiu Y, Ma G, Yang J, et al. Imiquimod 5% cream versus timolol 0.5% ophthalmic solution for treating superfi cial proliferating infantile haemangiomas: a retrospective study. Clin Exp Dermatol 2013; 38 : 845–850.
31. Chinnadurai S, Sathe NA, Surawicz T. Laser treatment of infantile hemangioma: A systematic review. Lasers Surg Med 2016 Mar; 48 (3): 221–233. doi: 10.1002/lsm.22455.
32. Šmucler R. Cévní anomálie u dětí. Betablokátory? Kdy? Lasery? Jaké? Referátový výběr z dermatovenerologie. Remedia 2015; 57 (6): 18–22. ISSN: 1213 9106.
33. Baselga E, Roe E, Coulie J, et al. Risk Factors for Degree and Type of Sequelae After Involution of Untreated Hemangiomas of Infancy. JAMA Dermatol. doi:10.1001/jamadermatol.2016.2905 Published online August 17, 2016.
34. Kurta AO, Dai D, Armbrecht ES, Siegfried EC: Prescribing propranolol for infantile hemangioma: Assessment of dosing errors. J Am Acad Dermatol 2017 May; 76 (5): 999-1000.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Seriál o EET
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2017 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Editorial: Rostoucí skelet – oblast zájmu do budoucna
- Osteogenesis imperfecta – současný pohled na problematiku
- Liečebné stratégie na optimalizáciu kostného metabolizmu pri mentálnej anorexii
- Hypofosfatázie – onemocnění skeletu, na které musíme myslet
- Sezónna variabilita deficitu vitamínu D u detí s nešpecifickým zápalovým ochorením čreva a inými chronickými ochoreniami
- Temperament v raném dětství a jeho popis pomocí IBQR VSF
-
Infantilní hemangiomy.
Současné léčebné postupy - Tolerogenní dendritické buňky a jejich využití v léčbě imunopatologických stavů
- Kvalita života dětských hemofiliků v České republice – zkušenosti jednoho centra
- Následná dlouhodobá intenzivní péče pro děti ve Vojenské nemocnici Olomouc
- Seriál o EET
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Osteogenesis imperfecta – současný pohled na problematiku
-
Infantilní hemangiomy.
Současné léčebné postupy - Hypofosfatázie – onemocnění skeletu, na které musíme myslet
- Následná dlouhodobá intenzivní péče pro děti ve Vojenské nemocnici Olomouc
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





