-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPraktický přístup k enterální výživě v pediatrii – doporučení ESPGHAN
Paediatric enteral nutrition: practical approach based on ESPGHAN recommendations
Enteral nutrition (EN) involves both delivery of nutrients via feeding tubes and the provision of specialised oral nutrition suplements. Enteral nutrition is indicated in patients with at least a partially functioning digestive tract, when oral intake is inadequate or intake of normal food is inappropriate to meet the patients needs. Whenever possible, physiological route of nutrition is of recommendation: intragastric is preferred to postpyloric delivery of nutrients, intermittent feeding is preferred to continuous. An anticipated duration of enteral nutrition exceeding 4–6 weeks is an indication for gastrostomy or enterostomy. Percutaneous endoscopic gastrostomy is the first option.
Indication and monitoring of EN should be guided by multidisciplinary nutrition support team to prevent EN-associated complications.Key words:
enteral nutrition, indications, complications, pediatric patient
Autoři: P. Szitányi; P. Frühauf
Působiště autorů: Klinika dětského a dorostového lékařství 1. LF UK a VFN, Praha přednosta prof. MUDr. J. Zeman, DrSc.
Vyšlo v časopise: Čes-slov Pediat 2011; 66 (4): 235-242.
Kategorie: Stanovisko odborné společnosti/pracovní skupiny
Souhrn
Enterální výživa (EV) z definice představuje jak podávání živin výživovou sondou, tak zajištění speciálních nutričních přípravků podávaných orálně. EV je indikovaná u pacientů s alespoň částečně funkčním GIT, u kterých není možné zabezpečit adekvátní perorální příjem a/nebo normální strava nestačí k pokrytí potřeb pacienta. Pokud možno doporučuje se fyziologická cesta výživy: intragastrické podávání živin upřednostňujeme před postpylorickým, intermitentní (bolusové) před kontinuálním podáváním živin. Při EV plánované na dobu delší než 4–6 týdnů je indikovaná gastrostomie nebo enterostomie. Perkutánní endoskopická gastrostomie (PEG) je metodou první volby.
Indikace a monitorování EV by měly být vedené multidisciplinárním nutričním týmem s dostatečnými zkušenostmi k prevenci komplikací EV.Klíčová slova:
enterální výživa, indikace, komplikace, pediatrický pacientÚVOD
Dětští pacienti představují značně vulnerabilní populaci se specifickými výživovými požadavky. Malnutrice spojená s onemocněními má závažné krátko - i dlouhodobé důsledky. Navazující nutriční intervence je závislá na věku pacienta, jeho klinickém stavu, gastrointestinálních funkcích (digesce, absorpce), na možnosti perorálního příjmu, na samotné proveditelnosti jakékoliv intervence, dietních zvycích a také na nákladech.
Následující článek vychází z doporučení nutričního výboru ESPGHAN publikováných v loňském roce.
DEFINICE A INDIKACE ENTERÁLNÍ VÝŽIVY
Definice EV
Enterální výživa je podávání tekuté výživy sondou a zajištění speciálních nutričních přípravků podávaných orálně.
Indikace EV
EV je indikována všude tam, kde je alespoň částečně funkční GIT a z jakéhokoliv důvodu je nedostatečný přívod živin perorálně (energeticky, kvantitativně, kvalitativně), tam kde pacient nemůže být živen normální stravou, a v neposlední řadě i tam, kde chceme nutričně definovanou stravou korigovat malnutrici, zabránit malnutrici, nebo zlepšit rekonvalescenci (schéma 1).
Schéma 1. Rozhodovací strom enterální výživy. EV – enterální výživa 
Navíc je EV indikována k léčbě některých nemocí (např. Crohnova nemoc, intolerance živin).
Výhodami EV ve srovnání s parenterální výživou (PV) jsou zachovávání GIT funkcí, jednodušší technické provedení, vyšší bezpečnost a prevence závažných komplikací spojených s PV (sepse, jaterní postižení) a v neposlední řadě 2–4krát nižší náklady.
K pokrytí nutričních potřeb je však v některých případech (onkologičtí pacienti, JIP,...) nutná kombinace PV a EV.
Tab. 1. Kritéria enterální nutriční podpory. 
Tab. 2. Klinické stavy vyžadující enterální výživu. 
KONTRAINDIKACE ENTERÁLNÍ VÝŽIVY
Absolutní: paralytický nebo mechanický ileus, střevní obstrukce, perforace a nekrotizující enterokolitida (NEC).
Relativní: střevní dysmotilita, toxické megakolon, peritonitida, GIT krvácení, střevní píštěl s významnými odpady, významné zvracení, intraktabilní průjem.
EV má být podávaná v maximálních pacientem tolerovaných dávkách, i minimální množství živin (trofické krmení – výživa střeva) stimuluje střevní prokrvení, zabezpečuje uvolňování střevních hormonů a udržuje střevní bariéru.
PŘÍPRAVKY ENTERÁLNÍ VÝŽIVY
Většina přípravků EV je v tekuté formě „ready to use“. Některé přípravky jsou ve formě prášku a smíchají se s vodou, mlékem či pokrmem těsně před samotným krmením. Principiálně je lze rozdělit na „klasické přípravky enterální výživy“ a „suplementaci“. Klasické přípravky mohou svým složením představovat exkluzivní zdroj výživy s pokrytím všech nutričních potřeb pacienta. Jejich složení pokryje minimálně 100 % potřeby dané pro referenční populaci zdravých jedinců dané věkové kategorie. Mohou být podávány sondou nebo perorálně. Přípravky by měly být přizpůsobené věku pacienta a přípravky určené pro dospělé jedince mohou být podávány až od věku 8–10 let.
Izokalorické (1 kcal/ml) přípravky jsou určeny pro většinu našich pacientů. Přípravky s vyšší energetickou denzitou (1,5 kcal/ml) mohou být s výhodou využity u pacientů se zvýšenými energetickými potřebami.
Suplementární EV se podává jako přídavek k normální stravě s účelem navýšit energii nebo jednotlivé nutrienty (bílkoviny, cukry, tuky). Suplementa představují koncentrovaný zdroj energie nebo jednotlivých živin, ale nemusí pokrývat všechny složky balancované výživy.
Polymerní preparáty jsou většinou vyrobeny na bázi bílkoviny kravského mléka, jsou podávány formou orální nebo sondou a pokrývají potřeby většiny pacientů.
Nízkomolekulární preparáty EV jsou proteinové hydrolyzáty a nebo preperáty na bázi aminokyselin. Jejich indikací zůstává potravinová intolerance polymerních preparátů a/nebo v některých případech závažná porucha střevní absorpce. Vzhledem k nelibé chuti jsou většinou podávány formou sondové výživy. Ve srovnání s polymerní výživou je nízkomolekulární výživa dražší a pro její podávání musí být specifická indikace.
Všechny přípravky EV jsou bez obsahu glutenu a většina je i bezlaktózových (nebo s minimálním množstvím laktózy). Izoosmolární preparáty (300–350 mOsm/kg) jsou preferovány před vysokoosmolárními (nízkomolekulární preparáty), protože mohou způsobovat u některých pacientů průjem. Vysokoosmolární preparáty se nedoporučují u transpylorického krmení (kontinuální intrajejunální krmení).
Pro většinu pacientů je vhodná výživa s obsahem vlákniny. Ta má současně s jejími fermentačními produkty – mastnými kyselinami s krátkým řetězcem – pozitivní efekt na střevo jako takové, zabraňuje průjmu a zácpě. Doporučuje se kombinace rozpustné a nerozpustné vlákniny.
Preparáty s vysokým obsahem tuku – více než 40 % celkové energie – dovolují snižovat glykemickou nálož podávanou pacientovi a jsou výhodné u pacientů se stresovým metabolismem (inzulinová rezistence, hyperglykémie, septikémie, postoperačně, popáleniny). Navíc snižují produkci CO2, což může být výhodné u pacientů s plicním onemocněním (např. cystická fibróza). Náhrada části tuku mastnými kyselinami se středně dlouhým řetězcem (MCT oleje) je výhodou u pacientů s těžkou formou maldigesce a/nebo malabsorpce tuků (cholestáza, exokrinní pankreatická insuficience, porucha enterohepatální cirkulace žlučových kyselin), u pacientů se syndromem krátkého střeva (short bowel syndrome – SBS) a u ostatních nemocných se sníženou absorpční plochou a s poruchou lymfatického systému střeva. I přes všechny výhody se extenzivní podávání MCT nedoporučuje: pro nižší energetickou denzitu (o 15 % méně energie na gram tuku) a nižší přívod esenciálních mastných kyselin.
Navíc existují také speciální orgánově specifické preparáty. Příkladem jsou přípravky se sníženým množstvím proteinů určené pro pacienty s renálním postižením a s hyperamonémií, přípravky s MCT a vyšším obsahem vitaminů rozpustných v tucích určené pro pacienty s cholestázou, přípravky s MCT pro nemocné se SBS, přípravky s upraveným obsahem cukrů pro pacienty s galaktosémií a preparáty na bázi aminokyselin, nebo s extrémně hydrolyzovanou bílkovinou určené pro pacienty s alergií na bílkovinu kravského mléka nebo s polyvalentní potravinovou alergií. U dospělých pacientů se také používají imunomodulační přípravky s obsahem omega-3 nenasycených mastných kyselin s dlouhým řetězcem, s obsahem glutaminu a argirinu. U dětí se zatím jejich benefit neprokázal.
PODÁVÁNÍ ENTERÁLNÍ VÝŽIVY – SONDOVÁNÍ, STOMICKÉ
Rozhodování o podávání gastrickém či postpylorickém záleží na morfologické a funkční integritě GIT, trvání EV a riziku aspirace (schéma 1, 2).
Schéma 2. Rozhodovací strom pro PEG a sondovou nutriční podporu. 
Preferenčně se doporučuje intragastrické podávání EV. Postpylorický přístup je indikován v případech s rizikem aspirací, u gastroparézy, žaludeční neprůchodnosti, po předchozích žaludečních operacích a nebo u časné postoperační výživy po rozsáhlých břišních operacích. Postpylorické krmení se nedoporučuje u předčasně narozených novorozenců.
Nazogastrická (NG) sonda
NG sondu má zavádět zkušený personál či jiný trénovaný poskytovatel péče. Hrozí riziko zasondování do dýchacích cest a perforace jícnu či plic. Doporučuje se pokaždé ověření pozice NG sondy. Existují různé metody: RTG, auskultace vzduchového proudu, analýza aspirátu... Všechny metody mají svoje nevýhody. Jednoznačná, praktická, lehce proveditelná a navíc důkazy podložená metoda zatím neexistuje.
Nazoduodenální a nazojejunální sonda
Zavádění těchto sond může být obtížné: existují metody zavedení naslepo samospádem, za RTG asistence, endoskopické zavedení. Při zavádění mohou pomoci prokinetika. I u vysoce sofistikovaných metod se úspěšnost zavedení pohybuje mezi 75–80 %.
Komplikace zavádění nazogastrických a nazoenterálních sond jsou uvedené v tabulce 3.
Tab. 3. Komplikace nazogastrických a nazoenterálních výživových sond. 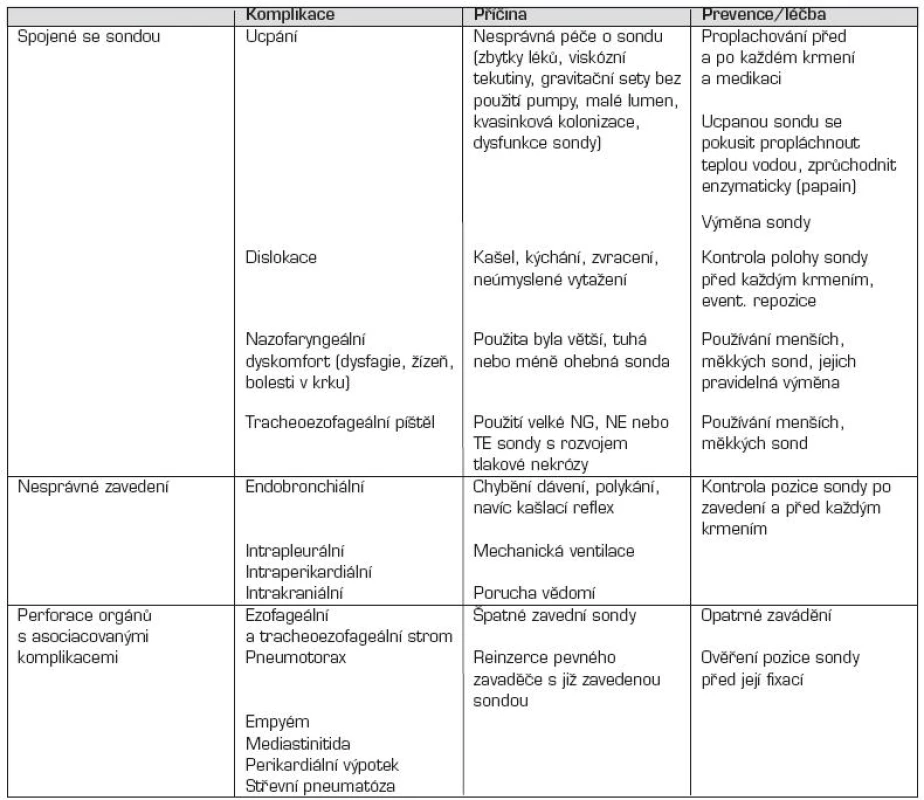
PVC sondy se používají při frekventním zavádění (denní, každý 3.–5. den), jemné silikonové a polyuretanové sondy mohou být ponechány in situ až 8 týdnů.
Perkutánní endoskopická gastrostomie (PEG), enterostomie
Základním obecným pravidlem pro rozhodnutí o zavedení PEG (v některých případech enterostomie) je nutnost dlouhodobé enterální výživy (ve většině případů 4–6 týdnů). Klasická metoda je „pull string“ podle Gauderera. Indikace a kontraindikace jsou uvedeny v tabulkách 4 a 5.
Tab. 4. Indikace perkutánní endoskopické gastrostomie (PEG). 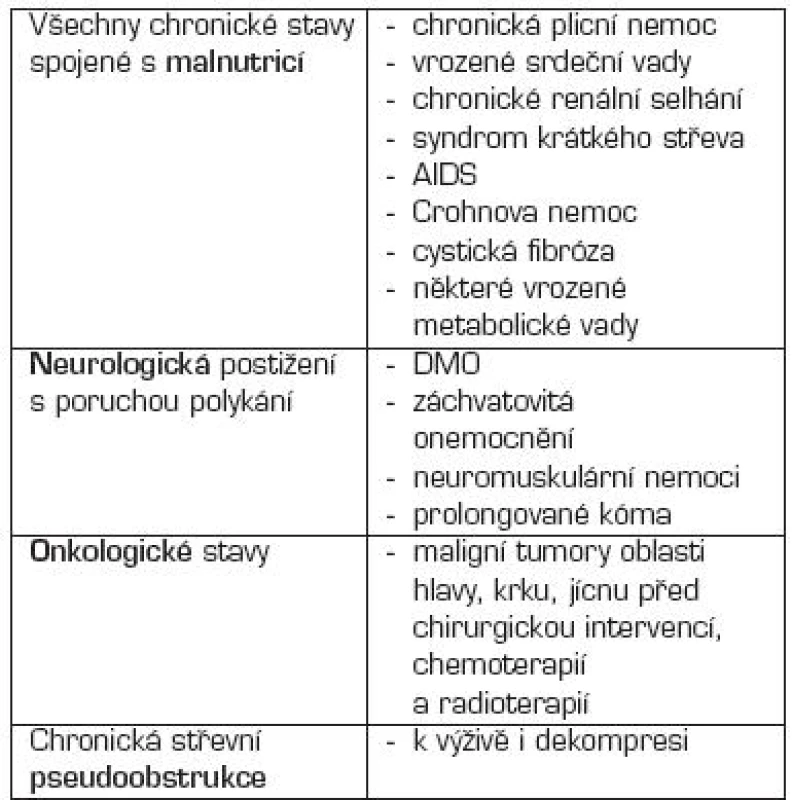
Tab. 5. Kontraindikace perkutánní endoskopické gastrostomie (PEG). 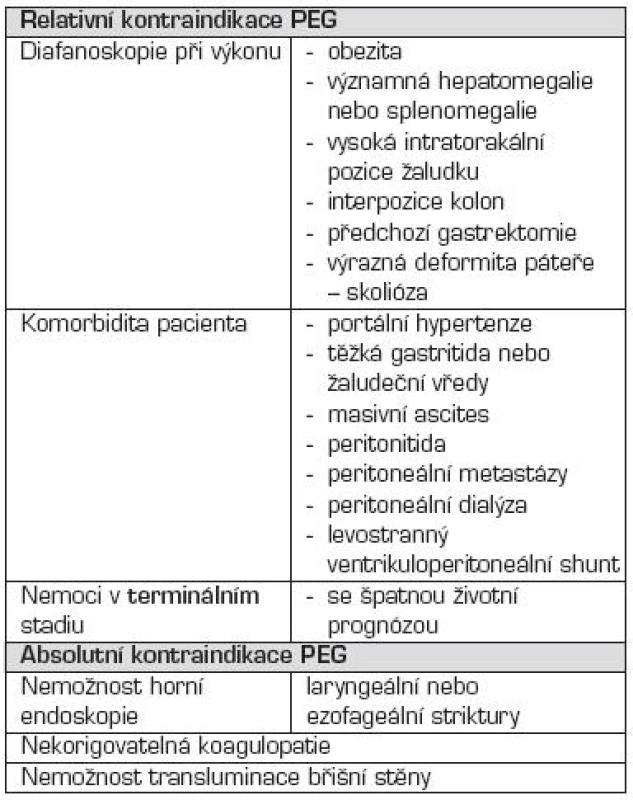
Příprava k PEG a péče po výkonu
Pacienta by měl k PEG indikovat nejlépe nutriční tým daného pracoviště s lékařem s dostatečnou zkušeností v oboru a v endoskopické problematice. Je nutné zvážit prospěch PEG pro pacienta a jeho okolí, kontraindikace, etické otázky a také minimalizovat rizika komplikací správně zvolenou a načasovanou indikací (tab. 4 a 5, schéma 2).
Před zavedením PEG je nutné získat informovaný souhlas zákonného zástupce s výkonem a provést vyšetření základních krevních testů: KO a koagulace (staré maximálně 1 týden). Dalším předpokladem je dostatečné lačnění před výkonem: alespoň 6 hodin tuhá strava, 4 hodiny mateřské mléko a 2 hodiny tekutiny.
Pro ATB profylaxi před zavedením PEG v pediatrii neexistují doporučení založená na důkazech, ale z dat pro dospělé pacienty se doporučuje podání širokospektrých ATB (cefalosporiny, potencované amoxiciliny) k redukci infekce rány.
Doporučení pro podávání výživy a používání PEG po jeho zavedení se různí (u dospělých 1–24 hodin), jako bezpečné se ukázalo používání PEG již za 6 hodin po výkonu a plné zatížení výživou po 24 hodinách.
Po výkonu se doporučuje sterilní chirurgické krytí a první převaz stomie po 24 hodinách. V rámci prevence tlakové ischemie je vhodné druhý den uvolnit fixační destičku tak, aby měla vůli přibližně 5 mm. Před propuštěním do domácí péče je nutné zaškolit rodiče či ošetřovatele v péči a obsluze PEG.
Komplikace spojené se zavedením a používáním PEG (mimo komplikací celkové anestezie a krvácení)
Procento časných komplikací v pediatrii se pohybuje mezi 8–30 % v závislosti na definici komplikací. Časné (do 1–4 týdnů po zavedení PEG) komplikace představují: infekce (lokální, absces, flegmona břišní stěny, peritonitida, sepse), nekrotizující fasciitida, komplikované pneumoperitoneum, lacerace a perforace, intolerance krmení, zaplavání katétru.
Výskyt pozdních komplikací je různý, často jsou spojené se sondou: ucpání, prasknutí sondy, zalomení či vytažení sondy, netěsnost, dislokace – zaplavání, syndrom zarostlého disku, rozšíření vstupu stomie a únik žaludečních šťáv a výživy.
Mezi pozdní lokální komplikace patří bolestivost v místě stomie, iritace kůže, granulační tkáň, lokální krvácení a lokální infekce: purulentní sekrece, celulitida, peristomální absces.
Nejčastější komplikací je infekce rány, s vyšším rizikem u pacientů s ventrikuloperitoneálním shuntem (VPS) a pacientů na peritoneální dialýze (PD). Proto se nedoporučuje zavedení PEG dříve než týden po zavedení VPS a vynechání PD alespoň po dobu 3 dnů s ATB a antimykotickou profylaxí.
Komplikace sondové výživy
Komplikace sondové výživy jsou uvedené v přehledné tabulce 6 i s navrženými preventivními a léčebnými opatřeními.
Tab. 6. Komplikace sondové výživy. 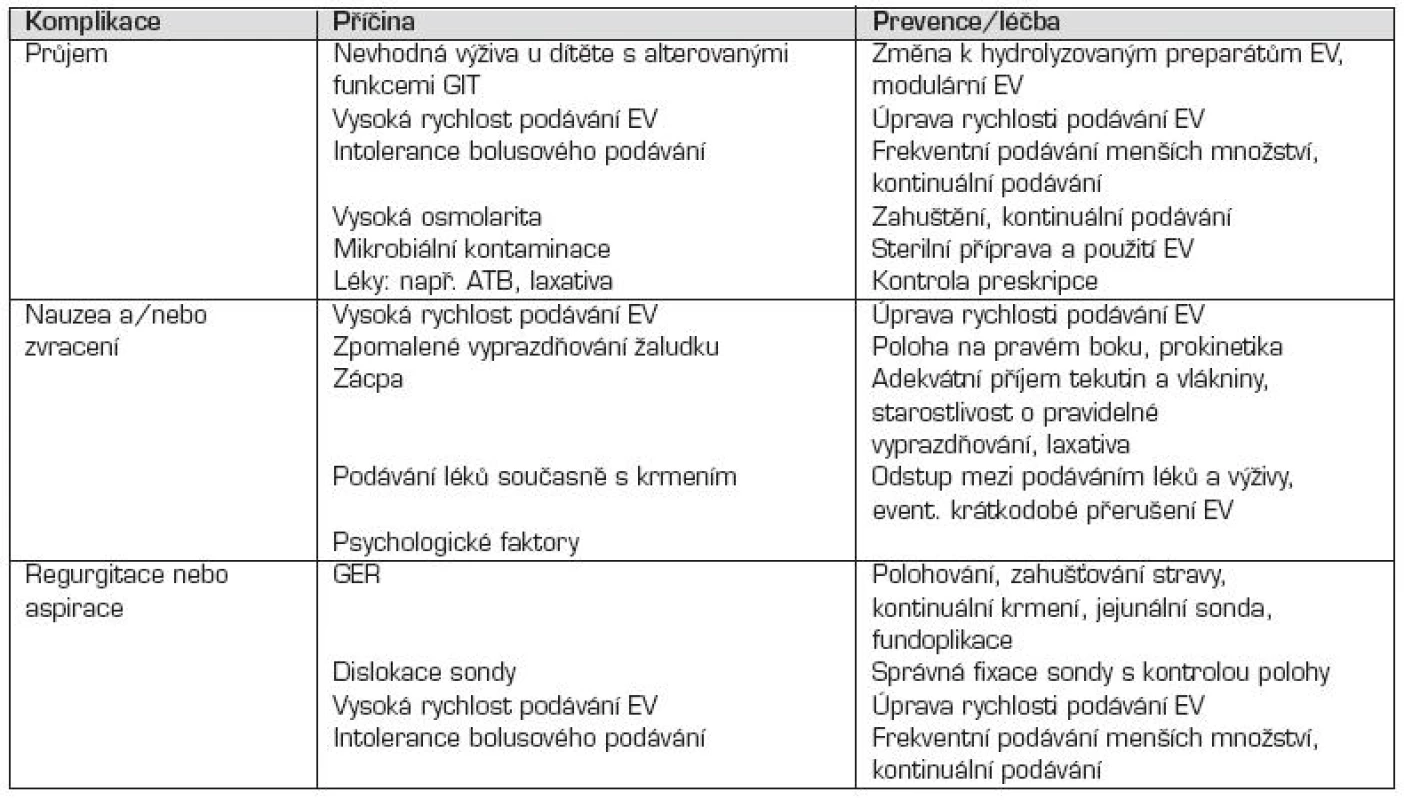
REŽIM PODÁVÁNÍ ENTERÁLNÍ VÝŽIVY
Intermitentní podávání, bolusově, je považováno za standardní a fyziologičtější z hlediska výživy, vede k cyklickému vyplavování GIT hormonů a tím k zlepšení trofiky střeva.
Kontinuální podávání výživy je upřednostňováno při intoleranci bolusového krmení a u některých skupin pacientů (srdeční selhání, závažné průjmy) vede k lepším hmotnostním přírůstkům a zlepšuje celkovou energetickou bilanci. Je však spojeno s poruchou vyprazdňování žlučníku.
REFEEDING SYNDROM
Tento syndrom je charakterizován metabolickými komplikacemi spojenými se zahájením nutriční podpory (enterální nebo parenterální) u podvyživených pacientů. Vysvětlením je redukce buněčné aktivity a orgánových funkcí, navozené dlouhodobým strádáním a spojené s nedostatkem mikronutrientů, minerálů a elektrolytů.
Hlavním zdrojem energie u katabolického pacienta jsou tuk a svaly, celkové zásoby dusíku, fosfátu, hořčíku a draslíku jsou snížené. Náhlá změna a obrat z katabolismu při nutriční podpoře (hlavně excesivní přívod cukrů) vedou k vyplavení inzulinu, následně k masivnímu transportu fosfátu, draslíku a hořčíku do buněk s poklesem jejich sérových hladin. Hypofosfatémie vede klinicky k hemolytické anemii, svalové slabosti a porušené kardiální funkci, což může být příčinou kardiálního selhání, hyperhydratace, arytmií až smrti.
Refeeding syndrom se může vyskytnout u každého podvyživeného pacienta. Vysoké riziko představují stavy s chronickou kachektizací (např. mentální anorexie, onkologičtí pacienti) v prvním týdnu výživové podpory. K snížení rizika rozvoje refeeding syndromu se doporučuje monitorování stavu výživy, hladin elektrolytů, hořčíku, fosfátu a hydratace ještě před zahájením nutriční podpory. Monitorování hladin elektrolytů, hořčíku, vápníku a fosfátu, močoviny, kreatininu se doporučuje po jejím zahájení provádět denně, s kontrolou kardiální kompenzace (pulz, EKG, ECHO). Iniciální enterální nutriční režim má představovat objemově i energeticky 75 % denních potřeb pacienta (pod 7 let 60 kcal/kg tělesné hmotnosti (TH) a den, 7–10 let 50 kcal/kg TH a den, 11–14 let 45 kcal/kg TH a den, 15–18 let 40 kcal/kg TH a den). Při dobré toleranci je možné po 3–5 dnech iniciální režim postupně navyšovat. Výhodné jsou izokalorické preparáty (1 kcal/ml), které při frekventním podávání menších množství minimalizují objemovou zátěž.
Dodávka bílkovin začíná na objemu 0,6–1 g/kg TH a den s postupným navýšením na 1,2–1,5 g/kg TH a den. Dále se doporučuje denní substituce Na 1 mmol/kg, K 4 mmol/kg, Mg 0,6 mmol/kg, fosfátu až 1 mmol/kg intravenózně a až 100 mmol/kg perorálně u dětí nad 5 let. Je navíc nutné kontrolovat a korigovat hypokalcémii. Nezbytné je také substituovat vitaminy a stopové prvky.
U pacientů s omezeným příjmem potravy delším než 5 dní se doporučuje začít nutriční podporu na 50 % jejich denních potřeb po dobu alespoň 2 dní a až následně stoupat do plných dávek při bedlivém monitorování klinických a biochemických parametrů. Největší pozornost zasluhují pacienti s BMI pod 16, s nechtěnou ztrátou hmotnosti více než 15 % za období posledních 3–6 měsíců, s nízkým či nulovým příjmem potravy delším než 10 dní a s nízkými hladinami draslíku, fosfátu a hořčíku iniciálně.
Obecně platí: čím více je pacient podvyživený, tím vyšší je riziko rozvoje refeeding syndromu po zahájení nutriční podpory.
BAKTERIÁLNÍ KONTAMINACE ENTERÁLNÍ VÝŽIVY
Mikrobiologická kontaminace sondové výživy je častá jak v domácích, tak v nemocničních podmínkách. Ve vyšším riziku jsou imunokomprimovaní pacienti a pacienti s potlačovanou aciditou GIT, která představuje přirozenou antibakteriální bariéru. Kultivačně se většinou jedná o koaguláza negativní stafylokoky, streptokoky a gramnegativní bakterie.
Preventivně se doporučuje připravovat enterální výživu se zvýšenou péčí o hygienu, používat „ready to hang“ systémy, nepodávat jednu EV déle než 6 hodin.
INTERAKCE VÝŽIVY S PODÁVANÝMI LÉKY
Před podáváním jakéhokoliv léku sondou určenou pro výživu je vždy potřeba zvážit jiné možnosti jeho podávání. Drcení či naředění léků mění jejich biologickou dostupnost, může vést k ucpání sondy. EV může navíc negativně ovlivnit absorpci, metabolismus či uvolňování léků. Sondou by neměly být podávané veškeré potahované tablety či léky s postupným uvolňováním. Pokud je to nutné, preferujeme tekuté formy a dostatečně rozdrcené tablety ředěné vodou.
Nezbytný je proplach sondy vodou (indiferentní tekutinou) před a po každém podání léků.
DOMÁCÍ ENTERÁLNÍ VÝŽIVA
Cílem domácí enterální výživy (DEV) je zabezpečení efektivní nutriční podpory, podpora autonomie samotného pacienta i jeho rodiny a zlepšení kvality života všech zúčastněných. Optimálně má být DEV organizována multidisciplinárním nutričním týmem sestaveným z ošetřujícího gastroenterologa, dietologa, zdravotní sestry, PLDD a lékárníka.
Rodiče či ošetřovatelé musí projít zácvikem pod vedením nutričního týmu, mají být obeznámeni s důvody DEV, předpokládanou délkou DEV, možnými komplikacemi, možnostmi kontroly polohy sondy, se základy přípravy a podávání EV, s postupy v případě emergence a v neposlední řadě i s telefonním kontaktem na pracovníky nutričního týmu.
Před propuštěním do domácí péče musí být zabezpečena dodávka EV a přístrojové i sondové vybavení. Používání enterálních pump je mnohem výhodnější než bolusové podávání.
MONITOROVÁNÍ PODÁVÁNÍ ENTRÁLNÍ VÝŽIVY
Hlavním cílem monitorování EV je její bezpečné podávání a zajištění optimálního růstu pacienta s možností časného záchytu klinických komplikací a jejich řešení.
Pravidelné sledování pacienta na DEV představuje hodnocení jeho stavu výživy, s následnou úpravou režimu a množství EV. Hodnotíme tělesnou hmotnost, délku/výšku, biochemické a hematologické parametry, celkový klinický stav a subjektivní potíže, GIT funkce, samotnou integritu sondy a možné komplikace s ní spojené. Typ a frekvence monitorování EV závisí na závažnosti stavu pacienta a základní diagnóze.
Došlo: 14. 4. 2011
MUDr. Peter Szitányi, Ph.D.
Klinika dětského a dorostového lékařství
1. LF UK a VFN
Ke Karlovu 2
129 01 Praha 2
e-mail: peter.szitanyi@vfn.cz
Zdroje
1. Braegger C, Decsi T, Dias JA, Hartman C, Kolaček S, Koletzko B, Koletzko S, Mihatsch W, Moreno L, Puntis J, Shamir R, Szajewska H, Turck D, van Goudoever J. Practical approach to paediatric enteral nutrition: A comment by the ESPGHAN Committee on Nutrition. JPGN 2010; 51 : 110–122.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2011 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Jak včas rozpoznat vzácné onemocnění? S diagnostickou rozvahou pomůže accelRare
-
Všechny články tohoto čísla
- Srovnání podílů kojených dětí v Baby-friendly a ostatních porodnicích ČR v letech 2000 až 2006
- Mukopolysacharidóza I – klinické projevy u 24 dětí z České republiky a Slovenska
- Artériová mozgová príhoda v detskom veku
- Praktický přístup k enterální výživě v pediatrii – doporučení ESPGHAN
- Slovenský pediatrický kongres s medzinárodnou účasťou
- Poruchy příjmu potravy
- Onemocnění spojená s malabsorpcí
- 10. CELOSTÁTNÍ KONFERENCE DĚTSKÉ PNEUMOLOGIE
- Ostravský den preventivní pediatrie
- Pediatria pre prax – 51. pediatrické dni Bratislava, 14.–15. 4. 2011
- XIII. hradecké pediatrické dny Hradec Králové, 11.–12. listopadu 2011
- Pařízková J.: Nutrition, Physical Activity, and Health in Early Life. 2. vyd.
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Onemocnění spojená s malabsorpcí
- Mukopolysacharidóza I – klinické projevy u 24 dětí z České republiky a Slovenska
- Praktický přístup k enterální výživě v pediatrii – doporučení ESPGHAN
- Artériová mozgová príhoda v detskom veku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



