-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaAdenómy hypofýzy – praktický prístup k histopatologickej diagnostike a zmeny v poslednej WHO klasifikácii z roku 2017
Pituitary adenomas – practical approach to the diagnosis and the changes in the 2017 WHO classification
The histopathological diagnosis of sellar tumors is a difficult area of the diagnostic surgical pathology. The most common sellar tumor is a pituitary adenoma. The histomorphology of pituitary adenomas is very heterogeneous, and in the sellar area, we can encounter practically any other tumor known from human pathology, either primary or secondary. Exact histopathological classification requires many immunohistochemical antibodies: pituitary hormones, pituitary transcription factors, and several other antibodies. At present, electron microscopy is no longer necessary for the routine diagnosis of the pituitary gland adenomas. The important aspect of the precise classification is to screen pituitary adenomas for aggressive histological types. The latest edition of the WHO classification of tumours of endocrine organs, published in 2017, involves several changes in the chapter of pituitary adenomas, including the abolition of the concept of atypical adenoma. In the short review, we discuss the practical approach to the diagnosis and the changes in the latest WHO classification of pituitary adenomas from 2017.
Keywords:
Pituitary adenoma – histopathology – WHO classification 2017
Autoři: Boris Rychlý 1; Magdaléna Puchertová 2; Marián Švajdler 3,4; Josef Zámečník 5
Působiště autorů: Alpha medical, s. r. o., Bratislava, Slovenská republika 1; Ústav patologickej anatómie, Slovenská zdravotnícka univerzita, Bratislava, Slovenská republika 2; Šiklův ústav patologie, Univerzita Karlova v Praze, Lékařská fakulta v Plzni a Fakultní nemocnice Plzeň, Česká republika 3; Bioptická laboratoř, s. r. o., Plzeň, Česká republika 5 Ústav patologie a molekulární medicíny 2. LF UK a FN v Motole, Praha, Česká republika 4
Vyšlo v časopise: Čes.-slov. Patol., 55, 2019, No. 3, p. 137-144
Kategorie: Přehledový článek
Souhrn
Tumory tureckého sedla patria k problematickým oblastiam histopatologickej diagnostiky. Ďaleko najčastejšími selárnymi tumormi sú adenómy hypofýzy, ktoré sú histomorfologicky veľmi heterogénne, zároveň sa v tejto oblasti môžeme stretnúť s celým spektrom ďalších primárnych aj sekundárnych nádorov známych z humánnej patológie. Pre presnú klasifikáciu je potrebných pomerne veľa imunohistochemických vyšetrení: hypofyzárne hormóny, príslušné transkripčné faktory a niekoľko ďalších protilátok. Elektrón-mikroskopické vyšetrenie v rutinnej diagnostike adenómov hypofýzy už nie je v súčasnosti nevyhnutné. Dôležitým aspektom podrobnej klasifikácie adenómov hypofýzy je identifikácia agresívnych histologických typov. V roku 2017 vyšlo posledné vydanie WHO klasifikácie nádorov endokrinných orgánov, ktoré prinieslo viacero zmien týkajúcich sa adenómov hypofýzy, vrátane zrušenia konceptu atypického adenómu. V krátkom prehľadovom článku diskutujeme praktický prístup k diagnostike a zmeny v poslednej WHO klasifikácii adenómov hypofýzy z roku 2017.
Klíčová slova:
adenóm hypofýzy – histopatológia – WHO klasifikácia 2017
Za posledných 40 rokov sa histopatologická klasifikácia pituitárnych adenómov vyvinula z „tinktoriálnej“ klasifikácie (acidofilný, bazofilný a chromofóbny adenóm) do súčasnej typizácie na základe pituitárnych transkripčných línií a produkcie príslušných hypofyzárnych hormónov do 7 typov a viacerých ultraštrukturálnych podtypov. Väčšinu hypofyzárnych adenómov je možné diagnostikovať pomocou imunohistochémie, bez nutnosti elektrón-mikroskopického vyšetrenia.
Turecké sedlo je malá, ale komplexná anatomická štruktúra, v ktorej je uložená podmozgová žľaza. I keď je ďaleko najčastejším tumorom tejto oblasti adenóm hypofýzy, môžeme sa tu stretnúť s kompletným spektrom primárnych aj sekundárnych nádorov, tak ako ich poznáme z humánnej patológie. Adenómy hypofýzy nie sú zriedkavé nádory. Predstavujú cca 10-25 % intrakraniálnych nádorov (1). Z metaanalýzy rádiologických a autoptických prác z roku 2004 vyplýva, že až 17 % populácie má nádor hypofýzy (2). Podobne ako napríklad karcinómy (mikrokarcinómy) štítnej žľazy alebo prostaty, sú to bežné nádory, ale len malá časť z nich je klinicky signifikantná. Klinické príznaky vyvolávajú rastom v anatomicky obmedzenom priestore v bezprostrednej blízkosti chiazmy optického nervu a časť z nich produkuje hypofyzárne hormóny s príslušnými klinickými syndrómami. Hyperprolaktinémia môže byť nešpecifický nález, pretože akýkoľvek útlak stopky hypofýzy obmedzuje prúd krvi, s následnou obštrukciou normálnej inhibície hypotalamu na prolaktín produkujúce bunky adenohypofýzy. Pri diabetes insipidus je tumor adenohypofyzárnych buniek menej pravdepodobný a skôr ide o iné tumory alebo zápalové lézie.
Na základe najväčšieho rozmeru rozlišujeme mikroadenómy (menej ako 1 cm), makroadenómy (1-4 cm) a gigantické adenómy (viac ako 4 cm) (3). Väčšina pituitárnych adenómov sa nachádza v tureckom sedle. Ektopické adenómy (4) v iných lokalitách, najčastejšie v sfenoidálnom sínuse, sú zriedkavé. Niekedy sa však aj nonektopické adenómy môžu prezentovať ako sinonazálna alebo nazofaryngeálna polypoidná lézia (5). Expresia pituitárnych transkripčných faktorov a hormónov je v týchto prípadoch nápomocná pri odlišovaní iných, klinicky agresívnejších, lézií (olfaktórny neuroblastóm, neuroendokrinný karcinóm) (5).
Adenómy hypofýzy sú komplexná heterogénna skupina nádorov s rozličnými klinickými manifestáciami a biologickou agresivitou. Niektoré sú drobné, stacionárne, klinicky nesignifikantné lézie. Laktotropné adenómy bez ohľadu na veľkosť dobre reagujú na medikamentóznu liečbu dopamínovými antagonistami. Aj niektoré drobné, minimálne proliferujúce adenómy nadprodukciou hormónov spôsobujú ťažkú metabolickú dysfunkciu. Niektoré tumory sú zase veľké, aktívne proliferujú, prerastajú do okolia, utláčajú okolité štruktúry a spôsobujú signifikantnú morbiditu aj bez nadprodukcie hormónov.
Od čias Harveyho Cushinga, ktorý ustanovil termín adenóm hypofýzy, sa tento názov používa aj pre agresívne tumory, ktoré môžu v krátkom čase spôsobiť smrť pacienta. Podobne ako pri nádoroch iných endokrinných orgánov, je prospektívne posúdenie biologického správania adenómov hypofýzy problematické (6). Termín adenóm, ktorým sa označujú benígne tumory, nie je optimálny pre agresívne, neresekovateľné a na terapiu refraktérne tumory. Medzinárodný klub pituitárnej patológie, ustanovený v roku 1981, združujúci expertných pituitárnych patológov, endokrinológov, neurochirurgov a vedcov so záujmom o patológiu tureckého sedla, na svojom 14. mítingu preto navrhol upustiť od termínu adenóm a zjednotiť terminológiu s neuroendokrinnými tumormi (7). Pre tumory z adenohypofyzárnych buniek by sa používalo označenie pituitárny neuroendokrinný tumor (PitNET). I keď vo WHO klasifikácii endokrinných orgánov z roku 2017 (3) ešte nebol „adenóm“ nahradený „tumorom“, v ďalších WHO klasifikáciách bude pravdepodobne táto terminológia adoptovaná.
ODLÍŠENIE NENÁDOROVEJ HYPOFÝZY OD ADENÓMU
Pri diagnostike adenómu hypofýzy je prvým krokom odlíšenie od nenádorovej adenohypofýzy, čo môže byť v malej limitovanej vzorke problematické. Nenádorová adenohypofýza je na rozdiel od adenómu tvorená cytologicky heterogénnou populáciou buniek a má acinárnu architektúru (obr. 1A, 1B), ktorú podporuje retikulínová kostra (obr. 1C). Retikulín je najčastejšie používané špeciálne farbenie, ktoré pomáha odlíšiť nádorové a nenádorové tkanivá adenohypofýzy. Redukcia retikulínu pre diagnózu adenómu ale nie je presne kvantifikovaná. Rovnako môže poslúžiť aj imunohistochemické farbenie na kolagén IV. Ak si predstavíme zorné pole pri 10x objektíve ako bludisko, ktorého steny sú tvorené kolagénom IV a dá sa bez prerušenia prejsť z jednej strany zorného poľa na druhú (obr. 1D), ide o adenóm hypofýzy s vysokou senzitivitou a špecificitou (8). V opačnom prípade sa pozeráme na nenádorovú adenohypofýzu (obr. 1E), prípadne hyperpláziu. Problematické na hodnotenie býva tiež tkanivo adenohypofýzy z okolia tumoru, ktoré býva komprimované, prípadne fibrotické, tzv. pseudopuzdro tumoru (obr. 1F). Aj v teréne pseudopuzdra tumoru cytologická heterogenita a zachovaný retikulín poukazujú na nenádorové tkanivo adenohypofýzy.
Obr. 1. (A) Nenádorová adenohypofýza. Zachovaná acinárna architektúra heterogénnej populácie adenohypofýzových buniek, HE 400x. (B) Adenóm hypofýzy („densely granulated“ somatotropný), homogénna populácia nádorových buniek bez acinárneho usporiadania (na porovnanie s obr. 1A), HE 400x. (C) Zachovaný retikulín v nenádorovej adenohypofýze, farbenie na retikulín, 100x. (D) Imunohistochemické farbenie na kolagén IV v adenóme hypofýzy. Myslené bludisko tvorené kolagénom IV je možné prejsť z jednej strany zorného poľa na druhú, 400x. (E) Imunohistochemické farbenie na kolagén IV v nenádorovej adenohypofýze (na porovnanie s obr. 1D), 400x. (F) V okolí adenómu hypofýzy býva nenádorové tkanivo hypofýzy komprimované, fibrotické (pseudopuzdro tumoru), HE 400x. 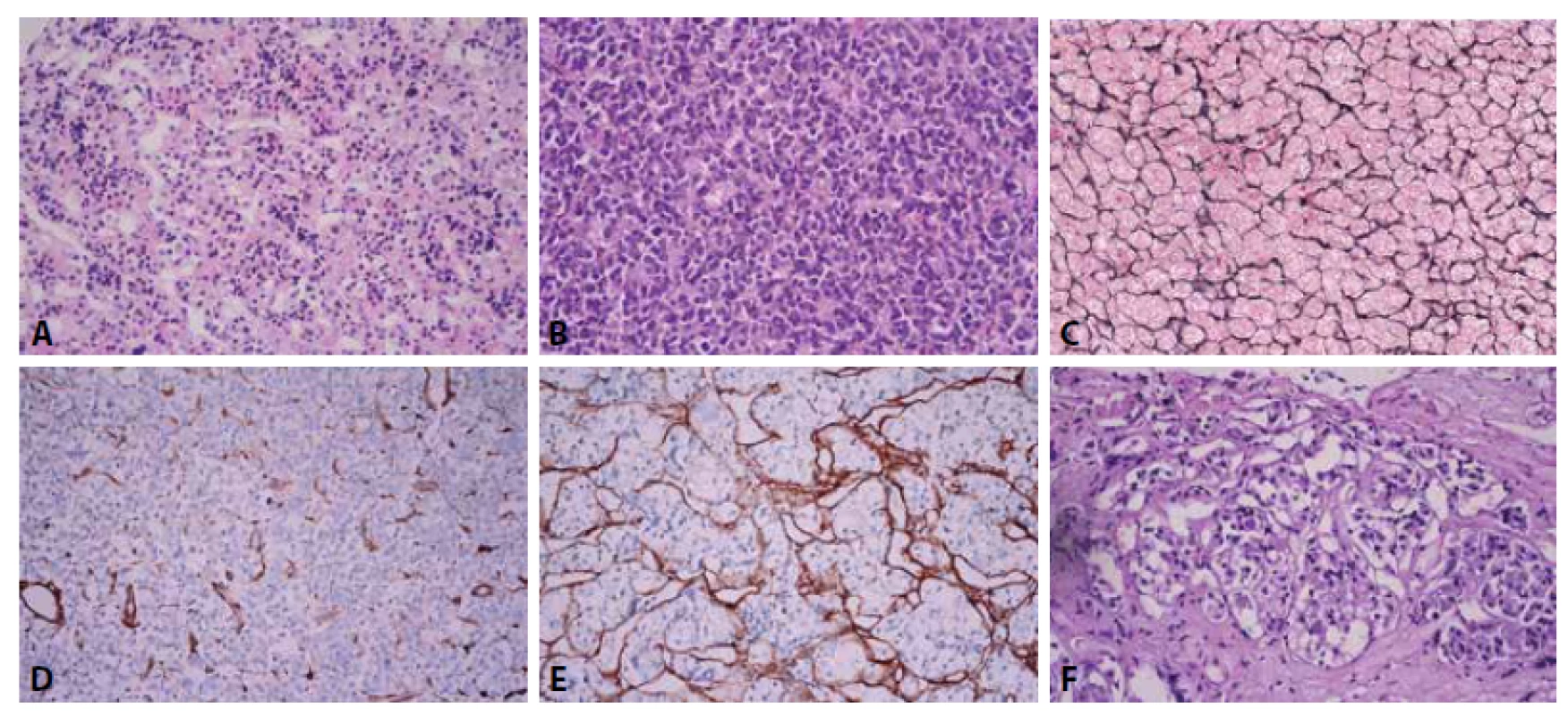
Niekedy môže neurochirurg operujúci adenóm hypofýzy požadovať peroperačnú diferenciáciu nádorového tkaniva od nenádorového. Snahou neurochirurga je odstrániť celý tumor, a zároveň zachovať čo najviac zdravého tkaniva a nespôsobiť pacientovi doživotný panhypopituitarizmus. Hodnotenie zmrazeného mikrofragmentu tkaniva hypofýzy je extrémne problematické. Výbornou pomôckou je v takomto prípade náterová cytológia (9,10). Adenóm vytvára homogénny náter uniformnej populácie buniek (obr. 2), zatiaľ čo v nenádorovej adenohypofýze je retikulín zodpovedný za kohezívnejšie zhluky heterogénnejšej populácie buniek v cytologickom nátere.
Obr. 2. Cytologický náter adenómu hypofýzy. Homogénna populácia pomerne rovnomerne rozptýlených „plazmocytoidných“ buniek, HE 400x. 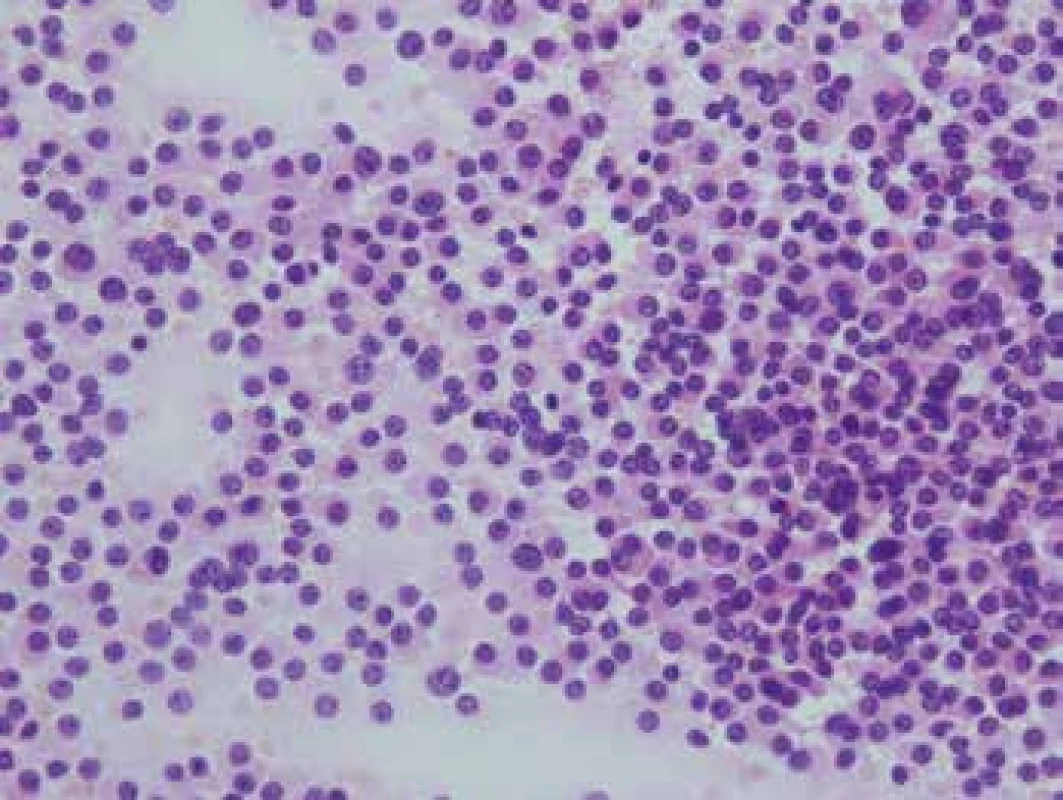
Pituitárna hyperplázia môže byť fyziologická, napr. proliferácia laktotropných buniek v gravidite, alebo patologická, pod vplyvom patologickej indukcie hypofýzotropnými hormónmi. Hyperplázia môže byť klinicky neodlíšiteľná od adenómu. Pri hyperplázii je acinárna architektúra s retikulínovou kostrou zachovaná, acíny sú zväčšené, na rozdiel od adenómu, v ktorom dochádza k disrupcii retikulínu (Obr. 3). Cytologicky a v imunohistochemických farbeniach v hyperplázii pozorujeme heterogénnu populáciu adenohypofýzových buniek (11).
Obr. 3. Hyperplázia ACTH buniek u pacienta s Cushingovym syndrómom. Pri vyšetrení magnetickou rezonanciou nájdená iba mierna asymetria žľazy, bez prítomnosti jednoznačného nádorového ložiska. (A) Zväčšené acíny v hyperplázii (vľavo), retikulínová kostra je ale zachovaná, 50x. (B) Imunohistochemicky hyperplastické acíny dominantne exprimovali ACTH, bola ale prítomná expreisa aj ostatných hormónov. Zároveň bola v normálnej hypofýze zachovaná normálna expresia ACTH (vpravo). Pri adenóme je očakávaná supresia ACTH v okolitej žľaze, 20x. (C) Zväčšené aciny tvorené heterogénnou populáciou buniek, podobnou normálnej hypofýze, 200x. 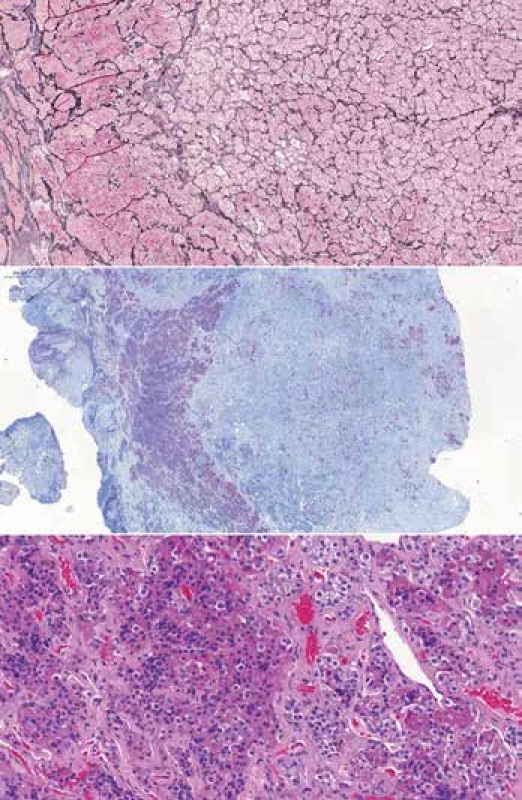
KLASIFIKÁCIA ADENÓMOV HYPOFÝZY PODĽA WHO 2017
Zmeny v novej WHO klasifikácii z roku 2017 (3) zahŕňajú:
- (i) nový prístup ku klasifikácii pituitárnych adenómov podľa adenohypofyzárnych bunkových línií,
- (ii) elimináciu kategórie atypického adenómu,
- (iii) predstavenie novej jednotky pituitárneho blastómu, a
- (iv) redefiníciu existujúcej jednotky „null cell“ adenómu.
Nová WHO klasifikácia rozlišuje sedem základných skupín adenómov hypofýzy s viacerými podskupinami (somatotropný, laktotropný, tyreotropný, kortikotropný, gonadotropný, „null cell“ adenóm a plurihormonálne a dvojité adenómy). V predchádzajúcej WHO klasifikácii z roku 2004 sa používala terminológia „hormón produkujúci nádor“ napr. rastový hormón produkujúci adenóm. V novej klasifikácii sa tento tumor označuje ako somatotropný adenóm.
Rutinná diagnostika adenómov hypofýzy vyžaduje pomerne veľké množstvo imunohistochemických farbení: rastový hormón (GH), prolaktín (PRL), tyreotropný (TSH), adrenokortikotropný (ACTH), folikulostimulačný (FSH) a luteinizačný hormóm (LH), alfa reťazec (spoločná podjednotka LH, FSH a TSH), transkripčné faktory (Pit-1, T-Pit, SF-1), nízkomolekulové cytokeratíny (na dôkaz tzv. fibróznych teliesok v „sparsely granulated“ tumoroch), prípadne ďalšie imunohistochemické markery pre diferenciálnu diagnostiku príslušného tumoru.
Markery proliferácie (mitózy, Ki67) sa v adenómoch hypofýzy bežne stanovujú, súvisia s rizikom rekurencie, najmä po inkompletnej resekcii, i keď špecifické hraničné hodnoty nie sú aktuálne stanovené. Prevažná väčšina adenómov (okrem laktotropných) je silne pozitívna v dôkaze synaptofyzínu a chromogranínu. Expresia cytokeratínov je taktiež prítomná v takmer všetkých adenómoch, vynimkou je približne 1/3 gonadotropných adenómov. Zo špeciálnych vyšetrení sa rutínne farbí retikulín a PAS.
Diferenciácia buniek adenohypofýzy a regulácia produkcie jednotlivých hormónov je pod kontrolou transkripčných faktorov. Základné pituitárne transkripčné faktory sú: pituitárne špecifický transkripčný faktor 1 (Pit-1), T-box transkripčný faktor (T-Pit) a steroidogénny faktor 1 (SF-1). Pit-1 má pod kontrolou rast, diferenciáciu a tvorbu príslušných hormónov somatotropných, laktotropných a tyreotropných buniek (12,13) (obr. 4). Adrenokortikotropný hormón je pod kontrolou transkripčného faktora T-Pit (14) (obr. 5). SF-1 reguluje gonadotropné bunky a produkciu LH a FSH (13,15) (obr. 6). Imunohistochémiu na SF-1 je možné použiť aj v diferenciálnej diagnostike ďalších nádorov produkujúcich steroidy, napr. tumorov kôry nadobličiek (16) alebo „sex cord“ gonadálnych nádorov (17).
Obr. 4. (A) Somatotropný „densely granulated“ makroadenóm u 39-ročnej ženy, HE 400x. (B) Difúzna pozitivita CAM5.2, 400x. (C) Expresia transkripčného faktora Pit-1, 200x. (D) Difúzna silná expresia rastového hormónu, 200x. 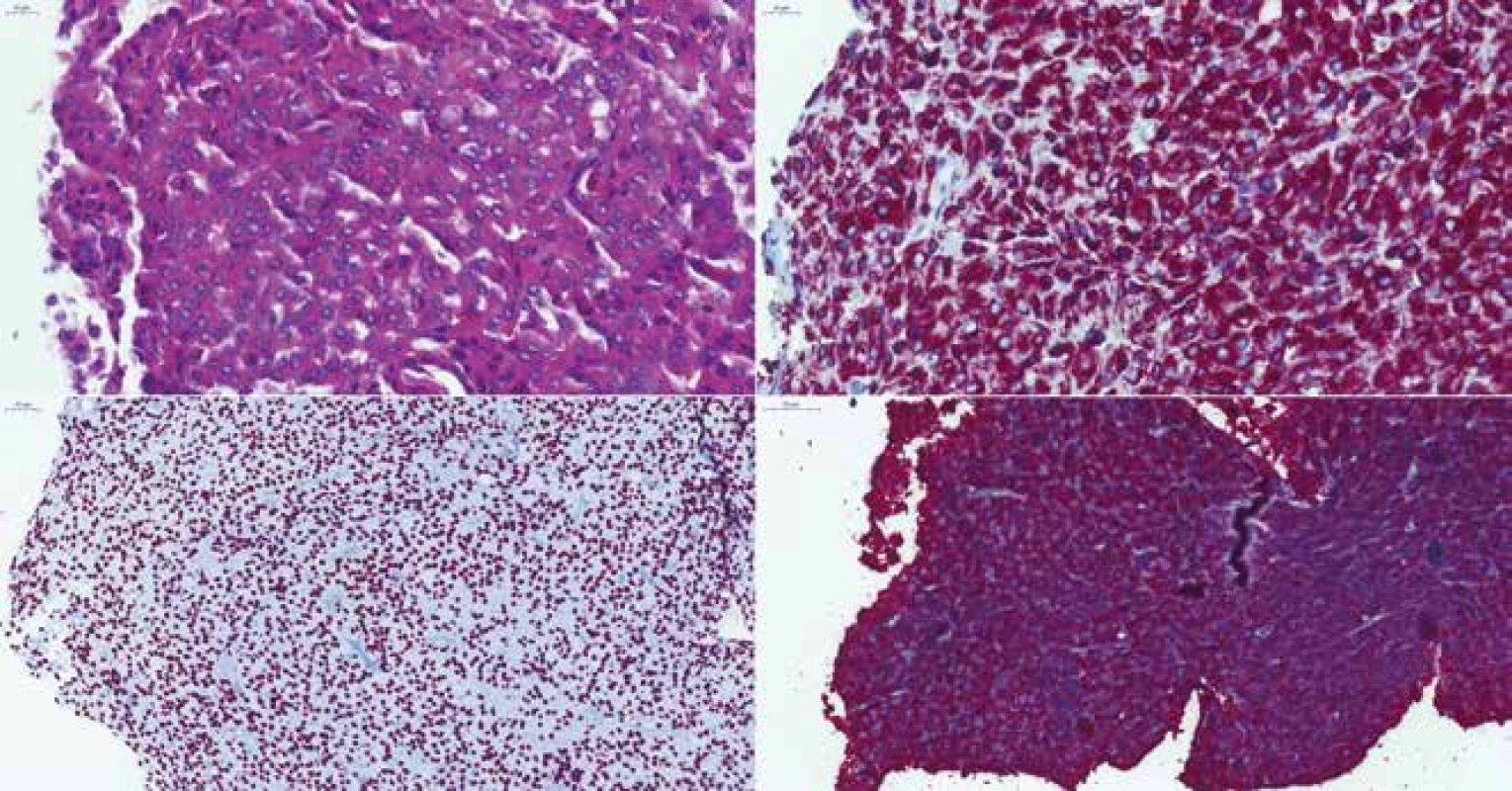
Obr. 5. (A) „Sparsely granulated“ kortikotropný adenóm u 46-ročného muža, HE 400x. (B) Expresia transkripčného faktora T-Pit, 200x. (C) Fokálna variabilne intenzívna expresia ACTH, 200x 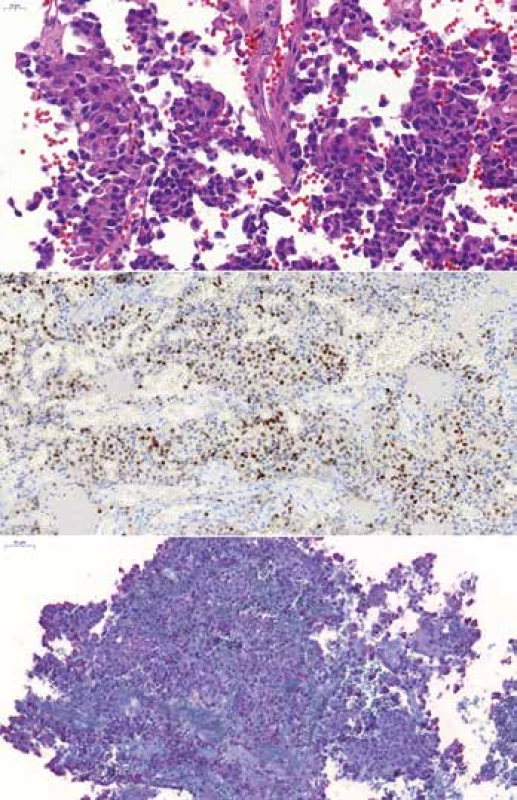
Obr. 6. (A) Afunkčný gonadotropný adenóm u 65-ročného muža, HE 300x. B) Expresia transkripčného faktora SF-1, 300x. (C) Negatívna expresia FSH, 300x. (D) Negatívna expresia LH, 300x. Rovnako negatívna bola expresia keratínov. Niektoré „null cell“ adenómy z minulosti sú dnes klasifikované ako gonadotropné adenómy iba na základe pozitivity transkripčného faktora SF-1, keďže pre mnohé gonadotropné adenómy je imunohistochemicky typická veľmi nízka alebo úplne nedetekovateľná expresia LH/FSH. 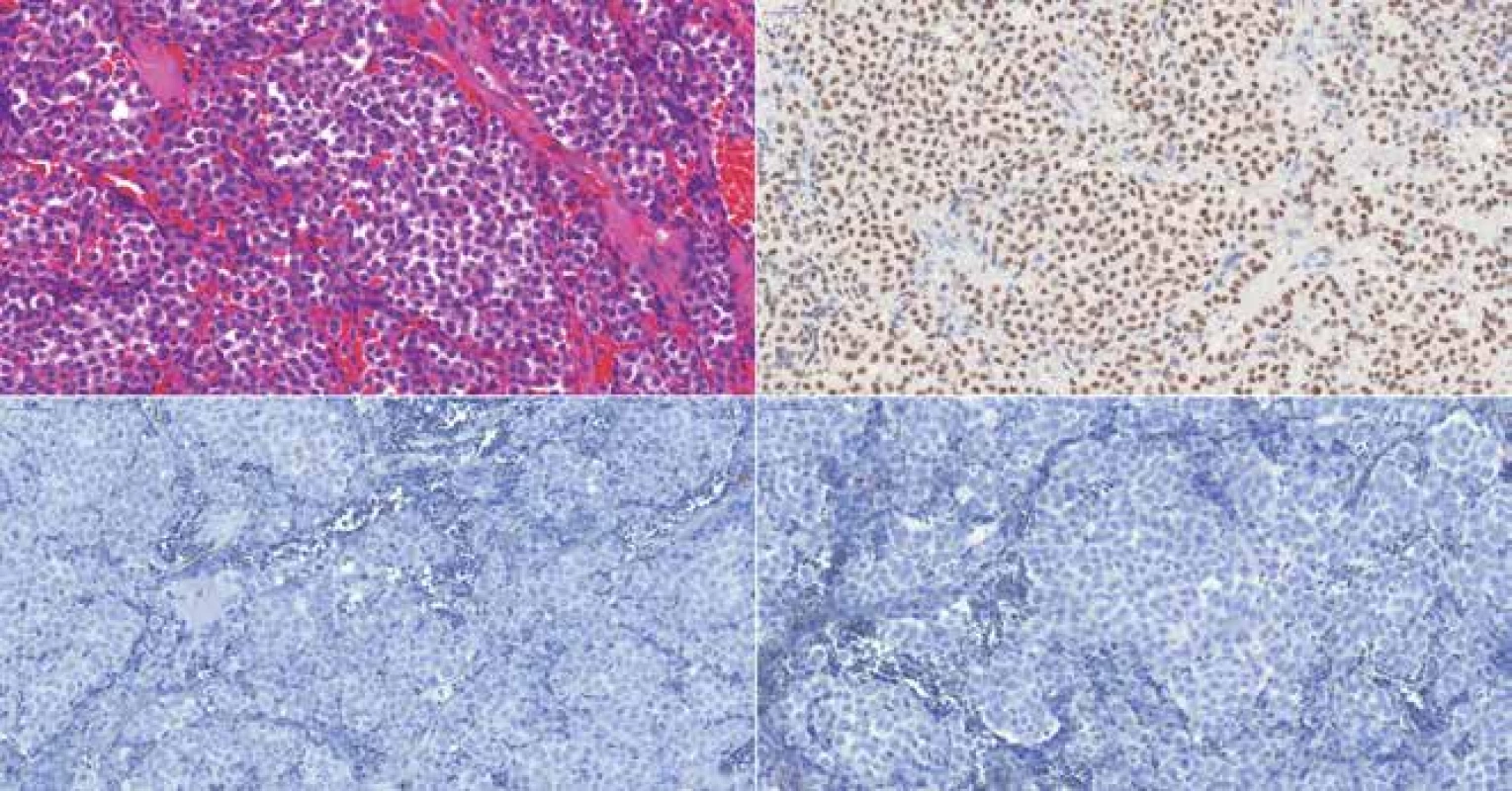
Pri potrebe šetriť prostriedky sa pri diagnostike adenómov môže začať samotnými transkripčnými faktormi a ďalej pokračovať imunohistochemickými vyšetreniami hormónov len v príslušnej línii.
Elektrónová mikroskopia je v súčasnosti na klasifikáciu adenómov hypofýzy používaná už len raritne.
Atypický adenóm bol vo WHO 2004 definovaný ako tumor s proliferačnou aktivitou (Ki67) väčšou ako 3% a/alebo s nukleárnou pozitivitou P53. Po viac ako 10-tich rokoch existencie klasifikácie z roku 2004 (18) nebol prognostický význam kategórie atypického adenómu jednoznačne dokázaný a jej klinická signifikantnosť je nejasná (väčšina agresívnych adenómov histologicky nespadá do kategórie atypického adenómu a naopak mnohé atypické adenómy sa nesprávajú agresívne). Preto bola vo WHO klasifikácii z roku 2017 kategória atypického adenómu zrušená. I keď silná nukleárna expresia P53 by mohla poukazovať na agresivitu tumoru (väčšina pituitárnych karcinómov je pozitívna), P53 by bol veľmi nesenzitívny marker nepriaznivého biologického správania adenómov hypofýzy. Väčšina agresívne sa správajúcich adenómov je P53 negatívna. Na našom súbore 433 konsekutívnych adenómov za 10 rokov bola P53 pozitivita zachytená v jedinom prípade (B.R.,nepublikované dáta).
Dôležitou úlohou rutinnej diagnostiky je vyhľadávanie agresívnych histologických typov adenómov (3,11): „sparsely granulated“ somatotropný adenóm, laktotropný makroadenóm u mužov, „densely granulated“ laktotropný adenóm, acidofilný stem cell adenóm, adenóm z Crookeho buniek, „silent“ kortikotropný (T-Pit) adenóm, plurihormonálny Pit-1 pozitívny adenóm (predtým „silent“ podtyp 3 adenóm).
Klinické údaje uvedené na sprievodke by mali obsahovať minimálne informácie o veľkosti tumoru, jeho lokalizácii (intraselárny, supraselárny) a hormonálny status.
Somatotropný adenóm
Somatotropný adenóm je pituitárny adenóm, ktorý produkuje rastový hormón a pochádza z Pit-1 línie buniek. Čisté somatotropné adenómy sa rozdeľujú na dva biologicky odlišné podtypy: „densely granulated“ (obr. 4) a „sparsely granulated“ adenóm. Ďalšie adenómy, ktoré vedú k akromegálii a/alebo gigantizmu nadprodukciou rastového hormónu sú mamosomatotropný adenóm (nádorové bunky koexprimujú GH a PRL), zmiešaný somatotropný a laktotropný adenóm (s dvoma rozličnými populáciami acidofilných a chromofóbnych buniek, z ktorých jedna produkuje GH a druhá PRL) a plurihormonálne adenómy. „Sparsely granulated“ adenóm sa správa agresívne, často sa jedná o väčšie tumory, s častejšou inváziou do kosti spodiny tureckého sedla (19). Pre jeho diagnózu je potrebné farbenie na nízkomolekulové cytokeratíny, ktoré znázorňujú jeho definujúci znak - fibrózne telieska (20). Sú to početné guľaté kolekcie keratín-pozitívnych vlákien (obr. 7). Okrem toho vykazuje slabšiu pozitivitu na GH ako „densely granulated“ adenóm, a tiež stráca expresiu E-Cadherinu (21). Niektoré „densely granulated“ GH adenómy vykazujú občasné fibrózne telieska, tieto tumory sa označovali ako intermediárny typ somatotropného adenómu. Biologicky sa ale neodlišujú od „densely granulated“ tumorov, do ktorých spektra teda zrejme patria (22).
Obr. 7. (A) „Sparsely granulated“ somatotropný makroadenóm u 78-ročnej ženy, tzv. fibrózne telieska sú viditeľné v HE farbení ako guľaté prejasnenie cytoplazmy (šípky), HE 400x. (B) Expresia transkripčného faktora Pit-1, 200x. (C) Variabilná expresia GH, 200x. (D) „fibrous bodies“ vo farbení CAM 5.2. 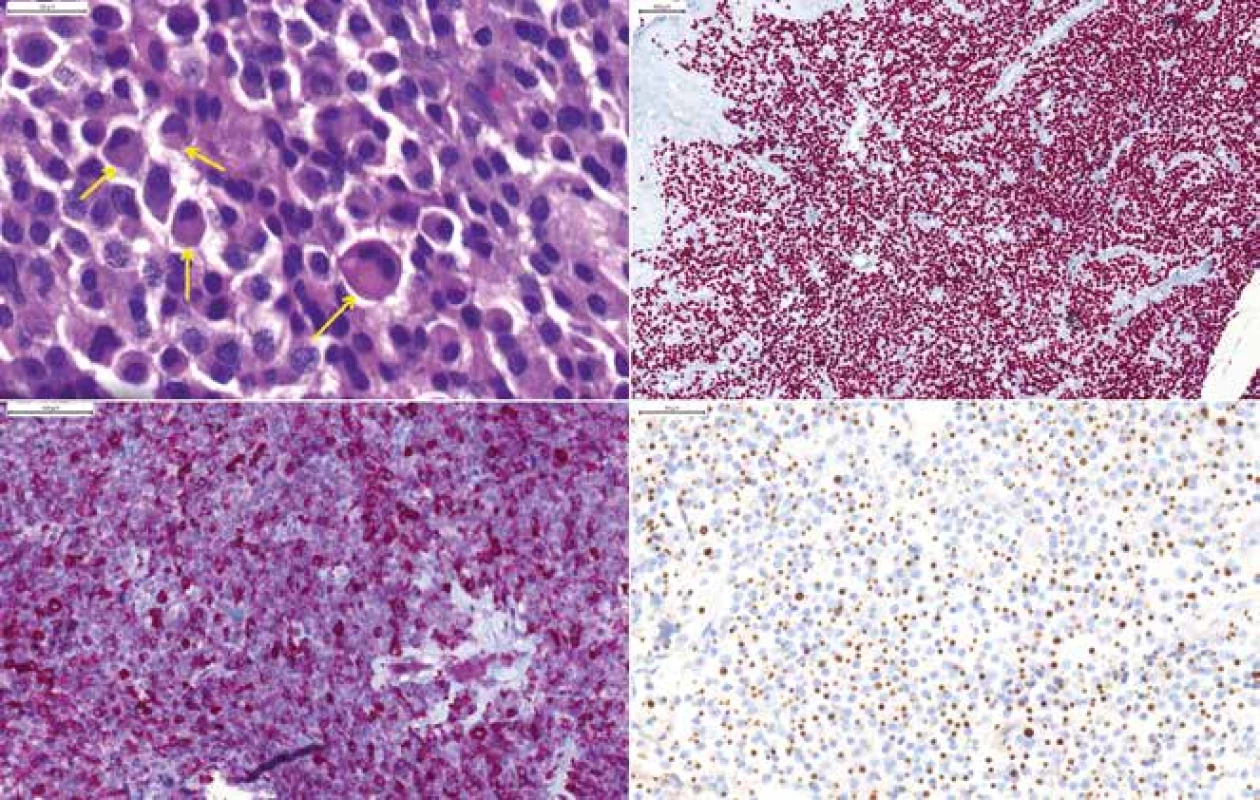
Laktotropný adenóm
Ďalším adenómom z Pit-1 línie je laktotropný adenóm, ktorý má tri rozličné podtypy: „sparsely granulated“, „densely granulated“ adenóm a acidofilný „stem cell“ adenóm. Laktotropné adenómy sú najčastejšie adenómy hypofýzy, predstavujú 30-50 % všetkých pituitárnych adenómov (22). Tiež sú to najčastejšie adenómy hypofýzy u detí (23). Väčšina pituitárnych karcinómov sú laktotropné tumory. „Sparsely granulated“ laktotropné adenómy sú chromofóbne tumory, negatívne vo farbení na PAS. Od ostatných tumorov hypofýzy produkujúcich PRL sa odlišujú charakteristickou perinukleárnou pozitivitou na PRL, ktorú možno pozorovať aj v nenádorových laktotropných bunkách (24). „Densely granulated“ laktotropné adenómy sú zriedkavé agresívne tumory, sú PAS pozitívne a imunohistochemicky vykazujú intenzívnu pozitivitu PRL v celej cytoplazme nádorových buniek (22). Acidofilný „stem cell“ adenóm tvoria onkocytické bunky s eozinofilnou cytoplazmou so svetlými vakuolami. Ich cytologický vzhľad je dôsledkom akumulácie dilatovaných mitochondrií v cytoplazme (25).
Tyreotropný adenóm
Tyreotropné adenómy vykazujú pomerne veľkú variabilitu histomorfologického obrazu, väčšinou sú chromofóbne, zložené z polygonálnych, občas krátkych vretenovitých buniek. Môžu vykazovať stromálnu fibrotizáciu, kalcifikácie a psamomatózne telieska – znaky iba zriedkavo prítomné v iných pituitárnych adenómoch. Žiadny z histopatologických znakov však nekoreluje s invazivitou, veľkosťou tumoru, či úrovňou hormonálnej sekrécie (26).
Kortikotropný adenóm
Kortikotropné adenómy patria k T-Pit línii, histologicky sú klasifikované do troch podskupín: „densely granulated“, „sparsely granulated“ kortikotropný adenóm a „Crooke cell“ adenóm. Produkujú ACTH a ďalšie peptidy odvodené od proopiomelanokortínu. Cushingov syndróm je súbor príznakov z nadprodukcie ACTH, a ak je sekundárny v dôsledku pituitárneho adenómu, označujeme ho ako Cushingova choroba (27). „Densely granulated“ kortikotropný adenóm tvoria bazofilné PAS pozitívne bunky, ktoré sú difúzne a silno pozitívne na ACTH. „Sparsely granulated“ kortikotropné adenómy sú tvorené slabo bazofilnými alebo chromofóbnymi PAS pozitívnymi bunkami so slabou alebo ložiskovou ACTH pozitivitou (22,24) (obr. 5). „Crooke cell“ adenómy sú tvorené z buniek s „Crooke“ hyalínnou zmenou. Typická je prstencová pozitivita cytokeratínov a pozitivita ACTH na periférii cytoplazmy a v okolí jadra. Patria medzi agresívne adenómy (28) podobne ako „silent“ kortikotropné adenómy, teda také kortikotropné adenómy, ktoré nemajú klinické prejavy nadprodukcie adrenokortikotropného hormónu (29). ACTH môžu produkovať aj iné nádory, napr. paragangliómy (30) a iné neuroendokrinné tumory (31), ktoré sa raritne môžu primárne alebo sekundárne objaviť aj v tureckom sedle. Preto je adenohypofýzový kortikotropný pôvod dobré potvrdiť aj Pit-1 pozitivitou.
Crookeho hyalínna zmena je nahradenie cytoplazmatických granúl bazofilných buniek adenohypofýzy homogénnym hyalínnym materiálom. Vzniká u pacientov s hyperkortizolizmom, pravdepodobne v dôsledku negatívnej spätnej väzby na sekréciu kortikotropínu (32,33). U niektorých pacientov sa v operačnom materiáli nezachytí adenóm, ale nenádorová hypofýza vykazuje extenzívnu Crookeho hyalínnu zmenu. Samotný výsledok chirurgie potom môže poukazovať na charakter poruchy, pretože niektoré veľmi malé adenómy sa môžu počas chirurgického výkonu stratiť, napr. pri odsávaní krvi z operačného poľa. Za úspech chirurgického zákroku sa potom pokladá, keď sa po operácii upraví hladina hormónu. V takomto prípade patológ v bioptickom závere môže len uviesť, že prítomná Crookeho hyalínna zmena je konzistentná s Cushingovým syndrómom. Naopak, ak po chirurgii nedôjde k úprave hormonálnych hladín, treba zvažovať ektopický zdroj ACTH, poruchu kôry nadobličiek alebo drobný adenóm, ktorý pri operácii nebol odstránený. Tiež treba pamätať na fakt, že centrálna časť hypofýzy je bohatá na kortikotropné bunky, ktoré sa môžu zhlukovať a nemali by sa automaticky interpretovať ako hyperplázia či mikroadenóm. Niektoré komerčné protilátky proti ACTH vykazujú výraznú nešpecifickú reakciu pozadia, dobrým zástupným markerom je PAS, ktorý identifikuje glykozylované produkty génu proopiomelanokortínu vrátane ACTH.
Gonadotropný adenóm
Gonadotropný adenóm produkuje v rôznych kombináciách SF-1, FSH, LH, Alfa podjednotku, podľa ktorých ho môžeme rozdeliť do 5 podskupín. U žien spôsobuje galaktoreu a amenoreu. Často vykazuje onkocytické zmeny (34).
„Null cell“ adenóm a odlíšenie adenómu od iných lézií
Diagnóza „null cell“ adenómu vyžaduje negativitu všetkých hypofyzárnych hormónov a transkripčných faktorov (22). Po zavedení transkripčných faktorov do diagnostiky adenómov hypofýzy sa „null cell“ adenómy stali pomerne zriedkavé, predstavujú cca 4,5 % všetkých adenómov (12). Autori Kovásc a spol. už pred desiatkami rokov predpokladali, že budúce práce rozriešia histogenézu väčšej časti „null cell“ adenómov (35). Väčšina nádorov, ktoré boli v minulosti diagnostikované ako „null cell“ adenómy, sú v skutočnosti gonadotropné adenómy, doložené expresiou SF-1, čo je najsenzitívnejší a najšpecifickejší marker gonadotropnej línie (15). Alfa podjednotka má nízku špecificitu a imunohistochémia pre FSH a LH má nízku senzitivitu - FSH a LH sú často v gonádotropných adenómoch exprimované vo veľmi nízkych koncentráciách (36) (obr. 6).
Pred diagnózou „null cell“ adenómu treba tiež zvážiť diferenciálnu diagnózu selárneho paragangliómu, prípadne metastatického neuroendokrinného tumoru. Metastatický NET by vo väčšine prípadov vykazoval zreteľne vyššiu proliferáciu (Ki67) ako pituitárny adenóm, ktorý má bežne proliferačnú aktivitu menej ako 1-2 %. Nápomocná može byť expresia serotonínu (pozitívna v NET-och, konzistentná negativita v adenómoch hypofýzy), ATRX a DAXX (až na sporadické výnimky zachovaná expresia v adenómoch hypofýzy a strata expresie v časti pankreatických NET-ov) (37). Paragangliómy sa môžu vyskytnúť v tureckom sedle, väčšinou sú negatívne na cytokeratíny a exprimujú synaptofyzín a chromogranín, tak isto ako niektoré pituitárne adenómy. Nápomocná je nukleárna pozitivita GATA-3 v paragangliómoch (38), kľúčová je ale pozitivita tyrozín hydroxylázy (39) a negativita pituitárnych transkripčných faktorov. Odlíšenie selárneho paragangliómu má klinický význam, pretože časť paragangliómov je hereditárnych/asociovaných s klinickým syndrómom (najčastejšia je mutácia v génoch pre sukcinátdehydrogenázu - SDH) a majú agresívnejšie správanie ako väčšina adenómov hypofýzy (40). Vzácne môžu adenómy hypofýzy, podobne ako SDH-mutované paragangliómy, vykazovať stratu expresie SDHB/SDHA a môžu byť asociované so syndrómom, pre ktorý je charakteristický výskyt paragangliómov, gastrointestinálnych stromálnych tumorov a karcinómov obličky. Univerzálny imunohistochemický skríning adenómov hypofýzy na prítomnosť SDH-deficiencie však pre vzácnosť výskytu mutácie (0,3 % všetkých adenómov) nie je v súčasnosti doporučovaný (41).
Plurihormonálne adenómy
Plurihormonálne adenómy zahrňujú plurihormonálny Pit-1 pozitívny adenóm (adenóm s pozitivitou Pit-1, GH, PRL, TSH), prípadne adenómy s neobvyklými imunohistochemickými kombináciami transkripčných faktorov a hormónov. Adenómy s kombináciou GH a PRL, alebo FSH a LH sa neklasifikujú ako plurihormonálne (42).
Zachytené nenádorové tkanivo adenohypofýzy môže byť zamenené za nádorové elementy a následne môže byť tumor chybne diagnostikovaný ako plurihormonálny. Prítomnosť niekoľkých roztrúsených buniek pozitívnych na ďalšie hormóny nie je postačujúca pre diagnózu plurihormonálneho adenómu.
Dvojité adenómy
Jedná sa o tumory s dvoma rozličnými typmi neoplastických buniek. Najčastejšie ide o tumory so sekréciou GH a ACTH (43). I keď je diagnóza pituitárnych adenómov výrazne závislá na imunohistochémii, niektoré morfologické znaky môžu poukazovať na typ tumoru: kalkosferity (laktotropné adenómy), eozinofília (somatotropné adenómy), paranukleárna vakuolizácia (acidofilný „stem cell“ adenóm), cytoplazmatická bazofília alebo Crookeho hyalínna zmena (kortikotropné adenómy), pseudorozety alebo onkocytická premena (gonadotropné adenómy) (3,11).
Pituitárny karcinóm
Aj v najnovšej WHO klasifikácii z roku 2017 je pituitárny karcinóm stále definovaný až cerebrospinálnou disemináciou a/alebo vzdialenými metastázami (3,44,45). Pre diagnózu karcinómu adenohypofýzy musia byť splnené následujúce kritériá: (a) dokázaný adenohypofyzárny tumor ako primárna lézia, (b) vylúčený alternatívny primárny tumor, (c) dokázané diskontinuálne šírenie tumoru, (d) histopatologické znaky sekundárneho tumoru musia byť podobné primárnemu tumoru (3). Takto striktne definované pituitárne karcinómy sú veľmi zriedkavé, predstavujú len cca 0,1 % pituitárnych tumorov, a často bývajú diagnostikované až pri autopsii (46). Metastáze častokrát predchádzajú početné lokálne rekurencie.
Tumory, ktoré infiltrujú okolité štruktúry (dura, kosť), sa označujú ako invazívne adenómy (47). Neexistujú histologické kritériá, ktoré by odlíšili invazívny adenóm od adenómu, ktorý bude progredovať do karcinómu (48). Na predikciu odpovede agresívnych pituitárnych adenómov a karcinómov na alkylačnú chemoterapiu temozolomidom je možné použiť imunohistochemické farbenie na MGMT (49), na rozdiel od glioblastómov, u ktorých je za rovnakým účelom nutné používať genetické molekulárne metódy. Podobne, zachovaná funkcia „DNA-mismatch“-opravujúcich proteínov (predovšetkým MSH6) môže byť prediktorom na odpoveď liečbou temozolomidom (50).
Pituitárny blastóm
Novou jednotkou vo WHO klasifikácii z roku 2017 je pituitárny blastóm, veľmi zriedkavý malígny nádor, ktorý sa vyskytuje väčšinou u detí mladších ako dva roky s prejavmi Cushingovho syndrómu. Tvoria ho žľazy pripomínajúce Rathkeho epitélie, malé primitívne bunky blastémového vzhľadu a väčšie sekretorické bunky vzhľadu adenohypofýzových elementov (51,52). Je súčasťou DICER1 syndrómu s familiárnym pleuropulmonálnym blastómom na podklade heterozygotnej zárodočnej mutácie DICER1 génu (53).
Histopatologická diagnostika adenómov hypofýzy je pre väčšie množstvo typov a podtypov týchto nádorov náročná a vyžaduje celý rad imunohistochemických vyšetrení. Podrobnosť diagnostiky a diagnostický prístup k týmto nádorom nie je na rozličných pracoviskách jednotný. Hlavnou úlohou histopatologickej diagnostiky je identifikácia agresívnych podtypov pituitárnych adenómov.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pre korešpondenciu:
MUDr. Boris Rychlý, PhD.
Alpha medical, s.r.o.
Polianky 7 841 01 Bratislava, Slovenská republika
tel.: +421 2 48234579
e-mail: Rychly.Boris@alphamedical.sk
Zdroje
- Mete O, Cintosun A, Pressman I, Asa SL. Epidemiology and biomarker profile of pituitary adenohypophysial tumors. Mod Pathol 2018; 31(6): 900-909.
- Ezzat S, Asa SL, Couldwell WT, et al. The prevalence of pituitary adenomas: a systematic review. Cancer 2004; 101(3): 613–619.
- Lloyd RV, Osamura RY, Klöppel G, Rosai J. WHO Classification of Tumours of Endocrine Organs (4th ed). Geneva: WHO Press; 2017 : 11-63.
- Thompson LD, Seethala RR, Müller S. Ectopic sphenoid sinus pituitary adenoma (ESSPA) with normal anterior pituitary gland: a clinicopathologic and immunophenotypic study of 32 cases with a comprehensive review of the english literature. Head Neck Pathol 2012; 6(1): 75-100.
- Hyrcza MD, Ezzat S, Mete O, Asa SL. Pituitary adenomas presenting as sinonasal or nasopharyngeal masses: a case series illustrating potential diagnostic pitfalls. Am J Surg Pathol 2017; 41(4): 525–534.
- Asa SL, Ezzat S. Aggressive pituitary tumors or localized pituitary carcinomas: defining pituitary tumors. Expert Rev Endocrinol Metab 2016; 11(2): 149-162.
- Asa SL, Casar-Borota O, Chanson P, et al. From pituitary adenoma to pituitary neuroendocrine tumor (PitNET): an International Pituitary Pathology Club proposal. Endocr Relat Cancer 2017; 24(4): 6-8.
- Jarzembowski J, Lloyd R, McKeever P. Type IV collagen immunostaining is a simple, reliable diagnostic tool for distinguishing between adenomatous and normal pituitary glands. Arch Pathol Lab Med 2007; 131(6): 931-935.
- Lacruz CR, Saenz de Santamaria J, Bardales RH. Central Nervous System Intraoperative Cytopathology (2nd edn). Cham: Springer; 2018 : 373-379.
- Afroz N, Khan N, Hassan J, Huda MF. Role of imprint cytology in the intraoperative diagnosis of pituitary adenomas. Diagn Cytopathol 2011; 39(2): 138-140.
- Asa SL. Tumors of the Pituitary Gland (4th ed). Washington: AFIP; 2011 : 249-255.
- Nishioka H, Inoshita N, Mete O, et al. The complementary role of transcription factors in the accurate diagnosis of clinically nonfunctioning pituitary adenomas. Endocr Pathol 2015; 26(4): 349–355.
- McDonald WC, Banerji N, McDonald KN, Ho B, Macias V, Kajdacsy-Balla A. Steroidogenic factor 1, Pit-1, and adrenocorticotropic hormone: a rational starting place for the immunohistochemical characterization of pituitary adenoma. Arch Pathol Lab Med 2017; 141(1): 104-112.
- Sjöstedt E, Bollerslev J, Mulder J, Lindskog C, Pontén F, Casar-Borota O. A specific antibody to detect transcription factor T-Pit: a reliable marker of corticotroph cell differentiation and a tool to improve the classification of pituitary neuroendocrine tumours. Acta Neuropathol 2017; 134(4): 675-677.
- Asa SL, Bamberger AM, Cao B, Wong M, Parker KL, Ezzat S. The transcription activator steroidogenic factor-1 is preferentially expressed in the human pituitary gonadotroph. J Clin Endocrinol Metab 1996; 81(6): 2165–2170.
- Sbiera S, Schmull S, Assie G, et al. High diagnostic and prognostic value of steroidogenic factor-1 expression in adrenal tumors. J Clin Endocrinol Metab 2010; 95(10): 161-171.
- Sangoi AR, McKenney JK, Brooks JD, Higgins JP. Evaluation of SF-1 expression in testicular germ cell tumors: a tissue microarray study of 127 cases. Appl Immunohistochem Mol Morphol 2013; 21(4) :318-321.
- Delellis RA, Lloyd RV, Heitz PU. Pathology and genetics of tumours of endocrine organs (3rd edn). Lyon: IARC Press; 2004 : 9-48.
- Larkin S, Reddy R, Karavitaki N, Cudlip W, Wass J, Ansorge O. Granulationpattern, but not GSP or GHR mutation, is associated with clinical characteristicsin somatostatin-naive patients with somatotroph adenomas. Eur J Endocrinol 2013; 168(4): 491–499.
- Obari A, Sano T, Ohyama K, et al. Clinicopathological features of growth hormone-producing pituitary adenomas: difference among various types defined by cytokeratin distribution pattern including a transitional form. Endocr Pathol. 2008; 19(2): 82-91.
- Sano T, Rong QZ, Kagawa N, Yamada S. Down-regulation of E-cadherin and catenins in human pituitary growth hormone-producing adenomas. Front Horm Res 2004; 32 : 127–132.
- Mete O, Asa SL. Clinicopathological correlations in pituitary adenomas. Brain Pathol 2012; 22(4): 443-453.
- Liu Y, Yao Y, Xing B, et al. Prolactinomas in children under 14. Clinical presentation and long-term follow-up. Childs Nerv Syst 2015; 31(6): 909-916.
- Mete O, Asa SL. Therapeutic implications of accurate classification of pituitary adenomas. Semin Diagn Pathol 2013; 30(3): 158-164.
- Horvath E, Kovacs K, Singer W, et al. Acidophil stem cell adenoma of the human pituitary: clinicopathologic analysis of 15 cases. Cancer 1981; 47(4): 761-771.
- Wang EL, Qian ZR, Yamada S, et al. Clinicopathological characterization of TSH-producing adenomas: special reference to TSH-immunoreactive but clinically non-functioning adenomas. Endocr Pathol 2009; 20(4): 209-220.
- Buliman A, Tataranu LG, Paun DL, Mirica A, Dumitrache C. Cushing‘s disease: a multidisciplinary overview of the clinical features, diagnosis, and treatment. J Med Life 2016; 9(1): 12-18.
- George DH, Scheithauer BW, Kovacs K, et al. Crooke‘s cell adenoma of the pituitary: an aggressive variant of corticotroph adenoma. Am J Surg Pathol 2003; 27(10): 1330-1336.
- Cooper O. Silent Corticotroph Adenomas. Pituitary 2015; 18(2): 225–231.
- Tutal E, Yılmazer D, Demirci T, et al. A rare case of ectopic ACTH syndrome originating from malignant renal paraganglioma. Arch Endocrinol Metab 2017; 61(3): 291-295.
- Byun J, Kim SH, Jeong HS, et al. ACTH-producing neuroendocrine tumor of the pancreas: a case report and literature review. Ann Hepatobiliary Pancreat Surg 2017; 21(1): 61–65.
- Neumann PE, Horoupian DS, Goldman JE, Hess MA. Cytoplasmic filaments of Crooke‘s hyaline change belong to the cytokeratin class. An immunocytochemical and ultrastructural study. Am J Pathol 1984; 116(2): 214–222.
- Crooke A. Change in the basophil cells of the pituitary gland common to conditions which exhibit the syndrome attributed to basophil adenoma. J Pathol Bacteriol 1935; 41(2): 339–349.
- Ho DM, Hsu CY, Ting LT, Chiang H. The clinicopathological characteristics of gonadotroph cell adenoma: a study of 118 cases. Hum Pathol. 1997; 28(8): 905-911.
- Kovacs K, Horvath E, Ryan N, Ezrin C. Null cell adenoma of the human pituitary. Virchows Arch A Pathol Anat Histol. 1980; 387(2): 165–174.
- Asa SL, Mete O. Immunohistochemical biomarkers in pituitary pathology. Endocr Pathol 2018; 29(2): 130-136.
- Casar-Borota O, Botling J, Granberg D, et al. Serotonin, ATRX, and DAXX expression in pituitary adenomas: markers in the differential diagnosis of neuroendocrine tumors of the sellar region. Am J Surg Pathol 2017; 41(9): 1238-1246.
- Miettinen M, McCue PA, Sarlomo-Rikala M. GATA3: a multispecific but potentially useful marker in surgical pathology: a systematic analysis of 2500 epithelial andnonepithelial tumors. Am J Surg Pathol 2014; 38(1): 13–22.
- Osinga TE, Korpershoek E, de Krijger RR, et al. Catecholamine-synthesizing enzymes are expressed in parasympathetic head and neck paraganglioma tissue.Neuroendocrinology 2015; 101(4): 289–295.
- Toledo RA, Burnichon N, Cascon A, et al. Consensus statement on next-generation-sequencing-based diagnostic testing of hereditary phaeochromocytomas and paragangliomas. Nat Rev Endocrinol 2017; 13(4): 233-247.
- Gill AJ, Toon CW, Clarkson A, et al. Succinate dehydrogenase deficiency is rare in pituitary adenomas. Am J Surg Pathol 2014;38(4):560–566.
- Scheithauer BW, Horvath E, Kovacs K, Laws ER Jr, Randall RV, Ryan N. Plurihormonal pituitary adenomas. Semin Diagn Pathol 1986; 3(1): 69-82.
- Ogando-Rivas E, Alalade AF, Boatey J, Schwartz TH. Double pituitary adenomas are most commonly associated with GH - and ACTH-secreting tumors: systematic review of the literature. Pituitary 2017; 20(6): 702-708.
- Amar AP, Hinton DR, Krieger MD, Weiss MH. Invasive pituitary adenomas: significance of proliferation parameters. Pituitary 1999; 2(2): 117-122.
- Thapar K, Kovacs K, Scheithauer BW, et al. Proliferative activity and invasiveness among pituitary adenomas and carcinomas: an analysis using the MIB-1 antibody. Neurosurgery 1996; 38(1): 99-106.
- Heaney AP. Pituitary Carcinoma: Difficult Diagnosis and Treatment. J Clin Endocrinol Metab 2011; 96(12): 3649–3660.
- Scheithauer BW, Kovacs KT, Laws ER, Jr, Randall RV. Pathology of invasive pituitary tumors with special reference to functional classification. J Neurosurg 1986; 65(6): 733-744.
- Kaltsas GA, Nomikos P, Kontogeorgos G, Buchfelder M, Grossman AB. Clinical review: Diagnosis and management of pituitary carcinomas. J Clin Endocrinol Metab 2005; 90(5): 3089-3099.
- Bush ZM, Longtime JA, Cunningham T, et al. Temozolomide treatment for aggressive pituitary tumors: correlation of clinical outcome with O(6)-methylguanine methyltransferase (MGMT) promoter methylation and expression. J Clin Endocrinol Metab 2010; 95(11): 280-290.
- Hirohata T, Asano K, Ogawa Y, et al. DNA mismatch repair protein (MSH6) correlated with the responses of atypical pituitary adenomas and pituitary carcinomas to temozolomide: the national cooperative study by Japan Society for hypothalamic and pituitary Tumors. J Clin Endocrinol Metab 2013; 98(3): 1130-1136.
- Scheithauer BW, Kovacs K, Horvath E, et al. Pituitary blastoma. Acta Neuropathol 2008; 116(6): 657-666.
- Scheithauer BW, Horvath E, Abel TW, et al. Pituitary blastoma: a unique embryonaltumor. Pituitary 2012; 15(3): 365-373.
- Sahakitrungruang T, Srichomthong C, Pornkunwilai S, et al. Germline and somatic DICER1 mutations in a pituitary blastoma causing infantile-onset Cushing’s disease. J Clin Endocrinol Metab 2014; 99(8): 1487-1492.
Štítky
Patologie Soudní lékařství Toxikologie
Článek vyšel v časopiseČesko-slovenská patologie

2019 Číslo 3-
Všechny články tohoto čísla
- Komentár k WHO 2017 klasifikácii nádorov endokrinných orgánov
- …postavenie Spoločnosti slovenských patológov vnímam dosť opatrne
- Monitor aneb nemělo by vám uniknout, že...
- Adenómy hypofýzy – praktický prístup k histopatologickej diagnostike a zmeny v poslednej WHO klasifikácii z roku 2017
- Cytologické vyšetření mozkomíšního moku
- Monitor aneb nemělo by vám uniknout, že...
- Histopatologické hodnocení intenzity a aktivity zánětu u zánětlivých střevních onemocnění: Důležitý doplněk endoskopie nebo marná snaha?
- Monitor aneb nemělo by vám uniknout, že...
- Metanefrický adenóm. Kazuistika a prehľad literatúry
- Změny angiogeneze a imunitních regulací ve stromálním mikroprostředí kožních melanomů
- Neuronálna ceroidná lipofuscinóza s postihnutím srdca
- Monitor aneb nemělo by vám uniknout, že...
- Atypický fibroxantóm, zriedkavý a často nerozpoznaný kožný mäkko-tkanivový nádor – kazuistika a prehľad literatúry
- Třetí ohlédnutí – poznámky k historii (nejen) šumperské patologie
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Cytologické vyšetření mozkomíšního moku
- Neuronálna ceroidná lipofuscinóza s postihnutím srdca
- Adenómy hypofýzy – praktický prístup k histopatologickej diagnostike a zmeny v poslednej WHO klasifikácii z roku 2017
- Atypický fibroxantóm, zriedkavý a často nerozpoznaný kožný mäkko-tkanivový nádor – kazuistika a prehľad literatúry
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



