-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaMONITOR aneb nemělo by Vám uniknout, že...
Vyšlo v časopise: Čes.-slov. Patol., 53, 2017, No. 4, p. 151-158
Kategorie: MONITOR aneb nemělo by vám uniknout, že...
GYNEKOPATOLOGIE
… imunohistochemické vyšetření může být přínosné v diferenciální diagnostice málo diferencovaných karcinomů endometria
Karcinomy endometria představují heterogenní skupinu zahrnující nádory s dobrou i velmi špatnou prognózou. Diferenciální diagnostika dobře diferencovaných prognosticky příznivých nádorů je obvykle snadná, u málo diferencovaných nádorů však může být obtížná. Přesto je přesná diagnostika málo diferencovaných karcinomů klinicky významná a může mít terapeutické dopady. V tomto kontextu připadá v úvahu zejména: i) odlišení málo diferencovaného (grade 3) endometroidního karcinomu (EC G3) od serózního karcinomu endometria (ESC); ii) rozlišení mezi ESC s buňkami se světlou (vodojasnou) cytoplazmou a světlobuněčným karcinomem endometria (CCE); iii) rozlišení mezi ESC a šířením high grade serózního karcinomu (HGSC) pocházejícího primárně z děložní tuby, ovaria, či pánevního peritonea.
Autoři z několika pracovišť se ve své studii zaměřili na možné využití panelu imunohistochemických protilátek ve 3 uvedených základních diferenciálních diagnózách. Metodicky zvolili použití tkáňových mikročipů (TMA) a panel celkem 20 imunohistochemických protilátek. Celkově studie zahrnovala 136 karcinomů endometria (52 ESC, 66 EC G3, 18 CCE) a 156 HGSC ovaria.
Výsledky studie ukázaly statisticky významné rozdíly v 7/17 markerů v indikaci ESC vs. EC G3; 6/17 markerů u ESC vs. CCE a 5/13 markerů u ESC vs. HGSC. Na podkladě těchto výsledků se autoři pokusili vytvořit pro každou uvedenou diferenciální diagnózu algoritmus kombinující několik markerů s nejvyšším potenciálem pro rozlišení jednotlivých nádorů a tím pro rutinní využití. V případě odlišení mezi ESC a EC G3 se jako nejvhodnější ukázala kombinace TP53, PTEN a p16(CDKN2A) se senzitivitou 93,6 % a specifitou 87,8 %. Aberantní exprese TP53 byla zastižena u 100 % ESC a 36 % EC G3; bloková pozitivita p16 u 92 % ESC a 26 % EC G3 a ztráta exprese PTEN u 0 % ESC a 67 % EC G3. Jako nepřínosnou pro uvedenou diferenciální diagnostiku autoři vyhodnotily případy s aberantní expresí TP53, zachovalou expresí PTEN a disperzní (nikoliv blokovou) expresí p16. K odlišení mezi ESC a CCE autoři vyhodnotili jako nejpřínosnější kombinaci napsinu A a estrogenových receptorů (ER) se senzitivitou 97,9 % a specifitou 72,2 %. Napsin A byl pozitivní u 16 % ESC a 82 % CCE a ER byly pozitivní u 80 % ESC a 17 % CCE. Jako alternativu k napsinu A lze použít HNF1B s pouze mírně nižší specifitou (ESC pozitivní ve 23 %, CCE v 83 %). Poslední diferenciální diagnostiku představovalo rozlišení mezi ESC a HGSC. V tomto kontextu se jako významný marker ukázala pouze exprese WT1 se senzitivitou 66 % a specifitou 98 % (exprese WT1 byla zastižena u 34 % ESC a 98 % HGSC).
Závěrem autoři konstatují, že využití imunohistochemických markerů vhodných pro diferenciální diagnostiku uvedených nádorů v rutinní praxi může zvýšit diagnostickou přesnost a její reproducibilitu. Nutno však konstatovat, že nadále jistě zůstane minorita nádorů s morfologicky, imunohistochemicky a molekulárně nejednoznačnými rysy, které se přes veškerou snahu nepodaří do přesné kategorie zařadit.
Zdroj:
Chen W et al. Immunohistochemical profiling of endometrial serous carcinoma. Int J Gynecol Pathol 2017; 36 : 128-139.
- P. Dundr -
HEPATOPATOLOGIE
…morfologické rysy progrese a regrese chronické jaterní léze se mohou lišit obecně i v závislosti na etiologii aneb „Zajde cirhóza na úbytě?“
Tradiční pojetí akutních i chronických jaterních lézí, a zvláště cirhózy jako terminálního ireverzibilního stadia jaterních chorob, bylo v posledních letech na podkladě studií nových terapeutických možností a následného zlepšení stavu pacientů značně zpochybněno. Kolektiv autorů z International Liver Pathology Study Group se pod vedením Alberta Quaglii ve svém obsáhlém přehledovém článku zaměřil na klinicko-patologické koncepty a morfologické rysy regrese a remodelace jaterního parenchymu obecně i v závislosti na etiologii.
Ukazuje se, že vymizení zásadních etiologických faktorů chronické jaterní léze vede často k regresi fibrózy, reparaci parenchymu i zlepšení klinického stavu pacienta. Ani přítomnost porto-centrálních cévních shuntů nemusí znamenat ireverzibilní stadium změn. Morfologický koncept „jaterního reparativního komplexu“, navržený v r. 2000 Wanlessem a jeho spolupracovníky, poskytuje základy pro rozlišení progresivní a regresivní fáze jaterního poškození. Původní popis „regresivních parametrů“ zahrnuje jemná neúplná/perforovaná vazivová septa, izolovaná silná kolagenní vlákna, jemná periportální vybíhající vazivová septa („spikes“), rezidua portobilií, rezidua hepatálních vén s prolapsem hepatocytů, štěpení sept vrůstáním hepatocytů, skupinky hepatocytů v portálních traktech, velmi drobné regeneratorní noduly a aberantní parenchymální vény.
Autoři prezentovaného článku přehledně doplnili i další obecné rysy, odlišující progresivní od regresivní fáze chronických jaterních chorob (Tab. 1):
Tab. 1. Obecné rysy odlišující progresivní a regresivní fázi chronických jaterních chorob. 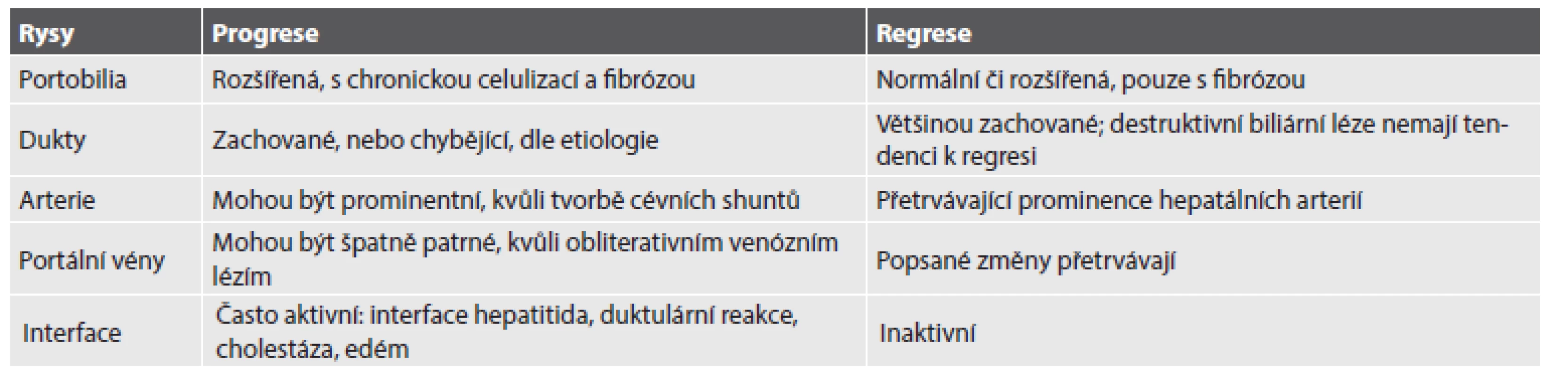
Vzhled fibrózních sept u progresivní léze závisí na etiologii: široká aktivní septa bývají patrná u infekční hepatitidy, jemnější sinusoidální fibróza u toxických či metabolických lézí; regresivní léze se naopak vyznačuje ztenčenými jemnými, případně i diskontinuálními septy. Při regresi zvláště časné fáze léze dochází rovněž k redukci duktulární hyperplazie (NASH, hemochromatóza, chronická hepatitida C). Co se týče parenchymových změn, mohou u progresivních lézí vykazovat typické etiologické rysy, zatímco v rámci regrese se změny včetně poškození hepatocytů či patologických depozit (steatóza, Cu, Fe) obecně utlumují.
Autoři se dále zaměřují na specifičtější rysy jednotlivých fází a typů jaterních chorob, včetně netypických či paradoxních známek, jako např. nárůst reaktivní portální celulizace v rámci regrese časných stádií alkoholické hepatopatie a non-alkoholické steatohepatitidy (NASH), relativní zvýšení množství lymfocytů v biopsiích abstinujících pacientů s pokročilou alkoholickou hepatopatií, přítomnost hepatocytárních rozet a splývajících okrsků stromálního kolapsu jako známky předchozího vzplanutí aktivity u autoimunitní hepatitidy, častou remodelaci původně mikronodulární přestavby na makronodulární u hemochromatózy či alkoholické hepatopatie.
Při posuzování jaterních biopsií by měl dle názoru autorů patolog nejen rozeznat specifické histologické rysy dotyčné léze, ale rovněž se pokusit posoudit dynamiku procesu s depozicí extracelulární matrix i současnými portálními změnami, inflamatorní celulizací a poškozením hepatocytů v rámci progresivní fáze; nebo reabsorpci extracelulární matrix s minimální až absentující inflamací i hepatocelulární lézí u regresivní fáze. Musí mít zároveň na paměti možný variabilní chronologický i topografický průběh choroby s alternujícími fázemi aktivity a naopak následné reparace, výrazně ovlivňující jednorázový vzhled daného bioptického vzorku. Situace může být navíc komplikována souběžným či následným působením odlišných etiologických faktorů, včetně možnosti superponované akutní léze v terénu pokročilé chronické jaterní choroby.
Otázkou rovněž zůstává riziko vzniku a rozvoje hepatocelulárního karcinomu, které není zcela eliminováno ani regresí jaterní léze včetně zmírnění stupně fibrózy při pozitivní odpovědi na terapii, vzhledem k dlouhodobému preexistujícímu souběžnému procesu neoplastické transformace hepatocytů i fibrotizace. Tento fakt vede samozřejmě k nutnosti dlouhodobého sledování i zdánlivě vyléčených pacientů, stejně jako k důrazu na hledání možných prediktivních znaků zvýšeného rizika rozvoje HCC.
Tradiční termín „cirhóza“, implikující ireverzibilní hepatální lézi, začíná být nahrazován označením „pokročilé stadium chronické jaterní choroby“. Název „cirhóza“ je navíc zavádějícím způsobem stále používán rovněž pro označení lézí, které v daném okamžiku v pokročilém stadiu ani nemusejí být (primární biliární cirhóza, v současnosti označovaná jako primární biliární cholangitida). Klasický grading a staging by tedy měl být postupně doplňován sofistikovanějším posouzením progresivní či regresivní fáze léze, regeneratorních a možných funkčních změn.
Zdroj:
Quaglia A et al. The International Liver Pathology Study Group. Role of aetiology in the progression, regression, and parencymal remodelling of liver disease: implications for liver biopsy interpretation. Histopathology 2016; 68 : 953-967.
- V. Žampachová -
DERMATOPATOLOGIE
... nový TNM staging skvamocelulárneho karcinómu kože (AJCC-8) prešiel významnými zmenami
Skvamocelulárny karcinóm kože (SCC) je najčastejšou príčinou úmrtia na nemelanómové kožné malignity. Väčšina SCC so zlým klinickým koncom bola podľa 7. vydania AJCC/TNM stagingu (AJCC-7) klasifikovaná ako T2. Prognostický význam kategórií T3 a T4 bol teda v praxi mininálny, pretože invázia do kostných štruktúr sa vyskytuje pomerne vzácne. Cieľom nového stagingového systému (AJCC-8, platný od začiatku roka 2018) bolo vytvorenie klinicky zmysluplnejších kategórií, ktoré identifikujú high-risk tumory a ktoré budú zaradené do vyššieho stage.
Významnou zmenou v AJCC-8 je, že staging sa týka iba SCC oblasti hlavy a krku, kde sa vyskytuje väčšina kožných SCC. SCC mimo tejto oblasti (okrem SCC penisu, vulvy a slizničnej časti pery) nemajú stagingový systém.
Podobne ako v AJCC-7, klinická veľkosť lézie ≥ 2 cm odlišuje stage T1 a T2. Nádory s veľkosťou ≥ 4 cm sú klasifikované ako T3. V AJCC-7 bola hrúbka lézie (Breslow) > 2 mm považovaná za high-risk charakteristiku, ktorá mohla radiť tumor do kategórie T2. Toto v novej klasifikácii už neplatí. Podľa AJCC-8, hĺbka invázie > 6 mm a/alebo invázia do podkožného tuku radí tumor do kategórie T3. Do kategórie T3 patria aj nádory s perineurálnou inváziou postihujúcou nervy veľkého kalibru (≥ 0,1 mm), nervy v podkožnom tuku, alebo s klinickým/radiologickým postihnutím nervov, ktoré majú anatomické pomenovanie. Malá erózia kosti je ďalšou high-risk charakteristikou, ktorá klasifikuje tumor ako T3. Nádory invadujúce do kosti sú klasifikované jako T4. Kategória T4a zahŕňa nádory s makroskopickou kortikálnou eróziou/infiltráciou drene. Ako T4b sú klasifikované lézie s inváziou bázy lebky a/alebo postihnutím otvorov bázy lebky.
Histologické charakteristiky nádora (nízka diferenciácia a po novom aj dezmoplastický alebo sarkomatoidný rastový vzor) sú menované medzi high-risk charakteristikami, ale na rozdiel od AJCC-7 už nie sú používané ako stagingové kritériá. Podobne, anatomická lokalizácia už neovplyvňuje staging (v AJCC-7 to bola lokalizácia na ušnici alebo ochlpenej časti pery). Medzi high-risk charakteristiky, ktoré zatiaľ neovplyvňujú staging patrí aj prítomnosť imunosupresie. Môže byť zaznamenaná ako kategória „I“ v pri záverečnom reportovaní stage.
Významné zmeny sa týkajú aj N kategórie. Novým kritériom je prítomnosť extranodálnej extenzie - podobne ako je to v prípade ostatných SCC oblasti hlavy a krku.
Autori Monthparti et al. okrem sumarizácie zmien v AJCC-8 v prehľadovom článku podrobne diskutujú aj o prognostických parametroch a klinicky významných histopatologických variantoch kožného SCC.
Zdroj:
Motaparthi K et al. Cullen D et al. Cutaneous squamous cell carcinoma: review of the eighth edition of the American Joint Committee on Cancer staging guidelines, prognostic factors, and histopathologic variants. Adv Anat Pathol 2017; 24 : 171-194.
- M. Švajdler ml. -
ORTOPEDICKÁ PATOLOGIE
… imunohistochemie s DUX4 může odhalit agresivní CIC-DUX4 sarkomy měkkých tkání
Recentně popsané nádory, morfologicky podobné Ewingovu sarkomu (EwS), ale bez charakteristických translokací EwS, zahrnují podtřídu tumorů s fúzí genů CIC a DUX4, tedy t(4;19) či t(10;19), kdy je ve fúzi zaskakován DUX4 jeho paralogem DUX4L. Tyto nádory jsou nazývané „kulatobuněčný sarkom s CIC translokací“, nebo „CIC-DUX sarkom“ a podobně.
Zdá se, že tumory charakterizované touto translokací mají velmi špatnou prognózu, což naznačuje, že jejich patobiologie je odlišná od EwS a podtrhuje význam jejich korektní diagnózy.
Morfologicky jsou CIC-DUX4 nádory charakterizované jaderným pleomorfismem, vakuolizací jader, prominentními nukleoly a geografickými nekrózami. Tvar buněk je ovoidní a okrouhlý, někdy vřetenitý. Finální diagnóza je stanovena s užitím cytogenetických a molekulárních metod.
Autoři monitorovaného článku testovali protilátku namířenou proti C-konci DUX4 proteinu, který reaguje i s DUX4L, ve standardním imunohistochemickém protokolu, na 5 případech CIC-DUX4 sarkomů a sestavě možných mitátorů v diferenciální diagnóze, zahrnující Ewingův sarkom, sarkom podobný Ewingovu sarkomu (BCOR-CCNB3), alveolární rabdomyosarkom, embryonální rabdomyosarkom, synoviální sarkom, desmoplastický tumor z malých okrouhlých buněk, maligní rabdoidní tumor, neuroblastom a světlobuněčný sarkom. Imunohistochemická reakce byla považována za pozitivní, pokud bylo pozorováno silné difúzní zbarvení jader nádorových buněk.
Klinicko-patologické charakteristiky malého souboru 5 CIC-DUX4 sarkomů zahrnovaly věk 10–19 let, poměr ženského k mužskému pohlaví 3 : 2, extraskeletální lokalizaci v axiálních měkkých tkáních v oblasti krku, paraspinálně a pánve. Imunohistochemicky byla ve většině případů membránová pozitivita CD99, jaderná reaktivita WT1, fokální pozitivita cytokeratinů, a negativita svalových markerů. Prognosticky byly sarkomy charakterizovány pokročilou chorobu v čase diagnózy a krátkým přežitím bez choroby.
Imunohistochemie s DUX4 perfektně korelovala s CIC-DUX4 translokací, kdy všech 5 případů v souboru bylo pozitivních a u všech ostatních testovaných nádorů byla reakce negativní. Protilátka DUX4 tak může být užit k rychlému stanovení diagnózy, nebo k nasměrování doplňkových cytogenetických nebo molekulárně genetických analýz.
Zdroj:
Siegele B et al. DUX4 Immunohistochemistry is a highly sensitive and specific marker for CIC-DUX4 fusion-positive round cell tumor. Am J Surg Pathol 2017; 41(3): 423-429.
- K. Veselý -
HEMATOPATOLOGIE
… diagnóza myeloidního sarkomu nemusí být snadná
Myeloidní sarkom (MS) byl kdysi nazýván chlorom, což dobře chápe každý, kdo alespoň jednou na vlastní oči viděl čerstvý nativní řez exstirpovaným tumorem. Fakt je zelenej! Jedná se o naštěstí relativně vzácný tumor morfologicky odpovídající leukemii, ale vznikající extramedulárně. Podle klinického zasazení se odlišuje 1) izolovaný MS (de novo MS) bez současného leukemického postižení kostní dřeně či periferní krve, 2) MS vznikající současně s akutní myeloidní leukémii (AML) ve dřeni, 3) MS vznikající na podkladu myelodysplastického syndromu (MDS), chronické myeloproliferace (MPN) či chronické myeloidní leukémie (CML) a 4) MS jako projev relapsu AML. Historicky se dělily na granulocytický sarkom a monocytický sarkom. Pileri je v roce 2007 navíc rozdělil na variantu blastickou, nezralou a diferencovanou. Ukázalo se však, že histologické dělení podle stupně maturace nádorových buněk není prognosticky ani klinicky významné.
Dosud největší publikovanou sestavu 131 myeloidních sarkomů popsali japonští autoři v AJSP. Všechny čtyři typy MS byly zastoupeny zhruba stejně často. Muži byli v této sestavě postiženi 3x častěji než ženy. Nejčastějším místem vzniku byly uzliny (55 %), následovala kůže a mediastinum (zhruba po 20 %), ostatní lokalizace přicházely už jen v jednotlivých případech. Typy MS se obvykle neodlišovaly v preferenci jednotlivých lokalizací, pouze 4. typ byl častěji než ostatní lokalizován ve varlatech.
Histologický a imunohistologický obraz byl ve všech typech obdobný. Nádorové buňky byly v 70 % případů 2-3x větší než zralý lymfocyt (tedy zhruba na úrovni buněk difuzního velkobuněčného B lymfomu), ve zbylých případech byly zhruba stejně často menší nebo naopak větší. Z myeloidních markerů byla nejčastější exprese myeloperoxidázy (zhruba dvě třetiny případů), zhruba v polovině případů byly pozitivní CD68 (klon KP-1), CD13 a CD33. Asi v 50 % případů bylo několik myeloidních markerů negativních, ale vždy byl pozitivní alespoň jeden. Autoři pohříchu nezmiňují lysozym, CD14 ani histochemický průkaz staré dobré „chlorky“, tedy naftol AS-D chloroacetátesterázy. CD34 byla pozitivní na třech čtvrtinách nádorů, TdT zhruba na čtvrtině. Výsledky průkazu CD117 nebyly popsány.
Nejdůležitější a současně nejobtížnější diferenciální diagnózou de novo chloromu je lymfom, a to zejména T lymfom. Rozlišení je o to obtížnější, že exprese markerů řady T (CD3, CD5 a hlavně CD7) je u MS poměrně běžná a kombinace několika pozitivních znaků řady T byla zastižena u více než třetiny případů MS. Protože klonální přestavba genů pro T buněčný receptor (TCR) byla u AML opakovaně popsána, autoři považují za znak spolehlivěji odlišující MS od T lymfomu imunohistologickou (nebo flowcytometrickou) expresi TCRalfa/beta nebo TCRgama/delta. V této souvislosti se asi sluší připomenout, že život diagnostika může komplikovat i běžná exprese CD45 (LCA), CD43 a CD99 na buňkách MS.
Při analýze celkového přežití nebyl statisticky významný rozdíl mezi de novo MS a MS provázejícím AML, jednoho roku od diagnózy se dožilo 60 % resp. 50 % pacientů. Výrazně horší, pouze 14% přežití však měly případy MS navazující na MDS, MPN či CML a odpovídající tak sekundární akutní leukémii či blastickému zvratu. Exprese znaků řady T stejně jako CD44 a CD56 u MS neměla vliv na prognózu onemocnění. Naproti tomu případy s expresí CXCR4 měly signifikantně kratší přežití.
Diagnóza de novo myeloidního sarkomu bez jiných projevů hematologické malignity je obtížná, v různých sestavách se uvádí, že prakticky polovina případů je primárně diagnostikována špatně, většinou jako velkobuněčný lymfom. Ke klidu nevede ani fakt, že MS má být léčen jako AML a naše diagnóza je tedy slovem do pranice, zejména když u de novo MS může být leukemické postižení dřeně prokázáno až za delší dobu a může se stát, že se klinik vzpírá nasadit agresivní léčebný režim „jen tak“ kvůli nějaké „bouli na krku“.
Zdroj:
Kawamoto K et al. Clinicopathological, cytogenetic, and prognostic analysis of 131 myeloid sarcoma patients. Am J Surg Pathol 2016; 40 : 1473-1483.
- V. Campr -
KARDIOPATOLOGIE
… je zavedena nová metoda léčby kalcifikované aortální stenózy – TAVI
Kalcifikovaná aortální stenóza (KAS) je dnes v rozvinutých zemích nejčastější chlopenní vadou a také nejčastějším objektem kardiochirurgické léčby. Po řadu desetiletí byla klasickou formou operace excize kalcifikované aortální chlopně a její náhrada umělou či biologickou protézou.
Pro pacienty, u nichž je pro extrémní riziko (polymorbidní; věk nad 75-80 roků) chirurgická náhrada kontraindikována, byla počátkem tohoto tisíciletí vyvinuta nová metoda – transkatetrová implantace aortální chlopně (transcatheter aortic valve implantation – TAVI). Její podstatou je, že kalcifikovaná aortální chlopeň je ponechána in situ, a cestou většinou a. femoralis je katetrem zavedena stlačená protéza (bioprotéza z hovězího nebo vepřového perikardu) a umístěna do oblasti aortální chlopně. Jejím roztažením pak je dosaženo stlačení vlastní chlopně, dilatace zúženého lumina a fixace protézy v této pozici; jde v podstatě o stentování aortální chlopně. V případech, kdy těžká skleróza femorální tepny znemožňuje tuto cestu, lze omezeným kardiochirurgickým přístupem protézu zavést z malého otvoru v hrotě levé komory – transapikální přístup. Protéz je řada typů, v podstatě jsou však buď samoexpandibilní či roztažitelné balonkem.
TAVI se stala obecně uznávanou metodou; její mortalita je nižší než u chirurgické náhrady chlopně. Léčba KAS se tak postupně přesunuje z kardiochirurgie na pracoviště invazivní kardiologie. V časném pozákrokovém období TAVI (1. – 3. den) jsou nejčastějšími příčinami smrti kardiogenní šok (selhání srdce) a hemoragický šok, většinou z mechanického poranění během výkonu – ruptury aortálního prstence či aorty; v období 4. – 30. den jsou to kardiogenní šok, sepse a respirační selhání, a v pozdním období (více než 30 dnů) sepse. Komplikacemi zákroku mohou být infarkt myokardu, obstrukce koronárního ústí prstencem protézy, krvácení, disekce aorty, paravalvulární regurgitace z neúplné apozice chlopenní náhrady s aortálním anulem (až ve 12 %), trombóza protézy, trombembolizace, infekční endokarditida, cévní mozková příhoda a v pozdním období (obvykle po 6 – 8 letech) degenerace bioprotézy. Jednoroční mortalita po TAVI je udávána 14 – 31 %.
V České republice byla TAVI zavedena v roce 2008; do poloviny 2016 bylo provedeno celkem 1532 výkonů a jejich počet rychle stoupá. Věk pacientů byl 67 – 89 roků (medián 80 r.) a nemocniční mortalita 3,9 %.
Pro patologa, který provádí pitvu pacienta po TAVI je důležité, aby klinikovi podal co nejpřesnější informaci o zjištěných komplikacích a příčině smrti; proto několik praktických rad:
- Je vhodné pitvat srdce se vzestupnou aortou zvlášť – vypreparované z komplexu hrudních orgánů.
- Je-li možno, preparát zrentgenovat, se zaměřením na pozici protézy.
- Ze strany levé komory i z kořene aorty zrevidovat pozici protézy, zejména její výši v aortě, vztah ke koronárním ústím, vztah k vlastní aortální chlopni a vztah k mitrální chlopni.
- Při revizi vztahu protézy a vlastní chlopně je třeba sondou po celém obvodu zjistit úplnost jejich apozice, s ohledem na poměrně častý tzv. paravalvulární leak.
- Pátrat po přítomnosti vegetací na protéze – trombů či infekční endokarditidy.
- U dlouhých pozákrokových intervalů pátrat po event. degeneraci cípů protézy (rigidita, kalcifikace, ruptury).
- Na závěr opatrně vystřihnout protézu a zrevidovat místo implantace.
- V indikovaných případech histologicky vyšetřit převodní systém srdce.
Zdroje:
1. van Kesteren F et al. Autopsy after transcatheter aortic valve implantation. Virchows Arch 2017; 470 : 331-339.
2. Kala P et al. Český registr TAVI – nemocniční výsledky. Cor et Vasa 2017; 59 : 57-62.
- I. Šteiner -
CYTODIAGNOSTIKA
… v cytopatologii jsme svědky velmi významných změn v indikacích
Změny v modelech screeningových programů cervikálního karcinomu posledních let vykazují v obecné rovině integrací detekce lidských papilomavirů a prodloužením intervalů pokles počtu gynekologických cytologických vyšetření. To uvolňuje jistou pracovní kapacitu v komunitě školených cytotechnologů. V USA se dle dostupných dat od 40. let minulého století, kdy byl zaveden rutinní screening, podařilo snížit incidenci i mortalitu cervikálního karcinomu o polovinu. Uplatněním nových směrnic pro screening se uvolnilo zhruba 30 % pracovní kapacity školených screenerů. Ta byla přesměrována zčásti na ROSE (Rapid On Site Evaluation), nabízí se však celé spektrum dalších aktivit: bakterioskopická mikroskopická vyšetření, hodnocení adekvátnosti renálních biopsií, určování čistoty nádorového vzorku pro Sangerovy sekvenace, výběr preparátů pro molekulární testování, digitalizace obrázků… Cytotechnologové se takto stávají prodlouženou rukou patologa.
V negynekologické cytologii zaznamenáváme vzhledem k neustálému zdokonalování rozlišovacích schopností zobrazovacích technik trvalý nárůst požadavků na vyšetření malých vzorků získaných zčásti metodami tenkojehlové aspirace (Fine Needle Aspiration – FNA), nyní však stále častěji metodou biopsie silnou jehlou („Core Needle Biopsy“ - CNB). Nástroje schopné získat i vícečetné minibioptické CNB vzorky v rukou radiologů představují vyhlídku na kvalitní materiál pro řadu diagnostických testů. Ověření obsahu diagnostických buněk v otiscích z CNB je opět zadáním pro školené cytotechnology. Proces pořízení otisků vyžaduje nepochybně určitý stupeň standardizace a adjustace k typu punktované tkáně. Ve hře je samozřejmě i „nácvičná křivka“ hodnotitelů – předpokládaně a přednostně cytotechnologů.
Popis nových pracovních možností pro cytotechnology ve spolupráci s patology končí citací Darwina: Nepřežívá nejsilnější nebo nejinteligentnější druh, nýbrž nejpřizpůsobivější.
Vysoce kvalifikovaní cytopatologové jsou nejpovolanějšími vytěžit maximum informace z minima vzorku.
Zdroj:
Gonzalez MF et al. Changing Trends and Practices in Cytopathology. Acta Cytol 2017; 61 : 91-95.
- J. Dušková -
NEUROPATOLOGIE
... marker TTF1 pomáha odlíšiť subependymálny obrovskobunkový ependymóm od iných histologicky podobných nádorov
Subependymálny obrovskobunkový astrocytóm (SEGA) je benígny tumor mozgu často asociovaný s tuberóznou sklerózou. Charakteristicky je tvorený obrovskými bunkami a vykazuje typickú, i keď málo špecifickú koexpresiu gliálnych a neuronálnych markerov. Môžu v ňom byť zastúpené aj iné typy buniek ako gemistocytoidné, vretenovité či ganglioidné, s problematickým odlíšením od iných typov nádorov. Okrem toho sú občas zachytené atypické znaky ako vaskulárna proliferácia a nekróza s rizikom chybnej diagnózy glioblastómu. Vaskulárna proliferácia ani nekróza v nádore typu SEGA neznamená agresívnejšie správanie. Správna diagnóza SEGA je dôležitá, pretože ide o jedno z hlavných diagnostických kritérií pre tuberóznu sklerózu, pacienti so SEGA nie sú kandidáti na adjuvantnú terapiu, ako pri agresívnejších gliómoch a môžu profitovať z terapie mTOR inhibítormi.
Autori práce študovali expresiu TTF1 na prípadoch: 24 SEGA, 21 gemistocytických astrocytómov, 24 gangliogliómov, 50 ependymómov, 19 neurocytómov, 7 subependymómov, 3 pleomorfných astrocytómov, 45 difúznych astrocytómov, 46 anaplastických astrocytómov, 40 glioblastómov. TTF1 bolo pozitívne vo všetkých SEGA. Z ostatných nádorov bolo pozitívnych 21-47% neurocytómov, v závislosti od použitého klonu protilátky. Tieto nádory sú ale morfologicky odlišné a nebývajú v diferenciálnej diagnóze SEGA. Okrem toho boli vyšetrené tri fetálne mozgy so zachytenou pozitivitou TTF1 v mediálnej ganglionickej eminencii, čo je prechodná embryonálna štruktúra medzi nucleus caudatus a talamom.
TTF1 je užitočný marker v diferenciálnej diagnostike SEGA od iných nádorov, s ktorými by mohol byť potenciálne zamenený a pravdepodobne pochádza z progenitorových buniek v oblasti mediálnej ganglionickej eminencie.
Zdroj:
Hang JF et al. Thyroid transcription factor-1 distinguishes subependymal giant cell astrocytoma from its mimics and supports its cell origin from the progenitor cells in the medial ganglionic eminence. Modern Pathology 2017; 30(3): 318-328.
- B. Rychlý -
PATOLOGIE GIT
... mezi iatrogenní střevní postižení přibyla anti-PD-1 terapií indukovaná kolitida
Cílená blokáda koinhibičních receptorů T-lymfocytů se pomalu ale jistě dostává do popředí léčby některých pokročilých malignit, jmenovitě např. melanom, dlaždicobuněčný karcinom plic nebo renální karcinom. V současné době jsou známy dvě molekuly, které fungují jako terapeutický cíl blokujících protilátek – cytotoxický T-lymfocytární antigen 4 (CTLA-4) a protein 1 programované buněčné smrti (PD-1). Jak už to v medicíně chodí, slibné experimentální výsledky bývají v praxi vykoupeny vysokou cenou terapie a paletou nežádoucích účinků, mezi které v tomto případě patří indukce autoimunitních onemocnění, postihujících především kůži, endokrinní systém a gastrointestinální trakt. Anti-CTLA-4 indukovaná kolitida je již delší dobu známou komplikací s relativně podrobně popsaným histopatologickým obrazem, který odpovídá akutní kolitidě s prominentními apoptózami kryptové výstelky a často závažným klinickým průběhem s perforacemi střeva. Ačkoliv se dají logicky předpokládat obdobné změny i v rámci anti-PD-1 indukované kolitidy, její morfologický obraz byl doposud popsán v rámci pouze jedné kazuistiky. (1)
O detailnější popis morfologických změn se pokusila skupina autorů z Massachusetts General Hospital. Provedli retrospektivní studii (2) na 10 pacientech s anti-PD-1 terapií mezi lety 2015 a 2016, kteří se klinicky prezentovali příznaky anti-PD-1 indukované kolitidy, kdy vstupními kritérii byla přítomnost průjmu v návaznosti na podanou terapii, zlepšení obtíží po vysazení léčby a vyloučení jiných příčin onemocnění. Dva pacienti byli ze studie vyřazeni z důvodu konkomitantní anti-CTLA-4 terapie. U zbylých pacientů byl zpětně revidován histopatologický nález z první vstupní endoskopie po propuknutí příznaků.
5 z 8 pacientů se prezentovalo obrazem akutní kolitidy s dominující neutrofilní zánětlivou celulizací v lamina propria s kryptitidou a kryptovými pseudoabscesy. Dalším společným znakem byly nápadné apoptózy kryptové výstelky (> 3 apoptózy / 10 krypt) s atrofií krypt, oploštěním epitelu a tvorbou buněčného detritu v lumen krypt, sestávajícího z deskvamovaných nekrotických epitelií a smíšené zánětlivé celulizace (tzn. apoptotické mikroabscesy). Zbylí tři pacienti měli obraz lymfocytární kolitidy s kulatobuněčným zánětlivým infiltrátem v superficiální lamina propria a nápadnou intraepiteliální lymfocytózou, ložiskově i s regresivními změnami povrchového epitelu (oploštění, deplece hlenotvorby). Apoptózy kryptové výstelky byly nekonstantním a pouze nevýrazným jevem, bez atrofie či zániku krypt. Ani v jednom případě nebyly patrny projevy chronicity jako je porucha architektoniky sliznice, přítomnost bazální plazmocytózy nebo panethovská metaplázie.
Zajímavý je následný follow-up pacientů. Choroba dobře reagovala na kortikoterapii a vysazení anti-PD-1 léčby, kdy 7 pacientů dosáhlo kompletní a 1 z pacientů parciální remise. U třech pacientů se však po čase objevil relaps a mikroskopie ukázala obraz aktivní kolitidy, nyní však již s patrnými známkami chronicity včetně defigurace architektoniky sliznice a bazální plazmocytózou. Obraz tak věrně imitoval nespecifický střevní zánět (IBD).
Souhrnem tedy lze říci, že typický obraz anti-PD-1 kolitidy (pokud můžeme u souboru 8 pacientů slovo „typické“ vůbec použít) je obdobný jako při anti-CTLA-4 léčbě a je jím akutní kolitida s nápadnou apoptózou výstelky krypt, na druhém místě pak obraz lymfocytární kolitidy. Nález tak není zcela specifický a diferenciální diagnóza široká. Aktivní kolitida bez známek chronicity staví do popředí zejména infekční „self-limited“ kolitidu, prominentní apoptózy pak GVHD, léky indukované kolitidy (především terapie mykofenolát mofetilem), CMV infekci nebo autoimunitní enteropatii. Autoři tak doporučují v rámci zvažované anti-PD-1 kolitidy rutinní imunohistochemické vyloučení CMV. Co se týče lymfocytární kolitidy, její dobře popsaná asociace s různými imunopatologickými onemocněními (zejména céliakie, dále např. diabetes mellitus 1. typu) by měla vést k jejich klinickému vyloučení i v tomto případě. Největším diagnostickým oříškem však zůstávají rekurentní anti-PD-1 kolitidy, jejíž obraz může být neodlišitelný od IBD, včetně znaků pro tuto skupinu chorob téměř signifikantních, jako je bazální plazmocytóza. Napomoct může nález početných kryptových apoptóz, které nejsou pro IBD typické.
Práce amerických autorů tak dokládá dvě nám patologům již notoricky známé skutečnosti – že ani tato choroba nemá specifický morfologický obraz a kruciální je znalost podrobné anamnézy a klinických údajů. A že tu máme další specialitku, která by „samozřejmě měla být standardní součástí naší diferenciální diagnostiky při každé střevní biopsii, se kterou máme co do činění.“
Zdroje:
1. Baroudjian B et al. Anti-PD1-induced collagenous colitis in a melanoma patient. Melanoma Res 2016; 26(3): 308-311.
2. Chen JH et al. Histopathologic features of colitis due to immunotherapy with anti-PD-1 antibodies. Am J Surg Pathol 2017; 41(5): 643-654.
- O. Fabián -
PATOLOGIE MAMMY
… byla reprezentativněji zmapována exprese PD-L1 na sestavě mamárních karcinomů. Jeden váleček nestačí
Cílená léčba inhibitory imunitních kontrolních bodů recentně prochází obdobím bouřlivého rozvoje a „počátečního nadšení“, i když fáze „realizačního vystřízlivění“ je pravděpodobně již na obzoru. Inhibitory však nepochybně najdou své místo v arzenálu moderních onkologických přístupů. Karcinom prsu se dosud v neustále se rozšiřujících se schválených indikacích neobjevil. Je ovšem známo, že část nádorů PD-L1 exprimuje, zejména nádory triple negativní a tato exprese významně koreluje s lymfocytární infiltrací. Největší dosud provedená studie (1) zahrnula skoro 4000 případů v TMA, ukázala však jen 1,7 % pozitivních případů. Recentnější studie (2) na to šla poněkud jinak a vyšetřila nádorů sice méně, ale ve větším rozsahu, včetně metastáz, pokud byly dosažitelné.
Výsledek byl významně odlišný: z 245 primárních nádorů zahrnujících plné histomorfologické spektrum bylo celkem 12 % pozitivních, s vyšším zastoupením pozitivity v karcinomech s medulárními (57 %), apokrinními (27 %) či metaplastickými (40 %) rysy. Z triple negativních nádorů bylo pozitivních 32 %. Konkordance mezi primárním nádorem a metastázou byla přítomna v 94 % případů. Z metodického hlediska je podstatné, že difuzní exprese v rámci celého nádoru se vyskytla jen u celkových 2 % případů, u triple negativních pak u 5 % případů. Pouze u poloviny nádorů byla pozitivita zachycena ve všech vyšetřených punkčních válečcích.
Je zřejmé, že u karcinomu prsu je indukovaná lokální a fokální overexprese PD-L1 častější, než difuzní exprese spojená s konstitutivní aktivací. Význam těchto rozdílů pro výsledek eventuelní cílené léčby musí být prověřen v klinických studiích. Problémům s prahem pozitivity se tedy, analogicky s jinými nádory, ani zde nevyhneme. Jedno je však jasné: na rozdíl od ostatních markerů vyšetření jednoho punkčního válečku ke stanovení negativního výsledku nestačí.
Zdroje:
1. Ali HR et al. PD-L1 protein expression in breast cancer is rare, enriched in basal-like tumours and associated with infiltrating lymphocytes. Ann Oncol 2015; 26 : 1488-1493.
2. Dill EA et al. PD-L1 Expression and intratumoral heterogeneity across breast cancer subtypes and stages: an assessment of 245 primary and 40 metastatic tumors. Am J Surg Pathol 2017; 41(3): 334-342.
- R. Nenutil -
UROPATOLOGIE
… možná máme vysvětlení pro nález morfologicky jasných translokačních Xp11.2 renálních karcinomů, kde ale nejsme schopni potvrdit nález geneticky
Translokační Xp11.2 renální karcinomy jsou morfologicky daleko variabilnější, než jsme si zpočátku představovali. Za poslední dobu bylo identifikováno několik fúzních partnerů TFE3, které vytvářejí relativně specifické morfologické varianty.
Z vlastní praxe znám případy, kdy morfologie byla velmi sugestivní pro Xp11.2 translokační karcinom, imunohistochemické vyšetření TFE3 bylo alespoň částečně pozitivní a přesto jsme nebyli schopni pomocí FISH prokázat zlom genu TFE3.
V současné době se považuje FISH za hlavní metodiku průkazu translokace a imunohistochemický průkaz proteinu TFE3 pouze za metodu screenovací či podřazenou FISH. Argani et al publikovali v květnovém čísle American Journal of Surgical Pathology (2017) 3 případy renálních tumorů, které přesně odpovídaly výše popsané situaci (1). Na základě kazuistiky publikované v cytogenetické literatuře vyvinuli sondu, která je schopna zachytit RBM10-TFE3 genovou fúzi. RBM10 je lokalizovaný pouze 1.8 mb od TFE3 na krátkém raménku chromozomu X a je velmi obtížné hodnotit abnormality v takto krátkém úseku.
Shodou okolností, velmi podobný fenomén popisují čínští autoři Xia et al ve stejném čísle American Journal of Surgical Pathology, zde navíc s melanotickými rysy (2).
Toto je tedy možné vysvětlení falešně negativních výsledků FISH při hodnocení jinak „jasných“ translokačních Xp11 renálních karcinomů.
Zdroje:
1. Argani et al: RBM10-TFE3 renal cell carcinoma. A potential diagnostic pitfall due to cryptic intrachromosomal Xp11.2 inversion resulting in false-negative TFE3 FISH. Am J Surg Pathol 2017; 41 : 655-662.
2. Xia et al: Xp11 translocation renal cell carcinomas (RCCs) with RBM10-TFE3 gene fusion demonstrating melanotic features and overlapping morphology with t(6;11) RCC. Interest and diagnostic pitfall in detecting paracentric inversion of TFE3. Am J Surg Pathol 2017; 41 : 663-676.
- O. Hes -
PULMOPATOLOGIE
... imunohistochemie může pomoci zlepšit diagnostiku malobuněčného plicního karcinomu a zpřesnit diferenciálně diagnostickou rozvahu
Malobuněčný plicní karcinom (SCLC) je v typických případech relativně snadno diagnostikovatelný ze standardního barvení. Charakteristický obraz nádoru však může být často modifikován zejména v malých vzorcích získaných endoskopickými metodami, kde sice odběrové artefakty napomáhají diagnóze, ale mohou být často zavádějící a výrazně komplikující. I v relativně dobře zachovaných nádorech může být navíc problémem odlišit bazaloidní variantu dlaždicobuněčného karcinomu, hematologické malignity, sarkomy z „malých tmavých buněk“ a další nádory. Rovněž je třeba odlišit ostatní neuroendokrinní nádory, jako atypický karcinoid nebo velkobuněčný neuroendokrinní karcinom. V 2. letošním čísle Journal of Thoracic Oncology byla publikována zajímavá studie, ve které nejzářivější hvězdy současné plicní patologie hodnotily 79 případů nádorů v prvním kole pouze ze standardního barvení, ve druhém kole si každý mohl zvolit libovolné barvení a ve třetím kole mel každý k dispozici celou sadu imunohistochemických vyšetření čítající různé typy cytokeratinů, neuroendokrinní markery, Ki-67, CD45, TTF-1 a P63/P40. Velmi zajímavý byl výběr markerů, protože absolutně nejčastěji byl požadován proliferační marker Ki-67 (77 ze 79), který by mnoho autorit s ohledem na možnost počítání mitóz mohlo předem odsoudit, ale zde se jasně ukázalo, že šedá je teorie a zelený strom života. Nepřekvapilo, že druhým nejčastěji požadovaným vyšetřením byl marker neuroendokrinní diferenciace, byť významná převaha synaptofyzinu (70/79) oproti CD56 (44/79) poněkud překvapující je. Možná ale do výběru protilátek zasáhl fakt, že hodnotitelé si mohli zvolit maximálně 5 různých barvení.
Finálně se hodnotila interobservační shoda, která se v prvním kole, tedy bez využití imunohistochemie, pohybovala na „pouhých“ 64,7 % - vezmeme-li v úvahu hvězdný tým účastníků, která se po užití speciálních metod vyšplhala na 77,5 %. Jistě není překvapující, že nejvíce speciální metody pomohly k potvrzení diagnózy SCLC a odlišení hematologických malignit a sarkomu z malých tmavých buněk, i když dramatický nárůst kappa skóre u posledně jmenovaných entit byl dozajista podmíněn i velmi malým počtem zařazených případů (4/79).
V poslední části se autoři zaobírají navržením optimálního spektra protilátek, které by co nejlépe podpořily diagnózu SCLC a které by byly nejužitečnější v rámci diferenciálně diagnostických obtíží. Součástí sdělení je i precizně připravená a velmi užitečná tabulka shrnující výhody jednotlivých protilátek v diferenciálně diagnostickém procesu SCLC včetně odkazů na literaturu. Opravdovou třešničkou na dortu je pak trochu komplikované, ale velmi podrobné schéma postupu, jak k diagnóze SCLC přistupovat.
Spíše k pobavení je následná přestřelka mezi statistickým puristou a Erickem Thunnissenem ohledně přesného významu uvádění kappa skóre a z toho plynoucích závěrů, která však nic neubírá na závěru práce. Diagnostikovat SCLC pouze ze standardního barvení lze v optimálních případech s relativně dobrou mírou diagnostické jistoty, která ale i ve skupině erudovaných specialistů nepřesáhla 2/3. Naopak při užití chytře zvoleného spektra protilátek lze přesáhnout 3/4 hranici diagnostické shody. Závěrem lze tedy shrnout, že v současné době je diagnostika SCLC ze standardního barvení možná, ale v případě sebemenší diagnostické nejistoty by patolog měl použít promyšlený soubor protilátek, kterými tuto diagnózu podpoří či zamítne, protože terapeutické a prognostické konsekvence (mis)diagnózy SCLC jsou obrovské.
Zdroje:
1. Thunnissen E et al. The use of immunohistochemistry improves the diagnosis of small cell lung cancer and its differential diagnosis. An international reproducibility study in a demanding set of cases. J Thorac Oncol 2017; 12(2): 334-436.
2. Sabour S. Immunohistochemistry improves the diagnosis of small cell lung cancer; statistical issue on reproducibility analysis. J Thorac Oncol 2017; 12(6): e69.
3. Thunnissen E et al. Reply to letter „The use of immunohistochemistry improves the diagnosis of small cell lung cancer and its differential diagnosis. an international reproducibility study in a demanding set of cases. J Thorac Oncol 2017; 12(6): e70-e71.
- R. Matěj -
NEFROPATOLOGIE
... pacienti s ANCA pozitivními vaskulitidami se budou léčit místo imunosupresí antibiotiky!?
Během posledních několika let byl prokázán vliv lymfocytů TH17 na několik typů autoimunních onemocnění, včetně vysoce agresivních glomerulonefritid (GN) se srpky. Převedení těchto znalostí do našeho přístupu k pacientům z pohledu diagnostiky a léčby bylo nejisté a v praxi zatím nulové. Tato komplexní práce začíná náš pohled měnit. Autoři v myším experimentu přímo prokázali, že TH17 lymfocyty cestují do ledvin ze střeva; a v ledvinách jsou hnací silou poškození tkáně.
TH17 buňky jsou hojné v lamina propria tenkého střeva, byly ale také identifikovány v myších modelech GN se srpky i v humánních biopsiích přímo v ledvinách, kde produkcí cytokinů přispívají k atrahování neutrofilů a rozvoji GN. Nebylo jasné odkud se lymfocyty TH17 do ledvin dostanou. Současná práce přímo dokazuje, že v myším experimentu cestují TH17 lymfocyty do ledvin za střeva (cestou, která je závislá na receptoru SIP-receptor1 a následně CCL20/CCR6).
Kromě průkazu vycestování TH17 lymfocytů ze střeva provedli autoři další experimenty s limitací a na druhé straně aktivací TH17 lymfocytů. Indukovali GN se srpky myším bez osídlení GIT (germ-free). Absence mikrobiomu v GIT vedla k chybění střevních TH17 lymfocytů a 10 dní po indukci GN měly myši méně glomerulárního i tubulárního poškození a současně bylo ve tkáni méně TH17 lymfocytů. Kromě toho v dalším experimentu potlačili mikrobiom koktailem širokospektrých antibiotik před indukcí GN a výsledek byl prakticky stejný (nízký počet TH17 v ledvině, redukce poškození glů i intersticia). Protože vankomycin se ve střevě nevstřebává, použili dále toto orálně podávané antibiotikum, které cílilo pouze na mikrobiom střeva. Potlačení a spektrum přetrvávající střevní flory ověřili na genové úrovni sekvenováním. Vankomycin redukoval počet TH17 lymfocytů ve střevě i v ledvině. Snížil expresi IL-17A střevních γδ T lymfocytů; tato exprese zůstala nezměněná v ledvině, což odpovídá tomu, že γδ T lymfocyty jsou součástí normálního prostředí v ledvině. Dalšími sofistikovanými postupy prokázali potlačení zánětu na úrovni cytokinů a chemokinů, genové regulace a také mechanismů atrahování polynukleárů. I zde došlo k menšímu poškození glů a intersticia.
Posledním experimentem byla aktivace zánětu infikováním myší Citrobacterem rodentium. Infekce zvýšila TH17 odpověď ve střevě, vyšší počet TH17 buněk byl prokázán v ledvině a také morfologické poškození ledviny bylo významnější. Všechny experimenty mají i histopatologickou dokumentaci. V těchto experimentech autoři prokázali, že deplece Th17 lymfocytů ve střevě zlepší onemocnění ledvin a na druhé straně aktivace střevního zánětu infekcí Citrobacterem redentium postižení ledvin zhorší.
Zdá se to neuvěřitelné, ale léčba cílená na rezervoár TH17 lymfocytů ve střevě by mohla představovat terapeutickou strategii v případě autoimunních onemocnění včetně vysoce agresivních ANCA pozitivních GN.
Zdroj:
Krebs CF et al. Autoimmune renal disease is exacerbated by S1P-receptor-1-dependent intestinal TH17 cell migration to the kidney. Immunity 2016; 45 : 1078–1092.
- E. Honsová -
PATOLOGIE ORL OBLASTI
… sinonazální adenokarcinomy neintestinálního typu lze považovat za seromucinózní adenokarcinomy
Adenokarcinomy sinonazálního traktu jsou celkově vzácné a lze je klasifikovat buď jako adenokarcinomy slinných žláz, nebo jako adenokarcinomy intestinálního, resp. neintestinálního typu. Etiopatogeneze posledních dvou typů nádorů je zatím nejasná. U adenokarcinomu intestinálního typu, jehož vznik je spojen s profesionální expozicí různým chemickým látkám a dřevnému prachu, se předpokládá, že by mohl vznikat z ložisek intestinální metaplázie sinonazální sliznice. U adenokarcinomu neintestinálního typu zatím nebyla případná prekurzorová léze identifikována.
Autoři Purgina et al. se ve své práci zaměřili na detailnější analýzu sinonazálních adenokarcinomů intestinálního a neintestinálního typu, včetně porovnání exprese DOG1, SOX10 a S100, které jsou v patologii slinných žláz považovány za nové markery „seromucinózní“ diferenciace. Zatímco u všech adenokarcinomů intestinálního typu byla exprese těchto markerů negativní (s výjimkou jednoho DOG1-pozitivního případu), tak u adenokarcinomu neintestinálního typu byla zjištěna exprese S100 u 14/19 případů, DOG1 u 13/19 případů a SOX10 u 7/9 případů. Zajímavým nálezem byla dále exprese CDX2 u třech případů adenokarcinomu neintestinálního typu v okrscích skvamoidních morul. Tento nález je třeba mít na paměti v rámci diferenciální diagnostiky adenokarcinomu intestinálního typu, který však exprimuje tento marker difúzně.
Závěrem autoři konstatují, že přinejmenším část sinonazálních adenokarcinomů neintestinálního typu, zejména ty nízkého stupně malignity, má seromucinózní diferenciaci, která by mohla být v budoucnu jejich definujícím znakem. V publikaci se autoři kupodivu blíže nevyslovují k tomu, zda se na základě svých výsledků domnívají, že tyto typy adenokarcinomů vznikají z malých slinných žlázek sinonazální sliznice či nikoli. V každém případě lze výše uvedené markery využít v diferenciální diagnostice adenokarcinomů sinonazálního traktu.
Zdroj:
Purgina B et al. A subset of sinonasal non-intestinal type adenocarcinomas are truly seromucinous adenocarcinomas: a morphologic and immunophenotypic assessment and description of a novel pitfall. Head Neck Pathol 2015; 9(4): 436-446.
- J. Laco -
PATOLOGIE GIT
… nastaly změny v diagnostice a terminologii málo diferencovaných neuroendokrinních nádorů – NEC G3 versus NET G3 – co aktuálně platí?
Stále častěji se v literatuře i na odborných fórech můžeme setkat s prezentací určitých navržených změn v terminologii neuroendokrinních karcinomů (zatím jen?) gastroenteropankreatické oblasti. Podstatou těchto návrhů je reflektovat nové poznatky v biologickém chování těchto nádorů a přizpůsobit jim nomenklaturu. V současné době dělíme neuroendokrinní nádory (jak samozřejmě všichni vědí) na neuroendokrinní tumory (NET G1 a NET G2) a neuroendokrinní karcinomy (NEC G3). Podstata navrhovaných změn spočívá v rozdělení skupiny NEC na dvě, konkrétně oddělit skupinu s nižší proliferační aktivitou (index KI-67 méně než 55%) z NEC a etablovat ji jako kategorii NET G3. Podkladem těchto návrhů jsou práce, dokládající rozdíly v prognóze, odpovědi na léčbu i genetickém profilu (zejména mutace v genech RB1 a TP5) mezi oběma skupinami.
Z pohledu bioptických nálezů je otázkou, kdy a zda již začít užívat tuto novou terminologii v konkrétních bioptických případech; z tohoto pohledu se mi jako nejlepší jeví přístup ENETS (evropská pracovní skupina pro NEN). Z pohledu jejich aktualizovaných guideline, kde není zatím kategorie NET G3 zavedena, bude dle mého názoru lepší s nomenklaturními změnami počkat až na jejich včlenění a kodifikaci v nové WHO klasifikace nádorů GIT, kde snad budou i definovány upravené algoritmy pro histopatologickou a ev. molekulární diagnostiku těchto nádorů.
Zdroje:
1. Tang LH et al. Well differentiated neuroendocrine tumors with a morphologically apparent high grade component: a pathway distinct from poorly differentiated neuroendocrine carcinomas. Clin Cancer Res 2016; 22 : 1011-1017.
2. Garcia-Carbonero R et al. ENETS Consensus Guidelines for High-Grade Gastroenteropancreatic Neuroendocrine Tumors and Neuroendocrine Carcinomas. Neuroendocrinology 2016; 103 : 186–194.
- T. Jirásek -
GYNEKOPATOLOGIE
… v oblasti děložního hrdla a vagíny byly popsány léze připomínající seborhoickou keratózu s možným vztahem k low risk HPV infekci
V dolním ženském pohlavním systému se vzácně vyskytují epiteliální proliferace s dlaždicobuněčnou nebo uroteliální morfologií, které však histologicky neodpovídají tradičním kategoriím nenádorových afekcí, prekanceróz nebo karcinomů obvyklých v této lokalizaci. Autoři revidovali celkem 7 konzultačních případů z oblasti děložního hrdla a vagíny s původními diagnózami od seborhoické keratózy přes invertované papilomy z přechodního epitelu, epitelový nádor nejasného maligního potenciálu až po karcinomy in situ. Všechny tyto afekce byly tvořeny solidně nebo trabekulárně uspořádanými cytologicky blandními epitelovými buňkami bazaloidního nebo uroteliálního vzhledu. V centru čepů byly konstantně pozorovány buňky se širší cytoplazmou a známkami dlaždicobuněčné diferenciace. V některých případech byly patrné periferní palisády. Mitotická aktivita byla variabilní, ovšem bez přítomnosti atypických mitóz. Koilocytóza nebyla zaznamenána. Léze odstraněné v kontinuitě s okolní tkání rostly exofyticky, zatímco léze zaslané ve fragmentech budily dojem invertovaného růstu do stromatu. Jednoznačná stromální invaze nebyla v žádném z případů zastižena.
Imunohistochemicky byly všechny léze difúzně pozitivní v průkazu markeru p63 a cytokeratinů CK 5/6 a 34βE12. CK 20 byl ve všech případech negativní. Marker GATA3 byl negativní ve 2 případech, fokálně slabě pozitivní ve 4 afekcích a difúzně slabě v 1 lézi. Marker p16 byl negativní anebo vykazoval fokální mozaikovou pozitivitu. Molekulární analýza prokázala přítomnost HPV 42 ve 3 případech.
Na základě histologického vzhledu a imunoprofilu dospěli autoři studie k závěru, že jde o léze spíše s dlaždicobuněčnou a nikoliv uroteliální diferenciací. To je v souladu s konceptem prosazovaném v posledním vydání WHO klasifikace nádorů ženského pohlavního systému, kde byla kategorie uroteliálních nádorů ve všech lokalizacích ženského genitálu prakticky zrušena (s výjimkou Brennerových nádorů ovaria). Ačkoliv se výskyt nenádorových metaplastických uroteliálních lézí v ženském genitálu i nadále připouští, výše popsaný imunofenotyp není s touto možností příliš konzistentní. Pokud lze tedy akceptovat dlaždicobuněčný původ afekcí, navrhují pro ně autoři termín „léze připomínající seborhoickou keratózu“ z důvodu jejich morfologické podobnosti s kožní iritovanou seborhoickou keratózou. Výsledky HPV testace naznačují vzhledem k přítomnosti HPV 42 možnou souvislost s low risk HPV infekcí. Jednoznačný průkaz etiologického spojení to nicméně není a navíc byla více než polovina případů zařazených do studie HPV negativní. Podobně rozporuplné výsledky přinesly i studie týkající se seborhoické keratózy vulvy, kdy některé práce prokázaly přítomnost low risk HPV (především HPV 6), zatímco jiné HPV DNA nedetekovaly.
Přínos studie vidím především v pokusu o sjednocení terminologie vzácné skupiny dlaždicobuněčných (resp. „uroteliálních“) lézí dolního ženského pohlavního systému s vyhraněným histologickým obrazem, nicméně přesvědčivé potvrzení kauzálního spojení s HPV infekcí je nutno ještě podpořit dalšími daty.
Zdroje:
Talia KL et al. Seborrheic keratosis-like lesions of the cervix and vagina: Report of a new entity possibly related to low-risk human papillomavirus infection. Am J Surg Pathol 2017; 41(4): 517-524.
- P. Škapa -
Štítky
Patologie Soudní lékařství Toxikologie
Článek vyšel v časopiseČesko-slovenská patologie

2017 Číslo 4-
Všechny články tohoto čísla
- Molekulární šachová partie s nádory – update terapeuticko-indikační patologie
- Tajemná role oligodendroglie v rozvoji neurodegenerací
- MONITOR aneb nemělo by Vám uniknout, že...
- Molekulární patologie plicních karcinomů pro rutinní praxi – update 2017
- Molekulární mechanizmy primární a sekundární rezistence, molekulárně-genetické znaky a vlastnosti KIT/PDGFRA nemutovaných GIST
- Jaká je Vaše diagnóza? (1)
- Co nového v Ewing-like family aneb malobuněčné/kulatobuněčné sarkomy měkkých tkání a kostí s rearanží genů CIC a BCOR. Přehled problematiky a naše prvotní zkušenosti
-
Jaká je Vaše diagnóza? (1)
Odpověď -
Vzpomínka na prim. MUDr. Josefa Mikuláštíka
(* 18.2. 1943 - † 20.7.2017) - Jaká je Vaše diagnóza? (2)
-
Hamartom ze zralých kardiomyocytů.
Pitevní kazuistika -
Jaká je Vaše diagnóza? (2)
Odpověď - JAK SE VÁM LÍBÍ
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Co nového v Ewing-like family aneb malobuněčné/kulatobuněčné sarkomy měkkých tkání a kostí s rearanží genů CIC a BCOR. Přehled problematiky a naše prvotní zkušenosti
- Molekulární patologie plicních karcinomů pro rutinní praxi – update 2017
- Molekulární mechanizmy primární a sekundární rezistence, molekulárně-genetické znaky a vlastnosti KIT/PDGFRA nemutovaných GIST
-
Jaká je Vaše diagnóza? (1)
Odpověď
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



