-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaIncidence karcinomu prostaty v preparátech po radikální cystoprostatektomii. Histopatologická charakteristika nádorů a posouzení vlivu histologického zpracování preparátu na incidenci nádoru
Incidence of prostate cancer in radical cystoprostatectomy specimen. Histopathological characteristics of tumor and the influence of the method of histological processing on the occurrence of incidental prostate cancer
Aim: Radical cystoprostatectomy (RCP) as a surgical procedure in the treatment of invasive bladder cancer requires a high degree of radicality. Surgical techniques sparing prostate apex or capsule involve the risk of residual urothelial carcinoma or incidental prostate cancer (IKP). The aim of this work is to assess the occurrence, histopathological characteristics of IKP and the influence of the method of histological preparation processing on the occurrence of IKP.
Material and methods: A group of 91 patients after RCP were evaluated retrospectively, with procedures performed from January 2009 to August 2019. In 42 patients the prostate was evaluated by theblock method, in 49 patients the whole-mount section (WMS). The work assessed the histopathological characteristics of IKP. Criteria for non-significant IKP determination: Gleason score ≤ 6, organ-limited disease (no extracapsular extension, no seminal vesicle invasion, NO), tumor size ≤ 0.5 cm3 .
Results: One patient was excluded from the evaluation. The overall incidence of IKP was 24.4%. With the WMS processing method the incidence was 43.8 %, while with the process ‑ ing blocks method it was only 2.4 %. Localized IKP was 95.5 %, 72.7 % of cases had GS ≤ 6. The average tumor volume was 1.90 ± 3.50 cm3 . Ten tumors (45.5 %) were evaluated as non-significant IKP. Statistically significant difference between significant / non-significant IKP was only in tu ‑ mor volume, 3.40 ± 4.25 cm3 vs 0.10 ± 0.10cm3 , p = 0.021. There was also a significant difference between GS ≤ 6 vs, GS> 7 and tumor significance (p = 0.012) and between number of tumors with volume ≤ 0.5 cm3 and tumor significance, 3 vs. 10 tumors (p = 0.0000). The median follow-up was 19.5 months, with no clinical manifestation of IKP and no need to start treatment.
Conclusion: In our cohort the method used to prepare a histological specimen has a significant effect. Using the WMS technique, the IKP capture was significantly higher.
Keywords:
prostate cancer – Incidental – Bladder cancer – significant
Autoři: Vladimír Šámal 1,2; Igor Richter 3; Vít Paldus 1; Tomáš Jirásek 4; Jan Mečl 1
Působiště autorů: Urologické oddělení, Krajská nemocnice Liberec, a. s., Liberec 1; Urologická klinika Fakultní nemocnice a Lékařské fakulty UK, Hradec Králové 2; Onkologické oddělení, Krajská nemocnice Liberec, a. s., Liberec 3; Oddělení patologie, Krajská nemocnice Liberec, a. s., Liberec 4
Vyšlo v časopise: Ces Urol 2020; 24(1): 42-50
Kategorie: Originální práce
Souhrn
Cíl: Radikální cystoprostatektomie (RCP) jako onkochirurgický výkon při léčbě invazivního kar ‑ cinomu močového měchýře vyžaduje vysoký stupeň radikality. Techniky šetřící apex nebo kapsulu prostaty s sebou přinášejí riziko postižení prostaty uroteliálním karcinomem nebo riziko incidentálního karcinomu prostaty (IKP). Cílem práce je posoudit výskyt, histopatologickou charakteristiku IKP a vliv metody zpracování histologického preparátu na výskyt IKP.
Materiál a metoda: Retrospektivně jsme zhodnotili soubor 91 pacientů po RCP provedených od ledna 2009 do srpna 2019. U 42 pacientů byla prostata hodnocena metodou bloků, u 49 pacientů pak metodou celoplošných řezů (WMS). Práce posuzovala histopatologickou charakteristiku IKP. Kritéria pro stanovení nesignifikantního IKP: Gleason skóre ≤ 6, onemocnění ohraničenéna orgán (bez extrakapsulárního šíření, bez invaze semenných váčků, N0), velikost nádoru ≤ 0,5 cm3 .
Výsledky: Celková incidence IKP v souboru byla 24,4 %. Při zpracování metodou WMS 43,8 %, při zpracování metodou bloků pouze 2,4 %. IKP lokalizovaných na prostatu bylo 95,5 %, GS ≤ 6 mělo 72,7 % pacientů. Průměrný objem nádoru činil 1,90 ± 3,50 cm3 . Jako nesignifikantních IKP bylo vyhodnoceno deset nádorů (45,5 %). Statisticky významný rozdíl mezi signifikantním/nesignifikantním IKP byl pouze u objemu nádoru, 3,40 ± 4,25 cm3 vs. 0,10 ± 0,10 cm3 (p = 0,021). Významný byl také rozdíl mezi GS ≤ 6 vs. GS > 7 a signifikantností nádoru (p = 0,012) a mezi počtem nádorů ≤ 0,5 cm3 a signifikantností nádoru, 3 vs. 10 nádorů (p = 0,0000). Medián doby sledování byl 19,5 měsíců, u nikoho se IKP klinicky neprojevil a nebylo potřeba zahájit léčbu.
Závěr: V souboru jsme prokázali vliv použité metody na přípravu histologického preparátu. Při použití WMS techniky byl záchyt IKP výrazně vyšší.
Klíčová slova:
Incidentální – karcinom prostaty – karcinom močového měchýře – signifikantní
ÚVOD
Radikální cystoprostatektomie je stále standardem léčby invazivního karcinomu močového měchýře (KM) a recidivujícího povrchového KM v případech, že selhává adjuvantní intravezikální léčba. Karcinom prostaty (KP) je nejčastější maligní nádor u mužů v ČR, jeho incidence stoupá. Prevalence latentního KP je ještě vyšší, než klinicky diagnostikované případy (1).Radikální cystoprostatektomie (RCP) jako onkochirurgický výkon vyžaduje vysoký stupeň radikality s odstraněním bloku močového měchýře, prostaty, semenných váčků a rozšířenou pánevní lymfadenektomií. Mezi možné komplikace radikálního výkonu v malé pánvi patří také erektilní dysfunkce a inkontinence moči v případě ortotopické derivace moči. U mladších pacientů je možno volit operační techniku s ohledem na lepší kontinenci a zachování sexuální funkce. Patří mezi ně, kromě nervy šetřících výkonů, také šetření apexu prostaty nebo prostatické kapsuly v onkologicky bezpečných případech s cílem zlepšení kontinence a erekce (2, 3). Jde samozřejmě o určitý kompromis chirurgické radikality a lepší kvality života, přináší s sebou riziko postižení prostaty uroteliálním karcinomem a riziko incidentálního karcinomu prostaty (IKP). Historicky se prostata vyšetřovala metodou bloků. Zpravidla se zhotovily 3–4 řezy prostatou a z každého bylo provedeno několik bloků. Z každého bloku se pak vyhotovilo několik mikrořezů. K histologickému posouzení tak přišlo zpravidla 12–16 řezů. Od roku 2007 se zavedla metoda Whole‑Mount Section‑WMS), která umožnila detailnější posouzení patologie prostaty, zejména velikosti nádorového ložiska, okrajů preparátu a nezanedbatelná je také možnost korelace patologického preparátu se zobrazovacími metodami (4). Metoda zpracování preparátu prostaty byla později ještě upřesněna na kongresu International Society of Urological Pathology – IUSP (3, 5). Cílem práce je zhodnotit incidenci karcinomu prostaty v preparátu po radiální prostatektomii, jeho histopatologickou charakteristiku a možný vliv vyšetřovací metody na výskyt IKP v preparátu.
METODA
Soubor pacientů
Retrospektivně jsme zhodnotili soubor 91 mužů po RCP provedené od ledna 2009 do srpna 2019 pro karcinom močového měchýře. Průměrný věk v souboru byl 70,1 roků (55–79 let). Indikací k RCP byl invazivní karcinom močového měchýře u 80 pacientů a recidivující povrchový, high grade nádor a nádory po selhání adjuvantní intravezikální léčby u 11 pacientů. Všechny RCP byly provedeny jako otevřený chirurgický výkon s odstraněním bloku močového měchýře, prostaty, semenných váčků, apendektomií a s rozšířenou pánevní lymfadenektomií. Ortotopická derivace byla provedena u 10 pacientů, u 81 pacientů pak derivace ureteroileálním konduitem. Neoadjuvantní terapii nepodstoupil nikdo ze souboru. Pacienti s patologickým nálezem při vyšetření per rektum a elevací PSA nad 5 ng/ml před RCP byli ze souboru vyřazeni. Patologické hodnocení provedeno podle TNM klasifikačního systému, 8. vydání, 2017. Definovali jsme klinicky nesignifikantní KP na podkladě kritérií: Gleason skóre ≤ 6, onemocnění ohraničené na orgán (bez extrakapsulárního šíření, bez invaze semenných váčků, N0), velikostnádoru ≤ 0,5 cm3. Pro kategorizaci tumoru jsme použili objem největšího nádoru (dominant/index tumor nodule princip). V případě, že onemocnění nesplnilo tato kritéria, jednalo se o signifikantní KP.K měření objemu nádorového ložiska jsme použili morfometrický software NIS Element AR (Nikon, Japan). Obsah vyznačené plochy nádoru byl násoben tloušťkou řezu. Objem nádoru byl pak součtem objemů nádoru v jednotlivých řezech.
Laboratorní vyšetření
Patologický preparát byl po výkonu fixován 10% formolem, prostata barvena tuší. Vyšetření močového měchýře bylo provedeno formou makrobloků se zhotovením 1–2 mikroskopických řezů z jednotlivých bloků, barvených metodou hematoxylineosin. Prostata byla vyšetřena u pacientů v letech 2009–2014 (42 pacientů) metodou standardních bloků. Preparát byl rozdělen na 2–3 příčné řezy, každý z nich pak rozdělen na 4 bloky. Z každého bloku byly zhotoveny 1–2 mikroskopické řezy, které byly barveny standardní metodou hematoxylineosin. V letech 2015–2019 byla prostata vyšetřena u 49 pacientů metodou celoplošných řezů (WMS). Z prostaty, která byla barvena tuší, byly zhotoveny celoplošné 3mm silné řezy. Z každého tohoto bloku pak 1–2 mikroskopické řezy, které byly barveny metodou hematoxylineosin. Interval follow‑up kontrol nebyl zcela standardizován a byl v rozmezí 2–6 měsíců v závislosti na klinickém stavu a probíhající adjuvantní léčbě. Data vycházejí z elektronické zdravotní dokumentace. V rámci hodnocení léčebných výsledků jsme definovali specifické přežití na KM (bladder cancer specific survival) jako dobu od data RCT do data úmrtí na KM nebo poslední follow up kontroly (cenzorovaná data). Progresi na IKP jsme definovali od provedení RCT do doby biochemické recidivy, která byla definovaná elevací, PSA po RCT nad 0,2 ng/ml (6). Výsledné hodnoty uvádíme jako průměr a směrodatnou odchylku, případně rozpětí. Statistické zpracování s použitím Fischerova exaktního testu, binomického testu a Kaplan‑Maier analýzy s použitím log rank testu, vše s hladinou významnosti 5 %. Pro statistické zpracování byl použit software SPSS 18 (IBM, USA).
VÝSLEDKY
Do souboru jsme zařadili 91 mužů po RCP. Jeden pacient s abnormálním PSA (13,2 ng/ml) a patologickým nálezem per rektum před provedenou RCP nebyl v souboru hodnocen. Histopatologická charakteristika KM uvedena v tabulce 1. Incidentální KP jsme diagnostikovali u 22 pacientů (24,4 %). Významný rozdíl byl v závislosti na metodě vyšetření prostaty (Tab. 2). Zatímco při vyšetření metodou WMS byl nalezen IKP u 21 pacientů (43,8 %), při vyšetření prostaty metodou bloků jen u jednoho pacienta (2,4 %). Při histopatologickém hodnocení IKP jsme zaznamenali stadium pT2a u 13 pacientů (59,1 %), stadium pT2b u pěti pacientů (22,7 %), stadium pT2c u tří pacientů (13,6 %) a stadium pT3a u jednoho pacienta (4,5 %). Hodnota Gleasonova skóre ≤ 6 byla u 16 pacientů (72,7 %), GS 7 (3+4) u 27,3 % souboru, GS 7 (4+3) a vyšší jsme nezaznamenali. Poměr monofokálního a multifokálního IKP byl stejný. U všech pacientů byl IKP lokalizován v periferní zóně prostaty, u jednoho pacienta byl navíc přítomen v přechodové zóně. Z rizikových faktorů jsme hodnotili perineureální šíření, které jsme zaznamenali u 31,8 % pacientů, a lymfangioinvazi, která byla nalezena u jednoho pacienta (4,5 %). Extraprostatické šíření nádoru jsme zaznamenali u jednoho pacienta (4,5 %), invazi do semenných váčků jsme nezaznamenali. Průměrný objem IKP byl 1,9 cm3 (0,001–6,89 cm3 ). Iniciální hodnota PSA byla u 2,54 ± 1,14 ng/ml. Podle zadaných kritérií bylo jako klinicky nesignifikantní KP vyhodnoceno deset nádorů (45,5 %). Při porovnání histopatologických parametrů mezi signifikantními a nesignifikantními nádory byl statisticky významný pouze rozdíl v objemu nádoru 3,40 ± 4,25 vs. 0,10 ± 0,11 (p < 0,021). Statisticky signifikantní rozdíl byl mezi Gleasonovým skóre GS ≤ 6 vs. GS > 7 a signifikantností nádorů (p = 0,012), dále pak mezi počtem nádorů s velikostí ≤ 0,5 cm3 a signifikantností nádoru, 3 vs. 10 nádory (p = 0,0000). Medián doby sledování byl 19,5 měsíce. Biochemickou recidivu jsme zaznamenali u jednoho pacienta se signifikantním KP po 27 měsících. Na KM jsme zaznamenali pět úmrtí, na IKP nikdo nezemřel (Obr. 1). Dvouletý bladder cancer specific survival byl 75 % (CI 0,50–0,89, p < 0,05). Prognóza IKP neměla vliv na délku přežití, kterou limituje především prognóza karcinomu močového měchýře.
Tab. 1. Histopatologická charakteristika nádorů močového měchýře
Tab. 1. Histopatological characteristics of bladder cancer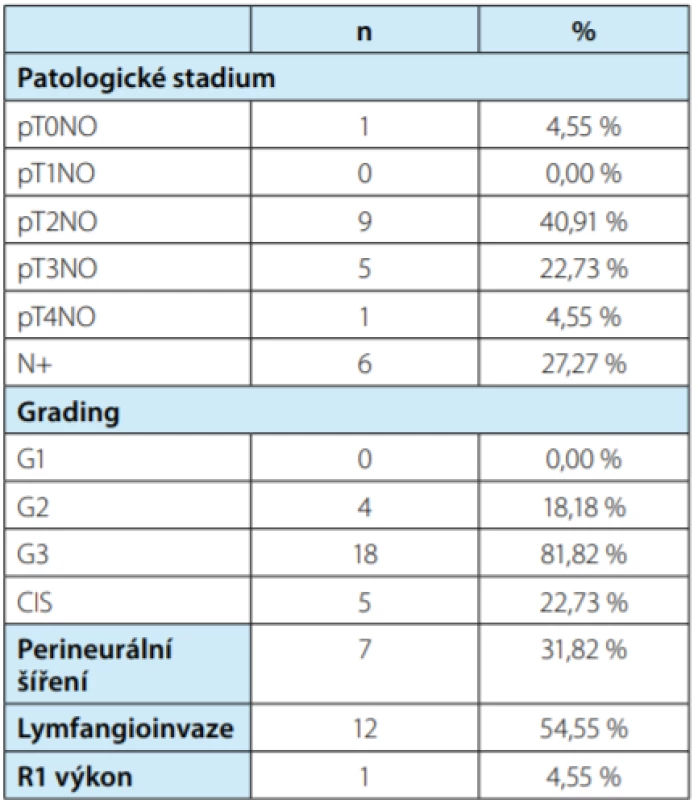
Tab. 2. Celkové výsledky incidence IKP v závislosti na metodě zpracování preparátu prostaty
Tab. 2. Overall results of incidental prostate cancer depending on the histopatological processing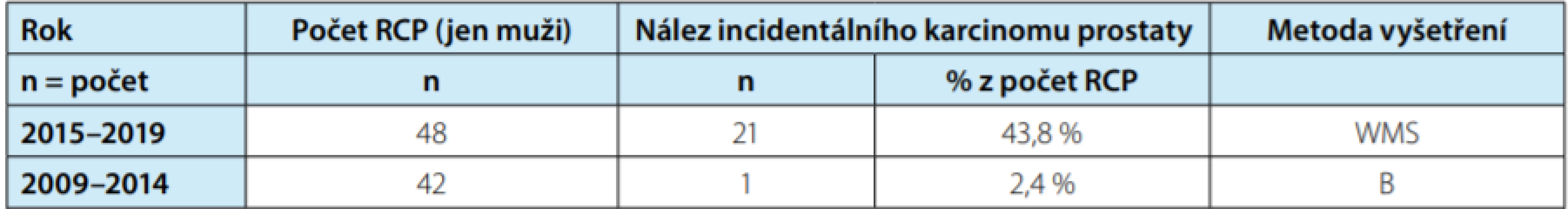
RCP – radikální cystoprostatektomie
WMS – Whole-Mount Section technika
B – příprava preparátu metodou standardních blokůTab. 3. Histopatologická charakteristika IKP
Tab. 3. Histopathological characteristics of IKP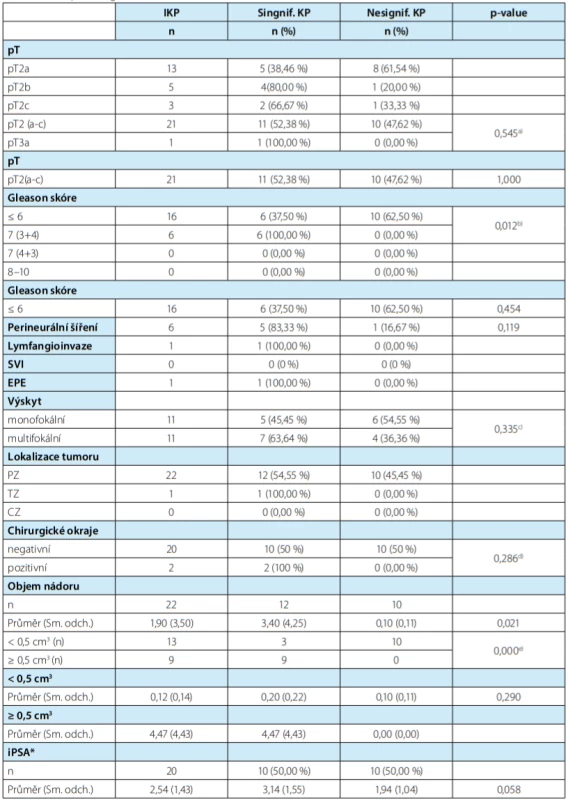
lIKP – incidentální karcinom prostaty, SVI – Seminal Vesical Invasion, EPE – ExtraProstatic Extension, PZ – periferní zóna, TZ – přechodová zóna, CZ – centrální zóna, iPSA – iniciální PSA, * – u dvou pacientů chyběla iniciální hodnota PSA
a)p-value pro stanovení významnosti rozdílu mezi stagingem (T2, T3) a signifikantností nádoru
b)p-value pro stanovení významnosti rozdílu mezi Gleasonovým skóre (GS ≤ 6 a vyšší) a signifikantností nádoru
c)p value pro stanovení významnosti rozdílu mezi výskytem nádoru (monofokální, multifokální) a signifikantností nádoru
d)p-value pro stanovení významnosti rozdílu mezí chirurgickými okraji (negativní, pozitivní) a signifikantností nádoru
e)p-value pro stanovení významnosti rozdílu mezi počtem nádorů < 0,5 cm3 a signifikantností nádoruObr. 1. Nádorově-specifické přežití pacientů s karcinomem močového měchýře (Bladder cancer specific survival; BCSS)
Fig. 1. Bladder cancer specific survival
DISKUZE
Výskyt IKP v preparátu po RCP se v západních zemích udává v rozmezí 18–49 % (7, 8, 9), což odpovídá námi zjištěným výsledkům. Data se blíží prevalenci incidentálního KP ve zdravé populaci, která dosahuje v 7. deceniu až 46 % (10). Stejně tak roste podíl klinicky nesignifikantních KP v pracích autorů s vysokou prevalencí IKP (8, 9, 11). Výskyt IKP u české populace se udává v rozmezí 14,6–37 % (12, 13). Buse et al. v souboru 1 222 pacientů nalezli karcinom prostaty u 200 pacientů (17,8 %), z toho u 13,7 % lokálně pokročilý. Výskyt IKP mezi skupinou zpracovanou metodou bloků a WMS řezů se statisticky nelišil (16,4 % vs. 20,1 %, p = 0,122). Při analýze věkového rizika prokázali rostoucí riziko IKP s věkem (odds ratio 1,03 % za rok od věku 40 let, p < 0,001) (7). Pignot et al. na velkém souboru 4299 RCP diagnostikovali 931 nádorů prostaty (21,7 %). Většina nádorů byla lokalizovaná (90,1 %), Gleason skóre < 6 mělo 13,9 %, GS 6 mělo 61,7 %, GS 7 (3+4) 16 % pacientů, GS 7 (4+3) 4,1 % a GS > 7 pak 4,3 %. Při mediánu follow up 25 měsíců mělo recidivu karcinomu měchýře 35 % pacientů a 23,8 % na KM zemřelo. Pouze 16 pacientů (1,9 %) mělo biochemickou recidivu, nikdo ze souboru na KP nezemřel (8). Barbisan et al. posuzovali přítomnosti uroteliálního nebo prostatického karcinomu v prostatě po RCP u souboru 248 pacientů. IKP nalezli u 123 (49,6 %) pacientů, z toho však 100 (81,3 %) mělo nesignifikantní KP. Všechny nádory byly lokalizované v periferní zóně, 87 % bylo GS ≤ 6, negativní okraje mělo 96,1 %. Autoři navíc hodnotili detailně možný nález uroteliálního karcinomu v prostatě, který zaznamenali u 94 pacientů (37,9 %), nejčastěji šlo o přímou infiltraci nádoru z oblasti trigona nebo hrdla (9).Práce z jihovýchodní Asie udávají výskyt IKP menší. Yang udává výskyt IKP u 28 % souboru (1). Zhu YP et al. v 92 případech detekovali IKP u tří pacientů (3,3 %), z toho u jednoho signifikatní KP. V přehledu literatury udávají analýzu dostupných dat z oblasti Asie, kde u prezentovaných 642 pacientů byl incidentální karcinom prostaty detekován u 64 pacientů tj. 9,9 % (14). U žádného pacienta v našem souboru nebylo třeba zahájit léčbu IKP. Nález incidentálního karcinomu prostaty nemá po provedené RCP zpravidla vliv na celkovou prognózu a neovlivňuje tak celkové přežití (15, 16). Prognóza je ovlivněna především charakteristikou a stadiem karcinomu močového měchýře. Klasická Epsteinova kritéria publikovaná v roce 1994 sloužila k posouzení nesignifikantnosti KP (17). Epsteinova práce pracovala s objemem nesignifikantního nádoru < 0,2 cm3. Tento objem byl stanoven na základě jeho prací, kde nádory stadia pT2 neinfiltrovaly kapsulu a nebyl prokázán biochemický relaps pět let po výkonu (18, 19). Stamey později stanovil objem nesignifikantního tumoru na 0,5 cm3 (20). Tato „Epsteinova kritéria“ mají 95% pozitivní prediktivní hodnotu, 66% negativní prediktivní hodnotu a celkovou prediktivní přesnost 73–84 % pro stanovení nesignifikantního nádoru prostaty. Později byla několika studiemi validována (21, 22, 23). V roce 2005 ISUP modifikovala Gleasonův grading (24). Změna vedla k určitému upgradingu onemocnění. Při porovnání vzorků z biopsie prostaty se tak celkový počet nádorů GS 6 zmenšil z 48 % na 22 %, zatímco počet nádorů GS 7 se zvýšil z 25,5 % na 67,9 % (25). Po této změně Gleasonova gradingu je nyní přesnost Epsteinových kritérií predikovat nesignifikantní nádor prostaty snížena z původních 73–84 % na 39–76 % (24, 25). V naší práci jsme použili k měření objemu nádoru planimetrický program s možností změřit plochu nádoru. Objem se pak vypočítává jako součet objemů nádoru v jednotlivých řezech. Existuje celá řada možností stanovení objemu nádoru od prostého odhadu, před planimetrii referenčními mřížkami, kde je při definované síle řezu znám objem jednoho elementu na mřížce, až po použití planimetrických programů. Použití objemu nádoru jako parametru signifikantního /nesignifikantního KP je tak asi místem, které je zatíženo největší chybou (26, 27). Někteří považují za signifikantní i multifokální nádor nad tři ložiska, nicméně v tomto názoru nepanuje shoda. Většina publikovaných dat pracuje v systému dominant/index nádor, včetně prvních prací Epsteina a Stamey (19, 20). V našem souboru jsme zaznamenali jeden pozitivní okraj IKP, lokalizovaný při apexu prostaty do 0,1 mm délky. PSA je ve sledování nulové. Ponecháním apexu prostaty je spojené s potencionálním rizikem 1% ponechání signifikantního KP (28). Proti výsledkům ostatních autorů (7) jsme zaznamenali velice nízký výskyt IKP při zpracování prostaty metodou standardních bloků. Hlavní příčinu spatřujeme v technických limitech zpracování preparátu prostaty touto metodou v minulosti. Za relevantní výsledek naší práce považujeme výskyt IKP u 43,8 % pacientů vyšetřených metodou WMS. Vliv tloušťky řezu tj. preciznosti zpracování preparátu prostaty je také znám. Desai et al. ve své práci prokázali signifikantně vyšší záchyt KP, extraprostatického šíření KP a invaze KP do semenných váčků při metodě WMS prováděných se šířkou řezu 2,5mm proti standardní metodě zpracování prostaty (29). Je zřejmé, že stěžejní roli v diagnóze IKP hraje histologické zpracování preparátu. Klasické zpracování prostaty do několika standardizovaných bloků s hrubou šířkou řezu pro histologické vyšetření vedlo k nízkému výskytu IKP (11, 30). S rozvojem radiologických zobrazovacích metod, zejména magnetické rezonance, spektroskopických vyšetřovacích metod stoupla možnost lokalizace nádoru v prostatě. Metoda WMS navíc přináší možnost korelovat předoperační zobrazovací vyšetření a pooperační histopatologický nález. Zavedení metody WMS významně upřesnilo staging onemocnění (4). Limitaci práce vidíme především v krátké době sledování, bez možnosti detailněji posoudit vliv incidentálního karcinomu prostaty na celkové přežití.
ZÁVĚR
Celková incidence IKP byla v našem souboru 24,4 %. Významně vyšší záchyt IKP (43,8 %) jsme zaznamenali při přípravě preparátu metodou WMS.V našem souboru nebyla celková prognóza pacienta ovlivněna nálezem IKP.
Seznam použitých zkratek:
- IKP – incidentální karcinom prostaty
- KP – karcinom prostaty
- KM – karcinom močového měchýře
- RCP – radikální cystoprostatektomie
- WMS – Whole‑Mount Section (celoplošné řezy)
- PSA – prostatický specifický antigen
- SVI – Seminal Vesical Invasion
- EPE – Extra Prostatic Extension
- PZ – periferní zóna
- TZ – přechodová zóna
- CZ – centrální zóna
- iPSA – iniciální PSA
Střet zájmů: Žádný.Prohlášení o podpoře: Autoři prohlašují, že práce vznikla s finanční podporou Vědecké rady Krajské nemocnice Liberec, a. sDošlo: 21. 10. 2019Přijato: 6. 1. 2020Kontaktní adresa:MUDr. Vladimír Šámal, Ph.D.Urologické oddělení, Krajská nemocnice Liberec, a. s.Husova 10,460 63 Liberece‑mail: vladimir.samal@nemlib.cz
Zdroje
1. Holund, B. Latent prostatic cancer in a consecutive autopsy series. Scand J Urol Nephrol 1980. 14(1): p. 29–35.
2. Autorino RG, Di Lorenzo R, Damiano G, et al. Pathology of the prostate in radical cystectomy specimens: a critical review. Surg Oncol 2009; 18(1): 73–84.
3. Davila HHT, Weber D, Burday S, et al. Total or partial prostate sparing cystectomy for invasive bladder cancer: long‑term implications on erectile function. BJU Int 2007; 100(5): 1026–1029.
4. Jhavar SGC, Fisher A, Jackson SA, et al. Processing of radical prostatectomy specimens for correlation of data from histopathological, molecular biological, and radiological studies: a new whole organ technique. Journal of clinical pathology 2005; 58(5): 504–508.
5. Samaratunga HR, Montironi L, True JI, et al. International Society of Urological Pathology (ISUP) Consensus Conference on Handling and Staging of Radical Prostatectomy Specimens. Working group 1: specimen handling. Mod Pathol 2011; 24(1): 6–15.
6. Freedland SJME, Sutter F, Dorey, Aronson WJ. Defining the ideal cutpoint for determining PSA recurrence after radical prostatectomy. Prostate‑specific antigen. Urology 2003; 61(2): 365–369.
7. Buse ST, Hofner SC, Muller E, et al. Characterization and risk stratification of prostate cancer in patients undergoing radical cystoprostatectomy. Int J Urol 2013; 20(9): 866–871.
8. Pignot GL, Salomon Y, Neuzillet A, et al. Clinicopathological characteristics of incidental prostate cancer discovered from radical cystoprostatectomy specimen: a multicenter French study. Ann Surg Oncol 2014; 21(2): 684–690.
9. Barbisan FR, Mazzucchelli M, Scarpelli A, et al. Urothelial and incidental prostate carcinoma in prostates from cystoprostatectomies for bladder cancer: is there a relationship between urothelial and prostate cancer? BJU Int 2009; 103(8): 1058–1063.
10. Yin MS, Bastacky U, Chandran MJ, Becich, Dhir R. Prevalence of incidental prostate cancer in the general population: a study of healthy organ donors. J Urol 2008; 179(3): 892–895; discussion 895.
11. Mazzucchelli RF, Barbisan M, Scarpelli A, et al. Is incidentally detected prostate cancer in patients undergoing radical cystoprostatectomy clinically significant? Am J Clin Pathol 2009; 131(2): 279–283.
12. Prošvic PP, Morávek, Šimáková E. Incidentální adenokarcinom prostaty u pacientů po radikální cystektomii pro uroteliální karcinom. Ces Urol 2002; 6(1): 37–40.
13. Kudláčková Š, Král M, Grepl M, Študent V. Výskyt karcinomu prostaty u mužů v materiálu po RACE. Ces Urol 2015; 19(Suppl. B): 33–33.
14. Zhu YP, DW Ye XD, Yao SL, et al. Prevalence of incidental prostate cancer in patients undergoing radical cystoprostatectomy: data from China and other Asian countries. Asian J Androl 2009; 11(1): 104–108.
15. Androulakakis PAHM, Schneider GH, Jacobi, Hohenfellner R. Coincident vesical transitional cell carcinoma and prostatic carcinoma. Clinical features and treatment. Br J Urol 1986; 58(2): 153–156.
16. Pritchett TR, Moreno J, Warner NE, et al. Unsuspected prostatic adenocarcinoma in patients who have undergone radical cystoprostatectomy for transitional cell carcinoma of the bladder. J Urol 1988; 139(6): 1214–1216.
17. Epstein JI, Walsh PC, Carmichael M, Brendler CB. Pathologic and clinical findings to predict tumor extent of nonpalpable (stage T1c) prostate cancer. Jama 1994; 271(5): 368–374.
18. Epstein JI, Pizov G, Walsh PC. Correlation of pathologic findings with progression after radical retro ‑ pubic prostatectomy. Cancer 1993; 71(11): 3582–3593.
19. Epstein JI, Carmichael M, Partin AW, Walsh PC. Is tumor volume an independent predictor of progression following radical prostatectomy? A multivariate analysis of 185 clinical stage B adenocarcinomas of the prostate with 5 years of followup. J Urol 1993; 149(6): 1478–1481.
20. Stamey TA, Freiha FS, McNeal JE, et al. Localized prostate cancer. Relationship of tumor volume to clinical significance for treatment of prostate cancer. Cancer 1993; 71(3 Suppl): 933–938.
21. Bastian PJ, Mangold LA, Epstein JI, Partin AW. Characteristics of insignificant clinical T1c prostate tumors. A contemporary analysis. Cancer 2004; 101(9): 2001–2005.
22. Hekal IA, El‑Tabey NA, Nabeeh MA, et al. Validation of Epstein criteria of insignificant prostate cancer in Middle East patients. Int Urol Nephrol 2010; 42(3): 667–671.
23. Lee MC, Dong F, Stephenson AJ, et al. The Epstein criteria predict for organ‑confined but not insigni ‑ ficant disease and a high likelihood of cure at radical prostatectomy. Eur Urol 2010; 58(1): 90–95.
24. Epstein JI, Allsbrook WC, Jr Amin MB, Egevad LL. The 2005 International Society of Urological Pathology (ISUP) Consensus Conference on Gleason Grading of Prostatic Carcinoma. Am J Surg Pathol 2005; 29(9): 1228–1242.
25. Epstein JI. An update of the Gleason grading system. J Urol 2010; 183(2): 433–440.
26. Chen ME, Johnston D, Reyes AO, et al. A streamlined three‑dimensional volume estimation method accurately classifies prostate tumors by volume. Am J Surg Pathol 2003; 27(10): 1291–1301.
27. Carvalhal GF, Humphrey PA, Thorson P, et al. Visual estimate of the percentage of carcinoma is an independent predictor of prostate carcinoma recurrence after radical prostatectomy. Cancer 2000; 89(6): 1308–1314.
28. Pan J, Xue W, Sha J, et al. Incidental prostate cancer at the time of cystectomy: the incidence and clinicopathological features in Chinese patients. PLoS One 2014; 9(4): e94490.
29. Desai A, Wu H, Sun, L, et al. Complete embedding and close step‑sectioning of radical prostatectomy specimens both increase detection of extra‑prostatic extension, and correlate with increased disease‑free survival by stage of prostate cancer patients. Prostate Cancer Prostatic Dis 2002; 5(3): 212–218.
30. Fritsche HM, Aziz A, Eder F, et al. Potentially clinically relevant prostate cancer is found more frequently after complete than after partial histopathological processing of radical cystoprostatectomy specimens. Virchows Arch 2012; 461(6): 655–661.
Štítky
Dětská urologie Nefrologie Urologie
Článek Editorial
Článek vyšel v časopiseČeská urologie
Nejčtenější tento týden
2020 Číslo 1- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
-
Všechny články tohoto čísla
- Editorial
- Roboticky asistovaná okluze vezikovaginální píštěle – krok za krokem
- Multirezistentní gram‑negativní bakterie v urologii
- Hereditární renální nádorové syndromy
- Incidence karcinomu prostaty v preparátech po radikální cystoprostatektomii. Histopatologická charakteristika nádorů a posouzení vlivu histologického zpracování preparátu na incidenci nádoru
- Naše zkušenosti s využitím MRI/TRUS softwarové fúze při cílené biopsii prostaty
- Gravidita u pacientek po augmentaci měchýře střevním segmentem – naše zkušenosti
- Kazuistika gigantického recidivujícího angiomyolipomu podkovovité ledviny
- Možnost řešení obstrukce dolního segmentu ledviny u zdvojené pánvičky pomocí roboticky asistované pyelo‑pyelo anastomózy systémem da Vinci XI®
- Vzpomínka na emeritního přednostu Urologické kliniky FN Hradec Králové pana docenta MUDr. Josefa Bašeho, CSc.
- Česká urologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Naše zkušenosti s využitím MRI/TRUS softwarové fúze při cílené biopsii prostaty
- Multirezistentní gram‑negativní bakterie v urologii
- Hereditární renální nádorové syndromy
- Kazuistika gigantického recidivujícího angiomyolipomu podkovovité ledviny
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



