-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaVýznamné rizikové faktory pádu v osobnej anamnéze u hospitalizovaných pacientov s neurologickým ochorením
Significant fall risk factors in the personal history of in-patients with neurological disease
Aim: To identify significant fall risk factors in in-patients with neurological disease and to assess their predictive value.
Patients and methods: 298 in-patients were included into the prospective study. Fall risk factors were assessed through analysis of medical records, and fall risk score was identified through the Morse Fall Scale (MFS) screening during admission to the hospital. A multidimensional logistic regression model was used to identify significant fall risk factors. The relative risk of falling was quantified using the odds ratio (OR). Receiver operating characteristic (ROC) curve with area under the curve (AUC) was used to assess the predictive value of selected fall risk factors.
Results: The most frequent fall risk factors were in the sample (N = 298): gait, balance and mobility disorders (80.9%), pharmacotherapy (57.0%), associated disease (52.7%), and visual impairment (52.3%). The average fall risk score was at medium risk level (MFS score of 44.2 ± 21.2). The highest risk of falling was seen in risk factors: associated disease (OR = 5.452; CI 1.693 – 20.033; P = 0.007), medical diagnosis G35 – G37 (OR = 4.597, CI 1.273 – 17.481; P = 0.021), visual impairment (OR = 3.494; CI 1.281 – 10.440; P = 0.019), and fall risk level according to the MFS at admission (OR = 1.18; CI 1.135 – 1.252; P < 0.001). The predictive value of risk factors expressed by the ROC curve was AUC = 0.934.
Conclusions: Identifying fall risk factors is the first step in effective prevention of this adverse event during hospitalization. Targeted fall risk screening will allow planning and implementation of interventions to minimize the risk of falling.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
患有神经系统疾病的患者的个人病史中存在重要的跌倒危险因素
目的:确定患有神经系统疾病的住院患者的重大跌倒危险因素,并评估其预测价值。
患者和方法:298名住院患者纳入前瞻性研究。通过对病历的分析来评估跌倒风险因素,并在入院期间通过莫尔斯跌倒量表(MFS)筛查来确定跌倒风险评分。多维逻辑回归模型用于确定重大的跌倒风险因素。使用比值比(OR)量化跌倒的相对风险。受试者工作特征(ROC)曲线及其下的面积(AUC)用于评估所选跌倒危险因素的预测值。
结果:最常见的跌倒风险因素是样本(N = 298):步态,平衡和活动障碍(80.9%),药物治疗(57.0%),相关疾病(52.7%)和视力障碍(52.3%)。平均跌倒风险评分处于中等风险水平(MFS评分为44.2±21.2)。跌倒的最高风险发生于危险因素:相关疾病(OR = 5.452; CI 1.693-20.033; P = 0.007),医学诊断G35-G37(OR = 4.597,CI 1.273-17.481; P = 0.021),视力障碍(OR = 3.494; CI 1.281 – 10.440; P = 0.019),并根据入院时的MFS下降风险水平(OR = 1.18; CI 1.135 – 1.252; P <0.001)。 ROC曲线表示的危险因素的预测值为AUC = 0.934。
结论:识别跌倒危险因素是有效预防住院期间这种不良事件的第一步。有针对性的跌倒风险筛查将有助于规划和实施干预措施,以最大程度地降低跌倒的风险。
关键词:跌倒–危险因素–筛查–神经科–患者–住院
Keywords:
fall – risk factor – patient – screening – Neurology – hospitalization
Autoři: M. Miertová 1; I. Bóriková 1; M. Grendár 2; J. Madleňák 1; M. Tomagová 1; K. Žiaková 1
Působiště autorů: Ústav ošetrovateľstva, Jesseniova LF UK v Martine, Slovensko 1; Martinské centrum pre biomedicínu (BioMed), Jesseniova LF UK v Martine, Slovensko 2
Vyšlo v časopise: Cesk Slov Neurol N 2019; 82(6): 649-654
Kategorie: Původní práce
doi: https://doi.org/10.14735/amcsnn2019649Souhrn
Cieľ: V súbore pacientov s neurologickým ochorením identifikovať významné rizikové faktory pádu a posúdiť ich predikčnú hodnotu.
Súbor a metodika: Do prospektívnej štúdie bolo zaradených 298 hospitalizovaných pacientov. Rizikové faktory pádu boli zisťované analýzou zdravotnej dokumentácie, výšku rizika pádu určil skríning podľa Morse Fall Scale (MFS) prijatí na hospitalizáciu. Na identifikáciu významných rizikových faktorov pádu bol použitý mnohorozmerný logistický regresný model. Relatívne riziko pádu bolo kvantifikované pomocou odds ratio (OR). Na posúdenie predikčnej hodnoty vybraných rizikových faktorov pádu bola použitá receiver operating characteristic (ROC) krivka so zhodnotením plochy pod krivkou (area under curve; AUC).
Výsledky: V súbore pacientov (n = 298) k najpočetnejším rizikovým faktorom pádu patrili: porucha chôdze, rovnováhy a hybnosti (80,9 %), farmakoterapia (57,0 %), pridružené ochorenie (52,7 %) a porucha zraku (52,3 %). Priemerné skóre rizika pádu bolo na úrovni stredného rizika (MFS skóre 44,2 ± 21,2). Najvyššie riziko pádu bolo zaznamenané pri rizikových faktoroch: pridružené ochorenie (OR = 5,452; CI 1,693 – 20,033; p = 0,007), medicínska diagnóza G35 – G37 (OR = 4,597; CI 1,273 – 17,481; p = 0,021), porucha zraku (OR = 3,494; CI 1,281 – 10,440; p = 0,019), výška rizika pádu podľa MFS pri príjme (OR = 1,18; CI 1,135 – 1,252; p < 0,001). Predikčná hodnota rizikových faktorov vyjadrená ROC krivkou bola AUC = 0,934.
Záver: Identifikácia rizikových faktorov pádu je prvým krokom v účinnej prevencii tejto nežiaducej udalosti počas hospitalizácie. Cielený skríning rizika pádu umožní naplánovať a implementovať intervencie na minimalizáciu rizika pádu.
Klíčová slova:
pád – rizikový faktor – skríning – neurológia – pacient – hospitalizácia
Úvod
Pády u hospitalizovaných pacientov patria k častým nežiaducim udalostiam, komplikujú základné ochorenie, vyžadujú si ďalšiu liečbu, predlžujú pobyt v nemocnici, zvyšujú dodatočné náklady na starostlivosť, prípadne vedú k žalobe na nekvalitnú starostlivosť [1 – 7]. U pacientov s neurologickým ochorením je pád výsledkom interakcie heterogénnej skupiny demografických, vnútorných a environmentálnych (situačných) rizikových faktorov [8,9]. Riziko pádu a počet opakovaných pádov sa zvyšuje po prekonaní CMP [10], u pacientov s Parkinsonovou chorobou [11 – 13], s demenciou [7,12], so sclerosis multiplex [14] a periférnou neuropatiou [7].
Analýza pádov s poranením odhaľuje niekoľko spoločných faktorov, ktoré zvyšujú počet pádov v nemocniciach, a okrem iného k nim zaraďuje aj nedostatočné posúdenie rizík pacienta a nedodržiavanie protokolov pre bezpečnostné postupy [15]. Literárne zdroje popisujú okolo 400 samostatných rizikových faktorov. K najvýznamnejším patria: pád v anamnéze, vyšší a vysoký vek, poruchy chôdze a rovnováhy, svalová slabosť, používanie kompenzačnej pomôcky, polyfarmakoterapia a jej vedľajšie účinky, kognitívny a zrakový deficit, stav po CMP [4,7,9,16]. Rizikové faktory sa u pacientov rôzne kombinujú a počas hospitalizácie sa môžu meniť, preto sa kladie dôraz na multifaktorové posudzovanie a identifikáciu individuálnych ovplyvniteľných rizikových faktorov, ktoré pomôže realizovať cielenú prevenciu pádov. Vzhľadom na časovú náročnosť komplexnosti posudzovania rizikových faktorov je efektívnou metódou pri príjme pacienta na hospitalizáciu rýchly skríning rizika pádu meracím nástrojom [4,8,9,17 – 23]. Pre pacientov s neurologickým ochorením boli vytvorené a klinicky testované viaceré nástroje, napr. Morse Fall Scale (MFS), Hendrich Fall Risk Model alebo Saint Thomas’s Risk Assessment Tool in Falling Elderly Inpatients [4,7,19,24 – 26].
Vzhľadom na vyššie uvedené východiská k problematike sme si stanovili niekoľko cieľov. V súbore pacientov s neurologickým ochorením: 1. identifikovať prítomnosť vybraných rizikových faktorov pádu; 2. zistiť pomocou mnohorozmernej logistickej regresie, ktoré rizikové faktory budú signifikantné medzi pacientami bez pádu a s pádom v anamnéze; 3. zistiť výšku rizika pádu skríningom podľa MFS; 4. posúdiť predikčnú hodnotu rizikových faktorov pádu, vrátane MFS skóre, pomocou receiver operating characteristic (ROC) krivky.
Štúdia bola zacielená primárne na mapovanie rizikových faktorov pádu a výšky rizika pádu na začiatku hospitalizácie; nebolo sledované, či pacient počas hospitalizácie aj reálne spadol.
Súbor a metodika
Súbor tvorilo 298 hospitalizovaných dospelých pacientov na neurologickej klinike univerzitnej nemocnice. Výber pacientov do súboru bol zámerný, podľa vopred zadefinovaných zaraďujúcich kritérií: vek pacienta ≥ 18 rokov, neurologická diagnóza (podľa Medzinárodnej klasifikácie chorôb [MKCH-10]). Nesplnenie minimálne jedného zaraďujúceho kritéria bolo indikátorom pre exklúziu pacienta zo súboru.
Design bol prospektívna kvantitatívna prierezová štúdia.
Zber údajov
U každého pacienta aktuálny zdravotný stav (neurologické symptómy, ochorenia, funkčné limitácie) objektivizoval a dokumentoval neurológ pri príjme na hospitalizáciu. Prítomnosť a početnosť vybraných rizikových faktorov pádu (podľa výskumného protokolu) sme zisťovali obsahovou analýzou zdravotnej dokumentácie pacientov zaradených do súboru. Prvá časť protokolu obsahovala zoznam rizikových faktorov pádu: pád v anamnéze, pohlavie, vek, neurologická diagnóza pri prijatí, pridružené ochorenie ≥ 4 diagnózy, farmakoterapia ≥ 5 indikačných skupín liekov, počet kusov liekov užívaných za 24 h (perorálne aj parenterálne), poruchy chôdze, rovnováhy a hybnosti, používanie kompenzačnej pomôcky pri chôdzi, poruchy kontinencie, psychického stavu, zraku, sluchu a spánku. Druhou časťou protokolu bol nástroj MFS, ktorý posudzuje: 1. pád v anamnéze (posledné 3 mesiace); 2. pridružená diagnóza (viac ako jedna diagnóza); 3. pomôcka pri chôdzi; 4. intravenózny vstup/ terapia; 5. poruchy chôdze; 6. psychický stav (v zmysle toho, ako sám pacient hodnotí svoju reálnu schopnosť chôdze a potrebu pomoci). Celkové skóre rizika pádu má hodnoty 0 – 125; riziko pádu je nízke ≤ 24, stredné 25 – 44, vysoké ≥ 45 (cut-off skóre 45 vymedzuje pacientov s vysokým a nízkym rizikom pádu a je východiskom pre realizáciu konkrétnych preventívnych intervencií). Senzitivita MFS v originálnej štúdii bola 78 %, špecifickosť 83 % a inter-rater reliabilita r = 0,96 [27].
Údaje boli zbierané na Neurologickej klinike Jesseniovej lekárskej fakulty Univerzity Komenského (JLF UK) a Univerzitnej nemocnice v Martine (UNM) od januára 2017 do novembra 2017 (v roku 2017 mala UNM 837 akútnych lôžok, 34 454 hospitalizácií, z 21 ošetrovacích jednotiek bolo hlásených 129 pádov, z toho Neurologická klinika hlásila 8 pádov).
Analýza a vyhodnotenie empirických údajov
Získané empirické údaje boli okódované a prepísané do programu Microsoft Excel (Microsoft Corporation, Redmond, WA, USA) a vyhodnotené v štatistickom programe SPSS, verzia 18.0 (IBM, Armonk, NY, USA), PASW Statistics 18 (IBM, Armonk, NY, USA) a v R verzia 3.5.2 (R Foundation for Statistical Computing, Viedeň, Rakúsko) [28] s použitím knižnice MASS [29].
Rizikové faktory pádu v súbore pacientov popisuje deskriptívna štatistika s vypočítaním absolútnej a relatívnej početnosti. U spojitých premenných a pri určení výšky rizika pádu je uvedený aritmetický priemer, smerodajná odchýlka, minimálna hodnota, maximálna hodnota (tab. 1). Na identifikáciu rizikových faktorov pádu bol použitý mnohorozmerný logistický regresný model zredukovaný pomocou Akaikeho informačného kritéria (AIC). Pre rizikové faktory bolo relatívne riziko pádu kvantifikované pomocou odds ratio (OR) a neurčitosť určenia OR bola kvantifikovaná 95 % konfidenčným intervalom. Pre každý faktor bola otestovaná hypotéza, že príslušný koeficient v regresii je rovný nule (tab. 2). Na posúdenie predikčnej hodnoty tých rizikových faktorov pádu, ktoré AIC kritérium stanovilo ako podstatné, bola použitá ROC krivka so zhodnotením plochy pod krivkou (area under the curve; AUC) (obr. 1).
Tab. 1. Rizikové faktory pádu v súbore pacientov s neurologickým ochorením. 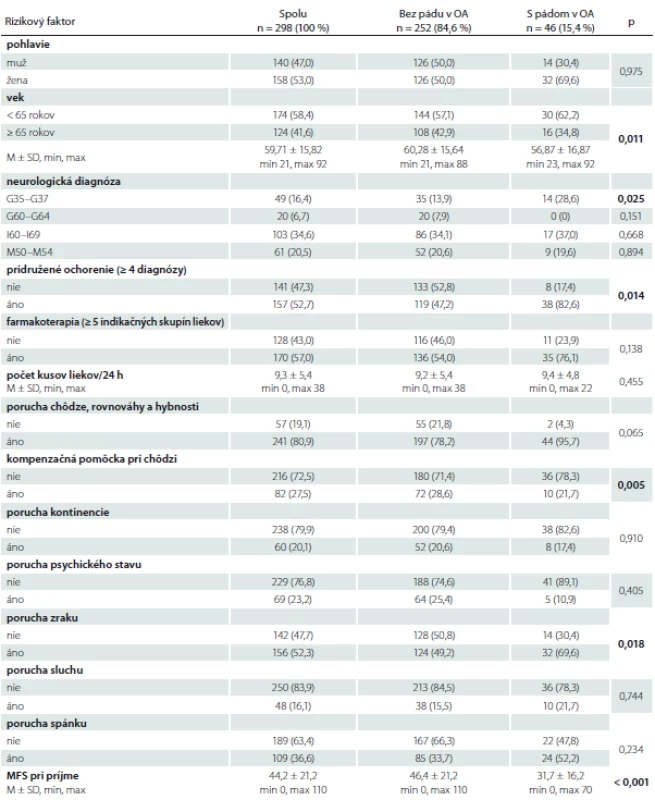
p-hodnota z mnohorozmernej logistickej regresnej analýzy, pre test hypotézy, že príslušný koeficient v mnohorozmernej logistickej regresii je rovný nule
% – relatívna početnosť; M – priemer; MFS – Morse Falls Scale; n – absolútna početnosť; OA – osobná anamnéza; SD – smerodajná odchýlkaTab. 2. Rizikové faktory pádu v súbore pacientov s použitím AIC. 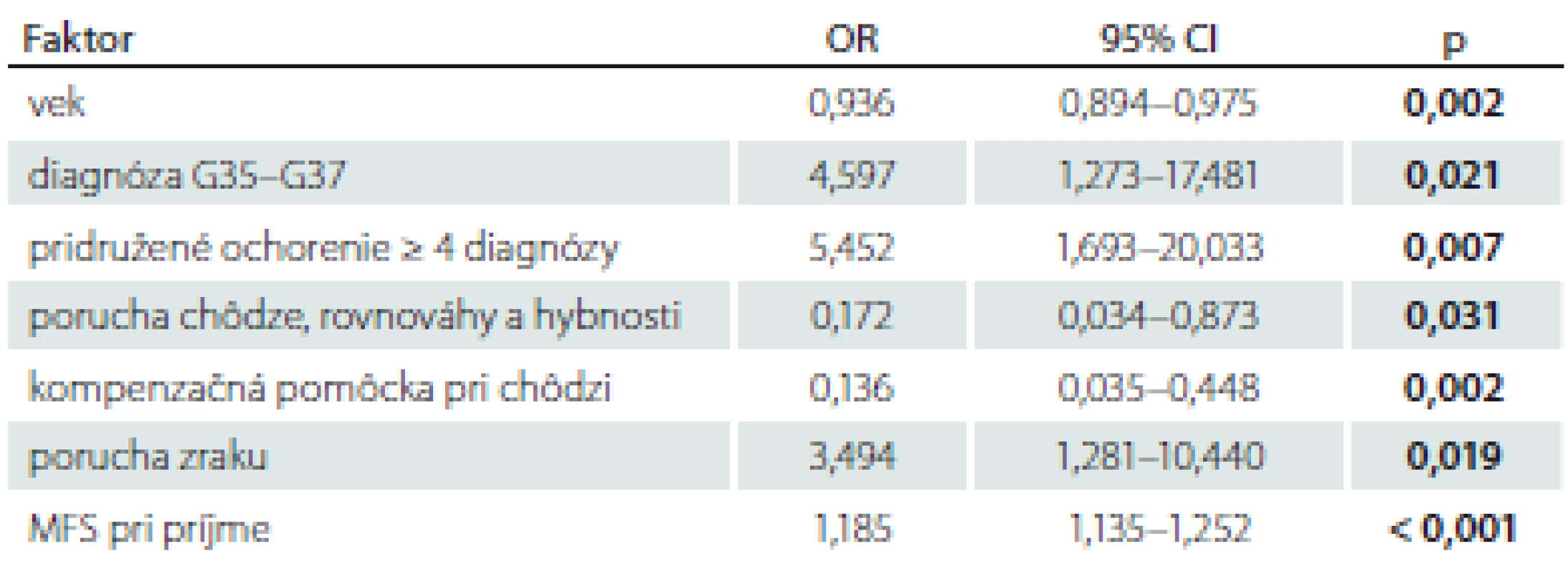
p-hodnota z mnohorozmernej logistickej regresnej analýzy po redukcii modelu pomocou AIC, a to pre test hypotézy, že príslušný koeficient v mnohorozmernej logistickej regresii je rovný nule
AIC – Akaikeho informačné kritériá; CI – konfidenčný interval; MFS – Morse Falls Scale; OR – odds ratio (pomer šancí; pri OR < 1 faktor znižuje riziko pádu, pri OR > 1 faktor zvyšuje riziko pádu)Obr. 1. Receiver operating characteristic krivka pre posúdenie predikčnej hodnoty rizikových faktorov pádu v súbore pacientov počas hospitalizácie. AUC – plocha pod křivkou
Fig. 1. Receiver operating characteristic curve to assess the predictive value of fall risk factors in a sample of patients during hospitalization. AUC – area under the curve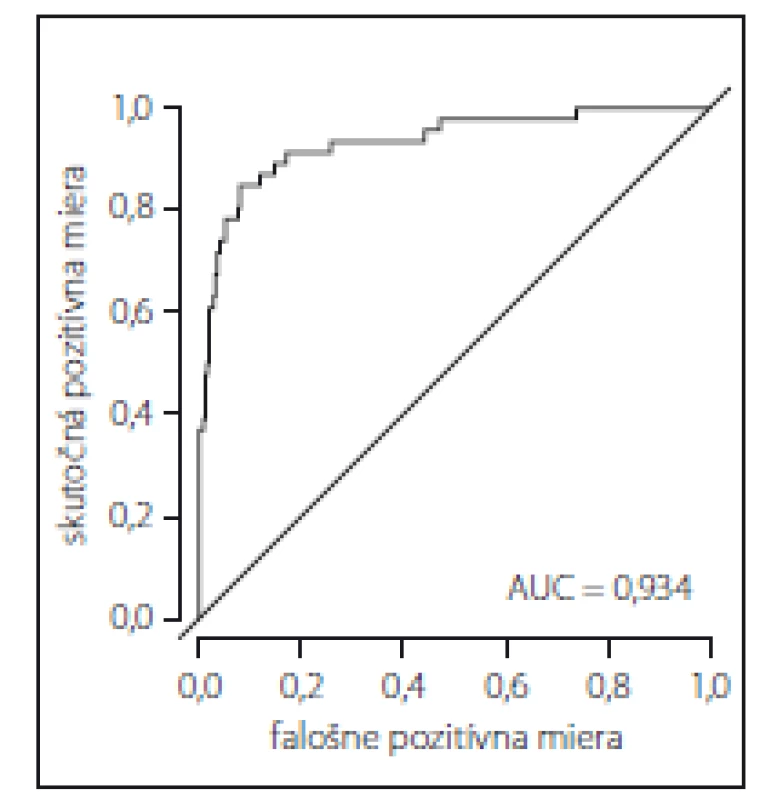
Výsledky
Výskumný súbor tvorilo 298 dospelých hospitalizovaných pacientov, z toho 158 (53,0 %) žien. Priemerný vek súboru bol 59,7 ± 15,8 rokov (min. 21, max. 92). Z rôznych neurologických diagnóz sa u pacientov najčastejšie vyskytovali: cievne choroby mozgu (I60 – I69) (n = 103; 34,6 %), iné dorzopatie (M50 – M54) (n = 61; 20,5 %), demyelinizačné choroby CNS (G35 – G37) (n = 49; 16,4 %), polyneuropatie a iné poruchy periférnej nervovej sústavy (G60 – G64) (n = 20; 6,7 %); tieto sme zaradili aj do štatistického spracovania údajov.
V celom súbore pacientov (n = 298) k najpočetnejším rizikovým faktorom pádu patrili: porucha chôdze, rovnováhy a hybnosti (80,9 %), farmakoterapia ≥ 5 indikačných skupín liekov (57,0 %), pridružené ochorenie ≥ 4 diagnózy (52,7 %) a porucha zraku (52,3 %). Pád v anamnéze sme zistili u 46 pacientov (15,4 %) a podľa tohto rizikového faktora sme rozdelili súbor pacientov na dva podsúbory (tab. 1). U pacientov bez pádu v anamnéze (n = 252) sa najčastejšie vyskytovali: porucha chôdze, rovnováhy a hybnosti (78,2 %), farmakoterapia ≥ 5 indikačných skupín liekov (54,0 %), porucha zraku (49,2 %) a pridružené ochorenie ≥ 4 diagnózy (47,2 %). U pacientov s pádom v anamnéze (n = 46) sa najčastejšie vyskytovali: poruchy chôdze, rovnováhy a hybnosti (95,7 %), pridružené ochorenie ≥ 4 diagnózy (82,6 %), farmakoterapia ≥ 5 indikačných skupín liekov (76,1 %) a poruchy zraku (69,6 %).
V rámci mnohorozmernej logistickej regresie boli medzi pacientami bez pádu a s pádom v anamnéze štatisticky významné faktory: vek (p = 0,011), medicínska diagnóza G35 – G37 (p = 0,025), pridružené ochorenie ≥ 4 diagnózy (p = 0,014), kompenzačná pomôcka pri chôdzi (p = 0,005), porucha zraku (p = 0,018) a výška rizika pádu podľa MFS (p < 0,001) (tab. 1).
Priemerné skóre rizika pádu v celom súbore pacientov (n = 298) bolo na úrovni stredného rizika (MFS skóre 44,2 ± 21,2; min. 0, max. 110). U pacientov bez pádu v anamnéze bolo priemerné skóre rizika pádu na úrovni vysokého rizika (46,4 ± 21,2; min. 0, max. 110), v súbore pacientov s pádom v anamnéze na úrovni stredného rizika (31,7 ± 16,2; min. 0, max. 70) (tab. 1).
Akaikeho informačné kritérium bolo v mnohorozmernom logistickom regresnom modeli použité na zredukovanie zoznamu rizikových faktorov pádu na nasledovné: pridružené ochorenie ≥ 4 diagnózy (OR = 5,452; CI 1,693 – 20,033; p = 0,007), prítomnosť medicínskej diagnózy G35 – G37 (OR = 4,597; CI 1,273 – 17,481; p = 0,021), porucha zraku (OR = 3,494; CI 1,281 – 10,440; p = 0,019), výška rizika pádu podľa MFS pri príjme (OR = 1,18; CI 1,135 – 1,252; p = 0,000) (tab. 2).
S použitím ROC krivky skonštruovanej na základe zredukovaného mnohorozmerného logistického regresného modelu sme zistili veľmi dobrú predikčnú hodnotu rizikových faktorov uvedených v tab. 2 pre predikciu pádu počas hospitalizácie, na čo ukazuje plocha pod ROC krivkou; AUC = 0,934 (obr. 1).
Diskusia
Prevencia pádu v ústavnom zariadení je prioritnou témou v rámci problematiky bezpečnosti pacienta. Mnohé z rizikových faktorov sú preventabilné, preto benefitom pre pacienta i nemocnicu je preventívny program, ktorého prvým komponentom je identifikácia rizika pádu [30]. V našom súbore pacientov mali najvyššie riziko pádu pacienti s diagnózou sclerosis multiplex (G35 – G37) – boli 4,6× rizikovejší k pádu (OR = 4,597). Títo pacienti majú vysokú aj incidenciu pádu, v časovom horizonte 3 – 6 mesiacov až 30 – 50 % pacientov uvádza pád, a to aj opakovaný [14]. Riziko pádu a reálny pád súvisí so symptomatológiou, ako sú poruchy citlivosti, chôdze a hybnosti sprevádzané spasticitou, ďalej vestibulocerebelárne poruchy, svalová slabosť, sfinkterové ťažkosti, v kombinácii s kognitívnym deficitom, chronickou únavou, depresiou [31,32]. Počas ataky sa niektoré symptómy zvýrazňujú, napr. porucha zraku a chôdze, únava, zhoršená koordinácia pohybov [14,16]. Poruchy chôdze, rovnováhy a hybnosti sú príčinou pádov, aj opakovaných [4,19,26,33,34]. V súbore boli prítomné vo vysokom počte (80,9 %), ale títo pacienti mali riziko pádu znížené 5,8× (OR = 0,172), čo súvisí s používaním kompenzačnej pomôcky, ktorá riziko pádu minimalizuje stabilizáciou rovnováhy a chôdze [23,35]. U našich pacientov jej používanie znížilo riziko pádu 7,1× (OR = 0,141). Na druhej strane, pomôcka môže prispieť k pádu v prípade, že ju pacient nesprávne používa alebo pomôcka nespĺňa účel a bezpečnostný štandard [31,35,36].
Všeobecne sa riziko pádu, vrátane skupiny neurologických pacientov, zvyšuje s polymorbiditou a komorbiditami [4,37]. Polymorbidní pacienti v našom súbore mali až 5,5× vyššie riziko pádu počas hospitalizácie (OR = 5,452). Treba však upozorniť na to, že pacient pri terajšom neurologickom ochorení môže mať iba jedno pridružené ochorenie, a napriek tomu má vysoké riziko pádu, napr. pacient s opakovanou CMP [2,10,38]. Vek sa v súbore našich pacientov ukázal ako signifikantný (p = 0,011), aj keď zvýšenie veku o 1 rok znížilo riziko pádu o 6,4 % (OR = 0,936). Involučné zmeny a progresia chronického ochorenia redukujú mobilitu a všeobecne platí, že z hľadiska prevencie pádu si prvoradú pozornosť vyžadujú pacienti vo veku ≥ 65 rokov [8,25]. Pacienti s neurologickým ochorením sú však rizikoví už vo veku ≥ 45 rokov [39], a to aj vo vzťahu k výskytu niektorých ochorení v mladšom veku, napr. Parkinsonovej choroby [12]. K ďalším štatisticky významným rizikovým faktorom pádu patrili poruchy zraku. V našom súbore pacientov boli prítomné u viac ako polovice z nich (52,3 %) a riziko pádu zvýšili až 3,5× počas hospitalizácie (OR = 3,494). Konkrétna porucha zraku sa viaže na konkrétne neurologické ochorenie a samotná porucha zraku, vrátane kombinácie s inými rizikovými faktormi, môže byť príčinou pádu [10,40 – 42].
Klinické symptómy spolu s pozitívnou anamnézou pádu zaraďujú pacienta už pri prijatí na hospitalizáciu do skupiny s vysokým rizikom pádu [7]. V našej štúdii mali pacienti s pádom v anamnéze stredné riziko pádu (maximálne MFS skóre 70 zo 125). Ich priemerný vek bol len o trochu nižší ako priemerný vek celého súboru a je pravdepodobné, že s vekom sa zvýši aj skóre rizika pádu. Zvýšenie výsledného MFS skóre o 1 zvýšilo riziko pádu počas hospitalizácie o 18,5 % (OR = 1,185). Vzhľadom k tomu sa odporúča pri pozitívnej anamnéze pádu realizovať skríning rizika pádu ako prvú, v klinickej praxi často opomínanú, univerzálnu intervenciu na prevenciu pádu [4,23,30]. Skríning rizika pádu validným meracím nástrojom pomôže rýchlo predikovať výšku rizika pádu tým, že deteguje niekoľko významných rizikových faktorov súčasne. Predikčná validita je dôležitý ukazovateľ diagnostickej presnosti nástroja a okrem iných parametrov zahŕňa aj ROC krivku a AUC, ktorá graficky vizualizuje výstupy diagnostického testu. AUC má hodnoty od 0 po 1 (alebo 0 – 100 %) a slúži ako štandardné vyjadrenie diagnostickej efektivity testu, pričom test s AUC nad 0,75 sa považuje za dobre diskriminujúci [43]. V našej štúdii bola táto hodnota AUC = 0,934 (93,4 %), teda ako výborne diskriminujúca.
Výsledky našej štúdie potvrdili, že u pacientov s neurologickým ochorením sa vyskytuje heterogénna skupina rizikových faktorov pádu, ktoré sa u konkrétneho pacienta vzájomne kombinujú, čím sa individualizuje aj výška rizika pádu. Klinické symptómy ochorenia spolu s pozitívnou anamnézou pádu zaraďujú pacienta už pri prijatí na hospitalizáciu do skupiny s vysokým rizikom pádu, bez ohľadu na to, či je prijatý s akútnou alebo chronickou neurologickou diagnózou [4,7,23,44]. Vzhľadom na multifaktorovú etiológiu pádov sa odporúča implementovať do klinickej praxe štandardizovanú metodiku posudzovania rizika pádu, vrátane skríningového nástroja [15,30,44]. Nástroj MFS sa ukazuje ako vhodný na používanie aj v skupine neurologických pacientov [4,5,23,25]. Jeho benefitom okrem krátkej administrácie je aj ponuka preventívnych intervencií podľa výšky rizika pádu [23]. Treba si však uvedomiť, že žiadny predikčný ukazovateľ nedá svojou hodnotou 100% záruku, že pri pozitívnom teste pacient aj reálne spadne. Napriek tomu je potrebné realizovať preventívne intervencie u každého pacienta bez ohľadu na jeho aktuálny stav a výšku rizika pádu, ako súčasť bezpečnej starostlivosti [22,45].
Výskumná štúdia má svoje limitácie: bola realizovaná v jednom regionálnom zdravotníckom zariadení, skríning rizika pádu bol realizovaný iba pri príjme pacienta na ošetrovaciu jednotku, nie opakovane. Zisťované bolo iba riziko pádu a nie počet pádov počas realizácie štúdie.
Záver
Identifikácia rizikových faktorov pádu a skríning rizika pádu u hospitalizovaných pacientov je dôležitou súčasťou prevencie nežiaducej udalosti. Výsledok skríningu je základom pre výber a implementáciu cielených individuálnych intervencií v rámci kompetencií členov interprofesionálneho tímu, ale nikdy by nemal nahradiť neurologické a funkčné vyšetrenie. Rutinné používanie nástroja v klinickej praxi predpokladá prospektívnu validáciu nástroja v slovenských podmienkach. Výsledky štúdie môžu byť východiskom pre ďalší výskum k problematike pádov na Slovensku a pre prípravu národného štandardu k tejto nežiaducej udalosti.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Michaela Miertová, PhD.
Ústav ošetrovateľstva
Jesseniova LF UK
Malá Hora 5
036 01 Martin
Slovensko
e-mail: miertova@jfmed.uniba.sk
Přijato k recenzi: 22. 3. 2019
Přijato do tisku: 12. 9. 2019
Zdroje
1. Kobayashi K, Imagama S, Inagaki Y et al. Incidence and characteristics of accidental falls in hospitalizations. Nagoya J Med Sci 2017; 79(3): 291 – 298. doi: 10.18999/ nagjms.79.3.291.
2. Krobot A, Kolářová B, Kolář P et al. Neurorehabilitace chůze po cévní mozkové příhodě. Cesk Slov Neurol N 2017; 80/ 113(5): 521 – 526. doi: 10.14735/ amcsnn2017521.
3. Kenny RA, Rommero-Ortuno R, Kumar P. Falls in older adults. Medicine 2017; 45(1): 28 – 33. doi: 10.1016/ j.mpmed.2016.10.007.
4. Yoo SH, Kim SR, Shin YS. A prediction model of falls for patients with neurological disorder in acute care hospital. J Neurol Sci 2015; 356(1 – 2): 113 – 117. doi: 10.1016/ j.jns.2015.06.027.
5. Sung YH, Cho MS, Kwon IG et al. Evaluation of fallsby inpatients in acute care hospital in Korea using the Morse Fall Scale. Int J Nurs Pract 2014; 20(5): 510 – 517. doi: 10.1111/ ijn.12192.
6. Bouldin ER, Andresen EM, Dunton NE et al. Falls among adult patients hospitalized in the United States: prevalence and trends. J Patient Saf 2013; 9(1): 13 – 17. doi: 10.1097/ PTS.0b013e3182699b64.
7. Hunderfund AN, Sweeney CM, Mandrekar JN et al. Effect of multidisciplinary fall risk assessment on falls among neurology inpatients. Mayo Clin Proc 2011; 86(1): 19 – 24. doi: 10.4065/ mcp.2010.0441.
8. Zhao YL, Kim H. Older adult inpatient falls in acute care hospitals: intrinsic, extrinsic, and environmental factors. J Gerontol Nurs 2015; 41(7): 29 – 43. doi: 10.3928/ 00989134-20150616-05.
9. Camicioli R. Falls in aging and neurological disease. In: Albert ML, Knoefel JE (eds). Clinical neurology of aging. 3rd ed. New York: Oxford University Press 2011 : 297 – 313.
10. Tan KM, Tan MP. Stroke and falls – clash of the two titans in geriatrics. Geriatrics (Basel) 2016; 1(31): 1 – 15. doi: 10.3390/ geriatrics1040031.
11. Rudzińska M, Bukowczan S, Stožek J et al. The incidence and risk factors of falls in Parkinson’s disease: prospective study. Neurol Neurochir Pol 2013; 47(5): 431 – 437. doi: 10.5114/ ninp.2013.38223.
12. Valkovič P, Košutzká Z, Schmidt F. Posturálna instabilita, poruchy chôdze a pády pri Parkinsonovej chorobe. Cesk Slov Neurol N 2012; 75/ 108(2): 141 – 153.
13. Allen NE, Sschwarzel AK, Canning CG. Recurrent fallsin Parkinson’s disease: a systematic review. Parkinsons Dis 2013; 2013 : 906274. doi: 10.1155/ 2013/ 906274.
14. Mazunder R, Murchison CH, Bourdette D et al. Fallsin people with multiple sclerosis compared with fallsin healthy controls. PLoS One 2014; 9(9): e107620. doi: 10.1371/ journal.pone.0107620.
15. Prevence pádů ve zdravotnickém zařízení. Cesta k dokonalosti a zvyšování kvality. Praha: GRADA Publishing 2007 : 172.
16. Remor CP, Cruz CB, Urbanetti JS. Analysis of fall risk factors in adults within the first 48 hours of hospitalization. Rev Gaucha Enferm 2014; 35(4): 28 – 34. doi: 10.1590/ 1983-1447.2014.04.50716.
17. Renfro M, Maring J, Bainbridge D et al. Fall risk among older adult high-risk populations: a review of current screening and assessment tools. Curr Geri Rep 2016; 5(3): 160 – 171.
18. Han J, Xu L, Zhou CH et al. Stratify, Hendrich II fall risk model and Morse Fall Scale used in predicting the risk of falling for elderly in-patients. Biomed Res 2017; 28 (special issue): S439 – S442.
19. Nassar N, Helou N, Madi CH. Predicting fallsusing two instruments (The Hendrich Fall Risk Scale and The Morse Fall Scale) in an Acute Care Setting in Lebanon. J Clin Nurs 2014; 23(11 – 12): 1620 – 1629. doi: 10.1111/ jocn.12278.
20. Sardo PM, Simões CS, Alvarelhão JJ et al. Fall risk assess-ment: retrospective analysis of Morse Fall Scale scores in Portuguese hospitalized adult patients. Appl Nurs Res 2016; 31 : 34 – 40. doi: 10.1016/ j.apnr.2015.11.013.
21. Gu YY, Balcaen K, Ni Y et al. Review on prevention of falls in hospital settings. Chin Nurs Res 2016; 3(1): 7 – 10. doi: 10.1016/ j.cnre.2015.11.002.
22. Bradley SM, Karani R, McGinn T et al. Predictors of serious injury among hospitalized patients evaluated for falls. J Hosp Med 2010; 5(2): 63 – 68. doi: 10.1002/ jhm.555.
23. Morse J. Preventing patient falls. Establishing a Fall Intervention Program. 2nd ed. New York: Springer Publishing Company, LLC 2009.
24. Miake-Lye IM, Hempel S, Ganz DA et al. Inpatient fall prevention programs as a patient safety strategy. A systematic review. Ann Intern Med 2013; 158 (5 Pt 2): 390 – 396. doi: 10.7326/ 0003-4819-158-5-201303051-00005.
25. Cumbler EU, Simpson JR, Rosenthal LD et al. Inpatient falls: defining the problem and identifying possible solution. Part I: an evidence-based review. Neurohospitalist 2013; 3(3): 135 – 143. doi: 10.1177/ 1941874412470665.
26. Kim KS, Kim JA, Choi YK et al. A comparative study of the validity of fall risk assessment scales in Korean hospitals. Asian Nurs Res (Korean Soc Nurs Sci) 2011; 5(1): 28 – 37. doi: 10.1016/ S1976-1317(11)60011-X.
27. Morse JM, Morse RM, Tylko SJ. Development of a scale to identify the fall-prone patient. Canadian J Aging 1989; 8(4): 366 – 377. doi: 10.1017/ S0714980800008576.
28. R Core Team. R: a language and environment for statistical computing. R Foundation for Statistical Computing. Vienna: Austria 2018. [online]. Available from URL: https:/ / www.R-project.org/ .
29. Venables WN, Ripley BD. Modern Applied Statistics with S. 4th ed. New York: Springer 2002.
30. Falls in older people: assessing risk and prevention. NICE Clinical Guideline 161 (reviewed). Developed by the Centre for Clinical Practice at NICE, 2018. 31 p. [online]. Available from URL: https:/ / www.nice.org.uk/ guidance/ cg161/ chapter/ about-this-guideline.
31. Gunn H, Creanor S, Haas B et al. Risk factors for fall in multiple sclerosis: an observational study. Mult Scler 2013; 19(14): 1913 – 1922. doi: 10.1177/ 1352458513488233.
32. Bednařík J, Ambler Z, Růžička E et al. Klinická neurologie – část speciální I. Praha: TRITON 2010 : 707.
33. Lunsford B, Wilson LD. Assessing your patients risk for falling. American Nurse Today 2015; 10(7): 29 – 31.
34. Nonnekes J, Goselink RJ, Růžička E et al. Neurological disorders of gait, balance and posture: a sign-based approach. Nat Rev Neurol 2018; 14(3): 183 – 189. doi: 10.1038/ nrneurol.2017.178.
35. Mion LC, Chandler AM, Waters TM et al. Is it possible to identify risks for injurious falls in hospital patients? Jt Comm J Qual Patient Saf 2012; 38(9): 408 – 413.
36. Gray-Miceli D, Quigley PA. Falls prevention: assessment, diagnoses, and intervention strategies. In: Boltz M et al (eds). Evidence-based geriatric Nursing Protocols for Best Practice. 4th ed. New York: SpringerPublishing Company 2012 : 268 – 297.
37. Marshall FJ. Approach to the elderly patient with gait disturbance. Neurol Clin Pract 2012; 2(2): 103 – 111. doi: 10.1212/ CPJ.0b013e31825a7823.
38. Fehlberg EA, Lucero RJ, Weaver MT et al. Associations between hypernatremia, volume depletion and the risk of falls in US hospitalised patients: a case-control study. BMJ Open 2017; 7(8): e017045. doi: 10.1136/ bmjopen-2017-017045.
39. Guillaume D, Crawford S, Quigley P. Characteristics of the middle-age adult inpatient fall. Appl Nurs Res 2016; 31 : 65 – 71. doi: 10.1016/ j.apnr.2016.01.003.
40. Krasulová E, Blahová Dušánková J, Havrdová E. Roz-troušená skleróza – psychoneuroimunologické onemocnění centrálního nervového systému. Psychiatr Prax 2009; 10(3): 121 – 125.
41. Kurčová S, Menšíková K, Kaiserová M et al. Pre-motorické a non-motorické príznaky Parkinsonovej choroby – taxonómia, klinická manifestácia a neuropatologické koreláty. Cesk Slov Neurol N 2016; 79/ 122(3): 255 – 270. doi: 10.14735/ amcsnn2016255.
42. Custodio N, Lira D, Herrera-Perez E et al. Predictive model for falling in Parkinson disease patients. eNeurological Sci 2016; 5 : 20 – 24. doi: 10.1016/ j.ensci.2016.11.003.
43. Dušek L, Pavlík T, Jarkovský J et al. Analýza dát v neurologii – XXVIII. Hodnocení diagnostických testů – křivky ROC. Cesk Slov Neurol N 2011; 74/ 107(4): 493 – 499.
44. Pokorná A, Búřilová P, Šrombachová V et al. Centrální systém hlášení nežádoucích událostí – Metodika nežádoucí událost PÁD. Plná verze metodiky 1/ 2017. Praha: Ústav zdravotnických informací a statistiky ČR 2017 : 40.
45. Bittencourt VL, Graube SL, Stumm EM et al. Factors associated with the risk of falls in hospitalized adult patients. Rev Esc Enferm USP 2017; 51: e03237. doi: 10.1590/ S1980-220X2016037403237.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2019 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Střelná poranění mozku
- Predstavujú ticagrelor a prasugrel alternatívu v protidoštičkovej liečbe ischemických CMP? ANO
- Představují tikagrelor a prasugrel alternativu v protidestičkové léčbě ischemických CMP? NE
- Predstavujú ticagrelor a prasugrel alternatívu v protidoštičkovej liečbe ischemických CMP?
- Klinické syndromy z oblasti cervikálního plexu
- Neurorehabilitace poruch chůze s využitím funkční elektrické stimulace – aktuální poznatky z randomizovaných klinických studií
- Úskalí při respektování autonomie u pacientů s Parkinsonovou nemocí
- Současný management pacientů s degenerativní kompresí krční míchy
- Krvácení do aterosklerotického plátu u symptomatické a asymptomatické progredující stenózy vnitřní karotidy – pilotní studie
- Porovnání perioperačního měření tlaku ve vaku aneuryzmatu a v mateřské tepně u prasklých a neprasklých aneuryzmat
- Významné rizikové faktory pádu v osobnej anamnéze u hospitalizovaných pacientov s neurologickým ochorením
- Systematická analýza klinické efektivity stabilizace sakroiliakálního skloubení v rámci terapie bolestí zad
- Spinální meningiomy – 92 pacientů operovaných na našem pracovišti
- Civilní a válečná střelná poranění hlavy
- Mění se při Parkinsonově nemoci tloušťka cévnatky?
- Epidurální aplikace kortikoidů Část 1 – Profil pacientů před aplikací
- Chirurgická terapie oboustranné farmakorezistentní Menièrovy choroby
- Mechanická trombektómia v liečbe akútnej ischemickej cievnej mozgovej príhody v detskom veku
- Konzervativní management prasklé Galassi III arachnoideální cysty střední jámy lební
- Rekonstrukce lícního nervu štěpem z nervus auricularis magnus při resekci recidivujícího bazaliomu parotideomasseterické krajiny
- Doporučení pro mechanickou trombektomii akutního mozkového infarktu – verze 2019
- Analýza dat v neurologii LXXVIII. Směsné míry korelace u vícerozměrných souborů kvantitativních a kvalitativních dat
- Osmdesátiny doc. MU Dr. Jiřího Bauera, CSc.
- Doc. MU Dr. Eugen Eiben, CSc.
- Recenze knih
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Klinické syndromy z oblasti cervikálního plexu
- Doporučení pro mechanickou trombektomii akutního mozkového infarktu – verze 2019
- Mechanická trombektómia v liečbe akútnej ischemickej cievnej mozgovej príhody v detskom veku
- Střelná poranění mozku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



