-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaCílené podávání léků: potenciální aplikace s resveratrolem
Targeted drug delivery system: potential application to resveratrol
Drug delivery system (DDS) is intended to increasing effectiveness of drugs through targeted distribution and to reducing of unwanted effects. In this mini-review, the basic principles of nanotechnology that were developed for DDS were reported including sections on the present research in key areas that are important for future investigations. Attention is paid on resveratrol as a model phytochemical with interesting pharmacologic profile which was demonstrated in great numbers of studies and for its wide use as supplemental therapy. Due to complicated pharmacokinetic profile of resveratrol that is characterized by very low bioavailability in spite of high oral absorption, the effects of resveratrol is being studied in new nanotechnology preparations of pharmaceutical formulation.
Herein we report on results of present in vitro and in vivo investigations with resveratrol in new types of drug formulations using different nanoparticles as liposomes, solid lipid particles, cyclodextrins and micelles.Key words:
targeted drug delivery • nanotechnology • resveratrol
Autoři: Hassan Farghali; Ludmila Kameníková
Vyšlo v časopise: Čes. slov. Farm., 2017; 66, 76-82
Kategorie: Přehledy a odborná sdělení
Souhrn
Od systému cíleného podávání léků (DDS – drug delivery system) se očekává pro terapii zvýšená účinnost léčiv, cílená distribuce a snížení nežádoucích efektů. V přehledném článku jsou stručně popsány základní principy nanotechnologie vyvinuté pro DDS, jednotlivé úseky současného výzkumu a klíčové oblasti nutné pro budoucí zkoumání. Pozornost je věnována resveratrolu jako modelové látce se zajímavými farmakologickými vlastnostmi, které byly potvrzeny v řadě studií, a také pro jeho široké užívání ve formě doplňkové terapie. Vzhledem k nepříznivým farmakokinetickým parametrům resveratrolu, charakterizovaných velmi nízkou biodostupností přes dostatečně vysokou orální absorpci, se účinnost resveratrolu začala studovat v nových nanotechnologií připravených lékových formách. V přehledu jsou uvedeny výsledky dosavadních in vitro a in vivo studií s resveratrolem v novém typu lékových forem s využitím různorodých nanočástic jako jsou liposomy, pevné lipidní částice, cyklodextriny a micely.
Klíčová slova:
cílené podávání léků • nanotechnologie • resveratrolÚvod
Úspěšnost farmakoterapie je závislá na mnoha faktorech. Jedním z velmi důležitých faktorů je uvolňování účinné látky z lékové formy. V současné farmakoterapeutické praxi se užívají všechny tři druhy lékových forem: formy s neřízených účinkem, tzv. formy konvenční, dále s řízeným účinkem a vyvíjejí se lékové formy s cílenou distribucí. Systém cíleného podávání léků (tzv. drug delivery system – DDS) byl vytvořen inženýrskou technologií pro cílené podávání a/nebo kontrolované uvolnění terapeutické účinné látky. Je možné kontrolovat rychlost, při které se léčivo uvolňuje, a místo, kde se v těle léčivo kumuluje. Cílem tohoto výzkumu s jakoukoliv jednotlivou účinnou látkou je přispět k zajištění lepší účinnosti léčby ve srovnání s konvenční aplikací léků.
Tento pokrokový systém není možné vždy akceptovat pro některá onemocnění, i když byl vyvinut na základě pokrokových strategií molekulární biologie, a to v důsledku vzniklých nežádoucích efektů, jež pak limitují snahu k navržení optimální léčby např. pro nádorová, neurodegenerativní a infekční onemocnění.
Pro budoucí terapeutické využití třetí generace lékových forem jsou důležité principy nanotechnologického výzkumu. Od tohoto systému se očekává zvýšená účinnost léčiv a úbytek nežádoucích efektů léčby. Za účelem optimalizovat tento systém byli začleněni do výzkumných týmů pracovníci rozličných specializovaných oborů, tj. chemici, biologové, farmaceutičtí technologové.
Základní principy nanotechnologie vyvinuté pro DDS
Základním principem nanotechnologie je snaha vytvořit nový transportní systém s léčivem, ve kterém je léčivo během prostupu tkáněmi chráněno, a dopravit ho až do cílené tkáně, kde se teprve léčivá látka uvolní.
V tkáni, která je patologicky postižená, by pak uvolněné léčivo mělo zlikvidovat škodlivé buňky a zároveň nezasáhnout zdravou tkáň. To je velký úkol pro moderní biomedicínu1).
Jednotlivé úseky současného výzkumu pro DDS
Prvním úsekem současného výzkumu pro DDS je cesta podání (delivery), neboť je mnoho rozmanitých způsobů aplikace, z nichž každá má pro konkrétní léčbu své výhody i nevýhody. Příkladem může být např. mikrovláknová náplast pro aplikaci vakcíny2). Tato nová léková forma je snadno použitelná, bez speciálních příkazů, takže může být používána samotnými pacienty i v domácí péči.
Druhý úsek výzkumu pro DDS se zabývá výběrem a testováním správného nosiče (cargo) pro léčivo. Tento úsek je pro cílený DDS nejdůležitější a také nejobtížnější. Prozkoumává se použití genů, proteinů i kmenových buněk jako nosičů. Takovým příkladem je projekt proteinové léčby autoimunitních onemocnění. Byly vyvinuty mikroskopické, biodegradovatelné částice, schopné selektivně napadnout imunitní buňky spojené s autoimunitním narušitelem pro vznik roztroušené sklerózy. Proteinové mikročástice bude možné využít v léčbě jiných na imunitě závislých nemocí, včetně alergií nebo při útlumu orgánové rejekce transplantačních pacientů.
Třetím úsekem výzkumu je cílená strategie, tj. určení onoho terče neboli cíle, kam má být léčivo dopraveno a kde má efektivně působit. Tímto cílem mohou být celé orgány (srdce, plíce, mozek), typy tkání (svaly, nervy), struktury specifické nemoci (nádorové buňky) nebo vnitřní struktury v buňce. Tak byly např. vyvinuty nanočástice rostlinného viru schopné zacílit a atakovat nádorové prostatické buňky3). Existuje mnoho dalších výzkumných projektů pro vývoj virových nanočástic k dopravě chemoterapeutických léčiv přímo do nádorů. Výhodou dané strategie bývá snížení vedlejších efektů, které téměř vždy doprovázejí terapii nádorového onemocnění.
Klíčové oblasti nutné pro budoucí zkoumání
Pro budoucí výzkum v DDS systému bude nutné hlouběji zkoumat průnik léčiv krevně-mozkovou bariérou u nemocí mozku, shromažďovat znalosti o průniku léčiv škodlivých mozku. Systém DDS je speciálně důležitý pro léčbu např. mozkových nádorů, Alzheimerovy a Parkinsonovy nemoci.
Druhou budoucí klíčovou oblastí je navýšení poznatků o cíleném intracelulárním podávání léčiv. Jako je tělo chráněno imunitním systémem před nemocemi, tak každá z našich buněk disponuje vlastními interními procesy k rozpoznání a zbavení se potenciálně škodlivých látek, tedy látek tělu cizích. Pomocí nových inženýrských technologií v rámci DDS zajistit průnik léčiva do cíleného intracelulárního místa a jeho uvolnění v závislosti na specifických molekulárních signálech a na základě správně vybraných intracelulárních buněčných strukturách.
Třetí oblast výzkumu se týká teranostiky4) – nové strategie kombinace diagnózy a léčby. Se zobrazovací technologií a současným cíleným dodáním léčiv budou lékaři schopni diagnostikovat a léčit nemoci současně, tzv. jedním krokem4).
Resveratrol – účinná látka, potravní doplněk
Zájem o substituční dodání resveratrolu do lidského těla souvisí s tzv. „francouzským paradoxem“ z poloviny osmdesátých let 20. století. Epidemiologické pozorování totiž odhalilo, že Francouzi i přes relativně bohatou stravu na tuky vykazují nízkou incidenci kardiovaskulárních onemocnění. Dává se to do souvislosti s velkou potřebou ovoce a vína, jejichž významnou složkou je resveratrol.
Resveratrol svými příznivými farmakologickými vlastnostmi5, 6) se začal jevil jako potenciální léčivá látka k léčbě rozličných potíží. Vykazuje antioxidační, kardioprotektivní, protizánětlivý, protirakovinný potenciál a popisuje se také jeho anti-aging efekt7–9). Je konzumenty užíván kromě konzumace ovoce a pití vín také jako potravní doplněk, a to dosud v klasických perorálních lékových formách.
Problematika substitučního podávání resveratrolu do organismu není zdaleka tak jednoduchá, jak by se zdálo. Většina základní vědecké literatury obsahuje enormní počty substrátů, které slibují zlepšit či dokonce anulovat symptomy nemocí v rozsahu mezi léčbou rakoviny až ke zpomalení samotných procesů stárnutí. Na druhé straně však tyto látky nebyly dostatečně zkoumány u lidí. Je nutné mít na mysli vždy důležitost extrapolace výsledků získaných ze základního výzkumu ke klinickému použití10).
Konference uspořádaná v Dánsku v roce 2011 upozornila na tu skutečnost, že publikované výsledky nejsou vždy jednoznačnými důkazy pro to, aby byl resveratrol podáván lidem v dávkách větších než v té dávce, která odpovídá denní spotřebě potravin11). Přesto se resveratrol svými farmakologickými vlastnostmi zdá být potenciální léčivou látkou k léčbě rozličných potíží v důsledku svých silných antioxidačních vlastností. Aby se však stal potenciálním kandidátem zařazeným do první linie léčby nemocí, vede ještě dlouhá cesta.
Podívejme se a zamysleme se nad jeho složitou farmakokinetikou.
Farmakokinetické vlastnosti resveratrolu
Jsou charakterizovány velmi nízkou biodostupností, slabou rozpustností ve vodě v důsledku své lipofility. Zajímavé je porovnání jeho účinnosti s biologickou dostupností. Tato látka je absorbována v těle ze 75 %, ale její biologická dostupnost je pouze 1%6). Je absorbována ze zažívacího traktu do jater, kde dochází k biotransformací, k first-pass-efektu s tvorbou řady metabolitů a také ze střevního traktu. Dá se tedy říci, že farmakokinetické vlastnosti nejsou u resveratrolu ve srovnání s jinými účinnými látkami příznivé, a to nejen pro jeho nepatrnou – velice nízkou biodostupnost a nízkou rozpustnost ve vodě, ale také pro chemickou nestabilitu.
Obr. 1. Možnosti nanoformulací s resveratrolem dle<sup>6)</sup> 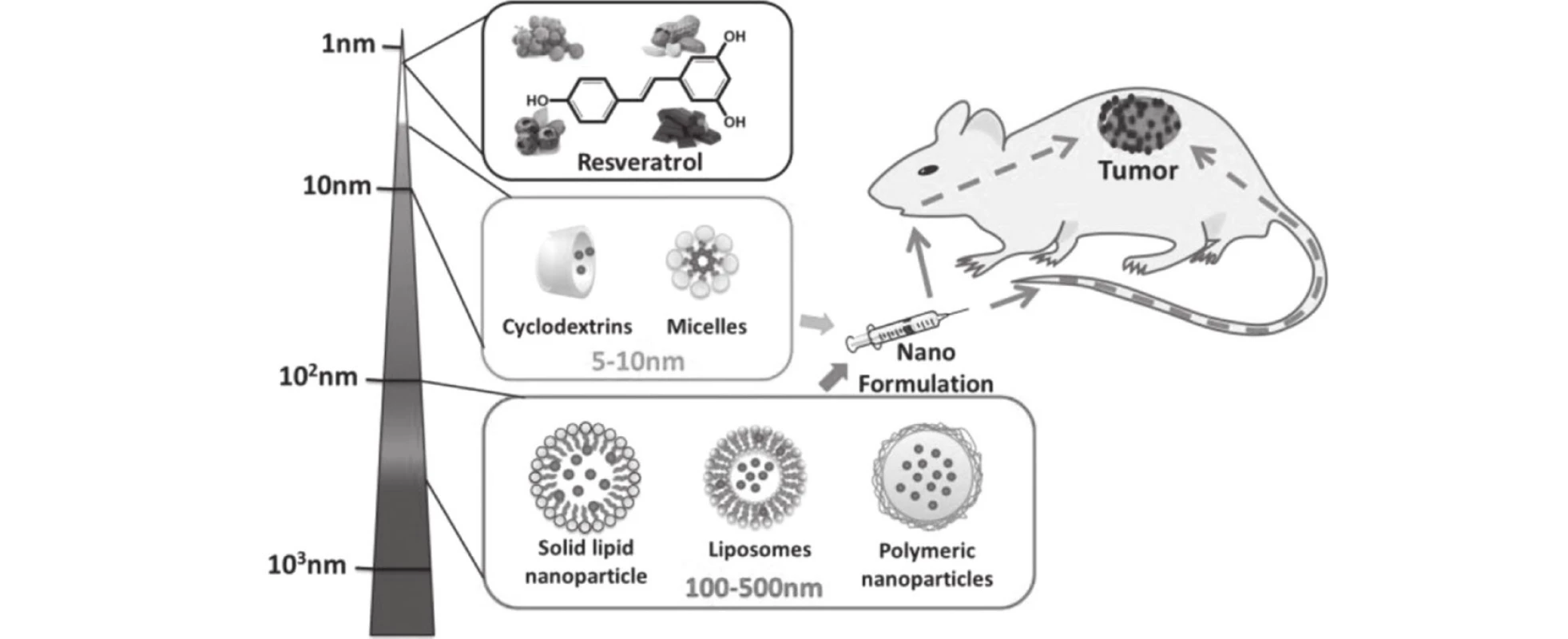
Samotný resveratrol existuje ve dvou geometrických isomerech jako cis - a trans-isomer. Trans-isomer se vyskytuje častěji a je biologicky aktivnější než cis-isomer12). Přesto je orální absorpce resveratrolu u lidí vysoká (asi 75%) a uskutečňuje se převážně transepiteliální difuzí13). Značně nízká biologická dostupnost resveratrolu (< 1 %) vyplývá v důsledku extensivního metabolismu ve střevech a játrech. Při biotransformaci dochází ke glukuronové a sulfátové konjugaci s tvorbou klíčových metabolitů a to trans-resveratrol-3-O-glukuronid a trans-resveratrol-3-sulfát14). Zda tyto metabolity vykazují také farmakologickou účinnost přes původně zjištěnou nepatrnou biologickou dostupnost, není dosud potvrzeno. Zda se jedná o nelineární farmakokinetiku není v publikacích uváděno.
Základní farmakokinetické parametry byly získány na dobrovolnících po aplikaci konvenčních lékových forem. V jedné farmakokinetické studii15) byl podáván resveratrol po dobu 29 dní v dávkách 0,5–5 g/den. Vyšší dávky od 2,5 g/den vyvolaly však řadu nepříjemných gastrointestinálních potíží. V dalších studiích16, 17) byly farmakokinetické parametry získávány včetně stanovení metabolitů u různého počtu dobrovolníků (soubor až 40). Hlavní pík plazmatické koncentrace látky byl nalezen v rozmezí 0,8–1,5 h, plocha pod plazmatickou křivkou byla závislá na dávce. Exkrece resveratrolu i jeho metabolitů do moči byla rychlá, okolo 4 h při nejnižší podané dávce. Po perorálně aplikovaném resveratrolu byla u lidí zjištěna jen nízká koncentrace volné látky13) v systémové cirkulaci a byla potvrzena hepato-enterická recirculace18) s výsledným biologickým poločasem 9,2 h.
Farmakologické vlastnosti resveratrolu
Hlavní farmakologické efekty po podání resveratrolu byly zjištěny převážně v in vitro studiích. Byla to aktivita protinádorová, antioxidační, kardioprotektivní a apoptotická.
Protirakovinná aktivita resveratrolu byla testována u rozličných nádorových buněčných linií. Přesné farmakologické poznatky nejsou však dosud zcela známé. Pochopení vlastního mechanismu účinku resveratrolu je založeno na schopnosti této látky indukovat apoptózu a zabrzdit buněčný cyklus19–21). Vysvětlit mechanismus účinku této aktivity resveratrolu je možné na základě regulace reaktivních druhů kyslíku (ROS), snížení signalizace této patologické cesty. Je nutné si také uvědomit, že v některých studiích vyšel nejen antioxidační, ale i prooxidační potenciál. Který z těchto dvou mechanismů je více dominantní a na čem to závisí, nelze dosud rozhodnout a nelze uvažovat jen o velikosti dávky.
Při zkoumání vlivu resveratrolu na parametry oxidativního stresu a na hladinu ROS včetně antioxidační aktivity se ukázalo, že dlouhotrvající substituce resveratrolu signifikantně snížila poškození DNA způsobené podáním některých toxických látek22), došlo ke zhášení lipoidních aniontových radikálů hydroperoxylu, hydroxylu a superoxidu23) a ke zvýšení antioxidační aktivity v buňkách, a to u superoxiddismutázy (SOD) a katalázy; rovněž byla zvýšena hladina různých kofaktorů nutných pro antioxidační efekt jako glutathionu, vitaminu C, vitaminu E a betakarotenu22). Z výsledků převážně in vitro studií vyplynulo, že resveratrol by mohl mít důležitou roli v prevenci iniciace karcinogeneze. Ovšem tato tvrzení bude nutno podložit klinickými studiemi, které dosud se samotným resveratrolem k dispozici nejsou.
Hlavním farmakologickým účinkem resveratrolu je jeho antioxidační aktivita, jak bylo uvedeno výše, která se může projevit také v účinku kardioprotektivním. Tento vliv byl prokázán v srdeční tkáni úbytkem iontových radikálů patřících do skupiny ROS. Resveratrol zvyšuje aktivitu endoteliální nitric oxid syntasy a inhibuje LDL oxidaci. Vykazuje také protektivní účinky vůči neurodegenerativnímu poškození. Je schopen inhibovat tvorbu a agregaci β-amyloidního peptidu24) zodpovědného za neuronální dysfunkce a úmrtí spojená s Alzheimerovou nemocí v důsledku působení ROS.
Pro spuštění apoptózy lidských buněk akutní myeloidní leukemie byl Yaseenem et al.25) prokázán synergický účinek resveratrolu s inhibitory histon deacetylasy. Došlo ke zvýšené tvorbě ROS doprovázené zvýšeným poškozením DNA a buněčnou apoptózou a následné aktivaci receptorů, jež dále aktivovaly enzymy proapoptotické kaskády. Podobné výsledky byly získány na nádorových buňkách lidského střeva, HT-29 a COLO 201, v nichž resveratrol indukoval celulární apoptosu.
K dalším vlastnostem resveratrolu přispěla v tomto roce publikovaná studie26) o možnosti biodostupnosti této – ve vodě slabě rozpustné látky – do kůže. S použitím modelu prasečí ušní kůže se zjistilo, že po aplikaci lékové nanosuspenzní formy resveratrolu došlo k jeho větší penetraci do hlubších úrovní kůže než ve srovnání s hrubou suspenzní látkou. Tento poznatek by mohl být v budoucnu využit za účelem léčby kožních nemocí.
Přesto, že výsledky prováděné s resveratrolem v in vitro studiích se zdály být slibné, byly v mnohém limitovány. Pro in vivo studie byl limitujícím faktorem výběr vhodného nosiče léčiva, se kterým by bylo možné látku cíleně zacílit např. do nádorových buněk v těle.
Pro jeho výrazné farmakologické a terapeutické účinky zjištěné a potvrzené převážně v in vitro studiích a vzhledem k jeho malé biologické dostupnosti se začalo uvažovat o novém typu lékových forem pro resveratrol s využitím tzv. „nanodelivery“ systémů.
Jaké jsou výsledky studií s resveratrolem v nanoformách?
Zkoumání účinnosti resveratrolu v novém typu lékových forem bylo provedeno za in vitro i in vivo podmínek5). Cílem těchto studií bylo zvýšit orální dostupnost resveratrolu pro další užití v medicíně jako doplňku stravy.
K vytvoření nových lékových forem s resveratrolem bylo využito různorodých nanočástic: liposomy, pevné lipoidní nanočástice, cyklodextriny a micely. Proti tradičním lékovým formám se očekávala řada předností. A to zvýšení rozpustnosti resveratrolu ve vodě, zlepšení biodostupnosti, zvýšení fysikálně-chemické stability látky. Především však schopnost zacílit léčivo přímo do místa účinku včetně možnosti kontrolovat postupné uvolňování léčiva27, 28).
Zjistilo se, že lékové formy s nanovelikostí mají své přednosti zejména v terapii nádorů v důsledku zvýšeného permeačního a retenčního efektu (EPR), kterým se tyto molekuly přednostně hromadí v nádorových tkáních. EPR efekt byl navržen k vysvětlení selektivního hromadění nanonosičů u solidních tumorů a použit k vysvětlení strategie celého „delivery“ systému29). Nanočástice mohou snadno difuzně proniknout do cévního systému a nahromadit se v intersticiální tekutině, např. v lymfatickém systému karcinogenní tkáně, a tak ji poškodit.
Podívejme se na výsledky náročných studií provedených v posledních letech s různorodými nanoformami s resvertrolem.
Liposomy
První sledovanou nano-lékovou formou s resveratrolem byly liposomy. Vesikuly liposomů obsahují vodní jádro obklopené fosfolipidní dvouvrstvou se silnou podobností se savčí plazmatickou membránou30), která je důležitá pro stabilitu vehikul. Výhodou liposomů je skutečnost, že zabraňují fotochemickou degradaci velkého počtu léčiv a biomolekul. Chemická stabilita trans-resveratrolu v liposomech byla zachována při jejich uskladnění v nepřítomnosti světla, ale jen při nízkých teplotách nad nulou31). Samotná fotoisomerizace resveratrolu má za následek narušení integrity liposomální dvojvrstvy a zapuštění látky do lipidního kompartmentu. Liposomální stabilita závisí na povrchu zeta (ζ)-potenciálu, což je parametr, podle kterého se určuje predikce elektrostatické stabilizace v koloidním systému. Vysoký ζ-potenciál je příznakem dobré disperzní stability.
V in vitro studiích byla zkoumána účinnost liposomů naplněných resveratrolem s cíleným zaměřením (targeting) do rakovinných buněk. Velikost liposomů použitá ve studiích se pohybovala v rozmezí 70–200 nm. Výsledkem byl pasivní transport většiny nanočástic do nádoru s využitím patofyziologických abnormalit cévní sítě nádoru. Na základě tohoto výsledku byly prováděny také povrchové modifikace za účelem zvýšení celulární přilnavosti liposomů a ochrany vesikulů před metabolickou eliminací za podmínek in vivo 32).
Úspěšně byly testovány imunoliposomy nejen s resveratrolem, ale i s obsahem dalších polyfenolů, např. s kurkuminem33). Ukázalo se, že imunoliposomy ve srovnání s konvenčními liposomy vykazují větší kumulaci v buňkách s HER2 receptory (receptor lidského epidermálního růstového faktoru), což vedlo ke zlepšení selektivity a antiproliferačních účinků resveratrolu v těchto buňkách. Síla účinnosti imunoliposomů je závislá na úrovni exprese tohoto receptoru v buňkách34).
Inovativním zlomem ve vývoji nanočástic resveratrolu bylo objevení mitochondrial-targeting liposomů. Wang et al.35) vyzkoušel použít tyto modifikované nanočástice za účelem selektivního zvýšení liposomů s resveratrolem při léčbě rezistentních plicních nádorových buněk. Výsledkem byla zvýšená apoptóza v nádorových buňkách vyvolaná zvýšeným celulárním příjmem a akumulací léčiva v mitochondriích. Jejím důsledkem došlo ke snížené mitochondriální depolarizaci.
Za účelem zvýšení cytotoxické účinnosti resveratrolu vůči rakovinným buňkám byly provedeny studie s kombinovanou enkapsulací resveratrolu s jinými cytotoxickými látkami, např. s 5-fluorouracilem36). Společná enkapsulace neprokázala násobně zvýšenou cytotoxickou aktivitu, ale značně se snížilo množství resveratrolu požadovaného pro 50% úmrtí buněk. Vysoké koncentrace resveratrolu měly synergické účinky s 5-fluorouracilem, zatímco nízké koncentrace antagonizovaly chemoterapeutické účinky léčby. Zdá se, že tato zjištění jsou důležitá pro budoucí výzkumy s ohlédnutím k účinností resveratrolu, uvažuje-li se o společné enkapsulací s jinými chemoterapeutickými činidly. Významnou brzdou ve výzkumu resveratrolem naplněných liposomů zůstává jejich nízká „loading“ kapacita, tj. limitující prostor ve fosfolipidní dvojvrstvě pro obsazení lipofilního léčiva, aby nedošlo ke ztrátě jeho strukturální integrity.
Chceme-li závěrem hodnotit tuto lékovou nanoformu – liposomy, lze říci, že životní prostor liposomální lékové formy bývá časově omezen a je nezbytné vždy vyžadovat skladování této lékové formy v chladu.
Polymerní nanočástice
K úspěšné přípravě těchto lékových forem bylo nutné vyřešit kompatibilitu těchto nanočástic s léčivou látkou. Proto bylo použito mnoho rozdílných polymerů obsahující poly(laktid-co-glykolidy) (PLGA), polyethylenglykol (PEG), polykaprolakton (PCL) a polyaktid (PLA)37).
Za podmínek in vitro studií byla prokázána vysoká účinnost enkapsulace resveratrolu do PCL nanočástic v rozmezí 73–98 % k porovnání jejich cytotoxicity vůči volnému resveratrolu, a to v buněčných liniích DU-145 a LNCaP38).
Enkapsulace resveratrolu do PLGA nanočástic byla studována nejen za podmínek in vitro, ale také za podmínek in vivo37). Její účinnost se pohybovala mezi 42 % a 72 %, resveratrol byl uvolňován po dobu 12 dnů a nanočástice zůstaly stabilní pro dobu nejméně 6 měsíců. Hodnotíme-li absorpční rychlost resveratrolu, tak ve srovnání s čistým léčivem byla sedminásobná a AUC (plocha pod plazmatickou křivkou) desetinásobná. Bylo prokázáno také signifikantní zvýšení biodostupnosti resveratrolu.
Enkapsulace resveratrolu byla hodnocena i do další formy polymerních nanočástic, a to PEG-PLA39), jak za podmínek in vitro, tak in vivo. Výsledkem bylo nahromadění nanočástic do mozkového nádoru, signifikantně snížený objem nádoru, což vedlo k prolongovanému přežívání potkanů s C6 gliomy. Použilo-li se methoxy-PEG-PCL nanočástic napuštěných resveratrolem, potvrdila se zvýšená antioxidační aktivita resveratrolu, vyšší radikálové zhášení a snížená lipoperoxidace ve srovnání s volným resveratrolem ve vodném roztoku40).
Hodnotíme-li dosavadní výzkumy s polymery PLGA, PEG, PCL a PLA, můžeme říci, že jsou biokompatibilní, biodegradovatelné a netoxické. Podle směrnic FDA mohou být použity, ovšem jejich zpracování do nanočástic je dosud velice drahé a inkorporace resveratrolu do polymerních nanočástí je poměrně nízká.
Ve výzkumu na úseku polymerních nanočástic se v tomto desetiletí přešlo na hodnocení polymerních micel, které jsou syntetizované z kopolymerů s hydrofilní a hydrofobní monomerní jednotkou41). I když se dosáhlo poměrně vysoké enkapsulace resverarolu (89%) a získaly se dobré výsledky v in vitro studiích, hlavním limitujícím faktorem pro využití polymerních micel byly obtížnosti vyplývající z jejich náročné syntézy a nemožnosti rozsáhlejšího užití polymerních micel v důsledku jejich limitované stability v krvi42).
Pevné lipidní nanočástice (solid lipid nanoparticles – SLN)
Další studovanou lékovou formou s resveratrolem jsou pevné lipidní nanočástice kombinované s lipidní emulzí. Lipidní jádro, obklopené surfaktantem, umožňuje snadné vkládání resveratrolu jako hydrofobního léčiva do jádra s hydrofobním povrchem. Resveratrol je tak chráněn před hydrolytickým štěpením, před oxidací a fotodegradací, čímž se také zvyšuje jeho biodostupnost43).
Příjem SLN lékových forem do buněk je možné měnit na základě růzností jejich povrchových vlastností, dovolující zacílení buňky (targeting). Příjem a transport resveratrolu do keratinocytů za podmínek in vitro prokázal větší cytostatické efekty enkapsulovaného léčiva44) i pozitivní lipoperoxidační aktivitu v porovnání s resveratrolem v roztoku. Cytotoxický efekt resveratrolu v částicích SLN s glycerolem byl prokázán také v mozkové tkáni na potkanech ve studii in vivo, kdy se hodnotila jeho biodistribuce. Částice SLN signifikantně navyšovaly koncentraci resveratrolu do mozkové tkáně v porovnání s volným resveratrolem v roztoku45).
Ukazuje se, že pevné lipidní nanočástice by mohly být vhodnou lékovou formou pro orální aplikaci v důsledku jejich schopností chránit resveratrol a řídit jeho uvolňování. Mohly by tedy být slibným léčivo-dodávajícím systémem. Bude však nutné vyhodnotit další série studií s resveratrolem nejen za podmínek in vitro, ale především in vivo.
Cyklodextriny
Cyklodextriny (CD), cyklické oligosacharidy o průměru 1 a 2 nm, mají hydrofilní povrch a hydrofobní vnitřní dutinu, která umožňuje přijmout molekuly xenobiotik46). CD mohou být za účelem zvýšení svých vlastností snadno modifikovány. Jak bylo prokázáno47), mají pro farmaceutický delivery systém hlavní význam cukry. V důsledku jejich schopnosti vytvářet s léčivy komplexy, vykazují následující přednosti: zvyšují rozpustnost léčiv ve vodě, zvyšují disoluční rychlost a biodostupnost, ochraňují léčiva před krystalizací a zlepšují jejich stabilitu. Tato léková forma je vhodná pro terapeutické použití, jenže jejich výroba je limitována vysokou cenou.
Ke zkoumání protirakovinné účinnosti resveratrolu vůči MCF-7 buňkám bylo v in vitro studii28) použito resveratol-sulfobutylether-β-CD komplexu v poměru 1 : 1. Potvrdilo se, že tvorba tohoto komplexu, tedy kompletace všech složek, značně zvýšila rozpustnost ve vodě a pozitivně ovlivnila cytotoxickou aktivitu léčiva a že CD molekula bez resveratrolu neměla žádný vliv na buněčnou viabilitu.
V další in vitro studii46) byly vytvořeny resveratrolové komplexy jak s β-CD, tak s 2-hydropropyl-β-CD za účelem vyhodnocení jeho dopadu na cytotoxicitu léčiva u dvou buněčných populací (HeLa a Hep3B) v porovnání se zdravou buněčnou populací. Bylo zjištěno, že v kancerogenních buňkách došlo ke zvýšení jejich cytotoxicity, aniž by byly pozorovány nějaké změny u zdravých buněk.
Lze říci, že CD komplexy značně zvyšují rozpustnost resveratrolu ve vodě, avšak jejich použití v nádorové terapii je limitováno v důsledku jejich nedostatečně zacílené distribuce (targeting) a v důsledku vysokých výrobních nákladů.
Závěr
Snahou výzkumných projektů v systému cíleného podávání léků je zvýšit jejich bezpečnost a minimalizovat výskyt rizikových nežádoucích efektů. Není snadné vždy dosáhnout tohoto cíle ve všech parametrech. Jako příklad uvádíme výsledky dosavadního výzkumu s resveratrolem, který patří mezi látky se zajímavou farmakologickou aktivitou a je vyhledáván pro doplňkovou terapii.
Pro jeho nepříznivé farmakokinetické parametry (velmi nízká biodostupnost přes dostatečně vysokou orální absorpci) se výzkumní pracovníci zaměřili na možnost cíleně distribuovat tuto látku na místo účinku v nových lékových formách. Slibnou oblastí se jevily různé formy „delivery“ systému, v nichž je důležitá nanoenkapsulace resveratrolu. Takové nanoformulace jsou schopny zacílit léčivo ke specifickým buňkám, snížit jeho požadovanou dávku a následně tak i toxicitu léčiva.
Mohlo by se zdát, že při inkorporaci resveratrolu do nanoformulací byly úspěšně překonány některé bariéry vzhledem k jeho fyzikálně-chemickým vlastnostem, přesto se enkapsulace resveratrolu dosud nachází v plenkách. Z toho důvodu zůstává mnoho otázek, jež bude nutné v dalších studiích experimentálně objasnit a zhodnotit, jako je např. dlouhodobá bezpečnost nanočástic, jejich interakce s biologickými systémy, tvorba reprodukovatelných a koloidně stabilních nanoformulací, ověření parametrů vedoucích ke zlepšení „loading“ kapacity resveratrolu s cílem získat co největší terapeutický efekt látky. Zajímavými by mohla být i zjištění synergického vlivu resveratrolu s dalšími látkami, jako je kurkumin a 5-fluorouracil.
Slibné protirakovinné a protizánětlivé vlastnosti resveratrolu byly v nanočásticích prokázány již in vitro modelech a ve studiích s buněčnými liniemi. Ovšem k využití terapeutické účinnosti resveratrolu k léčbě např. nádorového onemocnění bude nutné po zvážení všech preklinických hodnot přejít z in vitro a in vivo studií ke klinickému testování látky v nových lékových formách. A tak se vyskytují také úvahy, jak dalece je nezbytné pokračovat dále v těchto zajímavých, ale nesmírně drahých výzkumných projektech.
Střet zájmů: žádný.
Došlo: 14. dubna 2017
Přijato: 11. května 2017
H. Farghali
prof. RNDr. Ludmila Kameníková, DrSc.
Farmakologický ústav 1. LF UK a VFN
Albertov 4,
128 00 Praha 2
e-mail: ludmila.kamenikova@lf1.cuni.cz
Zdroje
1. Král V. Život je geniální projekt. Za obzorem Vyd. Advent Orion s.r.o., 2013; 1, 1–4.
2. Pamornpathomkul B., Wongkajorsilp A., Laiwattanapaisal W., Rojanarata T., Opanasopit P., Ngawhirunpat T. A combined approach of hollow microneadles and nanocarriers for skin immunization with plastid DNA encoding ovalbumin. Int. J. Nanomedicine 2017; 12, 885–898.
3. Gusta S., Wilder H., Rao A. L. N., Vyllev V. I., Anvari B. Plant virus-resembling optical nano-materials conjugated with Anti-EGFR for targeted cancer imaging. Reporters, dyes, nanoparticles, and molecular probes for biomedical applications IV. 2012; Proceedings of SPIE vol. 8233, No. 82330S.
4. Hwang S. R., Ku S. H., Joo M. K., Kim S. H., Kwon I. C. Theranostic nanomaterials for image-guided gene therapy. MRS Bulletin 2014; 39, 44–50.
5. Neves A. R., Lúcio M., Martins S., Lima J. L., Reis S. Novel resveratrol nanodelivery systems based on lipid nanoparticles to enhance its oral bioavailability. Int. J. Nanomedicine 2013; 8, 177–187.
6. Summerlin N., Soo E.,Thakur S., Qu Zhi. Resveratrol nanoformulations: Challenges and opportunities. Inter. J. Pharmac. 2015; 479, 282–290.
7. Aluyen J. K., Ton Q. N., Tran T., Yang A. E., Gottlieb H. B., Belanger R. A. Resveratrol potential as anticancer agents. J. Diet Supl. 2012; 9, 45–56.
8. Kraft T. E., Parisotto D., Schempp C., Efferth T. Fighting cancer with red wine? Molecular mechanisms of resveratrol. Crit. Rev. Food Sci. Nutr. 2009; 49, 782–799.
9. Yang X., Li X., Ren J. From french paradox to cancer treatment: anti-cancer activities and mechanisms of resveratrol. Anti-Cancer Agents Med. Chem. 2014; 14, 806–825.
10. Farghali H., Kutinová Canová N., Lekic N. Resveratrol and related compounds as antioxidants with an allosteric mechanism of action in epigenetic drug targets. Physiol. Res. 2013; 2, 1–13.
11. Vang O., Ahmad N., Baile C. A., Baur J. A., Brown K., Csiszar A., Das D. K., Delmas D., Gottfried C., Lin H. Y. What is new for an old molecule? Systematic Review and Recommendations on the use of resveratrol. Plos One 2011; 6, No. E9881, doi:10.1371.
12. Augustin M. A., Sanguansri L., Lokett T. Nano - and micro-encapsulated systems for enhancing the delivery of resveratrol. Ann. N.Y. Acad. Sci. 2013; 1290, 107–112.
13. Walle T. Biovailability of resveratrol. Ann. N.Y. Acad. Sci. 2011; 1215, 9–15.
14. Rotches-Ribalta M., Andres-Lacueva C., Estruch R., Escribano E., Urpi-Sarda M. Pharmacokinetic of resveratrol metabolic profile in healty humans after moderate consumption of red wine and grape extrakt tablets. Pharmacol. Res. Off. J. Ital. Pharmacol. Soc. 2012; 66, 375–382.
15. Brown V. A., Patel K. R., Viskaduraki M., Crowell J. A., Perloff M., Booth T. D., Vasilinin G., Sen A., Schinas A., Piccirilli G., Brown K., Steward W. P., Gescher A. J., Brenner D. E. Repeat dose study of the cancer chemopreventive agent resveratrol in healthy volunteers: safety, pharmacokinetics, and effect on the insulin-like growth factor axis.Cancer Research 2010; 70, 9003–9011.
16. Almeida L., Vaz-da-Silva M., Falcao A., Soares E., Costa R., Loureiro A. J., Fernandes-Lopes C., Rocha J. P., Nunes T., Wright L., Soares-da-Silva P. Pharmacokinetic and safety profile of trans-resveratrol in a Rosiny multiply-dose study in healthy volunteers. Mol. Nutr. Food Res. 2009; 53, S7–15.
17. Boocock D. J., Faust G. E. S., Patel K. R., Schinas A. M., Brown V. A., Duchařme M. P., Booth T. D., Crowell J. A., Perloff M., Gescher A. J., Steward W. P., Brenner D. E. Phase I dose escalation pharmacokinetic study in healthy volunteer of resveratrol, a potential cancer chemopreventive agent. Cancer Epidemiol. Biomarkers and Prevention 2007; 16, 1246–1252.
18. Rotches-Ribalta M., Andres-Lacueva C., Estruch R., Escribano E., Urpi-Sarda M. Pharmacokinetic of resveratrol metabolic profile in healty humans after moderate consumption of red wine and grape extrakt tablets. Pharmacol. Res. Off. J. Ital. Pharmacol. Soc. 2012; 66, 375–382.
19. Karthikeyan S., Rajendra Prasat N., Ganamani A., Balamurugan E. Anticancer aktivity of resveratrol-loaded gelatin nanoparticles on NCI-H460 non-small cell lung cancer cells. Biomed. Prev. Nutr. 2013; 3, 64–73.
20. Miki H., Uehara N., Kimura A., Sasaki T., Yuri T., Yoshizawa K., Tsubura A. Resveratrol induces apoptosis via ROS-triggered autophagy in human colon cancer cells. Int. J. Oncol. 2012; 40, 1020–1028.
21. Sun W., Wang W., Kim J., Keng P., Yang S., Zhang H., Liu C., Okunieff P., Zhang L. Anti-cancer effect of resveratrol is associated with induction of apoptosis via a mitochondrial pathway alignment. Adv. Exp. Med. Biol. 2008; 614, 179–186.
22. Sengottuvelan M., Deeptha K., Nalini N. Resveratrol ameliorates DNA damage, prooxidant and antioxidant imbalance in 1,2-dimethylhydrazine induced rat colon carcinogenesis. Chem. Biol. Interact. 2009; 181, 193–201.
23. Murias M., Jager W., Handler N., Erker T., Horvath Z., Szekeres T., Nohl H., Gille L. Antioxidant, prooxidant and cytotoxic aktivity of hydroxylated resveratrol analogues: structure-activity relationship. Biochem. Pharmacol. 2005; 69, 903–912.
24. Richard T., Pawlus A. D., Iglesias M. I., Pedrot E., Waffo-Teguo P., Merillon J. M., Monti J. P. Neuroprotective properties of resveratrol and derivatives. Ann. N. Y. Acad. Sci. 2011; 1215, 103–108.
25. Yaseen A., Chen S., Hock S., Rosato R., Dent P., Dai Y., Grant S. Resveratrol sensitizes acute myelogenous leukemia cells to histone deacetylase inhibitors through reactive oxygen species-mediated activation of the extrinsic apoptotic pathway. Mol. Phamacol. 2012; 82, 1030–1041.
26. Sinico C., Pirredu R., Pini E., Valenti D., Caddeo C., Fadda A. M., Lai F. Enhancing topíval delivery of ŕesveratrol through nanosizing approach. Planta Medica 2017; 83, 476–481.
27. da Rocha Lindner G., Khalil N. M., Mainardes R. M. Resveratrol-loaded polymeric nanoparticles: validation of an HPLC-PDA method to determine the drug entrapment and evaluation of its antioxidant aktivity. Sci. World J. 2013; 2013, S06083.
28. Venuti V., Cannava C., Cristiano M. C., Fresta M., Majolino D., Paolino D., Stancanelli R., Tommasini S., Ventura C. A. A characterization study od resveratrol/sulfobutyl ether-beta-cyklodextrin inclusion complex and in vitro anticancer activity. Colloids Surf. B Biointerfaces 2014; 115, 22–28.
29. Maeda H., Bharate G. Y., Daruwalla J. Polymeric drugs for efficient tumor - targeted drug delivery based on EPR-effect. Eur. J. Pharm. Biopharm. 2009; 71, 409–419.
30. Allen T. M., Cullis P. R. Liposomal drug delivery systems: from concept to clinical applications. Adv. Drug Deliv. Rev. 2013; 65, 36–48.
31. Coimbra M., Isacchi B., van Bloois L., Torano J. S., Ket A., Wu X., Broere F., Metselaar J. M., Rijcken C. J., Storm G., Bilia R., Schiffelers R. M. Improving solubility and chemical stability of natural compounds for medicinal use by incorporation into liposomes. Int. J. Pharm. 2011; 416, 433–442.
32. Csiszar A., Csiszar A., Pinto J. T., Gautam T., Kleusch C., Hoffmann B., Tucsek Z., Toth P., Sonntag W. E., Ungvari Z. Resveratrol encapsulated in novel fusogenic liposomes activates Nrf2 and attenuates oxidative stress in cerebromicrovascular endothelial cells from aged rats. J. Gerontol. Series A. Biol. Sci. Med. Sci. 2014; 70, 303–313.
33. Catania A., Barrajon-Catalan E., Nicolosi S., Cicirata F., Micol V. Immunoliposome encapsulation increases cytotoxic aktivity and selectivity of curcumin and resveratrol against HER2 overexpressing human breast cancer cells. Breast Cancer Res. Treat. 2013; 141, 55–65.
34. Barrajon-Catalan E., Menendez-Gutierrez M. P., Falco A., Carrato A., Saceda M., Micol V. Selective death of human breast cancer cells by lytic immunoliposomes: correlation with their HER2 expression level. Cancer Lett. 2010; 290, 192–203.
35. Wang X. X., Li Y. B., Yao H. J., Ju R. J., Zhang Y., Li R. J., Yu Y., Zhang L., Lu W. I. The use of mitochondrial targeting resveratrol liposomes modified with a dequalinium polyethylene glycol-distearoylphosphatidyl ethanolamine conjugate to induce apoptosis in resistant lung cancer cells. Biomaterials 2011; 32, 5673–5687.
36. Mohan A., Narayanan S., Sethuraman S., Krishnan U. M. Novel resveratrol and 5-fluorouracil coencapsulated in PEGylated nanoliposomes improve chemotherapeutic efficacy of combination against head and neck squamous cell carcinoma. BioMed. Res. Int. 2014; Artical Numer 424239.
37. Singh G., Pai R. S. Optimized PLGA nanoparticle platform for orally dosed trans-resveratrol with enhanced bioavailability potential. Exp. Opin. Drug Deliv. 2014; 11, 647–659.
38. Sanna V., Siddiqui I. A., Sechi M., Mukhtar H. Resveratrol-loaded nanoparticles based on poly(epsilon-caprolactone) blend for prostate cancer treatment. Mol. Pharm. 2013; 10, 3871–3881.
39. Guo W., Li A., Jia Z., Juan Y., Dai H., Li H. Transferrin modified PEG-PLA-resveratrol conjugates: in vitro and in vivo studies for glioma. Eur. J. Pharmacol. 2013; 718, 41–47.
40. Yin H., Si J., Xu H., Dong J., Zheng D., Lu X., Li X. Resveratrol-loaded nanoparticles reduce oxidative stress induced by radiation or anuloid-beta in transgenic Caenorhabditis elegans. J. Biomed. Nanotechnol. 2014; 10, 1536–1544.
41. Xu W., Ling P., Zhang T. Polymeric micelles, a promising drug delivery system to enhance bioavailability of poorly water-soluble drugs. J. Drug Deliv. 2013; 20, 340315.
42. Kim S., Shi Y., Kim J. Y., Park K., Cheng J. X. Overcoming the barriers in micellar drug delivery: loading efficiency, in vivo stability, and micelle cell interaction. Exp. Opin. Drug Deliv. 2010; 7, 49–62.
43. Ekambaram P., Sathali A., Priyanka K. Solid lipid nanoparticles: a review. Sci. Rev. Chem. Commun. 2012; 2, 80–102.
44. Teskac K., Kristl J. The evidence for solid lipid nanoparticles mediated cell uptake of resveratrol. Int. J. Pharm. 2010; 390, 61–69.
45. Jose S., Anju S. S., Cinu T. A., Aleykutty N. A., Thomas S., Souto E. B. In vivo pharmacokinetics and biodistribution of resveratrol-loaded solid lipid nanoparticles for brain delivery. Int. J. Pharm. 2014; 474, 6–13.
46. Lu Z., Chen R., Fu R., Xiong J., Hu Y. Cytotoxicity and inhibition of lipid peroxidation activity of resveratrol/cyclodextrin inclusion complexes. J. Incl. Phenom. Macrocycl. Chem. 2012; 73, 313–320.
47. Tiwari G., Tiwari R., Rai A. Cyclodextrins in delivery systems: applications. J. Pharm. Bioallied Sci. 2010; 2, 72–79.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2017 Číslo 2- Přerušovaný půst může mít významná zdravotní rizika
- MUDr. Václav Šmíd, Ph.D.: Jaterní fibróza a iniciální stadia cirhózy jsou potenciálně vratné stavy
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
-
Všechny články tohoto čísla
- Mobilní aplikace jako vhodné intervenční nástroje pro nemocné trpící depresí
- Separácia enantiomérov fenylalanínu a metionínu metódou HPLC: porovnanie typov stacionárnych fáz
- Určenie zhody v názoroch lekárov a lekárnikov na ich interprofesionálnu spoluprácu na Slovensku
- Cílené podávání léků: potenciální aplikace s resveratrolem
- Obraz dobrého lekárnika v diele Saladina z Ascola a Valeria Corda
- Alois Borovanský – 95-ročný
- Vzpomínka na doc. RNDr. PhMr. Věru Spurnou, DrSc.
- Nové knihy
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Cílené podávání léků: potenciální aplikace s resveratrolem
- Mobilní aplikace jako vhodné intervenční nástroje pro nemocné trpící depresí
- Separácia enantiomérov fenylalanínu a metionínu metódou HPLC: porovnanie typov stacionárnych fáz
- Obraz dobrého lekárnika v diele Saladina z Ascola a Valeria Corda
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



