-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Doporučení České revmatologické společnosti pro léčbu dny
Recommendations of the Czech Society for Rheumatology for the treatment of gout
Epidemiological studies show a steady increase in the incidence of hyperuricemia and gout in the population. Gout therapy can be divided into the treatment of an acute gout attack and the issue of lowering uric acid levels. Any acute gout attack should be treated pharmacologically and treatment initiated immediately. As an alternative, colchicine, non-steroidal anti-inflammatory drugs and corticosteroids may be used. Combinations such as colchicine plus non-steroidal anti-inflammatory drugs or intra-articular corticosteroids with NSAIDs or colchicine can also be used in severe polyarticular, refractory attacks. In patients with severe refractory and frequent attacks, the interleukin-1 inhibitor canakinumab may be used. Patients indicated for hypouricemic treatment are those with a high frequency of attacks, tofi, and joint destruction. The treatment of hyperuricemia should be comprehensive and consist of non-pharmacological and pharmacological therapy. Medicaments that are available include uric-acid lowering drugs (allopurinol, febuxostat) and uricosuric agents (benzbromarone). Allopurinol is the drug of first choice, whereas febuxostat is recommended in the second line in patients who do not have shown sufficient response to or who are into - lerant of allopurinol. Febuxostat is suitable in patients with moderate renal insufficiency where a renal sparing effect has been demonstrated. Lesinurad, an inhibitor of the kidney URAT-1 transporter, is used in combination with allopurinol or febuxostat.
Keywords:
therapy – gout – febuxostat – lesinurad
Autoři: K. Pavelka
Působiště autorů: Revmatologický ústav Praha
Vyšlo v časopise: Čes. Revmatol., 27, 2019, No. 4, p. 166-176.
Kategorie: Doporučené postupy
Souhrn
Epidemiologické studie ukazují stálý nárůst výskytu hyperurikemie a dny v populaci. Terapie dny může být rozdělena na léčbu akutního dnavého záchvatu a dále na problematiku snížení hladiny kyseliny močové. Každý akutní dnavý záchvat by měl být léčen farmakologicky a léčba by měla být zahájena okamžitě. Jako alternativa se dá použít kolchicin, nesteroidní antirevmatika a glukokortikoidy. U těžkých polyartikulárních, refrakterních záchvatů lze užít i kombinace například kolchicin plus nesteroidní antirevmatika nebo intraartikulární glukokortikoidy s NSA nebo kolchicinem. U pacientů s těžkými refrakterními a častými záchvaty lze aplikovat inhibitor interleukinu 1 canakinumab. Indikovaní pacienti k hypourikemické léčbě jsou pacienti s častou frekvencí záchvatů, tofy a destrukcemi kloubů. Léčba hyperurikemie by měla být komplexní a skládat se z nefarmakologické a farmakologické části. Z medikamentů jsou k dispozici jednak urikostatika (allopurinol, febuxostat) a urikosurika (benzbromaron). Lékem první volby je allopurinol, febuxostat je doporučován až ve druhé volbě u pacientů, kteří nemají dostatečný efekt nebo nesnášejí allopurinol. Febuxostat je vhodný u pacientů se středním stupněm renální insuficience, kde byl prokázán šetřící efekt na ledviny. Nově je zaváděn do praxe lesinurad, což je inhibitor transportéru URAT-1 v ledvinách, který se používá v kombinaci s allopurinolem nebo febuxostatem.
Klíčová slova:
DNA – terapie – febuxostat – lesinurad
ÚVOD
Dna je zánětlivé revmatické onemocnění, které je vyvoláno usazováním krystalů natrium urátu v pojivových tkáních a následnou zánětlivou reakcí. Krystaly natrium urátu vznikají u nemocných se zvýšenou hladinou kyseliny močové v séru. Dna je bolestivé a potenciálně invalidizující onemocnění se zvýšenou kardiovaskulární mortalitou (1). V klinické praxi činí diagnóza dny stále problémy a zůstává nerozpoznána, což má za následek suboptimální léčbu. Je to obzvláště škoda, protože poslední desetiletí přineslo řadu nových léků a strategií léčby (2). Prevalence dny v různých zemích kolísá a pohybuje se od 0,9–2,5 % (3). V posledních letech se v prevalence dny v některých zemích zvyšuje (4).
DIAGNOSTIKA DNY
Optimálním způsobem diagnostiky dny je průkaz krystalů natrium urátu v kloubním výpotku, nebo v materiálu z tofu. Nejčastěji používanou technikou je použití polarizačního mikroskopu, ve kterém krystaly vykazují silnou negativní dvojlomnost. Při větším množství krystalů, např. v tofu, lze použít murexidovou zkoušku.
Pokud není dostupný materiál na krystalografickou analýzu, doporučuje se použít klasifikační kritéria ACR (5). V praxi jsou stále pro svoji jednoduchost používaná, a to i při diagnostice. Jejich senzitivita je 87,6 % specificita 97,2 % (obr. 1).Použít lze i Doporučení pro diagnostiku dny, které na základě evidence publikoval EULAR (6).
Obr. 1. Klasifikační kritéria dnavé artritidy (Wallace et al., 1977) 
Je nutné upozornit na fakt, že navrhovaná kritéria většinou vyhovují pro typické případy dny. Udává se ale, že třetina až polovina záchvatů probíhá atypicky. Např. při začátku dny po 65. roce života se již neobjevují akutní záchvaty v typické lokalizaci na I. MTP, ale spíše polyartikulární formy dny. V anamnéze těchto pacientů nacházíme také často používání diuretik či renální insuficience a méně alkoholismu a jiných asociovaných onemocnění s dnou.
DOPORUČENÁ VYŠETŘENÍ PŘED ZAHÁJENÍM LÉČBY DNY
Pokud je dostupný výpotek kloubní, pak jeho analýza je základním vyšetřením. Krystalografická analýza byla zmíněna výše. Dále provádíme cytologické vyšetření, které stanovuje počet leukocytů, který bývá vysoký a to v rozmezí 10–60 tis. buněk na µmol/l. Rozpočet leukocytů také ukazuje výraznou převahu polymorfonukleárů. V rámci diferenciální diagnózy také posíláme výpotek na kultivační vyšetření (jde také o jedno kritérium v ACR Doporučeních) (5).
Zásadním biochemickým vyšetřením je stanovení hladiny kyseliny močové v séru. Horní limit normálních hladin kyseliny močové jsou arbitrárně stanoven na 420 µmol/l u mužů a 360 µmol/l u žen. Mohou se však mírně lišit v různých laboratořích podle používané metodiky. Protože hladiny kyseliny močové kolísají, je vhodné tato vyšetření v odstupu 2 týdnů zopakovat a používat průměr.
U každého nemocného s podezřením na dnu je nutné vyšetřit přítomnost tzv. asociovaných onemocnění s dnou, tzn. obezity, hypertenze, dyslipidemie a diabetu. Dále pak vyšetřit možnou přítomnost postižení ledvin. Tomu odpovídá i spektrum doporučovaných vyšetření: krevní obraz, reaktanty akutní fáze, lipidové parametry, jaterní testy, kreatinin, glykemie. Provádíme vyšetření moči chemicky. Vhodné je také určit vylučování kyseliny močové v moči za 24 hodin a eventuálně i poměr k vylučování kreatininu.
U každého nemocného s dnou by také měl být proveden rentgenový snímek rukou a nohou k vyloučení přítomnosti tofů a destruktivní tofózní artritidy. Rentgenový snímek při akutní dně bývá přínosný v malém počtu případů, ale je nutný z hlediska dalšího sledování vývoje nemoci. Z novějších zobrazovacích metodik se doporučuje také použití ultrazvuku, na kterém je někdy nacházen typický obraz tzv. dvojité kontury. Při anamnéze rodinného výskytu dny, nebo u dny velmi mladých nemocných je doporučováno genetické vyšetření k vyloučení jednak enzymatického defektu novotvorby urátů, nebo v oblasti polymorfismu genů kódujících membránové-urátové transportéry v ledvinách.
U každé hyperurikemie a dny je vhodné určit, zda je primární či sekundární. Při sekundární dně se nachází jiné onemocnění, které vede k hyper-urikemii a dně. Při nálezu takového onemocnění je samozřejmě toto nutné léčit (např. malignity, psoriáza atd.). Část pacientů má také hyperurikemii po lécích, nejčastěji po diureticích. V tomto případě je prvním opatřením změna léčby.
STADIA DNY
Dna probíhá obvykle ve čtyřech stadiích. První stadium je tzv. stadium asymptomatické hyperurikemie, dále pak akutní dnavý záchvat, interkritické období a stadium chronické dny. Do stadia chronické tofózní dny však dospěje pouze 5–10 % pacientů. Frekvence dnavých záchvatů kolísá od obvyklých dvou až tří ročně až po případy velmi četných záchvatů.
LÉČBA AKUTNÍHO DNAVÉHO ZÁCHVATU
Akutní dnavý záchvat je velmi bolestivý, přičemž největší bolesti jsou hned v prvních hodinách onemocnění, a proto by měla být léčba zahájena co nejdříve. Je možné říci, že rychlost zahájení léčby je stejně nebo dokonce více důležitá než výběr preparátu. Pacienti by měli být plně informováni a edukováni, jakou medikaci užívat při objevení se prvních symptomů. Výběr preparátu by měl být proveden na základě přítomnosti kontraindikací, pacientovy předešlé zkušenosti při této léčbě, času od zahájení záchvatu a typem kloubního postižení (7). Například při přítomnosti závažné renální insuficience je vhodné se vyhnout NSA, při přítomnosti inhibitorů CYP3A4 a P-glykoprotein inhibitorů pak kolchicinu.
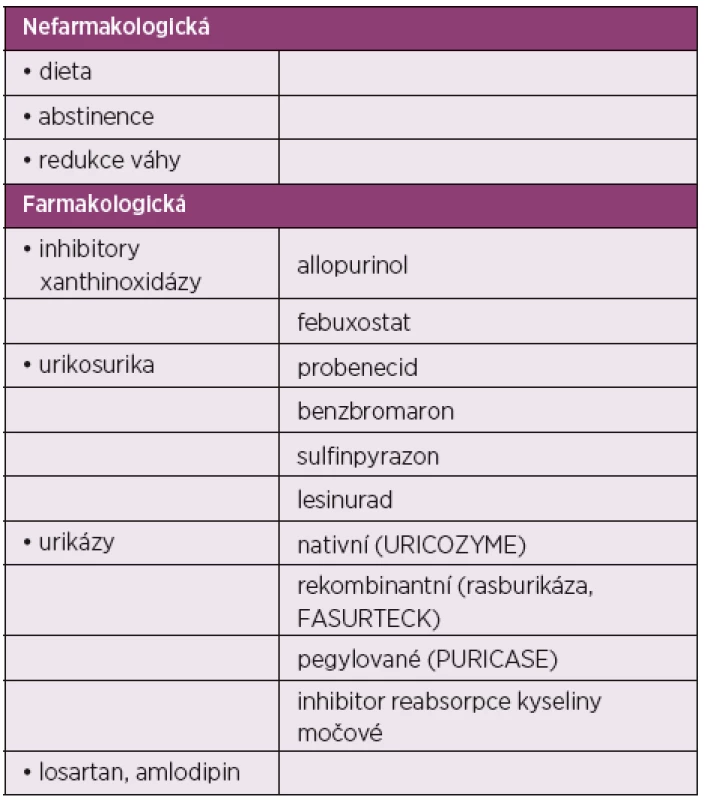
Mezi nefarmakologické formy léčby patří režimová opatření, kam řadíme určitý přechodný klidový režim a dostatečný přísun tekutin, abstinence a dietní opatření. Z fyzikální léčby se doporučuje přikládání kryoterapie.
Každý dnavý záchvat by měl však být léčen farmakologicky. Alternativními možnostmi jsou aplikace kolchicinu, nesteroidních antirevmatik (NSA) a glukokortikoidů. Komise EULAR nedává žádné z této alternativy jednoznačnou přednost, protože chybějí srovnávací studie. Volba by měla být individuální podle charakteristik pacienta a formy onemocnění. Nová EULAR Doporučení také kombinaci dvou způsobů léčby u těžkých a rezistentních pacientů (např. kolchicin plus NSA nebo glukokortikoidy) (obr. 2).
Obr. 2. Doporučení EULAR 2016 pro léčbu záchvatů u pacientů se dnou 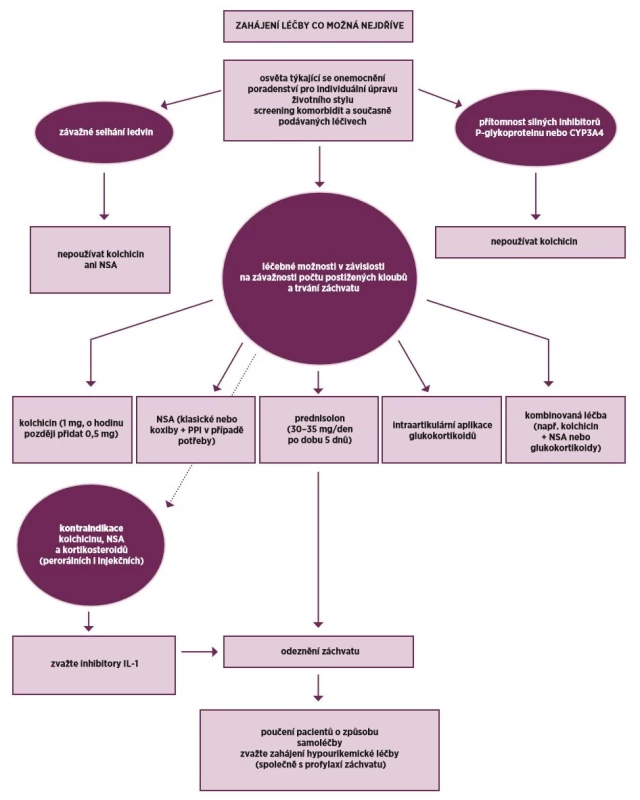
Kolchicin
Kolchicin je historickým lékem akutního dnavého záchvatu, který má ale stále u některých pacientů svůj význam. V klinických studiích byl kolchicin účinný u 2/3 pacientů, ale u velkého počtu pacientů vyvolával nežádoucí účinky, a to především průjmy a další gastrointestinální příznaky. Tyto nežádoucí účinky jsou asociovány s výškou dávky kolchicinu. Proto jsou důležité výsledky studie AGREE, která prokázala stejnou účinnost redukovaných a klasických dávek kolchicinu (8). Proto se doporučuje podat pouze 1 mg kolchicinu a následovně za hodinu 0,5 mg. Kolchicin je především lék časných stadií dnavého záchvatu a měl by být podán do 12 hodin od začátku dnavého záchvatu. Kolchicin má poměrně vysoce specifický účinek u dnavé artritidy, a proto jeho indikací může být pacient se zatím nejistou diagnózou artritického syndromu. Dalším vhodným pacientem může být pacient, který má kontraindikace k léčbě NSA. Kolchicin by neměl být podáván u pacientů se závažnou renální nedostatečností (GFR méně než 30 ml/min) a u nemocných se silnou inhibicí CYP 3A4 nebo glykoproteinu P (např. cyklosporin).
Nesteroidní antirevmatika
NSA jsou dnes nejčastěji používanou alternativou léčby dnavého záchvatu. Je možné použít jakékoliv schválené NSA, protože srovnávací studie neprokázaly žádné rozdíly mezi NSA v této indikaci. Historicky se nejvíce užíval indometacin, ale později i diklofenak. Z novějších léků byly provedeny studie i s cox-2 selektivními inhibitory celecoxibem a etorikoxibem (8). Při časném nasazení NSA v adekvátní dávce je dosaženo kompletního odeznění záchvatu u 90 % pacientů do 5–8 dne. Doporučuje se použít NSA s rychlým nástupem účinku nebo injekční NSA. Protože bolesti jsou největší první dny, je vhodné zahájit vysokými dávkami NSA a při odeznívání záchvatu dávky relativně rychle detrahovat. Doporučované iniciální dávky jsou uvedeny v tabulce 1. NSA mohou vyvolávat celou řadu nežádoucích účinků gastrointestinálních, renálních, kardiovaskulárních a dalších. Uvádí se až 90 % pacientů s dnou má alespoň jednu menší či větší kontraindikaci pro podání NSA (7). Proto je nutné u každého pacienta individuálně posoudit poměr benefit/riziko. U pacientů s vyšším GIT rizikem je vhodné podat inhibitor protonové pumpy nebo koxib (9). U pacientů se závažnější ICHS je kontraindikován diklofenak, ale riziko představují i další selektivní i neselektivní NSA, a proto je někdy se aplikaci NSA zcela vyhnout a podat kolchicin nebo glukokortikoidy.
Tab. 1. NSA v léčbě akutní dnavé artritidy 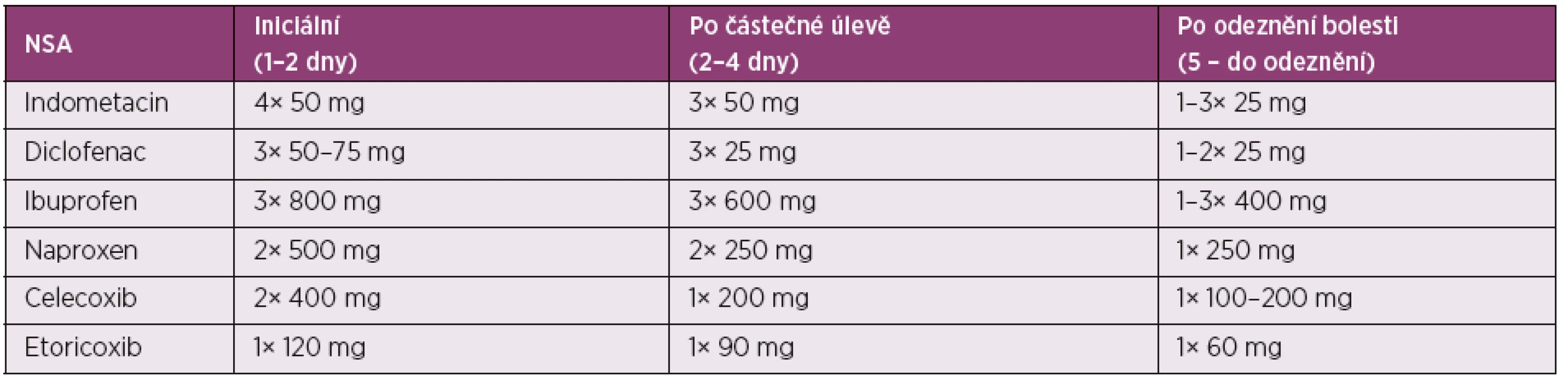
Glukokortikoidy
Glukokortikoidy (GK) se u akutní dny podávají perorálně, nebo parenterálně formou ACTH. Parenterální aplikace nemá oproti perorální žádné výhody a používá se velmi málo. Dvě novější studie prokázaly stejnou účinnost pětidenní léčby akutního záchvatu 35 mg prednisolonu p.o., jako plné dávky NSA (naproxen, indometacin) (10, 11). Glukokortikoidy jsou vhodné u pacientů s kontraindikací podávání NSA, dále u polyartikulárních forem, kde je nemožné podávat GK lokálně. Dále pak také je možné kombinovat GK s NSA či kolchicinem u těžkých, refrakterních záchvatů. Lokálně se GK podávají nejvíce u monoartritidy kolenního kloubu. GK je možné podat i do I. MTP či jiného malého kloubu, ale tato aplikace je dosti bolestivá. Vždy je nutné vyloučit septickou artritidu.
Canakinumab
Canakinumab je plně humánní, monoklonální protilátka blokující interleukin 1. Indikací canakinumabu jsou velmi závažní pacienti s dnou zcela refrakterní na léčbu první linie, a to včetně kombinací anebo u pacientů s kontraindikací první linie. Aplikuje se v dávce 150 mg s.c. v průběhu prvních 5 dnů po začátku záchvatu. Je účinnější než triamcinolon hexacetonid a při zahajování antiuratické léčby snižuje výskyt záchvatů (12, 13). V současné době je v České republice registrován, ale nemá úhradu.
Strategie léčby akutního dnavého záchvatu
U většiny dnavých záchvatů zahajujeme monoterapií jednou z výše zmíněných alternativ. Při velmi závažné atace dny je možné zahájit rovnou i kombinací léků. Za závažnou formu artritidy je možné považovat pacienta s velmi silnou bolestí (7 ≥ na 10stupňové škále), s výraznou polyartritidou nebo s postižením více než jednoho velkého kloubu (14). Je možné kombinovat kolchicin s NSA, perorální glukokortikoidy s kolchicinem nebo intraartikulární glukokortikoidy s jakoukoliv výše zmíněnou možností.
Kdy považovat léčbu akutního záchvatu za neúspěšnou?
Jako vhodné se zdá doporučení ACR, které uvádí jako neúspěch pokud nedojde alespoň k 20 % zlepšení bolesti do 24 hodin nebo 50 % redukci bolesti po 24 hodinách od zahájení léčby (14). V těchto případech se doporučuje buď změnit preparát, nebo přidat preparát. Řešením pro vysoce refrakterní pacienty může být aplikace canakinumabu. V Doporučeních ACR je zmíněna možnost aplikace blokátoru interleukinu 1 anakinry 100 mg po 3 následující dny. (Toto by vyžadovalo souhlas revizního lékaře).
FARMAKOLOGICKÁ PREVENCE DNAVÝCH ZÁCHVATŮ
Farmakologická prevence dnavých záchvatů je doporučována u všech pacientů, u kterých je zahajována léčba léky snižujícími hladinu kyseliny močové. Jako lék první volby je doporučován kolchicin v dávce 1–2krát denně 0,5 mg po dobu 3–6 měsíců. Pokud je kolchicin kontraindikován, nebo není tolerován, je vhodné použit NSA v malé dávce, eventuálně u osob se zvýšeným GIT rizikem pak za krytí inhibitorem protonové pumpy.
LÉČBA HYPERURIKEMIE
Léčba hyperurikemie by měla být diskutována a zvažována u každého pacienta s klinicky manifestní dnou již po prvním záchvatu. Neplatí tedy již dříve uváděná indikace pouze pro pacienty se zvýšeným počtem záchvatů. Jednoznačnou indikací pro zahájení hypourikemické léčby jsou pacienti s opakovanými záchvaty, dále pacienti s dnou v mladém věku (< 40 let), nebo s velmi vysokou hladinou kyseliny močové (> 480 µmol/l) a dále pacienti s postižením ledvin a komorbiditami.
Léčba hyperurikemie by měla být komplexní a skládat se jak z léčby nefarmakologické, tak farmakologické (tab. 2). Do nefarmakologické léčby řadíme především režimová opatření, redukci váhy, dietní opatření a omezení přijmu alkoholu. Mnoho pa-cientů s dnou má nadváhu a redukce váhy pomocí redukce příjmu kalorií a větším výdejem při cvičení může zvyšovat ledvinou exkreci urátů (observační studie z USA ukázala při dietní intervenci po 4 měsících pokles hladiny kyseliny močové o 18 % a frekvenci dnavých záchvatů o 67 %) (15).
Urikostatika
Allopurinol
Allopurinol je strukturální analog hypoxantinu. Jako inhibitor xanthinoxidázy interferuje s konverzí hypoxantinu na xantin a xantinu na kyselinu močovou. Snižuje hladiny kyseliny močové v séru a v moči a zvyšuje sérové hladiny hypoxantinu a xantinu. Většina allopurinolu je metabolizována na oxipurinol, který je aktivním metabolitem a který je principiálně zodpovědný za inhibici xanthinoxidázy.
Allopurinol je nejčastěji předepisovaným urikostatikem. Je tomu tak pro jeho dobrou účinnost a možnost podávat jedenkrát denně. Je dostupný v tabletách po 100 mg a 300 mg a může být podáván v jedné denní dávce. Efekt léčby allopurinolem je závislý na dávce léku. Výše nutné dávky však kolísá u jednotlivých pacientů od 100–900 mg allopurinolu denně. V praxi mnoho pacientů zůstává dlouhodobě na fixované dávce, což není správné, protože dávka by měla být adjustována podle aktuálních koncentrací kyseliny močové v séru. Obvykle se začíná s nižší dávkou 100–300 mg denně a k navýšení dávky se přistupuje později, pokud není dosaženo terapeutického cíle, kterým je 360 µmol/l a méně. Zvýšení dávky o 100 mg allopurinolu denně snižuje urikemii o 60 µmol/l. Doporučuje se redukovat hladinu kyseliny močové postupně ve smyslu, jděte nízko, jděte pomalu (gow low, go slow) (16). Redukce hladiny kyseliny močové vede k dlouhodobému poklesu frekvence dnavých záchvatů. Nicméně krátce po zahájení léčby allopurinolem, když dochází k rychlému poklesu hladiny kyseliny močové, může docházet naopak k přechodnému zvýšení frekvence záchvatů. Proto je doporučováno u všech pacientů, u kterých je prováděna léčba snižující urikemii a zvláště u jedinců s vysokou frekvencí dnavých atak aplikovat 6 měsíců profylaxi malými dávkami kolchicinu (1 až 2 tbl. denně). Dlouhodobé snížení, resp. normalizace urikemie vede ke snížení výskytu tofů. Například v kohortové studii v USA docházelo ve skupině s průměrnou urikemií 370 µmol/l k redukci tofů, zatímco ve skupině nad 490 µmol/l k žádné redukci nedocházelo. Dlouhodobé snížení urikemie může také vést ke zmenšení rizika kardiovaskulárních komplikací a mít ochranný vliv na ledviny (17, 18). Allopurinol je možné podávat i u pacientů s renální insuficiencí. Dávky je však nutné redukovat. U pacientů s renální insuficiencí je doporučeno zahajovat dávkou 50–100 mg denně nebo ob den.
Podávání allopurinolu může vyvolávat až u 5 % pacientů nežádoucí účinky, které pacienti netolerují a přerušují léčbu. Mezi nežádoucí účinky patří také gastrointestinální iritace, útlum kostní dřeně, hepatotoxicita a hypersenzitivní syndrom. Tento syndrom může probíhat mírně jako kožní vyrážka, byly však popsány těžké formy s toxickou epidermální nekrolýzou, teplotou, eozinofilií, zhoršením renálních funkcí a dokonce úmrtím (DRESS syndrom). Mechanismus těchto reakcí není jasný, u některých pacientů bylo podezíráno současné podávání diuretik. U pacientů s rizikem alergických reakcí je možné preventivně začít podávat allopurinol ve smyslu tzv. desensitizace, což znamená zahájení léčby velmi malými dávkami (25–50 mg) denně na lůžkovém oddělení.
Je nutné také myslet na lékové interakce allopurinolu. Allopurinol může interferovat s hepatálním metabolismem perorálních antikoagulancií a teofylinu. Některé léky jako azathioprin nebo merkaptopurin jsou metabolizovány xantinoxidázou. U všech těchto léků je nutné redukovat dávky allopurinolu o 20–30 %.
Allopurinol je stále lékem první volby při léčbě hyperurikemie. V případě jeho nesnášenlivosti či nedostatečné účinnosti je jeho alternativou febuxostat nebo urikosurika.
Febuxostat
Febuxostat je nový, nepurinový selektivní inhibitor xanthinoxidázy, který neinterferuje s ostatními enzymy. Febuxostat je metabolizován v játrech a je jimi i vylučován, takže u pacientů se středním stupněm renální insuficience (clearance kreatininu vyšší než 30 ml/l) není nutná adjustace dávky a stejně tak u pacientů s mírným poškozením jaterních funkcí. V klinických studiích byly zkoušeny dávky 80 mg a 120 mg denně. Schválenou dávkou EMEA a i v České republice je 80 mg denně. Protože jde o velmi účinný lék vedoucí k razantnímu snížení urikemie, doporučuje se podávat prvních 6 měsíců profylaktické dávky kolchicinu podobně jako u allopurinolu. Febuxostat byl testován v řadě studií především ve srovnání s allopurinolem. Do randomizované, kontrolované studie Beckera (19) bylo zařazeno 762 pacientů s dnavou artritidou, kteří dostávali 80 mg nebo 120 mg febuxostatu nebo 300 mg allopurinolu. Primárním cílem bylo dosažení urikemie nižší než 360 µmol/l, sekundárními cíli pak snížení počtu dnavých záchvatů a zmenšení tofů. Všichni pacienti měli prevenci záchvatů kolchicinem nebo NSA. Febuxostat byl signifikantně účinnější než allopurinol (p < 0,001), a to nejen v ukazateli proporce normálních urikemií, ale i ve snížení počtu dnavých záchvatů a regresi tofů. Ve studii Schumachera (20) bylo zařazeno 1072 pacientů, včetně pacientů s poškozenými renální mi funkcemi. Pacienti dostávali 80 mg nebo 120 mg febuxostatu denně, nebo allopurinol 100 mg nebo 300 mg denně nebo placebo. Primárního cíle bylo dosaženo ve 48 % oproti 22 % po allopurinolu a 0 % po placebu.
Tolerance febuxostatu je obvykle dobrá. Nicméně u 3–5 % se vyskytují elevace jaterních testů. Výskyt kardiovaskulárních komplikací u dnavé artritidy je zvýšený. Byla provedena dvojslepá, randomizovaná studie, která sledovala výskyt kardiovaskulárních příhod ve skupině léčené febuxostatem a allopurinolem. Jako primární ukazatel bylo zvoleno kompozitní skóre (kardiovaskulární úmrtí, nefatální infarkt myokardu, iktus, nestabilní angína s urgentní revaskularizací). V tomto skóre nebyl mezi oběma léky rozdíl (10,8 vs. 10,4 %, HR = 1,03). Nicméně kardiovaskulární mortalita byla ve skupině léčené febuxostatem zvýšena (HR = 1,34). Na základě těchto výsledků EMA nedoporučuje používat febuxostat u pacientů s kardiovaskulárním onemocněním (21).
Jaké jsou tedy indikace febuxostatu?
- Febuxostat není v současné době indikován jako lék první volby při léčbě hyperurikemie. Je indikován u pacientů, kteří nesnášejí allopurinol, nebo kteří mají kontraindikace k jeho podávání.
- Febuxostat je dále indikován u pacientů, kteří nedosáhnou terapeutického cíle ani při podávání maximálně doporučovaných dávek allopurinolu, nebo maximálních dávek, který pacient toleruje, nebo dávek, které jsou individuálně možné (např. redukce při chronické renální insuficienci).
Urikosurika
Urikosurické léky ovlivňují metabolismus aniontu kyseliny močové tím, že inhibují postsekreční, renální reabsorpci kyseliny močové, zvyšují ledvinou eliminaci kyseliny močové a tím redukují sérové koncentrace kyseliny močové. Zvýšená urikosurie může vést k depozitům urátů v ledvinných tubulech a k ledvinným kamenům a tím zhoršovat funkci ledvin. Toto riziko může být sníženo zajištěním vysoké diurézy (více než 2 litry denně) a v případě kyselé moči její alkalizací. Urikosurika lze podávat pouze u pacientů bez ledvinného postižení. V klinickém použití jsou probenecid, sulfinpyrazon a benzbromaron. Poslední urikosurikum na trhu v České republice byl benzbromaron, který byl v některých státech včetně České republiky stažen pro možnou hepatotoxicitu. V současné době není na trhu v České republice žádné urikosurikum. Je možné je eventuálně získat formou mimořádného dovozu. A jací pacienti jsou indikováni pro léčbu urikosuriky? Jsou to nemocní bez ledvinného poškození a při nesnášenlivosti urikostatik (allopurinol, febuxostat). Indikovaní mohou být i pacienti s prokázaným sníženým vylučováním urátů. U pacientů s těžkou a na léčbu refrakterní hyperurikemií, lze i urikosurikum a allopurinol kombinovat.
Novým schváleným urikosurikem s odlišným mechanismem účinku je lesinurad. Jde o blokátor urátového transportéru v ledvinách URAT-1. Podává se vždy v kombinaci s inhibitory xan-thinoxidázy v dávce 200–400 mg denně (22). Byla provedena randomizovaná, kontrolovaná studie, do které byli zařazeni pacienti s hyperurikemií, kteří užívali 300 mg allopurinolu a nedocílili žádoucího snížení urikemie (≥ 6,5 mg/l). Lesinurad byl přidáván k allopurinolu v dávkách 200–400 mg. Přidání lesinuradu k allopurinolu vedlo k dosažení cíle (≤ 6 mg/l) u 54 % pacientů oproti 27,9 % (p < 0,0001) ve skupině léčené monoterapií allopurinolem samotným (23). Úspěšná studie byla provedena i v kombinaci s febuxostatem (24).
LÉČBA CHRONICKÉ, TOFÓZNÍ DNY
V současné době se odhaduje proporce pacientů, kteří progredují ze stadia akutní, intermitentní dny do stadia chronické dny s tofy a rentgenovými známkami dny na 5–10 %. Základním pilířem v léčbě chronické dny je dlouhodobá normalizace hladiny kyseliny močové. Tato normalizace vede jednak ke snížení počtu vzplanutí dnavých záchvatů, jednak ke zmenšení počtu a velikosti tofů. Například ve studii FOCUS s febuxostatem bylo dosaženo normourikemie u 93 % pacientů po 5 letech léčby. Zatímco na začátku léčby mělo akutní vzplanutí až 47 % pacientů, v 5. roce léčby klesl tento počet na nulu. Alespoň jeden tofus mělo na začátku 26 pacientů a u 18 % došlo k jeho rezoluci na konci studie (69 %) (25).
Pacienti však mají při chronické dně chronickou synovitidu, bolestivé klouby a ztuhlost, takže obraz někdy může připomínat revmatoidní artritidu. Tito pacienti vyžadují chronickou léčbu NSA, někdy i přechodně systémově glukokortikoidy. Lokální léčba při vzplanutí je také vhodná. Při chronickém průběhu, který je doplňován akutními záchvaty je indikovaná i dlouhodobá profylaxe kolchicinem.
Nové léčebné postupy
U pacientů s chronickou, destruktivní dnou a špatnou kvalitou života, u kterých není možné docílit žádoucího snížení urikemie žádným dostupným lékem v maximální dávce, a to včetně kombinací, doporučuje EULAR použití pegylované urikázy. Jde o pegylovanou urikázu, která katalyzuje oxidaci kyseliny močové na allantoin, který je i více rozpustný. Podává se intravenózně v dávce 8 mg po 2 týdnech. V dvojslepé studii u nemocných s refrakterní dnou bylo cílové urikemie – méně než 300 µmol/l – dosaženo ve 42 % oproti 0 % v placebové skupině (26). Problémem jsou časté alergické reakce a též cena léčby. Není také jasně definováno, jak dlouho má léčba peglotikázou trvat. V současné době není peglotikáza v České republice registrována.
STRATEGIE LÉČBY HYPERURIKeMIE U DNY
Asymptomatická hyperurikemie
Hyperurikemie se vyskytuje v populaci až v 15 % populace, zatímco dna v 1 %, takže velká většina jedinců s hyperurikemii nikdy dnu nedostane a rovněž riziko nefrolitiázy je poměrně malé. Nicméně záleží na výšce urikemie, pokud je opakovaně vyšší než 540 μmol/l, jsou již rizika orgánových komplikací vyšší a je doporučeno nemocné léčit. V poslední době se objevily práce, které poukazují na možný toxický vliv kyseliny močové na endoteliální, cévní buňky. Přibývá názorů, že kyselina močová je významnou látkou působící negativně v patogenezi endoteliální dysfunkce a metabolického syndromu a hypertenze (27). Pravděpodobně je dnes vhodné snižovat urikemii medikamentózně u pacientů s vysokým kardiovaskulárním rizikem.
Hyperurikemie u manifestní dny
Jasnou indikací pro podávání léků jsou pacienti, kteří mají opakované, časté záchvaty. Dále pa-cienti, kteří mají tofózní dnu a pacienti s rentgenově průkaznou dnou a zvláště pak, u nichž rentgenové změny progredují. Určitá nejednotnost názorů je u pacientů, kteří mají velmi řídké záchvaty, a jsou dokonce pacienti, kteří mají jeden záchvat za život. U těchto pacientů je nutné individuální rozhodnutí. U dny zatím bohužel nejsou známá data, která by definovala rizikové (prediktivní) faktory frekvence záchvatů či rizika vzniku chronicity. Jediným známým rizikovým faktorem je vlastní výška urikemie.
Diskutovanou otázkou zůstává, kdy má být léčba snižující hladinu kyseliny močové zahájena v průběhu dnavého záchvatu. Dřívější Doporučení udávala jako vhodné zahájit léky snižujícími hy-perurikemii až 2 týdny po skončení záchvatu, přičemž důvodem byla obava ze zhoršení nebo prodloužení záchvatu. Dvě studie neprokázaly, že by zahájení léčby allopurinolem v průběhu akutního dnavého záchvatu prodlužovalo záchvat (28), nicméně šlo o malé studie a není nic známo o problému při užití účinnějších léků, než je allopurinol. Není tedy možné dát jednoznačné doporučení. Osobně bych spíše doporučoval zahájení až po odeznění záchvatu.
Princip léčba k cíli je doporučován také u dnavé artritidy (29). Hladina kyseliny močové by měla být monitorována a být udržována pod úrovní 360 µmol/l u všech nemocných s dnou, u pacientů s tofy pak pod 300 µmol. Strategie léčby hyperurikemie dle EULAR je na obrázku 3 (7).
Obr. 3. Strategie léčby hyperurikemie dle EULAR (dle Richette P, et al. Ann Rheum Dis 2017; 76: 29–42) 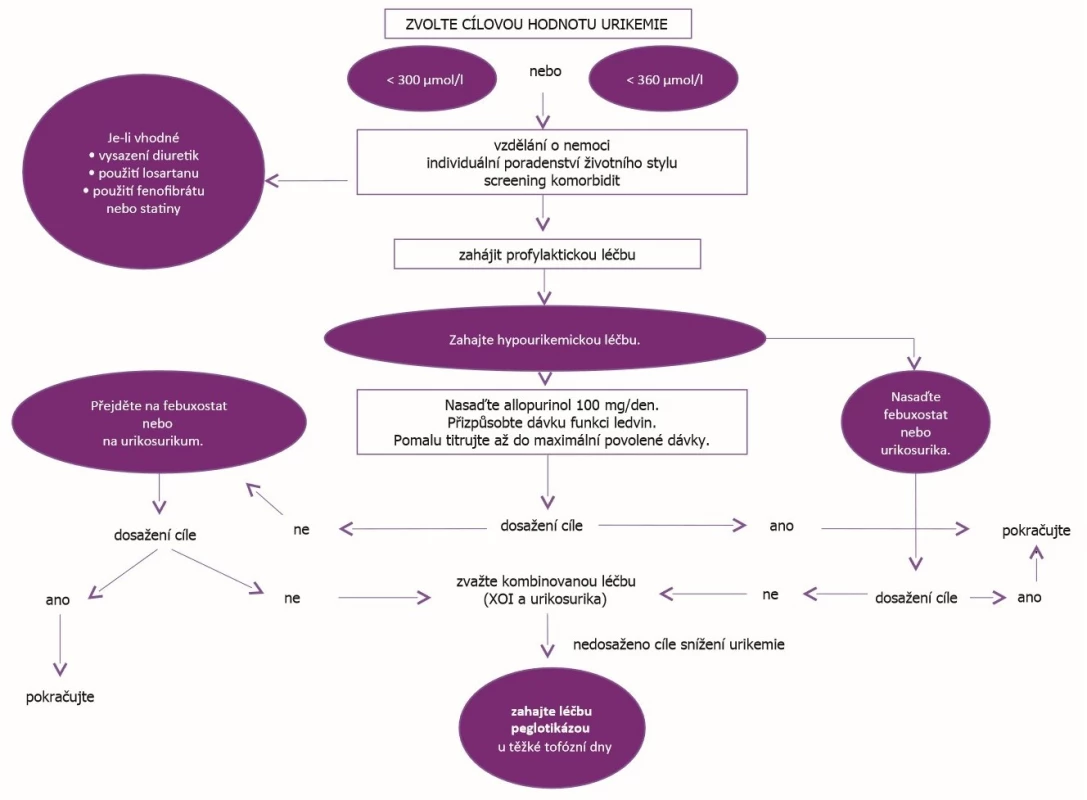
XOI – inhibitory xanthinoxidázy Protože některé studie prokázaly určitý ochranný vliv kyseliny močové na vznik Parkinsonovy nemoci nebo amyotrofické laterální sklerózy, neměly by být hladiny nižší než 180 µmol/l (30). Léčba preparáty snižujícími hladinu kyseliny močové by měla vždy být zahajována nižšími dávkami a dále titrována, dokud není dosaženo cílové hladiny.
TERAPIE ASOCIOVANÝCH ONEMOCNĚNÍ
Dna je velmi asociována s obezitou, alkoholismem, hypertenzí, hypertriglyceridemií nebo sumárně s metabolickým syndromem. Analýza studie NHANES ukázala, že 78 % dospělých pacientů s dnou mělo hypertenzi, 71 % chronické ledvinné onemocnění, 53 % bylo obézní, 26 % mělo diabetes, 24 % nefrolitiázu, 14 % mělo infarkt myokardu a 11 % srdeční selhání (31). Až polovina dnavců konzumuje denně 60 g alkoholu a více a má z toho komplikace – jako např. hepatopatii.
Zdá se, že hyperurikemie může být i nezávislým rizikovým faktorem infarktu myokardu, protože zvýšené riziko není plně vysvětleno ani výskytem klasických rizikových faktorů u dny, jako je renální dysfunkce, metabolický syndrom a další tradiční rizikové faktory ICHS. Každý pacient s dnou by měl být vyšetřen a monitorován na výskyt asociovaných onemocnění a tato by měla být adekvátně léčena – a je přitom doporučována spolupráce s příslušnými odborníky.
Když vznikne dna u nemocných léčených kličkovými nebo thiazidovými diuretiky, je lepší je nahradit. Pro léčbu hypertenze zvažte losartan nebo blokátory kalciových kanálů. Pro léčbu dyslipidemie zvažte statiny nebo fenofibrát.
ZÁVĚR
Výskyt dny a hyperurikemie se zvyšuje. Dna může být příčinnou zvýšené morbidity i mortality nemocných a může značně snižovat kvalitu života. Základem adekvátní léčby je správná diagnostika dny. V léčbě se musí uplatňovat kombinace nefarmakologických postupů, režimových opatření a farmakoterapie. Při akutním záchvatu je nutné zahájit léčbu okamžitě. Lékem první volby jsou NSA, u pacientů s diagnostickou nejistotou nebo kontraindikací NSA kolchicin. U pacientů s polyartritidou a kontraindikací NSA lze užít i systémové glukokortikoidy. U refrakterních pacientů s vysokou intenzitou zánětu a častou frekvencí lze uvažovat o aplikaci inhibitoru IL-1 canakinumabu. U forem s monoartritidou se osvědčuje i.a. aplikace dlouho působícího glukokortikoidu. Léčba snižující urikemii se zahajuje až po odeznění záchvatu. Indikováni jsou pacienti s častou frekvencí záchvatů nebo rentgenovou progresí dny a pacienti s chronickou tofózní dnou. Lékem první volby je allopurinol, při jeho nesnášenlivosti nebo nedostatečném účinku pak febuxostat. U pacientů se středním stupněm renální insuficience je doporučován febuxostat, který je účinnější než redukované dávky allopurinolu. U pacientů s nedostatečným efektem iniciální léčby je možné užít i kombinací více léků. Novým urikosurikem je inhibitor URAT-1 lesinurad. Cílovou hodnotou pro pacienty s dnou je hladina kyseliny močové < 360 μmol/l a u pa-cientů s chronickou tofózní dnou < 300 μmol/l. Jsou to také základní strategické parametry uvedené v dokumentu léčba k cíli u dny (Treat to target T2T).
Podpořeno projektem Ministerstva zdravotnictví ČR koncepčního rozvoje výzkumné organizace 023728 Revmatologický ústav.
Konflikt zájmů: žádný.
prof. MUDr. Karel Pavelka, DrSc.
Revmatologický ústav
Na Slupi 4, 128 50 Praha 2
e-mail: pavelka@revma.cz
Zdroje
1. Liu SC, Xia L, Zhang J, et al. Gout and risk of myocardial infarction: a systematic review and meta-analysis of cohort studies. Plos One 2015; 10: e0134088.
2. Edwards NL, So A. Emerging therapies for gout. Rheum Dis Clin North Am 2014; 40 : 375–387.
3. Bardin T, Bouee S, Clerson P, et al. Prevalence of gout in the adult population of France. Arthritis Caare Res (Hoboken) 2016; 68 : 261–266.
4. Kuo CF, Grainge MJ, Zhang W, et al. Global epidemiology of gout: prevalence, incidence and risk factors. Nat Rev Rheumatol 2015; 11 : 649–662.
5. Wallace SL, Robinson H, Pascual E, et al. Preliminary criteria for the classification of acute arthritis of primary gout. Artrhitis Rheum 1977; 20 : 895–900.
6. Zhang W, Doherty M, Pascual E, et al. EULAR evidence based recommendations for gout. Part I. Diagnosis. Ann Rheum Dis 2006; 65 : 1301–1311.
7. Richette P, Doherty M, Pascual E, et al. 2016 updated EULAR evidence-based recommendations for the management of gout. Ann Rheum Dis 2017; 76 : 29–42.
8. Terkeltaub RA, Furst DE, Bennet K, et al. High versus low dosing of oral colchicine for early acute gout flare: twenty-four hour outcome of the first, multicentre, randomized, double blind, placebo-controlled, parallel group, dose-comparison colchicin study. Arthritis Rheum 2019; 62 : 1060–1068.
9. Rubib BR, Burrton R, Novarra S. Efficacy and safety profile of treatment with etoricoxib 120 mg once daily compared with indomethacin 50 mg three times daily in acute gout: a randomized controlled trial. Arthritis Rheum 2004; 50 : 598–606.
10. Rainer TH, Chneg CH, Janssens HJ, et al. Oral prednisolone in the treatment of acute gout: a pragmatic, multicentre, double-blind, randomized trial. Ann Intern Med 2016; 164 : 464–471.
11. Janssens HJ, Janssen M, et al. Use of oral prednisolone or naproxen for the treatment of gout arthritis: a double-blind, randomised equivalence trial. Lancet 2008; 371 : 1854–1860.
12. Schlesinger N, Mysler E, et al. Canakinumab reduces the risk of acute gouty arthritis flares during initiation of allopurinol treatment: Results of double blind randomised study. Ann Rheum Dis 2011; 70 : 1264–1271.
13. Bardin T. Canakinumab for the patient with difficult to treat gouty arthritis: review of the clinical evidence. Joint Bone Spine 2015; 82: eS9–eS16.
14. Khanna D, Fitzgerald JD, Khanna PP, Bae S, Singh MK, Neogi T, et al. American College of Rheumatology guidelines for management of gout. Part 1: systematic non-pharmacologic and pharmacologic therapeutic approaches to hyperuricemia. Arthritis Care Res (Hoboken) 2012; 64 : 1431–1446.
15. Dessein PH, Shipton AE, Stanwix AE, et al. Beneficial effects of weight loss associated with moderate calorie/carbohydrate restriction and increased proportional intake of protein and unsaturated fat on serum and lipoprotein levels in gout a pilot study. Ann Rheum Dis 2000; 59 : 539–543.
16. Pavelka K. Diagnostika a léčba dnavé artritidy a hyperurikémie. Farmakoterapeutická revue 2018; 3 : 242–252.
17. Agarwal V, Hans N, Messerli FH, et al. Effect of allopurinol on blood pressure: a systematic review and metaanalysis. J Clin Hypertens 2013; 15 : 435–442.
18. Keikar K, Kuo A, Frishman WH. Allopurinol as a cardiovascular drug. Cardiol Rev 2011; 19 : 265–271.
19. Becker MA, Schumacher HR, Wortmann RL, et al. Effects of febuxostat versus allopurinol and placebo in reducing serum urate in subjects with hyperuricemia and gout: a 298 week, phase III randomized trial. Arthritis Care Res 2008; 59 : 1540–1544.
20. Schumacher HR Jr, Becker MA, Wortmann RL, Macdonald PA, Hunt B, Streit J, et al. Effects of febuxostat versus allopurinol and placebo in reducing serum urate in subjects with hyperuricemia and gout: a 28-week, phase III, randomized, double-blind, parallel-group trial. Arthritis Rheum 2008; 59(11): 1540–1548.
21. White WB, Saag KG, Becker MA, et al. Cardiovascular safety of febuxostat or allopurinol in patients with gout. N Engl J Med 2018; 378 : 1200–1210.
22. Bardin T, Keenan RT, Khanna PP, et al. Lesinurad in combination with allopurinol: a randomized, double blind, placebo controlled study in patients with gout with inaadequate response to standard of care the multinational CLEAR 2 study. Ann Rheum Dis 2017; 69 : 203–212.
23. Saag KG, Fitz-Patrick D, Kopicko J, et al. Lesinurad combined with allopurinol Arthritis Rheum 2017; 69 : 203–212.
24. Dalbeth N, Jones G, Terkeltaub R, et al. Lesinurad, a Selective Uric Acid Reabsorption Inhibitor, in Combination With Febuxostat in Patients With Tophaceous Gout: Findings of a Phase III Clinical Trial. Arthritis Rheumatol 2017; 69(9): 1903–1913.
25. Schumacher HR, Becker MA, Lloyd E, et al. Febuxostat in the treatment of gout. 5 year findings of the FOCUS efficacy and safety study. Rheumatology 2009; 48 : 188–194.
26. Sundy JS, Becker MA, Baraf HS, et al. Reduction of plasma urate levels following treatments with multiple doses of pegloticase in patients with treatment failure gout results of phase II randomizes study. Arthritis Rheum 2008; 58 : 2882–2891.
27. Sun M, Vazquaez AI, Reynolds RJ, et al. Untangling the complex relationship between incident gout risk, serum urate and its comorbidities. Arthritis Res Ther 2018; 20(1): 90.
28. Hill EM, Sky K, et al. Does starting allopurinol prolong acute treated gout? A randomized clinical trial. J Clin Rheumatol 2015; 21 : 120–125.
29. Kilz V, Smolen J, Bardin T, et al. Treat to target (T2T) recommendations for gout. Ann Rheum Dis 2017; 76 : 632–638.
30. Zhu Y, Pandya BJ, Choi HK. Comorbidities of gout and hyper-uricemia in the US general population. NHANES 2007–2008 Am J Med 2012; 125(7): 679–687.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek Paraneoplastické syndromy
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2019 Číslo 4- Jak včas rozpoznat vzácné onemocnění? S diagnostickou rozvahou pomůže accelRare
- INFOGRAFIKA: Vzácná diagnóza včas
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Léčba chronické blefaritidy vyžaduje dlouhodobou péči
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Doporučení České revmatologické společnosti pro léčbu dny
- Závažnost zánětlivých granulomů u revmatických chorob
- Paraneoplastické syndromy
- Muskuloskeletální postižení u pacientů s lyzozomálním střádavým onemocněním
-
Standardy péče o pacienty s revmatoidní artritidou dle doporučení EULAR
Je nutné sdílet léčebná rozhodnutí s pacientem? - Význam dosažení remise u pacientů s revmatoidní artritidou
- Zemřel prof. MUDr. Robert Bardfeld, DrSc. (10. června 1925 – 20. října 2019)
- XVII. seminář mladých revmatologů
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Paraneoplastické syndromy
- Doporučení České revmatologické společnosti pro léčbu dny
- Závažnost zánětlivých granulomů u revmatických chorob
- Význam dosažení remise u pacientů s revmatoidní artritidou
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání