-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaKolorektální karcinom (část 2)
Vyšlo v časopise: Čas. Lék. čes. 2014; 153: 162-175
Kategorie: Abstrakta
6.–7. prosince 2013, Praha
Vážené kolegyně, vážení kolegové,
následující text navazuje na abstrakta z 2. národního kongresu o kolorektálním karcinomu a 4. postgraduálního kurzu Společnosti pro gastrointestinální onkologii ČLS JEP, která byla publikována v předchozím čísle. Ve druhé části jsou shrnuta abstrakta zaměřená na diagnostiku, molekulární genetiku, dispenzarizaci a využití digestivní endoskopie a miniinvazivních metod v léčbě kolorektálního karcinomu. V části diagnostiky jsou příspěvky zaměřeny na pohled radiologa i chirurga, kdy u karcinomů rekta je preferováno EUS pro časnější stadia a magnetická rezonance (MR) pro stadia pokročilejší. PET-CT má nezastupitelnou roli v diagnostice metastazujících nádorů a napomáhá určit případnou resekabilitu jaterních metastáz. V sekci o molekulární genetice jsou sdělení zaměřena na funkční genetické a epigenetické aspekty DNA oprav, testování mikroRNA, volné nádorové DNA (cftDNA) a dále cirkulujících nádorových buněk (CTCs) u pacientů s jaterními metastázami KRK. Praktické využití molekulárně-genetických metod leží v rutinním testování molekulárních prediktorů cílené onkologické léčby KRK (KRAS a NRAS geny). Pohled endoskopisty lze shrnout do konstatování, že v diagnostice KRK je kolonoskopie stále zlatou metodou, nicméně musí být prováděna na nejvyšší úrovni kvality s využitím dostupných klasifikací (Kudo) i respektem k dosud přehlíženým patologiím (pilovité léze). Alternativními metodami mohou být virtuální kolonoskopie, případně kapslová kolonoskopie. Obě metody se zatím rutinně ve screeningu nepoužívají a jsou zatím ve fázi studií (včetně právě probíhajícího kapslového projektu v ČR). Kolonoskopie má dominantní úlohu také v terapii kolorektální neoplazie. Nejčastěji je využívána metoda endoskopické mukozální resekce (EMR), eventuálně endoskopická submukozální disekce (ESD). Obě tyto metody by měly být prováděny ve specializovaných centrech, s cílem redukovat počet komplikací. V případě selhání EMR/ESD je indikováno operační řešení. Poslední část abstrakt se týká úlohy praktického lékaře, který je nejen významným článkem ve screeningu KRK, ale také registruje jedince s vysokým rizikem tohoto onemocnění (pacienti s rodinnou či osobní anamnézou KRK), u kterých je spolupráce s gastroenterology nezbytností.
Věřím, že publikovaná abstrakta budou přínosem ve vaší klinické praxi.
prof. MUDr. Miroslav Zavoral, Ph.D.
předseda organizačního výboru kongresu
předseda Společnosti pro gastrointestinální onkologii ČLS JEP
DIAGNOSTIKA
T, N a M diagnostika karcinomu rekta
Bohatá Š.
Radiologická klinika FN, Brno
Předoperační vyšetření je pro stanovení optimální léčby karcinomu rekta klíčové a je důležitým faktorem při rozhodování o neoadjuvantní léčbě a také determinuje prognózu.
Endoanální ultrazvukové vyšetření (EUS) je používáno především pro T staging, magnetická rezonance (MR) je důležitá pro hodnocení především cirkumferentního okraje a mezorektální invaze, která je významným prognostickým faktorem a předurčuje vhodnou chirurgickou léčbu, je použitelná také pro detekci lokální rekurence. Výpočetní tomografie (CT) hrudníku, břicha a pánve je používána především k hodnocení vzdálených metastáz.
Cílem sdělení je demonstrovat výhody a naopak nedostatky jednotlivých modalit při stagingu karcinomu rekta a navrhnout optimální postup. CT vyšetření je široce dostupné a rychlé, nicméně není metodou volby při hodnocení vrstev rektální stěny, tedy při T stagingu se příliš neuplatňuje. Je schopno detekovat pokročilá stadia choroby s přesností 80–90 %, nicméně při zahrnutí nižších stadií tato hodnota klesá dle některých studií až na 53 %. Hodnocení uzlinové invaze pak je založeno zejména na měření velikosti uzlin, posouzení morfologie a sycení a přesnost CT zde dosahuje 54–70 %.
U MR, co se týče muscularis propria invaze, je udávána podobná senzitivita jako EUS, specificita EUS (86 %) je pak signifikantně vyšší než MR (69 %). Co se týče invaze do perirektální tkáně, senzitivita EUS (90 %) je signifikantně vyšší než CT (79 %) a MR (82 %), specificity jsou srovnatelné. MR však nemůže odlišit T1 a T2 stadium a zcela spolehlivě odlišit T2 a časné T3 stadium, zejména není možné odlišit samotnou infiltraci tumorem od desmoplastické reakce. N staging založený pouze na hodnocení velikosti lymfatických uzlin je neuspokojivý, s udávanou přesností jen 43–85 %. Mikrometastázy se totiž mohou objevit i v normálně velkých uzlinách, morfologická kritéria samotná mají proto nízkou výpovědní hodnotu. Pokud ale posuzujeme i intenzitu signálu a kontury, lze dosáhnout senzitivity 85 % a specificity až 97 %.
Závěrem: Nejpřesnější metodou pro hodnocení invaze do rektální stěny je zejména u nižších stadií EUS, pak MR, nicméně přesný staging radiální invaze tumoru a postižení mezorektální facie a lymfatických uzlin je pomocí moderních MR technik. Hodnocení vzdálených metastáz pak náleží CT, v případě diferenciálně diagnostických rozpaků u jaterních ložisek lze využít i MR s použitím hepatospecifických kontrastních látek a v případě drobných ložisek pod 1 cm velikosti je vhodné použití kontrastního ultrazvukového vyšetření.
Chirurg a T+N diagnostika karcinomu rekta
Kala Z.
Chirurgická klinika FN, Brno
Zlatým standardem lokálního stagingu karcinomu rekta je TRUS a MR. TRUS má nezastupitelné postavení při hodnocení nádorů Tis a T1.
MR je dnes zásadním vyšetřením lokálního stagingu. Její význam je zejména dán tím, že na rozdíl od CT umí stanovit vztah nádorové tkáně k fascia recti, provazce obalující perirektální měkké tkáně – zejména uzliny a tuk a vyjádřit ji v milimetrech. Vzdálenost k cirkumferentnímu radiálnímu okraji (CRM) se vyjadřuje v milimetrech. Při bezpečné vzdálenosti (1 mm a více) je riziko lokální recidivy 12 % oproti 28 % riziku lokální recidivy u vzdálenosti menší.
MR má význam i při detekci lokálně-regionálních uzlinových metastáz.
V současnosti nabývají některé ukazatele detekovatelné na MR i významu prognostického. Jde zejména o hodnocení extramurálního šíření nádoru v milimetrech od zevního longitudinálního okraje muscularis propria od zevní hranice nádoru, tzv. EMD.
Na základě maximální invaze nádoru vně zevní hranice muscularis propria byla vypracována i MR kritéria hodnocení T3 tumorů do čtyř podskupin: T3a, T3b, T3c a T3d. Ukazuje se, že toto rozdělení má velký prognostický význam – nádory v podskupinách T3a a T3b mají významně lepší prognózu než nádory T3c a T3d.
Dalším prognostickým ukazatelem je i invaze do cév, zejména EMVI, extramural venous invasion. Pacienti s detekovatelnou žilní invazí na MR mají významně horší prognózu a také významné riziko synchronního jaterního metastazování.
Speciálně se na MRI hodnotí distální nádory rekta – zde má klíčový význam vztah nádorové infiltrace ke svěračům (hodnotí se infiltrace intersfinkterického prostoru, infiltrace zevního svěrače) a k musculus levator.
Pro prognózu má zásadní význam stagingové hodnocení MRI po proběhlé neoadjuvantní léčbě (viz níže) tzv. restaging.
Klíčový význam v rámci lokálního stagingu nemetastatického karcinomu rekta má MR.
Především na jejím základě se v prostředí multidisciplinární onkologické indikační komise stanovuje, zda je indikována primární chirurgická léčba nebo léčba neoadjuvantní. V rámci neoadjuvantní léčby se zvažuje radiochemoterapie, radioterapie krátkodobá, nově se v indikovaných případech zvažuje i systémová chemo(bio)terapie.
MR hraje i zásadní roli pro volbu chirurgického zákroku. Zvažuje se lokální výkon (TEM) či standardní resekce: nízká přední resekce s partiální či totální mezorektální excizí (TME) nebo abdominoperineální amputace rekta.
Ve speciálních případech je na základě MR a klinického vyšetření indikována extrasfinkterická resekce či extralevátorová amputace rekta. Výjimečně indikovanými zákroky jsou multiorgánové resekce či tzv. exenterace malé pánve.
PET/CT v M diagnostice kolorektálního karcinomu
Votrubová J.
Radiodiagnostické oddělení Thomayerova nemocnice, Praha
Diagnostika metastazujícího kolorektálního karcinomu (CRC) pomocí FDG-PET je dle dnešní medicíny založené na důkazech (evidence based medicine – EBM) zařazena do skupiny indikací vhodných pro toto metabolické vyšetření. Zvýšený metabolismus glukózy ve většině buněk primárního a sekundárního karcinomu tlustého střeva je dobře využitelný pro vyšetření postižených pacientů pozitronovou emisní tomografií (PET) pomocí radiofarmaka 18F-fluorodeoxyglukózy (FDG). Hybridní vyšetřovací modalita kombinující PET s výpočetní tomografií (CT) zvyšuje na podkladě přidané morfologicko-anatomické informace specificitu a celkovou přesnost velmi senzitivního funkčního vyšetření PET. Vyšší senzitivitu dosahuje FDG-PET/CT díky zobrazení drobných plicních a jaterních metastáz na CT skenech, které jsou velikostí pod hranicí prostorové rozlišovací schopnosti PET.
Vzhledem k mohutnému rozvoji chirurgických (záchovné resekce střeva, resekce jaterních a plicních metastáz) i nechirurgických technik (TACE, RFA) se indikace k FDG-PET/CT rozšiřují. Hybridní vyšetření je využíváno pro ověření počtu a topografie ložisek nádoru před zvažovanými výkony a pro ověření účinnost terapie po vlastním výkonu. Je tak možné spolehlivě odhalit pacienty vhodné pro radikální léčbu a vyčlenit pacienty s rozsáhlým nádorovým postižením pro léčbu paliativní.
Neocenitelnou výhodou FDG-PET/CT vyšetření ve stagingu kolorektálního karcinomu je možnost provedení dvou vyšetření v jednom sezení, neinvazivita a standardní velký rozsah snímání od báze lební po proximální polovinu stehen.
Nevýhodou tohoto vyšetření je určitá radiační zátěž pacienta, která se významně snižuje použitím vysoce citlivých moderních skenerů, využitím dostupných skenovacích i rekonstrukčních algoritmů a správnou přípravou pacienta před vyšetřením.
Chirurg a M diagnostika karcinomu rekta
Kala Z.
Chirurgická klinika FN, Brno
Metastazující karcinom rekta je příkladem onemocnění, kde se nelze řídit jednoduchými léčebnými schématy. V současnosti je přijímán všeobecně jako konsenzus individualizovaný přístup každého pacienta ve IV. stadiu za účasti všech relevantních odborníků onkologické indikační komise na základě pečlivého stagingového vyšetření pomocí nejmodernějších zobrazovacích metod.
Důležitá je přítomnost chirurga nejen při vstupním stagingu, kdy se metastazující karcinom rekta rozděluje na primárně resekabilní, resekabilní po konverzní léčbě a nikdy neresekabilní, ale i v průběhu reevaluace, která by měla probíhat každé 3 měsíce onkologické léčby, a to i ve skupině nikdy neresekabilních nálezů.
V posledním desetiletí došlo díky pokroku v zobrazovacích metodách k výraznému zpřesnění stagingu metastazujícího karcinomu konečníku. Jde zejména o rutinní užívání torakoabdominálního CT při pátrání po vzdálených orgánových metastázách. Nejčastěji metastázy postihují játra. V případě potřeby je CT vyšetření doplněno vyšetřením pomocí MR. Výrazný pokrok byl zaznamenán v rozlišení malých jaterních lézí menších než 1 cm pomocí UZ vyšetření s kontrastní látkou CEUS. PET a PET/ CT se užívá k detekci viabilní nádorové tkáně, zejména při vylučování podezření na konvenčních zobrazovacích metodách skrytých metastáz.
V případě synchronního metastazujícího karcinomu konečníku je třeba došetřit i nález na rektu, pomocí transrektální ultrasonografie a magnetické rezonance rekta a pánve.
U metastazujícího karcinomu konečníku nejprve zhodnotíme, zda jsou nemocní schopni agresivního onkologického a onkochirurgického přístupu či zda jsou vzhledem ke svému stavu kandidáty paliativní a symptomatické léčby.
U kandidátů agresivní léčby se u metachronního metastazujícího karcinomu konečníku zabýváme jen resekabilitou metastáz. U synchronního metastazujícího karcinomu rekta je situace složitější – hodnotíme resekabilitu primárního nádoru rekta dle MR (cirkumferentní okraj!) a resekabilitu dceřiných nádorů (na CT dutiny břišní a hrudníku).
Postižené s nejčastějšími orgánovými metastázami jater pak rozdělujeme do tří skupin – na pacienty primárně resekabilní – na pacienty resekabilní po neoadjuvantní konverzní léčbě – a na pacienty „nikdy neresekabilní“ (většinou s mnohočetnými metastázami ve více orgánech).
Velké části pacientů ve IV. stadiu onemocnění schopných agresivní léčby lze v současnosti pomoci a zajistit velmi dobrou šanci na delší přežívání. Tato šance je velká především u pacientů, kterým se podaří metastázy (u synchronního karcinomu rekta samozřejmě nejen metastázy, ale i primární nádor!) radikálně odstranit chirurgickou cestou. Díky pokroku v hrudní chirurgii a zejména jaterní chirurgii se staly tyto náročné operace pro nemocné relativně bezpečné s nízkou letalitou a akceptovatelnou morbiditou. U resekčních výkonů na játrech se preferují neanatomické resekce. Výjimkou však nejsou ani indikace k rozsáhlým anatomickým resekcím jater u biologicky mladých pacientů s příznivou biologií nádoru. Obecně platí, že z osmi jaterních segmentů je z funkčního hlediska nutné zachovat minimálně 20 % jaterního parenchymu, tj. cca dva jaterní segmenty (pozn.: Transplantace jater není v současnosti léčebnou metodou u metastazujícího KRK!). V případě hepatopatie (která může být dána i dlouhodobou chemoterapií) procento nutného minimálního množství jaterní tkáně stoupá na 30–40 %.
Při řešení případů metastatického karcinomu rekta se prohlubuje spolupráce všech zúčastněných odborníků z onkologické komise. Případné operační léčbě ve většině případů (výjimkou je například primárně resekabilní metachronní solitární jaterní metastáza) předchází léčba v podobě systémové chemoterapie, často i v kombinaci s biologickou léčbou.
Primární resekabilita jaterních metastáz není vysoká a pohybuje se okolo 20 %. Příčinou neresekability není jen neodstranitelnost všech metastatických ložisek (částečné odstranění metastáz karcinomu rekta, tzv. debulking není účinný!), ale i nemožnost zachovat dostatečné množství funkčního jaterního parenchymu.
Díky stále účinnějším látkám a lékům lze u značné části pacientů postižených metastázami dosáhnout zmenšení dceřiných nádorů. To pak umožní následné chirurgické odstranění metastáz, které byly před léčbou původně neodstranitelné, s možností zachování dostatečného množství funkčního jaterního parenchymu. Léčebná odpověď na chemo - či chemobioterapie je hodnocena na zobrazovacích metodách podle různých kritérií (např. kritéria RECIST). Příznivá léčebná odpověď je v současnosti až u 30 % nemocných. Tato příznivá odpověď je i důležitým prognostickým kritériem. U metastatických ložisek okolo1 cm je třeba počítat s možností vymizení metastázy na zobrazovacích metodách (missing metastases). Proto je nutné v těchto případech neoadjuvancí vždy pečlivě zvážit a eventuálně velmi dobře definovat lokalizaci metastáz v rámci segmentálního uspořádání jater. Délka neoadjuvantní chemoterapie by neměla překročit v ideálním případě pět sérií chemoterapie z důvodů toxicity a nárůstu možných pooperačních komplikací při následné chirurgické léčbě.
Pokud dojde k sekundární resekabilitě, hovoříme o konverzní léčbě. Pacienti resekovaní až po této konverzní léčbě mají přibližně stejnou šanci na pětileté přežití jako pacienti, kteří byli resekovatelní primárně. Pětileté přežívání po úspěšné R0 resekci se pohybuje okolo 40 % (u solitární metastázy metachronního karcinomu rekta až 60 %).
Resekabilitu lze zvýšit i některými speciálními intervenčně radiologickými metodami (předoperační embolizace větve v. portae k dosažení hypertrofie po resekci ponechané části jater či kombinace chirurgické resekce s lokální destrukcí malé metastázy velikosti do 2 cm pomocí RFA – radio frekvenční ablace).
MOLEKULÁRNÍ GENETIKA KOLOREKTÁLNÍHO KARCINOMU: SOUČASNOST A BUDOUCNOST
Funkční genetické a epigenetické aspekty DNA oprav v kolorektální karcinogeneze
Vodička P.1, Slyšková J.2, Štětina R.3, Vodičková L.7, Procházka P.1,Levý M.4, Vymetálková V.2, Pardini B.5, Bielik L.1, Schneiderová M.6, Liška V.7, Naccarati A.5, Kumar R.8
1ÚEM AV ČR v.v.i., Praha
2Ústav biologie a lékařské genetiky 1. LF UK, Praha
3Oddělení toxikologie, Fakulta vojenského zdravotnictví, Univerzita obrany, Hradec Králové
4Oddělení chirurgie Thomayerovy nemocnice, Praha
5Human Genetics Foundation, Torino, Italy
61. chirurgická klinika 1. LF UK a VFN, Praha
7Biomedicínské centrum LF UK, Plzeň
8Dept. Molec. Genet. Epidemiol., German Cancer Research Center (DKFZ), Heidelberg, Germany
Mechanismy DNA opravy jsou kritickými mechanismy při udržování univerzální genomové stability a integrity a zajištění buněčných funkcí. Defekty v mechanismech DNA oprav zvyšují pravděpodobnost vzniku poškození DNA působením endogenních a exogenních vlivů, které vedou k následné akumulaci mutací v genomu a vývoji celé řady onemocnění. Jedinci s defektní opravou DNA vykazují významně zvýšené riziko rozvoje řady chronických onemocnění, především maligních. Individuální kapacita DNA reparace je ovlivňována řadou komplexních faktorů, jako jsou genové varianty, genové exprese, stabilita genových produktů, účinky inhibitorů či stimulátorů a faktory životního stylu a prostředí. Stanovování DNA reparační kapacity pomocí funkčních testů tudíž představuje integrovaný marker, syntetizující vlivy výše uvedených faktorů. Funkční testy DNA opravy odrážejí kapacitu organismu vyrovnat se s chronickou expozicí celé řadě genotoxických látek v životním prostředí a ve stravě a mohou být rovněž využity jako prediktivní biomarker nádorové terapie.
V posledních letech jsme pak vyvinuli funkční testy pro stanovování nukleotidové (NER) a bázové (BER) excizní reparace v lidských pevných tkáních. V našich studiích jsme rovněž zkoumali kapacitu BER u zdravých osob, profesionálně exponovaných potenciálním chemickým karcinogenům. Velmi zajímavým výsledkem byla inverzní korelace BER kapacity s poškozením DNA a pozitivní korelace mezi BER opravou a mírou expozice. V protikladu s výsledky u zdravých jedinců kapacity oprav BER a NER byly významně nižší (spolu s významně vyšší hladinou poškození DNA) u pacientů s nově diagnostikovaným kolorektálním karcinomem ve srovnání s pacienty zdravými. Velmi zajímavým fenoménem je zvýšení kapacity DNA opravy k hodnotám srovnatelným se skupinou kontrolní u pacientů s ukončenou chemoterapeutickou léčbou. V naší další studii jsme pak porovnávali kapacity DNA oprav BER a NER v periferních lymfocytech, nádorové tkáni a zdravé střevní sliznice u 70 pacientů se sporadickým karcinomem tlustého střeva a konečníku. Lymfocyty v porovnání s nádorovou tkání opravují poškození DNA cestou BER a NER méně efektivně než nádorová tkáň a zdravá sliznice. Definování genetických a genotypických faktorů onemocnění jsme tudíž rozšířili o DNA reparační funkční charakteristiky, a to jak na systémové (periferní krev), tak lokální (vlastní nádor) úrovni. V budoucnu bude zapotřebí se zaměřit na studie DNA reparačních kapacit s důrazem na vznik onemocnění, jeho průběh a prognózu v souvislosti s interakcemi mezi prostředím a genetickou složkou.
Podpořeno granty CZ GA CR: GA P304/10/1286, GA P304/12/1585 a IGA MZCR 14329.
MikroRNA v molekulární patologii kolorektálního karcinomu a jejich translace do klinické onkologie
Slabý O.
Masarykův onkologický ústav, Brno; Středoevropský technologický institut MU, Brno
MikroRNA (miRNA) jsou krátké nekódujcí RNA dlouhé 18–25 nukleotidů, které post-transkripčně regulují genovou expresi v průběhu rozličných buněčných procesů jako jsou apoptóza nebo diferenciace, ale také maligní transformace. Změny v expresních profilech miRNA byly opakovaně pozorovány u většiny solidních nádorů včetně kolorektálního karcinomu. Mechanistické studie prokázaly v nádorové buňce schopnost jednotlivých miRNA vykazovat funkci nádorových supresorů a onkogenů. Nejnovější pozorování navíc popisují potenciál jedné miRNA vykazovat v závislosti na kontextu jak funkci nádorového supresoru tak onkogenu. Tato pozorování zásadním způsobem rozšířila koncept molekulární patogeneze kolorektálního karcinomu a naznačila potenciál miRNA nejen jako diagnostických biomarkerů, ale také jako terapeutických cílů. Specifické expresní profily miRNA byly u pacientů s kolorektálním karcinomem úspěšně využity ke stanovení prognózy nebo k predikci léčebné odpovědi na vybrané terapeutické režimy. Přítomnost miRNA byla prokázána v krevním séru a plazmě, kde vykazovaly nejen vysokou míru stability, ale u kolorektálního karcinomu rovněž velice dobré analytické vlastnosti. V současné době je kromě možného diagnostického využití cirkulujících miRNA intenzivně studován jejich původ a příčiny jejich extrémně vysoké stability. MiRNA jsou také velice slibnými terapeutickými cíli, přičemž první protinádorová terapie na bázi miRNA vstoupila do klinického hodnocení začátkem roku 2013. Sdělení shrnuje novinky z oblasti biogeneze a funkce miRNA, význam miRNA v nádorové biologii a jejich zapojení do hlavních znaků maligního nádoru. V kontextu našich výsledků bude dále diskutována schopnost vybraných miRNA složit jako tkáňové biomarkery (prognostické a prediktivní), sérové biomarkery (diagnostické) a potenciální terapeutické cíle u kolorektálního karcinomu.
Výzkum byl podpořen granty IGA MZ ČR NT13549–4/2012, NT138604/2012, NT–13547 –04/2012, NT13514–4/2012.
Význam mezioborové spolupráce při vyšetřování volné nádorové DNA (cftDNA) u kolorektálních lézí
Benešová L.
CEGES; Laboratoř molekulární genetiky a onkologie, Genomac výzkumný ústav, Praha
Volná nebo také cirkulující tumorová (cft) DNA je v současné době velmi slibným markerem pro neinvazivní vyšetřování pacientů s nádorovým onemocněním, a to především v souvislosti s diagnostikou, predikcí nebo sledováním odpovědi na léčbu či časným záchytem rekurence. Jde o krátké fragmenty DNA, které se volně vyskytují v periferní krvi a jejich hladina je u pacientů s nádorovým onemocněním zvýšena (převážně u pokročilých stadií). V předchozí studii jsme ve spolupráci se dvěma klinickými pracovišti na souboru 200 pacientů s kolorektálním karcinomem (CRC) zavedli kompletní metodiku vyšetřování cftDNA od odběru, zpracování a transportu vzorků, přes izolaci cftDNA až po její detekci a vyhodnocení. Na cftDNA pozitivních pacientech, kteří podstoupili chirurgickou a/nebo chemoterapeutickou léčbu, jsme pak ukázali význam jejího průběžného follow-upu, a to především při záchytu rekurence onemocnění a sledování účinku léčby. Následně jsme navázali spolupráci s dalšími třemi pracovišti a zpracovali více než 100 nových vzorků. V této přednášce bude popsán celý postup vyšetření cftDNA s hlavním zaměřením na klinickou část, a to zejména výběr pacientů, způsob odběru vzorků a manipulaci s nimi a důležitost spolupráce endoskopisty nebo chirurga, patologa a molekulárního genetika. Dále bude nastíněn dosavadní stav všech projektů (počty odebraných, vyšetřených a cftDNA pozitivních vzorků) a ukázány hlavní směry využití cftDNA u pacientů s CRC.
Podpořeno grantem IGA MZ NT 13660.
Rutinní testování molekulárních prediktorů cílené onkologické léčby kolorektálního karcinomu
Vaněček T.
Bioptická laboratoř s.r.o., Plzeň
Vznik kolorektálního karcinomu je vícestupňový proces zasahující různé signální dráhy. Z molekulárně genetického hlediska zahrnuje chromozomální přestavby, mutace, epigenetické změny.
Z klinického hlediska patří mezi nejvýznamnější dráhy MAPK a PI3K/Akt/mTOR, které jsou aktivované prostřednictvím Tyr kinázového EGFR. Na tento receptor může být cílena terapie monoklonálními protilátkami (MAbs). Tyto MAbs působí jednak jako inhibitory nasednutí ligandů na EGFR, popř. jejich dimerizace, dále prostřednictvím na protilátkách závislé buněčné cytotoxicity (ADCC) a také pomocí internalizace vázaného receptoru.
EGFR je overexprimována v nezanedbatelném procentu mKRK. Tato skutečnost vedla k úspěšné myšlence, cílit na pacienty s overexpresí biologickou terapii MAbs, konkrétně nejprve cetuximab a posléze panitumumab.
Postupem času bylo zjištěno, že i pacienti bez exprese EGFR mají benefit z léčby MAbs. Příčiny tohoto jevu jsou nejasné. Částečně může jít o artefakt IHC. Dalším vysvětlením může být vliv zvýšené exprese ligandů, konkrétně AREG a EREG. Během klinických studií se také ukázalo, že řada pacientů s expresí EGFR (a také bez exprese) je na léčbu rezistentní. Tato skutečnost vedla k hledání příčin tohoto jevu a bylo zjištěno, že terapie je neúčinná, jestliže v některé ze signálních drah dojde v důsledku somatické mutace ke ztrátě schopnosti reagovat na řídící podněty.
Aktivační somatické mutace a také další alterace byly detekovány v obou hlavních signálních drahách ovlivňovaných EGFR, MAPK a PI3K/Akt/mTOR.
U MAPK dráhy jsou mutovány produkty genů rodiny RAS (KRAS/NRAS u mKRK). Tyto proteiny se účastní přenosu signálu z EGFR na další proteiny MAPK dráhy. Aktivační mutace těchto genů způsobí ztrátu GTP-ázové aktivity a aktivaci proteinu nezávislé na funkčním stavu EGFR. Aktivační mutace V600E genu BRAF stimuluje fosforylaci na T599 a/nebo S602 a protein zůstává v permanentně aktivním stavu.
U PI3K/Akt/mTOR dráhy jsou mutace nalézány v genu PIK3CA, který využívá ATP k fosforylaci fosfatidylinositolů. Alterován je též gen PTEN, který kóduje fosfatázu, která se účastní regulace buněčného cyklu, inhibuje růst a dělení buněk. Ztráta funkce proteinu PTEN (ztráta exprese) vede k zvýšení koncentrace PIP–3 a v důsledku toho k aktivaci PI3K/Akt/mTOR dráhy.
V těchto signálních drahách jsou nalézány i další změny, např. overexprese (Amphiregulin – AREG a epiregulin – EREG) či mutace (vzácně) a amplifikace EGFR.
V současné době jsou v ČR standardně vyšetřované jediné dva geny – KRAS a NRAS. Pacienti s prokázanou mutací neodpovídají na léčbu antiEGFR MAbs. Vyšetřují se mutace v kodonech 12, 13, 61 a dále kodony 59, 117 a 146.
Další alterované geny mají nejistý prediktivním význam pro antiEGFR terapii:
- BRAF – negativní prognostický význam, nejasný prediktivní,
- PIK3CA – mutace v exonu 20 – možná rezistence,
- ztráta exprese PTEN – možná rezistence,
- mutace EGFR – není známo,
- amplifikace EGFR – není známo, možná senzitivita amplifikovaných EGFR,
- zvýšená exprese AREG/EREG – senzitivita.
Pokud se jedná o predikce dalších cílených terapeutik, tak pro nízkomolekulární inhibitory ostatních členů MAPK a PI3K/Akt/mTOR dráhy v současné době nejsou k dispozici jasné výstupy a stále probíhají klinické studie. Pokud jde o cílené inhibitory ostatních drah bez rutinně vyšetřovaného molekulárního markeru, pak jako nadějné se jeví např. varianty VEGFA a VEGFR u léčby antiVEGF.
Analýzy používané v prediktivní diagnostice zahrnují kombinace následujících metod:
- izolace DNA – většinou kolonky nebo paramagnetické partikule
- PCR a její varianty – real-time PCR, alel specifická PCR
- hybridizace – ve formě reverzního systému
- sekvenování – klasické „Sangerovo“ a „next generation“
Kombinace těchto metod má rozdílnou analytickou senzitivitu a také rozdílné množství výstupních informací. Některé metody mají při vyšší senzitivitě omezený panel testovaných mutací (real-time, reverzní hybridizace). Testování jednotlivých mutací v genech pak zachycuje vždy pouze větší či menší část změn (mutací), které jsou přítomné – zůstává část netestovaná a tím i nezachycená část pacientů, kteří nevykazují predikovanou léčebnou odpověď z důvodu, že „jejich“ mutace nebyla testována. Jiné metody jsou omezeny méně, získávají informaci z celého analyzovaného úseku DNA, mají však nižší analytickou citlivost (klasické sekvenování). V současné době pak začínají být dostupné metody, které při dostatečné analytické senzitivitě získávají velmi komplexní informaci („next generation“ sekvenování).
Cirkulující nádorové buňky (CTCs) u pacientů s jaterními metastázami kolorektálního karcinomu
Pešta M.1, Fichtl J.2, Kulda V.3, Topolčan O.4, Třeška V.2
1LF UK, Plzeň
2Chirurgická klinika LF UK a FN, Plzeň
3Ústav lékařské chemie a biochemie LF UK, Plzeň
4II. interní klinika LF UK a FN, Plzeň
V ČR patří kolorektální karcinom mezi nejčastěji se vyskytující nádorová onemocnění. Jde o nejčastější nádorové onemocnění po karcinomu plic u mužů a u žen po karcinomu prsu. Plzeňský kraj má smutnou prioritu, má ze všech krajů v ČR největší výskyt tohoto nádorového onemocnění. Po operativním odstranění kolorektálního karcinomu a adjuvantní terapii jsou častou příčinou úmrtí vzniklé metastázy. Nejčastějším místem metastazovaní kolorektálního karcinomu jsou játra (jaterní metastázy kolorektálního karcinomu – JMKRK).
Jedinou radikální léčbou těchto metastáz s dobrými dlouhodobými výsledky je léčba chirurgická, resekce. V dalším průběhu tohoto onemocnění dochází často k opětovnému vzniku metastáz, vlivem mikrometastáz vzniklých v játrech již v době resekce. Zároveň mohou mít vliv na rekurenci JMKRK metastatické buňky uvolněné vlivem operačního postupu.
Cílem projektu bylo zjistit, jak často se cirkulující nádorové buňky vyskytují v krevní cirkulaci pacientů s JMKRK, zda během operačního postupu resekce jaterních metastáz může dojít k uvolnění nádorových buněk do krevní cirkulace krve. Zároveň zjistit informace o délce přežívání těchto buněk. Zjištěné výsledky by mohly mít vliv na případnou úpravu operačního postupu.
Přestože operační postup je prováděn tak, aby nedošlo k uvolnění nádorových buněk i dalších elementů (způsobujících například různé typy embolií) do krevního oběhu, může k tomu docházet. Schéma výzkumu bylo následující:
Skupina pacientů: 14 pacientů s resekcí jaterních metastáz, s par-ciální a celkovou resekcí jaterního laloku, bez omezení věku. Sled odběrů: 1. odběr předoperačně, 2. během operace – po odstranění 3 ml plné krve náběr 7,5 ml, odběr z centrálu, 3. těsně po operaci, 4. 2 dny po operaci, 5. 7 dní po operaci.
Odběr: 7,5 ml plné krve do speciálních zkumavek (AdnaCollect Blood Collection Tubes). Odebraná krev je skladovaná při 4–8 oC a zpracována do 24 hodin.
Analýza byla provedena soupravou firmy AdnaGen: AdnaTest ColonCancerSelect + AdnaTest ColonCancerDetect.
Byla provedena kvalitativní a kvantitativní analýza genů GA733–2, CEA, EGFR, B-actin (housekeeping gen) genů exprimovaných v zachycených buňkách před a po výkonu a analyzována souvislost exprese výše uvedených genů s rozsahem a charakterem chirurgického výkonu.
Závěr: Detekovali jsme CTCs pouze u menšiny pacientů s jaterními metastázami kolorektálního karcinomu, u tří ze 14 (21 %) pacientů. U jednoho z jedenácti (9 %) pacientů bylo zaznamenáno dlouhodobé (z hlediska studie) přežívání CTC – tento pacient neměl před operací CHT. U jednoho z jedenácti (9 %) pacientů byla zaznamenána přítomnost CTC během operace – dalších přítomnost CTC u tohoto pacienta nebyla zaznamenána. U každého z pacientů u kterých byla detekována přítomnost CTC byla zachycena pomocí jiného „nádorového rysu“ – argument podporující názor o heterogenitě CTC. Přítomnost CTCs byla zjištěna u pacientů bez chemoterapie, ale také u pacientů léčených chemoterapií po primární operaci. Stanovení ukazují, že chirurgický zákrok může způsobit přítomnost CTCs v krevní cirkulaci.
POKROKY DIGESTIVNÍ ENDOSKOPIE V DIAGNOSTICE A LÉČBĚ KOLOREKTÁLNÍCH NEOPLAZIÍ
Kudova klasifikace – je čas na změnu?
Vítek P., Mikoviny Kajzrlíková I.
Beskydské gastrocentrum, Interní oddělení, Nemocnice ve Frýdku-Místku
Ostravská Univerzita v Ostravě
Znalost histologického charakteru léze již během endoskopického vyšetření („virtuální histologie“) přináší endoskopistům zásadní informace. Umožňuje totiž ponechat nenádorové léze bez léčby a naopak zvolit adekvátní terapeutickou strategii u lézí s pokročilými neoplastickými změnami. V minulých letech proto bylo do praxe zavedeno několik metod, které odhad histologického charakteru léze umožňují. Jedná se o především zvětšovací chromoendoskopii, elektronickou (optickou) chromoendoskopii a konfokální laserovou endomikroskopii.
V oblasti zvětšovací chromoendoskopie se v praxi nejvíce uplatnila Kudova klasifikace, která popisuje takzvaný pit pattern (vzor jamek, odpovídají ústí kolonických krypt). Kudova klasifikace rozlišuje celkem sedm typů pit pattern I, II, IIIS, IIIL, IV, Vi a Vn. Z nich typ I odpovídá normální sliznici, typ II hyperplastické lézi, ostatní typy jsou pak neoplastické. Nejpokročilejší neoplastické změny zahrnují pit pattern IIIS a Vi, pit pattern Vn je pak jednoznačnou známkou invazivního karcinomu. Jednotlivé typy pit pattern z Kudovy klasifikace jsou znázorněny na obrázku 1.
Obr. 1. Schematické znázornění původní Kudovy klasifikace 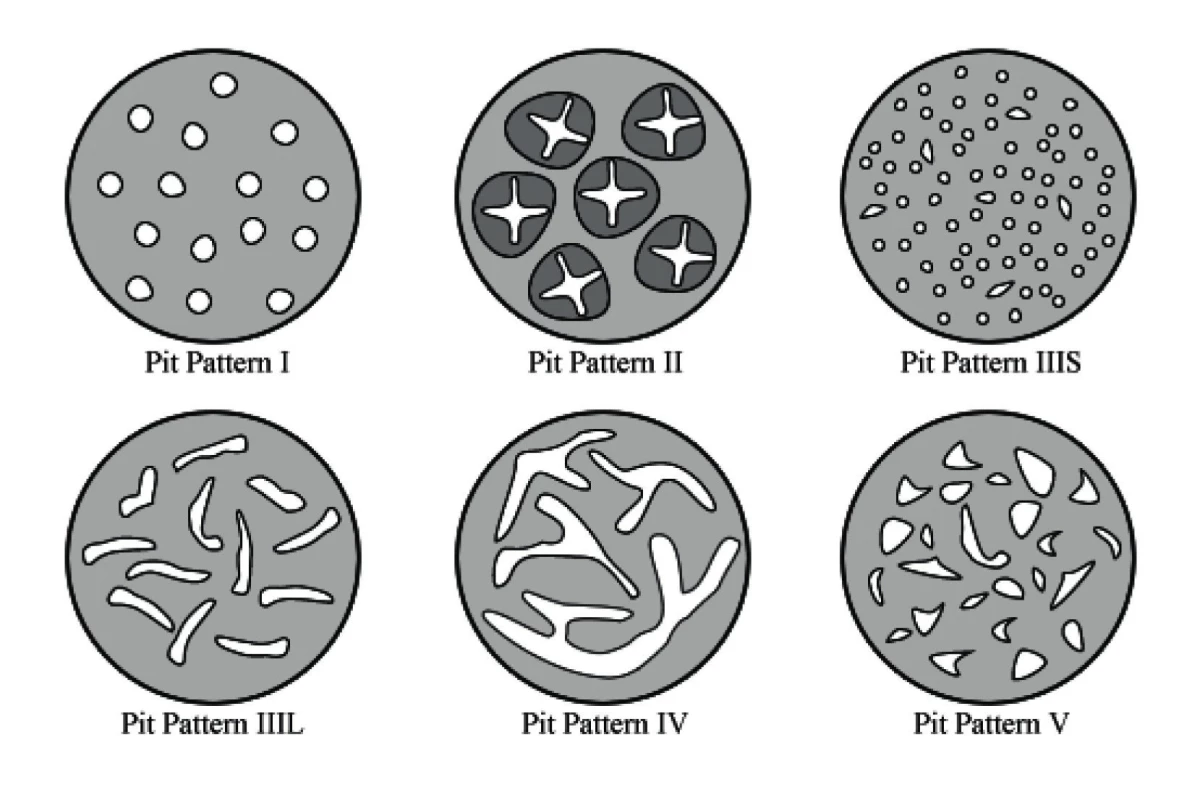
Kudova klasifikace předpokládá použití zvětšovacího endoskopu, v praxi se ale běžně používají endoskopy s vysokým rozlišením bez optického zoomu. Nezbytné je použití barviva, které se aplikuje na sliznici, obvykle se používá 0,1% roztok indigokarmínu. Vzhledem k časové náročnosti chromoendoskopie byly vyvinuty techniky elektronické (optické) chromoendoskopie, které zlepšují viditelnost především vaskulárních struktur sliznice s pomocí optického filtru či úpravou digitálního obrazu (NBI firmy Olympus, i-Scan firmy Pentax a FICE firmy Fujinon). Nejvíce prací bylo doposud publikováno s technologií NBI, při které se na rozdíl od vzoru jamek hodnotí především cévní struktury. U neoplastických lézí s vývojem dysplazie narůstá denzita cév i jejich šířka (vascular pattern). Přesnost určení neoplastického charakteru léze je při používání NBI a hodnocení vascular pattern obdobná jako při užití chromoendoskopie s analýzou pit pattern. Obdobných výsledků bylo dosaženo i u technologie i-Scan. Senzitivita a specificita pro rozlišení neoplastické a non-neoplastické léze se u metod elektronické chromoendoskopie pohybují nad 90 %.
Za účelem standardizace hodnocení nálezů vypracovala skupina expertů z Japonska, USA a Evropy v roce 2010 NBI international colorectal endoscopic (NICE) klasifikaci pro hodnocení kolorektálních neoplazií. NICE klasifikace byla vytvořena pro použití u endoskopů s vysokým rozlišením bez zvětšení při dostatečném přiblížení. V rámci NICE klasifikace se hodnotí tři charakteristiky léze: barva, mikrovaskulární struktura a vzhled povrchu. Pro zjednodušení byly léze rozděleny do tří kategorií (Typ 1 – hyperplastická léze, Typ 2 – adenom či karcinom s povrchovou submukózní invazí a Typ 3 – karcinom s hlubokou submukózní invazí). Přesná charakteristika jednotlivých typů je uvedena v tabulce 1.
Ve studii, která přímo porovnávala zvětšovací chromokolonoskopii vůči zvětšovací NBI endoskopii, byla zvětšovací chromokolonoskopie přesnější především u lézí s výraznějšími nepravidelnostmi povrchu. Obě metody nejsou zaměnitelné, ale mohou se doplňovat především v odhadu přítomnosti submukózní invaze před endoskopickou léčbou.
V posledních letech je zvýšená pozornost věnována problematice pilovitých lézí (hlavně sesilních serrated adenomů), které mohou být prekurzory kolorektálního karcinomu především v proximálním tračníku. V souvislosti s jejich charakteristikou metodami zvětšovací chromokolonoskopie je z původní Kudovy klasifikace vyčleňován samostatný subtyp vzoru jamek – pit pattern II-O (open shape – otevřeného tvaru), který je odlišný od klasického typu II dle Kudovy klasifikace. Molekulární analýza u lézí s pit pattern II-O prokázala vysokou četnost BRAF mutace a CIMP.
Povrchový vzhled léze je jednou z řady faktorů, které endoskopista před případnou resekcí zvažuje. Významným dalším parametrem je především přítomnost elevace léze při submukózní injekci (lifting sign), případně přítomnost ulcerace. Rozhodující pro další postup u konkrétního nemocného však nadále zůstává histopatologické zhodnocení kompletního resekátu.
Nové možnosti kapslové kolonoskopie
Suchánek Š.1, Májek O.2, Voška M.1, Grega T.1, Zavoral M.1
1Interní klinika 1. LF UK a ÚVN, Praha
2Institut biostatistiky a analýz MU, Brno
Kapslová kolonoskopie je nová, minimálně invazivní metoda vyšetření tlustého střeva. Ve srovnání s optickou kolonoskopií není nutná intubace a insuflace střeva, které jsou pacientem vnímány negativně. Může tudíž významně zvýšit adherenci ke screeningu.
V ČR probíhá v současné době studie, jejímž cílem je porovnat účinnosti nové generace kolonické kapsle a kolonoskopie v detekci polypů a karcinomů kolon a zhodnocení možnosti využití kapsle v programu screeningu kolorektálního karcinomu v ČR. Tato multicentrická (ÚVN Praha, IKEM Praha, GEP Praha, FN Hradec Králové), prospektivní, cross over studie zahrnující 232 asymptomatických jedinců starších 50 let. Mezi sledované veličiny patří počet pacientů s polypy velikosti < 6 mm, ≥ 6 mm, resp. ≥ 10 mm. Dalšími parametry jsou stupeň střevní přípravy, tolerance vyšetření nemocnými a komplikace vyšetření kolonickou kapslí.
Dosud bylo ve studii vyšetřeno celkem 139 jedinců ve všech endoskopických centrech, do dalšího zpracování dat bylo zařazeno 119 pa-cientů. Průměrná senzitivita kolonické kapsle v detekci polypů byla 83 % (67 % pro polypy ≥ 6 mm a rovněž 67 % pro polypy ≥ 10 mm). Průměrná specificita činila 83 % (64 % pro polypy ≥ 6 mm a 93 % pro polypy≥ 10 mm). Senzitivita a specificita v detekci adenomů byly u kapsle86 % respektive 62 %, (75 % resp. 63 % pro adenomy ≥ 6 mm). Karcinom byl identifikován kolonickou kapslí i na kolonoskopii.
Celková střevní příprava byla v případě kapslové kolonoskopie adekvátní u 81 % pacientů. Bylo zaznamenána vyšší senzitivitu kolonické kapsle v detekci polypů u pacientů s adekvátní střevní přípravou. Dosud byly dokumentovány čtyři mírné nežádoucí účinky spojené s oběma vyšetřovacími metodami.
Tato studie, která má jako první v souboru pouze screeningovou populaci, ukázala srovnatelné výsledky, jako dosud publikované zahraniční studie. Průměrná senzitivita v detekci polypů odpovídá jiným neinvazivním screeningovým metodám.
Práce byla podpořena granty IGA MZ č. 1154 a PRVOUK–P27/LF1/1.
Kvalita koloskopie
Kopáčová M.
II. interní gastroenterologická klinika LF UK a FN, Hradec Králové
Koloskopie je endoskopické vyšetření tračníku. Název pochází z řečtiny (colon-scopeo). Tak jako všechny endoskopické techniky prošlo i vyšetření tračníku výrazným kvalitativním vývojem a v dnešní době pracujeme nejen se sofistikovanou technikou, ale řada požadavků je kladena i na kvalitu naší práce a způsob provedení endoskopického výkonu. Pankoloskopie s dosažením céka a v optimálním případě intubací terminálního ilea je v nyní zlatým standardem vyšetření tračníku.
Cílem koloskopie je dokonalá vizualizace celé sliznice tračníku. Zde hraje dominantní roli očista střeva – dělená příprava se stala již standardem, poslední dávka očistného přípravku musí být podána cca 4 hodiny před výkonem, aby bylo dokonale přehledné dno céka a ascendens. U nemocných, kde jsme pro špatnou přípravu neuspěli, volíme intenzifikovaný režim. Přípravu hodnotíme písmeny A až D (modifikovaná Bostonská škála), kde písmenem A označujeme vynikající přípravu s dokonale čistou sliznicí, písmenem B tekutinu v lumen, kterou lze bez problému odsát, nebo obsah, který lze opláchnout a odsát, písmenem C přípravu, při které není dokonalá vizualizace sliznice pro zbytky stolice a písmenem D formovanou stolici v lumen, pro kterou nelze vyšetření provést či dokončit. Screeningová koloskopie je prováděna pouze při přípravě A či B, při nedostatečné přípravě pacienta přeobjednáváme na novou screeningovou koloskopii. Jako samozřejmost dnes používáme velkokapacitní oplach, krouživým pohybem konce endoskopu obhlížíme celou plochu sliznice, snažíme se nahlédnout za řasy, využíváme symeticon či dimeticon. Názory na využití butylskopolaminu se různí (viz recentní studie Corteho, de Browera a další), ale obecně se přikláníme k názoru, že u tračníku s výraznějšími spasmy jeho aplikace pomáhá při diagnostické i terapeutické koloskopii. V indikovaných případech nám pomáhá endoskopie ve vodní imerzi. CO2 insuflace umožňuje snazší provedení výkonu s menší analgosedací a s větším komfortem pro nemocného. Nezapomínejme na vyšetření análního kanálu a anokutánního přechodu. Po odběru biopsie z tumoru je nutno vzít nové klíšťky na další odběry (část patologické tkáně může zůstat v kleštičkách a spojit se s dalším vzorkem). Pozor na zavádění endoskopu v ohbí tračníku („walking stick handle“ fenomen), v oblasti ohybu střeva pomůže k dalšímu zavedení stahovat a odsávat. Při endoskopii zavádíme endoskop zlehka, nikdy neužíváme násilí a je nutné vědět, kdy přestat (ukončit výkon). Nikdy nečistíme ucpaný kanál endoskopu zavedeného v pacientovi!! Hrozí riziko perforace tračníku. Pokud chceme dělat terapeutické výkony, musíme nejprve ovládat řešení jejich komplikací (stavění krvácení, klipování).
Indikátory kvality endoskopie jsou dosažení céka (%) a adenoma (polyp) detection rate (optimálně při vysouvacím čase 10 min) – poměr počtu pacientů, u kterých je zachycen adenom (polyp), vůči celkovému počtu koloskopií v procentech. Vysouvací čas se hodnotí od opuštění céka do vysunutí přístroje z rekta, stopky se zastavují při odběru biopsií a dalších případných výkonech. Parametrem kvality pracoviště je samozřejmě i procento komplikací při diagnostických a terapeutických výkonech. Dalším kritériem je procento intervalových lézí.
Nejedná se ale jen o kvalitu vlastní endoskopie, ale celého výkonu, komplexní. Je nutno znát a posoudit indikace a kontraindikace, nemocnému vysvětlit výkon a podepsat s ním kvalitní informovaný souhlas. Tam, kde je to potřebné, podat ATB profylaxi, zeptat se na antikoagulancia, antiagregancia, na rodinnou anamnézu kolorektálního karcinomu. Zajistit adekvátní analgosedaci a komfort nemocného. Je nutný dohled po výkonu. Do kvality výkonu nepochybně zahrnujeme i kvalitu dokumentace (stručná a výstižná zpráva se všemi náležitostmi, foto/videodokumentace, doporučení a další postup) a kvalitu očisty endoskopů včetně její evidence a ověřování formou stěrů.
Podpořeno MZ ČR – RVO (FNHK, 00179906).
Pilovité léze tračníku
Tachecí I.1, Kamarádová K.2
1II. interní gastroenterologická klinika FN, Hradec Králové
2Fingerlandův ústav patologie FN, Hradec Králové
Mnoho let byly definovány dva hlavní typy benigních epite-liálních lézí kolorekta: adenomy a hyperplastické polypy. Adenomy byly identifikovány jako zřejmé prekurzory kolorektálního karcinomu, hyperplastické polypy byly považovány za léze neškodné, s nulovým maligním potenciálem. Vzhledem k narůstajícímu množství důkazů o morfologické, molekulárně genetické i klinické heterogenitě skupiny tzv. „hyperplastických polypů“ byl vypracován koncept pilovitých lézí, umožňující diferencovaný diagnostický i terapeutický přístup. Diagnostická kritéria nejsou přesto stále ještě sjednocena a všeobecně akceptována, což často vede k nejasnostem a omylům.Definice pilovitých lézí tračníku je založena na jejich morfologii v mikroskopickém obraze s charakteristickým pilovitým uspořádáním epitelu krypt. Pilovité léze jsou v podstatě vytvářeny klonální proliferací epiteliálních buněk s genetickými alteracemi genů KRAS a BRAF. Typická morfologie je důsledkem poruchy apoptózy a migrace buněk na povrch krypt, která vede k jejich retenci a tvorbě pilovitých struktur.
Z klinického pohledu je zásadní maligní potenciál některých pilovitých lézí. Bylo prokázáno, že klasické adenomy nejsou s největší pravděpodobností prekurzory části sporadických kolorektálních karcinomů s vysokým (MSI-H) či nízkým (MSI-L) stupněm mikrosatelitové nestability, vzhledem k nálezům mutace genu BRAF a hypermetylace CpG ostrůvků (CIMP) v těchto karcinomech (nejsou typické pro adenomy). Prekurzory těchto převážně pravostranných karcinomů (tvořících podle některých autorů až 30 %) jsou pilovité léze. Některá data prokazují u těchto lézí urychlenou karcinogenezi (CIMP-pathway) v porovnání s nádorovou transformací na základě chromozomální či mikrosatelitové nestability.
V současné době zahrnuje revidovaná nomenklatura pilovitých lézí hyperplastické polypy, tradiční pilovité adenomy, sesilní pilovité léze/adenomy a podle některých autorů také tzv. smíšené léze.
Nejčastější pilovité léze jsou hyperplastické polypy (80 %). Jedná se o většinou drobné (menší než 5 mm), přisedlé polypy lokalizované v oblasti rektosigmatu. Mikroskopicky nacházíme pilovité uspořádání proximální poloviny krypt, buňky jsou typicky bez dysplazie. Také změny architektury krypt, typické pro další pilovité léze, nejsou přítomny. Hyperplastické polypy jsou většinou pokládány za léze s nulovým maligním potenciálem, v případě nálezu lézí větších (než 10 mm) či pravostranných, měly by být kompletně odstraněny. Otázkou zůstává, zda se v těchto případech nejedná spíše o sesilní pilovité léze chybně diagnostikované jako hyperplastické polypy. Specifická je situace u takzvané hyperplastické polypózy, kde je asociace s kolorektálním karcinomem zjevná.
Nejproblematičtější je druhá nejčastější pilovitá léze (15 %) – sesilní pilovitá léze. Makroskopicky nalézáme nejčastěji ploché, mapovité léze, větší než 5 mm, častěji pravostranné s nadprodukcí hlenu (kryté tzv. hlenovou čepičkou). Vzhledem k těmto charakteristikám existuje u sesilních pilovitých lézí významně vyšší riziko jejich přehlédnutí v průběhu endoskopie a zároveň představují jeden z rizikových faktorů vzniku takzvaných intervalových karcinomů (karcinomy, které vzniknou 3–5 let po dispenzární pankolonoskopii s odstraněním všech nalezených polypů.). Histologická diagnostika je zároveň při klíšťkové biopsii vzhledem k výskytu charakteristických znaků pilovité léze při bázi krypt (pilovité uspořádání distální třetiny epitelu krypt, dilatace a rozšíření báze krypt do T nebo L, pseudoinvaze pod muscularis mucosae) obtížná a vede často k desinterpretaci léze jako hyperplastického polypu. Vzhledem k tomu je všeobecně doporučováno provádět kompletní endoskopickou resekci těchto lézí (EMR či ESD) s jejich vyšetřením erudovaným patologem. Při resekci léze po částech a vzhledem k jejímu často neostrému ohraničení vůči normální sliznici v bílém světle se doporučuje používat endoskopy s vysokým rozlišením, chromoendoskopii/narrow band imaging a okraje resekce dále ošetřit argonovou plazmakoagulací. V případě pochybnosti stran kompletnosti snesení léze, je nutné ji ověřit časnější kontrolní endoskopií. V nomenklatuře těchto lézí panuje stále ještě poměrně významná míra neshody mezi patology. Otázkou je, zda tyto léze nazývat termínem sesilní pilovitá léze či sesilní pilovitý adenom. Léze je definována pouze na základě změn architektury krypt a přítomnost dysplazie byla považována za diagnostický nález pro takzvanou smíšenou lézi (kombinace pilovité léze s adenomem či tradičním pilovitým adenomem). Na druhou stranu byla v recentních publikacích popsána existence takzvané pilovité dysplazie s odlišnými histopatologickými charakteristikami od standardní adenomové dysplazie. Zda se oba typy dysplazie také liší ve svém biologickém chování, nebylo prozatím prokázáno.
Poslední a raritní (1–5 %) pilovitou lézí je tradiční pilovitý adenom. Nachází se s mírnou převahou v levém tračníku (60 %). Jedná se o přisedlé nebo stopkaté polypy s vilózní strukturou. Vzhledem k jejich morfologii připomínající adenom (včetně přítomnosti dysplazie), nečiní jejich diagnostika větší problémy.
Také v našem souboru koloskopií tvoří pilovité léze menšinu identifikovaných lézí. Mezi roky 2005 a 2009 jsme na endoskopickém pracovišti 2. interní gastroenterologické kliniky provedli celkem 12 144 koloskopií a identifikovali 15 444 polypů a plochých lézí. Sesilních pilovitých lézí a tradičních pilovitých adenomů (histologicky potvrzených) bylo pouhých 156 (1 %), což je výrazně méně než podíl adenomových (6124 : 40 %) a hyperplastických polypů (3562 : 23 %).
Vzhledem k nárůstu zkušeností s pilovitými lézemi mezi endo-skopisty a patology i vzhledem k odlišnému přístupu k pravostranným polypům a plochým lézím v posledních letech se ale v našem souboru v čase procento diagnostikovaných nehyperplastických pilovitých lézí významně zvyšuje (mezi roky 2005–2009 cca 6krát).
Z praktického hlediska je zásadní doporučení endoskopické dispenzarizace těchto lézí. I přes pokrok v klasifikaci a diagnostice neoplastických i non-neoplastických lézí tračníku v posledních letech, neexistuje v oblasti pilovitých lézí dosud všeobecně akceptovaný přístup. Na našem pracovišti se v dispenzarizaci přikláníme k doporučenému postupu publikovanému Rexem a spoluautory v loňském roce.
Práce byla podpořena grantem IGA: NT11524–5/2010.
STATE OF THE ART LECTURE
Může virtuální kolonoskopie nahradit kolonoskopii optickou?
Válek V.
LF a FN MU, Brno
Technika vyšetření: Virtuální kolonoskopie je vlastně vyšetření břicha výpočetní tomografií. K vyšetření je nutný multidetektorový přístroj (nejméně 16-spirální CT přístroj) a speciální program, pomocí kterého provádíme vlastní virtuální kolonoskopii, což je vlastně 3D rekonstrukce tlustého střeva z 2D velmi tenkých řezů. Vlastní vyšetření skládá z dvou sad 2D obrázků, kterých je několik set až 2000. Vyšetření provádíme protokolem „low dose technique“, při kterém se využívá RTG záření o nízké energii (effektivní dávka 3–8 mSv). Metoda virtuální kolonoskopie je neinvazivní, bezbolestná. Výkon se provádí po standardní přípravě (stejně jako kolonoskopie nebo dvojkontrastní irrigografie). Vyšetření můžeme kompletně archivovat.
Po přípravě pacienta a nafouknutí tlustého střeva vyžaduje vlastní VCT dobu skenování dobu okolo 20 sekund za jednu akvizici (vyšetření se provádí na zádech a břiše). Tedy nemocný stráví ve skeneru asi 3 minuty. Typicky celé vyšetření od uložení na CT stůl zabere přibližně 15 minut. Analgosedace se nepoužívá. Vlastní generace obrázků trvá opět asi 10 minut. Doba hodnocení vyšetření radiologem je variabilní. Ve studii ACRIN se doba hodnocení pohybovala v rozmezí v rozmezí 19–25 minut (19 minut pro základní 2D prohlížení snímků a 25 minut pro základní 3D prohlížení snímků).
Vlastní snímky i virtuální kolonoskopii většinou nezávisle hodnotí několik lékařů, což zvyšuje objektivitu vyšetření (senzitivitu, specificitu i přesnost) a výrazně omezuje pravděpodobnost ovlivnění nálezu chybou lékaře. Radiolog proto musí projít speciálním kvalitním a přísným tréninkovým programem. Interpretace VCT je proto časově náročná. Nutnost prohlédnout velký počet obrázků vede k únavě a vysokému riziku percepční chyby. To snižuje kvalitu, přesnost a spolehlivost tohoto vyšetření. Rozdíly ve spolehlivosti hodnocení výsledku vyšetření mezi jednotlivými lékaři i pracovišti dosahuje u polypů větších než 10 mm až 25 % ve velikosti. Tato omezení částečně řeší CAD – počítačové vyhodnocování snímků a rozpoznání patologických nálezů. CAD má potenciál zkrátit dobu interpretaci VCT a snížit variabilitu přesnosti a spolehlivosti nálezů. K dispozici řada komerčních CAD systémů a některé jsou schválené FDA.
Indikace: Hlavní indikací VCT je vyšetření pacientů s karcinomem tlustého střeva, který významně obturuje lumen střeva. Vyšetření umožňuje simultánní předoperační staging nádoru a kontrolu proximálního tračníku a vyloučení synchronních lézí. VTC je samozřejmě indikované u nemocných s neúplnou kolonoskopií. Význam vyšetření pro screening kolorektálního karcinomu není jasný. V roce 2008 aktualizované doporučení American Cancer Society, the U.S. Multi-Society Task Force on Colorectal Cancer, a American College of Radiology definovalo VCT jako metodu vhodnou pro screening polypů větších než 6 mm v intervalu jednu za 5 let. Byť je další výhodou možnost náhodné diagnosticky patologických procesů v dutině břišní, zůstává nevýhodou vyšetření radiační zátěž. Pro diagnostiku polypů menších jak 10 mm je VCT horší než optická kolonoskopie. Probíhající screening v USA pak neprokázal zásadní benefit či finanční přínos VCT jako screeningové metody.
Přesnost metody: VCT je srovnávána v řadě studií s optickou kolonoskopií. Senzitivita a specificita pro detekci všech polypů se mezi studiemi pohybuje v poměrně širokém spektru a snižuje se s klesající velikostí polypů. Dřívější studie, které používaly 2D zobrazení a nepoužívaly značení tekutiny a stolice kontrastem měly nízkou senzitivitu a specificitu pro detekci polypů. Studie shrnující vyšetření 1233 asymptomatických dospělých (bylo použito značení stolice a tekutin, vyšetření bylo prováděno ve 2D a 3D zobrazením, bylo hodnoceno zkušenými radiology), prokázala senzitivitu a specificitu 94 % a 96 % pro polypy 10 mm a větší a 89 % a 80 % pro polypy 6 mm a větší. Negativní prediktivní hodnota VCT byla více než 99 % pro adenomatózní polypy o velikosti 8 mm a více. V nerandomizované studii s pacienty, kteří podstoupili buď kolonoskopii (3120 pacientů) nebo VCT (3163 pacientů), byl záchyt pokročilých nádorů podobný ve skupině VCT (3,2 %) a kolonoskopie (3,4 %). Tato studie prokázala 90 % senzitivitu a 86 % specificitu pro identifikaci adenomů větších než 10 mm a 78 % senzitivitu a 88 % specificitu u lézí větších než 6 mm. U polypů větších než 10 mm byla pozitivní prediktivní hodnota u pacienta 23 % a negativní prediktivní hodnota 99 %. Senzitivita u polypů větších než 6 mm byla u pacienta 78 %. Navíc ve srovnání s kolonoskopií především jako předoperační vyšetření VCT přesněji lokalizuje polohu léze v tlustém střevě.
Při vyšetření VCT se u asymptomatických jedinců nálezy mimo tlusté střevo vyskytují v 6–8 %. Ve studii ACRIN mělo 16 % pacientů nález mimo tlusté střevo, který vyžadoval další vyšetření. K těmto nálezům patřily především karcinomy mimo tlusté střevo, aneuryzma břišní aorty, adenomy nadledvin, ložiska v plíci a ledvinách, postižení vaječníků, jater a sleziny. Kim et al. identifikoval u 3120 asymptomatických pacientů vyšetřených VTC 241 nálezů mimo tlusté střevo (7,7 %). V osmi případech se jednalo o maligní proces (0,3 %).
Komplikace a rizika VCT: U VCT se komplikace vyskytují pouze zřídka. Potenciální komplikace souvisejí především s přípravou nemocného před vyšetřením, s insuflací tlustého střeva a radiační zátěží. Perforace střeva je vzácná a běžnější u symptomatických pacientů, kteří u kterých není použita automatická nízkotlaková insuflace oxidu uhličitého. Burling et al. měl u souboru 17 067 vyšetření VCT 9 perforací (0,08 %). V jiné studii z 11 870 vyšetření prováděných v jedenácti zařízeních bylo sedm perforací (0,06 %). Mezinárodní pracovní skupina pro virtuální kolonoskopie neměla hlášeny žádné perforace u provedených více než 11 000 screeningových VCT vyšetření a jednu perforaci u 22 000 screeningových a diagnostické vyšetření (0,005 %). Vyšší radiační zátěž se týká především obézních nemocných, u kterých je VCT prováděna opakovaně. Radiační dávka je podle některých studií srovnatelná se zátěží u dvojkontrastní irrigografie. Podle odhadů výpočtu celoživotního rizika rakoviny při typické VCT u 50letého muže, který podstoupí VCT se toto riziko zvyšuje o 0,14 %. Protokolem s „low-dose“ CT se dá ale tato dávky výrazně snížit.
Virtuální kolonoskopie a včasný záchyt polypů: Až 80 % kolorektálních karcinomů vzniká z adenomů tlustého střeva. Maligní transformace těchto polypů trvá 10–15 roků. Přitom je známé, že polyp < 5 mm má malé riziko maligní transformace (< 0,01 %). Proto je pro časnou detekci kolorektálního karcinomu důležité zobrazit všechny polypy než 5 mm. Při virtuální kolonoskopii můžeme zobrazit polyp ze všech stran vyšetřit lze střevo i za stenózou. K hodnocení využíváme různé typy programů, z nichž některé mají funkci tzv. „CAD“, tedy automatické vyhodnocení vyšetření včetně automatické detekce polypů „počítačovým programem“ (CAD = Computer-aided detection). Kombinace virtuální kolonoskopie, hodnocení 2D CT vyšetření a využití CAD umožňuje v současné době dosáhnout senzitivitu pro diagnostiku lézí v tlustém střevě > 6 mm 96 %, pro léze > 10 mm okolo 99 %. Navíc při vlastním CT vyšetření, i když použijeme protokol low doze (nízká dávka), vyšetříme alespoň orientačně uzliny v dutině břišní a v retroperitoneu a stejně tak zachytíme parenchymové orgány. V případě podezření na patologický proces můžeme doplnit plnohodnotné CT vyšetření břicha i s intravenózním podáním kontrastní látky.
Mapa pracovišť v ČR: V současné době je v ČR 37 pracovišť, na kterých lze provést virtuální kolonoskopii. Část těchto pracovišť prošla auditem Radiologické společnosti a jsou uvedeny na mapě pracovišť, která je pro veřejnost dostupní na www.crs.cz v kolonce mapa přístrojů VZT. Informace o přípravě nemocných a o vlastním vyšetření lze též získat na adrese http://www.fnbrno.cz/nemocnice-bohunice/radiologicka-klinika/informace-pro-pacienty/t2221. Ročně se v ČR provede okolo 3000 vyšetření virtuální kolonoskopií.
Závěry: VTC je dnes plně standardizovaná metoda vyšetření tlustého střeva. Její spolehlivost a přesnost se zvyšuje s velikostí polypů. U polypů větších než 10 mm jsou výsledky plně srovnatelné a optickou kolonoskopii. Kvalitu vyšetření zvyšuje použití MDCT s nejméně 64 řadami detektorů, značení stolice perorálním kontrastem, hodnocení 2D i 3D obrazů s využitím plně automatického software (CAD) a plnění střeva automatickým insuflátorem s využitím oxidu uhličitého. Nicméně, detekce polypů menších než 10 mm a plochých polypů je horší než při optické kolonoskopii. VTC se dnes dává přednost před dvojkontrastní irrigografií.
MINIINVAZIVNÍ METODY V LÉČBĚ ČASNÉHO KOLOREKTÁLNÍHO KARCINOMU
Konvenční endoskopická resekce
Pekárek B.
Národný onkologický ústav, Bratislava, SR
Endoskopická resekcia sa za posledných 20 rokov stala jedným zo štandardných postupov v terapii premalígnych i včasných malígnych lézií tráviaceho traktu. Veľmi významný je jej diagnostický prínos, pretože nám umožnuje nielen odstránenie, ale aj histologické zhodnotenie lézie a rozhodnutie o ďalšom postupe. Konvenčnou nazývame endoskopickú resekciu pomocou endoskopickej slučky. Konvenčná ER má viacero modifikácií. Napriek preferencii endoskopických resekcií s možnosťou nasávania do cylindra v pažeráku, ev. žalúdku, je v našich podmienkach v hrubom čreve väčšinou používaná najjednoduchšia z techník bez nutnosti sliznicu nadvihovať prídavnými inštrumentáriami či nasávať do nástavca. Pôvod tejto opatrnosti je v rozdielnej hrúbke steny hrubého čreva oproti pažeráku a žalúdku, i hrúbke a tuhosti lamina muscularis propria. V pažeráku lamina muscularis propria odoláva nasatiu do pseudopolypu nad ligačným krúžkom, a preto je v tejto lokalite bezpečná endoskopická resekcia s ligátorom aj bez úvodného podpichu. Toto si však v hrubom čreve (snáď s výnimkou rekta) dovoliť nemôžeme. Z techník používajúcich štandardne prvotné nasávanie do nástavca či kanálu endoskopu našla širšie uplatnenie len takzvaná studená polypektómia, ktorú môžeme realizovať u drobných lézií (do 7 mm) nezhubného vzhľadu, spravidla 0-IIa a 0-Is. Technika „studenej polypektómie“ spočíva vo vytvorení pseudopolypu pri nasatí do kanálu na cca 5 s a následnom odstránení pripravenou slučkou rezom bez použitia elektrochirurgickej jednotky. Technika je rýchla a u malých lézií do 7 mm bezpečná. Slučka musí byť pripravená v pracovnom kanáli, lebo vytvorený pseudopolyp veľmi rýchlo zmizne. Lézie do 20 mm (podľa charakteru a uloženia) sú zväčša odstrániteľné klasickou konvenčnou ER s použitím elektrochirurgickej jednotky jedným rezom s možnosťou dobrého posúdenia laterálneho i vertikálneho okraja. Pokiaľ je lézia odstraňovaná po častiach, túto výhodu strácame. Pri tuhších léziách, ako sú neuroendokrinné tumory, môže byť zložité aj pri drobnej lézii do 1cm udržať patologicky posúditeľný bezpečný okraj a je potrebné zvážiť inú techniku odstránenia.Pred odstránením lézie je vždy na mieste endoskopické zhodnotenie vzhľadu. Dôležitá je i palpácia, pričom do 7 cm v rekte máme možnosť palpovať priamo prstom (či je lézia mäkká a pohyblivá voči stene), inak je možná palpácia inštrumentáriom (zväčša zavretými kliešťami). Je samozrejmé, že rozpadavú, tvrdú alebo ulcerovanú lézie pokladáme za malígnu. Pri hodnotení lézií sa používa štandardne Parížska klasifikácia, ktorá nám podľa typu lézie takisto napovedá o pravdepodobnosti karcinómu v lézii i možnostiach odstránenia. LST (laterally spreading tumors = do strán rastúce lézie) ešte navyše rozdeľujeme na granulárne a negranulárne. Tieto ďalej delíme na granulárne homogénne a granulárne zmiešané. Negranulárne zas delíme na elevované, pseudovklesnuté. Negranulárne pseudovklesnuté lézie sú väčšinou karcinómami, navyše majú vo svojej biologickej podstate fibrózu submukózy, a preto je na mieste zvážiť inú techniku odstránenia ako konvenčnú EMR. Naopak homogénne granulárne lézie majú veľmi nízku pravdepodobnosť výskytu karcinómu v lézii. Zväčšovacia endoskopia s chromodiagnostikou alebo NBI nám umožňujú i zhodnotenie pit pattern a povrchovej vaskulatúry lézie, čo je pre nás posledným vodidlom k suspozícii histologického záveru pred výkonom. U podozrivých a rizikových lézií s vkleslinou, mechanických prejavmi v okolitej sliznici pri lézii, pit pattern V alebo nepravidelnou či roztrúsenou vaskulatúrou môže byť prínosom EUS s využitím minisondy, ev. transrektálnej sonografie, ak je lézia v jej dosahu. Pokiaľ léziu pokladáme za odstrániteľnú, nebioptujeme ju zbytočne a už vôbec nie necielene. Je dávno dokázané, že necielené biopsie sa nemôžu porovnávať z endoskopickým hodnotením. Príkladom je štúdia Galandiuka a kolektívu zverejnená už v 80. rokoch 20. storočia, pričom pri posúdení 1400 polypov pri endoskopickej palpácii prišlo k chybe pri posúdení malígnej lézie len u 9 % lézií, naopak u necielených biopsí až 39 %. Je potrebné si uvedomiť, že biopsia samotná je nedostatočná a iba kompletná excízia umožní presné histologické zhodnotenie. Léziu bioptujeme len vtedy, ak výsledok histologického zhodnotenia môže zmeniť prístup pričom odoberáme len 1–2 biopsie z endoskopicky suspektného miesta, v ideálnom prípade na okraji lézie. Bioptizácia môže následným hojením spôsobiť neskorší „non-lifting sign.“ Čo sa týcha technickej stránky prevedenia konvenčnej EMR, okraje lézie v hrubom čreve nie je zväčša potrebné označovať pred výkonom, keďže sú spravidla dobre diferencovateľné aj počas výkonu. Podpich realizujeme najčastejšie najprv z aborálnej strany, aby neprišlo k schovaniu lézie za vytvorený vankúš, pričom je možné realizovať podpich aj cez léziu. Je možné použiť celú škálu roztokov od fyziologického, cez dextrózu, glycerol, hydroxy-propyl-metyl-celulózu a mnohé ďalšie až po kyselinu hyalurónovú, ktorá je najdrahšia. Fyziologický roztok má nevýhodu v jeho rýchlom – niekoľkominútovom vstrebaní. V našich podmienkach je všeobecne dostupným použitie niektorým z plazmaexpanderov, ktoré vydržia v submukóze mnohonásobne dlhšie ako fyziologický roztok a sú použiteľné pri predpoklade dlhšieho výkonu. Roztoky na podpich dopĺňame farbivom, u nás najčastejšie patentovou modrou. Léziu je zväčša vhodné rotáciou endoskopu na pozíciu 5–6 v pohľade endoskopistu. Pri väčších léziách je na mieste zvážiť umiestnenie prvého rez na koniec s obtiažnejším dosahom. V rekte a colon ascendens máme počas výkonu využiť možnosť práce v inverzii. Pokiaľ nám práca v inverzii umožní oveľa lepší prístup počas zložitej EMR po častiach aj v iných častiach čreva (najmä sigme či colon descendens), je na mieste i použitie gastroskopu, ktorý nám umožní práci v inverzii aj v tejto lokalite. Pri piecemeal EMR býva výhodou použitie monofilamentnej slučky a počas výkonu nadväzovať jeden rez na druhý, pričom začínať treba určite od okraja lézie (aj v prípade že hlavný nodulus či polypózna masa nie je v dosahu prvého rezu). Pred samotným začiatkom výkonu je na mieste pacienta polohovať tak, aby lézia bola na opačnej strane ako hladina tekutiny. Zabezpečíme si tak lepší a dlhší prehľad pri prípadnom masívnom krvácaní, rovnako i to, že pri prípadnej perforácii nám obsah nemusí do nej zatiecť a máme šancu ju bezpečnejšie zatvoriť. Krvácanie počas ER hodnotíme ako komplikáciu len v tom prípade, že ju nedokážeme vyriešiť endoskopicky, čo je zriedkavé. Oneskorené krvácanie sa udáva v prípade rozsiahlejších EMR zväčša 5–7 %. Perforácie sa pri konvenčnej ER vyskytujú do 0,5 %. Po piecemeal ER je vhodná kontrola jazvy po 3–12 mesiacoch, i ďalšia následná kontrola po roku. Je na mieste spomenúť najmä štúdiu autorov z nemocnice vo Vítkoviciach a Frýdku–Místku, ktorí dokázali vysoký výskyt lokálnej reziduálnej neoplazie (LRN) po odstránení LST i ošetrení argón-plazma koaguláciou (APC). Vzhľadom na obvykle nevýrazné zmeny v oblasti jazvy pri LRN i zmenu okolitej sliznice pri ošetrení APC býva výhodné rozsah LRN označiť koagulačnými značkami pred vlastným ošetrením.
Endoskopická submukózní disekce v colon a rektu
Urban O.
Centrum péče o zažívací trakt, Ostrava-Vítkovice; LF, Ostravská Univerzita v Ostravě
Endoskopická submukózní disekce (ESD) je endoskopická technika určená ke snesení povrchových lézí trávicí trubice řezem v submukóze diatermickým nožem. ESD je používána k resekci velkých (zpravidla > 20 mm) přisedlých nebo plochých lézí en bloc.
Potřebné vybavení: Diatermický nůž, injektor, roztok pro sm injekci, průhledný nástavec, coagrasper.
Provedení:
- označení okraje léze,
- submukózní injekce po obvodu léze,
- cirkulární incize,
- sm injekce pod lézi,
- submukózní disekce,
- vybavení léze a ošetření spodiny.
Metoda ESD byla popsána japonskými autory na přelomu tisíciletí. Je standardně používána k léčbě dysplazie a časného karcinomu jícnu a žaludku. V posledních letech je stále častěji používána také v kolon a rektu. V roce 2008 provádělo kolorektální ESD celkem 198 japonských endoskopických center. Z Japonska se metoda rozšiřuje na západní polokouli. V České republice byla první ESD provedena v roce 2005.
K ESD v rektu a levém tračníku používáme často gastroskop, v pravém kolon nejlépe pediatrický kolonoskop. Důvodem je větší flexibilita těchto endoskopů. Vždy používáme průhledný nástavec („cap“) pomocí kterého lze dosáhnout trakce parciálně odklopeného slizničního laloku a lepší expozice submukózní vrstvy. Standardem je insuflace CO2 místo obvyklého atmosférického vzduchu. CO2 se vstřebává asi 150krát rychleji než vzduch, což zvyšuje toleranci dlouhých výkonů pacientem a snižuje diskomfort v případě mikroperforace. Způsob analgosedace se řídí délkou plánovaného výkonu a zvyklostmi pracoviště. Označení okraje léze se provádí například jehlovým nožem nebo některým z nástrojů pro ESD. Po liftingu sliznice v okolí léze je provedena cirkulární incize vně značek. Japonští endoskopisté používají v kolon nejčastěji hook-knife. Následuje injekce pod lézi a submukózní disekce pomocí laterálně směřujících řezů zpravidla stejným nástrojem. K prevenci perforace je nůž v průběhu řezu udržován v maximálně tangenciálním postavení vůči stěně trávicí trubice. Jednotlivé nože mají různé operační vlastnosti a vyžadují různá nastavení elektrochirurgické jednotky (tab. 1).
Tab. 1 Některé nástroje k ESD a jejich charakteristiky 
Postavení ESD v colon a rektu není v roce 2013 jednoznačné. Japonská pracovní skupina pro standardizaci kolorektální ESD definovala následující indikační kritéria: Léze typu LST podtyp NG velikosti≥ 20 mm, léze se submukózní fibrózou, sporadické léze v terénu ulcerózní kolitidy a lokální recidiva po EMR.
Metoda ESD v colon je srovnávána s metodou EPMR (endoscopic piecemeal mucosal resection). Obě metody jsou určeny pro endoskopickou léčbu přisedlých nebo plochých lézí velikosti > 20mm. Hlavní výhodou EPMR je snadná technická proveditelnost, nevýhodami jsou výskyt lokální reziduální neoplazie (LRN) ve 2–21 % a nemožnost posoudit R0 resekci při histologického vyšetření.. LRN může být zdrojem invazivního karcinomu, zejména pokud nemocný neakceptuje endoskopické kontroly. Hlavní výhodou ESD je možnost en bloc resekce v 84–94 % a výskyt lokální reziduální neoplazie pouze v 0–2, 8 % případů. Nevýhodami jsou výskyt perforace v 1, 4–10 % a dlouhý operační čas. Perforace jsou většinou uzavřeny endoskopicky klipy.
Při provádění ESD je potřeba zvážit, že stěna kolon je ve srovnání s žaludkem významně tenčí. Kolonoskop se hůře ovládá a prostor k provedení výkonu je omezený. Snazší je ESD v extraperitoneálně uloženém rektu.
Závěrem lze konstatovat, že metoda ESD v colon a rektu má definované indikace. V České republice je dostupná na 3–4 pracovištích. Jedná se o jeden z nejobtížnějších výkonů terapeutické digestivní endoskopie. Vyžaduje dobře trénovaného endoskopistu a kvalitní vybavení. Zásadní je mezioborová spolupráce s chirurgem, patologem a onkologem.
Komplikace konvenční endoskopické resekcea endoskopické submukózní direkce
Cyrany J.1, Kopáčová M.2
1II. interní gastroenterologická klinika LF UK a FN, Hradec Králové2
2LF UK a FN, Hradec Králové
Komplikace koloskopických výkonů představují široké spektrum pre-, intra-, postprocedurálních a odložených příhod, které jsou různé závažnosti. Toto sdělení je zaměřeno pouze na komplikace bezprostředně související s odstraňováním časné kolorektální neoplazie převážně typu laterally spreading tumor metodami konvenční endoskopické resekce (CER) a endoskopické submukózní disekce (ESD). Intraprocedurální krvácení je většinou efektivně ošetřeno již během výkonu a za komplikaci je považujeme jen tehdy, pokud si vynutí emergentní operaci, příjem na jednotku intenzivní péče nebo převod krevních derivátů. Podobně intraprocedurální perforace je často efektivně ošetřena při výkonu. Naproti tomu perforace manifestovaná až po výkonu prakticky vždy vyžaduje chirurgické řešení. Nekompletní odstranění neoplazie je buď rozpoznáno při výkonu, a pak je indikací k operaci ve druhé době, nebo představuje zdroj rekurence, která musí být rozpoznána v rámci kontrolních endoskopických vyšetření a je většinou řešena endoskopicky (méně často chirurgicky). Možnou závažnou konsekvencí je diseminace karcinomu s hlubokou submukózní invazí. Správné zhodnocení histologických parametrů patologem (hloubka invaze, stupeň diferenciace, přítomnost angioinvaze a perineurálního šíření, nepostižené resekční okraje) je závislé na kvalitě resekátu. Jen tak můžeme odhadnout individuální riziko lymfatického postižení a vážit ho proti riziku operačního výkonu u konkrétního pacienta.
Výskyt komplikací: Volba terapeutické strategie (CER versus ESD) i způsob a kvalita provedení těchto výkonů se velmi liší geograficky (východ versus západ) i mezi jednotlivými pracovišti a endoskopisty. S vědomím této heterogenity musíme hodnotit také výsledky prezentované v literatuře.
CER: Dle Burgesse riziko intraprocedurálního krvácení při CER stoupá s velikostí léze, s charakterem 0–IIa+Is dle Pařížské klasifikace, vilózní komponentou a nízkým objemem prováděných výkonů. Klinicky významné odložené krvácení se objevuje v 6–7 % a je častější u lézí, které krvácely již při výkonu a které byly lokalizovány v pravém tračníku.
Frekvence perforací při CER nepřesahuje 2 % dle studie Masciho.
Riziko inkompletního odstranění léze při CER je odhadováno na 11 % a je vyšší u lézí již dříve ošetřovaných a lézí v oblasti ileocékální chlopně. Riziko rekurence stoupá s velikostí léze.
ESD: Repici ve svém přehledu shrnuje poznatky z 22 převážně asijských studií zabývajících se ESD v kolorektu a konstatuje incidenci odloženého krvácení 2 % a perforace 4 %. Většina těchto komplikací byla ale vyřešena endoskopicky, emergentní operace musela být indikována jen v 1 % případů a to pro perforaci. Ve 12 % nebylo možné dosáhnout kompletní resekce, ve dvou evropských studiích to bylo až 35 %. Chirurgický výkon ve druhé době byl nutný u 2 % pacientů. Pokud byla resekce označena za kompletní (R0), byla rekurence v průměrně dvouletém sledování prakticky vyloučena (0,07 %).
CER vs. ESD: Výsledky a komplikace CER a ESD srovnává v multicentrické prospektivní nerandomizované studii Nakajima: rizika odloženého krvácení nebyla rozdílná (CER 1,7 % ESD 2,2 %), procento perforací bylo vyšší v ESD skupině (CER 0,8 % ESD 2,0 %), většina komplikací byla ale zvládnuta endoskopicky, potřeba emergentní chirurgie byla v obou skupinách nízká (0,1 % CER a 0,2 % u ESD).
Prevence a terapie komplikací: Obecnou prevencí komplikací je dobrá příprava tračníku, správná volba typu endoskopu, jeho příslušenství (distální nástavec) a instrumentária, vhodná je insuflace oxidem uhličitým. Videodokumentace všech invazivních výkonů je důležitým nástrojem pro zpětnou vazbu pokud ke komplikaci dojde. Optimálním způsobem registrace komplikací je strukturovaná endoskopická databáze.
Perforace: Prevence perforace spočívá ve správném endoskopickém zhodnocení rizika hlubší submukózní invaze (velikost léze, laterally spreading tumor negranulárního typu nebo s dominantním nodulem, pit-pattern V, kvalita lifting-sign) a případně v použití endosonografie. Vysoké riziko perforace mají léze po předchozím odběru biopsií nebo po předchozí endoskopické terapii. Riziko perforace pak z velké části určuje technika vlastního výkonu – více u ESD než u CER, kde je základem přiměřená submukózní injekce a zohlednění anatomie tračníku (haustra).
Pneumoperitoneum či kapnoperitoneum vzniklé při perforaci do volné dutiny břišní je často vhodné vzhledem k diskomfortu pacienta drénovat za sterilních kautel pomocí flexily a stříkačky s tekutinou plnící roli ventilu. K uzávěru defektu můžeme využít buď klasických hemostatických klipů, kombinace klipů a odpojitelné kličky nebo klipů typu over-the-scope. Některé z těchto technik vyžadují znovuzavedední endoskopu (over-the-scope klip) nebo výměnu za dvoukanálový přístroj (klipy + odpojitelná klička). I při technické úspěšnosti endoskopického uzávěru je nutné pacienta pečlivě sledovat stran známek peritoneálního dráždění a léčit systémovými antibiotiky. Postprocedurální perforaci ve většině případů není možné řešit endoskopicky. Jen část perforací směřuje do volné peritoneální dutiny – rektum je uloženo z větší části extraperitoneálně, vzestupný a sestupný tračník je částečně uložen retroperitoneálně, i při výkonech v ostatních částech tračníku může dojít k perforaci v místě úponu mezocolon. Základem je včasná diagnostika této komplikace a její odlišení od hyperkoagulačního syndromu. Při významném klinickém podezření se nespokojíme s nálezem na nativním snímku břicha, ale provádíme počítačovou tomografii. Včasná diagnostika minimalizuje kontaminaci peritoneální dutiny a zlepšuje tak operační výsledky (možnost primární anastomózy) a snižuje riziko pooperačních komplikací.
Krvácení: Při stavění krvácení používáme nejčastěji koagulační metody. Během ESD je to vlastní disekční nástroj (nůž) v nastavení pro koagulaci u cév menšího kalibru, větší cévy je nutné koagulovat nástrojem s možností úchopu (kleště typu coagrasper nebo hot-bio-psy). Na spodině defektu po slizniční resekci je použití koagulační sondy (typu bipolární sondy) limitované vzhledem k riziku perforace při tlaku sondy do spodiny. K redukci intenzity krvácení je možné použít opich směsí s adrenalinem (limitováno v aborálním rektu, kde může dojít k významnému systémovému působení). Z mechanických technik používáme standardních hemostatických klipů, jen při významném jinak nestavitelném krvácení je možné použít za cenu nového zavedení endoskopu i klip typu over-the-scope. Spíše u krvácení z více drobnějších zdrojů lze zvážit použití sprejového hemostatika. Při selhání endoskopické terapie je možné se pokusit o angiografickou intervenci (i když s vysokým rizikem ischemického postižení části tračníku), jinak nemocného musíme indikovat k urgentní chirurgické revizi. Paralelně s úsilím o zástavu krvácení musíme hradit ztráty krevními deriváty. Riziko odloženého krvácení lze snížit profylaktickým ošetřením cév na spodině nebo uzávěrem slizničních defektů po výkonu. S cílem minimalizovat krvácení po výkonech byla publikována doporučení podávání protisrážlivé terapie. Je nutné zohlednit individuální riziko vysazení protisrážlivé terapie u konkrétního pacienta. Antiagregancia a warfarin vysazujeme před výkonem 5 dní, perorální inhibitory 48 hodin a nízkomolekulární heparin 8 hodin.
Reziduální neoplazie: Riziko reziduální neoplazie je nižší při použití ESD než při použití CER. Při použití CER je základním pravidlem snaha o systematické odstranění adenomové tkáně kličkou do zdravých okrajů. Reziduální neoplastická tkáň na spodině či v okrajích musí být aktivně vyhledávána a odstraněna, případně ošetřena argonovou plazmakoagulací. Nezbytné je endoskopické sledování po výkonu (2 a 6 měsíců) a v indikovaných případech značení místa tetováží.
Závěr: CER i ESD jsou efektivní techniky k odstranění časné kolorektální neoplazie s přijatelným rizikem komplikací. Nejvýznamnějšími komplikacemi těchto výkonů jsou odložené významné krvácení, postprocedurální perforace a systémový rozsev u karcinomu s hlubokou submukózní invazí. Velká část komplikací může být efektivně řešena endoskopicky. Frekvence komplikací endoskopické léčby časné kolorektální neoplazie je důležitým parametrem kvality endoskopisty i endoskopického centra – je totiž důležitou složkou efektivity digestivní endoskopie v boji s kolorektálním karcinomem.
Možnosti chirurgické a další léčby po selháníESD/EMR
Örhalmi J.1, Urban O.2
1Chirurgická klinika LF UK a FN, Hradec Králové
2Vítkovická Nemocnice, Ostrava
Endoskopické metody v současnosti dokážou nalézat neoplazie v jejich časných stadiích.
Rozpoznání malignity a její správná diagnostika má rozhodující vliv na další terapeutický postup a prognózu pacienta.
Riziko lymfatických metastáz je v případě slizniční neoplazie v kolorektu 0 %, při postižení submukózy se zvyšuje na 3–18 %. U T2 nádorů je riziko již 12–28 % a u T3 nádorů 36–79 %. Časné neoplazie až do stadia sm1–sm2 lze radikálně řešit endoskopicky metodami EMR, nebo EMD. Při nepříznivých formách a pokročilejších stadiích mohou být edoskopické metody nedostatečné. Stejně tak i při přítomné lymfangioinvazi. V případě selhání endoskopických metod je nutné zvolit optimální postup vhodný pro daného pacienta. Zde je nutná spolupráce gastroenterologa, chirurga, patologa a onkologa. PO zvážení celkového stavu pacienta a možných rizik operačního řešení, které lze předběžně stanovit pomocí skórovacích algoritmů P-POSSUM a Cr POSSUM je určen další postup. Při T1 tumoru bez lymfangioinvaze je metodou volby transanální endoskopická mikrochirurgie – TEM, nebo transanální miniinvazivní chirurgie – TAMIS. Výkon lze provést radikálně s minimální morbiditou ve srovnání s resekčním výkonem. I při vyšším výskytu lokálních recidiv je pětileté přežívání srovnatelné s resekčními výkony. Resekční výkony jsou indikované pro vyšší stadia nádorového onemocnění, ale jsou zatíženy vyšší pooperační morbiditou – 19–30 % a nezanedbatelnou 30denní pooperační letalitou 0,9–3 % Nutno vzít v potaz i zhoršenou kvalitu života při zhoršené kontinenci pro stolici, nebo při provedení amputačního výkonu s trvalou kolostomií. Při přítomné lymfangioinvazi a vyšších stadiích – T2 je indikovaný resekční výkon, protože riziko možné recidivy a lymfatického postižení je již vyšší, než předpokládaná pooperační morbidita. V případě vysoce rizikových pacientů, nebo u pacientů odmítajících operační řešení lze i zde zvolit lokální terapii v kombinaci s neoadjuvantní chemoradioterapii. I zde pak lze dosáhnout velmi dobrých výsledků.
Optimální postup je nutné nastavit na konkrétního pacienta v kooperaci s gastroenterologem, patologem a onkologem a samozřejmě s pacientem. Lze tak vytěžit maximum z miniinvazivních technik při zachování nižšího rizika pooperačních komplikací a zároveň při uspokojivém riziku možné lokoregionální recidivy. Při vzniku recidivy lze pak postupovat principem salvage surgery opět multidisciplinárně.
CO BY MĚL PRAKTICKÝ LÉKAŘ VĚDĚT O DISPENZARIZACI PACIENTŮ S KOLOREKTÁLNÍM KARCINOMEM
Vysokorizikové skupiny kolorektálního karcinomu a jejich dispenzarizace
Frič P.
Interní klinika 1. LF UK a ÚVN a Vojenské fakultní nemocnice, Praha
Úvod: Vysokorizikové skupiny kolorektálního karcinomu (KRK) zahrnují 20–25 % všech nemocných s touto chorobou. Tito nemocní vyžadují dlouhodobé odborné sledování (dispenzarizaci), na němž se podílí řada lékařských oborů. Dispenzarizace (surveillance, follow-up) je tzv. terciární prevence a tento termín je třeba odlišovat od screeningu, což je metoda sekundární prevence u bezpříznakových osob, které jsou nositelem nízkorizikového faktoru, jímž je v případě KRK věk nad 50 let u obou pohlaví. Cílem dispenzarizace je zjistit riziko, zhodnotit jeho závažnost a léčit se stejnými výstupy jako u sekundární prevence, tj. snížit morbiditu, mortalitu a zlepšit kvalitu života.
Vysoké riziko je způsobenou vrozenou a dědičnou změnou genomu (obě adenomové polypózy, Lynchův syndrom nebo nutností dlouhodobého sledování prekancerózy (některé adenomy, idiopatický střevní zánět) nebo KRK samotného.
Tab. 1 Vysokorizikové skupiny KRK 
Úloha praktického lékaře
Praktický lékař má v dispenzarizaci KRK specifickou a významnou úlohu podobně jako ve screeningu. Tato úloha má tři složky:
1. Podrobná rodinná a osobní anamnéza u všech osob, u nichž má podezření na nádor střeva.
Při podezření na tuto diagnózu u osoby do 50 let se pravděpodobnost familiární (hereditární) etiologie zvyšuje.
Ve všech případech podezření na KRK má anamnéza praktického lékaře obsahovat podrobnou osobní anamnézu pacienta a rodinnou anamnézu jeho příbuzných 1. stupně (rodiče, sourozenci, děti) i 2. stupně (prarodiče, strýcové a tety) zaměřenou na výskyt karcinomu kolorekta i jiných lokalizací a jeho prekanceróz.
Výstup této činnosti: Praktický lékař může jako první vyslovit podezření na některou z vysokorizikových forem KRK.
2. Časné příznaky KRK: Není jím pouze enteroragie a laboratorní nález mikrocytové anémie. Patří k nim dále: nedávná změna vyprazdňovacího rytmu střeva ve smyslu zácpy nebo střídání zácpy a průjmu, úbytek tělesné hmotnosti a dalších příznaků anemického syndromu, např. námahové dušnosti. Symptomy KRK se rovněž liší podle lokalizace a také v tomto směru je třeba anamnézy využít.
Příznaky KRK: pravý tračník – anémie, úbytek tělesné hmotnosti, někdy hmatná rezistence; levý tračník – poruchy pasáže, enteroragie; konečník – hlen s krví, tenesmy.
Bolest při KRK je vzácným příznakem u mladých osob s FAP.
3. Praktický lékař má být spojovacím článkem mezi pacientem a jednotlivými specialisty, kteří mají v programu vyhrazeny dílčí úkoly a zároveň monitorem doporučeného časového plnění jednotlivých částí dispenzárního programu.
Poznámky k vysokorizikovým formám KRK: Pro stanovení stupně rizika a intervalů dispenzárních kontrol ve všech skupinách má zásadní význam kvalita první kolonoskopie, dokonale čisté střevo a pečlivá aspekce střevní sliznice při zpětném postupu kolonoskopem.
Familiární adenomová polypóza (FAP): Je způsobena mutacemi APC genu (adenoma polyposis gen) lokalizovaného na 5. chromozomu. Tento gen je regulátorem homeostázy kolonocytu: buněčné proliferace, migrace, diferenciace a apoptózy. Dědí se autozomálně dominantně. Postižený jedinec se rodí s jednou mutací (germinativní) od jednoho z rodičů. Mutace spočívá v tom, že předčasně končí transkripce příslušné DNA, takže generovaný protein je neúplný, zkrácený a nefunkční. Fenotypem tohoto stavu jsou benigní adenomy, které se manifestují nejčastěji mezi 10.–16. rokem (nejdříve v levém tračníku – nejčastěji v sigmoideu). Adenomy jsou často asymptomatické. Karcinogeneze (maligní zvrat) začíná poškozením normálního genu (tzv. somatické alely) od druhého rodiče. K tomu dochází nejčastěji mezi 30.–40. rokem a to ve 100 %. Presymptomatická diagnóza FAP je proto nezbytností.
Sedmdesát pět procent nemocných FAP má v rodinné anamnéze polypy a/nebo KRK u příbuzných ve věku do 40 let.
Výskyt FAP v různých populacích se významně liší (1 : 5000 až1 : 30000). Rozeznávají se dvě formy: FAP: klasická (> 100 adenomů, pravidelné postižení rektosigmoidea) a atenuovaná (20–100 adenomů, více v pravém tračníku, maligní zvrat přibližně o 10 let později).
Dispenzární program má tři části: 1. genetická konzultace, 2. genetické testování (určení mutace), 3. endoskopická dispenzarizace: kolonoskopie, sigmoidoskopie v intervalu 1 roku od 10–12 let s odstraněním všech polypů (> 10 mm), pokud není indikováno bezprostřední chirurgické řešení.
MUTYH–asociovaná polypóza: Je způsobena mut-Y-homolog genem na 1. chromozomu. Tento gen kóduje enzym MYH glykosilázu, která opravuje chyby při replikaci DNA. Jeho mutace působí hromadění chybných sekvencí DNA a při postižení signální dráhy APC genu dochází k tvorbě adenomů. Tato polypóza se dědí autozomálně recesivně. Rodinná anamnéza je většinou negativní. Nemocní jsou symptomatičtí od věku 45 let výše. Kolorektální adenomy jsou v počtu 10–100, někdy i více a až u 20 % se zjistí také adenomy duodena. Na tuto polypózu je možno pomýšlet při adenomové polypóze s negativní mutacíAPC-genu. V takovém případě je vhodné doporučit genetické testování mutací MYH-genu.
Hereditární nepolypózní KRK (HNPKK), synonymum Lynchův syndrom(LS): Tento syndrom je způsoben vrozenými mutacemi genů (tzv. mismatch repair genů MMR), které řídí syntézu enzymů opravujících chyby při replikaci DNA. Tento jev se označuje jako mikrosatelitní nestabilita (MSI). Tyto mutace jsou časté, ale významně nejčastější jsou mutace hMLH1 a hMSH2, které se vyskytují u 90 % nemocných Lynchovým syndromem. Tento se dělí na Lynchův syndrom I (familiární karcinom kolorekta) a Lynchův syndrom II (HNPKK se vyskytuje společně s jinými karcinomy gastrointestinálními i dalších lokalizací).
Klinická kritéria LS se označují jako Amsterdamská kritéria II:1. tři příbuzní postižení karcinomem (KRK, tenké střevo, endometrium, močovod, ledvinová pánvička a jiné), 2. jeden nemocný je příbuzným 1. stupně dvou jiných nemocných, 3. karcinom postihuje dvě nebo více generací, 4. diagnostika KRK ve věku pod 50 let u jednoho nebo více příbuzných, 5. FAP je vyloučena u všech postižených.
Dispenzární program má tři části podobně jako u FAP: 1. genetická konzultace, 2. genetické testování mutací MMR genů, 3. endoskopická dispenzarizace. Tato se provádí u osob s genetickou nebo klinickou diagnózou LS a u osob s podezřením na LS. Její náplní jsou kolonoskopie v 1–2letém intervalu od 20–25 let věku nebo od věku o 10 let nižšího, než je věk nejmladšího pacienta s KRK v LS-rodině. Cílem je časná terapie KRK a adenomů.
Adenom/KRK v rodinné anamnéze: Tato skupina je početná. Relativní riziko (RR) činí 1,5–4,2 podle příbuzenského stupně.
Při nálezu jednoho příbuzného 1. stupně s KRK nebo adenomem ve věku pod 60 let nebo dvou příbuzných 1. stupně s KRK bez věkové hranice se doporučuje kolonoskopie od 40 let věku v 5letém intervalu nebo od věku nižšího o 10let než je věk nemocného s časnějším KRK nebo adenomem.
Při nálezu jednoho příbuzného 1. stupně s KR–CA nebo adenomem ve věku nad 60 let nebo dvou příbuzných 2. stupně se doporučuje test na okultní krvácení ve stolici (TOKS) od 40 let věku.
Při nálezu jednoho příbuzného 2. stupně nebo jakéhokoliv počtu příbuzných 3. stupně se doporučuje TOKS od 50 let věku (tj. program průměrného rizika).
Adenom v osobní anamnéze: Doporučené postupy zohledňují v této situaci míru rizika, kterou jednotliví autoři posuzují rozdílně. Hlavní doporučení lze shrnout do těchto bodů:
Nemocní s jedním nebo dvěma adenomy do 10 mm v průměru a s lehkou dysplazií mají mít další kolonoskopii za 5 let. Přesnější určení termínu závisí na dalších údajích (nález při předchozích endoskopiích, rodinná anamnéza).
Pacienti s 3–4 adenomy nebo s jakýmkoliv adenomem 10 a více mm, vilózní strukturou nebo těžkou dysplazií mají mít kontrolní kolonoskopii za 3 roky za předpokladu, že adenomy byly odstraněny úplně. Jestliže kontrolní kolonoskopie prokáže jen 1–2 tubulární adenomy s lehkou dysplazií, může být interval další endoskopie prodloužen na 5 let.
Odstranění více než pěti adenomů do 10 mm nebo jednoho adenomu více než 20 mm vyžaduje kontrolní kolonoskopii za 1 rok. Při odstranění více než 10 adenomů je třeba uvážit možnost familiární formy KR-CA (FAP, HNPKK).
Přisedlé polypy odstraněné piece-meal technikou vyžadují kontrolní kolonoskopii v krátkých intervalech (2–6 měsíců) k ověření úplnosti výkonu; další sledování po jejím dosažení závisí na úvaze endoskopisty.
Intenzivnější dispenzarizace se doporučuje při rodinné anamnéze vzbuzující podezření na HNPCC.
Pacienti s malými hyperplastickými polypy rekta nevyžadují zvláštní dispenzární program. Výjimkou jsou pacienti se syndromem hyperplastické polypózy.
KRK v osobní anamnéze: Dispenzarizace sleduje detekci časných recidiv primárního nádoru ve fázi umožňující kurativní výkon a detekci metachronních nádorů (adenomu, karcinomu).
U nemocných s KR-CA se doporučuje v perioperačním období diagnostika a terapie všech synchronních polypů. U neobstrukčních nádorů lze obojí provést předoperační kolonoskopií. U obstrukčních nádorů se doporučuje předoperační diagnostika změn nad zúžením CT-kolonografií a pooperační kolonoskopická polypektomie do 3–6 měsíců po chirurgickém výkonu, pokud nejsou přítomny neresekovatelné metastázy.
Po kurativní resekci karcinomu tračníku nebo rekta se doporučuje kolonoskopie za 1 rok po chirurgickém výkonu (popř. za 1 rok po pooperačním odstranění synchronních polypů).
Jestliže je tato normální, doporučuje se interval 3 let před další kolonoskopií a v případě normálního nálezu je vhodná další endoskopie za 5 let.
Kratší intervaly kolonoskopií po endoskopickém vyšetření za 1 rok jsou nutné při HNPKK a jestliže takový postup vyžadují zjištěné adenomy.
Po nízké přední resekci rekta se doporučují během 2–3 roků po výkonu opakované rektoskopie (rigidní nebo flexibilní) nebo rektální endosonografie v intervalu 3–6 měsíců k zjištění lokální recidivy, která je významně častější než po resekci karcinomu tračníku. Tato vyšetření jsou nad rámec výše uvedených kolonoskopií doporučených k detekci metachronních lézí.
Idiopatický střevní zánět (ulcerózní kolitida (UK), Crohnova nemoc (CN)) v osobní anamnéze: Identifikace rizikových nemocných ISZ vyžaduje dispenzární program k časné diagnostice nádorového procesu. Nejvýznamnější marker souběžného nebo pozdějšího KR-CA při ISZ je dysplazie, tj. nádorová přeměna epitelu bez postižení slizniční proprie.
Dispenzarizace se doporučuje při UK s postižením levé poloviny kolon nebo s pankolitidou a při CN s postižením alespoň jedné třetiny tračníku. U všech nemocných s ISZ je indikována 8 let od objevení příznaků ileokolonoskopie k určení aktuálního rozsahu zánětlivých změn. Dispenzarizace se zahajuje 8–10 roků trvání příznaků u nemocných s postižením více než poloviny tračníku, 15 let u ostatních. Základní metodou dispenzární kolonoskopie jsou etážové biopsie ze všech čtyř kvadrantů střevní sliznice celého tračníku v intervalu 10 cm a histologické vyšetření všech biopsií. Při první negativní kolonoskopii se vyšetření opakuje v intervalu 1–2 let. Při negativitě této druhé kolonoskopie je možné interval rozšířit až na 3 roky. Po 20 letech trvání choroby se interval opět zkracuje na 1–2 roky. Kolonoskopie se provádějí v klidové fázi bez aktivního zánětu a reaktivních změn, které mohou interferovat s histologickým hodnocením dysplazie.
Nález těžké dysplazie (HGD) nebo multifokální lehké dysplazie (LGD) je indikací k profylaktické proktokolektomii. Při neurčité dysplazii se doporučuje druhé čtení a opakování kolonoskopie za 3–6 měsíců. Podobně se postupuje při nálezu jednoho plochého ložiska LGD. Při nálezu ploché nebo vyvýšené léze bez ohraničení k okolí (DALM) se doporučuje proktokolektomie, neboť karcinom je přítomen až u poloviny nemocných s tímto nálezem. Při lézi podobné adenomu (ALM) se doporučuje kompletní resekce včetně báze a vícečetné biopsie okolní sliznice. Při negativní dysplazii v této lokalizaci následují další kolonoskopie v intervalu 6 měsíců, při pozitivní dysplazii chirurgická terapie.
Dispenzarizace nemocných ISZ dovoluje časnější diagnózu a lepší prognózu asociovaného KR–CA, snižuje jeho riziko a je přijatelná v pojmech náklady – účinek.
Závěr: Dispenzární programy jsou v praxi využívány nedostatečně často a jsou různě modifikovány co do obsahu i frekvence dispenzárních kontrol. Jejich standardizace a široká aplikace může významně zlepšit ukazatele efektivity dispenzárních programů (náklady – účinek i náklady – užitek).
Včasná diagnostika nádorů kolorekta z perspektivy primární péče – strategie a kapacity
Seifert B.1, Dušek L.2, Májek O.2
11. LF UK, Praha
2Institut biostatistiky a analýz MU, Brno
Východisko: V České republice je organizován program screeningu kolorektálního karcinomu (KRK) od roku 2000 v současné metodice, uvedené ve Věstníku MZ ČR č. 01/2009 (s. 20–23)1: Standard při poskytování a vykazování výkonů screeningu nádorů kolorekta v ČR. Změna byla zavedena s cílem oživit stagnující program, ve kterém účast nepřesáhla 20 % a jehož efektivita nebyla uspokojivá. Nová metodika, kromě každoročního testování ve věkovém intervalu 50–55 let, uvedení imunochemických testů a screeningové kolonoskopie jako volby v 55 letech, zapojila do screeningu testem na okultní krvácení ve stolici (TOKS) vedle všeobecných praktických lékařů (VPL) také ambulantní gynekology (AG).
Adherenci občanů k preventivním programům a preventivním i dispenzárním prohlídkám zvyšuje jejich zvaní; poštou, elektronicky, telefonicky nebo prostřednictvím krátké textové zprávy. Nejvyšší účasti ve screeningových onkologických programech dosahují země, které organizují „cílené zvaní“ z občanských nebo pojištěneckých registrů.
Předmětem sdělení je hodnocení kapacit a hledání strategií po předpokládaném efektu zavedení adresného zvaní ve screeningu KRK.
Metodika: Informace o aktivitách poskytovatelů primární péče v rámci screeningu kolorektálního karcinomu jsou získávány přes pojišťovny, které předávají vybrané kódy Národnímu referenčnímu centru, které je agreguje a k centrálnímu vyhodnocení poskytuje Institutu biostatistiky a analýz Masarykovy univerzity (IBA MU). Na základě analýz a předpokladů, vypracovaných IBA MU, autoři sdělení hodnotí kapacity pro rozvoj českého screeningu KRK a zvažují strategie pro jeho optimalizaci v podmínkách adresného zvaní.
Výstupy screeningu po roce 2009: Od roku 2010 je patrná stagnace, která naznačuje, že oportunní program dosáhl svého limitu, který nebude překročen bez zavedení adresného zvaní. Současné pokrytí je 25 % cílové populace nad 50 let, resp. zhruba 30 % v mezinárodně srovnatelné skupině 60–69 let. Ke zvýšení pokrytí došlo ve všech okresech ČR, nicméně variabilita přetrvává. V roce 2011 sice došlo k nárůstu screeningových kolonoskopií (4235), ale celkový podíl kolonoskopií na screeningových intervencích klesl o 0,5 %. Z toho vyplývá, že pro rozvoj screeningu v ČR je perspektivní spíše program dvoustupňový, s úvodním TOKS.
Pozitivita TOKS roste od roku 2007 napříč regiony, v důsledku postupného, od roku 2012 již jednoznačného přechodu na používání imunochemických testů s vyšší citlivostí. V roce 2011 činila průměrná míra pozitivity 6,7 %.
Co můžeme očekávat ve screeningu v ČR: Do konce roku 2013 očekáváme zavedení adresného zvaní. Podle zahraničních zkušeností lze očekávat efekt navýšení účasti ve screeningu o 10–30 %. Zároveň lze předpokládat další nárůst pozitivity TOKS při používání citlivějších imunochemických testů, s cut-off 75–100 ng/ml. Vyšší počet a vyšší pozitivita TOKS znamenají více odeslaných osob na kolonoskopické vyšetření.
Teoretické 30 % navýšení TOKS znamená pokrytí zhruba 35 %. Za této situace se v ČR navýší počet kolonoskopií o 9671 ročně, tj. o 4 %.
Třináctiprocentní pozitivita TOKS se dá zhruba očekávat přicut-off 75 ng/ml.
Při 30 % navýšení a 13 % pozitivitě by byl požadavek 90 000 preventivních kolonoskopií ročně, tj. trojnásobný nárůst preventivních kolonoskopií a o 40 % nárůst kolonoskopií vůbec.
V každém centru by pak bylo potřeba provést o tři kolonoskopické výkony denně navíc. Přitom již dnes dochází k prodlužování čekací doby na kolonoskopii nad 6 týdnů, což je obecně považováno za hranici udržení compliance pacientů s pozitivním TOKS.
Varianty řešení: Věkové omezení screeningu se nejeví pro českou populaci jako vhodné. Navýšení kapacit anglosaským způsobem (endoskopující sestry) je v ČR neprůchodné a výchova nových gastroenterologů je zdlouhavý proces.
Situace je výzvou jak pro lékaře primární péče, tak pro gastroenterology. Možnosti jsou v optimalizaci indikací ke kolonoskopii u symptomatických pacientů v nízkém riziku (např. funkční poruchy u mladších osob) a v racionalizaci dispenzarizace pacientů po kolonoskopii. Studie z primární péče prokázaly, že hodnocení podle příznaků má omezenou spolehlivost, a to včetně příznaků, které hodnotíme jako alarmující. Do budoucna bude třeba hledat spolehlivější markery pro stanovení priorit k výběru pacientů pro včasnou kolonoskopii. Podle literárních údajů se slibně jeví kombinace imunochemického TOKS a fekálníM2-pyruvát kinázy.
Podle analýzy více než 100 závěrů kolonoskopických vyšetření s biopsií byl interval pro kontrolní vyšetření ve více jak polovině případů kratší (v řádech let), než odpovídá současným doporučením.
Závěr: Z uvedeného vyplývá, že efekt zavádění adresného zvaní je třeba pečlivě monitorovat. Do budoucna je třeba volit TOKS a jeho cut-off s ohledem na kapacity, zajištění kvality a bezpečí. Při dispenzarizaci kolonoskopovaných osob je třeba dodržovat doporučení. Edukace VPL v oblasti gastroenterologie musí zohlednit potřebu optimalizace indikací k endoskopii.
Kolonoskopie: dispenzarizace pacientů po endoskopické terapii, trendy a strategie
Suchánek Š.1, Seifert B.2, Frič P.1, Zavoral M.1
1Interní klinika 1. LF UK a ÚVN, Praha
2Ústav všeobecného lékařství 1. LF UK, Praha
Kolorektální karcinom (KRK) je druhé nejčastější nádorové onemocnění, jehož výskyt stoupá zejména v rozvinutých zemích. V roce 2010 byl v ČR KRK diagnostikován u 8265 osob a 3991 pacientů na tuto malignitu zemřelo. Přestože je v posledních letech pozorován pozitivní trend snižování mortality (možný vliv 13 let trvajícího screeningového programu), tak i nadále je KRK diagnostikován v pokročilých stadiích. Predikce na rok 2013 předpokládají záchyt 2222 pacientů ve stadiu III a 2177 pacientů ve stadiu IV, což představuje 25,4 %, resp. 25,3 % ze všech pacientů s diagnózou KRK.
Je známou skutečností, že KRK je nádor dobře ovlivnitelný prevencí. Primární prevence spočívá v úpravě životosprávy a jídelníčku. Sekundární prevence je zaměřena buď na vyhledávání a časnou diagnostiku onemocnění u bezpříznakových jedinců starších 50 let (screening, depistáž), nebo na dlouhodobé sledování vysokorizikových skupin chorob, tedy osob s pozitivní rodinnou či osobní anamnézou kolorektální neoplazie nebo déletrvajícího nespecifického střevního zánětu (dispenzarizace, surveillance, follow-up). Osobní anamnézou se rozumí stav po operaci pro KRK nebo po endoskopickém odstranění adenomového polypu. Surveillance probíhá formou dispenzárních kolonoskopií, které se provádějí v pravidelných intervalech. Jejich cílem je záchyt rekurentních adenomů, jejich odstranění, a tím přerušení kancerogeneze KRK.
Intervaly dispenzárních kolonoskopií vychází z odborných doporučení. V roce 2010 byla publikována obsáhlá Evropská guidelines pro screening a diagnostiku KRK, vypracovaná na základě principu evidence based medicine. Součástí těchto doporučení je i schéma intervalů dispenzárních kolonoskopií, které bylo adaptováno pro účely této studie. Pacienti jsou zde rozděleni (dle počtu, velikosti a histopatologické charakteristiky adenomových polypů) do tří skupin určující míru rizika (nízké, střední a vysoké riziko) vzniku KRK. Klíčovým intervalem sledování jsou jeden až tři roky, během kterých je dispenzární kolonoskopie indikovaná u pacientů se středním (3 roky) a vysokým rizikem (1 rok).
dokončení v příštím čísle
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek KOMPENDIUM STOMATOLOGIE IČlánek WERNER ARBER
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Přerušovaný půst může mít významná zdravotní rizika
- Tři jsou více než jeden: Kombinace 3 vitaminů skupiny B prodlužuje délku neuritů
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
-
Všechny články tohoto čísla
- Přístrojový přístup k personalizaci medicíny (vyšetření u pacienta, Point of Care Testing)*
- CREATIVE DESTRUCTION OF MEDICINE
- Perspektivy farmakoterapie obezity*
- Současné možnosti a perspektivy léčby akromegalie*
- Upozornění na blížící se mezinárodní kongres
- Rezistence na tyreoidální hormony*
- Současné možnosti non-orální estrogen-progestinové antikoncepce
- Dobrá smrt: eutanazie očima studentů medicíny
- KOMPENDIUM STOMATOLOGIE I
- Vareniklin: bezpečná léčba závislosti na tabáku u kardiovaskulárních pacientů
- Plánované akce složek ČLS JEP
- Příspěvek k dějinám farmakologie (období raného římského císařství)
- Plánované akce složek ČLS JEP
- Kolorektální karcinom (část 2)
- Zdánlivá smrt někdy zachraňuje život
- Léčba v psychiatrii z pohledu léčby závislosti na tabáku
- Zirmův olomoucký diskuzní den
- Profesor Vratislav Schreiber devadesátiletý
- Doc. MUDr. Vojtěch Hainer, CSc., sedmdesátníkem
- Odešel plk. v.v. doc. MUDr. Pavel Petýrek, CSc.
- WERNER ARBER
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Rezistence na tyreoidální hormony*
- Kolorektální karcinom (část 2)
- Doc. MUDr. Vojtěch Hainer, CSc., sedmdesátníkem
- Dobrá smrt: eutanazie očima studentů medicíny
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání