-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Současné poznatky o vztahu spánku a obezity
The relationship between sleep and obesity: current perspective
Disruption of circadian rhythms negatively affects regulation of metabolism and energy homeostasis. Disrupted metabolism in response to disrupted biological rhythms might lead, together with genetic background, to obesity and to other health complications. Results of epidemiologic surveys are consistent with mechanistic theory showing the interconnection between the biological rhythms, sleep and metabolism. Epidemiologic surveys confirm that sleep duration of less than 6 hours increases significantly the risk of obesity. Systematic reviews of epidemiologic surveys examining association of sleep and obesity refer to large heterogeneity in involved subjects, methodological approaches of measuring obesity and sleep, and confounders. Design of study plays also essential role in interpretation and definition of causal relationship. Reduced sleep duration in relation to obesity is in the literature discussed from different points of view: 1. as a possible primary cause of obesity, 2. as a result of comorbidities resulting from obesity and 3. as an accompanied part of the third factor contributing to obesity (e.g. long working hours, chronic emotional stress, overusing of media). Causal relationship between sleep and obesity is not yet fully elucidated, however the association is supposed to be bidirectional. The article gives an overview of current knowledge concerning the influence of sleep on the development of obesity and points to the critical points of current research.
Key words:
sleep, sleep duration, obesity, body mass index.
Autoři: Zlata Piskáčková; Martin Forejt; Lucie Martykánová
Působiště autorů: Masarykova univerzita v Brně, Ústav preventivního lékařství, Lékařská fakulta
Vyšlo v časopise: Čas. Lék. čes. 2012; 151: 279-285
Kategorie: Přehledové články
Souhrn
Narušení biologických rytmů nepříznivě ovlivňuje regulaci metabolismu a energetickou rovnováhu. Změny v metabolismu vyvolané narušenou cirkadiánní aktivitou mohou v závislosti na genetickém pozadí přispívat k rozvoji obezity a dalších zdravotních komplikací. Většina epidemiologických studií prezentuje závěry shodné s mechanistickým modelem o vzájemném propojení biologických rytmů, spánku a metabolismu. Studie potvrzují, že zvláště krátké trvání spánku v délce < 6 hodin zvyšuje signifikantně riziko rozvoje obezity. Systematické přehledy, které zahrnují epidemiologické studie zabývající se vztahem spánku a obezity, nicméně poukazují na rozdíly v cílových souborech, v použitých metodikách pro měření spánku a obezity a v zahrnutých spolupůsobících faktorech. Interpretace a hodnocení kauzálních vztahů se odvíjí také od typu studie. Redukovaná délka spánku ve vztahu k obezitě je v publikacích diskutována ze tří hledisek: 1. jako možná primární příčina obezity, 2. jako důsledek komorbidit vyplývajících z obezity a 3. jako doprovodný jev jiného spolupůsobícího faktoru, který přispívá k obezitě (např. dlouhá pracovní doba, chronický emocionální stres, nadužívání medií). Kauzalita vztahu mezi spánkem a obezitou není dosud zcela objasněna, převažují však názory o obousměrné interakci. Příspěvek podává aktuální přehled poznatků týkajících se vlivu spánku na rozvoj obezity a poukazuje na kritická místa dosavadních výzkumů.
Klíčová slova:
spánek, délka spánku, obezita, body mass index.Úvod
V posledním desetiletí vzniklo nebývalé množství studií, které svou pozornost zaměřily na úlohu spánku v rozvoji obezity. Průřezové a longitudinální studie zkoumají asociaci mezi nedostatečnou délkou spánku a obezitou na populační úrovni. Laboratorní studie sledují mechanismy, jakými nedostatek spánku přispívá k nárůstu hmotnosti, na jednotlivcích či v malých souborech. V experimentech na zvířatech je pozornost soustředěna zejména na cirkadiánní rytmy a jejich význam v regulaci metabolických procesů a v udržování energetické rovnováhy.
Východiskem pro tyto výzkumy se stal dlouhodobý trend nárůstu prevalence obézních jedinců doprovázený postupným zkracováním obvyklé délky spánku, popsaný trend se vztahuje k období uplynulých 50 let. Příkladem mohou být Spojené státy americké, ve kterých prevalence obézních jedinců podle studie NHANES stoupla z 13,4 % v roce 1960–1962 na 34,3 % v roce 2007–2008 (populace ve věku 20–74 let) (1). Současně s tím se za období 1959–2009 zkrátil spánek z obvyklých 8–9 hodin za noc (2) na průměrných 6,7 hodin za noc (3). Moderní společnost prošla za posledních pět dekád výraznou proměnou ve více ohledech. Mezi nejvíce dominující proměny patří rapidní snížení pohybové aktivity a fyzické zátěže, neomezená dostupnost energeticky bohatých potravin a dobrovolné zkracování doby spánku díky umělému osvětlení.
Existence umělého osvětlení umožňuje sociální život, práci, zábavu (včetně sledování televize a užívání počítače) i v nočních hodinách, ovšem tento „přínos“ je za cenu narušení přirozených rytmů bdění a spánku a zkrácení optimálního trvání spánku (4).
Spánek je jednou ze základních fyziologických potřeb. Při jeho nedostatku byla zjištěna častá asociace nejen s obezitou, ale také s častějším výskytem metabolického syndromu, hypertenze, diabetes mellitus 2. typu, depresí a zvýšenou mortalitou (5, 6). Spánek je důležitý pro správnou funkci fyziologických pochodů, jakými jsou sekrece hormonů, metabolismus, imunita, kognitivní funkce a řada dalších. Důsledky spánkové deprivace na úrovni jednotlivých systémů je možné zhlédnout v tabulce 1.
Tab. 1. Důsledky spánkové deprivace na úrovni jednotlivých systémů 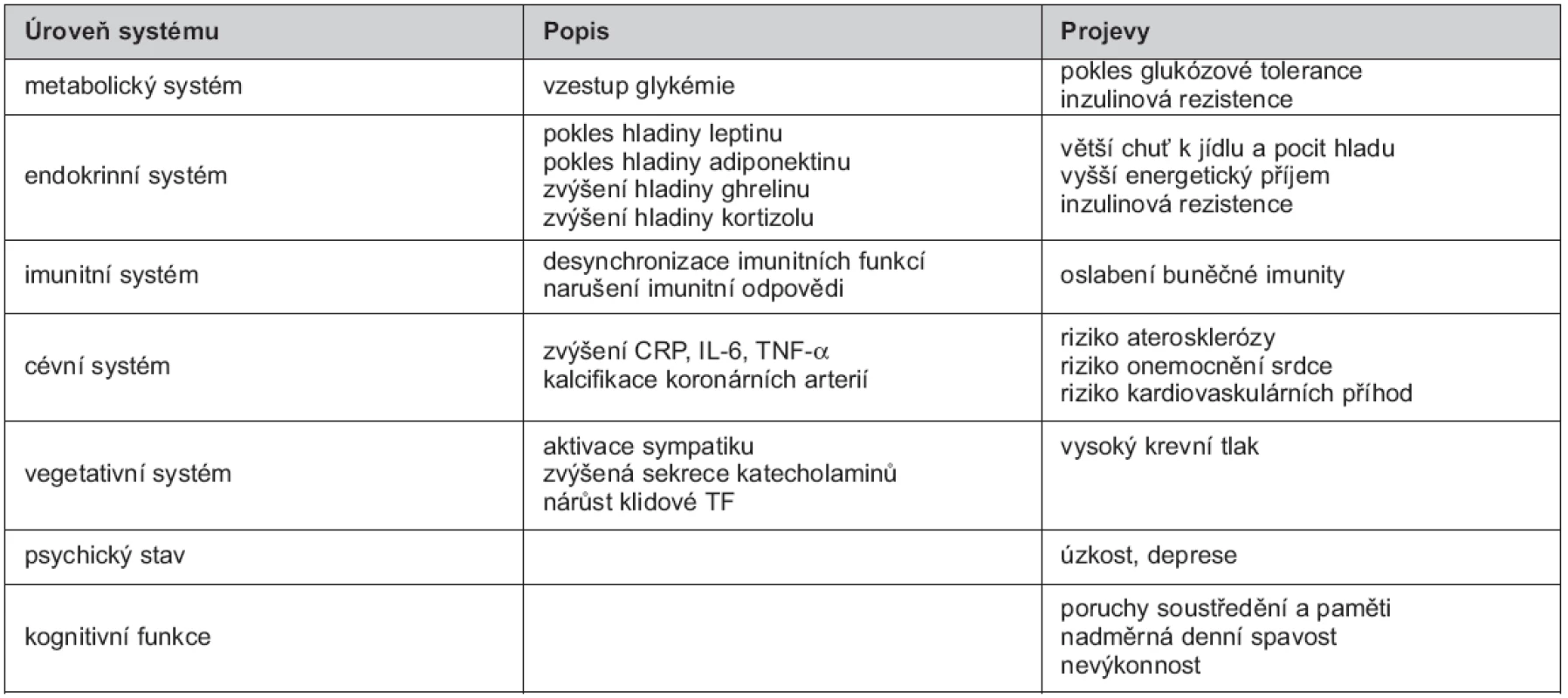
Použité zdroje: Knutson KL, et al. (2), Grandner MA, et al. (6), Nevšímalová S, et al. (13), Gangwisch JE. (20), Bollinger T, et al. (40), King CR, et al. (41), Mezick EJ, et al. (42), Padilha HG. (46) Obezita je chronické onemocnění multifaktoriální etiologie charakterizované zmnožením tukové tkáně v důsledku pozitivní energetické rovnováhy (7). Individuální odchylky v predispozici akumulovat tuk na základě pozitivní energetické bilance vykazují poměrně silnou genetickou podmíněnost. Běžná, polygenní obezita se rozvíjí na podkladě vzájemné interakce mezi biologickými (geny, hormony, neurotransmitery), psychobehaviorálními a environmentálními faktory. Vzájemné působení těchto faktorů má vliv na výslednou akumulaci tuku, rozložení tuku a přítomnost zdravotních rizik spojených s obezitou (7).
V rámci preventivních i intervenčních programů se bohužel stále nedaří efektivně snižovat prevalenci obezity, zejména u dospělých. Pozornost se proto obrací také na spánek jako možný příčinný faktor. Souhrnný článek si klade za cíl podat přehled současných důkazů o asociaci spánku s obezitou.
Biologické rytmy
Aby organismus správně fungoval v souladu s okolními podmínkami, je nutné, aby byl se zevním prostředím synchronizovaný. K tomu účelu byly u všech živých organismů vyvinuty biologické rytmy. Tyto oscilace, s periodou roční, měsíční nebo denní, umožňují předjímat mnoho fyziologických a behaviorálních mechanismů. Díky získané schopnosti předjímat stimuly zevního prostředí je organismus schopný efektivně organizovat buněčné procesy a koordinovat rytmy v pravý čas, což je podstata adaptace na změny prostředí (8).
Cirkadiánní rytmy jsou biologické pochody konstantně se opakující v přibližně 24hodinové periodě. Jsou tvořené endogenními generátory, které zahrnují centrální hodiny lokalizované v suprachiasmatických jádrech (SCN z anglického suprachiasmatic nuclei) v hypotalamu a periferní hodiny přítomné ve všech ostatních buňkách (8). Cirkadiánní hodiny jsou synchronizované ve shodě s periodickými změnami nastávajícími v prostředí. Hlavním synchronizátorem vnitřních cirkadiánních hodin je sluneční světlo, které determinuje přesně délku dne, denní a noční periodu a orientuje člověka v čase během dne. Správně synchronizované hodiny zaručují, že všechny fyziologické i behaviorální rytmy nastávají koordinovaně v průběhu 24hodinové periody.
Pokusy na zvířatech bylo prokázáno, že v periferních orgánech existují cirkadiánní hodiny totožné s těmi v SCN. Nalezeny byly například v srdci, v plících, v ledvinách, v játrech, v trávicím traktu, v kosterním svalstvu, v bílé a hnědé tukové tkáni (9, 10). Prameny uvádí, že 10–20 % všech genů ve tkáních může být pod cirkadiánní kontrolou (9, 10). Z toho lze usuzovat, že cirkadiánní regulaci podléhá mnoho fyziologických pochodů včetně metabolismu. Produkce adipocytokinů tukovou tkání – leptinu a adiponektinu či procesy adipogeneze, lipogeneze a diferenciace adipocytů jsou rovněž podřízené periferním cirkadiánním hodinám v adipocytech (8, 9). Cirkadiánní hodiny centrální i periferní jsou na molekulární úrovni zastoupeny hodinovými geny. Hodinové geny kódují skupinu proteinů (např. CLOCK, BMAL1, CRY, PER, REV-ERBα, RORα, CK1ε), které vytvářejí autoregulační mechanismy pozitivních a negativních transkripčně-translačních zpětných vazeb, které jsou podstatou cirkadiánních rytmů. Proto jakákoliv změna v genové expresi nebo v proteinové translaci může mít za následek zhoršené fungování celého systému. V případě tukové tkáně mohou změny v adipocytárních cirkadiánních hodinách vyústit v poruchu regulace energetické rovnováhy, v poruchu signalizace pocitu hladu/sytosti, v poruchu lipogeneze a adipogeneze, a přispívat tím ve svém důsledku k obezitě (8). Je pravděpodobné, že právě exprese hodinových genů adipocytokinů je zodpovědná za distribuci tuků do viscerální nebo subkutánní oblasti (9). Desynchronizace cirkadiánních rytmů má za následek i další poruchy na úrovni celého organismu. Jedná se například o narušení glukózové tolerance, prohloubení prozánětlivých a protrombotických procesů, dysfunkci imunitního systému, zvýšení krevního tlaku, zvýšení rizika akutních kardiovaskulárních příhod, narušení termoregulace a poruchy spánku (9).
Cirkadiánní hodiny v metabolismu
Řada metabolických funkcí probíhá ve specifickém čase v průběhu dne, což má z hlediska efektivity pro organismus zásadní význam – cirkadiánní exprese metabolických genů se optimálně přizpůsobuje a „přepíná“ mezi anabolickými a katabolickými procesy v souladu s periodami, které se týkají příjmu potravy/hladovění, aktivity/odpočinku apod. (9). Jak již bylo zmíněno výše, rozhodujícím faktorem je míra synchronizace organismu s prostředím. Hlavní úlohu sehrává denní světlo, které prostřednictvím retinohypotalamického traktu předává signál o trvání denní fotoperiody do SCN. SCN je hlavní centrum („master clock“) pro řízení fyziologických a behaviorálních cirkadiánních rytmů a je také hlavní udavatel rytmu („pacemaker“) pro periferní hodiny, které synchronizuje k jednotnému času prostřednictvím hormonálních a neuronálních signálů (9, 10). SCN je také zapojen do kontroly chuti k jídlu, do regulace energetického výdeje a do kontroly behaviorálních činností díky anatomickým vazbám na regiony, které jsou centrem těchto regulací (tj. subparaventrikulární zóna hypotalamu a části hypotalamu zvané nucleus arcuatus a area hypothalamica lateralis) (9).
Vedle světla, které představuje predominantní sychronizátor, je dalším přímým zevním synchronizačním činitelem potrava (11). Svou roli hraje pravidelný příjem potravy i složení potravy. Omezení příjmu potravy na určitou atypickou dobu (tzv. „restricted feeding“) či podávání stravy bohaté na tuky může způsobit desynchronizaci rytmů v hodinách centrálních i periferních (10, 11). Jako další ne-fotogenní signály, podílející se na synchronizaci vnitřních struktur i v absenci světla, jsou vedle potravy popisovány také pravidelná pohybová aktivita a teplota okolí (12). Synchronizace centrálních a periferních oscilátorů je zobrazena ve schématu 1.
Schéma 1. Synchronizace vnitřních biologických rytmů Použité zdroje: Maury E, et al. (9), Froy O. (11) 
Narušení vzájemného propojení mezi cirkadiánními rytmy a metabolismem může mít vážné následky v podobě metabolických patologií, jakými jsou obezita a diabetes mellitus 2. typu. To dokazují zejména pokusy na myších: Turek et al. demonstroval u CLOCK knockoutovaných myší rozvoj obezity, hyperfagie a hormonálních abnormalit (hyperlipidémie, hyperleptinémie, jaterní steatózy, hyperglykémie, hypoinzulinémie), které přispívají k metabolickému syndromu (8). Také u polymorfismu genu CLOCK (CAT rs4864548A) byla prokázána pozitivní korelace s obezitou. A například polymorfismus genu BMAL1 (CCA rs6486121) byl asociován s hypertenzí a s diabetes mellitus 2. typu (AC rs7950226) (8).
Dalším příkladem, na kterém lze demonstrovat propojení cirkadiánních hodin s energetickým metabolismem, je transkripční koaktivátor PGC1α, který sehrává důležitou úlohu v regulaci energetického metabolismu (10). Je rytmicky exprimován v játrech a v kosterním svalu a stimuluje expresi hodinových genů, jmenovitě BMAL1 a REV-ERBα (8). BMAL1 je klíčový regulátor cirkadiánního rytmu, podílí se na normální diurnální oscilaci glykémie a triacylglycerolémie a reguluje diferenciaci buněk tukové tkáně a lipogenezi v adipocytech (11). REV-ERBα je pro-adipogenní transkripční faktor, jehož hladiny stoupají v závislosti na diferenciaci adicpocytů, současně je negativním regulátorem exprese BMAL1 (11). Na molekulární úrovni jsou postupně definovány další klíčové geny (např. SIRT1, PPARα, PPARγ), které zesilují důkazy o propojení metabolismu s cirkadiánními hodinami (8–12). V otázce cirkadiánní regulace bylo nedávno prokázáno, že nejen cirkadiánní systém ovlivňuje metabolismus, ale naopak i metabolický stav buněk v periferních orgánech může modulovat hodinový mechanismus (10). Metabolický stav buňky vyjádřený oxidovanou nebo redukovanou formou kofaktoru nikotinamid-adenin-dinukleotidu (NAD(P)+/NAD(P)H) reguluje transkripční aktivitu genů CLOCK/BMAL1 a NPAS2/BMAL1 (9, 10). Tato skutečnost může přispívat k seřizování periferních hodin příjmem potravy (10).
Za zmínku také stojí úloha SCN v metabolismu glukózy. SCN se na regulaci glukózy podílí tím, že v době probuzení zajišťuje citlivost k inzulinu s následným vychytáváním glukózy svalem a současně zajišťuje produkci glukózy v játrech, a tím i dostatečný přísun tohoto energetického zdroje (10). Endogenní cirkadiánní rytmy v koncentraci glukózy a inzulinu v lidské plazmě vrcholí právě okolo doby probouzení (10). Usuzuje se, že do regulace glukózy zasahuje významně i hormon melatonin (9).
Ranní hodiny se ukazují kriticky důležité i pro pacienty s kardiovaskulárním onemocněním, protože mnoho akutních kardiovaskulárních a cerebrovaskulárních příhod vykazuje vrchol právě v ranní době. Riziko akutního infarktu myokardu je v ranních hodinách až o 40 % vyšší v porovnání se zbytkem dne nebo první částí noci (13). Tyto jevy jsou dávány do souvislosti s inhibitorem aktivátoru plazminogenu 1 (PAI-1), který vykazuje vrchol oscilace právě časně ráno (9). Cirkadiánní kontrola exprese genu pro PAI-1 je řízena REV-ERBα v játrech a může přispívat k cirkadiánním variacím ve fibrinolýze (9).
Nepříznivé působení narušených cirkadiánních rytmů na zdraví člověka bylo opakovaně demonstrováno u pracovníků na noční směny, u kterých byla prokázána častější přítomnost metabolických poruch, kardiovaskulárních onemocnění, diabetes mellitus 2. typu a obezity (8, 9, 11).
Epidemiologické studie
Výše popsanou mechanistickou teorii o propojení cirkadiánních rytmů s obezitou testují na populační úrovni epidemiologické studie.
V úvodu je ovšem nutné zmínit problém mnoha epidemiologických studií, kterým je používání nejednotné terminologie v souvislosti s vymezením krátkého trvání spánku. Často jsou jako synonyma užívány pojmy „short sleep“, „insufficient sleep“, „sleep loss“, „sleep curtailment“, „sleep restriction“ nebo „sleep deprivation“. Grandner et al. (2010) (14) striktně rozlišuje význam jednotlivých pojmů, které definuje následovně:
Short sleep = obvyklé trvání spánku v délce 6 a méně hodin.
Self-reported short sleep = subjektivní, retrospektivní hodnocení obvyklého spánku, též průměrné trvání spánku zjištěné prospektivními metodami (např. ze spánkových deníků).
Insufficient sleep = zkrácení spánku na míru, která je spojena s negativními zdravotními důsledky.
Sleep loss = relativní zkrácení spánku vzhledem k předchozímu trvání spánku.
Sleep curtailment = úmyslné, záměrné zkracování spánku.
Sleep restriction = zkrácení obvyklého trvání spánku, ne však na méně než 5 hodin za noc (v laboratorních i nelaboratorních podmínkách).
Sleep deprivation = akutní zkrácení spánku v laboratorních podmínkách.
Total sleep deprivation = úplné vynechání spánku po dobu 24 hodin a více.
Partial sleep deprivation = zkrácení spánku v laboratorních podmínkách, ne však na méně než 5 hodin za noc.
Z epidemiologických studií, které se věnují dané problematice, se převážná většina z nich shoduje v závěru, že přítomnost obezity je determinována délkou a kvalitou spánku (15–18). Typ závislosti je popisován buď nepřímou lineární závislostí, nebo častěji křivkou ve tvaru U s nejnižším rizikem obezity při spánku v délce mezi 7–8 hodinami (18). Důsledky dlouhého trvání spánku (> 8 hodin) vzhledem k obezitě nejsou dosud dostatečně prozkoumané. V mnoha epidemiologických studiích jsou prezentovány shodně závěry, že krátké trvání spánku (tj. ≤ 6 hodin) představuje signifikantně významný rizikový faktor predikující přítomnost obezity či vyšší BMI (15–18).
Pravděpodobný mechanismus, jakým nedostatek spánku působí na rozvoj obezity, popsal Patel a Hu (16): Nedostatek spánku vede k hormonálním a metabolickým změnám (k poklesu hladiny anorexigenního hormonu leptinu a k nárůstu hladiny orexigenního hormonu ghrelinu), které zvyšují pocit hladu, chuť k jídlu a spolu s častější příležitostí ke konzumaci potravy zvyšují celkově energetický přívod. Všechny tyto aspekty přispívají k obezitě. Na druhou stranu nedostatek spánku prohlubuje denní únavu, přispívá k nižší fyzické aktivitě a ovlivňuje termoregulaci. Tímto dochází ke snížení energetického výdeje, což ve svém důsledku rovněž přispívá k rozvoji obezity. Magee et al. (19) tento model kauzálních vztahů doplnil o další potenciálně příčinný nebo zavádějící faktor, kterým je nadužívání medií (TV, PC, internet, videohry aj.). Nadměrné užívání medií je přímo asociováno s krátkým trváním spánku, s vyšším energetickým příjmem a s nižším energetickým výdejem, což v důsledku přispívá taktéž k obezitě. Magee rovněž upozorňuje na zpětnovazebnou smyčku, kdy obezita přímou zpětnou vazbou ovlivňuje a prohlubuje již tak krátké trvání spánku, například v důsledku obstrukční spánkové apnoe, která je velmi často sdružená s obezitou (19). Velmi podobný model uvádí Magee et al. (22), podle nějž krátké trvání spánku přispívá k obezitě v důsledku tří mechanismů: 1. narušení neuroendokrinních a metabolických funkcí, 2. narušení glukózové regulace a 3. v důsledku změny chování ve smyslu nízké fyzické aktivity a častější konzumace energeticky bohatých potravin. V souvislosti s vyšším energetickým příjmem vysoce palatabilních pokrmů, který se pojí s krátkým trváním spánku, se v pramenech hovoří také o významu hédonistické hodnoty potravy, kterou zprostředkovává endogenní opiátový systém. Propojení endogenního opiátového systému se spánkem a obezitou může být zesíleno zvlášť u obézních jedinců s nedostatečnou délkou spánku (20, 21).
Závěry epidemiologických studií posledního desetiletí podávají přesvědčivé důkazy o existenci závislosti tělesné hmotnosti na spánku. K těmto závěrům pozitivně přispívá i fakt, že se jedná o studie provedené na velkých populacích z různých zemí a kontinentů (Amerika, Evropa, Asie, Austrálie). Na druhou stranu i na tyto výsledky je nutné nahlížet kriticky v kontextu všech souvislostí.
Hlavní problém většiny epidemiologických studií, pokud se týká interpretace a srovnání výsledků, spočívá:
- v heterogenitě populačního vzorku,
- v heterogenitě použitých metodik pro hodnocení obezity a spánku,
- v heterogenitě zahrnutých zavádějících faktorů (confounders) a
- v designu studie (24).
Ad 1. Při hodnocení dopadu krátkého trvání spánku na obezitu v populaci hraje svou roli věk, méně jednoznačná je pak role pohlaví a rasy. Asociace mezi chronicky zkráceným spánkem a obezitou je konzistentní u dětí, studie na dospělých osobách vykazují nejednotné závěry. Přesvědčivě vycházejí studie s jedinci do 40 let, u starších osob asociace spánku s obezitou spíše slábne (16, 19, 23). Výraznější efekt vlivu krátkého trvání spánku na obezitu byl prokázán v některých průřezových studiích pouze u žen (25, 26), v longitudinálních studiích pouze u mužů (27). Lauderdale et al. (28) neprokázali rozdíl v asociaci spánku a BMI ve skupinách rozdělených podle pohlaví a rasy v průřezovém, ani longitudinálním modelu studie.
Ad 2. Metody pro měření obezity a spánku jsou ve studiích voleny s ohledem na jejich přesnost, proveditelnost a finanční dostupnost (v různém pořadí) (24). Například u hodnocení spánku převládají metody na základě subjektivních sdělení pomocí dotazníků a spánkových deníků. U těchto metod se udává, že jsou častějším zdrojem subjektivních chyb v závislosti na věku a pohlaví (23, 24). Naopak méně často jsou využívány objektivní metody polysomnografie (PGS) a aktigrafie. Průřezové studie založené na měření spánku objektivními metodami (aktigrafie, PGS) vykazují silnější asociaci spánku s obezitou, na rozdíl od průřezových studií založených na subjektivních metodách (23). Při hodnocení obezity převládá nejvíce měření na základě BMI, obvodu pasu a kožních řas. Méně časté je měření pomocí bioelektrické impedance (BIA), zřídka se využívá zobrazovací technika (duální emisní rentgenová absorpciometrie – DEXA), počítačová tomografie (CT), nukleární magnetická rezonance (NMR) nebo hydrodenzitometrie (24). Při měření obezity má každá metoda své limity, v ideálním případě je doporučeno kombinovat minimálně dvě metody v rámci možností konkrétní studie (24).
Ad 3. Při zkoumání asociace mezi expozicí a následkem je třeba vždy důrazně prověřit, zda pozorovaná asociace není ve skutečnosti projevem působení nějakého dalšího činitele, tzv. zavádějícího faktoru („confounding factor/confounder”). Podle definice pro zavádějící faktor platí, že zavádějící faktor je ve vztahu (přímém nebo nepřímém) k následku a současně je asociován se studovanou expozicí, ale není mezikrokem na cestě od expozice k následku (29). Míra ovlivnění studované asociace závisí na těsnosti vazby mezi zavádějícím faktorem a expozicí, resp. následkem. Proto je nutné některé faktory ve výpočtech zohledňovat, aby nebyla daná asociace ovlivněna (zamaskována) zavádějícím faktorem a mohla být skutečně nezávisle potvrzena (29). Problematiku hodnocení asociace spánku a obezity znesnadňuje řada zavádějících faktorů. Tabulka 2 nabízí některé z nich. Mezi další faktory, které jsou asociovány se spánkem i s obezitou, patří socioekonomický status (vzdělání, příjem), počet a rozložení pracovních hodin během dne, zdravotní omezení a přítomnost bolesti, medikace, rodinný stav a genetické predispozice (19). Silnou asociaci například vykazují počet pracovních hodin a zaměstnání na plný pracovní úvazek, které korelují s nízkým počtem hodin strávených spánkem, konkrétně se spánkem < 6 hodin (30). Podobné výsledky prezentují i Magee et al. (31) a Di Milia et al. (32), kteří upozorňují, že obézní jedinci mají společný, vedle krátkého trvání spánku, také vyšší počet pracovních hodin. Vgontzas et al. (33) zase prokázal velmi silnou vazbu krátkého spánku s chronickým emocionálním stresem spíše než s BMI. V současných epidemiologických studiích je široká variabilita v počtu zahrnutých zavádějících faktorů. Liší se v počtu od 3 do 17 faktorů na studii, což může významně ovlivňovat interpretaci závěrů (34, 5).
Tab. 2. Zavádějící faktory, které mohou ovlivňovat vztah mezi spánkem a obezitou 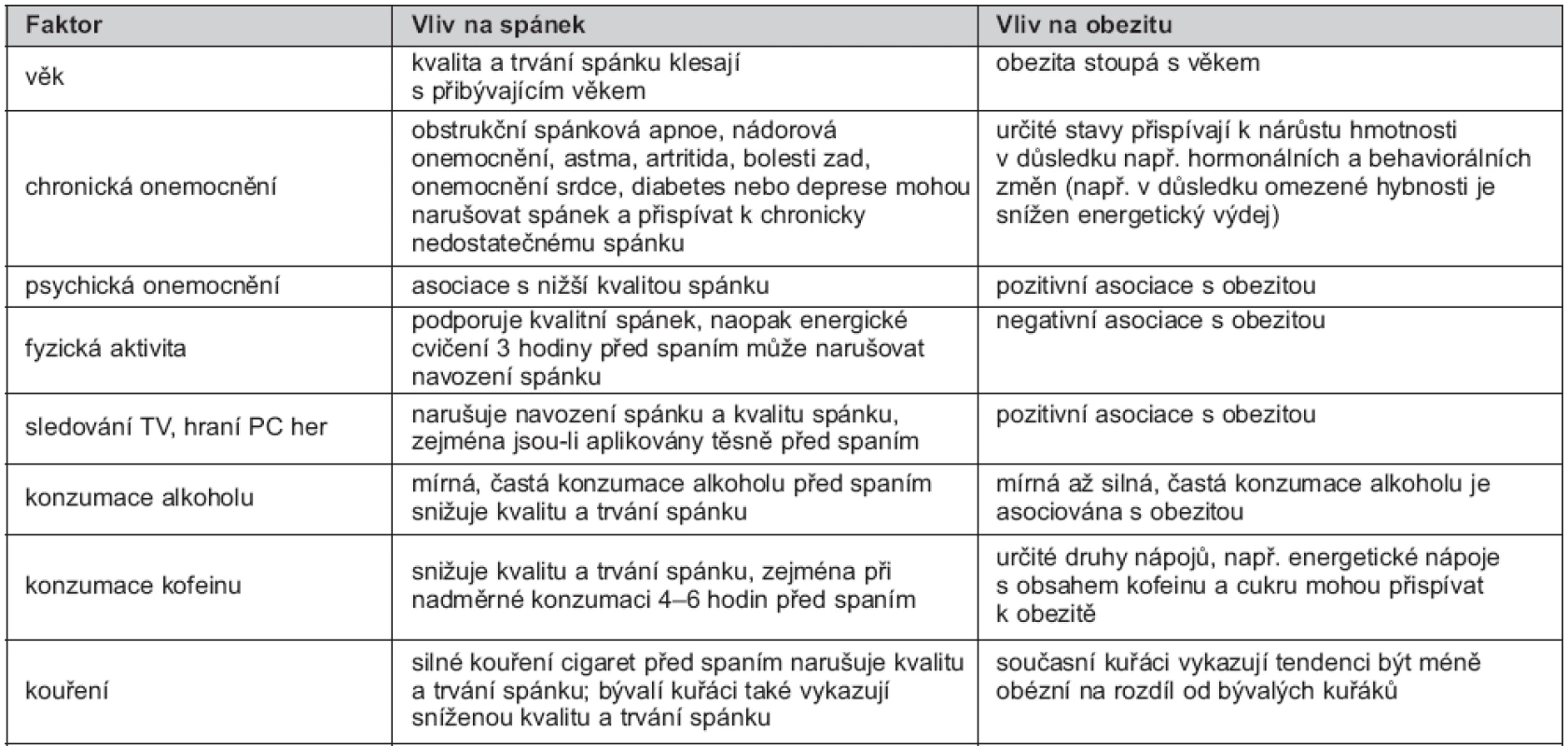
Ad 4. Design studie napomáhá definovat vztahy (typ závislosti, kauzalitu) a souvislosti mezi sledovanými ukazateli. Nezbytným předpokladem naplnění kauzality vztahu je průkaz časové posloupnosti krátkého trvání spánku a pozdějšího rizika obezity. To lze prokázat pouze v dlouhodobých typech studií, nikoliv v průřezových studiích nebo ve studiích případů a kontrol, které při zkoumání dané problematiky výrazně převažují.
Diskuze
Ačkoliv značná část dosud provedených průřezových studií podává velmi přesvědčivě důkazy o dopadu krátkého trvání spánku na rozvoj obezity, použitý design studií je značně limitující v otázce objasnění příčinné souslednosti. Provedené longitudinální studie, které mohou pomoci tuto otázku vyřešit, ovšem neposkytují zdaleka jednoznačné výsledky. Některé studie potvrdily, že chronicky zkrácený spánek podmiňuje v čase nárůst hmotnosti (27), jiné studie toto neprokázaly (28). Magee L. et al. (19) poznamenává, že při sledování ukazatelů v průběhu času je však nutné klást větší důraz na počáteční stav délky spánku již při zahájení studie. Jestliže dotyčný jedinec spí kratší počet hodin dlouhodobě již před samotným začátkem studie, nemusí být změna hmotnosti v čase evidentní a longitudinální design studie tak nemusí tyto změny v hmotnosti podchytit. Autoři dodávají, že longitudinální pozorování souboru by mělo být zahájeno před nebo v počátku, kdy jedinec/skupina vstupuje do období krátkého trvání spánku (19, 35). Podobně by měly být posuzovány i další proměnné, které mají z časového hlediska souběžný vliv na spánek i obezitu. Příkladem je kouření: Bude-li dlouhodobý kuřák zařazený do studie kouřit i v průběhu studie, nebude s největší pravděpodobností asociace spánku s obezitou nijak ovlivněna. Rozhodne-li se však dotyčný v počátku studie přestat/začít s kouřením, mohou být výsledky studie tímto značně ovlivněny, protože kouření významně působí jak na spánek, tak na tělesnou hmotnost. Podobně mohou výsledky ovlivnit také časové změny v konzumaci alkoholu, změny ve stravě či v dietě, v medikaci nebo přítomnosti psychických problémů (19).
Hodnotit dlouhodobý efekt spánku na obezitu je obtížné i z toho důvodu, že spánkový režim je velmi proměnlivý a změny, které nastávají po akutním zkrácení spánku, mohou být odlišné od změn způsobených chronicky zkráceným spánkem (14). Dopad může být odlišný i v závislosti na různých životních etapách. Taktéž krátké trvání spánku, jež je podchyceno ve studiích, nemusí být odrazem dlouhodobých zvyklostí (14). Při hodnocení délky spánku vyvstává mnoho otazníků: Je vůbec možné subjektivně udávaný spánek považovat za stabilní expozici a posuzovat ji ve vztahu ke zdravotním ukazatelům? Do jaké míry je člověk skutečně vystaven nežádoucí expozici krátkého trvání spánku, restauruje-li spánkový deficit během následujících dnů nebo, jak je obvyklé, o víkendových dnech? Nakolik musí být trvání spánku sníženo, aby toto snížení vedlo k negativním důsledkům? Existuje při dlouhodobě zkráceném spánku u člověka adaptace? Je důležitá pravidelnost spánku, průměrná délka nebo kumulovaná délka spánku v průběhu týdnů či měsíců? Nebo je třeba hodnotit odchylku v délce spánku od věkem specifické a pravděpodobně individuálně specifické potřeby spánku? Jaká je individuální hranice? Je důležitá délka nebo kvalita spánku? Na tyto otázky se stále hledá odpověď.
Délka spánku nemusí představovat rozhodující parametr v otázce nárůstu tělesné hmotnosti. Indikátory narušené kvality spánku (nižší podíl non-REM spánku, fragmentace spánku) korelují v některých studiích s BMI a s množstvím tukové tkáně daleko silněji než s délkou spánku (36). Z hlediska délky spánku je neméně překvapivé zjištění, že v průběhu 31 let se počet jedinců se spánkem kratším než 6 hodin ve společnosti nijak zásadně nezměnil. Signifikantní zkrácení spánku na méně než 6 hodin bylo evidováno pouze u lidí s plným pracovním úvazkem (30). Konzistentní výsledky týkající se poklesu subjektivně udávané délky spánku v průběhu let 1960–2000 neprokázal systematickým přehledem studií z 15 zemí ani Bin et al. (37).
Horne (3) dodává, že distribuce obvyklé délky spánku je velmi blízká normálnímu rozložení a zahrnuje i běžně vyskytující se genotypy s obvyklým krátkým/dlouhým trváním spánku. Horne upozorňuje, že asociace spánku a obezity je v mnoha studiích signifikantní až při obvyklém trvání spánku < 5 hodin, což odpovídá velmi malému procentu populace (cca < 10 %). V této skupině se mohou nacházet spolu s fenotypicky adaptovanými jedinci také jedinci s chronicky nedostatečným spánkem, u kterých je zvýšená pravděpodobnost rozvoje obezity, morbidity a denní spavosti. Podobné stanovisko zastává i Grandner et al. (14), který rovněž upozorňuje na to, že skupina „short sleepers“ přestavuje heterogenní skupinu, ve které by se měli identifikovat a rozlišit normální „short sleepers“ od „short sleepers“, kteří trpí deficitem spánku spojeným s negativními důsledky. V diskutované skupině mohou být samozřejmě zahrnuti i jedinci s momentálně náhodným pro ně atypicky krátkým trváním spánku.
Horne (39) dále argumentuje, že ačkoliv řada epidemiologických studií je ve svých pozorováních statisticky signifikantních, publikované rozdíly v BMI pro jednotlivé kategorie spánku nebo nárůst tělesné hmotnosti o < 1 kg/rok na vrub krátkého trvání spánku, jsou natolik malé, že je nelze považovat za klinicky signifikantní. Upozorňuje také na to, že zatímco se pozornost soustřeďuje na krátce spící obézní jedince, opomíjí se opačný konec distribuce, což jsou krátce spící podvyživení jedinci. Skeptické názory jsou do určité míry i pochopitelné, protože nebylo dosud prokázáno dostatečným počtem studií, že by naopak prodloužení spánku vedlo k redukci tělesné hmotnosti, jak se logicky očekává. V otázce kauzality se řada autorů přiklání k názoru, že vztah mezi spánkem a obezitou je obousměrný a vzájemné ovlivňování probíhá v uzavřeném kruhu (16, 22, 23). Chaput (40) navíc dodává, že hlavním cílem nemusí být zodpovězení otázky kauzality, nýbrž snaha porozumět mechanismům a důsledkům chronicky nedostatečného spánku a jeho vlivu na regulaci příjmu potravy a energetické rovnováhy, což se jeví jako daleko zásadnější.
Existují také názory, které vycházejí z evoluční koncepce o sezonní podmíněnosti exprese šetřivého genu. V minulosti dlouhá fotoperioda v letních měsících korespondovala s vyšším energetickým příjmem převážně ze sacharidových zdrojů a spolu s krátkým trváním spánku také korespondovala s tvorbou tukového depozitu. Vytvořené zásoby mohly posloužit jako energetická rezerva v zimních měsících. Tyto evoluční adaptace, které byly v minulosti výhodné pro naše předky, mohou být naopak nevýhodné a maladaptivní ve společnosti, která dnes čelí zcela jiným podmínkám (20). Wyse (4) dodává, že chronická cirkadiánní desynchronizace může indukovat některou z forem adaptivního fenotypu, který zvyšuje efektivitu metabolismu v situaci, kdy se okolní podmínky stávají nepředvídatelnými. Tento typ fenotypických změn může vysvětlovat trvající vysokou četnost obezity a také rezistenci obezity k dietární intervenci.
Závěr
I přesto, že není vztah mezi spánkem a obezitou dosud zcela objasněn, objektivním faktem zůstává, že spánek je nezbytnou fyziologickou potřebou. Je důležitý pro správné řízení procesů na všech úrovních systémů, které se vzájemně doplňují a přispívají k celkovému zdraví, metabolické pochody nevyjímaje. Spánek sám o sobě není zodpovědný za epidemii obezity a není zatím ani prokázané, že by prodloužení spánku vedlo k redukci tělesné hmotnosti. Je však pravděpodobné, že nedostatek spánku, narušením vnitřních regulačních mechanismů, může spolu s dalšími okolnostmi přispívat k metabolickým poruchám a následně i k nárůstu tělesné hmotnosti. V oblasti prevence a léčby obezity je žádoucí prosazovat komplexní přístup, který zahrnuje úpravu celkového životního stylu s důrazem na stravovací zvyklosti, pravidelný pohybový režim a správnou spánkovou hygienu.
Zkratky
- BMAL 1 – brain and muscle Arnt-like protein 1
- BMI – index tělesné hmotnosti (body mass index)
- CK1ε – kasein kináza 1ε
- CLOCK – circadian locomotor output cycles kaput
- CRP – C-reaktivní protein
- CRY – cryptochrome
- CT – počítačová (computerová) tomografi
- IL-6 – interleukin 6
- NAD – nikotinamid adenin dinukleotid
- NMR – nukleární magnetická rezonance
- NPAS2 – neuronal PAS domain protein 2
- PAI-1 – inhibitor aktivátoru plazminogenu 1 (plasminogen activator inhibitor type 1)
- PER – period
- PGC1α – peroxisome proliferator-activated receptor-coactivator 1α, PPARα coactivator 1α
- PPARα – peroxisome proliferator-activated receptor α
- PPARγ – peroxisome proliferator-activated receptor γ
- REV-ERBα – reverse erythroblastotis virus α
- RORα – retinoic acid-related organ receptor α
- SCN – suprachiasmatic nuclei; suprachiasmatická jádra
- SIRT1 – sirtuin 1
- TF – tepová frekvence
- TNF-α – tumor necrosis faktor α
ADRESA PRO KORESPONDENCI:
Mgr. Zlata Piskáčková
Ústav preventivního lékařství
Lékařská fakulta, Masarykova univerzita
Kamenice 753/5, 625 00 Brno
e-mail: zlata.p@seznam.cz
Zdroje
1. Ogden CL, Carroll MD. 2010. Prevalence of overweight, obesity, and extreme obesity among adults: United States, trends 1960–1962 through 2007–2008. http: //www.cdc.gov/ nchs/data/hestat/obesity_adult_07_08/obesity_adult_07_08.pd.
2. Knutson KL, et al. The metabolic consequences of sleep deprivation. Sleep Med Rev 2007; 11 : 163–178.
3. National Sleep Foundantion. 2009 Sleep in America™ Poll Highlights & Key Findings. http: //www.sleepfoundation.org/ sites/default/files/2009%20Sleep%20in%20America%20SOF%20EMBARGOED.pdf.
4. Wyse CA, et al. Circadian desynchrony and metabolic dysfunction; did light pollution made us fat? Med Hypotheses 2011; 77 : 1139–1144.
5. Buxton OM, et al. Short and long sleep are positively associated with obesity, diabetes, hypertension, and cardiovascular disease among adults in the United States. Soc Sci Med 2010; 71 : 1027–1036.
6. Grandner MA, et al. Mortality associated with short sleep duration: The evidence, the possible mechanisms, and the future. Med Rev 2010; 14 : 191–203.
7. Hainer V, et al. Role of hereditary factors in weight loss and its maintenance. Physiol Res 2008; 58: S1–S15.
8. Zanquetta MM, et al. Body weight, metabolism and clock genes. Diabetol Metab Syndr 2010; 16 : 53.
9. Maury E, et al. Circadian rhythms and metabolic syndrome: from experimental genetics to human disease. Circ Res 2010; 106 : 447–462.
10. Illnerová H, et al. Vnitřní časový systém. Psychiatr prax 2008; 9 : 230–233.
11. Froy O. Metabolism and circadian rhythms – implications for obesity. Endocr Rev 2010; 31 : 1–24.
12. Morris CJ, et al. Circadian system, sleep and endocrinology. Mol Cell Endocrinol 2012; 349 : 91–104.
13. Nevšímalová S, Šonka K, et al. Poruchy spánku a bdění. Praha: Galén 2007.
14. Grandner MA, et al. Problems associated with short sleep: bridging the gap between laboratory and epidemiological studies. Sleep Med 2010; 14 : 239–247.
15. Van Cauter E, et al. Sleep and the epidemic of obesity in children and adults. Eur J Endocrinol 2008; 159: S59–S66.
16. Patel SR, et al. Short sleep duration and weight gain: a systematic review. Obesity 2008; 16 : 643–653.
17. Cappuccio FP, et al. Meta-analysis of short sleep duration and obesity in children and adults. Sleep 2008; 31 : 619–626.
18. Marschall NS, et al. Is sleep duration related to obesity? A critical review of the epidemiological evidence. Sleep Med Rev 2008; 12 : 289–298.
19. Magee L, et al. Longitudinal associations between sleep duration and subsequent weight gain: a systematic review. Sleep Med Rev 2011; doi: 10.1016/j.smrv.2011.05.005.
20. Gangwisch JE. Epidemiological evidence for the links between sleep, circadian rhythms and metabolism. Obes Rev 2009; 10 : 37–45.
21. Chaput JP. Short sleep duration promoting overconsumption of food: a reward-driven eating behavior? Sleep 2010; 33 : 1135–1136.
22. Magee CA, et al. Examining the pathways linking chronic sleep restriction to obesity. J Obes 2010; doi: 10.1155/ /2010/821710.
23. Nielsen LS, et al. Short sleep duration as a possible cause of obesity: critical analysis of the epidemiological evidence. Obes Rev 2011; 12 : 78–92.
24. Magee CA, et al. A link between chronic sleep restriction and obesity: methodological considerations. Public Health 2008; 122 : 1373–1381.
25. St-Onge MP, et al. Gender differences in the association between sleep duration and body composition: The Cardia Study. Int J Endocrinol 2010; doi: 10.1155/2010/726071.
26. Buscemi D, et al. Short sleep times predict obesity in internal medicine clinic patients. J Clin Sleep Med 2007; 3 : 681–688.
27. Watanabe M, et al. Association of short sleep duration with weight gain and obesity at 1-year follow-up: a large-scale prospective study. Sleep 2010; 33 : 161–167.
28. Lauderdale DS, et al. Cross-sectional and longitudinal associations between objectively measured sleep duration and body mass index. Am J Epidemiol 2009; 170 : 805–813.
29. EuroMISE Centrum Univerzity Karlovy a Akademie věd ČR. Zavádějící faktory. http://ucebnice.euromise.cz/index.php? conn=0§ion=epidem&node=node32.
30. Knutson KL, et al. Trends in the prevalence of short sleepers in the USA: 1975–2006. Sleep 2010; 33 : 37–45.
31. Magee CA, et al. Short sleep mediates the association between long work hours and increased body mass index. J Behav Med 2011; 34 : 83–91.
32. Di Milia L, et al. The association between job related factors, short sleep and obesity. Ind Health 2009; 47 : 363–368.
33. Vgontzas AN, et al. Short sleep duration and obesity: the role of emotional stress and sleep disturbances. Int J Obes 2008; 32 : 801–809.
34. Bjorvatn B, et al. The association between sleep duration, body mass index and metabolic measures in the Hordaland Health Study. J Sleep Res 2007; 16 : 66–76.
35. Magee L, et al. Re: “Cross-sectional and longitudinal associations between objectively measured sleep duration and body mass index: The Cardia Sleep Study”. Am J Epidemiol 2010; 171 : 745.
36. Patel SR. Invited commentary: Understanding the role of sleep. Am J Epidemiol 2009; 170 : 814–816.
37. Bin YS, et al. Secular trends in adult sleep duration: A systematic review. Sleep Med Rev 2011; http://www. sciencedirect.com/science/article/pii/S1087079211000736.
38. Horne J. Obesity and short sleep: unlikely bedfellows? Obes Rev 2011; 12: e84–e94.
39. Horne J. Short sleep is a questionable risk factor for obesity and related disorders: Statistical versus clinical significance. Biol Psychol 2008; 77 : 266–276.
40. Chaput JP. Short sleep duration as a cause of obesity: myth or reality? Obes Rev 2011; 12: e2–e3.
41. Bollinger T, et al. Sleep, immunity, and circadian clocks: a mechanistic model. Gerontology 2010; 56 : 574–580.
42. King CR, et al. Short sleep duration and incident coronary artery calcification. JAMA 2008; 300 : 2859–2866.
43. Mezick EJ, et al. Are sleep and depression independent or overlapping risk factors for cardiometabolic disease? Sleep Med Rev 2011; 15 : 51–63.
44. Loprinzi PD, et al. Association between objectively-measured physical activity and sleep, NHANES 2005–2006. Ment Health Phys Act 2001; 4 : 65–69.
45. Sucharda P. Obezita a kouření. Postgrad Med 2002; 4 : 413–415.
46. Padilha HG, et al. A link between sleep loss, glucose metabolism and adipokines. Braz J Med Biol Res 2011; 44 : 992–999.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Současné poznatky o vztahu spánku a obezity
- Plánované akce odborných složek ČLS JEP
- Využívanie súčasných poznatkov tkanivového inžinierstva pri príprave kožných náhrad
- Efekt nefarmakologických metod tlumících bolest u novorozenců
- Public health je důležitým nástrojem rozvoje péče o zdraví
- Úloha nutlinu v terapii CTCL
- IX. luhačovické dny
-
Mezinárodní kongres lidské genetiky
Montreal, prosinec 2011 - Biomedicínský výzkum s podporou evropských zdrojů v nemocnicích Ústí nad Labem, 12. až 13. dubna 2012
-
Den rodinné terapie
Praha, 17. dubna 2012 -
Stan proti melanomu
Praha, Ostrava, Brno, květen 2012 -
Zemřel MUDr. Jaroslav Ulrich, CSc.
*30. dubna 1921 – †20. února 2012 - Karl von Frisch
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Efekt nefarmakologických metod tlumících bolest u novorozenců
- Využívanie súčasných poznatkov tkanivového inžinierstva pri príprave kožných náhrad
- IX. luhačovické dny
- Public health je důležitým nástrojem rozvoje péče o zdraví
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



