-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Chronické cholestatické jaterní choroby, primární biliární cholangitida a primární sklerozující cholangitida
Chronic cholestatic liver diseases – Primary biliary cholangitis and Primary sclerosing cholangitis
Cholestasis is defined as hepatocyte and cholangiocyte bile excretion failure or failure of bile transport to the duodenum. Primary biliary cholangitis (PBC) and primary sclerosing cholangitis as chronic progressive cholestatic diseases are the common reasons of chronic cholestasis. Altogether with cholestatic laboratory picture the pruritus, liver osteodystrophy and fatigue are associated symptoms in both diseases. All associated symptoms and complications are needed to be diagnosed and treated early. In case of liver cirrhosis complicatons of accompanied portal hypertension should be treated and liver transplantation must be considered in all those patients. Diagnosis of PBC is based on cholestatic laboratory features, animitochondrial antibody positivity or typical histological patern. Most patients are asymptomatic in time of diagnosis. First line therapy is ursodeoxycholic acid. In case of first line therapy failure, the prognosis is unfavourable. In this case, second line therapy must be considered. In case of PSC the diagnosis is based on MRCP finding mainly, laboratory test and liver biopsy in some cases. Progressive inflamatory and fibrosing impairment affecting intrahepatic and extrahepatict biliary ducts and strong association with inflamatory bowel disease, especially ulcerative colitis is typical for PSC. Endoscopic therapy with dilatation of dominant structure is crucial. The effect of pharmacotherapy is still being discussed and ursodeoxycholic acid could be used. During follow up patients are in the risk of bacterial cholangitis and malignant tumor development (cholangiogenic and colorectal carcinoma mainly). In PSC patients the severe pruritus and reccurent bacterial cholangitis could be an indication for the liver transplantation.
Keywords:
diagnostics – biliary cholangitis – cholangitis – cholestasis – sclerosing cholangitis – treatment
Autoři: Tomáš Fejfar 1; Tomáš Vaňásek 1; Petr Hůlek 1,2
Působiště autorů: II. interní gastroenterologická klinika LF UK a FN Hradec Králové 1; Katedra interních oborů LF OU Ostrava 2
Vyšlo v časopise: Vnitř Lék 2020; 66(5): 287-300
Kategorie: Přehledové články
Souhrn
Cholestáza je definována jako porucha tvorby a vylučování žluči hepatocyty a cholangiocyty nebo poruchou jejího transportu ve vývodných cestách. Mezi nejčastější chronické progresivní choroby v dospělosti spojené s cholestázou patří primární biliární cholangitida (PBC) a primární sklerozující cholangitida (PSC). Spolu s cholestatickým obrazem mají obě choroby společnou řadu klinických projevů s pruritem, únavou a metabolickou kostní chorobou. Přidružené symptomy a komplikace vyžadují časnou diagnostiku a léčbu. U nemocných s již rozvinutou cirhózou jater vyžadují léčbu i komplikace asociované portální hypertenze. V pokročilých stadiích je u obou onemocnění nutno zvažovat transplantaci jater. Diagnóza u PBC je založena na nálezu cholestázy, průkazu specifických antimitochondriálních protilátek nebo typickém histologickém nálezu. Velká část nemocných je v době diagnózy asymptomatických. Základní léčbou první linie je ursodeoxycholová kyselina (UDCA). U nemocných, kteří na léčbu UDCA neodpoví adekvátním ústupem cholestázy, zůstává prognóza nepříznivá. Pro tyto nemocné lze zvážit podání léčby 2. linie. V případě PSC je diagnóza založena na zobrazovacích vyšetřeních, zejména MRCP a pomocných laboratorních testech, event. jaterní biopsii. Pro PSC je typické progresivní postižení nitrojaterních a mimojaterních žlučovodů a silná asociace s idiopatickým střevním zánětem, zejména ulcerózní kolitidou. V terapii se uplatňuje endoskopická léčba dominantních stenóz pomocí ERCP s balónovou dilatací nebo dilatací s následným krátkodobým zavedením stentů. Ve farmakoterapii se může uplatnit ursodeoxycholová kyselina, i když její efekt je stále diskutován. V průběhu onemocnění jsou pacienti ohroženi vznikem bakteriální cholangitidy a maligních nádorů, zejména cholangiogenního a kolorektálního karcinomu. U nemocných s PSC je transplantaci jater nutno zvažovat i v případě recidivujících bakteriálních cholangitid a nezvladatelného pruritu.
Klíčová slova:
biliární cholangitida – diagnostika – cholangitida – cholestáza – léčba – sklerozující cholangitida
Úvod
Cholestáza je definována jako porucha tvorby a vylučování žluči nebo selhání schopnosti organismu dodat do duodena dostačující množství žluči odpovídajícího složení (1). Onemocnění (porucha) tedy může být lokalizováno jak v hepatocytu nebo cholangiocytu, tak i v primárních žlučovodech či vývodných žlučových cestách až po Vaterovu papilu. Hlavní organické složky žluče jsou žlučové lipidy, tj. primární, sekundární a terciarní žlučové kyseliny, fosfatidylcholin a neesterifikovaný cholesterol. Žlučové proteiny a pigmenty jsou v menšině a představuje je hlavně konjugovaný bilirubin (1). Z jaterních buněk jsou secernovány pomocí řady specifických transportních proteinů a v kanalikulární žlučí se spojují v micely, které umožňují transport cholesterolu, sterolů a vážou žlučové kyseliny na svém povrchu a tím omezují jejich toxicitu. K dalším změnám složení žluče dochází v důsledku sekrece bikarbonátu a směny dalších složek specifickými receptory umožňujícími i obrácený tok ze žluče do krevního řečiště. Hromadění složek žluče v organismu, tedy zej ména bilirubinu a žlučových kyselin, se odehrává zejména v játrech, druhotně pak v séru a vede k poruše funkce žlučových cest, jater, CNS a poruše trávení a vstřebávání tuků. Dochází k narušení fyziologické signální funkce žlučových kyselin a absenci jejich detergenčního efektu ve střevě. Vysoké koncentrace žlučových kyselin vedou k aktivací cholangiocytů a způsobují jejich chronické zánětlivé změny, proliferaci, apoptózu a fibrózu.
Fyziologicky jsou primární žlučové kyseliny, tj. kyselina cholová a chendeoxycolová, syntetizovány z cholesterolu v játrech enzymem CytochromP4507A1-hydroxylázou (CYP7A1), před sekrecí jsou konjugovány s taurinem anebo glycinem a tvoří sole bránící pasivní reabsoprci. V tračníku podstupují dehydroxylaci a dekonjugaci střevní mikroflórou, čímž tvoří sekundární a terciální žlučové sole (deoxycholová, lithocholová a ursodeoxycholová). Ačkoliv existuje i pasivní střevní reabsorpce, drtivá část žlučových kyselin je reabsorbována v terminálním ileu specifickým přenašečem (Apical Sodium Dependent Bile Acid Transporter – ASBT) a portální krví se dostávají zpět do jaterních buněk. Tento děj podléhá řadě zpětnovazebných regulačních mechanismů s cílem omezit dopad cytotoxicity žlučových kyselin. Jejich popis přesahuje rámec našeho sdělení. Hlavní negativní zpětnou vazbu cestou FGF 19 (fibroblast growth factor) zprostředkuje farnesoid X nukleární receptor (FXR) spouštějící kaskádu omezující transkripci CYP7A1 i ASBT, receptory ovlivňující jejich sekreci, reabsorpci z portální krve do hepatocytu a zvyšují funkci pump exportujících žlučové kyseliny. Další ochranné děje vyvažující toxický dopad cholestázy jsou zejména tzv. bikarbonátový deštník a cholehepatální shunting a signální cesty tlumící zánětlivou odpověď. Takto dochází ke změně pH a ionizaci žlučových kyselin, což snižuje jejich schopnost difuze a toxicitu. Změny zkratující krve mezi hepatocyty a cholangiocyty periduktulárními kapilárními pleteněmi zlepšují tok žluče a ochrannou bikarbonátovou cholerézu. Vazba žlučových kyselin na řadu nukleárních a membránových receptorů mění zánětlivé kaskády, kde zejména FXR, TGR5 a PXR receptory mohou zánětlivou reakci snižovat. Právě na tyto signální cesty a nukleární receptory se upírá pozornost moderní léčby stavů zapříčiněných či spojených s cholestázou.
Z klinického hlediska se však stále zachovává základní dělení etiopatogeneze cholestázy na 4 okruhy, tj. nezánětlivý typ (hormonální léčba, hormonální a paraneoplastické změny, totální parenterální výživa), zánětlivé cholestázy (virové hepatitidy, sepse, alkoholem navozená zánětlivá reakce), cholestázy při primárním poškození žlučovodů (PBC, PSC, syndrom mizejících žlučovodů) a mechanické cholestázy (nádory, benigní striktury, zevní útlak žlučovodů, obstrukce konkrementy) (1).
Z hlediska terapeutického postupu je zásadní dělení cholestázy na intrahepatální a extrahepatální typ.
Základní vyšetření
Diferenciální diagnostika cholestatických stavů je velmi široká (Tab. 1) a vyšetření by mělo probíhat podle určitého algoritmu (Obr. 1) (2).
Tab. 1. Základní diferenciální diagnostika cholestatických stavů (2, 44) 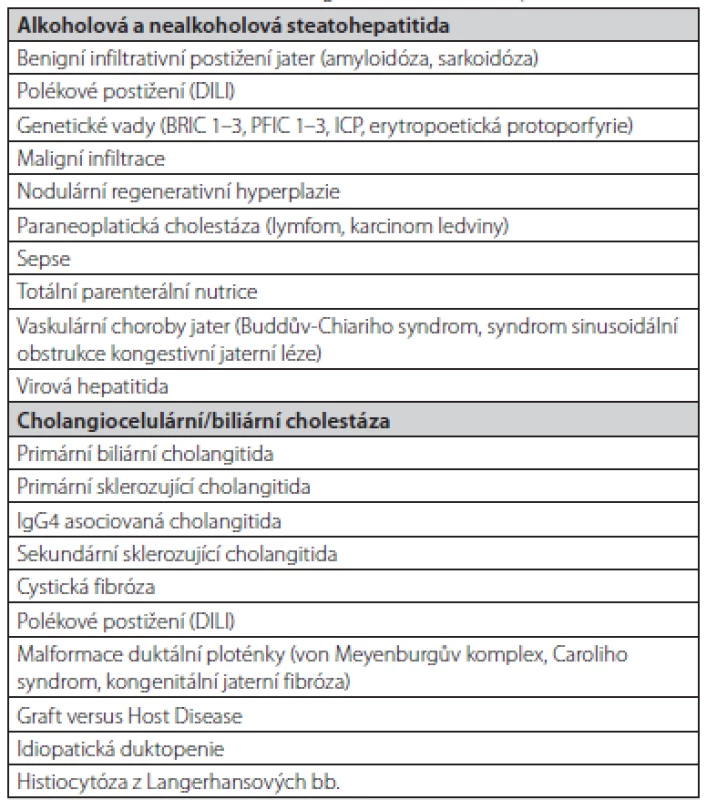
DILI – drug induced liver injury, polékové postižení jater, BRIC – benigní rekurentní intrahepatální cholestáza, PFIC – progresivní familiární intrahepatální cholestáza, ICP – intrahepatální cholestáza těhotných Obr. 1. Vyšetřovací schéma. Upraveno dle EASL (2) 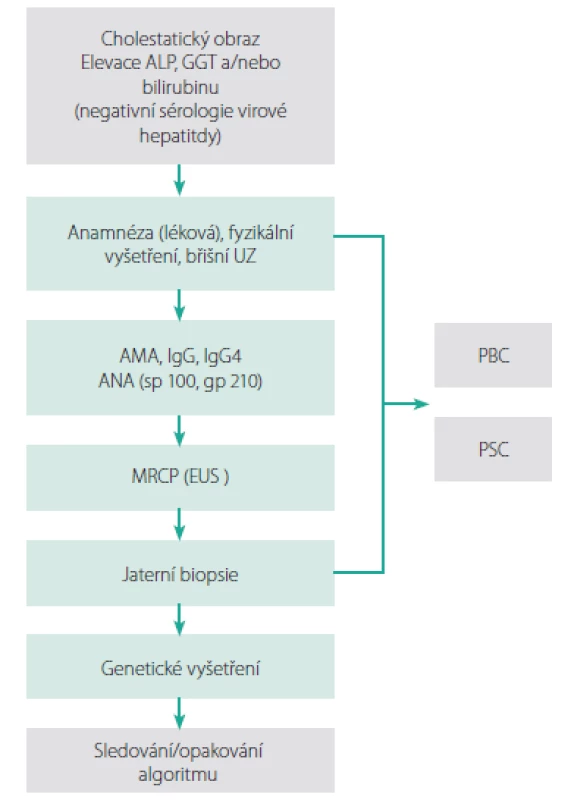
Vzhledem k vysokému výskytu polékového postižení v západních zemích je v rámci diferenciální diagnostiky na prvním místě farmakologická anamnéza. Cílíme zejména na hormonální léčbu, NSAID, betalaktamová a makrolidová antibiotika (ATB), metyldopu, chlorpromazin, izoniazid, LMWH a některá antikonvulziva, hypolipidemika a antidiabetika (Tab. 2).
Tab. 2. Nejčastější příčiny polékové cholestázy dle EASL (2) 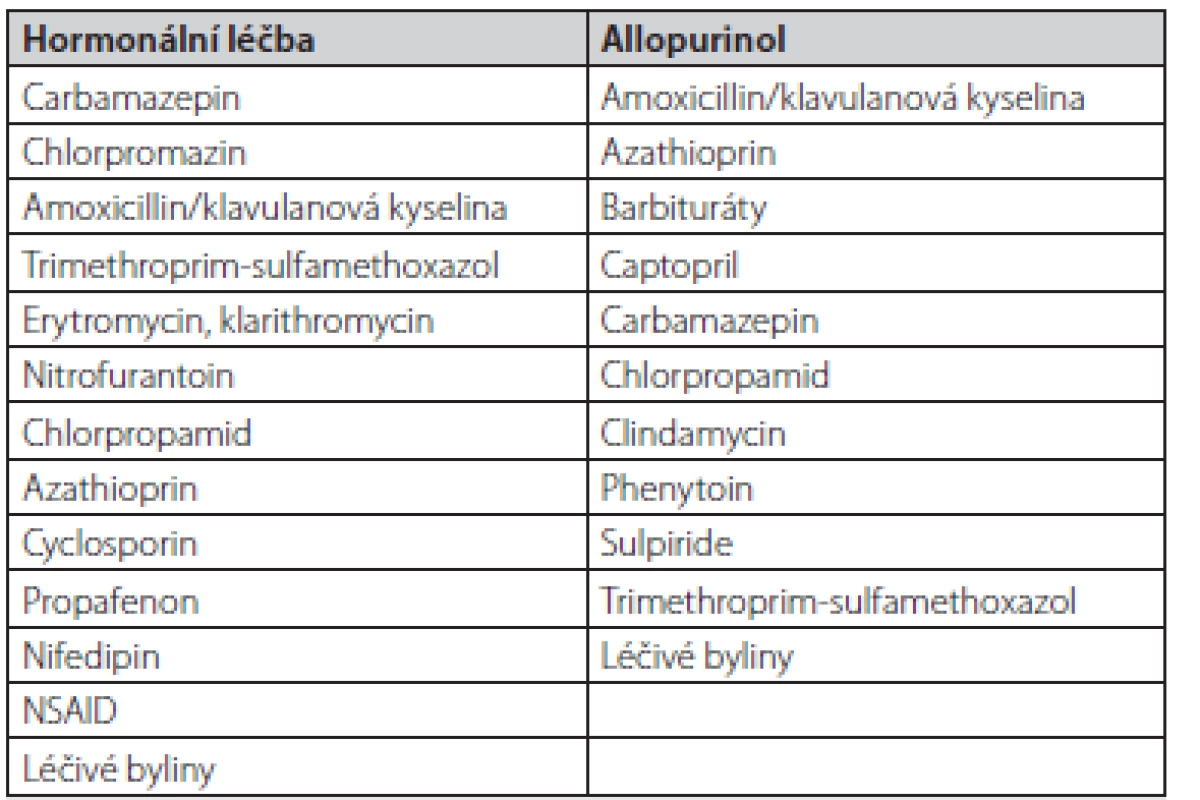
http://www.easl.eu/research/our-contributions/clinical-practice-guidelines/detail/ management-of-cholestatic-liver-diseases/report/9 Primární biliární cholangitida (PBC) a primární sklerozující cholangitida (PSC) patří v dospělosti k nejčastějším chorobám vedoucím k chronické progresivní cholestáze s rizikem rozvoje jaterní cirhózy s potřebou jaterní transplantace. Vzhledem k imunitně podmíněné etiologii obou onemocnění (PBC, PSC) u osob s cholestázou v osobní i rodinné anamnéze pátráme tedy kromě metabolických poruch též po chorobách autoimunitních (Hashimotova tyreoiditida, IBD, celiakie, Sjögrenův syndrom, revmatoidní artritida, systémová skleróza). Obzvláště asociace s IBD je u nemocných s PSC velmi silná a typická.
V klinickém obraze se nejčastěji setkáváme s pruritem a zejména v případě PBC s progredující, někdy velmi výraznou únavou. V menším procentu se objevují bolesti v pravém podžebří. U nemocných s PSC může být prvním projevem akutní bakteriální cholangoitida. Velká část nemocných je ale v době diagnózy asymptomatická a k diagnóze vede zjištění abnormálních laboratorních parametrů často indikovaných z jiných důvodů. Při fyzikálním vyšetření pátráme po přítomnosti xantalasmat, exkoriací spojených s pruritem nebo známkách již pokročilého jaterního onemocnění (hepatomegalie, splenomegalie, ikterus) a portální hypertenze (palmární erytém, pavoučkovité névy, hyperdynamická cirkulace, ascites). V časných stadiích onemocnění však fyzikální nález bývá u obou onemocnění zcela normální. Kromě zmíněného pruritu jsou obě onemocnění velmi často asociována i s poruchou kostního metabolismu, kam po stanovení diagnózy musíme cílit další vyšetření.
Typickým nálezem při základním laboratorním vyšetření je u obou chorob přítomnost různého stupně cholestázy. Hlavním znakem je zvýšení sérové aktivity alkalické fosfatázy (ALP). Při posuzování nálezu je ale nutné mít na paměti možnost elevace hodnot ALP způsobenou zvýšením střevní, kostní či placentární frakce. Hodnoty jsou tedy zcela fyziologicky zvýšené v těhotenství a bývají vyšší i u dětí v období růstu. Zvýšení gamaglutamyltransferázy (GGT) obvykle elevaci ALP doprovází. U dětí je specifičtější. Hodnoty aktivit aminotransferáz (ALT, AST) nemusí být zvýšeny. Při jejich elevaci musíme vždy myslet i na možnost překryvného syndromu s autoimunitní hepatitidou, který se může vyskytovat u PBC i PSC. Zvýšení bilirubinu se přidává až v pokročilejších stadiích onemocnění, kdy často nalézáme i pokles hodnot albuminu, trombocytů a prodloužení protrombinového času. Chronický cholestatický obraz je zpravidla provázen hypercholesterolemií.
V rámci diferenciální diagnostiky vždy provádíme ultrazvukové vyšetření břicha s dopplerovským mapováním k vyloučení extrahepatální obstrukce žlučových cest a vaskulárních onemocnění jater. PBC nemá na ultrazvukovém zobrazení žádný specifický obraz. Pouze ve vyšším procentu nemocných bývá popisována hilová lymfadenopatie benigního charakteru. PSC nemá také jasný specifický obraz. Jen v případě pokročilejšího onemocnění již můžeme zobrazit nespecifické segmentální dilatace intrahepatálních žlučovodů nebo signifikantní zesílení stěny žlučovodů, obzvláště v průběhu extrahepatálních žlučových cest. Známky jaterní přestavby a portální hypertenze nalézáme v obou případech až u pokročilého onemocnění. Elastografie jater dokáže přispět k časnějšímu odhalení významné jaterní fibrózy i následnému stagingu onemocnění (2, 3), nikoli přispět k rozlišení etiologie.
Již specifickým vyšetřením, které provádíme v případech nejasné cholestázy ještě před indikací jaterní biopsie, je zobrazení žlučového stromu pomocí magnetické rezonance – MR cholangiografie (MRC) (viz níže).
K určení prognózy u nemocných ve stadiu jaterní cirhózy je stále standardně používána Childova‑Pughova klasifikace. Při výpočtu hodnot pro stanovení Childova‑Pughova skóre u primárně cholestatických nemocí, jako jsou PBC a PSC, je vhodné používat modifikaci podle Mayo kliniky s hranicemi bilirubinemie < 70 μmol/l pro 1 bod, 70–170 μmol/l pro 2 body a > 170 μmol/l pro 3 body.
Primární biliární cholangoitida (PBC)
PBC je chronické autoimunitní jaterní onemocnění vyznačující se cholestázou přítomnou déle než 6 měsíců. Po desetiletí zažitý a používaný název primární biliární cirhóza (PBC) je od roku 2014 v Evropě a 2015 v USA změněn za název primární biliární cholangitida. Zkratka přitom zůstává stejná – PBC. Důvodem této změny byla potenciální stigmatizace nemocných použitím termínu cirhóza i u velké skupiny nemocných, kteří do stadia jaterní cirhózy v době diagnózy dosud nedospěli (2, 4). Navíc je i přesnějším označením, protože hlavním rysem onemocnění je nehnisavá chronická destruující cholangoitida.
V současné době nemáme v České republice přesná epidemiologická data o incidenci a prevalenci PBC. V Evropě je incidence udávána 0,3–5,8 nemocných na 100 000 a rok, prevalence pak v širším rozmezí od 1,9 do 40/100 000. V posledních letech má incidence i prevalence rostoucí tendenci (2). Epidemiologické studie potvrzují jasnou dominanci žen, které jsou postiženy ve více než 90 % případů, a to převážně v mladším a středním věku. Začátek choroby po 60. roce je spíše výjimečný. V posledních desetiletích ale dochází k mírnému nárůstu podílu choroby i u mužů (2).
Genetická podstata této choroby nebyla jednoznačně identifikována, ale u řady nemocných lze prokázat antigeny HLA‑B8, HLA‑DR3 či HLA‑DR4, které jsou typické i pro jiná autoimunitní onemocnění.
Etiologie a patofyziologie
Etiologie a patofyziologie není stále dostatečně objasněna. Je ale vysoce pravděpodobné, že v geneticky predisponovaném terénu se uplatňují faktory ze zevního prostředí. Klíčovou roli hraje zejména patologická imunitní reakce převážně T cytotoxických lymfocytů vedoucí k poškození nitrojaterních, převážně interlobulárních a septálních žlučovodů. Není zcela jasné, proč je zánětlivý děj primárně selektivně směřován do oblasti interlobulárního duktu. Zřetelný je však autoimunitní charakter celého patologického procesu se zkříženou reaktivitou autoprotilátek s řadou mikrobiálních i environmentálních antigenů. Aktivované T buňky také produkují cytokiny, které poškozují biliární epitelie i hepatocyty. Velkou úlohu v této reakci hraje řada prozánětlivých cytokinů produkovaných i monocyto‑makrofágovým systémem, jako je IL23, IL12, interferon γ a TNFα, které působí přímo nebo aktivují cytotoxické T buňky. Významnou roli v aktivaci zánětlivé kaskády hraje i JAK/Stat a NFκB signální dráha. Dnes je za jeden z důležitých patofyziologických mechanismů považováno i poškození cholangiocytů s narušením sekrece již zmíněné ochranné vrstvy glykokalix a narušení „bikarbonátového deštníku“ chránícího cholangiocyty před toxickým efektem žlučových kyselin. Jednou z hlavních složek tohoto systému je na Na+ nezávislá Cl-/HCO3 - pumpa (AE2 – anion exchanger 2). U nemocných s PBC je exprese této pumpy snížena. Důsledkem je pak vyšší toxický efekt hydrofobních žlučových kyselin s možným proapoptotickým působením, další down‑regulací AE2 pumpy a indukcí tvorby reaktivních kyslíkových radikálů (2).
Současně dochází k aktivaci eozinofilů a žírných buněk. Výsledkem je progresivní granulomatózní zánět vedoucí k duktopenii a zvýšené aktivitě a transformaci hvězdicovitých buněk s následnou fibroprodukcí a rozvojem zvýšeného portálního tlaku. Onemocnění se tak svými rysy řadí též mezi příčiny takzvaného syndromu mizejících žlučovodů.
Diagnostika
Základní laboratorní a imunologické vyšetření
Hlavním laboratorním znakem u nemocných s PBC je zvýšení sérové aktivity alkalické fosfatázy (ALP). Nejdůležitějším, vysoce senzitivním a specifickým vyšetřením (senzitivita ≥ 90 %, specificita ≥ 95 %) při podezření na PBC je stanovení antimitochondriálních protilátek (AMA) (5). Nepřímou imunofluorescencí lze rozlišit 9 typů AMA, pro PBC je charakteristická pozitivita anti‑M2 AMA. Tyto protilátky jsou namířeny proti E2 podjednotce pyruvátdehydrogenázového komplexu (PDC‑E2) mitochondrií. Vyskytují se u více než 90 % nemocných s PBC (6). Negativní nález bývá asi u 5 % nemocných s diagnózou PBC. Na druhou stranu izolované zvýšení AMA bez přítomné cholestázy neznamená diagnózu PBC a v určitém procentu jej můžeme nalézt i u zdravých jedinců. V běžné populaci je výskyt AMA uváděn 1/1 000 (2). V případě, že máme nemocného s AMA pozitivitou, bez vyjádřené cholestázy, měli bychom ho dále sledovat (2). Riziko rozvoje PBC je v tomto případě uváděno 14–15 % v horizontu 5 let (7).
U části nemocných (30 %) s PBC můžeme prokázat přítomnost i antinukleárních protilátek (ANA). Senzitivita je nízká, ale specificita u podtypů anti sp-100 a anti gp-210 je vysoká (> 95 %) a lze je využít v případech AMA negativity (6, 8). Nespecifickým, ale poměrně častým nálezem je i polyklonální zvýšení IgM protilátek.
Histologie
Pro PBC je v jaterní histologii charakteristický nález nehnisavé cholangoitidy s destrukcí malých interlobulárních a septálních žlučovodů. Zánětlivá, převážně lymfocytární, infiltrace je lokalizována kolem malých žlučovodů a je tvořena převážně T‑lymfocyty a menšinovou populací B‑lymfocytů, makrofágů a eozinofilů. Typický epiteloidní granulom se podaří prokázat v menším procentu případů. V závislosti na stadiu onemocnění je dále přítomna duktopenie, depozice kolagenu až do obrazu cholestatické jaterní cirhózy. V histologii by se měl hodnotit zejména stupeň fibrózy, duktopenie a množství orcein‑pozitivních granul (2). Toto hodnocení je v současnosti preferovanější, protože lépe koreluje s prognózou, než dříve používané hodnocení dle Ludwiga a Scheuera (9).
Vzhledem k vysoké specificitě antimitochondriálních protilátek je v současné době pro potvrzení diagnózy dostatečné splnění dvou ze 3 kritérií, mezi která patří: cholestatický laboratorní obraz, pozitivita AMA a typický nález v jaterní biopsii. Z tohoto pohledu je dnes jaterní biopsie indikována spíše jen v nejasných případech AMA a ANA negativní PBC nebo při podezření na překryvný syndrom s autoimunitní hepatitidou (AIH) (2, 3).
Prognostické ukazatele a dispenzarizace
PBC je progresivním onemocněním s vysokým rizikem rozvoje jaterní cirhózy, portální hypertenze a všech komplikací s nimi asociovanými.
Prognóza nemocných v době diagnózy je určována na základě demografických parametrů (věk, pohlaví), základních parametrů laboratorních (zejména hodnoty sérového bilirubinu a albuminu) a pokročilosti jaterního onemocnění (histologické vyšetření a/nebo neinvazivní metody stanovení stupně jaterní fibrózy) (2, 3, 10). AMA protilátky se na vlastní etiopatogenezi nepodílejí, a proto výše jejich hladiny není ukazatelem tíže onemocnění či odpovědi k léčbě.
Ke kalkulaci odhadu rizika je používáno Mayo risk skóre (MRS), které je dále spolu s MELD skóre používáno i v rozhodování o indikaci k transplantaci jater (2, 11). Pro výpočet obou skóre jsou standardně používány webové kalkulátory (www.mayoclinic.org). I provedení jaterní elastografie dokáže přispět k určení stadia onemocnění. V případě nálezu hodnot nad 9,6 kPa (při tranzientní elastografii – TE) považujeme onemocnění za pokročilé (2).
Důležitým prognostickým ukazatelem v průběhu léčby je odpověď na terapii UDCA. Na základě vývoje základních laboratorních parametrů se u léčených nemocných, nejčastěji po 12 měsících, provádí stanovení odpovědi na léčbu (Tab. 3). Tato odpověď je podle řady retrospektivních a prospektivních dat vysoce validním ukazatelem míry rizika další progrese onemocnění (12–23).
Tab. 3. Skórovací systémy k vyhodnocení odpovědi na léčbu UDCA u nemocných s PBC 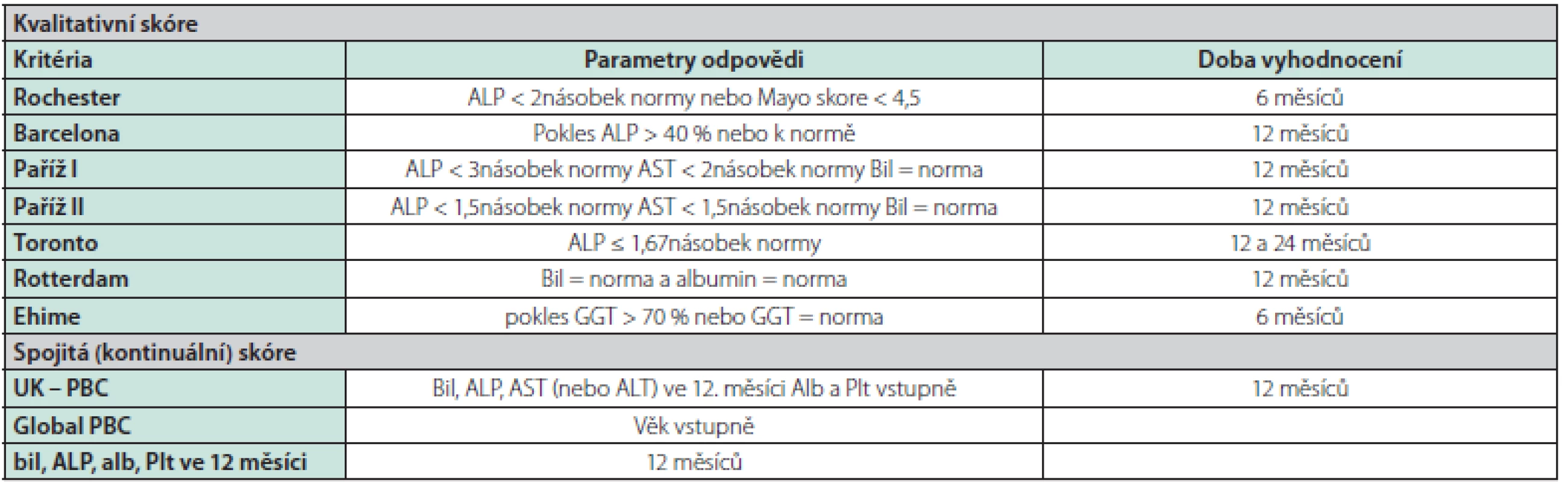
Bil – bilirubin, ALT – alaninaminotransferáza, AST – aspartátaminotransferáza, alb – albumin, Plt – trombocyty, UDCA – ursodeoxycholová kyselina Všichni nemocní mají být dispenzarizováni. U nemocných ve stadiu jaterní cirhózy je indikováno standardní sledování jako u ostatních nemocných s jaterní cirhózou jiné etiologie, a to jak ultrazvukové screeningové kontroly k vyhledávání hepatocelulárního karcinomu, tak i pravidelné gastroskopické kontroly k zjištění klinicky významné portální hypertenze podle daných doporučení (2). Nemocné bez jaterní cirhózy v závislosti na výše uvedených rizikových faktorech sledujeme obvykle v intervalech 6 měsíců. Vždy monitorujeme základní laboratorní ukazatele pokročilosti a aktivity choroby (sérový bilirubin, ALP, AST, albumin, trombocyty) (2). Dle možností je vhodné k časné diagnostice progrese onemocnění v ročních intervalech provádět jaterní elastografii. Názory na provádění dispenzárních ultrazvukových kontrol u nemocných v pokročilejším stadiu bez cirhózy nejsou jednoznačné. U nemocných s pokročilejším onemocněním (tuhost jater vyšetřená pomocí TE ≥ 9,6 kPa nebo III. stadium dle jaterní histologie) a přítomnosti rizikových faktorů provádíme UZ sledování obvykle jednou za 6–12 měsíců (3).
Léčba PBC
Z pohledu testování a hodnocení výsledků léčby v randomizovaných studiích je u PBC problematická pomalá progrese onemocnění a povětšinou velký rozdíl v pokročilosti choroby u jednotlivých nemocných v době diagnózy. V řadě studií proto není adekvátně hodnocena doba přežívání nebo doba do potřeby transplantace jater. Hodnoceny jsou převážně již dříve verifikované a obecně přijímané, jak laboratorní, neinvazivní, tak histologické ukazatele rizika progrese (ALP, bilirubin, albumin, výsledky hodnocení tuhosti jater pomocí jaterní elastografie, stupeň jaterní fibrózy) (12, 14–21).
Léčba 1. linie
Ursodeoxycholová kyselina (UDCA)
Ursodeoxycholová kyselina je dnes jednoznačně léčbou první volby u všech nemocných s PBC. UDCA je u člověka terciální žlučovou kyselinou a v lidské žluči je obsažena v 1–3 %. Jedná se o 7β‑epimer chenodeoxycholové kyseliny (CDCA). Je hydrofilnější než její strukturní analog. Jak naznačuje její název, UDCA je primární žlučovou kyselinou medvědů (Ursidae). Z jejich žluče byla v minulosti také získávána. V evropské medicíně se objevuje jako chemicky částečně syntetizovaná molekula od 70. let minulého století. První prospektivní randomizovaná studie s UDCA u nemocných s PBC byla publikována v roce 1989 (24).
Efekt UDCA je velmi široký a všechny úrovně, na kterých UDCA působí, nejsou dosud rozpoznány. V experimentu byl prokázán efekt UDCA na snížení reabsorbce hydrofobních žlučových kyselin v terminálním ileu (kompetice), zvýšení pólu hydrofilních žlučových kyselin ve žluči, stabilizaci membrán i imunomodulační efekty. V hepatocytu zvyšuje expresi BSEP (bile salt export pump), snižuje permeabilitu mitochondriální membrány a má efekt antiapoptotický (25). Na úrovni cholangiocytu zvyšuje expresi AE2, cholerézu a tím sekreci HCO3 a ochranu cholangiocytu s antiapoptotickým a protizánětlivým efektem. V klinické praxi byl efekt UDCA na průběh PBC pozitivně testován v různých dávkách (5–25 mg/kg/den) a jako optimální se jeví podávání 13–15 mg/kg/den. Bylo prokázáno zpomalení progrese onemocnění do významné fibrózy nebo cirhózy a udržení časného stadia (26). Tři velké prospektivní randomizované studie (548 pacientů) u nemocných se středně až více pokročilým onemocněním prokázaly u léčených nemocných snížení potřeby transplantace jater a letality v porovnání s placebem o 1/3 (2, 27, 28). Následná metaanalýza více než 1 000 nemocných ze sedmi RCT z roku 2006 tyto výsledky potvrdila a navíc ukázala větší profit u nemocných s nižším stadiem jaterní fibrózy (stadium I a II) (29).
Nejvýznamnější data podporujících indikaci UDCA pochází z retrospektivní analýzy Global PBC study group z roku 2014 (4 845 nemocných), kdy v horizontu 5, 10 a 15 let v porovnání s neléčenou skupinou opět ukázala signifikantní rozdíl (90 vs. 78 %, 66 vs. 79 % a 59 vs. 32 %) v prodloužení doby do transplantace i přežívání (23, 30).
Obecně platí, že léčba UDCA je velmi bezpečná. V některých případech byl popsán vzestup hmotnosti, dyspeptické potíže a průjmy. Procento nemocných, u kterých je však nutno léčbu pro nežádoucí účinky přerušit, je ale malé (3–20 %) (31).
Za validní ukazatele adekvátní odpovědi na léčbu jsou dnes považovány základní laboratorní hodnoty, zejména aktivita alkalické fosfatázy a koncentrace sérového bilirubinu. Podle některých kritérií i aktivita AST, koncentrace sérového albuminu a hodnoty trombocytů (Tab. 3). Do budoucna se jako perspektivní jeví i neinvazivní metody vyšetřování jaterní fibrózy (32). Ne všichni nemocní bohužel na terapii UDCA odpoví adekvátním poklesem nebo normalizací těchto laboratorních hodnot. Hůře odpovídají nemocní mladší 45 let, muži a nemocní v pokročilejším stadiu jaterního onemocnění s vyšší hodnotou bilirubinu. V histologickém nálezu je negativním prediktivním ukazatelem pokročilejší stadium jaterní fibrózy, vyšší stupeň lymfocytárního periportálního infiltrátu a duktopenie. Počet nemocných, kteří na léčbu neodpoví, je uváděn v poměrně širokém rozmezí (5–25 %).
V poledních 10 letech vzniklo několik skórovacích prediktivních systémů založených především na laboratorních datech pro vyhodnocení odpovědi či ne‑odpovědi na léčbu (Tab. 3). V současnosti je zřejmé, že u nemocných v časném stadiu jaterní choroby s dobrou odpovědí na léčbu hodnocenou dle poklesu základních laboratorních parametrů (ALP < 1,5násobek normy, normální sérový bilirubin) se přežívání blíží obecné srovnatelné populaci (2). U nemocných s pokročilejším stadiem onemocnění v době diagnózy a dobrou odpovědí na léčbu UDCA tato léčba prodlužuje přežívání a snižuje potřebu transplantace jater (33). Naopak ve skupině bez adekvátní odpovědi (pokles ALP a bilirubinu) je přežívání signifikantně kratší.
Pro tuto podskupinu nemocných se stále hledá adekvátní léčba. V současné době se jako potenciálně nejvíce slibné léky pro druhou linii terapie jeví kyselina obeticholová a bezafibrát.
Léčba 2. linie
Obeticholová kyselina (OCA)
Obeticholová kyselina je derivátem chenodeoxycholové kyseliny. Na rozdíl od UDCA má však afinitu k FXR receptoru, kde působí jako agonista. Tento receptor hraje zásadní roli v řízení metabolismu žlučových kyselin i v celé řadě dalších metabolických procesů. Aktivace nukleárního FXR receptoru v enterocytech terminálního ilea vede k produkci FGF - 19, který zpětnovazebně snížením aktivity cholesterol-7α‑hydroxylázy redukuje syntézu žlučových kyselin v játrech. Působí i jako růstový faktor cholangiocytů a hepatocytů. Naopak při snížené aktivitě FXR je popisována zvýšená exprese ASBT (apical sodium bile acid transporter), která vede ke zvýšené reabsorpci žlučových kyselin s možným vlivem na apoptózu hepatocytů. Aktivace FXR receptoru je spojena i s řadou metabolických účinků, jako jsou snížení jaterní glukoneogeneze, zvýšení β‑oxidace mastných kyselin, zlepšení periferní inzulinové senzitivity a protizánětlivé účinky.
U nemocných s PBC, kteří neodpověděli adekvátně na terapii UDCA podle Torontských kritérií (ALP > 1,67 ULN a/nebo nadhraniční koncentrace sérového bilirubinu do 2násobku normy), byl prospektivně prokázán signifikantní pokles ALP a bilirubinu kombinovanou léčbou UDCA a OCA (34). Na základě těchto dat byla OCA jako inovativní lék nejprve FDA a dále Evropskou lékovou agenturou (EMA) podmínečně v kombinační léčbě s UDCA schválena jako možná terapie u nemocných s nedostatečnou odpovědí na terapii UDCA. Pozitivní efekt na hlavní laboratorní ukazatele cholestázy byl potvrzen přitom i v monoterapii (35). V současné době EASL navrhuje zvážit podání OCA jako léčbu 2. linie u nemocných s neadekvátní odpovědí na dvanáctiměsíční léčbu UDCA (ALP > 1,67 × ULN a/nebo zvýšená sérová koncentrace celkového sérového bilirubinu do 2násobku normy) nebo u nemocných, kteří nemohou UDCA užívat pro intoleranci nebo hypersenzitivitu. Uvedená horní hranice bilirubinu přitom tvoří bezpečnostní bariéru. Dosud totiž nejsou dostupná data o efektu a bezpečnosti léčby u nemocných v pokročilejších stadiích jaterního onemocnění (jaterní cirhóza ve stadiu B nebo C dle Childa a Pugha). Při hodnocení sérových koncentrací bilirubinu je třeba též zvažovat, zda se nejedná o jedince se současným Gilbertovým syndromem (5–7 % populace). Nejvýznamnějším rizikem při terapii OCA se v současnosti jeví spolu se zhoršením pruritu i riziko dekompenzace jaterní choroby u nemocných v pokročilejším stadiu onemocnění (2). Případná terapie musí proto probíhat za bedlivého sledování dle daných poručení (2, 3). Pozitivní odpověď na léčbu lze ze známých dat lze očekávat u 40–50 % nemocných (34, 35).
V České Republice je OCA registrována od roku 2019. Nezodpovězená je otázka nákladové efektivity této terapie. Nákladová studie byla zatím provedena pouze v USA (36).
Fibráty
Fibráty jsou léky užívané běžně v terapii dyslipidemií. Jejich účinek je dán agonistickým působením na PPARα receptorech, které se uplatňují nejen v metabolických pochodech, ale i na úrovni reakcí monocyto‑makrofágového systému i metabolismu samotného hepatocytu a cholangiocytu. Nepřímo ovlivňují i produkci žlučových kyselin (2). Z tohoto důvodu je tato léková skupina v posledních letech testována jako možná terapie PBC. V menších studiích přidání bezafibrátu (400 mg/ den) v kombinaci s UDCA v porovnání s placebem vedlo k normalizaci ALP, bylo popsáno zlepšení pruritu (37) i trend k lepšímu přežívání (38). Celková biochemická odpověď u předchozích nonrespondentů byla uváděna v 69 % (39).
Nejvýznamnější data přinesla prospektivní randomizovaná studie (BEZURSO) ukončena v roce 2017, která sledovala efekt bezafibrátu v dávce 400 mg/den v kombinaci s UDCA. Výsledky ukázaly normalizaci aktivity ALP u 67 % léčených nemocných spolu se signifikantní redukcí únavy, pruritu i částečný pokles neinvazivních parametrů jaterní fibrózy (40). U léčených nemocných nebyl přitom zaznamenán zvýšený výskyt závažných nežádoucích účinků. Výsledky této studie nebyly doposud sice zohledněny v mezinárodních doporučeních, ale bezafibrát je jistě dalším slibným lékem pro nemocné bez adekvátní odpovědi na terapii UDCA. Z pohledu potenciální léčby fibráty je třeba velké pozornosti na současné podávání NSAID vedoucí k výrazně vyššímu riziku nežádoucích účinků, zejména jaterního a renálního poškození (2).
Budesonid
Budesonid je syntetický kortikosteroid s vysokým first‑pass metabolismem v játrech a nízkými systémovými nežádoucími účinky. Pozitivní efekt systémových kortikoidů kromě overlap syndromu PBC s AIH na průběh onemocnění nebyl dosud dokumentován. V případě budesonidu je však známo, kromě jeho protizánětlivých účinků, i jeho synergické působení s UDCA na expresi AE2, jako jednoho z protektivních faktorů cholangiocytu (41)
Jeho efekt byl dosud zkoušen v několika menších studiích se slibným efektem (42, 43). Větší prospektivní studie ale zatím chybí.
U ostatních preparátů, které byly zkoušeny, se efekt na zpomalení progrese PBC neprokázal (azathioprin, methotrexát, D‑penicilamin, kolchicin).
Transplantace jater
Indikace k transplantaci jater se u nemocných s PBC řídí stejnými pravidly jako u nemocných s jaterní cirhózou na podkladě jiné etiologie. Pokročilost jaterního onemocnění se pro potřeby transplantace vyjadřuje jak pomocí zmíněného modifikovaného Childova‑Pughova skóre, tak pomocí MELD skóre. U nemocných s PBC navíc provádíme kalkulaci Mayo risk skóre a zohledňujeme odpověď na terapii UDCA pomocí již zmíněných skórovacích systémů, kdy využíváme zejména PBC Global score.
Primární sklerozující cholangitida (PSC)
Primární sklerozující cholangitida (PSC) je další ze skupiny chronických progresivních zánětlivých autoimunitně podmíněných cholestatických jaterních chorob. Hlavním rysem tohoto onemocnění jsou zánětlivé a následně fibrózní a stenotické změny intrahepatálních a extrahepatálních žlučovodů. S progresí cholestázy v konečném důsledku opět vzniká jaterní cirhóza s rozvojem portální hypertenze a všech jejích komplikací. Již zmíněným typickým rysem je silná asociace onemocnění s idiopatickým střevním zánětem. 60–75 % nemocných má IBD kolitidu (44, 45). V průběhu onemocnění jsou pacienti s PSC ohroženi rozvojem sekundární bakteriální cholangitidy. Významné je vysoké riziko vzniku cholangiogenního karcinomu i dalších malignit, zejména karcinomu žlučníku, pankreatu a u nemocných s asociovanou PSC‑IBD kolitidou i karcinomem tračníku a rekta.
Incidence PSC se v Evropě udává 0–1,3/10 000/rok, prevalence pak v širším rozmezí od 1 do 16,2/10 000 (46). Největší výskyt onemocnění je popisován v severských zemích Evropy a naopak výrazně nižší v Asii. Nejčastěji je onemocnění diagnostikováno ve věku 30–40 let. Epidemiologická data potvrzují větší výskyt u mužů (60–75 %) (44–46). Medián dožití bez potřeby transplantace je uváděn v rozmezí 10–21 let (47, 48). Mírnější průběh mívají nemocní s postižením pouze malých nitrojaterních žlučovodů (small‑duct PSC), nemocní se začátkem onemocnění v mladším věku a ženy (49).
Etiologie a patofyziologie
Etiologie a patofyziologie PSC není dosud objasněna. Podle současné teorie rozvoje imunopatologického děje hraje na jedné straně opět významnou úlohu genetická dispozice (asociace s HLA komplexem, HLA‑B8, HLA‑DR3) a na straně druhé vlivy zevního prostředí s dosud ne jasně definovanými spouštěcími faktory. Z vlivů zevního prostředí je zmiňován vliv výživy, životního prostředí a životního stylu. V posledních letech narůstá množství informací o možném vlivu střevní mikroflóry, jejího složení (snížená bakteriální diverzita, změna složení) a vlivu zvýšené střevní propustnosti na spuštění imunopatologického děje (50). Významnou úlohu zřejmě hraje i aberantní exprese adhezních molekul v játrech a abnormální migrace střevních lymfocytů, stejně tak jako zvýšená aktivita T buněk proti mikrobiálním antigenům (51, 52). Za významný a potenciálně farmakologicky ovlivnitelný se uvádí také na jedné straně cytotoxický efekt žlučových kyselin a protektivní mechanismy cholangiocytů na straně druhé, včetně narušení sekrece ochranné vrstvy glykokalix a „bikarbonátového deštníku“. Významnou roli hraje signální cesta ovlivňující funkce cholangiocytu cestou TGR5 receptoru a produkce glykokalix stabilizujícího enzymu fucosyltransferázy 2 (FUT2) (52).
Diagnostika
Základní laboratorní a imunologické vyšetření Hlavním znakem je u PSC opět zvýšení sérových hodnot alkalické fosfatázy (ALP). PSC na rozdíl od PBC ale nemá žádný patognomonický imunologický laboratorní test. Nejčastějším nálezem bývá pozitivita atypických perinukleárních antineutrofilních protilátek (p‑ANCA), které nalézáme u 26–93 % nemocných. Nejsou však specifické pouze pro diagnózu PSC a nemají též prognostickou hodnotu. Častý je též průkaz ANA (8–77 %) i anti‑SMA (0–83 %) (53).
Asi u 10 % nemocných můžeme též nalézt zvýšené hodnoty IgG4, které jsou jinak specifické pro cholangitidu asociovanou s IgG4 chorobou (54). Diferenciální diagnostika PSC a IgG4 cholangitidy bývá přitom někdy poměrně obtížná. U IgG4 cholangitidy nalézáme zvýšení IgG4 > 2,8 g/l. Zvýšení v šedé zóně od 1,4 do 2,8 g/l je nediagnostické a vyžaduje další vyšetření (55). Dalším pomocným ukazatelem pro IgG4 chorobu může být poměr IgG4 a IgG1 > 0,24 (56). V diferenciální diagnostice IgG4 cholangitidy pomáhá i průkaz postižení dalších orgánů (slinné žlázy, pankreas, ledviny), histologický nález s průkazem IgG4 pozitivních plazmatických buněk a odpověď na léčbu kortikoidy (HISORt kritéria) (57).
Protilátky proti glykoproteinu 2 ve třídě IgA (anti GP2 IgA), které jsou spojeny s těžším průběhem Crohnovy choroby, jsou v poměrně vysokém procentu (46–72 %) nalézány i u nemocných s PSC. Některé práce je dávají do souvislosti s postižením velkých žlučovodů a rizikem rozvoje cholangiogenního karcinomu. V případě potvrzení těchto dat by mohly sloužit jako nový ukazatel rizika (58).
V posledních letech je u nemocných s PSC popisován i průkaz protilátek proti žlučovému epitelu (BEC‑Ab, Biliary Epithelial Cells). Tyto protilátky ve třídě IgA, by mohly mít též prognostický význam a některá data ukazují, že se uplatňují i v rámci imunopatologického děje (53).
Zobrazovací vyšetření
Za hlavní diagnostickou metodu je v současné době považováno zobrazení žlučového stromu pomocí magnetické rezonance – MR cholangiografie (MRC) (Obr. 2a). Při tomto vyšetření nalézáme typický obraz segmentálních stenóz žlučovodů a v závislosti na typu a stadiu onemocnění i více nebo méně výraznou suprastenotickou dilatací.
Endoskopická retrográdní cholangiografie (ERCP) se provádí dle současných doporučení (EASL/ESGE) jako primárně diagnostické vyšetření jen v případě, že MRCP a jaterní biopsie jsou z nějakého důvodu kontraindikovány a trvá klinické podezření na PSC (45) (Obr. 2 b).
Obr. 2. Chronické cholestatické jaterní choroby 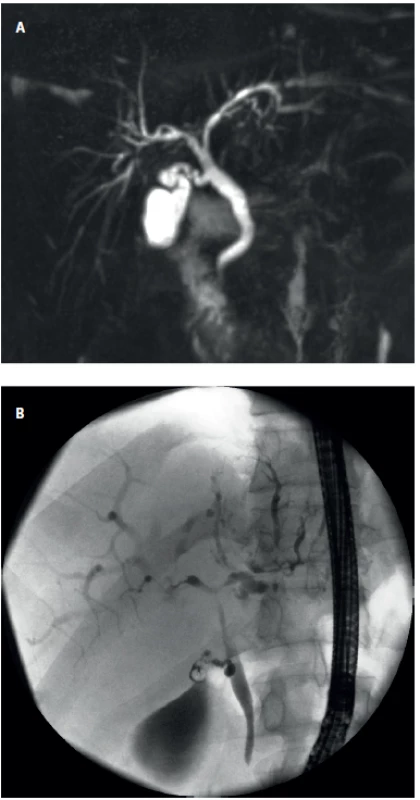
Histologie
Vzhledem ke specifickému nálezu na zobrazovacích vyšetřeních je histologické vyšetření jaterní biopsie indikováno opět spíše jen v případech podezření na překryvný syndrom s autoimunitní hepatitidou nebo formu s postižením pouze malých nitrojaterních žlučovodů (small duct PSC), kdy je nález na MRCP nebo ERCP normální. I histologický nález nemusí být ale jednoznačný. Primární sklerozující cholangitida má totiž v parenchymu jater značně fokální distribuci. U některých nemocných jsou zánětlivé změny soustředěny v okolí velkých žlučovodů v hilu a patolog ve standardní biopsii spatří jen sekundární nespecifické projevy cholestázy. Typickým histologickým rysem pro PSC je periduktální fibróza s cibulovitým vrstvením pojivové tkáně, dále jsou přítomny zánětlivé změny a edém. Žlučovody atrofují a postupně se jizví. Stupeň postižení lze z hlediska pokročilosti klasifikovat do 4 stupňů, podobně jako u PBC. V diferenciální diagnostice je histologické vyšetření též důležité k odlišení IgG4 choroby, pro kterou je typické vysoké zastoupení IgG4 pozitivních plazmatických buněk.
Diferenciální diagnostika PSC
Diferenciální diagnostika zahrnuje zejména IgG4 chorobu, cholangiogenní karcinom a všechny stavy vedoucí k sekundární sklerozující cholangitidě, zejména obtížnou choledocholitiázu a hepatikolitiázu a chirurgické zákroky na žlučových cestách. MRCP/ERCP obraz podobný až shodný s primární sklerozující cholangitidou je znám u cholangiopatie u AIDS, parazitárních postižení žlučovodů, imunosuprimovaných pacientů, po intraarteriální chemoterapii jater a u ischemických lézí, např. po transplantaci (Tab. 4)
Tab. 4. Příčiny sekundární sklerozující cholangitidy a stavy, které mohou MRCP/ERCP nálezem PSC napodobovat (45) 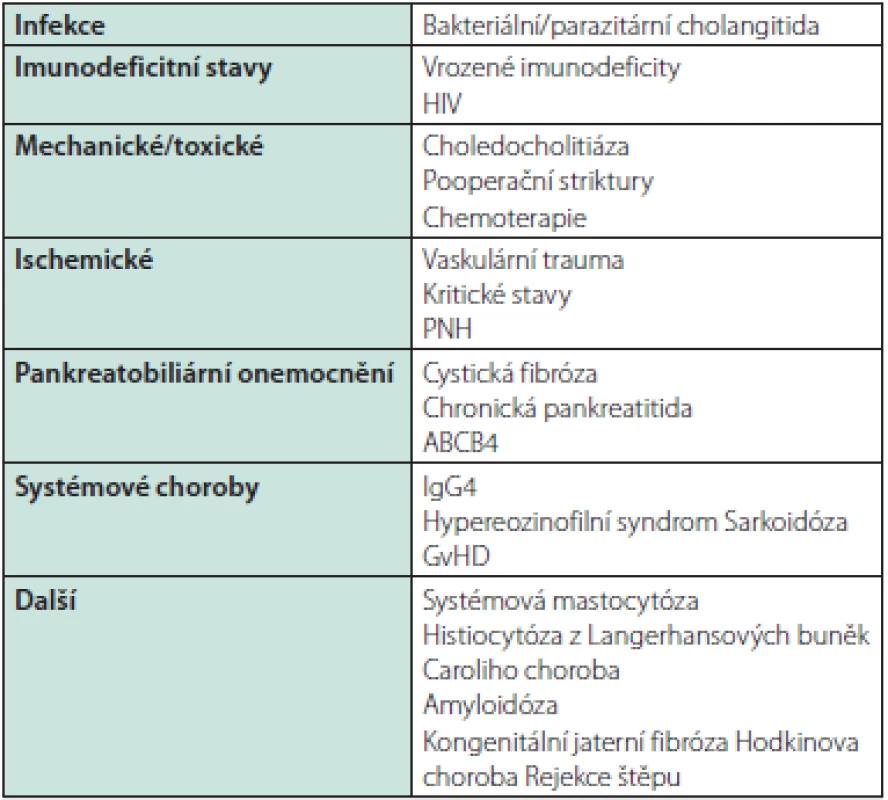
PNH – paroxysmální noční hemoglobinurie, HIV – virus lidské imunitní nedostatečnosti U mladších nemocných musíme myslet i na vrozené anomálie žlučového stromu. U dětí a adolescentů je klinický obraz primární sklerozující cholangitidy navíc velmi podobný autoimunitní hepatitidě nebo může jít až o překryvný syndrom se známkami jak hepatocelulárního, tak cholestatického postižení. Charakteristika MRCP/ERCP nálezu bývá vodítkem pouze částečným (Tab. 5) a spektrum nutných vyšetření k vyloučení jiné etiologie je dále velmi široké.
Tab. 5. Charakteristiky cholangiografických nálezů u jednotlivých cholangiopatií (45) 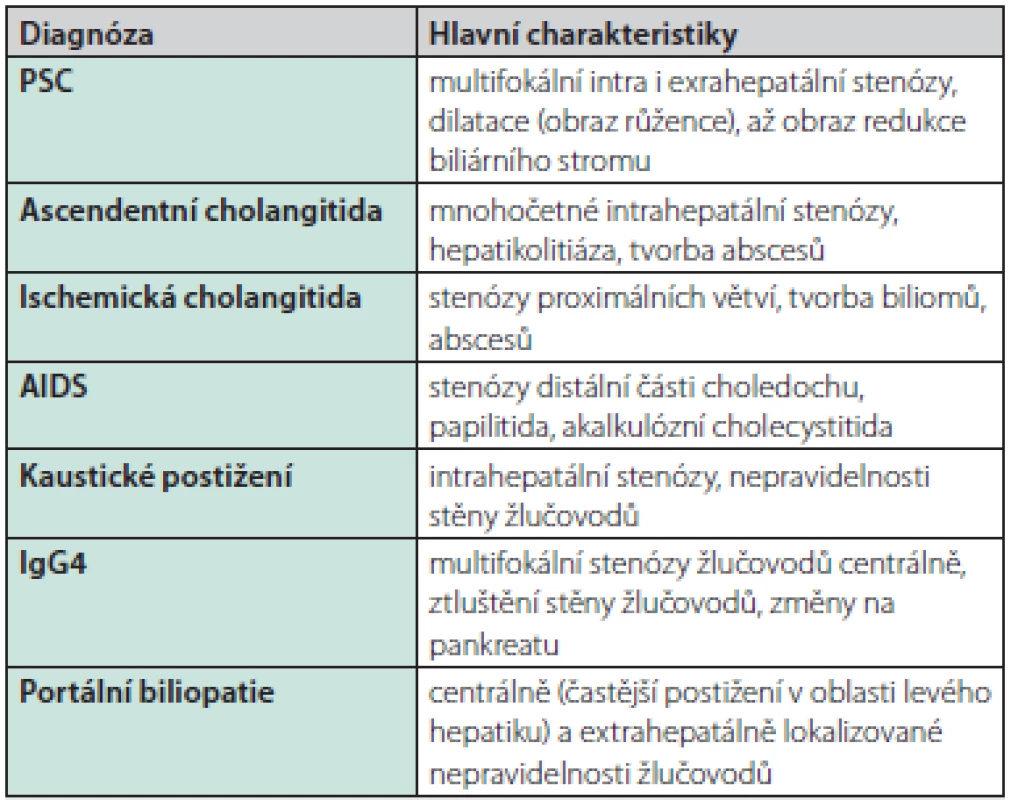
PSC – primární sklerozující cholangitida, AIDS – získaný syndrom imunitní nedostatečnosti Určení prognózy onemocnění
Nemocní s PSC tvoří značně heterogenní skupinu s různým průběhem onemocnění a rozdílnou prognózou. Mírnější průběh mívají zejména nemocní s postižením pouze malých nitrojaterních žlučovodů (small duct PSC), nemocní se začátkem onemocnění v mladším věku a ženy (59–61) (Tab. 6). Lepší průběh onemocnění je popisován i u nemocných s poklesem ALP v průběhu choroby nebo v souvislosti s terapií ursodeoxycholovou kyselinou. Tato asociace není ale zdaleka tak silně dokladována jako u nemocných s PBC (62–65).
Tab. 6. Prognostické ukazatele u nemocných s primární sklerozující cholangitidou (52) 
ALP – alkalická fosfatáza, UDCA – ursodeoxycholová kyselina, AIH – autoimunitní hepatitida, PSC – primární sklerozující cholangitida K určení prognózy v pokročilejších stadiích onemocnění je standardně používána Childova‑Pughova klasifikace v modifikaci podle Mayo kliniky (viz výše).
Novější Mayo risk skóre (MRS) může mít lepší prognostický přínos v případě méně pokročilého onemocnění. Je vhodné ke stanovení prognózy v době diagnózy i v dalším průběhu sledování nemocného (66). Výpočet je možný na řadě webových kalkulátorů (http://www. psc‑literature. org/mrscalc.htm)
Léčba
V současné době není pro farmakoterapii PSC jednoznačné doporučení, i když UDCA je stále jedním z hlavních léků chronických jaterních onemocnění s cholestázou.
Obtížné je hodnocení efektu terapie. Na rozdíl od PBC, u které existují jednoznačná data prokazující korelaci mezi hladinou ALP a sérového bilirubinu a jejich poklesem při terapii UDCA a prognózou nemocného, u PSC jasný sérový ukazatel zatím nemáme. I u PSC sice existují práce ukazující pokles ALP jako jeden z ukazatelů prognózy, pro jednoznačná doporučení ale nejsou tato data zatím dostatečně silná (62–65). Hodnocení nálezů při zobrazovacích vyšetřeních MRCP/ERCP je v prospektivních studiích také poměrně obtížné.
Ursodeoxycholová kyselina (UDCA) je v současné době lékem volby u řady cholestatických jaterních onemocnění, zejména u nemocných s primární biliární cholangitidou (PBC) (2, 3). Pro svůj léčebný potenciál u cholestatických stavů byla dlouhá léta užívána i v terapii PSC. Její místo v terapii PSC je ale v současné době stále kontroverzní, což se odráží i v doporučeních jednotlivých hepatologických a endoskopických společností. U nemocných s PSC byla UDCA v minulosti zkoušena v různém dávkování.
Významný zlom v pohledu na užití UDCA přinesla data ze studie Lindora prokazující negativní efekt léčby vysoko dávkovanou UDCA (> 28 mg/kg/den) (67, 68). Léčba vysokou dávkou byla spojena s vyšším rizikem dekompenzace jaterního onemocnění, vyšší potřebou transplantace i úmrtností. Signifikantně negativní efekt byl sice zaznamenán pouze u nemocných s nízkým stupněm pokročilosti podle histologie nebo normální hladinou celkového sérového bilirubinu (68), ale významně ovlivnil následná doporučení.
Na základě těchto výsledků Americká asociace pro studium jater (AASLD) léčbu UDCA u nemocných s PSC nedoporučuje (69).
Na druhou stranu existují data prokazující pozitivní efekt UDCA v nižším a středním dávkování. Metaanalýza studií s nižším dávkováním (13–15 mg/kg/den) ukazuje zlepšení biochemických parametrů a analýza prací se střední dávkou (13–17 mg/kg/den) zlepšení jak biochemického tak histologického nálezu (70, 71).
Na rozdíl od PBC, kde je jasně dokumentovaná korelace poklesu ALP s terapií UDCA a lepšího přežívání, u nemocných s PSC nejsou tato data zcela jednoznačná. Některé studie tento vztah ale ukazují (62, 63, 65, 72). Z tohoto pohledu je pak zajímavá menší práce dokumentující naopak negativní vliv ukončení dlouhodobé terapie UDCA u dosud léčených nemocných s významným zhoršením laboratorního nálezu, vzestupem Mayo Risk Skóre a zhoršením kvality života dané zejména zhoršením pruritu (73).
Americká kolej gastroenterologů nyní stejně jako AASLD nedoporučuje podávat vysoké dávky UDCA, ale podání střední dávky považuje za možné se sledováním efektu na hladiny ALP. Evropská asociace v tomto duchu jasné doporučení nedává a považuje otázku stále za otevřenou (45, 74).
Obecně lze říci, že studie jsou zatíženy značnou heterogenitou vyplývající z charakteru onemocnění a u nemocných s méně pokročilou formou lze očekávat zpomalení progrese, naopak u nemocných s již vyvinutou cirhózou je těžko očekávat jednoznačné zlepšení. Vhodná je patrně indikace i u nemocných u kterých je přítomna současná cholelitiáza.
UDCA byla též zkoušena v kombinaci s dalšími léky, a to systémovými kortikoidy, budesonidem, azathioprinem, methotrexátem, cyklosporinem, takrolimem, D‑penicilaminem, kolchicinem a pentoxifyllinem bez jasně prokázaného pozitivního efektu (44).
Endoskopická léčba
Z diagnostiky je v současné době ERCP vytlačeno neinvazivním MRCP. V terapii PSC má ale své dominantní místo. ERCP je indikováno, pokud předpokládáme prospěch pro nemocného z invazivního výkonu nebo je žádoucí odběr cytologického nebo histologického materiálu k vyloučení neoplastických změn.
Podle retrospektivních dat správně prováděná endoskopická léčba zlepšuje přežívání nemocných a prodlužuje interval bez potřeby transplantace. Prospektivní data však chybí (75, 76). Podle současných EASL/ESGE doporučení je třeba ERCP jednoznačně zvážit v případě stanovené diagnózy PSC a klinicky významného zhoršení ikteru, pruritu, projevů cholangitidy nebo vzestupu cholestatických enzymů. Nebo v případě rozvoje nové dominantní stenózy nebo zhoršení známé stenózy podle MRCP vyšetření v kontextu s klinickým stavem. Dominantní striktura je nyní přitom definována jako zúžení průměru na ≤ 1,5 mm v případě choledochu a společného ductus hepaticus nebo na ≤ 1,0 mm u pravého a levého ductus hepaticus v rozsahu do 2 cm od junkce. Před terapeutickým ERCP bychom měli vždy zvážit provedení MRC. V případě průkazu dominantní stenózy má být výkon spojen vždy současně s kartáčkovou cytologií nebo biopsií k vyloučení cholangiogenního karcinomu (44, 45).
Terapeuticky k řešení dominantní stenózy můžeme přestupovat buď pomocí krátkodobého stentování nebo balónové dilatace. Rozhodnutí mezi krátkodobým zavedením stentu nebo balónovou dilatací dle EASL/ESGE doporučení záleží na rozhodnutí výkon provádějícího endoskopisty. V případě použití stentu se doporučuje ponechání stentů maximálně na dobu 1–2 týdnů. Průměr stentů je nutno volit vždy podle individuální situace stejně jako průměr dilatačního balónu v případě dilatace. V doporučeních v USA je pro vyšší výskyt komplikací dokumentovaný v některých studiích doporučována preferenčně balónová dilatace (77). Nedílnou součástí ERCP výkonu u nemocných s diagnózou PSC je profylaktické podání ATB před výkonem. Volba ATB je na jednotlivých centrech, dle aktuálního výskytu rezistencí. Jako prevence pankreatitidy po výkonu je doporučováno podání diklofenaku nebo indometacinu 100 mg rektálně těsně před nebo po výkonu. V případě obtížnější kanylace spolu s provedením biliární papilotomie je u nemocných ve vyšším riziku vhodné i krátkodobé profylaktické zavedení pankreatického stentu (45).
Při podezření na výskyt cholangiogenního karcinomu je spolu s odběrem cytologie a histologie ze stenózy vhodné zvážit i provedení cholangioskopie. Provedení FISH (fluorescenční in situ hydridizace), která zvyšuje senzitivitu i specificitu vyšetření je vhodné. V běžné praxi je však její dostupnost omezená. V případě nedostupnosti ERCP je alternativou i PTC/PTD.
Transplantace jater
Jedinou účinnou kauzální léčbou primární sklerozující cholangitidy zůstává transplantace jater. Stejně jako v případě jiných jaterních chorob v konečném stadiu je třeba nemocné odeslat k vyhodnocení na transplantační pracoviště s dostatečným předstihem před rozvojem komplikací snižujících úspěšnost léčby. Spolu s MELD skóre je stále využívána i Childova‑Pughova klasifikace v modifikaci podle Mayo kliniky. Udávané krátkodobé i dlouhodobé přežívání nemocných po transplantaci jater pro PSC je dle dat v Evropském transplantačním registru velmi dobré (91 % v 1 roce, 82 % v 5 letech a 74 % v 10 letech) (44).
Vedle pokročilé jaterní insuficience je indikací k transplantaci jater u nemocných s PSC i farmakologicky nezvladatelný pruritus, závažné recidivující cholangitidy nebo jinak neřešitelné komplikace portální hypertenze a progresivní kostní nemoc.
I když je PSC spojena s vysokým rizikem rozvoje cholangiogenního karcinomu, není samotná diagnóza PSC indikací k časnější transplantaci. Nejednoznačný je přístup k nemocným s prokázanou dysplazií epitelu, která je v některých zemích argumentem pro časnější transplantační léčbu (44).
Přestože v některých studiích v podskupině vysoce selektovaných nemocných s hilovým postižením transplantační léčba v kombinaci s neoadjuvantní chemoradioterapií přinesla uspokojivé výsledky (78), je ve většině transplantačních center diagnóza cholangiogenního karcinomu dosud pro transplantaci jater naopak kontraindikací.
Možná perspektivní farmakoterapie PSC
Na poli výzkumu nových preparátů a postupů v terapii PSC dochází k velkému pokroku. Nejnadějnější se v současné době jeví zejména nor‑UDCA, modifikace střevního mikrobiomu pomocí ATB léčby nebo terapie kyselinou obetichlovou.
24-nor‑ursodeoxycholová kyselina díky svým chemickým vlastnostem v porovnání s kyselinou cholovou zvyšuje více cholerézu a méně sekreci fosfolipidů a cholesterolu. Zvyšuje sekreci žlučových kyselin a díky cholehepatálnímu zkratu cestou periduktálního kapilárního plexu a vyšší osmotické aktivitě zvyšuje více produkci bikarbonátu (bikarbonátový deštník) (79). V porovnání s UDCA se jeví její protizánětlivé, antifibrotické a antiproliferativní účinky jako silnější (80). V proběhlé studii fáze II byla léčba touto molekulou spojena se signifikantním zlepšením laboratorního nálezu bez zvýšeného výskytu nežádoucích účinků (81).
Modifikace střevního mikrobiomu jako faktoru ovlivňujícího metabolismus žlučových kyselin i další metabolické cesty je další potenciální léčebnou variantou (82). Z tohoto důvodu byla v posledních letech testována některá běžně užívaná antibiotika, jako vankomycin, metronidazol, rifaximin a minocyklin (83). Nejvíce slibný se prozatím jeví efekt podání vankomycinu nebo metronidazolu (84–86). Fekální bakterioterapie, jako metoda používaná v terapii rekurentní klostridiové kolitidy a studovaná i v terapii IBD, je u nemocných s PSC též v malých studiích zkoušena, zatím s pozitivním efektem na zlepšení cholestatického laboratorního obrazu. Další studie v tomto duchu probíhají (87).
Obeticholová kyselina je sice primárně testována u nonrespondérů na léčbu UDCA u nemocných s PBC, ale její anticholestatické, protizánětlivé a antifibrózní působení se ukázalo ve studii AESOP potenciálně slibné i v terapii PSC (88).
V neposlední řadě jsou testovány i PPAR agonisté – fibráty, které se uplatňují nejen v metabolických pochodech, ale i na úrovni reakcí monocyto‑makrofágového systému. Fenofibrát a zejména bezafibrát mající širší spektrum účinku jak na α, tak γ a δ receptory byly testovány s pozitivní odpovědí na hladinu ALP, i když zatím jen v menších studiích (89, 90).
Riziko vzniku malignit u nemocných s PSC
U nemocných s PSC v průběhu života narůstá riziko vzniku maligních nádorů. Nejvyšší riziko je pro vznik cholangiogenního karcinomu, karcinomu žlučníku, pankreatu a u nemocných s PSC‑IBD i karcinomu tračníku. V rozsáhlé studii ze Švédska bylo riziko hepatobilárních malignit zvýšeno 161×, kolorektálního karcinomu 10× proti běžné populaci a celkový výskyt maligních onemocnění v souboru činil 13 %. Maligní nádory, jako příčina úmrtí u nemocných s PSC, tvoří v některých souborech až 40 % (91, 92).
Cholangiogenní karcinom (CCA)
Životní riziko vzniku CCA je uváděno 10–20 % (44, 91). Podle některých studií riziko narůstá převážně ve vyšším věku, u mužů, s vysokým Mayo risk skóre (MRS > 4), se zvýšenou hladinou sérového bilirubinu, anamnézou varikózního krvácení a dobou trvání asociované IBD kolitidy (93, 94). Riziko zvyšuje i konzumace alkoholu a kouření (95). Přitom nejvýznamnějším rizikovým faktorem je věk v době diagnózy, mužské pohlaví a asociace s ulcerózní kolitidou (96).
Z klinického pohledu je důležité, že až 1/3 CCA u nemocných s dominantní stenózou je diagnostikována do 1 roku od diagnózy PSC. Proto je nutno na tuto diagnózu intenzivně pomýšlet již v době diagnózy a včasně spolu MR/MRCP indikovat i ERCP s odběrem biologického materiálu. Dosud bohužel nemámě spolehlivý biomarker. Široce užívaný CA 19–9 (carbohydrate antigen) nemá bohužel dostatečnou senzitivitu a specificitu pro záchyt časných lézí. Pro cut‑off hodnoty 121 U/ml je uváděna senzitivita 78 % a specificita 98 % (97). V případě nižších cut‑off hodnot pak získáváme vysoké procento falešně pozitivních výsledků. Problematická je i častá elevace CA 19–9 u samotné cholestázy. Zvýšené hodnoty nalézáme až u 1/3 nemocných s PSC bez maligního onemocnění (98).
I když současná doporučení pro dispenzarizaci nejsou zcela jednoznačná, doporučuje se kombinovat vyšetření CA 19–9 s UZ vyšetřením 1× za půl roku nebo roční provádění MR/MRCP (44, 99). U nemocných s elevací CA 19–9 bez zřejmé dominantní stenózy pak provádění MR/ MRCP častější.
Karcinom žlučníku a hepatocelulární karcinom
Výskyt karcinomu žlučníku je u nemocných s PSC uváděn kolem 3,5 %, což je přibližně 10× více než v běžné populaci (100). I výskyt cholecystolitiázy, cholecystitidy a polypů žlučníku je u nemocných s PSC zvýšen. Screening pro karcinom žlučníku probíhá stejným způsobem jako pro cholangiogenní karcinom. V současné době AASLD i EASL doporučuje u všech nemocných s nálezem léze v oblasti žlučníku provedení cholecystektomie (44, 69, 74).
Podle současného konsenzu léze žlučníku nad 8 mm jsou u nemocných s PSC s vysokou pravděpodobností neoplastické. Obtížnější situace je u nemocných s pokročilejším jaterním onemocněním, u kterých je i cholecystektomie spojena s vysokým operačním rizikem. Některé autority u nemocných Child‑Pugh nad 7 bodů a lézí do 8 mm doporučují pouze ultrazvukové sledování v intervalech 3 měsíců a chirurgický zákrok indikovat až při progresi.
Výskyt hepatocelulárního karcinomu (HCC) je u nemocných s PSC též zvýšen. Roční incidence je v průměru uváděna kolem 1,5 %. Doporučené sledování je však shodné jako v případě cholangiogenního karcinomu.
Kolorektální karcinom
Nemocní s PSC asociovanou kolitidou jsou ve vysokém riziku vzniku kolorektálního karcinomu. Desetileté a dvacetileté riziko je uváděno 14 % a 31 %, tedy výrazně vyšší než u nemocných s PSC bez kolitidy, kde je 20leté riziko uváděno kolem 2 % (101).
Ve švédské studii z roku 1995 bylo dokumentováno absolutní riziko vzniku kolorektálního karcinomu 9 % po 10 letech, 31 % po 20 letech a 50 % po 25 letech v porovnání se skupinou nemocných s ulcerózní kolitidou bez PSC (2 %, 5 %, 10 %) (102). Z toho plyne potřeba důsledné diagnostiky IBD u všech nemocných s PSC. Koloskopické vyšetření je indikováno u všech nemocných s PSC v době diagnózy. Vznik karcinomu bývá přitom 2× častější v pravém tračníku než v levém a klinické projevy proto bývají velmi chudé (103).
U nemocných s PSC‑IBD je dále doporučováno provádění dispenzárních koloskopií jednou ročně. V případě, že kolitida není v úvodu u nemocného s PSC diagnostikována, autority se v současné době shodují na dispenzárních koloskopiích v intervalech 5 let nebo dříve v případě klinických známek kolitidy (44). Současná doporučení pro sledování nemocných shrnuje Tab. 7 (104).
Tab. 7. Souhrn doporučení pro vyšetření u nemocných s PSC při diagnostice a sledování (82) 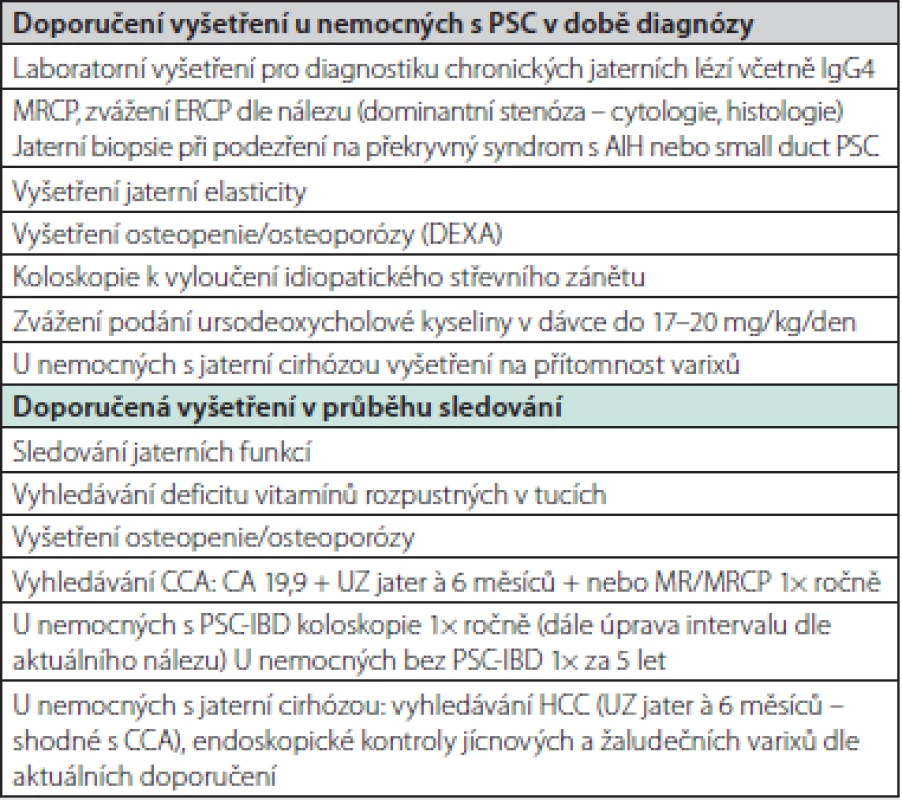
PSC – primární sklerozující cholangitida, AIH – autoimunitní hepatitida, CCA – cholangiogenní karcinom, MRCP – cholangiopankreatografie pomocí magnetické rezonance, CA – carbohydrate antigen, DEXA – dual energy X-ray absorptiometrie Léčba komplikací spojených s chronickou cholestázou
Pro PBC i PSC stejně jako pro řadu dalších chronických cholestatických chorob je typický výskyt pruritu, kostní choroby, únavy a některých hypovitaminóz. Léčba těchto komplikací je u obou onemocnění obdobná.
Pruritus se může se objevit v kterémkoli stadiu jaterní choroby a o řadu let i předcházet laboratorním projevům onemocnění. Značně ovlivňuje kvalitu života a v případech rezistentních ke standardní terapii může být zejména u nemocných s PSC indikací k transplantaci jater. Efekt UDCA na pruritus není zcela dokumentován, i když některá data pozitivní efekt ukazují (105). U nemocných s PSC v případě rozvoje nebo zhoršení pruritu musíme vyloučit i rozvoj dominantní stenózy a v případě pozitivního nálezu na MRCP indikovat terapeutické ERCP.
Jinak v první linii nemocnému nabízíme lokálně chladící emolentia. K lékům první volby patří zejména sekvestranty žlučových kyselin. Nejčastěji je s dobrým efektem používán cholestyramin (2, 3, 106). Podání cholestyraminu musí být odděleno od ostatní medikace, zejména UDCA, o 2–4 hod. Problémem může být horší tolerance léku. V případě neúčinnosti této léčby by další volbou mohlo být podání Rifampicinu (107, 108). Jako třetí linii lze použít léky ze skupiny perorálních opiodních antagonistů (naltrexon, nalmefen) (2, 109, 110). Dlouhodobé podávání může být ale komplikováno projevy syndromu odnětí nebo snížením tolerance bolesti.
Spolu s psychoterapií lze empiricky použít i inhibitory zpětného vychytávání serotoninu (SSRI) nebo gabapentin. V případě refrakterního pruritu je třeba zvážit i možnost transplantace jater, která může být indikována i bez významné jaterní dysfunkce.
Zvýšená únava se zejména u nemocných s PBC objevuje u více než 1/2 pacientů a ve vysoké míře může vést k signifikantnímu snížení kvality života (2). V případě výskytu výrazné únavy je nutné se zaměřit zejména na cílené vyhledávání únavu zhoršujících faktorů, převážně anémii, hypotyreózu a poruchy spánku. V některých případech je třeba nemocnému poskytnou i psychologickou nebo psychiatrickou léčbu.
Metabolická kostní choroba je u nemocných s chronickou cholestázou velmi častou komplikací. Její výskyt je u PBC/PSC v závislosti na pokročilosti základní choroby uváděn v rozmezí 13–60 % (111). Riziko roste s pokročilostí choroby a stupněm cholestázy. U méně pokročilých nemocných jsou rizikovými faktory kouření, malá fyzická aktivita, nižší tělesná hmotnost, pozitivní rodinná anamnéza, ženské pohlaví a vyšší věk. U každého nemocného je v době stanovení diagnózy doporučeno vyšetření duální RTG absorpciometrií (DEXA) s následnými kontrolami v intervalech 1–5 let v závislosti na vstupním nálezu a individuálních rizikových faktorech. Léčba může být velmi problematická, naprosto zásadní je její včasné zahájení. V první linii suplementujeme vápník a vitamin D v dávce 1 500 mg a 1 000 IU denně. Doporučujeme úpravu pohybového režimu a u postmenopauzálních žen ve spolupráci s gynekologem hormonální substituční léčbu. Hormonální substituce androgeny u mužů není vhodná pro riziko hepatocelulárního karcinomu. U závažnějších stavů je indikována léčba bisfosfonáty (alendronát) (2, 112, 113). U nemocných po transplantaci jater je případně variantou zoledronát (114, 115). Zvýšené opatrnosti a zvážení benefitu perorální léčby je třeba u nemocných s jícnovými varixy.
Dle aktuálního stavu řešíme i deficit dalších v tucích rozpustných vitaminů.
Další symptomy
Projevy sicca‑syndromu, pokud jsou přítomny, léčíme symptomaticky. Lokálně se u xeroftalmie aplikují umělé slzy. U xerostomie umělé sliny s pečlivou ústní hygienou a zvlhčováním dutiny ústní. V zahraničí je používán a registrován muskarinový agonista cevimelin (2). Vaginální projevy nutno řešit ve spolupráci s gynekologem.
Překryvný (overlap) syndrom s autoimunitní hepatitidou (AIH)
PBC i PSC jsou onemocnění s autoimunitní etiologií. U některých nemocných proto můžeme nález rysy charakteristické pro PBC nebo PSC a současně pro autoimunitní hepatitidu (AIH). Stejně tak se můžeme setkat s nemocnými s typickým obrazem PBC a současně primární sklerozující cholangoitidou. Tyto případy se nazývají překryvným syndromem. Prevalence těchto syndromů činí asi 10 % ze všech případů autoimunitních jaterních chorob (2). Klasifikace není ale zcela jednotná.
Z pohledu terapie je nejdůležitější odlišit zejména překryvný syndrom PBC nebo PSC s AIH. V tomto případě se neobejdeme bez jaterní biopsie a histologického vyšetření.
V případě PBC je lymfocytární infiltrace lokalizována periduktálně a pouze minimálně nalézáme obraz lobulárního zánětu nebo interface hepatitidy. U 8–10 % nemocných se však mohou zánětlivé změny v histologickém obraze blížit nálezu autoimunitní hepatitidy s obrazem lobulární a interface hepatitidy. Podezření na překryvný syndrom s AIH musíme mít u nemocných, kdy v laboratorním obraze nalézáme krom cholestatických rysů i výraznější elevaci aminotransferáz a IgG. Dle Pařížských kritérií (2) mají být pro diagnózu naplněna diagnostická kritéria jak pro PBC (ALP > 2násobek normy nebo GGT > 5 násobek normy, AMA 1 : 40, duktální léze v histologii), tak alespoň 2 znaky z následujících: ALT > 5násobek normálních hodnot, IgG > 2násobek normálních laboratorních hodnot nebo pozitivita ASMA, těžká nebo středně těžká interface hepatitida v histologickém nálezu.
V případě PSC se překryvný syndrom s AIH typicky vyskytuje zejména u mladších nemocných ve věku do 25 let. V laboratoři opět spolu s cholestázou nalézáme typické znaky autoimunitní hepatitidy s hypergamaglobulinemií, která do obrazu PSC nepatří. Opět je na místě jaterní biopsie. Prognóza nemocných s asociovanou AIH i s ohledem k věku v době diagnózy bývá spíše lepší než u nemocných s izolovanou PSC. Obráceně u mladších nemocných s diagnózu AIH a elevací ALP > 2 ULN je vhodné doplnit MRCP k vyloučení PSC (44).
V terapii překryvného syndromu PBC/PSC s AIH je indikována kortikoterapie nebo další imunosupresivní léčba jako u samotné AIH (2).
Závěr
Primární biliární cholangitida a primární sklerozující cholangitida jsou chronická cholestatická autoimunitní jaterní onemocnění s vysokým rizikem přechodu do jaterní cirhózy. Obě onemocnění provází typický cholestatický laboratorní obraz.
V případě PBC je diagnóza založena na průkazu antimitochondriálních protilátek nebo typickém histologickém nálezu. Léčebně je indikováno podávání UDCA. V případě adekvátní odpovědi na léčbu UDCA je prognóza nemocných dále dobrá. U pacientů, kteří na léčbu neodpovídají, lze zvážit možnost podání léčby 2. linie.
Diagnostika PSC je dále založena na zobrazovacích vyšetřeních (MRCP). Typická je silná asociace s IBD. V průběhu onemocnění jsou nemocní ohrožení rozvojem bakteriální cholangoitidy a maligních nádorů, především cholangiogenního karcinomu. Základem terapie je endoskopická (ERCP) léčba dominantních stenóz. Efekt dostupné farmakoterapie není zcela jednoznačný.
V obou případech léčíme asociované symptomy a komplikace, zejména pruritus a metabolickou kostní chorobu. U nemocných s již pokročilou jaterní chorobou vždy musíme zvážit možnosti transplantace jater a nemocné sledovat dle standardů pro nemocné s jaterní cirhózou, zejména s ohledem k asociované portální hypertenzi. U nemocných s PCS se přidává potřeba dispenzárních koloskopií.
Zkratky:
- AASLD – Americká asociace pro studium jaterních chorob
- AIH – autoimunitní hepatitida
- AMA – antimitochondriální protilátky
- ASMA – protilátky proti hladkému svalu
- BSEP – bile salt export pump
- EASL – Evropská asociace pro studium jater
- ALT – alaninamonotransferáza
- AST – aspatrátaminotrasferáza
- ALP – alkalická fosfatáza
- ICP – intrahepatální cholestáza těhotných
- OCA – obeticholová kyselina
- UDCA – ursodeoxycholová kyselina
- GGT – gamaglutamyltransferáza
- TE – tranzientní elastografie
- ULN – (upper limit of normal), horní hranice normy
- ERCP – endoskopická retrográdní cholangiopankreatografie
Zdroje
1. Jirsa M, Mareček P, Vítek L. Cholestáza. In: Hůlek P, Urbánek P (eds.) Hepatologie. 3 vydání. Praha: Grada 2018, 166–178.
2. Hirschfield GM, Beuers U, Corpechot C, et al. European Association for the Study of the Liver. EASL Clinical Practice Guidelines: The diagnosis and management of patients with primary biliary cholangitis. J Hepatol 2017; pii: S0168–8278(17)30186–1.
3. Fejfar T, Vaňásek T, Hůlek P, et al. Primární biliární cholangitida – doporučený postup České hepatologické společnosti ČLS JEP pro diagnostiku a léčbu. Gastroenterol Hepatol 2018; 72 : 109–118.
4. A Name Change for PBC: Cholangitis replacing Cirrhosis, AASLD (online). (Cit. 20. 3. 2018). Dostupné z: http://www.aasld.org/name‑change‑pbc‑cholangitis‑replacing‑cirrhosis# sthash. hrd6kN6F.dpuf
5. Invernizzi P, Lleo A, Podda M. Interpreting serological tests in diagnosing autoimmune liver diseases. Semin Liver Dis 2007; 27 : 161–172.
6. Vergani D, Alvarez F, Bianchi FB, et al. Liver autoimmune serology: a consensus statement from the committee for autoimmune serology of the International Autoimmune Hepatitis Group. J Hepatol 2004; 41 : 677–683.
7. Dahlqvist G, Gaouar F, Carrat F, et al. Large‑scale characterization study of patients with antimitochondrial antibodies but nonestablished primary biliary cholangitis. Hepatology 2017; 65 : 152–163.
8. Hirschfield GM, Heathcote EJ. Antimitochondrial antibody‑negative primary biliary cirrhosis. Clin Liver Dis 2008; 12 : 323–331.
9. Kakuda Y, Harada K, Sawada‑Kitamura S, et al. Evaluation of a new histologic staging and grading system for primary biliary cirrhosis in comparison with classical systems. Hum Pathol 2013; 44 : 1107–1117.
10. Carbone M, Mells GF, Pells G, et al. Sex and age are determinants of the clinical phenotype of primary biliary cirrhosis and response to ursodeoxycholic Acid. Gastroenterology 2013; 144 : 560–569.
11. Mayo PBC model (online). (Cit.28. 10. 2018). Dostupné z: https://www.mayoclinic.org/ medical‑professionals/ model‑end‑stage‑liver‑disease/ updated‑natural‑history‑model‑for‑primary‑biliary‑cirrhosis
12. Angulo P, Lindor KD, Therneau TM, et al. Utilization of the Mayo risk score in patients with primary biliary cirrhosis receiving ursodeoxycholic acid. Liver 1999; 19 : 115–121.
13. Parés A, Caballería L, Rodés J. Excellent long‑term survival in patients with primary biliary cirrhosis and biochemical response to ursodeoxycholic Acid. Gastroenterology 2006; 130 : 715–720.
14. Corpechot C, Abenavoli L, Rabahi N, et al. Biochemical response to ursodeoxycholic acid and long ‑ term prognosis in primary biliary cirrhosis. Hepatology 2008; 48 : 871–877.
15. Kuiper EM, Hansen BE, de Vries RA, et al. Dutch PBC Study Group. Improved prognosis of patients with primary biliary cirrhosis that have a biochemical response to ursodeoxycholic acid. Gastroenterology 2009; 136 : 1281–1287.
16. Kumagi T, Guindi M, Fischer S, at al. Baseline Ductopenia and Treatment Response Predict Long‑Term Histological Progression in Primary Biliary Cirrhosis. Am J Gastroenterol 2010; 105 : 2186–2194.
17. Lammert C, Juran BD, Schlicht E, et al. Biochemical response to ursodeoxycholic acid predicts survival in a North American cohort of primary biliary cirrhosis patients.J Gastroenterol 2014; 49 : 1414–1420.
18. Corpechot C, Chazouillères O, Poupon R. Early primary biliary cirrhosis: biochemical response to treatment and prediction of long‑term outcome. J Hepatol 2011; 55 : 1361–1367.
19. Azemoto N, Abe M, Murata Y, et al. Early biochemical response to ursodeoxycholic acid predicts symptom development in patients with asymptomatic primary biliary cirrhosis. J Gastroenterol 2009; 44 : 630–634.
20. Azemoto N, Kumagi T, Abe M, et al. Biochemical response to ursodeoxycholic acid predicts long‑term outcome in Japanese patients with primary biliary cirrhosis. Hepatol Res 2011; 41 : 310–317.
21. Momah N, Silveira MG, Jorgensen R, et al. Optimizing biochemical markers as endpoints for clinical trials in primary biliary cirrhosis. Liver Int 2012; 32 : 790–795.
22. Carbone M, Sharp SJ, Flack S, et al. The UKPBC risk scores: Derivation and validation of a scoring system for long‑term prediction of end‑stage liver disease in primary biliary cirrhosis. Hepatology 2016; 63 : 930–950.
23. Lammers WJ, Hirschfield GM, Corpechot C. Global PBC Study Group. Development and validation of a scoring system to predict outcomes of patients with primary biliary cirrhosis receiving ursodeoxycholic acid therapy. Gastroenterology 2015; 149 : 1804–1812. GLOBE kalkulátor http://www.globalpbc.com/globe
24. Leuschner U, Fischer H, Kurtz W, et al. Ursodeoxycholic acid in primary biliary cirrhosis: results of a controlled double‑blind trial. Gastroenterology 1989; 97 : 1268–1274.
25. Juřica J. Ursodeoxycholová kyselina. Remedia 2016; 26 : 529–535.
26. Corpechot C, Carrat F, Bonnand AM, at al. The effect of ursodeoxycholic acid therapy on liver fibrosis progression in primary biliary cirrhosis. Hepatology 2000; 32 : 1196–1199.
27. Poupon RE, Lindor KD, Cauch‑Dudek K, et al. Combined analysis of randomized controlled trials of ursodeoxycholic acid in primary biliary cirrhosis. Gastroenterology 1997; 113 : 884–890.
28. Lindor KD, Dickson ER, Baldus WP, et al. Ursodeoxycholic acid in the treatment of primary biliary cirrhosis. Gastroenterology 1994; 106 : 1284–1290.
29. Shi J, Wu C, Lin Y, et al. Long‑term effects of mid‑dose ursodeoxycholic acid in primary biliary cirrhosis: a meta‑analysis of randomized controlled trials. Am J Gastroenterol 2006; 101 : 1529–1538.
30. Lammers WJ, van Buuren HR, Hirschfield, et al. Levels of alkaline phosphate and bilirubin are surrogate end points of outcomes of patients with primary biliary cirrhosis: an international follow up study. Gastroenterology 2014; 147 : 1338–1349.
31. Hempfling W, Dilger K, Beuers U. Systematic review: ursodeoxycholic acid‑adverse effects and drug interactions. Aliment Pharmacol Ther 2003; 18 : 963–972.
32. EASL‑ALEH Clinical Practice Guidelines: Non‑invasive tests for evaluation of liver disease severity and prognosis. J Hepatol 2015; 63 : 237–264.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Pulmo‑renální syndromČlánek Praluent (alirokumab)
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2020 Číslo 5- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Etiologie a management dyslipidemie u pacientů s chronickým onemocněním ledvin
- Katetrizační implantace aortální chlopně – co víme v roce 2020
- Chronické cholestatické jaterní choroby, primární biliární cholangitida a primární sklerozující cholangitida
- Doporučená očkování pro diabetiky
- Ropeginterferon alfa-2 b v léčbě pacientů s pravou polycytémií
- Onemocnění jater související s alkoholem (ALD)
- Diabetes mellitus a nelegální drogy
- Pulmo‑renální syndrom
- Konfokální laserová endomikroskopie v diagnostice onemocnění jícnu: pilotní studie
- Srovnání různých přístupů k určení prevalence diabetu 2. typu v ČR
- Terapie dušnosti zdrojem svízelné diagnózy neurologického onemocnění
- Akútna končatinová ischémia v dôsledku paradoxnej embolizácie liečená systémovou trombolýzou
- Náhodne zistený feochromocytóm u 33-ročného pacienta s Lynchovým syndrómom
- Transplantace jater jako potenciální kurativní metoda těžké hemofilie A: popis případu a literární přehled
- Osteolytická ložiska, hyperkalcemie a paraprotein, ale myelom to není
- Praluent (alirokumab)
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Osteolytická ložiska, hyperkalcemie a paraprotein, ale myelom to není
- Onemocnění jater související s alkoholem (ALD)
- Chronické cholestatické jaterní choroby, primární biliární cholangitida a primární sklerozující cholangitida
- Doporučená očkování pro diabetiky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



