-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaNahlédnutí do budoucnosti farmakoterapie diabetes mellitus 2. typu
An outlook to the future of pharmacotherapy for type 2 diabetes mellitus
A new class of drugs that affect incretin system has been introduced in clinical practice, and renal glucose reabsorption inhibitors are soon to follow. Clinical practice thus has an access to drugs with mechanisms of action that differ from those of the currently available antidiabetics, and extend our ability to influence the multifaceted metabolic disorder associated with the type 2 diabetes. Non-peptide molecules affecting GLP1 receptor and insulin mimetics are being tested in clinical trials. Research also continues in metabolic modulators of nuclear receptors, glucagon receptor antagonists and cellular glucocorticoid inhibitors. Promising are the compounds that increase glucose utilization (glucokinase activators) and decrease its release (fructose-1,6-diphosphatase inhibitors). Gene therapy is also likely to be used for the treatment of type 2 diabetes and its complications.
Key words:
antidiabetics – insulin mimetics – PPAR modulators – incretin treatment – cyrbohydrate digestive enzyme inhibitors – gene therapy
Autoři: A. Šmahelová
Působiště autorů: Klinika gerontologická a metabolická Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Luboš Sobotka, CSc
Vyšlo v časopise: Vnitř Lék 2011; 57(11): 954-958
Kategorie: 80. narozeniny prof. MUDr. Jaroslava Rybky, DrSc.
Souhrn
Nedávno byla uvedena do klinické praxe nová skupina léků ovlivňujících inkretinový systém a brzy budou následovat inhibitory reabsorpce glukózy v ledvinných tubulech. Reálně tak jsou k dispozici látky s jiným mechanizmem účinku než dosavadní antidiabetika a rozšiřuje se možnost účinného ovlivnění komplexní metabolické poruchy u diabetu 2. typu. Ve fázi klinických studií jsou nepeptidové látky, ovlivňující receptor GLP 1, a inzulinová mimetika. Pokračuje výzkum modulátorů metabolických funkcí jaderných receptorů, antagonistů glukagonového receptoru a buněčných inhibitorů glukokortikoidů. Nadějné jsou látky, které zvyšují přímo utilizaci glukózy (aktivátory glukokinázy) a snižují její výdej (inhibitory fruktózo-1,6-difosfatázy). V budoucnu bude pravděpodobně využita genová terapie a biologická léčba i v léčbě diabetu 2. typu a jeho komplikací.
Klíčová slova:
antidiabetika – inzulinová mimetika – modulátory PPAR – inkretinová léčba – inhibitory trávení sacharidů – genová terapieÚvod
Dnes je již jasné, že diabetes 2. typu je heterogenní progredující nosologická jednotka. Shoda panuje i v přístupu k léčbě diabetické poruchy, která je založena na cílené úpravě dnes známých patogenetických poruch, které vedou k vzniku a rozvoji diabetické poruchy [1]. Současná taktika léčby využívá kombinace antidiabetik s různým, většinou širším, mechanizmem účinku. Heterogenita poruchy je pobídkou k hledání a vývoji nových léků, které korigují hyperglykemii.
Doba léčby diabetu se stále prodlužuje, takže nové léky musí být dlouhodobě naprosto bezpečné, dlouhodobě účinné, s komfortní aplikací a s minimálním rizikem hypoglykemie. Další specifika budoucích léků souvisí např. i se zvyšujícím se zastoupením starších a starých diabetiků nebo s potřebou komplexního efektu na průvodní další metabolické poruchy, snížení hyperglukagonemie nebo přímé ovlivnění glukotoxicity a lipotoxicity [2]. Vývoj nových léků je dlouhý a finančně velmi náročný a před uvedením na trh vyžaduje pečlivé preklinické a klinické zkoušení, včetně prospektivního sledování zejména kardiovaskulárních dopadů.
Možnosti, které se dnes nabízejí jako reálné pro vývoj účinného farmakologického nástroje pro léčbu diabetu 2. typu, jsou velmi široké, a proto zde nebudou zmíněny všechny. Intenzivní výzkum a vývoj nových farmak v léčbě diabetu 2. typu vychází z významného pokroku v poznání jeho patogenetických souvislostí. Jsou zkoumány antidiabetické látky, které mají antihyperglykemický nebo hypoglykemizující efekt (tab. 1). Antihyperglykemické látky (inhibitory vstřebávání glukózy, antiobezitika, slabé inhibitory jaterního výdeje glukózy nebo kontraregulačního obranného mechanizmu proti hypoglykemii, mírná inzulinová sekretagoga nebo sekretagoga, jejichž účinek je závislý na hladině glykemie, většina inzulinosenzitizujících látek a modulátory metabolizmu lipidů) neohrožují pacienta hypoglykemií. Látky, které mají hypoglykemizující účinek, však toto riziko v různé míře mají (inzulinová sekretagoga, inzulinová mimetika, látky, které zvyšují výdej glukózy z jater, a látky poškozující kontraregulační mechanizmus) (tab. 2 a 3) [3].
Tab. 1. Mechanizmus účinku některých známých látek, snižujících glykemii. 
Tab. 2. Mechanizmy, které jsou zkoumány ve vývoji nových léků diabetu 2. typu. 
Tab. 3. Příklady perspektivních látek snižujících glykemii. 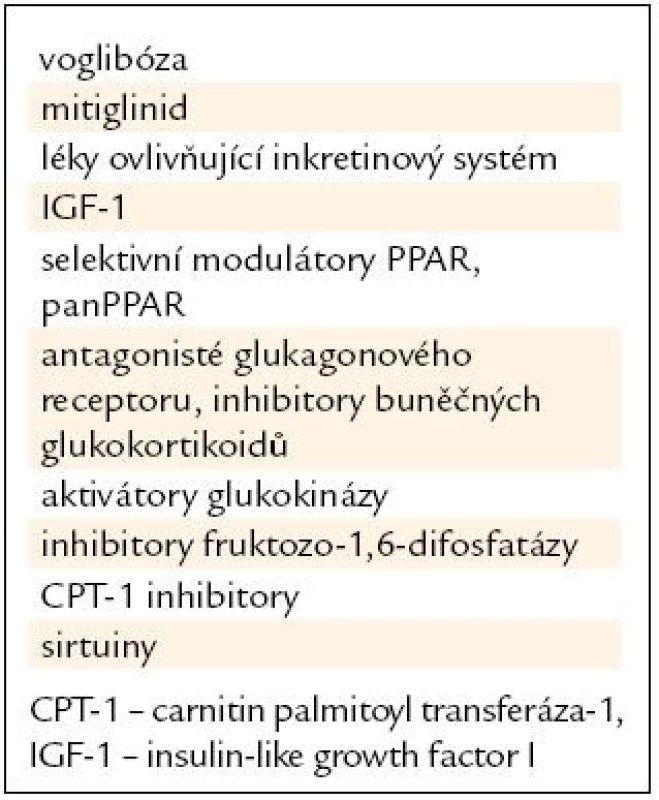
Inhibitory trávení a absorpce sacharidů z trávicího traktu
Dále se pátrá po možnostech, jak ovlivnit funkci trávicího traktu. Intenzivní výzkum probíhá ve skupině inhibitorů trávení a absorpce sacharidů (tab. 2). V tenkém střevě ovlivňují metabolizmus glukózy hned na začátku inhibitory α-glukozidázy. V současnosti jsou ve světě využívány akarbóza, miglitol a voglibóza. Tyto látky mají rozdílnou afinitu k specifickým α-glukosidázám, voglibóza, která podobně jako miglitol inhibuje sukrázu, je účinnější než akarbóza. V kombinaci s nově vyvíjenými přípravky dietní vlákniny, zejména jejích rozpustných forem (např. guar – E412, galaktomanany, pektin), účinně snižuje postprandiální hyperglykemii a hyperinzulinemii [4].
Inzulinová sekretagoga
Inzulinová sekretagoga zvyšují sekreci inzulinu buď přímo (sulfonylurea), nebo v závislosti na glykemii (analogy glukagon-like peptidu 1 – GLP 1) a dalšími mechanizmy. Účinek všech sekretagog je závislý na glykemii. Rozčleňují se na iniciátory (např. sulfonylurea) a potenciátory inzulinové sekrece (např. agonisté receptoru GLP 1 a inhibitory enzymu dipeptidylpeptidázy 4 – DPP4).
Sulfonylurea a meglitinidy (iniciátory) spouštějí sekreci inzulinu vazbou na SUR1 receptor membrány β-buňky. Klasický zástupce, glibenclamid, ovlivňuje sulfonylureovou i benzamidovou část receptoru. Deriváty meglitinidu se vážou k benzamidové složce, mohou účinkovat na imidazolové receptory I1 a I2 membrány β-buňky a pravděpodobně také na další, dosud neklasifikované receptory. Přímým účinkem na póry Kir 6,2, které jsou součástí K-ATP kanálů v membráně, patrně zvyšují sekreci inzulinu odlišným mechanizmem než sulfonylurea. Patří sem např. mitiglinid (KAD-1229), morpholinoguanidin (BTS 67582), komponenty imidazolu (S 22068) a další.
K dnes již používaným potenciátorům inzulinové sekrece patří zástupci tzv. inkretinové skupiny (agonisté GLP 1 receptoru exenatid a liraglutid a DPP 4 inhibitory – sitagliptin, vildagliptin, saxagliptin, brzy již linagliptin). Klinické studie probíhají s dalšími agonisty GLP 1 receptoru (např. LY315902, lixisenatid) a jsou připravovány další. Podobně je tomu i u inhibitorů DPP 4 (např. alogliptin, R1438, P32/98). V blízké budoucnosti budou patrně používány i varianty inkretinů, které bude možné aplikovat v delším než týdenním intervalu [5].
Kromě inkretinových léků jsou zkoumány další látky. Patří k nim inhibitory fosfodiesterázy v β-buňce, která degraduje cAMP, a tím omezuje uvolňování inzulinu (především její izoformy PDE-3B, která nejvíce ovlivňuje glukózodependentní sekreci inzulinu) [6]. Problémem zůstává účinné cílené ovlivnění dílčího metabolického kroku v β-buňce. Další dosud zatím teoretickou možností je např. cíleně využít antagonistů α2-adrenergních receptorů a aktivátorů fosfolipázy C.
Inzulinová mimetika
Inzulinová rezistence je u většiny diabetiků 2. typu pravděpodobně způsobena mnohočetnými defekty na úrovni inzulinového receptoru a v signální cestě, kterou je realizován metabolický účinek inzulinu. S tím jsou nezávisle spojeny poruchy v aktivitách přenašečů buněčných substrátů a metabolických enzymů a v konečném důsledku vzniká glukotoxicita a lipotoxicita [7]. Inzulin má důležité účinky v rámci genomu, které určují míru exprese mnoha buněčných produktů, a tím přímo nebo nepřímo ovlivňuje metabolickou rovnováhu. Defekty struktury inzulinového receptoru a jejich optimální počet nejsou ještě zcela prozkoumány. K přímému ovlivnění inzulinové rezistence bude nutné ovlivnit buněčný metabolizmus na různých úrovních [8]. Zkoumány jsou např. proteinkinázy B, adenozin monofosfát aktivované kinázy, syntázy endoteliálního kysličníku dusného, aktivátory přenašečů glukózy a inzulin receptorového substrátu. Zajímavou možností je ovlivnění kinázy mTOR (mammalian target of rapamycin), regulujícího růst buněk a buněčný cyklus prostřednictvím regulace proteosyntézy (např. dnes již používaný sirolimus v léčbě nádorových onemocnění) [9].
K látkám aktivujícím inzulinový receptor patří insulin-like growth fac-tor I – IGF-I, který může slabě napodobit účinky inzulinu vazbou k inzulinovému receptoru. Interakce mezi IGF-I receptorem a časnými postreceptorovými součástmi inzulinové signální kaskády mohou zlepšit těžkou inzulinovou rezistenci, jejíž příčinou jsou genetické poruchy inzulinového receptoru. Problémem je ale především proliferativní účinek IGF-I. Ve vývoji jsou nyní směsi rekombinantního humánního IGF-I a IGFBP-3. Spuštění buněčné kaskády inzulinového receptoru po navázání inzulinu na α podjednotku receptoru může být podpořeno nebo prodlouženo různými mechanizmy. Patří sem např. nepeptidová molekula TLK 16998, která kromě řady dalších efektů zvyšuje inzulinem indukovanou fosforylaci na β podjednotce a v pokusu na zvířeti snižuje glykemii u inzulinorezistentních obézních myší [10].
Většina patogenetických procesů, odehrávajících se za inzulinovým receptorem, není specifická pouze pro inzulin, a proto jsou zkoumány možnosti komplexního ovlivnění metabolizmu glukózy, lipidů i proteinů formou časné potenciace postreceptorových pochodů. Zajímavé jsou inhibitory proteinkinázy C (ruboxistaurin, pinitol a další nové látky), inhibitory proteinu tyrozinfosfatázy 1B, která defosforyluje β podjednotku inzulinového receptoru a IRS1 a IRS2 a další (např. N terminální části růstového hormonu a mosaprid, což je benzamidový derivát, který aktivuje serotoninové receptory 5HT-4 a podporuje motilitu trávicího traktu). Také ovlivnění produktů metabolicky aktivní tukové tkáně – adipokinů (např. inhibice prozánětlivých faktorů – např. TNF-α a interleukinu 6 – nebo analogy leptinu a agonisté nepeptidových receptorů, rezistin, adiponektin, visfatin, retinol-binding protein 4, omentin a další) – může být novým směrem v léčbě diabetu 2. typu. Účinek inzulinu potencují (zlepšení inzulinové senzitivity a hyperglykemie) také některá již dnes z jiných indikací používaná léčiva. Sem patří např. bromocriptin, používaný v léčbě Parkinsonovy choroby a hyperprolaktinemie, kyselina thioktová, isoferulic (výtažek z propolisu), ACE inhibitory, antiobezitika (β adrenergní agonisté a látky příbuzné sibutraminu, rimonabantu).
Agonisté buněčných receptorů, aktivujících proliferátory peroxisomů (agonisté PPAR), jsou látky, které ovlivňují metabolické pochody dominantně v tukové tkáni [11]. Dva zástupci agonistů PPARγ, troglitazon a rosiglitazon, byly vyřazeny z léčebného portfolia pro nežádoucí účinky, v klinické praxi zůstává pioglitazon. I ten je v současnosti pod drobnohledem zájmu regulačních úřadů v souvislosti s hlášeným výskytem karcinomu močového měchýře. Příklad thiazolidionů dokládá, jak je důležitá dlouhodobá zkušenost s antidiabetickým léky, zejména v souvislosti s doživotním trváním diabetu 2. typu. Vývoj inzulinových senzitizérů však pokračuje dále a je zkoušena celá řada inzulinových senzitizérů, působících pozitivně na hyperglykemii i na komplikace diabetu [12]. Jsou to PPARδ senzitizéry, které mohou nalézt uplatnění i v léčbě obezity a kožních onemocnění. Perspektivní skupinou jsou tzv. selektivní modulátory PPARγ (SPARRM), parciální agonisté PPARγ. Koncept jejich klinického využití je založen na interakci agonista-selektivní receptor-kofaktor, která ovlivňuje regulaci genu. Selektivní PPARγ modulátory mají žádoucí efekt na metabolizmus glukózy bez vedlejšího účinku (např. na zvýšení hmotnosti). Tyto látky mají tedy menší adipogenní účinek než klasické thiazolidindiony.
Důležitou skupinou jsou tzv. double senzitizéry α-γ, které působí jako antidiabetika i hypolipidemika. Tzv. glitazary se dostaly do pokročilé fáze klinického vývoje, jejich distribuce však byla pro vedlejší účinky zastavena. Patrně nejvíce perspektivní skupinou jsou tzv. panPPAR agonisté (tab. 4). Jejich efekt by měl být podle experimentů na zvířatech velmi komplexní. Prozatímní výsledky potvrzují významné snížení inzulinové rezistence, zlepšení lipidogramu i obezity a pravděpodobně mají i komplexní efekt na metabolický syndrom. Bezafibrát, tedy látka velmi stará, je rovněž panPPAR senzitizér, jeho další efekty, kromě hypolipidemického, jsou však velmi slabé [13]. V tab. 4 jsou uvedeny některé perspektivní látky, které ovlivňují diabetes, lipidy, aterogenezi i metabolický syndrom.
Tab. 4. PanPPAR agonisté. Podle [12]. ![PanPPAR agonisté. Podle [12].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/1ac6f4493286add93edde3357dc2f4bd.jpg)
Většina kontraregulačních hormonů zvyšuje glykemii akcentací glykogenolýzy a glukoneogeneze v jaterní buňce. Případná inhibice jejich aktivity je ale současně spojena s rizikem navození hypoglykemie. Antagonisté glukagonu (analogy somatostatinu a nepeptidoví antagonisté glukagonového receptoru) potlačují sekreci glukagonu, zpomalují absorpci glukózy ze střeva a snižují sekreci růstového hormonu. Jejich využití v léčbě diabetu 2. typu brání současná inhibice sekrece inzulinu. Některé inhibitory receptorů pro glukokortikoidy působí zčásti selektivně v játrech. Nadějné jsou selektivní inhibitory enzymu 11-β-hydroxysteroiddehydrogenázy 1, které zlepšují citlivost inzulinu, glykemii a lipidové spektrum v pokusu u králíků [14]. Dihydroepiandrosteron a etiocholanolony mohou mít podobný efekt u obézních zvířat i lidí. Tyto látky mohou účinkovat prostřednictvím zvýšení fosforylace proteinů IRS a zvýšením translokace přenašečů glukózy GLUT 1 a GLUT 4 k buněčné membráně.
Metabolizmus glukózy (stimulace vychytávání glukózy a její utilizace nebo potlačení tvorby glukózy) může přímo ovlivnit řada látek (např. deoxyfrenolicin, vitamin K5, diamidy a peroxidy, estery fobolu). Dichloracetát zvyšuje oxidaci glukózy, ale zhoršuje nervové funkce tvorbou glyoxylátu a oxalátu [15]. Klíčovým enzymem, regulujícím buněčnou energii, je proteinkináza aktivovaná adenozin monofosfátem (AMPK). Její aktivace metforminem, adiponektinem a thiazolidiony snižuje glykemii [16], podobný efekt mají i různé analogy AMP (AICAR-5-aminoimidazol-4-carboxamid-1-B-D-ribofurasonid) u inzulinorezistentních zvířat s diabetem [17]. Probíhají pokusy s inhibitory kinázy glykogenosyntázy, aktivátory glukokinázy a inhibitorů tvorby jaterní glukózy (inhibitory glykogenfosforylázy, glukózo-6-fosfatázy, fruktózo-1,6-difosfatázy).
Sirtuiny zahrnují skupinu 7 enzymů, které ovlivňují transkripci genů a zprostředkují metabolickou odpověď tak, že potenciálně prodlužují život podobně jako při chronické restrikci energetického příjmu. Sirtuin 1 je exprimován v tkáních savců (včetně jaterní, svalové a tukové) a zdá se, že podporuje biogenezi mitochondrií, termogenezi a snižuje náchylnost k diabetu, obezitě a kardiovaskulárním onemocněním a v β-buňkách může také podpořit sekreci inzulinu (např. resveratrol). Tyto aktivátory u experimentálních zvířat zvyšují mitochondriální kapacitu, citlivost na inzulin a snižují glykemii [18].
V léčbě diabetu 2. typu se mnohdy neobejdeme bez exogenního inzulinu. Překvapivý je vývoj nových, tzv. superrychle působících inzulinů. Jejich účinek je ještě rychlejší než účinek krátkodobě působících inzulinových analogů. Přitom nejde o pravé inzulinové analogy, neboť není změněna sekvence aminokyselin v molekule inzulinu. Jsou také zkoumány různé manipulace s molekulou inzulinu, jako např. vazba s halogeny či vzájemná vazba molekul inzulinu podobná jako v molekule proinzulinu. Tyto modifikace způsobují, že inzulin nevytváří dimery, a proto po aplikaci tak rychle účinkuje. Nové inzulinové formy by tak mohly být v léčbě diabetu 1. i 2. typu velmi atraktivní.
V horizontu několika let se budou v klinické praxi pravděpodobně již běžně využívat i nové kombinace léků, např. nový dlouhodobý inzulinový analog degludec, který bude možno aplikovat ještě v delším intervalu než 24 hod v kombinaci s inkretinovým analogem, u něhož 1 aplikace vystačí na 12 měsíců. Zajímavý je také výhled možnosti využití agonistů GLP 1 v perorální formě nebo hybridních molekul s 2 hormonálními složkami (např. glukagon a inkretinový analog). Pozoruhodné je, že glukagon v této hybridní podobě nezvyšuje glykemii a má pozitivní metabolické efekty.
Genová terapie
Nadějnou možností je genová terapie, ovlivňující funkci inkretinového systému. Další možností je využití potenciálu bílkovin virů v léčbě poruch glukózové homeostázy. Humánní adenovirus typ 36 zvýšil inzulinovou senzitivitu u experimentálně infikovaných krys [19], vychytávání glukózy tukovou tkání u diabetiků a nediabetiků a v kosterním svalu [20]. Genová terapie je také slibnou možností v léčbě diabetických komplikací. Výsledky klinických studií s genovou terapií angiopoetinem 1 ukazují, že podporuje stabilizaci diabetického poškození angiogeneze a remodelingu myokardu u myší [21].
Některé klinické studie u diabetiků naznačují zlepšení difuzního cévního postižení po intramuskulární aplikaci plastidu s genem pro VEGF (vaskulární endoteliálním růstovým faktor). Nevirová genová terapie v kombinaci s autologní transplantací buněk zlepšuje hojení ran u diabetických zvířat [22].
Nevýhodou genové terapie je cena a také riziko těžké hypoglykemie, např. při nesprávném odhadu počtu genů produkujících inzulin. Použití genové terapie u diabetiků 2. typu bude nepochybně následovat až po jejím etablování v léčbě diabetu 1. typu. Pravděpodobně se přiblížila i doba biologické léčby diabetu 2. typu, perspektivní je využití protilátek proti některým interleukinům.
Závěr
S postupem poznání složitého patogenetického mechanizmu diabetu 2. typu jsou odkrývány další možnosti účinné léčby. V současné době jsme svědky nástupu nové, velké skupiny léků, ovlivňujících inkretinový systém. Jde o léky, které mají pravděpodobně minimum nežádoucích účinků, a v současnosti probíhá potvrzení jejich komplexních účinků, s dopady nejen do léčby diabetu 2. typu, ale i dalších onemocnění, např. demence. Jsou zkoumány další látky této skupiny a současně je hledána optimální cesta jejich podání, ať už souvisí s formou aplikace, nebo délkou jejich účinku. Kromě této skupiny budou do klinické praxe pravděpodobně brzy uvolněny i glifloziny, kterými je možné snížit zpětnou reabsorpci glukózy z primární moči. V nejbližších letech lze v praktické diabetologii očekávat využití řady nových terapeutických principů. Jistě to však nebude znamenat konec starších léků, s kterými máme již kratší či dlouholeté praktické zkušenosti. Před řadou z nich se totiž otevírají nové možnosti komplexního využití. To se týká jednak léků opravdu starých, např. metforminu a moderních sulfyonylureových antidiabetik, ale i léků jen relativně starých, např. gliptinů či inkretinových analogů, u nichž lze očekávat nejen vývoj nových lékových forem, ale i nových léčebných kombinací. Intenzivně jsou zkoumány také vazby diabetu 2. typu na onemocnění CNS a možnost jejich ovlivnění (např. u agonistů receptorů GLP 1 na funkce hypotalamu).
Současně jsou dále hledány nové látky, které ovlivňují všechny dosud známé patogenetické poruchy a komplexností účinku zasahují kromě glukózového také lipidový metabolizmus. Cesta k jejich praktickému použití je trnitá, finančně náročná a dlouhá. Očekává se však, že jejich efekt umožní účinněji léčit diabetes 2. typu jako komplexní metabolickou poruchu s širokým dopadem na prakticky všechny orgány.
doc. MUDr. Alena Šmahelová, Ph.D.
www.fnhk.cz
e-mail: smahelov@lfhk.cuni.cz
Doručeno do redakce: 23. 10. 2011
Zdroje
1. DeFronzo RA, Ferrannini E, Keen H et al. International Textbook of Diabetes Mellitus. 3th Ed. John Wiley & Sons Ltd. Cholchester, West Sussex, 2004.
2. Adams CP, Branter VV. Estimating the coast of new drug development: is it really 802 million dollars? Health Aff 2006; 25 : 420–428.
3. Bailey CJ. Treating insulin resistance: future prospects. Diab Vasc Dis Res 2007; 4 : 20–31.
4. Chandalia M, Garg A, Lutjohann D et al. Beneficial effects of high dietary fiber intake in patients with type 2 diabetes mellitus. N Engl J Med 2000; 342 : 1392–1398.
5. Haluzík M, Svačina Š. Inkretinová léčba diabetu. Praha: Mladá Fronta 2010.
6. Saltiel AR, Kahn CR. Insulin signaling and the regulation of glucose and lipid metabolism. Nature 2001; 414 : 799–806.
7. Kahn SE, Hull RL, Utzschneider KM. Mechanisms linking obesity to insulin resistence and type 2 diabetes. Nature 2006; 444 : 840–846.
8. Bailey CJ. Treating insulin resistence: future prospects. Diab Vasc Dis Res 2007; 4 : 20–31.
9. Tokunaga C, Yoshino K, Yonezawa K. mTOR integrates amino acid - and energy-sensing pathways. Biochem Biophys Res Commun 2004; 313 : 443–446.
10. Machem VP, Glodfine ID, Kohanski RA et al. A novel small molecule that directly sensitisez the insulin receptor in vitro and in vivo. Diabetes 2001; 50 : 824–830.
11. Šmahelová A. Inzulin senzitizující léky. Vnitř Lék 2009; 55 : 425–428.
12. Gross B, Staels B. PPAR agonists: multimodal drugs for the treatment of type-2 diabetes. Best Pract Res Clin Endocrinol Metab 2007; 21 : 687–710.
13. Tenenbaum A, Motro M, Fisman EZ. Dual and pan-peroxisome proliferator-activated receptors (PPAR) co-agonism: the bezafibrate lessons. Cardiovasc Diabetol 2005; 4 : 14.
14. Tomlinson JW, Stewart PM. Modulation of glucocorticoid action and the treatment of type 2 diabetes. Best Pract Res Clin Endocrinol Metab 2007; 21 : 607–619.
15. Bailey CI. New pharmacological approaches to glycemic control. Diabetes Revs 1999; 7 : 94–113.
16. Schimack G, DeFronzo RA, Musi N. AMP-activated protein kinase: role in metabolism and therapeutic implications. Diabetes Obes Metab 2006; 8 : 591–602.
17. Iglesias MA, Furler SM, Cooney GJ et al. AMP-activated protein kinase activation by AICAR increases both muscle fatty acid and glucose uptake in white muscle of insulin-resistant rats in vivo. Diabetes 2004; 53 : 1649–1654.
18. Milne JC, Lambert PD, Schenk S et al. Small molecule activators of SIRT1 as therapeutics for the therapeutics for the treatment of type 2 diabetes. Nature 2007; 450 : 712–716.
19. Pasarica M, Shin AC, Yu M et al. Human adenovirus 36 induces adiposity, increases insulin sensitivity, and alters hypothalamic monoamines in rats. Obesity (Silver Spring) 2006; 14 : 1905–1911.
20. Rogers PM, Mashtalir N, Rathod MA et al. Metabolically favorable remodeling of human adipose tissue by human adenovirus type 36. Diabetes 2008; 57 : 2321–2331.
21. Wang ZQ, Cefalu WT, Zhang XH et al. Human adenovirus type 36 enhances glucose uptake in diabetic and nondiabetic human skeletal muscle cells independent of insulin signaling. Diabetes 2008; 57 : 1805–1813.
22. Hirsch T, Spielmann M, Velander P et al. Insulin-like growth factor-1 gene therapy and cell transplantation in diabetic wounds. J Gene Med 2008; 10 : 1247–1252.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2011 Číslo 11- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Tři jsou více než jeden: Kombinace 3 vitaminů skupiny B prodlužuje délku neuritů
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Životní jubileum prof. MUDr. Jaroslava Rybky, DrSc.
- Aktuální a budoucí možnosti léčby osteoporózy
- Chronická pankreatitida v roce 2011
- Patofyziologické podklady inkretinové léčby: dokáže ještě více, než si myslíme?
- Jak se dívat na psychosomatickou medicínu
- Možnosti plnění mezinárodních doporučení terapie syndromu diabetické nohy v České republice
- Antibiotická léčba akutních bakteriálních infekcí
- Inkretiny změnily a dále mění strategii léčby diabetu 2. typu
- Moderní technologie v diabetologii. CSII (kontinuální subkutánní infuze inzulinu) a CGM (kontinuální glykemický monitoring) v klinické praxi
- Lze zpomalit rentgenovou progresi ankylozující spondylitidy?
- Inzulinová léčba v roce 2011
- Genetika monogénových foriem diabetu
- Terapie obezity – postupy, účinnost a perspektivy
- Patogeneze diabetes mellitus 1. a 2. typu v roce 2011 – jednotící model poruchy glykoregulace
- Nahlédnutí do budoucnosti farmakoterapie diabetes mellitus 2. typu
- Pharmacotherapy of chronic heart failure after the first decade of 21st century
- Farmakoterapie po srdečním infarktu
- Pokroky v metabolizmu a výživě 2011 a cesta k personalizované léčbě
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Antibiotická léčba akutních bakteriálních infekcí
- Moderní technologie v diabetologii. CSII (kontinuální subkutánní infuze inzulinu) a CGM (kontinuální glykemický monitoring) v klinické praxi
- Terapie obezity – postupy, účinnost a perspektivy
- Genetika monogénových foriem diabetu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



