-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaFecal microbiota transplantation and novel therapies for Clostridium difficile infection
Fecal microbiota transplantation and novel therapies for Clostridium difficile infection
Clostridium difficile infection (CDI) represents a serious chronic disease with typical chronic and recurrent course. The number of patiens with recurrent CDI is still growing and currently used therapeutic approaches are not always effective. We successfully cured two patients by fecal microbiota transplantation and discuss the role of fecal microbiota transplantation in the CDI treatment algorithm. Novel CDI treatments discovery, necessity of strictly rational antibiotic use and probiotic use in prevention of CDI and its recurrencies are also mentioned.
Keywords:
Clostridium difficile infection (CDI) – fecal microbiota transplantation – new approaches to treatment – rational antibiotic use
Autoři: J. Vejmelka; P. Kohout; J. Koten; Z. Beneš
Působiště autorů: Interní oddělení ; Primář: doc. MUDr. Zdeněk Beneš, CSc. ; Thomayerova nemocnice, Praha
Vyšlo v časopise: Prakt. Lék. 2014; 94(4): 195-200
Kategorie: Z různých oborů
Souhrn
Klostridiová střevní infekce vyvolaná působením toxinů bakterie Clostridium difficile (CDI) představuje závažné průjmové onemocnění charakteristické svým chronickým a rekurentním průběhem. Počet pacientů s rekurentní CDI neustále narůstá a terapeutické možnosti nejsou dostatečně efektivní. Fekální bakterioterapie představuje znovuobjevenou léčebnou metodu s velmi dobrými výsledky léčby rekurentní CDI. Úspěšně jsme touto metodou léčili dvě pacientky a uvádíme návrh možného postupu léčby rekurentní CDI se zahrnutím fekální bakterioterapie do léčebného algoritmu. Upozorňujeme na vývoj nových antibiotik a na další možnosti léčby CDI. Zdůrazňujeme nutnost striktního dodržování racionální antibiotické terapie a vhodnost užívání probiotik v primární a sekundární prevenci CDI.
Klíčová slova:
infekce Clostridium difficile – fekální bakterioterapie – nové léčebné cesty – racionální antibiotická terapieÚvod
Onemocnění vyvolaná působením toxinů bakterie Clostridium difficile (Clostridium difficile infection – CDI) se stávají závažným celosvětovým medicínským, ekonomickým a v neposlední řadě i společenským problémem. Případy pacientů, u nichž došlo k rozvoji klostridiové enterokolitidy s protrahovaným a rekurentním průběhem a minimální odezvou na adekvátní a včasně zahájenou léčbu, by nás měly vést k velmi odpovědnému přístupu ke klostridiové střevní infekci. Neustupující průjmy (nebo perzistující obavy již vyléčených pacientů z jejich rekurence), malnutrice, renální insuficience, těžké kolitidy vedoucí k rozvoji toxického megakolon a následnému septickému stavu s rizikem úmrtí pacienta – to jsou v současné době hlavní impulzy k hledání nových léčebných cest v boji s tímto závažným onemocněním. Zvyšuje se četnost klinických studií, jejichž cílem je prokázat vyšší účinnost nových léků, či nových postupů v léčbě klostridiové enterokolitidy ve srovnání s běžně užívanou farmakoterapií (metronidazol, vankomycin). Zásadním úkolem se nyní stává nalézt takovou léčebnou modalitu, která by vedla ke kompletní remisi pacienta a která by zabránila rekurencím onemocnění.
Paralelně s rostoucím počtem studií zabývajících se léčbou onemocnění se zlepšuje také diagnostika a epidemiologický dohled nad klostridiovými střevními infekcemi. V České republice byl v roce 2012 vypracován „Doporučený postup diagnostiky a léčby kolitidy vyvolané Clostridium difficile“ (www.infekce.cz) (2), ve kterém jsou shrnuty všechny nejnovější znalosti o této problematice. Tento postup byl v roce 2014 upraven v souladu s doporučením ESCMID.
Fekální bakterioterapie (užívá se též pojmu fekální transplantace, transplantace stolice) je přenos stolice zdravého dárce do střeva pacienta s narušenou střevní mikroflórou.
První zmínka o léčbě fekální suspenzí pochází ze 4. století z Číny, kdy byla stolice podána pacientům s alimentárními intoxikacemi a těžkými průjmy (3). V 16. století se stolice užívala k léčbě průjmů, horečky, bolesti, zvracení a zácpy (3). V 17. století byla využívána v rámci veterinární medicíny (4).
V nové době byla fekální bakterioterapie poprvé zdokumentována již před více než 50 lety, kdy byl fekální transplantát podán formou klyzmatu čtyřem pacientům s těžkou kolitidou vyvolanou Micrococcus pyogenes (Staphylococcus) (5). V roce 1983 byla fekální bakterioterapie poprvé využita k léčbě rekurentní klostridiové střevní infekce (6) a v současné době bylo zdokumentováno již více než 400 případů, kdy byla fekálních bakterioterapie realizována (7). Jak vyplývá z metaanalýzy 273 pacientů léčených fekální bakterioterapií (8), je tato léčebná metoda úspěšná zhruba u 80 % případů.
Přesto však stále budí řadu obav (někdy až odporu) a je důvodem dlouhých diskuzí nejen mezi laickou, ale i mezi odbornou veřejností. V současné době však představuje velmi efektivní, relativně levnou a nekomplikovanou léčbu rekurentní klostridiové střevní infekce. Předpokládáme, že úspěšnost této léčebné metody spočívá v obnově narušeného střevního mikrobiomu (3, 4), přesný mechanismus účinku však není v současné době plně objasněn.
Fekální bakterioterapie je léčebná metoda, kterou lze využít nejen k léčbě rekurentní klostridiové střevní infekce, ale i k léčbě řady jiných onemocnění. Rostoucí význam fekální bakterioterapie dokazují i jednotlivé případy úspěšně léčených pacientů, u nichž byla fekální bakterioterapie využita k léčbě idiopatických střevních zánětů (zejména ulcerózní kolitidy), některých forem syndromu dráždivého tračníku, obstipace, ale také k léčbě jiných než střevních onemocnění (obezita, roztroušená skleróza, Parkinsonova choroba, autismus, idiopatická trombocytopenická purpura a další) (7). U těchto indikací je samozřejmě nutné provést řadu klinických studií (tab. 1). Pokud by byl léčebný efekt prokázán, potvrdilo by to předpoklad zásadního vlivu střevní mikroflóry – coby významné součásti naší imunitní soustavy – na prevenci a vznik mnoha onemocnění. Doceněna by byla i významná role střevní mikroflóry v konceptu osy střevní mikroflóra-střevo-mozek (9).
Tab. 1. Příklady onemocnění spojených s poškozenou střevní mikroflórou (upraveno dle 10) 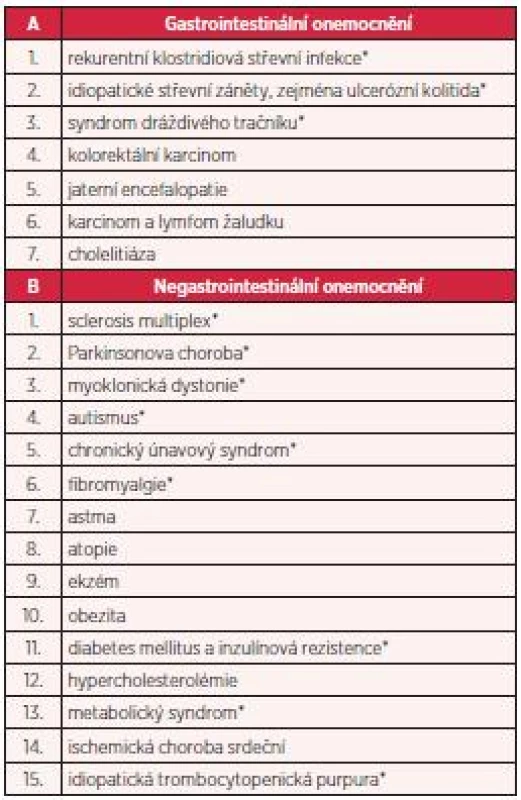
*Literárně dokumentováno zlepšení průběhu onemocnění nebo vyléčení po provedení fekální bakterioterapie. První informace o léčbě CDI fekální bakterioterapií publikoval u nás v roce 2011 MUDr. P. Polák z Kliniky infekčních chorob Fakultní nemocnice v Brně (1). Při zavedení tohoto léčebného postupu na našem oddělení jsme vycházeli ze zkušeností brněnských autorů, kteří aplikovali pacientům s rekurentní CDI nazojejunální sondou 20–50 g stolice homogenizované v 50 ml krystaloidního roztoku (1), a amerických autorů, kteří uveřejnili v odborném tisku možný rozsah vyšetření dárce stolice (7, 10).
V následující anamnéze pacientek bychom chtěli zvláště upozornit na to, že rozvoj CDI nebyl jednoznačně vázán na předchozí antibiotickou terapii.
POPIS PŘÍPADU 1
Pacientka, 81 let, léčená pro arteriální hypertenzi, s adenokarcinomem Vaterovy papily po provedení resekce hlavy pankreatu v anamnéze, byla v roce 2012 hospitalizována na infekčním oddělení pro akutní enteritidu, jejíž etiologie byla hodnocena jako virová. Po intenzivní rehydratační a dietní terapii došlo ke zlepšení klinického stavu pacientky a ústupu průjmů. V následujících dnech ale průjmové stolice recidivovaly a ve stolici byl zachycen toxin A i B Clostridium difficile. I po správně vedené terapii této ataky udávala pacientka stále intermitující průjmy, pro které perorálně užívala dlouhodobě metronidazol (500 mg 3krát/den). Na přelomu března a dubna roku 2013 byla přijata na naše pracoviště k hospitalizaci s febriliemi až 38 °C, křečovitými bolestmi břicha a přibližně 12 řídkými stolicemi za den. Po průkazu pozitivity klostridiových toxinů A a B byla zahájena terapie perorálním metronidazolem (v dávce 500 mg 3krát/den) a vankomycinem (v dávce 125 mg 4krát/den) po dobu 14 dnů. Tato léčba sice vedla k ústupu febrilií a abdominální bolesti, ale průjmové stolice přetrvávaly stále. To bylo důvodem našeho rozhodnutí k provedení fekální bakterioterapie. Převod fekálního transplantátu od zdravé a předem vyšetřené dárkyně byl úspěšný a do několika málo hodin po podání došlo k ústupu průjmů. Pacientka je od 10. dubna 2013 (kdy byla provedena fekální bakterioterapie) bez rekurence CDI.
POPIS PŘÍPADU 2
Pacientka, 84 let, sledována pro asthma bronchiale, léčena pro arteriální hypertenzi a ischemickou chorobu srdeční, měla od listopadu roku 2012 průměrně tři řídké stolice za den. Protože se počet těchto stolic stále zvyšoval, navštívila lékaře a byla doporučena k hospitalizaci na infekční oddělení s diagnózou průjmových stolic nejasné etiologie. Po vyloučení infekční etiologie (včetně negativního vyšetření na klostridiové toxiny) byla k dalšímu vyšetření přeložena na naše pracoviště. Anamnéza protrahovaných průjmů s chronickou dehydratací pacientky, která byla příčinou dlouhodobého upoutání na lůžko, vedla i přes intenzivní hydrataci a preventivní léčbu nízkomolekulárním heparinem ke komplikaci v podobě pravostranné femoropopliteální flebotrombózy. Vzhledem k chronickým průjmům bylo provedeno endoskopické vyšetření s obrazem pablánové pankolitidy a tento nález spolu s pozitivním klostridiovým toxinem ve stolici vedl k diagnóze klostridiové střevní infekce (obr. 1).
Obr. 1. Endoskopický obraz nejtěžší formy infekce <i>Clostridium difficile</i> – pseudomembranózní kolitida (ilustrativní snímek, archiv Oddělení endoskopických metod a sonografie Thomayerovy nemocnice) 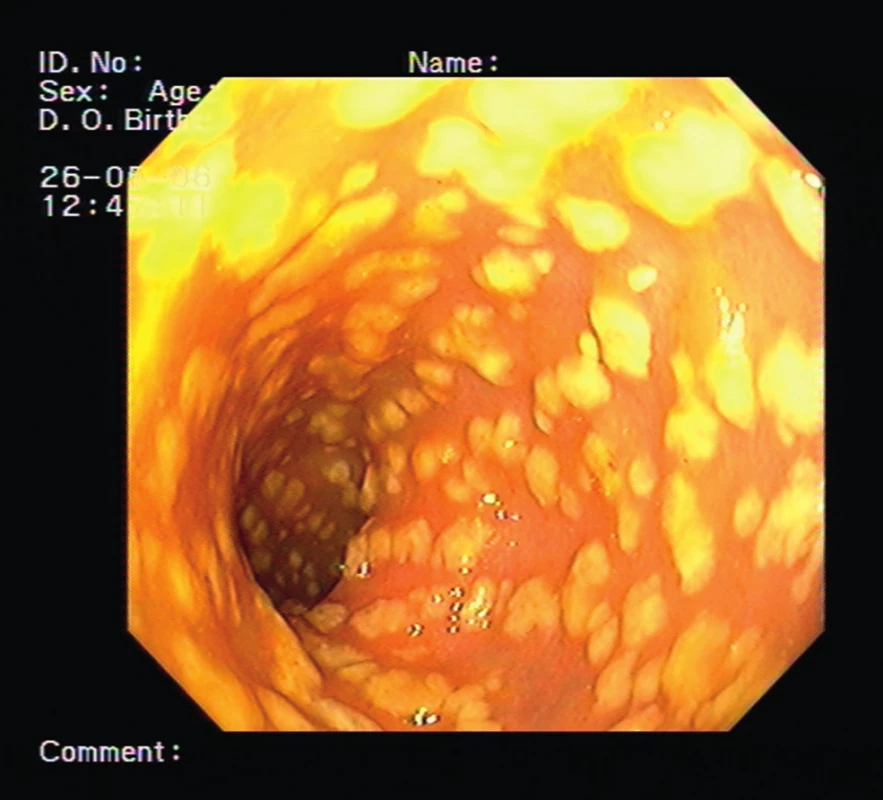
Byla zahájena perorální léčba vankomycinem (v dávce 125 mg perorálně 4krát/den) a metronidazolem (v dávce 500 mg parenterálně 3krát/den). Po 14 dnech léčby byla antibiotika vysazena a pacientka neudávala žádné obtíže. Za 5 dní však došlo k recidivě průjmů (až osm řídkých stolic za den). Opětovná desetidenní antibiotická terapie vedla k jejich ústupu, avšak po 5 dnech se objevila další ataka průjmového onemocnění. Zahájili jsme tedy znovu antibiotickou terapii vankomycinem (125 mg perorálně 4krát/den) a metronidazolem (zpočátku parenterálně 500 mg 3krát/den, dále perorálně 500 mg 3krát/den), a protože se jednalo již o třetí rekurenci klostridiové enterokolitidy, přistoupili jsme k aplikaci fekální bakterioterapie. Efekt této léčby se dostavil do cca 24 hodin. Pacientka je od provedení fekální bakterioterapie 1. července 2013 bez rekurence.
PROVEDENÍ VÝKONU FEKÁLNÍ BAKTERIOTERAPIE
Prvním úkolem před přenosem stolice zdravého dárce bylo získat plně informovaný souhlas pacienta, kterému byla celá léčebná metoda podrobně popsána a vysvětlena. Následoval pak výběr vhodného dárce. Ten byl zevrubně vyšetřen, aby nedošlo k přenosu jakékoliv infekce na pacienta (parazitologické vyšetření stolice, běžné kultivační vyšetření stolice, byla vyloučena přítomnost klostridiového antigenu a toxinu ve stolici dárce, vyšetřena byla dále sérologie hepatitid, HIV, provedli jsme rozbor krevního obrazu, koagulačních parametrů, základní biochemická vyšetření séra a moči včetně močového sedimentu). Všechna tato vyšetření dárce byla provedena v rozmezí cca 1 týdne. U první pacientky jsme mezitím pokračovali ve standardní antibiotické terapii (kombinace perorálního metronidazolu a perorálního vankomycinu), kterou jsme ukončili 1 den před vlastním přenosem fekálního transplantátu. U druhé pacientky jsme taktéž před provedením fekální bakterioterapie podávali standardní antibiotickou terapii a ukončili ji 1 den před výkonem. Před každou transplantací jsme podali inhibitory protonové pumpy ke snížení gastrické sekrece a kalciové kapsle s kodeinem k deceleraci střevní motility (tab. 2).
Tab. 2. Postup provedení fekální bakterioterapie (archiv autora) 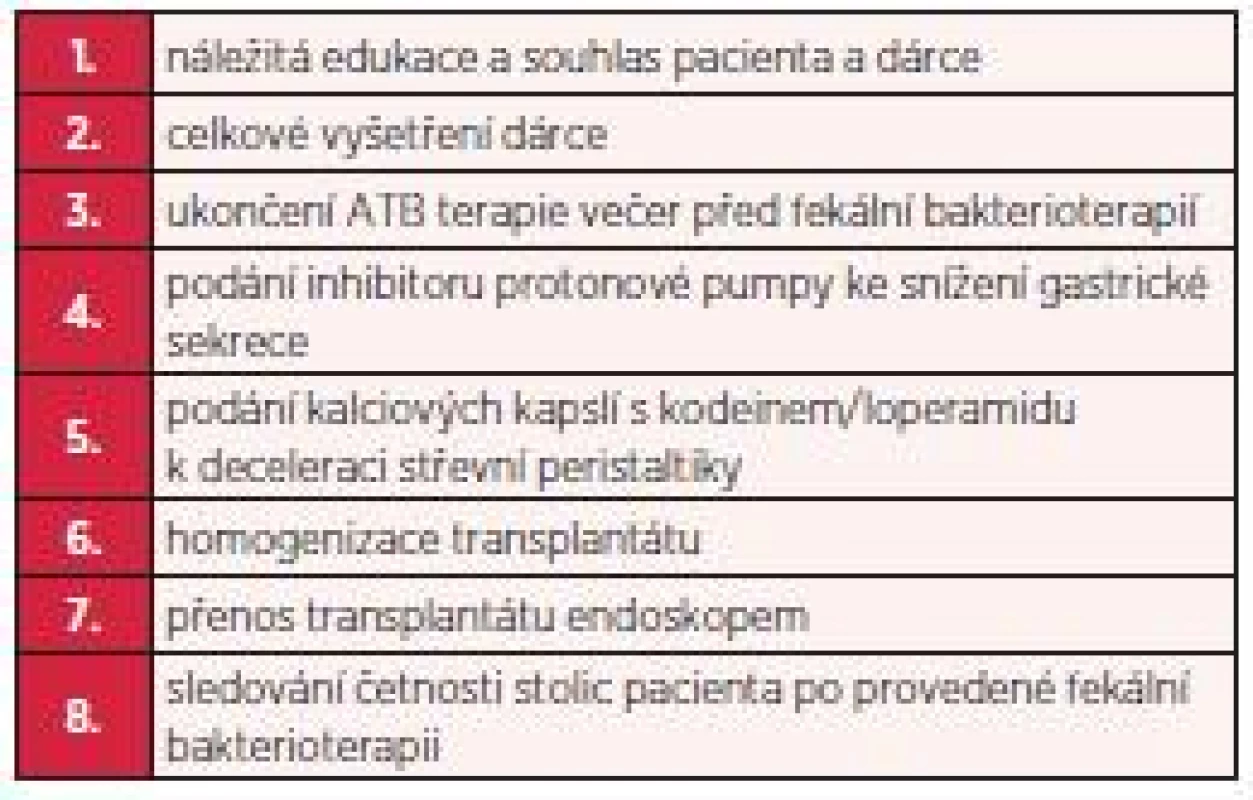
Fekální transplantát (obr. 2) byl zpracován postupem zvaným homogenizace a aplikován pracovním kanálem gastroskopu do oblasti přechodu duodena a jejuna (obr. 3).
Obr. 2. Fekální transplantát – 300 ml homogenizátu (archiv autora) 
Obr. 3. Přenos fekálního transplantátu pracovním kanálem gastroskopu (archiv autora) 
Za zásadní jsme považovali pacientům podrobně popsat celou léčebnou metodu se zvláštním důrazem na předpokládaný mechanismus jejího účinku. Výsledkem edukace po odstranění všech nejasností byl zcela informovaný pacient. Byli jsme překvapeni vstřícností motivovaných pacientů, kteří s navrhovanou léčebnou metodou souhlasili jakožto s vhodnou alternativou. Informovaní pacienti poté velmi dobře napomohli s výběrem vhodného dárce (pacientův příbuzný či známý), který byl taktéž náležitě informován o celé metodě a jejím principu.
Zajímavé je zjištění, že 97 % pacientů s rekurentní klostridiovou střevní infekcí ve skupině léčené fekální bakterioterapií by bylo ochotno podstoupit tuto léčbu znovu a 53 % by ji dokonce upřednostnilo jako léčbu první linie, ještě před podáním antibiotik (11).
DISKUZE
Ve světové literatuře zabývající se problematikou fekální bakterioterapie je cesta přenosu bakteriálního transplantátu pomocí koloskopu do colon ascendens udávána častěji než aplikace duodenojejunální. Konečné výsledky léčebného efektu se však statisticky významněji neliší. Fekální transplantát lze rovněž podat klyzmatem, které však dosahuje maximálně do lienální flexury – proximální úsek tlustého střeva a terminální ileum tak nejsou kolonizovány bakteriemi transplantátu stolice (12). Význam aplikace fekálního transplantátu prostřednictvím klyzmat však roste v rámci léčby jiných onemocnění než CDI (např. ulcerózní kolitida). My jsme (s přihlédnutím k přání obou pacientek) využili přenos transplantátu do duodena prostřednictvím pracovního kanálu gastroskopu.
V současné době není jasné, zda je výhodnější využít stolici od zdravého příbuzného nebo zdravého nepříbuzného dárce (11). Prokázáno rovněž nebylo, zda lze lepších výsledků dosáhnout využitím čerstvé stolice (tedy podané do 8 hodin od získání od zdravého dárce), nebo stolice hluboce zmražené a déle skladované (13). Je již zpracována metodika úpravy stolice k jejímu dlouhodobému skladování, kdy se koncentrovaná fekální suspenze smísí s 10% glycerolem a následně skladuje v teplotě –80 °C po dobu 1–8 týdnů. Takto skladovaná stolice je poté během 2–4 hodin rozmrazena a před aplikací naředěna krystaloidním roztokem. Takto upravenou stolici důkladně vyšetřeného pravidelného dárce lze poté bezpečně využít i k podání na jiných pracovištích (13).
K procesu homogenizace stolice je nejčastěji využit nebakteriostatický krystaloidní roztok (např. fyziologický roztok), lze však využít i jiné tekutiny, např. vodu nebo mléko (14).
Neexistují obecně platná doporučení ohledně ukončení antibiotické terapie před provedením vlastní bakterioterapie. Američtí autoři doporučují ukončit tuto antibiotickou léčbu 2–3 dny před podáním fekálního transplantátu, my jsme zvolili interval 24 hodin. Nemáme rovněž k dispozici jednoznačná doporučení ohledně výběru a screeningu dárců fekálního transplantátu. Dárce stolice by měl být zcela zdráv, bez rizikového sexuálního chování, bez tetování a piercingu v posledních 3 měsících, neměl by užívat antibiotika v posledních 3 měsících a neměl by mít v anamnéze chronické průjmy, zácpy, idiopatický střevní zánět, syndrom dráždivého tračníku, kolorektální karcinom. Neměl by být imunokompromitovaný, morbidně obézní, neměl by mít metabolický syndrom, atopii, chronický únavový syndrom (7). Američtí autoři pak doporučují tato vyšetření: vyšetření Clostridiového toxinu ve stolici, kultivační a parazitologické vyšetření stolice (Giardia, případně též Cryptosporidium, Isospora), eventuálně rotaviry, antigen Helicobacter pylori ve stolici, sérologii hepatitid A, B, C, HIV a syfilis (7). Dle zkušeností našeho pracoviště je vhodné při screeningu dárce fekálního transplantátu postupovat tímto způsobem: získat prohlášení od dárce, že se neléčí se žádným závažným onemocněním, že se cítí zdráv, nemá rizikové chování a v posledních 3 měsících neužíval žádná antibiotika; dárci vyšetřit sedimentaci erytrocytů, provést základní biochemická vyšetření krve a krevního obrazu; pokud jsou tato vyšetření normální, vyšetřit krev dárce sérologicky (HBsAg, anti-HCV, anti-HAV IgM, HIV, Yersinie) a stolici dárce kultivačně a parazitologicky.
Bezpečnost fekální bakterioterapie představuje v současné době zcela zásadní téma. Riziko přenosu patogenů z dárce na příjemce je nutné minimalizovat důkladným vyšetřením dárce. Některá zahraniční pracoviště již mají v současné době k dispozici mraženou stolici od podrobně vyšetřených pravidelných dárců, kteří jsou zcela zdrávi a dodržují zásady racionální životosprávy. Do budoucna lze očekávat nárůst kritérií pro výběr optimálního dárce stolice. Zatím jsou však tato kritéria nejednoznačná a roli hraje především bezpečnost vlastního výkonu pro pacienta.
Dnes je již jednoznačně prokázáno, že vznik střevní dysmikrobie s následnou kolonizací Clostridium difficile není podmíněn pouze antibiotickou terapií, kdy riziko CDI můžeme očekávat u všech ATB skupin mimo aminoglykosidy (15), ale i dalšími faktory. Je samozřejmé, že pokud byla CDI podmíněna předchozím užíváním antibiotika, je nutné léčbu vysadit. Jak jsme již uvedli výše, nebyla u našich dvou pacientek prokázána vazba začátku klostridiového onemocnění na předcházející antibiotickou terapii. Jako další faktory disponující ke vzniku klostridiové kolitidy jsou uváděny:
- imobilita střeva (stavy po operaci v břišní dutině, léky tlumící peristaltiku, gravidita),
- celková imobilita (dlouhodobý pobyt na lůžku, operace v celkové narkóze, revmatické a nervové choroby omezující hybnost),
- porucha slizniční imunity GIT (nedostatečná tvorba slizničního IgA, karence bílkovin, maligní tumory, léčba cytostatiky, ulcerózní kolitida),
- vyšší věk (incidence a závažnost nemoci podstatně narůstá od věku ≥ 65 let) (2).
Prozatím není uzavřena otázka vlivu inhibitorů protonové pumpy na výskyt klostridiových střevních infekcí (16, 17). Mechanismus, jakým inhibitory protonové pumpy zvyšují pravděpodobnost klostridiové infekce, je doposud neznámý. Předpokladem je, že podobně jako řada antibiotik, mohou i inhibitory protonové pumpy změnit složení střevní mikroflóry, a tím poskytnout prostor pro klíčení spór Clostridium difficile.
Je řada klinických prací, kdy se do kombinace s antibiotiky přidávala probiotika. Přesvědčivé důkazy o efektu této kombinace však neexistují. Probiotika je však možné využít v primární a sekundární profylaxi CDI – tedy při antibiotické léčbě nebo po proběhlé epizodě CDI ke snížení pravděpodobnosti rekurence. Ačkoliv výsledky metaanalýz (18, 19) signifikantně nepotvrzují účinnost konkrétních kmenů probiotik, považuje se za výhodné využívat v primární a sekundární prevenci CDI zejména probiotika s obsahem bakterií Lactobacillus sp. a kvasinek Saccharomyces boulardi.
Další možnou cestou léčby rekurentní klostridiové střevní infekce je kromě slibné a přesvědčivé metody fekální bakterioterapie i neustále se rozvíjející antibiotická terapie.
Z nových antibiotik indikovaných pro CDI je v naší republice registrován a již také používán fidaxomicin. Efekt léčby tímto antibiotikem je velmi dobrý při prvém onemocnění a statisticky významně lépe zabraňuje relapsům než léčba standardní (20). Jeho podání jako léku prvé volby však brání vysoká cena.
K diskuzi navrhujeme postup léčby, který bychom chtěli uplatňovat na našem oddělení:
- první ataka onemocnění CDI – standardní antibiotická terapie: u lehčích případů metronidazol, u těžších vankomycin;
- první relaps CDI – vankomycin nebo fidaxomicin (dle ekonomických možností nemocničního oddělení). Pokud by byl podán fidaxomicin, fekální bakterioterapii zatím neprovádět. V případě léčby vankomycinem by následovala fekální bakterioterapie.
- druhý relaps CDI – fidaxomicin nebo vankomycin a následně fekální bakterioterapie.
Pokládáme toto časování léčby za vhodné i vůči pacientovi, protože není důvodů vyčkávat se změnou standardní léčby až po více relapsech.
Z ostatních antibiotik zkoušených v této indikaci se nepříliš osvědčil rifaximin vzhledem k rychlému vzniku rezistence mikroba.
V klinickém hodnocení jsou antibiotika nové skupiny cyklických lipoglykopeptidů (surotomycin, ramoplanin), 2. generace skupiny glykopeptidů (oritavancin, dalbavancin, telavancin) a stále jsou nadějné i deriváty kyseliny fusidové. Koncem července roku 2013 byla zahájena analýza dat v rámci prospektivní observační studie testující bezpečnost a účinnost parenterálně aplikovaného glycylcyklinového antibiotika tigecyklinu přidaného ke standardní perorální léčbě (vankomycin nebo metronidazol).
Testována je i řada dalších látek, z nichž se některé jeví jako velmi nadějné: GT160-246 (tolevamer – polymer se schopností vázat toxiny Clostridium difficile) (21), ACT-79811 (cadazolid – oxazolidinonové antibiotikum), LFF571 (semisyntetické thiopeptidové antibiotikum), RBX2660 (definovaná suspenze střevní mikrobioty).
Za zmínku stojí snaha vyvíjet nové formy běžně užívaných antibiotik, např. metronidazol s modifikovaným uvolňováním léčiva, s cílem zajistit co nejvyšší koncentraci v distálních úsecích gastrointestinálního traktu.
Uveďme pro úplnost v současné době probíhající slibný výzkum možného využití lidských monoklonálních protilátek proti toxinu A a B Clostridium difficile či toxoidu Clostridium difficile.
Mimo výše uvedené možnosti léčby je nutno připomenout rovněž prevenci. Velmi důležité je dodržování hygienických opatření a zásad antibiotické politiky při indikaci antibiotické terapie. Nelze zapomenout i na některá obecná doporučení – příjem pestré stravy s dostatkem hrubé vlákniny, užívání mléčných výrobků s probiotickými kulturami, omezení konzumace sterilovaných jídel nebo stravy s vysokým obsahem konzervačních látek.
ZÁVĚR
Nejen z našich zkušeností, ale i ze stále se množící kazuistické literatury vyplývá, že fekální bakterioterapie použitá při recidivující CDI představuje léčebnou metodu s vysokou efektivitou.
Nové léčebné cesty a velmi dobré výsledky fekální bakterioterapie jsou nadějí pro stále narůstající počet pacientů trpících závažnou rekurentní střevní infekcí vyvolanou bakterií Clostridium difficile.
Boj s touto bakterií může být úspěšný pouze za předpokladu, že budeme dostatečně otevřeni novým poznatkům a zejména novým cestám léčby této infekce.
ADRESA PRO KORESPONDENCI:
MUDr. Jiří Vejmelka
Interní oddělení Thomayerovy nemocnice
Vídeňská 800, 140 59 Praha 4
e-mail: jiri.vejmelka@ftn.cz
Zdroje
1. Polák P, Freibergerová M, Juránková J, Kocourková H, Mikešová L, Svačinka R, Husa P. První zkušenosti s fekální bakterioterapií v léčbě relabující pseudomembranózní kolitidy způsobené Clostridium difficile. Klin Mikrobiol Infekc Lek 2011; 17(6): 214–217.
2. Beneš J, Husa P, Nyč O. Doporučený postup diagnostiky a léčby kolitidy vyvolané Clostridium difficile [on-line]. Dostupný na: www.infekce.cz/Standardy/dopCDI12.rtf [cit. 6-1-2013].
3. Zhang F, Luo W, Shi Y, et. al. Should we standardize the 1700-years-old fecal microbiota transplantation? Am J Gastroenterol 2012; 107(11): 1755.
4. Borody TJ, Warren EF, Leis SM, et al. Bacteriotherapy using fecal flora: toying with human motions. J Clin Gastroenterol 2004; 38 : 475–483.
5. Eiseman B, Silen W, Bascom GS, et al. Fecal enema as an adjunct in the treatment of pseudomembranous enterocolitis. Surgery 1958; 44 : 854–859.
6. Schwan A, Sjolin S, Trottestam U, et al. Relapsing Clostridium difficile enterocolitis cured by rectal infusion of homologous faeces. Lancet 1983; 2 : 845.
7. Brand LJ, Aroniadis OC. An overview of fecal microbiota transplantation: techniques, indications, and outcomes. Gastrointest Endosc 2013; 78(2): 240–249.
8. Kassam Z, Lee CH, Yuan Y, Hunt RH. Fecal microbiota transplantation for Clostridium difficile infection: systematic review and meta-analysis. Am J Gastroenterol 2013; 108(4): 500–508.
9. Chen X, D'Souza R, Hong ST. The role of gut microbiota in the gut-brain axis: current challenges and perspectives. Protein Cell 2013; 4(6): 403–414.
10. Brandt LJ, Aroniadis OC. Fecal microbiota transplantation: past, present and future. Curr Opin Gastroenterol 2013; 29 : 79–84.
11. Brandt LJ, Aroniadis OC, Mellow M, et al. Long-term follow-up of colonoscopic fecal microbiota transplant for recurrent Clostridium difficile infection. Am J Gastroenterol 2012; 107(7): 1079–1087.
12. Persky S, Brandt LJ. Treatment of recurrent Clostridium difficile-associated diarrhoea by administration of donated stool directly through a colonoscope. Am J Gastroenterol 2000; 95 : 3283–3285.
13. Hamilton MJ, Weingarden AR, Sadowsky MJ, et al. Standardized frozen preparation for transplantation of fecal microbiota for recurrent Clostridium difficile infection. Am J Gastroenterol 2012; 107 : 761–767.
14. Gough E, Shaikh H, Manges AR. Systemic review of intestinal microbiota transplantation (fecal bacteriotherapy) for recurrent Clostridium difficile infection. Clin Infect Dis 2011; 53 : 994–1002.
15. Brown KA, Khanafer N, Daneman N, Fisman DN. Meta-analysis of antibiotics and the risk of community-associated Clostridium difficile infection. Antimicrob Agents Chemother 2013; 57(5): 2326–2332.
16. Deshpande A, Pant C, Pasupuleti V, et al. Association between proton pump inhibitor therapy and Clostridium difficile infection in a meta-analysis. Clin Gastroenterol Hepatol 2012; 10(3): 225–233.
17. Lowe DO, Mamdani MM, Kopp A, et al. Proton Pump Inhibitors and Hospitalisation for Clostridium difficile-Associated Disease: A Population-Based Study. Clin Infect Dis 2006; 43 : 1272–1276.
18. Goldenberg JZ, Ma SS, Saxton JD, et al. Probiotics for the prevention of Clostridium difficile-associated diarrhea in adults and children. Cochrane Database Syst Rev. 2013; 5: CD006095.
19. McFarland L. Meta-analysis of probiotics for the prevention of antibiotic associated diarrhea and the treatment of Clostridium difficile disease. Am J Gastroenterol 2006; 101 : 812–822.
20. Cornely OA, Crook DW, Esposito R, et al. Fidaxomicin versus vancomycin for infection with Clostridium difficile in Europe, Canada, and the USA: A double-blind, non-inferiority, randomised controlled trial. Lancet Infect Dis 2012; 12(4): 281–289.
21. Louie TJ, Peppe J, Watt CK, et al. Tolevamer, a novel nonantibiotic polymer, compared with vancomycin in the treatment of mild to moderately severe Clostridium difficile-associated diarrhea. Clin Infect Dis 2006; 43 : 411–420.
22. Nyč O. Přístup k léčbě střevních infekcí způsobených bakterií Clostridium difficile. Klin Mikrobiol Infekc Lek 2010; 16(3): 93–96.
23. Beneš J, Sýkorová B. Kolitida vyvolaná Clostridium difficile. Zpráva z kongresu ICAAC 2006. Klin Mikrobiol Inf Lék 2006; 12 : 247–251.
24. Bergmann D, Koten J, Beneš Z, a kol. Pseudomembranózní kolitida. Vnitř. Lék. 2007; 53(10): 645–652.
25. Zela O, Vítek P. Infekce Clostridium difficile – stav v roce 2012. Med. praxi 2012; 9(10): 391–394.
26. Petr J. Střevní mikrobiom v systémovém pojetí. Medical Tribune 1/2012 [on-line]. Dostupné z: http://www.tribune.cz/clanek/25566-strevni-mikrobiom-v-systemovem-pojeti [cit. 6-1-2014].
27. van Nood, E, Vrieze A, Nieuwdorp M, et al. Duodenal infusion of donor feces for recurrent Clostridium difficile. N Engl J Med 2013; 368(5): 407–415.
28. Petrof EO, Gloor GB, Vanner SJ, et al. Stool substitute transplant therapy for the eradication of Clostridium difficile infection: „RePOOPulating“ the gut. Microbiome 2013, 1 : 3. Dostupné z: http://www.microbiomejournal.com/content/1/1/3 [cit. 6-1-2014].
29. Heineman J, Bubenik S, McClave S, Martindale R. Fighting fire with fire: is it time to use probiotics to manage pathogenic bacterial diseases? Curr Gastroenterol Rep 2012; 14(4): 343–348.
30. Paterson D, Iredell J, Whitby M. Putting back the bugs: bacterial treatment relieves chronic diarrhoea. Med J Aust 2012; 160 (4): 232–233.
31. Joshi NM, Macken L, Rampton D. Inpatient diarrhoea and Clostridium difficile infection. Clin Med 2012; 12(6): 583–588.
32. Didelot X, Eyre D, Cule M, et al. Microevolutionary analysis of Clostridium difficile genomes to investigate transmission. Genome Biol 2012; 13(12): R118.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek vyšel v časopisePraktický lékař
Nejčtenější tento týden
2014 Číslo 4- Nitrofurantoin s řízeným uvolňováním – osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
-
Všechny články tohoto čísla
- O kráse
- Posttraumatická stresová porucha
- Artrotické postižení zápěstí a možnosti jeho operačního řešení
- Předoperační vyšetření a příprava před operací plic
- Výsledky testování Novorozenecké škály pro hodnocení rizika sepse (SOS-CZ)
- Stanovisko předsednictva České lékařské společnosti J. E. Purkyně k systému atestačního (specializačního) vzdělávání
- Co je „third-hand smoke“?
- Fecal microbiota transplantation and novel therapies for Clostridium difficile infection
- Specifika přístupu zdravotní a posudkové péče u osob zbavených způsobilosti k právním úkonům
- Adolf Svoboda (1917–1971)
- Primář MUDr. Svatopluk Káš, CSc. zemřel
- 56. Purkyňův den v Libochovicích
-
David H. Bennett
Srdeční arytmie praktické poznámky k interpretaci a léčbě - Jubilanti
- Praktický lékař
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Artrotické postižení zápěstí a možnosti jeho operačního řešení
- Předoperační vyšetření a příprava před operací plic
- Posttraumatická stresová porucha
- Co je „third-hand smoke“?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



