-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Budoucnost léčby karcinomu plic
Future of lung cancer treatment
The evolution of lung cancer treatment is an example of new perspectives in clinical oncology. Genomically determined targeted therapy of non-small cell lung cancer (NSCLC) is developing very rapidly with the gradual identification of new target structures and the concomitant development of innovative drugs are a great promise for the future. The historical development of systemic treatment of NSCLC is a model example of the path to accurate (precise) treatment. The innovation of the treatment has led to the shift from (non-targeted) cytostatic treatment to targeted therapy and immunotherapy. The targeted treatment and immunotherapy with checkpoint inhibitors have led to breakthrough prolongation of survival in patients with advanced NSCLC. According to a recent European Society for Medical Oncology (ESMO) recommendation, NSCLC is therefore one of the diagnoses where an examination using the next-generation sequencing panel should be performed as a standard.
Keywords:
precision medicine – personalized medicine – agnostic tumor therapy –next-generation sequencing – checkpoint inhibitors – targeted therapy
Autoři: L. Petruželka; J. Špaček; L. Křížová
Působiště autorů: Onkologická klinika 1. LF UK a VFN a ÚVN Praha
Vyšlo v časopise: Klin Onkol 2021; 34(Supplementum 1): 71-81
Kategorie: Přehled
doi: https://doi.org/10.48095/ ccko2021S71Souhrn
Evoluce léčby plicních karcinomů je příkladem nového směřování klinické onkologie. Genomicky řízená terčová léčba nemalobuněčného karcinomu plic (non-small cell lung cancer – NSCLC) se při postupné identifikaci nových cílových struktur a se souběžným vývojem inovativních léků velmi rychle rozvíjí a je velkým příslibem do budoucnosti. Historický vývoj systémové léčby nemalobuněčných karcinomů plic je modelovým příkladem cesty k precizní léčbě. Inovace léčebných postupů vedla k odklonu od (necílené) cytostatické léčby k (cílené) terčové léčbě a imunoterapii. Terčová léčba a imunoterapie inhibitory kontrolních bodů imunitní reakce (checkpoint inhibitory) vedly potom k průlomovému prodloužení doby přežití u pacientů s pokročilými stadii NSCLC. Dle recentního doporučení Evropské společnosti pro klinickou onkologii je také z tohoto důvodu NSCLC jednou z diagnóz, kde by se vyšetření pomocí panelu sekvenování nové generace mělo standardně provádět.
Klíčová slova:
precizní medicína – personalizovaná medicína – tumor-agnostická léčba – sekvenování nové generace – checkpoint inhibitory – terčová léčba
Úvod
Cesta k ukončení stagnace léčby pokročilých solidních nádorů spočívá v klinické aplikaci principů personalizované a precizní medicíny. Budoucností onkologické léčby je genomicky řízená precizní medicína přizpůsobená klinické charakteristice nemocného (personalizovaná medicína). Je to cesta, jak nalézt vhodné nemocné s nejlepší odpovědí na léčbu a minimalizovat nežádoucí účinky [1]. Evoluce léčby plicních karcinomů je příkladem nového směřování onkologie. V léčbě karcinomů plic došlo v poslední dekádě ke dvěma klíčovým změnám léčebného paradigmatu. Inovace léčebných postupů vedla k odklonu od necílené (cytostatické) léčby k cílené (terčové) léčbě a k imunoterapii. Terčová léčba a imunoterapie inhibitory kontrolních bodů imunitní reakce (checkpoint inhibitory) vedly k průlomovému prodloužení doby přežití pacientů s pokročilými stadii nemalobuněčného karcinomu plic (non-small cell lung cancer – NSCLC). Významné prodloužení doby bez progrese onemocnění a celkové doby přežití pokročilého onemocnění je při využití všech možností inovativní léčby možno dosáhnout u 25–30 % nemocných.
Klinická aplikace blokátorů kontrolních bodů imunitní reakce (immune checkpoint blockade) odstartovala novou éru cílené protinádorové imunoterapie, modality umožňující dosáhnout plateau křivky přežití (graf 1).
Graf 1. Rozdíl ve tvaru křivek přežití – chemoterapie, terčová léčba a imunoterapie [69]. ![Rozdíl ve tvaru křivek přežití – chemoterapie, terčová léčba a imunoterapie [69].](https://pl-master.mdcdn.cz/media/image_pdf/4cd68eab9dcd82728f72cd782db098f9.png?version=1622147205)
Dlouhodobé výsledky léčby monoterapie inhibitorem kontrolních bodů imunitní reakce u hyperexpresorů ligandu proteinu programované buněčné smrti 1 (programmed cell death ligand 1 – PD-L1) s 5letým přežitím 31,9 % byly v minulosti nepředstavitelné a jsou vzkazem do budoucnosti (graf 2) [2].
Graf 2. Dlouhodobé výsledky studie KEYNOTE – 024 [2]. ![Dlouhodobé výsledky studie KEYNOTE – 024 [2].](https://pl-master.mdcdn.cz/media/image_pdf/bab20f5c7fcf1629c72ce8adfbcbd4ac.png?version=1622147225)
Imunoterapii nelze řadit mezi paliativní modality ani v léčbě pokročilých stadií onemocnění. Precizní výběr cílené imunoterapie poskytuje velký prostor pro další zlepšení léčebných výsledků. Nicméně budoucnost imunoterapie jako léčby pro všechny nemocné se solidními nádory je klinickým omylem. Budoucnost a správná cesta k precizní imunoterapii spočívá ve vhodném výběru respondentů s využitím imuno-omické predikce pomocí úplného portfolia omických metod (genomika, transkriptomika, proteomika, metabolomika aj.) [3].
Ač jsou výhody principu precizní medicíny jednoznačné, do klinické praxe se teprve postupně dostávají. Je třeba si ovšem uvědomit, že na základně genomického testování formou sekvenování nové generace (new generation sequencing – NGS) je možné identifikovat targetabilní mutaci u 30–40 % nemocných, pro které je možné nalézt odpovídající cílenou terapii. Zatím není standardním postupem provádět molekulárně genetická vyšetření u všech pacientů se solidními malignitami. U NSCLC je ale situace poněkud jiná, protože terčová léčba nezůstala pouze u inhibitorů tyrozinkinázy (TKI) v léčbě EGFR-mutovaných karcinomů, ale máme k dispozici široké portfolio cílených medikamentů (tab. 1). Dle recentního doporučení Evropské společnosti pro klinickou onkologii je také z tohoto důvodu NSCLC jednou z diagnóz, kde by se vyšetření pomocí NGS panelu mělo standardně provádět, viz tab. 1 [4].
Tab. 1. Tyrozinkinázové inhibitory receptoru epidermálního růstového faktoru. 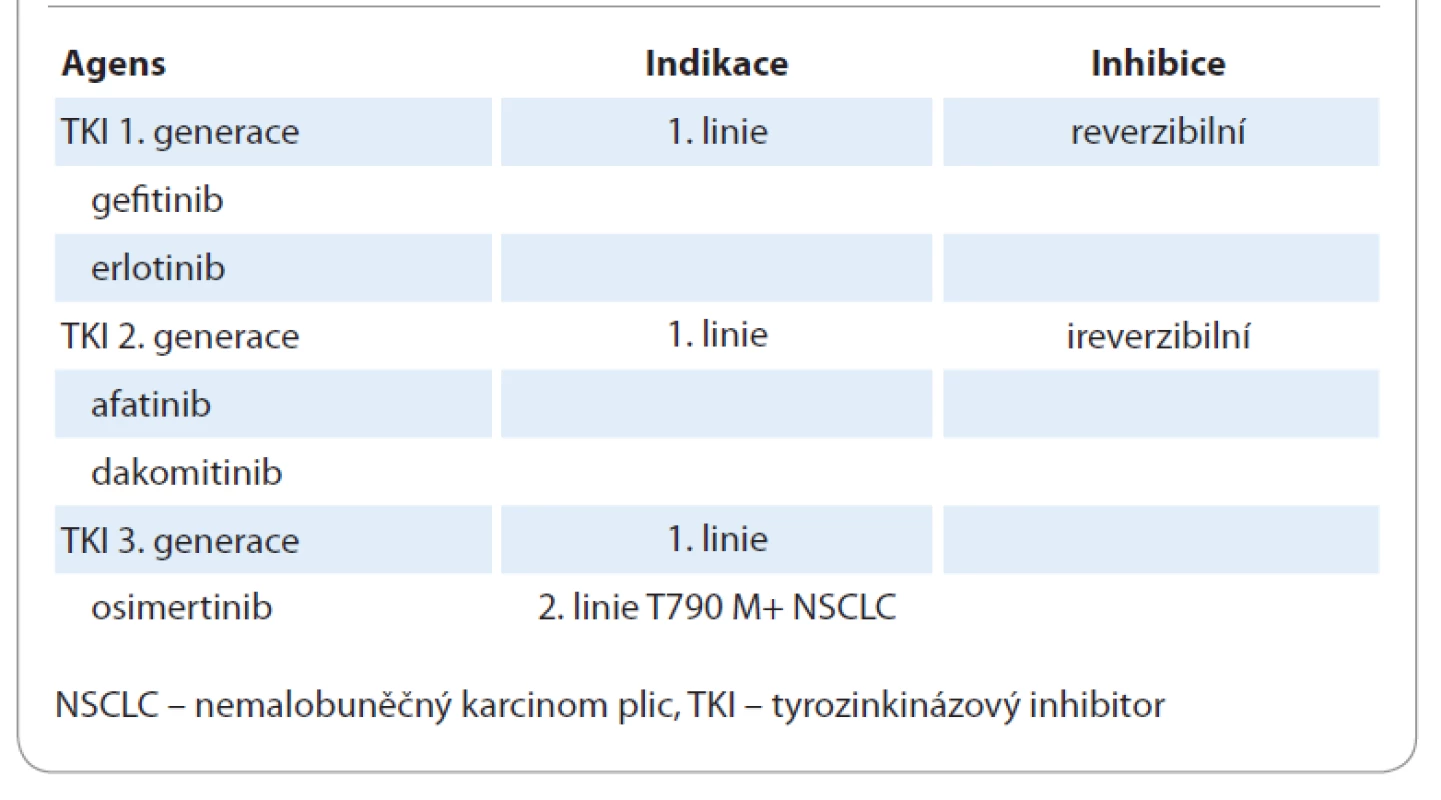
Genomicky řízená terčová léčba NSCLC se při postupné identifikaci nových cílových struktur a se souběžným vývojem inovativních léků velmi rychle rozvíjí a další její rozvoj je příslibem do budoucnosti. Historický vývoj systémové léčby nemalobuněčných karcinomů plic je modelovým příkladem cesty k přesné (precizní) léčbě (graf 3). Precizní a personalizovaná medicína ukončila dlouhotrvající stagnaci léčby NSCLC (graf 4).
Graf 3. Evoluce vnímání onemocnění nemalobuněčným karcinomem plic [70]. ![Evoluce vnímání onemocnění nemalobuněčným karcinomem plic [70].](https://pl-master.mdcdn.cz/media/image_pdf/369ddef001aabac7750e1572cb2d70ba.png?version=1622147290)
Graf 4. Evoluce identifikace molekulárních aberací v čase [71]. ![Evoluce identifikace molekulárních aberací v čase [71].](https://pl-master.mdcdn.cz/media/image_pdf/4872e17f533e672805a9d58e289cd8cc.png?version=1622147327)
Terčová léčba vs. imunoterapie u NSCLC
Identifikace nových řídicích targetabilních aberací bude v budoucnosti výrazně rozšiřovat portfolio terčové léčby, ale bude pravděpodobně prohlubovat příkop mezi terčovou léčbou a imunoterapií checkpoint inhibitory v 1. linii léčby. Přítomnost „základních“ aberací (EGFR, ALK, ROS1) je a v budoucnosti pravděpodobně i nadále bude vylučujícím kritériem pro nasazení imunoterapie jako 1. linie léčby, a to i u PD-L1 hyperexpresorů. Ve většině klinických studií s checkpoint inhibitory kromě atezolizumabu byla přítomnost „základních“ aberací vylučujícím kritériem. Nové klinicky významné targetabilní aberace s dostupností inovativní terčové léčby jsou shrnuty v tab. 2.
Tab. 2. Nové klinicky využitelné targetabilní aberace. 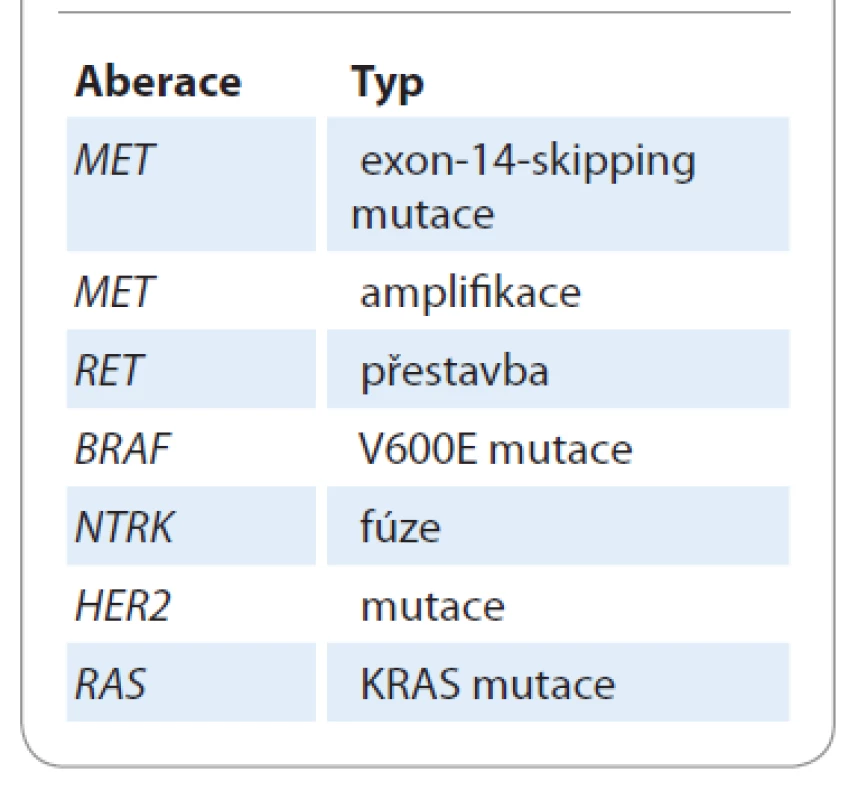
V budoucnosti lze očekávat, že přítomnost nově identifikovaných řídicích aberací ještě více zúží indikační hrdlo pro checkpoint inhibitory v 1. linii.
U nemalobuněčných plicních karcinomů, kde se výběr správné léčby neobejde bez molekulární subklasifikace, může neznalost přítomné aberace nemocnému významně ubrat šanci na dlouhodobé přežití. Výskyt řady řídicích aberací je relativně řídký (např. prevalence ALK fúze < 5 %). Účinnost terčové léčby je u této precizně definované nádorové podskupiny (ALK-pozitivní) dramaticky lepší ve srovnání s nádory, u kterých nebyla molekulární aberace detekována. Neprovedení molekulárního vyšetření může proto nemocné poškodit. Dobrou zprávou pro budoucnost je, že paralelně s novými molekulárními aberacemi přibývají nové terčové léky (tab. 3).
Tab. 3. Inovativní léčba po identifikaci nových terčových struktur. 
MET jako terčová struktura
Mezi MET aberace patří mutace (MET exon-14-skipping mutace) vyskytující se u 3 % adenokarcinomů a až u 20 % relativně vzácných sarkomatoidních NSCLC. Amplifikace genu MET se objevuje u 2–4 % systémově nepředléčených NSCLC a její výskyt je vyšší u EGFR-mutovaných nádorů při rezistenci na EGRF inhibitory (5–20 %) [5]. Pro nádory s prokázanou MET exon-14-skipping mutací byl schválen ke klinickému použití na podkladě výsledků jednoramenné, multikohortové studie fáze II (GEOMETRY mono-1) vysoce selektivní MET inhibitor kapmatinib. Je indikován v 1. linii spíše než imunoterapie a je možná též indikace v následné sekvenci [6,7]. Terčové léky při MET amplifikaci jsou hodnoceny v probíhajících klinických studiích. Zatím není definována standardní léčba.
RET rearrangement jako terčová struktura
Přestavba genu RET se vyskytuje u 1–2 % adenokarcinomů a je častější u mladších jedinců a nekuřáků [8]. Při prokázané přestavbě Americký úřad pro kontrolu potravin a léčiv (Food and Drug Administration –FDA) doporučuje indikace dvou inovativních RET inhibitorů – selpercatinibu a pralsetinibu. Při prokázané genové přestavbě jsou indikovány v 1. linii spíše než imunoterapie. Účinnost selpercatinibu (LOXO-292) byla prokázána ve studii fáze I/II (LIBRETTO-001) a účinnost pralsetinibu (BLU-667) ve studii fáze I/II (ARROW) [9,10]. Dříve bylo možné použít méně potentní RET inhibitory kabozantinib, vandetanib, alektinib a sunitinib, které s novými léky ztratily na významu.
BRAF mutace jako terčová struktura
Aktivační BRAF mutace byly zaznamenány v 1–3 % NSCLC a jsou častější u kuřáků [11]. Nádory s BRAF mutací V600 mají lepší prognózu ve srovnání s non-V600 BRAF mutacemi. NSCLC s BRAF mutací (V600 a non-V600) reagují lépe na imunoterapii na rozdíl od ostatních řídicích mutací u NSCLC [12]. U pacientů s NSCLC s prokázanou BRAF V600E mutací při progresi na chemoterapii je ze strany FDA schválena kombinace dabrafenib plus trametinib. Kombinace je indikována v 1. linii spíše než imunoterapie. U BRAF non-V600E mutací není indikována BRAF nebo MEK inhibice.
NTRK fúze jako terčová struktura
NTRK fúze se u NSCLC vyskytuje vzácně (prevalence < 1 %). U nemocných s NTRK-pozitivním NSCLC je první nebo následnou volbou larotrektinib nebo entrektinib, jak vyplývá z analýz časných klinických studií [13,14].
HER2 mutace jako terčová struktura
HER2 mutace jsou detekovány v 1–3 % NSCLC. Nemocní s detekovanou HER2 mutací by měli být přednostně zařazováni do klinických studií. Potenciální možností jsou protilátkové konjugáty (ado-trastuzumab emtansin, trastuzumab deruxtekan), stejně jako malé molekuly TKI (poziotinib, pyrotinib, mobocertinib) [15–17].
KRAS mutace jako terčová struktura
KRAS mutace se vyskytují až u 25 % všech NSCLC (z ostatních solidních nádorů se objevují též u kolorektálních karcinomů, karcinomů slinivky břišní a gynekologických nádorů). Aktivační mutace KRAS může aktivovat dostředivou transdukční signalizaci Raf-MEK-ERK a PI3K-AKT-mTOR, která ovlivňuje proliferaci, přežití a motilitu nádorových buněk. Většina (80 %) mutací KRAS se objevuje v kodonu 12 (p.G12D (41 %), p.G12V (28 %), p.G12C (14 %)). Mutace KRAS G12C tvoří téměř 50 % ze všech KRAS mutací u NSCLC [18]. Mutace KRAS G12C je často spojena s mutací serin/threonin kinázy 11 (STK11) a TP53. Naopak je téměř exkluzivní s EGFR mutací [19]. Kromě ko-mutací se může simultánně vyskytnout amplifikace v genu MET (15,4 %) nebo ERBB2 (13,8 %) [20]. Tyto ko-alterace jsou potenciálem pro tvorbu kombinovaných režimů v budoucnosti. Výzkumná snaha zablokovat signály aktivované KRAS mutací dlouho selhávala, KRAS onkogen byl považován za „nezasažitelnou“ terčovou strukturu [21]. V klinických studiích nebyla potvrzena účinnost inhibitorů farnesyl transferázy (tipifarnib), Raf (selumetinib), MEK (tivantinib, cobimetinib, trametinib) a MET aberace (onartuzumab, ganetespib) [22]. Nicméně recentně bylo toto prolomeno s vývojem nových KRAS innhibitorů AMG 510 (sotorasib) a MRTX849. Sotorasib je inovativní, vysoce selektivní ireverzibilní perorální inhibitor KRAS G12C ověřený v klinické studii fáze I CodeBreaK 100 u pacientů s lokálně pokročilým a metastazujícím NSCLC s KRAS G12C mutací [23,24]. MRTX849 je další potentní perorální KRAS G12C inhibitor v klinickém zkoušení [25,26]. První výsledky léčby inovativními KRAS G12C inhibitory jsou shrnuty v tab. 4. Při hodnocení sotorasibu byl zaznamenán jeho příznivý bezpečnostní profil a pouze u 8,5 % silně předléčených pacientů byla přerušena léčba pro nežádoucí účinky (NÚ). Nejčastějším NÚ jakéhokoliv stupně byl průjem (25,4 %), elevace alaninaminotransferázy (20,3 %) a aspartátaminotransferázy (20,3 %), únavnost (10,2 %), nauzea (10,2 %), elevace alfa-fetoproteinu (8,5 %) a nechutenství (6,8 %). Klinický výzkum pokračuje. V probíhající studii fáze III CodeBreaK 200 je přímo srovnáván sotorasib s docetaxelem u předléčených pacientů s NSCLC KRAS G12C mutací.
Tab. 4. Výsledky inovativní léčby KRAS-mutovaných pokročilých NSCLC. 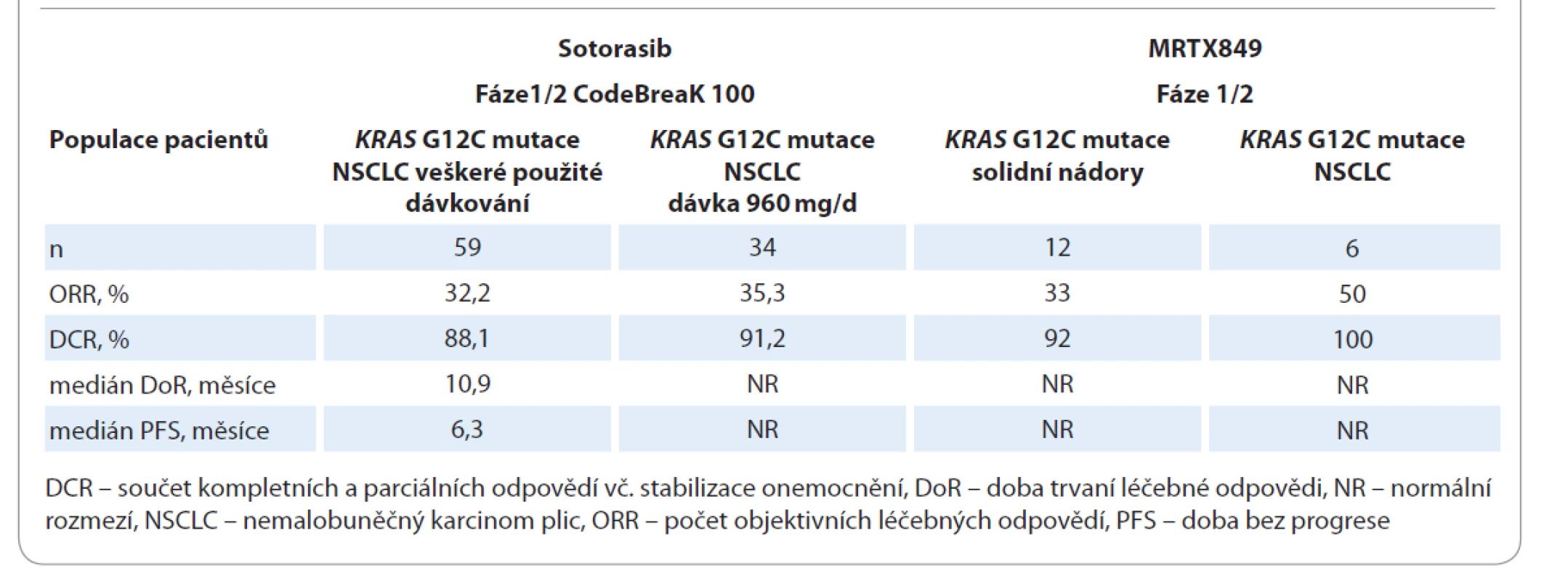
KRAS mutace jsou spojeny s vyšší mutační náloží (tumor mutation burden – TMB) a vyšší PD-L1 expresí, která může ovlivnit senzitivitu k checkpoint inhibitorům. Imunogenicita při KRAS mutaci může být ovlivněna přítomností ko-mutací. Ko-mutace TP53 může zvyšovat senzitivitu k checkpoint inhibitorům, ko-mutace STK11 naopak způsobuje rezistenci. V metaanalýze klinických studií s nivolumabem a atezolizumabem u pokročilých NSCLC bylo potvrzeno delší přežití OS při léčbě checkpoint inhibitory při KRAS-mutovaných NSCLC. Obdobný benefit byl prokázán v klinických studiích s pembrolizumabem [27,28].
Schéma 1 zachycuje evoluci armamentaria terčové léčby se začleněním nových terčových léků, které se bude v budoucnosti rozšiřovat.
Schéma 1. Evoluce armamentaria terčové léčby. 
Terčová léčba nebo imunoterapie checkpoint inhibitory nebo jejich kombinace
Pro klinickou praxi platí, že při identifikaci řídicí mutace současně s hyperexpresí PD-L1 by měla být úvodní modalitou vždy terčová léčba, vč. PD-L1 100 % superexpresorů. Imunoterapie je v tomto případě nesprávná volba spojená s nižší účinností a vyšším rizikem nežádoucích účinků. Nádorové mikroprostředí u plicních karcinomů s identifikovanou řídicí mutací je méně imunogenní, „studené“, bez dostatečného množství CD8+ tumor-infiltrujících lymfocytů (TILs) – výjimkou jsou mutace KRAS. Jak malá TMB, tak nízké zastoupení CD8+ TIL jsou spojeny s nižší účinností imunoterapie u těchto pacientů [29]. Z těchto důvodů byla přítomnost řídicí mutace (EGFR, ALK, ROS1) vylučujícím kritériem u většiny studií s imunoterapií v 1. linii. Stanovení molekulárních aberací před zahájením léčby je proto klinickou urgencí (minimálně EGFR, ALK a ROS1). Tyto řídicí mutace jsou častější u mladších jedinců a nekuřáků, kde je celková TMB nižší zejména z důvodu nekuřáctví a výskyt neoantigenů zvyšujících imunogenicitu je nižší. Otázkou je, zda toto bude platit i nadále pro všechny přibývající, nově identifikované genové aberace [30].
Tab. 5 shrnuje současné a budoucí kontroverze imunoterapie a terčové léčby.
Tab. 5. Současné a budoucí kontroverze imunoterapie a terčové léčby. 
Tumor-agnostická léčba
Obecně jde o druh systémové terčové léčby maligních onemocnění, při které se používají léky založené na genetických a molekulárních vlastnostech konkrétního nádoru bez ohledu na příslušnou histologii nebo tkáň, kde nádorové bujení začalo [31].
Nádorové nemoci jsou mimořádně heterogenní, ale heterogenní jsou i hostitelé nemoci. Tumor-agnostická léčba používá stejný lék k terapii všech typů nádorů, které mají specifickou genetickou mutaci nebo vykazují určitý biomarker zvyšující pravděpodobnost léčebné odpovědi na daný lék. Průlom v tumor-agnostické léčbě nastal v listopadu 2018, kdy byl FDA v USA zaregistrován larotrektinib (později entrektinib) u nádorů s identifikovatelnou NTRK fúzí k léčbě solidních karcinomů bez ohledu na primární lokalizaci nádoru. Současně se schválením léčby checkpoint inhibitorem u nádorů s prokázanou mikrosatelitovou instabilitou (MSI high) se jedná o průlomové události ve vývoji léčiv aplikovaných nezávisle na lokalitě vzniku nádoru a jeho histologii [32,33]. Principy tumor-agnostické léčby budou v budoucnosti využívány jak v terčové léčbě, tak v imunoterapii a dá se očekávat pochopení nového přístupu a z toho plynoucí podpora plátci zdravotní péče. Tyto principy je nutné uplatnit i ze strany plátců zdravotní péče a přizpůsobit tomu schvalování úhrady léčby.
Precizní checkpoint inhibitory jsou zatím iluzorní. Imunoterapie je sice účinná napříč solidními nádory, ale hrdlo účinnosti je poměrně úzké a léčebné odpovědi lze zatím dosáhnout jen u 30–35 % léčených pacientů [34]. Širší hrdlo účinnosti je u nejvíce imunogenních nádorů, jako jsou maligní melanomy a renální a plicní karcinomy. Současné armamentarium checkpoint inhibitorů pro léčbu NSCLC je shrnuto v tab. 6.
Tab. 6. Současné armamentarium checkpoint inhibitorů pro léčbu nemalobuněčného karcinomu plic. 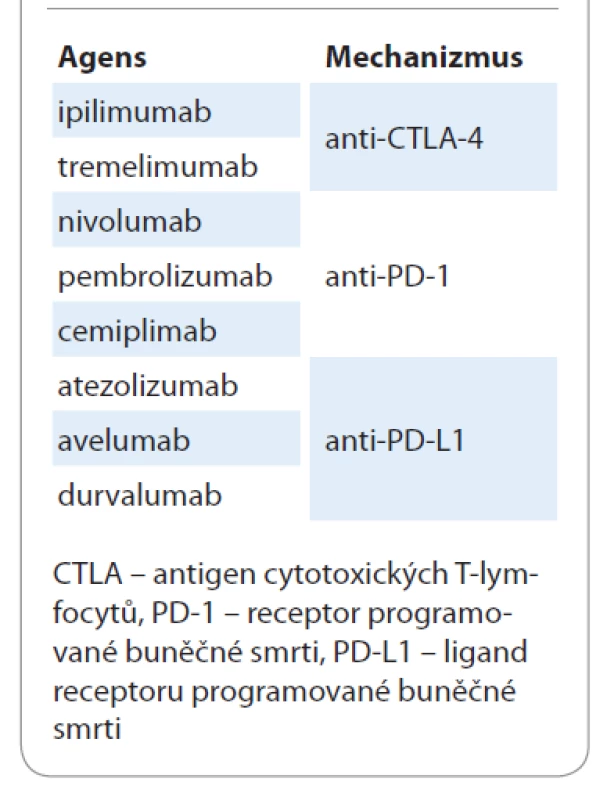
Limitací této inovované terapeutické modality je chybějící širší paleta prediktivních biomarkerů a imunomarkerů [35]. Cílem do budoucnosti je zúžení indikačního hrdla, zvýšení účinnosti a eliminace rizik nežádoucích projevů. Imunoterapie checkpoint inhibitory působí bez ohledu na lokalizaci a typ nádorové tkáně. V některých indikacích je možné imunoterapii považovat za nádorově, lokalizačně a liniově (nezávislou na linii léčby) agnostickou léčbu. Kontroverzní otázky imunoterapie (primární, sekundární rezistence, hyperprogrese, hypertoxicita, doba podávání, reindukce) nejsou dostatečně zodpovězeny a musí být též urgentně řešeny [36,37]. Aplikace precizní medicíny vyžaduje změnu klinického myšlení – nejedná se o výběr nejlepší léčebné modality, ale o výběr (optimální) léčby pro každého nemocného. Imunoterapie checkpoint inhibitory se stala klíčovou součástí standardních algoritmů léčby pacientů v pokročilých stadiích onemocnění NSCLC. Přestane být pouze léčbou paliativní [37] a ve vybraných indikacích bude léčbou s kurativním záměrem. V dohledné době lze očekávat posun k léčbě méně pokročilých stadií v neoadjuvantní a adjuvantní indikaci [39,40].
Klinicky aplikovaná imunoterapie předbíhá prediktivní imunodiagnostiku. Budoucí cestou k navýšení počtu léčebných odpovědí je přesná (precizní) imunoterapie s využitím širokého spektra imunobiomarkerů. Kromě molekulárních biomarkerů nelze při indikaci imunoterapie nikdy opominout klíčové klinické faktory, jako je biologický věk, výkonnostní stav (performance score – PS), komorbidity vč. posouzení preferencí pacienta. Stále existuje řada nezodpovězených otázek a nevyřešených kontroverzí. Roztříštěná metodika stanovení exprese PD-L1 je příkladem nevhodným k následování. Pravděpodobnost léčebné odpovědi se zvyšuje s narůstající expresí PD-L1, ale u některých PD-L1-negativních nádorů lze léčebnou odpověď navodit. Řešením není prohlásit expresi PD-L1 za zbytečný a nepotřebný biomarker. Identifikace a validace dalších prediktorů je proto klinickou urgencí [41–44].
Ve schématu 2 je rozhodovací algoritmus založený pouze na histologickém typu a PD-L1 expresi, který v budoucí éře precizní imunoterapie bude vyžadovat změnu.
Schéma 2. Imunoterapie nemalobuněčného karcinomu plic – nutnost změny v budoucnosti. 
PD-1 – receptor programované buněčné smrti, PD-L1 – ligand receptoru programované buněčné smrti Budoucnost imunopredikce není v izolovaném, ale v kombinovaném využití prediktorů při utilizaci informací z nádoru a nádorového mikroprostředí, ale i periferního imunomu a imunologické charakteristiky hostitele nemoci, vč. jeho mikrobiomu. Za průlomovou událost je možno označit identifikaci mikrobiomu jako dalšího silného faktoru pro imunopredikci – v situaci, kdy je imunopredikce smutnou kapitolou imunoterapie (schéma 2).
Mutační nálož
Tumor mutation burden (TMB) je jedním ze slibných imunonkologických biomarkerů, které by mohly mít potenciál pomoci při výběru pacientů a vést k přesnější imunoonkologii [45].
TMB je definována jako množství somatických mutací v nádorové DNA, většinou se vyjadřuje jako celkový počet mutací na jednu megabázi nádorové DNA (mut/Mb) [46]. Ač se TMB používá jako prediktivní biomarker imunoterapie v mnoha studiích, není jednoznačně stanovena standardní metoda stanovení její hodnoty. Přístupy k výpočtu TMB se značně liší mezi jednotlivými dostupnými NGS platformami, a dokonce ani cut-off mezi TMB high a TMB low není napříč studiemi stejně definován [47]. Ani význam TMB jako prediktivního markeru u NSCLC není zatím jednoznačně stanoven, řada studií ukázala jeho význam a pozitivní korelaci mezi odpovědí na imunoterapii a hodnotou TMB, ale jsou k dispozici i negativní studie u NSCLC, kde nebyl pozorován žádný rozdíl v odpovědi na imunoterapii u pacientů s NSCLC s TMB high, resp. TMB low [48–52]. TMB je slibný biomarker v imunoonkologii, jsou ale potřeba další studie, které jednoznačně určí jeho roli u NSCLC, a hlavně je třeba sjednotit metodologii stanovování tohoto biomarkeru.
Mikrobiom
Výsledky humánních epidemiologických studií a experimentu na myších modelech bylo prokázáno, že střevní mikrobiota může determinovat účinnost protinádorové imunoterapie a může být využita jako prognosticko-prediktivní biomarker a současně jako terčová struktura pro léčbu. Rozdílné složení mikrobiomu může vést k rozdílné odpovědi na imunoterapii. Narušení mikrobiomu (dysbióza) může účinnost imunoterapie snížit [53–55]. Modulace mikrobiomu cestou fekální mikrobiální transplantace (FMT) je zcela novou možností, jak ovlivnit účinnost imunoterapie checkpoint inhibitory. FMT představuje nejpřímější způsob manipulace se střevní mikrobiotou a již běžně se používá v jiných indikacích, což lze demonstrovat na významném úspěchu při léčbě infekce Clostridium difficile, které je rezistentní na konvenční terapii [56]. Klinické studie využívající FMT u pacientů s nádorovým onemocněním jsou v plenkách, ale na základě výsledků preklinických studií diskutovaných výše vyvolaly velké vzrušení [57–59].
Autologní FMT u pacientů s akutní myeloidní leukemií se zkouší při intenzivní chemoterapii s cílem zabránit dysbióze a zvýšit biodiverzitu střevní mikroflóry v průběhu terapie (NCT02928523). Kromě toho je FMT experimentálně zkoušena u pacientů podstupujících imunoterapii pro zhoubné solidní nádory, zejména u těch, kteří jsou léčeni checkpoint inhibitory (tab. 7). Stále probíhá studie fáze I u pacientů s metastatickým melanomem, u nichž selhala předchozí imunoterapie (NCT03353402), přičemž refrakterním pacientům je podávána FMT od pacientů s dobrou léčebnou odpovědí na imunoterapii. Primární výsledky zahrnují bezpečnost a schopnost kolonizovat střevní sliznici akceptora, zatímco sekundární výsledky zahrnují změny v periferním imunogramu, změny aktivity jednotlivých imunitních buněk a objektivní léčebnou odpověď na imunoterapii. V současné době probíhá celá řada klinických studií k ověření hypotézy, že modulace střevní mikrobioty zlepší odpověď na léčbu imunoterapií checkpoint inhibitory (tab. 7). Aktuálně i v ČR probíhá výzkumný projekt zaměřený na výzkum střevního mikrobiomu u pacientů s NSCLC a jeho vliv na imunoterapii.
Tab. 7. Modulace mikrobiomu – klinické studie. 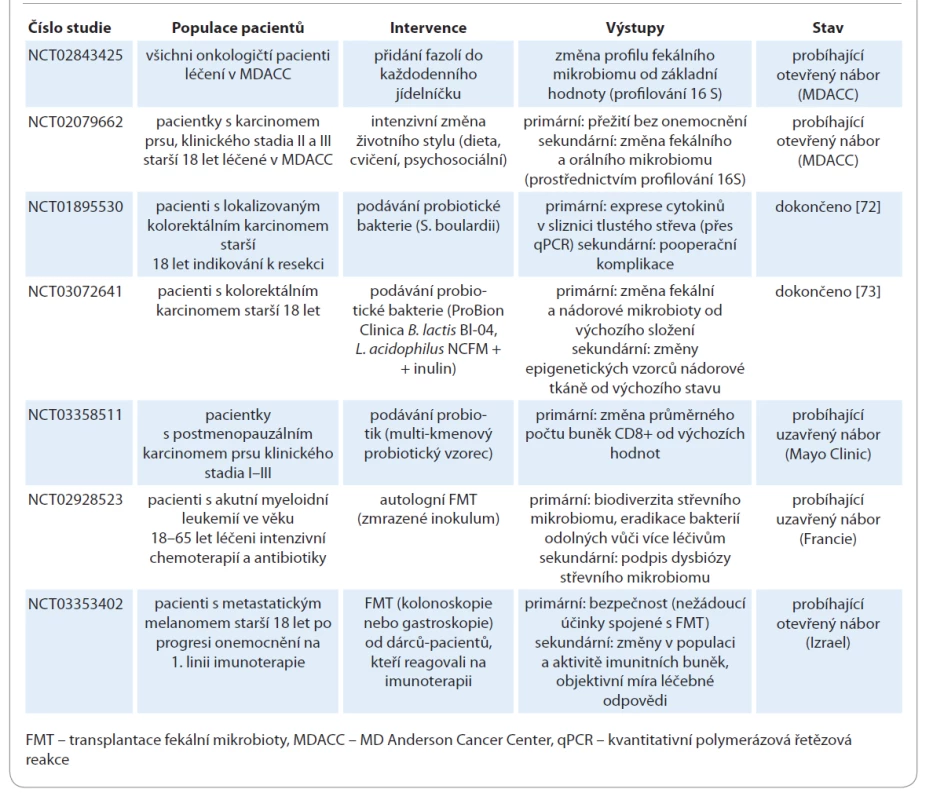
TIGIT inhibitory
TIGIT (T cell immunoreceptor with Ig and ITIM domains) je imunitní receptor exprimovaný na některých T a NK buňkách. Exprese TIGIT receptorů na regulačních T-lymfocytech (Tregs), zvláště na tumor-infiltrujících Tregs, navyšuje jejich imunosupresivní funkci vč. nepřímého efektu působícího inhibici produkce proinflamatorních cytokinů. TIGIT též přímo suprimuje protinádorovou efektorovou funkci CD8+ T-lymfocytů. TIGIT, LAG-3 a TIM-3 patří do stejné skupiny receptorů jako CTLA-4 a PD-1 a vzhledem ke svým unikátním funkcím jsou nonredundantní. TIGIT, LAG-3 a TIM-3 tvoří skupinu ko-inhibičních receptorů. Exprese TIGIT koreluje s PD-1 expresí, zvláště na T-lymfocytech u NSCLC. Inhibice TIGIT protilátkami nové generace v kombinaci s CTLA-4 a PD-1 inhibitory by měla zvýšit výsledný léčebný efekt. Monoklonální protilátky proti ko-inhibičním receptorům jsou předmětem hodnocení časných klinických a preklinických studií s cílem potvrdit zvýšení účinnosti checkpoint inhibitorů používaných v klinické praxi. Jedním ze slibných protilátek je tiragolumab: plně humánní antiTIGIT protilátka zabraňující navázání TIGIT na PVR. Preklinická evidence svědčí o synergistické protinádorové aktivitě při kombinaci protilátek [60]. V klinické studii fáze I s kombinací tiragolumab s atezolizumabem byla potvrzena protinádorová aktivita a přijatelný profil nežádoucích účinků u solidních nádorů [61]. V klinické randomizované studii fáze II CITYSCAPE byl srovnáván atezolizumab v kombinací s tiragolumabem s monoterapií atezolizumabem v 1. linii u 135 nemocných s pokročilým NSCLC PDL1-pozitivních a EGFR - a ALK-negativních pacientů. Při vyhodnocení výsledků byla kombinace tiragolumab plus atezolizumab účinnější než monoterapie (objektivní léčebná odpověď (objective response rate – ORR) 31,3 vs. 16,2 %; přežití bez progrese (progression-free survival – PFS) 5,4 vs. 3,6 měsíce; HR 0,57) při dobré toleranci. O budoucnosti tiragolumabu rozhodnou výsledky probíhajících klinických studií fáze III [62]. Probíhá řada studií kombinujících jiné checkpoint inhibitory – pembrolizumab nebo nivolumab – s inovativními antiTIGIT protilátkami (MK-7684, BMS-986207, COM701) [63].
Konjugované monoklonální protilátky
Další budoucí systémovou modalitou léčby NSCLC po terčové léčbě a imunoterapii jsou konjugované monoklonální protilátky. Vývoj konjugovaných monoklonálních protilátek (monoclonal antibodies – MAb) probíhá již několik desetiletí, ale v protinádorové léčbě zatím nedosáhly odpovídajícího uplatnění. Jen obtížně se daří najít optimální poměr mezi jejich účinností a toxicitou pro jiné než cílové buňky. V posledních letech však dochází k významné klinické akceleraci této modality. Příkladem je uplatnění ado-trastuzumab emtansinu (T-DM1) v léčbě HER-2 dependentních karcinomů prsu. Protilátkový konjugát se skládá ze tří komponent: vlastního MAb, spojovacího článku (linkeru) a cytotoxické molekuly. Konjugované monoklonální protilátky mají transformační potenciál pro terčovou léčbu pokročilého a metastatického karcinomu plic. Časná data pro datopotamab deruxtekan a trastuzumab deruxtekan naznačují slibný trvalý přínos zejména pro pacienty, jejichž další léčebné možnosti jsou omezené. Vývoj těchto inovativních léků je cílen zejména na pacienty po progresi základního onemocnění na léčbě chemoterapií na bázi platiny nebo při progresi po léčbě checkpoint inhibitory. Aktualizované výsledky studie fáze I TROPION-PanTumor01 ukázaly slibnou klinickou aktivitu pro datopotamab deruxtekan, konjugovanou monoklonální protilátku zaměřenou proti TROP2 receptoru u pacientů s pokročilým nebo metastatickým NSCLC [64]. U 159 pacientů s pokročilým nebo metastazujícím NSCLC byly objektivní odpovědi v rozmezí 21–25 %. Pacienti dostávali různé dávky datopotamab deruxtekanu (4, 6 nebo 8 mg/kg). Míra kontroly onemocnění (disease control rate – DCR) po třech dávkách datopotamab deruxtekanu se pohybovala v rozmezí 67–80 % a medián PFS pak v rozmezí mezi 4,3–8,2 měsíce [65]. Prozatímní analýza kohorty pacientů s mutovaným HER2 ve studii DESTINY-Lung01 fáze II potvrdila protinádorovou aktivitu léku trastuzumab deruxtekan, konjugované monoklonální protilátky zaměřené proti HER2, u pacientů s metastatickým NSCLC. V současné době neexistují žádné léky schválené speciálně pro léčbu HER2m NSCLC, která postihuje přibližně 2–4 % pacientů s NSCLC [66,67]. Primárním cílem studie bylo potvrzení ORR. U 61,9 % pacientů s HER2-mutovaným metastatickým nemalobuněčným karcinomem plic léčených monoterapií Enhertu (6,4 mg/kg) bylo dosaženo ORR. Pacienti dosáhli DCR 90,5 % s odhadovaným mediánem PFS 14,0 měsíce. Medián doby odpovědi a celkového přežití nebyl v době uzavření dat dosud dosažen [68]. Závěrem lze problematiku shrnout konstatováním, že se aktuálně vyvíjí řada konjugovaných monoklonálních protilátek proti různým epitopům s různými linkery. Některé vyžadují vyšetření specifických genových mutací nebo vyšetření exprese určitých bílkovin, zatímco jiné jsou v současné době podávány plošně. Nežádoucí účinky těchto léků obvykle zahrnují nauzeu, zvracení, hematotoxicitu, pneumonitidu a neuropatii v závislosti na dávce. Tyto léky kombinují výhody terčové léčby a cytotoxické chemoterapie a v nadcházejícím roce pravděpodobně dojde k jejich schválení v indikaci metastatického NSCLC.
Závěr
Výčet zásadních událostí, které budou v budoucnosti stále více ovlivňovat možnosti onkologické léčby:
1.Plošná implementace nových biotechnologií (NGS) umožní významně zpřesnit předpověď rizika relapsu (prognostické faktory) časných stadií onemocnění a předpovědět účinnost vybrané léčby (prediktivní faktory).
2.Molekulární identifikace rozdílů dříve morfologicky téměř identických nádorů povede k reklasifikaci nádorových onemocnění a expanzivnímu nárůstu nových klinicko-molekulárně patologických jednotek. Každý nádor je molekulárně unikátní, a tak se stane pojem vzácný nádor ve vztahu k léčbě obsoletním a zůstane mu pouze epidemiologický význam.
3.K dispozici budou „stovky“ nových terčových léků, které mohou přímo zasáhnout signální struktury podílející se na onkogenezi. Při volbě léčby se tak otevře prostor pro molekulární informatiku a aplikaci umělé inteligence.
4.Dojde k průlomovému nárůstu tumor-agnostické indikace systémové léčby podle geneticky rozpoznaných molekulárních (omických) aberací nezávisle na lokalizaci primárního nádoru. Pacienti s nádory, které mají stejné genetické změny, dostanou léky cílené na danou změnu nezávisle na typu nádoru.
5.Skončí éra necílené „paliativní“ imunoterapie checkpoint inhibitory ve prospěch precizní cílené kurativní imunoterapie. Cesta povede ke kombinaci imunoprediktorů nejen pro účinnost, ale i pro předpověď rizika nežádoucích účinků.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Práce byla realizována za podpory grantové agentury MZ ČR pod grantovým číslem VES NV19-03-00179.
This work was supported by the Grant Agency of the Ministry of Health of the Czech Republic, grant No. VES NV19-03-00179.
prof. MUDr. Luboš Petruželka, CSC.
Onkologická klinika 1. LF UK a VFN
a ÚVN Praha
U nemocnice 2
128 08 Praha 2
e-mail: lubos.petruzelka@vfn.cz
Přijato/Accepted: 15. 2. 2021
Zdroje
1. Hyman DM, Taylor BS, Baselga J. Implementing genome-driven oncology. Cell 2017; 168 (4): 584–599. doi: 10.1016/j.cell.2016.12.015.
2. Brahmer JR, Rodriguez-Abreu D, Robinson AG et al. KEYNOTE-024 5-year OS update: first-line (1L) pembrolizumab (pembro) vs platinum-based chemotherapy (chemo) in patients (pts) with metastatic NSCLC and PD-L1 tumour proportion score (TPS) ≥ 50%. Annal Oncol 2020; 31 (suppl_4): S1142–S1215.
3. Šesták Z. Znáte všechny -omiky? Vesmír 2001; 80 : 357.
4. Hirsch V. Turning EGFR mutation-positive non-small-cell lung cancer into a chronic disease: optimal sequential therapy with EGFR tyrosine kinase inhibitors. Ther Adv Med Oncol 2018; 10 : 1758834017753338. doi: 10.1177/1758834017753338. eCollection 2018.
5. Onozato R, Kosaka T, Kuwano H et al. Activation of MET by gene amplification or by splice mutations deleting the juxtamembrane domain in primary resected lung cancers. J Thorac Oncol 2009; 4 (1): 5–11. doi: 10.1097/JTO.0b013e3181913e0e.
6. Wolf J, Seto T, Han JY et al. Capmatinib in MET exon 14-mutated or MET-amplified Non-small-cell lung cancer. N Engl J Med 2020; 383 (10): 944–957. doi: 10.1056/NEJMoa2002787.
7. Novartis. Tabrecta (capmatinib) tablets, for oral use. [online]. Available from: https: //www.hcp.novartis.com/products/tabrecta/met-exon-14-skipping-mutation-nsclc/.
8. Wang R, Hu H, Pan Y et al. RET fusions define a unique molecular and clinicopathologic subtype of non-small-cell lung cancer. J Clin Oncol 2012; 30 (35): 4352–4359. doi: 10.1200/JCO.2012.44.1477.
9. Drilon A, Oxnard GR, Tan DS et al. Efficacy of selpercatinib in RET fusion-positive non-small-cell lung cancer. N Engl J Med 2020; 383 (9): 813–824. doi: 10.1056/NEJMoa2005653.
10. Pralsetinib capsules, for oral use. United States prescribing information. [online]. Available from: https: //www.accessdata.fda.gov/drugsatfda_docs/label/2020/213721s000lbl.pdf.
11. Kinno T, Tsuta K, Shiraishi K et al. Clinicopathological features of nonsmall cell lung carcinomas with BRAF mutations. Ann Oncol 2014; 25 (1): 138–142. doi: 10.1093/annonc/mdt495.
12. Mazieres J, Drilon AE, Mhanna L et al. Efficacy of immune-checkpoint inhibitors (ICI) in non-small cell lung cancer (NSCLC) patients harboring activating molecular alterations (ImmunoTarget). J Clin Oncol 2018; 36S: ASCO #9010.
13. Hong DS, Bauer TM, Lee JJ et al. Larotrectinib in adult patients with solid tumours: a multi-centre, open-label, phase I dose-escalation study. Ann Oncol 2019; 30 (20): 325–331. doi: 10.1093/annonc/mdy539.
14. Doebele RC, Drilon A, Paz-Ares L et al. Entrectinib in patients with advanced or metastatic NTRK fusion-positive solid tumours: integrated analysis of three phase 1-2 trials. Lancet Oncol 2020; 21 (2): 271–282. doi: 10.1016/S1470-2045 (19) 30691-6.
15. Pillai RN, Behera M, Berry LD et al. HER2 mutations in lung adenocarcinomas: a report from the Lung Cancer Mutation Consortium. Cancer 2017; 123 (21): 4099–4105. doi: 10.1002/cncr.30869.
16. Li BT, Shen R, Buonocore D et al. Ado-trastuzumab emtansine for patients with HER2-mutant lung cancers: results from a phase II basket trial. J Clin Oncol 2018; 36 (24): 2532–2537. doi: 10.1200/JCO.2018.77. 9777.
17. Smit EF, Nakagawa K, Nagasaka M et al. Trastuzumab deruxtecan (T-DXd; DS-8201) in patients with HER2-mutated metastatic non-small cell lung cancer (NSCLC): interim results of DESTINY-Lung01. J Clin Oncol 2020; 38S: ASCO #9504.
18. Friedlaender A, Drilon A, Weiss GJ et al. KRAS as a druggable target in NSCLC: rising like a phoenix after decades of development failures. Cancer Treat Rev 2020; 85 : 101978. doi: 10.1016/j.ctrv.2020.101978.
19. Nusrat M, Roszik J, Holla V et al. Therapeutic vulnerabilities among KRAS G12C mutant (mut) advanced cancers based on co-alteration (co-alt) patterns. J Clin Oncol 2020; 38 (15): Abstract 3625.
20. Scheffler M, Ihle MA, Hein R et al. K-ras mutation subtypes in NSCLC and associated co-occurring mutations in other oncogenic pathways. J Thorac Oncol 2019; 14 (4): 606–616. doi: 10.1016/j.jtho.2018.12.013.
21. Nagasaka M, Li Y, Sukari Aet al. KRAS G12C Game of Thrones, which direct KRAS inhibitor will claim the iron throne? Cancer Treat Rev 2020; 84 : 101974.) doi: 10.1016/j.ctrv.2020.101974.
22. Roman M, Baraibar I, Lopez Iet al. KRAS oncogene in non-small cell lung cancer: clinical perspectives on the treatment of an old target. Mol Cancer 2018; 17 (1): 33. doi: 10.1186/s12943-018-0789-x.
23. Hallin J, Engstrom LD, Hargis Let al. The KRAS G12C inhibitor MRTX849 provides insight toward therapeutic susceptibility of KRAS-mutant cancers in mouse models and patients. Cancer Discov 2020; 10 (1): 54–71. doi: 10.1158/2159-8290.CD-19-1167.
24. Janne PA, Papadopoulos K, Ou I et al. A phase 1 clinical trial evaluating the pharmacokinetics (PD), safety, and clinical activity of MRTX849, a mutant-selective small molecule KRAS G12C inhibitor, in advanced solid tumors. [online]. Available from: https: //www.mirati.com/wp-content/uploads/AACR-NCI-EORTC-Clinical-Data-Presentation_Janne_October-2019-1-1.pdf.
25. Kim JH, Kim HS, Kim BJ. Prognostic value of KRAS mutation in advanced non-small-cell lung cancer treated with immune checkpoint inhibitors: A meta-analysis and review. Oncotarget 2017; 8 (29): 48248–48252. doi: 10.18632/oncotarget.17594.
26. Herbst RS, Lopes G, Kowalski DM et al. Association of KRAS mutational status with response to pembrolizumab monotherapy given as first-line therapy for PD-L1-positive advanced non-squamous NSCLC in KEYNOTE-042. Ann Oncol 2019; 30 (Suppl 11): Abstract LBA4.
27. Fakih M, O’Neil B, Price TJ et al. Phase 1 study evaluating the safety, tolerability, pharmacokinetics (PK), and efficacy of AMG 510, a novel small molecule KRASG12C inhibitor, in advanced solid tumors. J Clin Oncol 2019; 37 (15): Abstract 3003.
28. Hong DS, Fakih MG, Strickler JH et al. KRASG12C inhibition with sotorasib in advanced solid tumors. N Eng J Med 2020; 383 (13): 1207–1217. doi: 10.1056/NEJMoa1917239.
29. Altmann DM. A Nobel prize-worthy pursuit: cancer immunology and harnessing immunity to tumour neoantigens. Immunology 2018; 155 (3): 283–284. doi: 10.1111/imm.13008.
30. Gadgeel S, Rodriguez-Abreu Det al. KRAS mutational status and efficacy in KEYNOTE-189: pembrolizumab (pembro) plus chemotherapy (chemo) vs placebo plus chemo as first-line therapy for metastatic non-squamous NSCLC. Ann Oncol 2019; 30 (Suppl 11): Abstract L BA5.
31. Andersen MH: Anti-cancer immunotherapy: breakthroughs and future strategies. Semin Immunopathol 2019; 41 (1): 1–3 doi: 10.1007/s00281-018-0711-z.
32. Tang J, Shalabi A, Hubbard-Lucey VM. Comprehensive analysis of the clinical immuno-oncology landscape. Ann Oncol 2018; 29 (1): 84–91. doi: 10.1093/annonc/mdx755.
33. Vadedeplay RK, Kharel P, Pandey R et al. Review of indication of FDA-approved immune checkpoint inhibitors per NCCN guidelines with the level of evidence. Cancers 2020; 12 (3): 738. doi: 10.3390/cancers12030738.
34. Petruželka L. Imunoterapie nemalobuněčnych karcinomů plic. [online]. Dostupné z: https: //www.worldmednet.cz/sk/imunoterapie-nemalobunecnych-karcinomu-plic-jak-dal-po-asco-2018/.
35. Uruga H, Mino-Kenudson M. Predictive biomarkers for response to immune checkpoint inhibitors in lung cancer: PD-L1 and beyond. Virchows Arch 2021; 478 (1): 31–44. doi: 10.1007/s00428-021-03030-8.
36. Lo Russo G, Moro M, Sommariva M et al. Antibody-Fc/FcR interaction on macrophages as a mechanism for hyperprogressive disease in non-small cell lung cancer subsequent to PD-1/PD-L1 blockade. Clin Cancer Res 2019; 25 (3): 989–999. doi: 10.1158/1078-0432.CCR-18-1390.
37. Petruželka L. Jak, kdy a proč hodnotit léčebnou odpověď na léčbu imunoterapií „check point inhibitory“ při léčbě pokročilých nemalobuněčných plicních karcinomů (NSCLC). Onkologie 2019; 12 (6) 278–281.
38. Foster CC. Pitroda SP, Weichselbaum RR. Beyond palliation: the rationale for metastasis-directed therapy for metastatic non–small cell lung cancer. J Thorac Oncol 2019; 14 (9): 1510–1512. doi: 10.1016/j.jtho.2019.05.025.
39. Gentzler RD, Riley DO, Martin LW. Striving toward improved outcomes for surgically resectable non-small cell lung cancer: the promise and challenges of neoadjuvant immunotherapy. Curr Oncol Rep 2020; 22 (11): 109. doi: 10.1007/s11912-020-00969-w.
40. Sijia Ren, Chunguo Wang, Jianfei Shen et al. Neoadjuvant immunotherapy with resectable non-small cell lung cancer: recent advances and future challenges. J Thorac Dis 2020; 12 (4): 1615–1620. doi: 10.21037/jtd.2020.03.44.
41. Taube JM, Akturk G, Angelo M et al. The Society for Immunotherapy of Cancer statement on best practices for multiplex immunohistochemistry (IHC) and immunofluorescence (IF) staining and validation. J Immunother Cancer 2020; 8 (1): e000155. doi: 10.1136/jitc-2019-000155.
42. Rosenbaum M, Khosrowjerdi S, Kamesan V et al. The utility of PD-L1/CD8 dual immunohistochemistry for prediction of response to immunotherapy in non-small cell lung cancer (NSCLC). [online]. Available from: https: //www.jto.org/article/S1556-0864 (18) 31694-0/fulltext.
43. Fumet JD, Richard C, Ledys F et al. Prognostic and predictive role of CD8 and PD-L1 determination in lung tumor tissue of patients under anti-PD-1 therapy. Br J Cancer 2018; 119 (8): 950–960. doi: 10.1038/s41416-018-0220-9.
44. Gettinger SN, Choi J, Mani N et al. A dormant TIL phenotype defines non-small cell lung carcinomas sensitive to immune checkpoint blockers. Nat Commun 2018; 9 (1): 3196. doi: 10.1038/s41467-018-05032-8.
45. Steuer CE, Ramalingam SS. Tumor mutation burden: leading immunotherapy to the era of precision medicine? J Clin Oncol 2018; 36 (7): 631–632. doi: 10.1200/JCO.2017.76.8770.
46. Fancello L, Gandini S, Pelicci PG et al. Tumor mutational burden quantification from targeted gene panels: major advancements and challenges. J Immunother Cancer 2019; 7 (1): 183. doi: 10.1186/s40425-019-0647-4.
47. Merino DM, McShane LM, Fabrizio D et al. Establishing guidelines to harmonize tumor mutational burden (TMB): in silico assessment of variation in TMB quantification across diagnostic platforms: Phase I of the friends of cancer research TMB harmonization project. J Immunother Cancer 2020; 8 (1): e000147. doi: 10.1136/jitc-2019-000147.
48. Herbst RS, Lopes G, Kowalski DM et al. Association between tissue TMB (tTMB) and clinical outcomes with pembrolizumab monotherapy (pembro) in PD-L1-positive advanced NSCLC in the KEYNOTE-010 and -042 trials. [onine]. Available from: https: //www.sciencedirect.com/science/article/pii/S0923753419604370.
49. Ready N, Hellmann MD, Awad MM et al. First-line nivolumab plus ipilimumab in advanced non-small-cell lung cancer (CheckMate 568): outcomes by programmed death ligand 1 and tumor mutational burden as biomarkers. J Clin Oncol 2019; 37 (12): 992–1000. doi: 10.1200/JCO.18.01042.
50. Hellmann MD, Ciuleanu TE, Pluzanski A et al. Nivolumab plus ipilimumab in lung cancer with a high tumor mutational burden. N Engl J Med 2018; 378 (22): 2093–2104. doi: 10.1056/NEJMoa1801946.
51. Langer C, Gadgeel S, Borghaei H et al. OA04.05 KEYNOTE-021: TMB and outcomes for carboplatin and pemetrexed with or without pembrolizumab for nonsquamous NSCLC. [online]. Available from: https: //www.jto.org/article/S1556-0864 (19) 31109-8/abstract.
52. Garassino MC, Gadgeel SM, Rodriguez-Abreu D et al. Evaluation of blood TMB (bTMB) in KEYNOTE-189: pembrolizumab (pembro) plus chemotherapy (chemo) with pemetrexed and platinum versus placebo plus chemo as first-line therapy for metastatic nonsquamous NSCLC. [online]. Available from: https: //ascopubs.org/doi/abs/10.1200/JCO.2020.38.15_suppl.9521.
53. Gibson, RG. Fibre and effects on probiotics (the prebiotic concept). Clinical Nutrition Supplements 2004; 1 (2): 25–31.
54. Guarner F, Malagelada J-R. Gut flora in health and disease. Lancet 2003; 361 (9356): 512–519. doi: 10.1016/S0140-6736 (03) 12489-0.
55. Sender R, Fuchs S, Milo R. Are we really vastly outnumbered? Revisiting the ratio of bacterial to host cells in humans. Cell 2016; 164 (3): 337–340. doi: 10.1016/j.cell.2016.01.013.
56. Borody TJ, Warren EF, Leis SM et al. Bacteriotherapy using fecal flora: toying with human motions. J Clin Gastroenterol 2004; 38 (6): 475–483. doi: 10.1097/01.mcg.0000128988.13808.dc.
57. Zitvogel L, Ma Y, Raoult D et al. The microbiome in cancer immunotherapy: diagnostic tools and therapeutic strategies. Science 2018; 359 (6382): 1366–1370. doi: 10.1126/science.aar6918.
58. Routy B, Le Chatalier E, Derosa L et al. Gut microbiome influences efficacy of PD-1-based immunotherapy against epithelial tumors. Science 2017; 359 (6371): 91–97. doi: 10.1126/science.aan3706.
59. Gopalakrishnan V, Spencer CN, Nezi Let al. Gut microbiome modulates response to anti-PD-1 immunotherapy in melanoma patients. Science 2017; 359 (6371): 97–103. doi: 10.1126/science.aan4236.
60. Manieri NA, Chiang EY, Grogan JL. TIGIT: a key inhibitor of the cancer immunity cycle. Trends Immunol 2017; 38 (1): 20–28. doi: 10.1016/j.it.2016.10.002.
61. Ventola CL. Cancer immunotherapy, part 3: challenges and future trends. PT 2017; 42 (8): 514–521.
62. Rodriguez-Abreu D, Johnson ML, Hussein MA et al. Primary analysis of a randomized, double-blind, phase II study of the anti-TIGIT antibody tiragolumab plus atezolizumab versus placebo plus atezolizumab as 1L treatment in patients with PD-L1-selected NSCLC (CYTISCAPE). [online]. Available from: https: //www.researchgate.net/publication/341630619_Primary_analysis_of_a_randomized_double-blind_phase_II_study_of_the_anti-TIGIT_antibody_tiragolumab_tira_plus_atezolizumab_atezo_versus_placebo_plus_atezo_as_first-line_1L_treatment_in_patients_with_P.
63. Harjunpää H, Guillerey C. TIGIT as emerging immune checkpoint. ClinExp Immunol 2020, 200 (2): 108–119. doi: 10.1111/cei.13407.
64. Li Z, Jiang XZhang W. TROP2 overexpression promotes proliferation and invasion of lung adenocarcinoma cells. Biochem Biophys Res Commun 2016; 470 (1): 197–204. doi: 10.1016/j.bbrc.2016.01.032.
65. US National Library of Medicine. First-in-human study of DS-1062a for advanced solid tumors. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT03401385.
66. Campbell JD, Alexandrov A, Kim J et al. Distinct patterns of somatic genome alterations in lung adenocarcinomas and squamous cell carcinomas. Nat Genet 2016; 48 (6): 607–616. doi: 10.1038/ng.3564.
67. Li BT et al. HER2 amplification and HER2 mutation are distinct molecular targets in lung cancers. J Thorac Oncol 2016; 11 (3): 414–419. doi: 10.1016/j.jtho.2015.10.025.
68. US National Library of Medicine. DS-8201a in human epidermal growth factor receptor 2 (HER2) -expressing or -mutated non-small cell lung cancer (DESTINY-Lung01). [online].
69. Ribas A, Hersey P, Midleton MR et al. New challenges in endpoints for drug development in advanced melanoma. Clin Cancer Res 2012; 18 (2): 336–341. doi: 10.1158/1078-0432.CCR-11-2323.
70. Li T, Kung H-J, Mack PC et al. Genotyping and genomic profiling of non-small cell lung cancer: implications of current and future therapies. J Clin Oncol 2013; 31 (8): 1039–1049. doi: 10.1200/JCO.2012.45.3753.
71. Udagawa H, Matsumoto S, Ohe Y et al. Clinical outcome of non-small cell lung cancer with EGFR/HER2 exon 20 insertions identified in the LC-SCRUM –Japan. J Thorac Oncol 2019; 14 (10): S224.
72. Consoli ML, Steinberg da Silva R, Nicoli JR et al. Impact of oral administration of Saccharomyces boulardii on gene expression of intestinal cytokines in patients undergoing colon resection. [online]. Available from: https: //aspenjournals.onlinelibrary.wiley.com/ doi/ abs/ 10.1177/ 0148607115584387.
73. Hibberd AA, Lyra A, Ouwehad AC et al. Intestinal microbiota is altered in patients with colon cancer and modified by probiotic intervention. [online]. Available from: https: / / bmjopengastro.bmj.com/ content/ bmjgast/ 4/ 1/ e000145.full.pdf.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2021 Číslo Supplementum 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Role multidisciplinárního týmu a molekulárního tumor boardu v léčbě pacienta s karcinomem plic
- Prediktivní testování u nemalobuněčného karcinomu plic
- Chirurgická léčba karcinomu plic
- Editorial
- Nové možnosti léčby časného a lokálně pokročilého nemalobuněčného karcinomu plic
- Cílená terapie nemalobuněčného plicního karcinomu
- Imunoterapie v léčbě nemalobuněčného karcinomu plic
- Karcinom plic – diagnostika a časný záchyt
- Pokroky v léčbě malobuněčného karcinomu plic
- Budoucnost léčby karcinomu plic
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Karcinom plic – diagnostika a časný záchyt
- Chirurgická léčba karcinomu plic
- Pokroky v léčbě malobuněčného karcinomu plic
- Budoucnost léčby karcinomu plic
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



