-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
FDG-PET/ CT v diagnostice a hodnocení léčebné odpovědi Castlemanovy choroby – retrospektivní studie 29 případů z jednoho centra
FDG-PET/ CT for initial staging and response assessment in Castleman disease – retrospective single-center study of 29 cases
Background: Castleman disease (CD) is a rare lymphoproliferative disorder including unicentric and multicentric forms which can further be divided into four histopathologic variants (hyaline vascular, plasma cell, mixed, and plasmablastic). Multicentric CD typically behaves as an aggressive, relapsing entity with generalized lymphadenopathy and systemic symptoms. PET/CT following 18F-fluorodeoxyglucose administration (FDG-PET/CT) represents an imaging modality commonly used in malignant lymphomas for staging purposes and response assessment. However, literature data on its role in CD have been limited. Patients and methods: Twenty-nine patients, 18 men and 11 women, diagnosed in 1998–2016 were enrolled in our retrospective study. All patients underwent FDG-PET/CT during initial staging and/or as part of response assessment. We measured the maximum diameter of a lesion and established an index value corresponding to the ratio of the maximum standardized uptake value for the observed lesion and for the liver. The information about imaging examinations, patients, and disease extensions was put in a registry and statistically analyzed. Results: Unicentric and multicentric CD was diagnosed in 17 and 12 patients, respectively. Median age at the diagnosis was comparable between the two groups (51 and 58 years, respectively; P = 0.352). The majority of patients with multicentric CD (83%) were men. In women, the unicentric form prevailed (82 vs. 18%) while the difference between the two forms was of borderline significance in men (44 vs. 56%; P = 0.064). Most of the patients (88%) with unicentric CD had the hyaline vascular pathology type. On the contrary, the plasma cell type was predominant in multicentric CD (42%). The most commonly included anatomic sites included the retroperitoneum (52%) and the thorax (43%). Inguinal node involvement developed only in patients with multicentric CD. In repeatedly examined patients, FDG-PET/CT demonstrated a progressively decreasing size and metabolic activity of a selected lymph node. Conclusion: FDG-PET/CT represents a suitable modality for initial staging and response monitoring of CD, especially in patients with a multicentric form.
Keywords:
Castleman disease – FDG-PET/CT – SUVmax lesion/SUVmax hepar index
Autoři: R. Koukalová 1; I. Selingerová 2,3; Z. Řehák 1; Z. Adam 4; P. Szturz 5
Působiště autorů: Oddělení nukleární medicíny, MOÚ Brno, Česká republika 1; Oddělení laboratorní medicíny, MOÚ Brno, Česká republika 2; Výzkumné centrum aplikované molekulární onkologie (RECAMO), MOÚ Brno, Česká republika 3; Interní hematologická a onkologická klinika LF MU a FN Brno, Česká republika 4; Department of Oncology, Lausanne University Hospital (CHUV), Lausanne, Switzerland 5
Vyšlo v časopise: Klin Onkol 2021; 34(2): 120-127
Kategorie: Původní práce
doi: https://doi.org/10.48095/ccko2021120Souhrn
Východiska: Castlemanova choroba (Castleman disease – CD) je vzácné lymfoproliferativní onemocnění zahrnující unicentrickou a multicentrickou formu, které se dále dělí do čtyř histomorfologických variant (hyalinně-vaskulární, plazmocelulární, smíšené a plazmablastické). Multicentrická CD je typicky agresivní relabující onemocnění s generalizovanou lymfadenopatií a systémovými příznaky. PET/CT po podání 18F-fluorodeoxyglukózy (FDG-PET/CT) je zobrazovací metoda, která je běžně využívána u maligních lymfomů k určení rozsahu postižení a monitorování léčebné odpovědi. Informace o jejím přínosu u Castlemanovy choroby se však v literatuře vyskytují jen okrajově. Soubor pacientů a metody: Do retrospektivní studie bylo zařazeno 29 pacientů (18 mužů a 11 žen) diagnostikovaných v letech 1998–2016. Všichni byli vyšetřeni na FDG-PET/CT pro zjištění rozsahu onemocnění a/nebo v rámci monitorování léčebné odpovědi. Sledován byl maximální příčný rozměr léze a index vyjadřující poměr maximální standardizované hodnoty vychytávání sledované léze a jater. Informace o vyšetřeních, pacientech a rozsahu jejich onemocnění byly uloženy do registru a poté statisticky vyhodnoceny. Výsledky: Unicentrická forma byla zjištěna u 17 pacientů, 12 pacientů mělo multicentrickou formu onemocnění. Medián věku v době diagnózy byl srovnatelný u unicentrické (51 let) a multicentrické (58 let) formy (p = 0,352). Převážná část pacientů s multicentrickou CD (83 %) byli muži. U žen převažovala unicentrická forma onemocnění (82 vs. 18 %), u mužů byly obě formy téměř stejně zastoupené (44 vs. 56 %; p = 0,064). Většina pacientů (88 %) s unicentrickou CD měla hyalinně-vaskulární histomorfologický typ onemocnění, naproti tomu u pacientů s multicentrickou CD převažoval plazmocelulární typ (42 %). Nejčastěji postiženými oblastmi byly retroperitoneum (52 %) a hrudník (43 %). Postižení tříselných uzlin se objevilo pouze u pacientů s multicentrickou CD. U opakovaně vyšetřovaných pacientů prokázalo FDG-PET/CT během účinné léčby postupné zmenšování velikosti zvolené patologické uzliny a postupný pokles její metabolické aktivity. Závěr: FDG-PET/CT je vhodná metoda pro detekci a monitorování průběhu CD, zejména u pacientů s multicentrickou formou onemocnění.
Klíčová slova:
Castlemanova choroba – FDG-PET/CT – index SUVmax lesion / SUVmax hepar
Úvod
Castlemanova choroba (Castleman disease – CD) je vzácné neklonální lymfoproliferativní onemocnění s dosud ne zcela jasnou etiopatogenezí [1]. Stěžejní roli v patofyziologii Castlemanovy choroby hraje pravděpodobně dysregulace cytokinové sítě. Významnou úlohu má zejména interleukin-6, který stimuluje proliferaci a vyzrávání B-lymfocytů a podporuje novotvorbu cév [2,3]. Toto onemocnění je jednou z možných příčin nenádorové lymfadenopatie. Poprvé bylo popsáno v roce 1954 Castlemanem a Townovou jako hyperplazie lymfatických uzlin v předním mediastinu, která imitovala thymom [4]. V následujících letech se objevily ve světové literatuře další termíny označující toto onemocnění, např.: angiofollicular lymph node hyperplasia, giant lymph node hyperplasia, lymphoid hamartoma, angiomatous lymphoid hamartoma, benign lymphoma či follicular lymphoreticuloma [1,5].
Castlemanova choroba nepředstavuje homogenní nozologickou jednotku. Z hlediska klinického ji můžeme rozdělit na dva základní subtypy. Postižena může být pouze jedna oblast těla, pak se jedná o formu unicentrickou (uCD), nebo je postiženo oblastí více u formy multicentrické (mCD). Z hlediska histomorfologického existuje varianta hyalinně-vaskulární, méně častá je pak varianta plazmocelulární a plazmablastická. Tyto histologické typy se mohou navzájem různě kombinovat a vytvářet tak pleomorfní obraz onemocnění. Také klinický obraz onemocnění může být pestrý. U uCD vídáme nebolestivé, pomalé zvětšování postižené uzliny. Tato forma je vyléčitelná pouhou exstirpací postižených uzlin. Výraznější obtíže u této formy onemocnění mohou být podmíněny útlakem okolních struktur. U mCD, kde histomorfologicky se často jedná o plazmocelulární, plazmablastický či smíšený typ, mohou být kromě lymfadenopatie také celkové příznaky. Tento typ onemocnění vyžaduje již systémovou léčbu a na základě nejnovějších poznatků jej lze dále dělit do tří skupin, na mCD idiopatickou, mCD asociovanou s lidským herpetickým virem 8 a na mCD asociovanou s tzv. POEMS syndromem (polyneuropatie, organomegalie, endokrinopatie, monoklonální gamapatie a kožní změny). V rámci idiopatické mCD lze dále rozlišit pacienty s tzv. TAFRO syndromem označujícím trombocytopenii, ascites, retikulinovou fibrózu, renální nedostatečnost a organomegalii [6].
CD je proto důležitou součástí diferenciální diagnostiky anemie, horeček nejasného původu a dalších, tzv. B symptomů (hubnutí, nočního pocení a patologické únavy). Do obrazu této choroby může patřit i vaskulitida, poškození funkce ledvin či změny skeletu. Při diagnostice je nutné vyloučit maligní lymfomy, vzácné plazmocytomy, reaktivní lymfadenopatii spojenou s infekcí, sarkoidózu či např. autoimunitní onemocnění [7,8].
Vzhledem k pestré klinické prezentaci je toto onemocnění často špatně diagnostikované či poddiagnostikované. Nejsou tedy známy přesné údaje o jeho výskytu v populaci. Odhadovaný počet případů v USA sahá od 30 000 ke 100 000 postižených s vypočtenou roční incidencí 2,1 na 100 000 osob [5,9,10].
Cíl práce
Primárním cílem je představit výsledky retrospektivní studie z našeho centra hodnotící diagnostiku a sledování pacientů pomocí FDG-PET/CT vyšetření u 29 případů s CD. Sekundárním cílem je zvýšit všeobecné povědomí o této chorobě a také srovnat již publikovaná data s výsledky statistického hodnocení našeho souboru.
Metodika
Soubor pacientů
V letech 1998–2016 bylo na Interní hematologické a onkologické klinice FN Brno evidováno 29 pacientů s diagnózou CD. U 17 pacientů byla prokázána unicentrická forma onemocnění, 12 pacientů trpělo multicentrickou variantou nemoci. Všichni pacienti byli v rámci vstupního hodnocení rozsahu onemocnění a/nebo jeho sledování vyšetřeni na PET/CT po podání 18F-fluorodeoxyglukózy (FDG-PET/CT). Data získaná z anamnézy pacientů a ze vstupních vyšetření byla v časovém rozmezí od prosince 2014 do března 2016 doplněna do Registru vzácných diagnóz. Registr vznikl ve spolupráci s Institutem biostatistiky a analýz Masarykovy univerzity a byl podpořen interním grantem FN Brno. Tato elektronická platforma byla vytvořena pro zadávání, zálohování a vyhodnocení dat pacientů Interní hematologické a onkologické kliniky FN Brno, u nichž byla diagnostikována onemocnění ze skupiny histiocytárních onemocnění, systémové mastocytózy, monoklonálních gamapatií s kožními projevy, vaskulopatií či CD. Následující text se zabývá výsledky, které vyplynuly ze zpracování dat pacientů s CD. Do registru byla uložena v anonymizované podobě základní data o pacientech (datum narození, pohlaví, iniciály, věk při zjištění diagnózy, datum zařazení do registru, zařazující lékař) a údaje o diagnostice (rozlišení na uni/multicentrickou chorobu, histomorfologický typ onemocnění).
Do části registru věnované zobrazovacím modalitám jsme doplnili informace o typu a pořadí vyšetření, jeho datu a indikaci (vstupní vyšetření při diagnóze, interim při léčbě, sledování po léčbě a restaging, pokud léčba nebyla).
Vyšetřovací metody
U všech pacientů bylo provedeno FDG-PET/CT. Hlavním důvodem, proč byli pacienti vyšetřeni na PET/CT, byla potřeba odlišit uCD a mCD. Všechna PET/CT vyšetření byla provedena na dvou hybridních kamerách – PET/CT TruePoint Biograph64 a PET/CT mCT Flow Biograph64 (obě Siemens, Německo). Pacientům byla aplikována dávka FDG 283–477 MBq (množství aplikované FDG bylo závislé nejen na aktuální hmotnosti pacienta, ale také na typu kamery). Standardní rozsah vyšetření byl od baze lební po horní třetinu stehen.
Do registru byly doplněny údaje o aplikované aktivitě (množství FDG v MBq) a aktuální glykémie před vyšetřením. Největší prostor byl věnován údajům o lokalizaci postižení. Kromě zařazení do základních oblastí postižení (centrální nervový systém, krk, hrudník, břicho, retroperitoneum, páteř, pánev, horní končetiny, dolní končetiny) byla lokalizace popsána podrobněji (např. v případě postižení hrudníku byla možná volba mezi postižením hrudního koše, mediastina mimo srdce a srdce). Byla definována postižená struktura (nejčastěji šlo o lymfatickou uzlinu) a bylo určeno stranové rozložení postižení (vpravo, vlevo, bilaterálně a v úrovni středové čáry). Pokud to bylo možné, byl také stanoven počet patologických ložisek. U deseti pacientů, kteří byli vyšetřeni opakovaně a měli dobře měřitelné patologické léze, byl u těchto ložisek sledován vývoj velikosti a změny metabolické aktivity v čase vyjádřené jako maximální standardizovaná hodnota vychytávání (maximum standardized uptake value – SUVmax). Tři pacienti s největším počtem vyšetření byli pak vyhodnoceni zvlášť a údaje o změně velikosti a metabolické aktivitě v patologických lézích byly zobrazeny pomocí grafů.
Statistické zpracování
Pro vyhodnocení údajů zadaných v registru byla využita standardní popisná statistika, přičemž spojité proměnné jsou popsány mediánem a rozsahem (minimum – maximum) a diskrétní proměnné pomocí absolutních a relativních počtů. Statistická významnost vztahu mezi jednotlivými skupinami pacientů byla testována pomocí Mann-Whitneyho testu pro spojité proměnné a Fisherova exaktního testu pro diskrétní proměnné. Oba testy byly uvažovány na 5% hladině významnosti. Při výpočtech byl využit software R, verze 4.0.2.
Výsledky
Diagnóza onemocnění byla u všech 29 pacientů stanovena na základě histopatologického vyšetření resekované tkáně v kombinaci s klinickým průběhem, laboratorními hodnotami a nálezy při vyšetření zobrazovacími metodami. Část pacientů byla vyšetřována pro nespecifické celkové příznaky. U několika pacientů byla diagnóza stanovena náhodně (např. při nálezu zvětšené uzliny v axile při mamografii nebo při zvýšené sedimentaci před operací varixů).
Z 29 sledovaných pacientů bylo 8 pacientů vyšetřeno dvakrát, 14 pacientů bylo vyšetřeno vícekrát. Nejvyšší počet byl 14 vyšetření u pacienta (do doby ukončení sběru dat do registru), jednalo se o pacienta s plazmocelulární variantou CD, který byl sledován a léčen od 7/2008 a je sledován dosud (obr. 1 – pacient č. 2, obr. 2a,b). Nejvíc vyšetření podstoupili pacienti s multicentrickou formou CD – v průměru 5,3 vyšetření na pacienta. Pacienti s unicentrickou formou byli průměrně vyšetřeni dvakrát. Nejkratší interval mezi kontrolami byl 1 měsíc (2 pacienti) a 2 měsíce (3 pacienti). Nejdelší interval mezi kontrolami byl 43 měsíců. Průměrný interval byl 8,7 měsíce.
Charakteristiky pacientů s CD z registru s ohledem na formu onemocnění jsou shrnuty v tab. 1. Medián věku je pro mCD 58 let a pro uCD 51 let; tento rozdíl není statisticky významný (p = 0,352). Převážná část pacientů (83 %) s mCD byli muži, 17 % ženy. U žen převažovala unicentrická forma onemocnění (82 vs. 18 %), u mužů byly obě formy téměř stejně zastoupené (44 vs. 56 %). Tento rozdíl je na hranici statistické významnosti (p = 0,064). Většina pacientů (88 %) s uCD měla hyalinně-vaskulární typ onemocnění, naproti tomu u pacientů s mCD převažoval plazmocelulární typ CD (42 %). Nejčastěji postiženými oblastmi (tab. 2) byly retroperitoneum (52 % pacientů) a hrudník (43 % pacientů). Postižení třísel se objevilo pouze u pacientů s mCD, tedy v kombinaci s dalšími oblastmi.
Tab. 1. Charakteristiky pacientů a typ onemocnění. 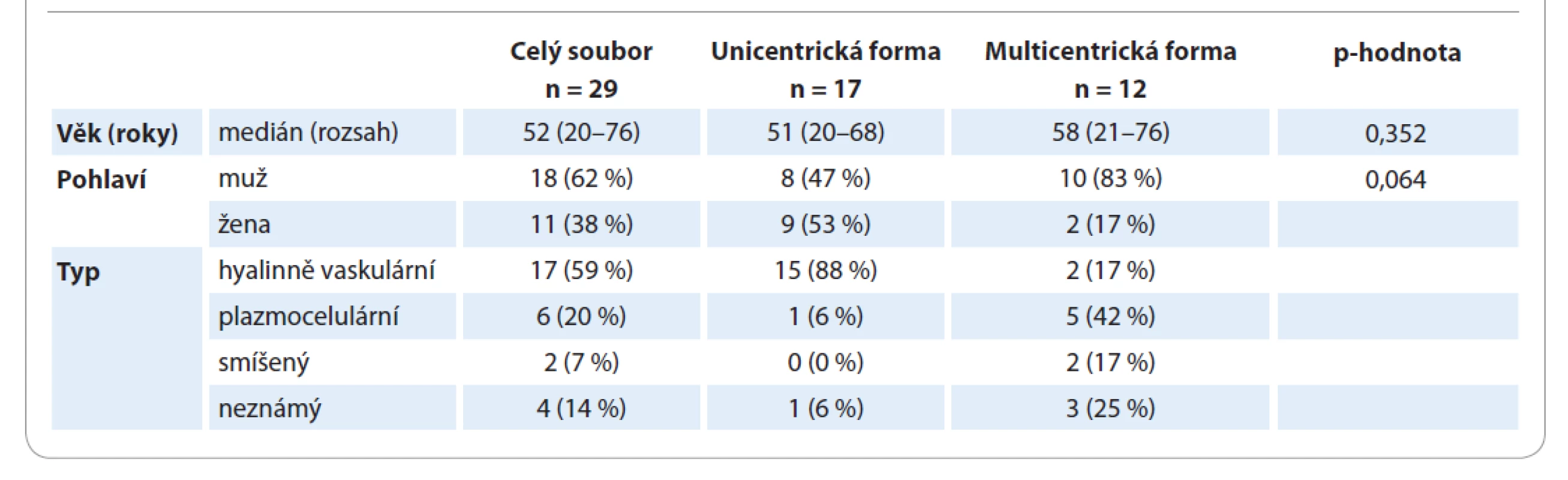
Tab. 2. Postižené oblasti u pacientů. 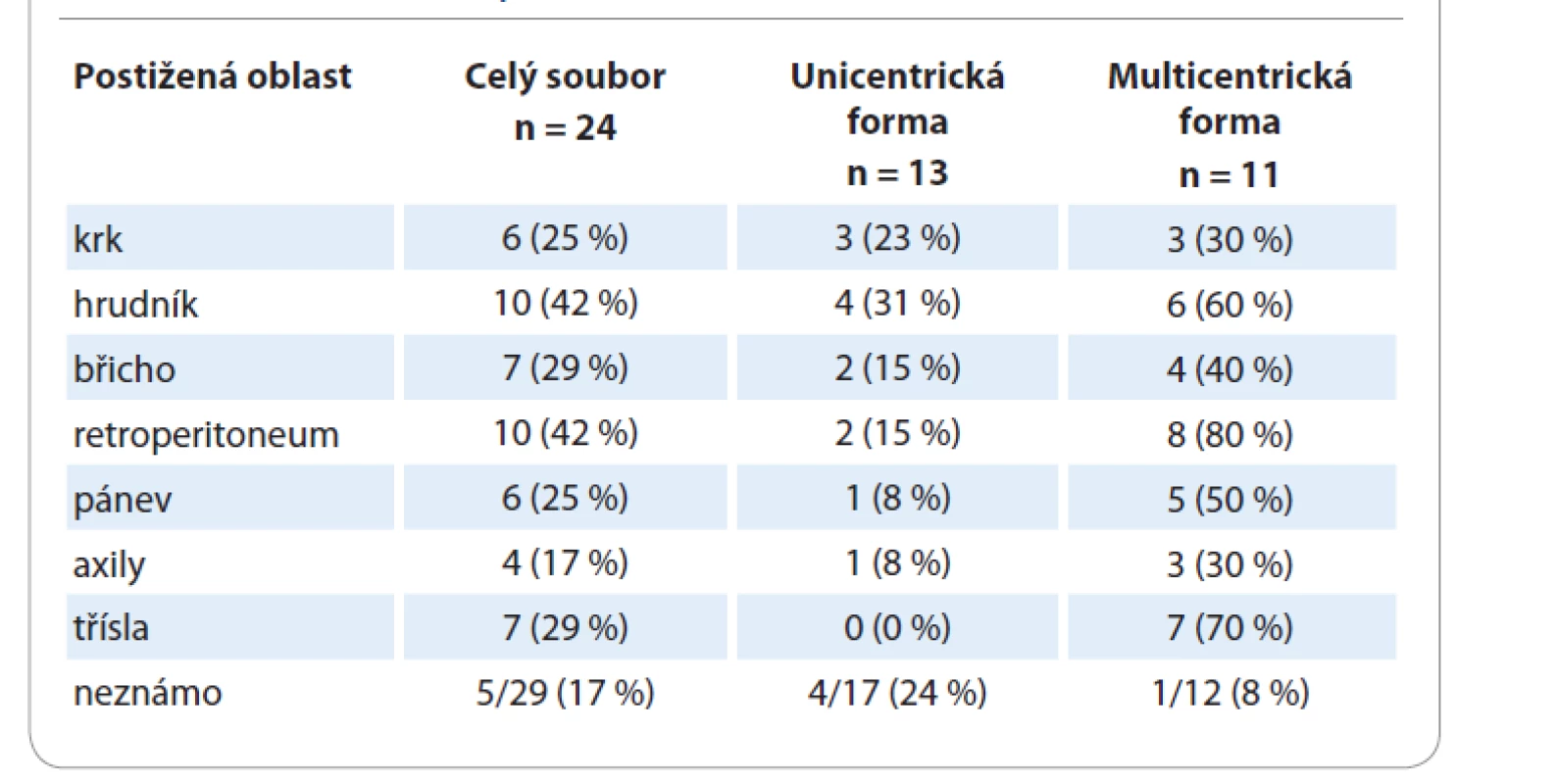
U pacientů s uCD nebyl významnější rozdíl v postižení pravé či levé strany a středové čáry. U 8 pacientů bylo postižení nad bránicí, u 5 pod bránicí. U pacientů s mCD byla postižena nejvíce středová čára (10 pacientů), časté bylo také bilaterální postižení (6 pacientů). Nejvíce bylo pacientů s postižením pod bránicí (11 pacientů), nad bránicí mělo postižení 7 pacientů, stejný počet pacientů měl postižení zároveň nad i pod bránicí. Převažovaly případy s postižením 2–4 oblastí ve srovnání s 5 a 6 oblastmi (tab. 3).
Tab. 3. Počet postižených oblastí. 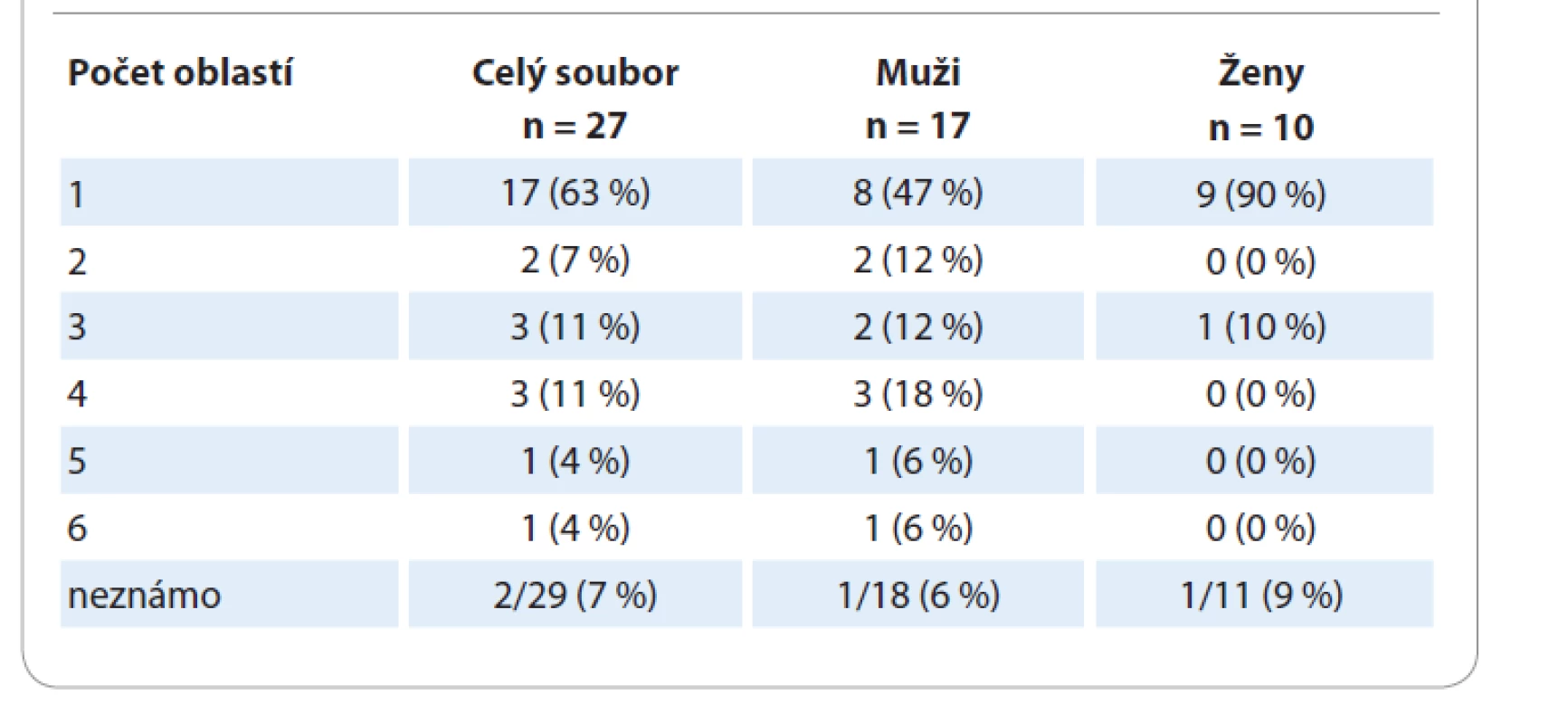
Kromě výše uvedených parametrů byli vybráni pacienti s největším počtem PET/CT vyšetření a byl u nich sledován vývoj velikosti a metabolické aktivity zvolené dobře hodnotitelné léze (patologické uzliny) v čase. Výsledky pacientů s alespoň 5 PET/CT vyšetřeními jsou zobrazeny na obr. 1. Největší počet vyšetření (14) měl pacient č. 2. Sledován byl maximální příčný rozměr léze (size) a index vyjadřující metabolickou aktivitu patologické uzliny. Index je číselná hodnota vyjadřující poměr SUVmax sledované léze (SUVmax lesion) a SUVmax jater (SUVmax hepar). Z uvedených grafů vyplývá, že v průběhu času došlo u všech sledovaných pacientů ke zmenšení ložiska a k poklesu jeho metabolické aktivity. Metabolická aktivita u všech pacientů roste s velikostí léze, tento trend je lineární a velmi podobný u všech uvažovaných pacientů (obr. 1c). Role indexu byla však pouze pomocná. Za pozitivní výsledek PET/CT vyšetření byl u některých pacientů považován i výskyt patologicky zvětšených uzlin, které neměly index > 1. Příkladem je pacient s plazmocelulární variantou CD, u něhož byla kromě zvětšených uzlin v mediastinu a retroperitoneu také prokázána splenomegalie. Sledovaná patologická uzlina v retroperitoneu měla 36 mm v maximální příčné ose, hodnota jejího indexu však již při vstupním vyšetření při stanovení diagnózy byla pouze 0,63. Naše zjištění nejsou v souladu např. s prací, v níž Lee et al na souboru 12 pacientů popisují zvýšení metabolické aktivity všech postižených uzlin, vč. těch, které měly velikost < 1 cm [15]. U pacientů, u kterých byla na začátku terapie vybrána patologicky zvětšená uzlina se zvýšenou metabolickou aktivitou (měla hodnotu indexu > 1), byl za regresi onemocnění považován pokles hodnoty indexu na < 1. Nejvyšší hodnota indexu v celém souboru byla 2,52; jednalo se o hodnotu pacienta s plazmocelulární variantou CD. Na PET/CT byl vyšetřen celkem 7×, nejnižší hodnota indexu po prodělané léčbě byla 1,26. Nemoc se bohužel nepodařilo dostat pod kontrolu a pacient zemřel. Nejnižší hodnota indexu v souboru byla 0,30; jednalo se o hodnotu indexu u pacienta s plazmocelulární variantou po skončené léčbě, který byl vyšetřen na PET/CT celkem 14× (obr. 1 – pacient č. 2, obr. 2a,b). Nejvyšší hodnota indexu u něj byla 1,56, a to při vstupním vyšetření při zjištěné diagnóze. Z výše uvedených informací vyplývá, že hodnocení léčebné odpovědi bylo u každého pacienta individuální.
Obr. 1. Vývoj indexu (A) a velikosti léze (B) s ohledem na pořadí PET/CT vyšetření. Závislost indexu na rozměru léze s regresní přímkou pro každého pacienta (C). 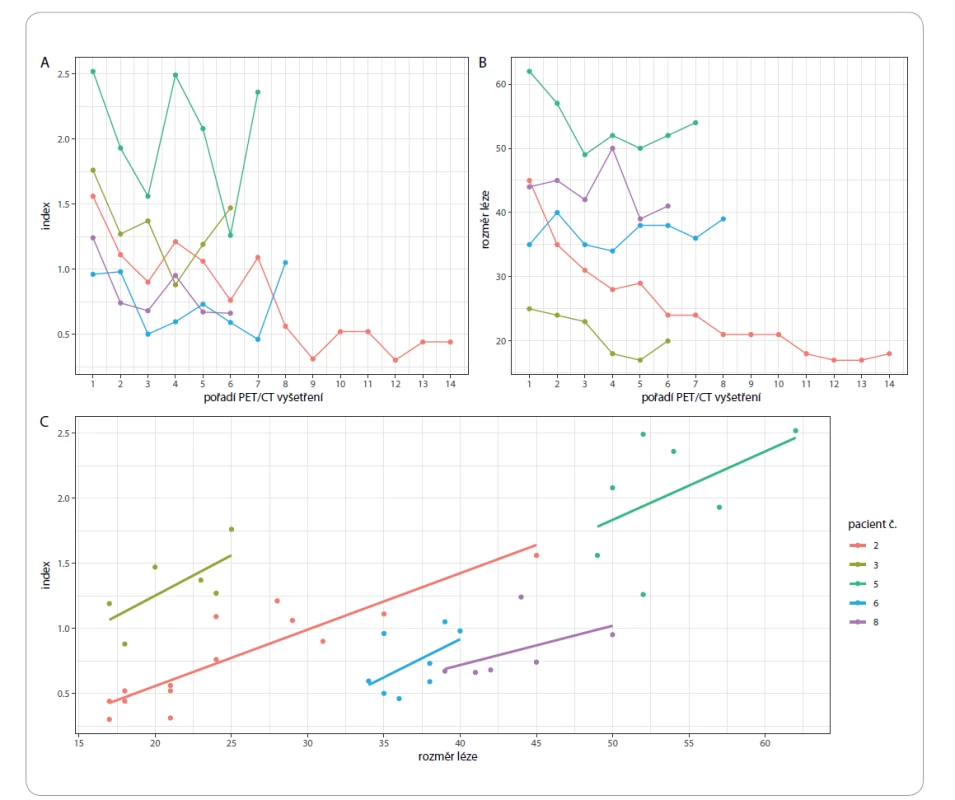
Obr. 2a. Výrazně postkontrastně se sytící patologická uzlina laterálně od společné ilické tepny – HU 126,6; HU společné ilické tepny vlevo je 161,5 (A). 
HU – Hounsfi eldova jednotka Obr. 2b. Metabolická aktivita léze (SUVmax lesion) je 3,50 a metabolic - ká aktivita jater (SUVmax hepar) je 3,79. Index SUVmax lesion / SUVmax hepar je 0,92 (B). 
SUV – standardizovaná hodnota vychytávání Diskuze
Ve srovnání s údaji publikovanými v minulosti v odborných periodikách se data o věku a pohlaví pacientů, procentuálním zastoupení jednotlivých histopatologických typů CD či distribuci postižení od našich výsledků mnohdy liší. Hlavním důvodem je jistě relativně malý soubor pacientů (29 pacientů) a ne zcela kompletní data o lokalizaci onemocnění u pacientů, kteří se dostavili k FDG-PET/CT vyšetření až během sledování vývoje onemocnění po proběhlé terapii, což se týká zejména pacientů s uCD. Z recentních studií o Castlemanově chorobě největší soubor dat analyzuje práce německých autorů publikovaná v Blood Reviews v roce 2018 [11], kteří zpracovali data z 1 133 článků o CD. Autory zajímal věk pacientů, pohlaví, typ onemocnění, lokalizace, histologický typ onemocnění a radiologické nálezy. Další část práce byla zaměřena na analýzu laboratorních výsledků, virologický status, přidružené nemoci a samozřejmě na terapii onemocnění. Unicentrická forma CD byla diagnostikována u 719 pacientů (42 % mužů), multicentrická forma byla prokázána u 416 pacientů (63 % mužů). Naše výsledky jsou ve shodě s výsledky rozsáhlé retrospektivní analýzy, např. v tom, že převažují pacienti s uCD. Dále pak ve skupině s uCD převažují ženy, naopak formu mCD mají zejména muži. Pacienti s uCD jsou mladší než pacienti s mCD. V případě uCD výrazně převažuje hyalinně-vaskulární typ (následuje pak plazmocelulární a smíšený typ), u mCD převažuje plazmocelulární typ (dále pak hyalinně-vaskulární a smíšený). Ve shodě s velkým souborem je také častější postižení axil a pánve u mCD ve srovnání s uCD. V dalších údajích o lokalizaci postižení u uCD a mCD se lišíme. Např. v našem souboru bylo významně častěji postiženo retroperitoneum u pacientů s mCD, u velkého souboru pacientů s mCD dominovalo postižení axil. Kalcifikace v postižených uzlinách byly patrné u 3 pacientů s uCD a u 2 pacientů s mCD, ve velkém souboru byl jednoznačně vyšší počet uzlin s kalcifikacemi u uCD. Rozdíly v této oblasti analýzy jsou patrně způsobené výrazně menším počtem pacientů v našem souboru a absencí přesnějších informací o lokalizaci a vzhledu patologických lézí, zejména ve skupině pacientů s uCD v našem souboru.
Co se týká našich zkušeností se vzhledem postižených uzlin a s dalšími formami projevu onemocnění v zobrazovacích metodách, tyto jsou většinou v souladu s uváděnými daty. Typická uzlina se po intravenózní aplikaci kontrastní látky nápadně sytí (na FDG-PET/CT jsou pacienti vyšetřeni v portální fázi sycení kontrastní látkou) a může obsahovat kalcifikace [12]. V našem souboru se zdá, že postkontrastní sycení není vázáno na histomorfologický typ; nápadnější postkontrastní sycení je patrné jak u plazmocelulární varianty (obr. 2), tak u hyalinně-vaskulární varianty (obr. 3a,b). Někteří autoři [2] uvádějí výraznější postkontrastní sycení jako typický znak hyalinně-vaskulárního typu. Sycení kontrastní látkou bývá většinou homogenní, může být však i nehomogenní – nehomogenní sycení léze bývá většinou u lézí větších (obr. 4a,b) [13,14].
Obr. 3a. Hladce konturovaná, postkontrastně homogenně se sytící expanze v pravé axile, centrálně obsahuje kalcifi kace. V portální fázi dosahuje denzity 112,68 HU, aortální oblouk má denzitu 135,4 HU. 
HU – Hounsfieldova jednotka Obr. 3b. Metabolická aktivita léze (SUVmax lesion) je 4,70 a metabolická aktivita jater (SUVmax hepar) je 2,81. Index SUVmax lesion / SUVmax hepar je 1,67. 
SUV – standardizovaná hodnota vychytávání Obr. 4a. Ventrálně od pravé ledviny je patrná objemná, hladce konturovaná, nehomogenní ovoidní léze s kalcifi kacemi (hyalinně vaskulární forma Castlemanovy choroby). 
Obr. 4b. Metabolická aktivita léze (SUVmax lesion) je 4,83 a metabolická aktivita jater (SUVmax hepar) je 3,21. Index SUVmax lesion / SUVmax hepar je 1,50. 
SUV – standardizovaná hodnota vychytávání Z našeho souboru také vyplývá, že patologický vzhled uzliny v CT obrazu (její zvětšení, nápadné postkontrastní sycení) vždy nekoresponduje s metabolickou aktivitou v PET obrazu, některé patologicky zvětšené uzliny vykazují normální či jen mírně zvýšenou metabolickou aktivitu. Naopak některé nezvětšené uzliny vykazují zvýšené vychytávání FDG [15,16]. Dalšími projevy multicentrické formy onemocnění může být hepatosplenomegalie [17]. Výrazná hepatosplenomegalie byla prokázána u čtyř pacientů s multicentrickou formou onemocnění v našem souboru. U jedné pacientky a jednoho pacienta s multicentrickou formou onemocnění byla patrná početnější osteoplastická ložiska ve skeletu, která patrně patřila k projevům CD – jejich vzhled připomínal osteoplastická metastatická ložiska některých solidních nádorů (u pacientů nebyla prokázána jiná malignita). Osteolytické léze, které mohou být také projevem multicentrické formy onemocnění [2], jsme neprokázali. K dalším nespecifickým radiologickým projevům multicentrické formy onemocnění můžou patřit výpotky pleurální či perikardiální, ascites, různé formy postižení plic – např. difuzní centrilobulární opacity plicní jako projev intersticiální pneumonitidy, ground glass opacity a bronchiektázie [2,12,14].
Vzhledem k pestrosti projevů CD a různorodému vývoji onemocnění jsme nedokázali určit univerzální, jednoznačně platná kritéria hodnocení léčebné odpovědi. U pacientů, u nichž nevykazovaly patologické uzliny ani při vstupním vyšetření patologickou FDG aviditu, bylo měřítkem léčebné odpovědi zejména zmenšení velikosti sledovaných uzlin. V některých případech se neměnila velikost patologických uzlin, ale měnila se hodnota indexu – jeho pokles pak byl kritériem parciální remise. Někteří autoři hodnotící výsledky PET/CT vyšetření u pacientů s CD pracují s prostou hodnotou SUVmax patologického ložiska [15,17]. Z našeho pohledu má přesnější výpovědní hodnotu „index“, který zohledňuje aktuální nastavení metabolizmu daného organizmu. Stejný postup srovnávání metabolické aktivity patologických uzlin zvolili také Han et al; ve své práci používají „T/L ratio“ (tumor-to-liver ratio), aby eliminovali odchylky měření SUVmax způsobené použitím několika různých PET/CT skenerů při vyšetřování 44 pacientů. Jedním ze závěrů zmíněné práce, která se zabývala srovnáním PET/CT nálezů v závislosti na histologickém subtypu CD a laboratorních hodnotách, bylo, že FDG avidita ložisek nezávisí na histologickém subtypu CD a nekoreluje s laboratorními nálezy [18]. To, že metabolická aktivita patologických lézí není závislá na histologickém subtypu CD, vyplývá i z analýzy dat našeho souboru.
Závěr
Castlemanova choroba je vzácná idiopatická ne-neoplastická lymfoproliferativní choroba, která je často poddiagnostikována, a to nejen kvůli své nízké prevalenci a širokému spektru klinických manifestací, ale často také pro nejednoznačný histopatologický nález. Je třeba na ni vzpomenout při diferenciální diagnostice lymfadenopatie, mikrocytární anemie, ale také u onemocnění se systémovými příznaky, jako je horečka, hubnutí a noční pocení. U pacientů s multicentrickou formou onemocnění jsou také časté imunodeficity, sekundární amyloidóza, neuropatie, kožní léze a neoplastické projevy (např. Kaposiho sarkom, non-hodgkinské lymfomy a další). Vzhledem ke znalosti typických rysů postižených lymfatických uzlin a dalších možných projevů onemocnění mohou zobrazovací metody (v našem případě FDG-PET/CT) v radiologickém obrazu hrát významnou roli v primární diagnostice CD. FDG - PET/CT je schopna rozlišit unicentrickou a multicentrickou variantu onemocnění a díky tomu umožní správnou volbu léčebné strategie [19]. V neposlední řadě je FDG-PET/CT důležitá při sledování léčebné odpovědi [20,21].
Podpořeno MZ ČR – RVO (MOÚ, 00209805).
Supported by the Ministry of Health of the Czech Republic, Development of Research Organization (MOÚ, 00209805).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential confl icts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
MUDr. Renata Koukalová
Oddělení nukleární medicíny
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: rkoukalova@mou.cz
Obdrženo/Submitted: 15. 11. 2020
Přijato/Accepted: 18. 1. 2021
Zdroje
1. Vassos N, Raptis D, Lell M et al. Intra-abdominal localized hyaline-vascular Castleman disease: imaging characteristics and management of a rare condition. Arch Med Sci 2016; 12 (1): 227–232. doi: 10.5114/aoms.2016.57600.
2. Bonekamp D, Horton KM, Hruban RH et al. Castleman disease: the great mimic. Radiographics 2011; 31 (6): 1793–1807. doi: 10.1148/rg.316115502
3. Yabuhara A, Yanagisawa M, Murata T et al. Giant lymph node hyperplasia (Castleman’s disease) with spontaneous production of high levels of B-Cell differentiation factor activity. Cancer 1989; 63 (2): 260–265. doi: 10.1002/1097-0142 (19890115) 63 : 2<260:: aid-cncr2820630210>3.0.co; 2-y.
4. Castleman B, Iverson L, Menendez VP. Localizedmediastinal lymphnode hyperplasia resembling thymoma. Cancer 1956; 9 (4): 822–830. doi: 10.1002/10970142 (195607/08) 9 : 4<822:: aid-cncr2820090430>3.0.co; 2-4.
5. Ye B, Gao SG, Yang LH et al. A retrospective study of unicentric and multicentric Castleman’s disease: a report of 52 patients. Med Oncol 2010; 27 (4): 1171–1178. doi: 10.1007/s12032-009-9355-0.
6. Dispenzieri A, Fajgenbaum DC. Overview of Castleman disease. Blood 2020; 135 (16): 1353–1664. doi: 10.1182/blood.2019000931
7. Szturz P, Adam Z, Řehák Z et al. Castlemanova choroba: retrospektivní studie léčebných výsledků u 10 pacientů z jednoho centra. Klin Onkol 2013; 26 (2): 124–134.
8. Adam Z, Szturz P, Krejčí M et al. Léčba 14 případů Castlemanovy nemoci: zkušenosti jednoho centra a přehled literatury. Vnitř Lék 2018; 62 (4): 287–298.
9. Moore DF, Preti A, Tran SM et al. Prognostic implications following an indeterminate nondiagnostic workup of lymphoma. Blood 1996; 88 (10): 906.
10. Mehra M, Cossrow N, Stellhorn RA et al. Use of Claims Database to Characterize and Estimate the incidence of Castleman’s Disease. Blood 2012; 120 (21): 4253. doi: 10.1182/blood.V120.21.4253.4253.
11. Haap M, Wiefels J, Horger M et al. Clinical, laboratory and imaging findings in Castleman’s disease – the subtype decides. Blood Rev 2018; 32 (3): 225–234. doi: 10.1016/j.blre.2017.11.005.
12. Zhao S, Wan Y, Huang Z et al. Imaging and clinical features of Castleman disease. Cancer Imaging 2019; 19 (1): 53. doi: 10.1186/s40644-019-0238-0.
13. Meador TL, McLarney JK. CT features of Castleman disease of the abdomen and pelvis. AJR Am J Roentgenol 2000; 175 (1): 115–1188. doi: 10.2214/ajr.175.1.1750115.
14. Ko SF, Hsieh MJ, Ng SH, Lin JW et al. Imaging spectrum of Castleman’s disease. AJR Am J Roentgenol 2004; 182 (3): 769–775. doi: 10.2214/ajr.182.3.1820769
15. Lee ES, Paeng JC, Park CM et al. Metabolic characteristics of Castleman disease on 18F-FDG PET in relation to clinical implication. Clin Nucl Med 2013; 38 (5): 339–342. doi: 10.1097/RLU.0b013e3182816730
16. Madan R, Chen JH, Trotman-Dickenson B et al. The spectrum of Castleman’s disease: Mimics, radiologic pathologic correlation and role of imaging in patient management. Eur J Radiol 2012; 81 (1): 123–131. doi: 10.1016/j.ejrad.2010.06.018
17. Barker R, Kazmi F, Stebbing J et al. FDG-PET/CT imaging in the management of HIV-associated multicentric Castleman’s disease. Eur J Nucl Med Mol Imaging 2009; 36 (4): 648–652. doi: 10.1007/s00259-008-0998-4
18. Han EJ, Jung SE, Park G et al. FDG PET/CT findings of Castleman disease assessed by histologic subtypes and compared with laboratory findings. Diagnostics 2020; 10 (12): 998. doi: 10.3390/diagnostics10120998
19. Halac M, Ergul N, Sager S et al. PET/CT findings in a multicentric form of Castleman’s disease. Hell J Nucl Med 2007; 10 (3): 172–174.
20. Bertagna F, Biasiotto G, Rodella R et al.18F-fluorodeoxyglucose positron emission tomography/computed tomography findings in a patient with human immunodeficiency virus-associated Castleman’s disease and Kaposi sarcoma, disorders associated with human herpes virus 8 infection. Jpn J Radiol 2010; 28 (3): 231–234. doi: 10.1007/s11604-009-0404-6.
21. Enomoto K, Nakamichi I, Hamada K et al. Unicentric and multicentric Castleman’s disease. Br J Radiol 2007; 80 (949): e24–e26. doi: 10.1259/bjr/93847196.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2021 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Radikální reiradiace rekurentních nádorů hlavy a krku s využitím zevní radioterapie
- Význam 18F-FDG-PET vyšetření v léčbě adenokarcinomu jícnu a gastroezofageální junkce – přehled
- FDG-PET/ CT v diagnostice a hodnocení léčebné odpovědi Castlemanovy choroby – retrospektivní studie 29 případů z jednoho centra
- Posuzování zdravotního stavu pro účely dávek a služeb sociálního zabezpečení u osob s karcinomem plic a ekonomický dopad tohoto onemocnění na sociální zabezpečení v České republice
- Cielená liečba Xp11 translokačného renálneho karcinómu
- Zriedkavý histopatologický nález po pľúcnej resekcii u dieťaťa
- Výskyt dvoch histopatologicky odlišných malígnych nádorov
- Význam 177Lu-PSMA v léčbě kastračně-rezistentního karcinomu prostaty
- Postižení dutiny ústní onkologických a hematoonkologických pacientů
- Onkologické důsledky epidemie COVID-19
- Metastáza spinálního procesu u pacienta s EGFR mutovaným plicním adenokarcinomem
- Aktuality z odborného tisku
- Reiradiace u nádorů hlavy a krku
- Onemocnění asociované s IgG4
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Onemocnění asociované s IgG4
- Postižení dutiny ústní onkologických a hematoonkologických pacientů
- FDG-PET/ CT v diagnostice a hodnocení léčebné odpovědi Castlemanovy choroby – retrospektivní studie 29 případů z jednoho centra
- Význam 18F-FDG-PET vyšetření v léčbě adenokarcinomu jícnu a gastroezofageální junkce – přehled
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



