-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Výsledky Národního programu screeningu kolorektálního karcinomu v České republice – testy na okultní krvácení do stolice
Results of the Czech National Colorectal Cancer Screening Programme – Faecal Occult Blood Tests
Introduction:
The nationwide Colorectal Cancer Screening Programme was introduced in the Czech Republic in 2000. The aim of this article is to describe the employment of faecal occult blood tests (FOBTs) by the Czech population within the screening programme, and to provide information on the latest results of the programme.Material and Methods:
Data on the development of the colorectal cancer (CRC) burden in the Czech population is obtained from the Czech National Cancer Registry, a database required by the Czech law that has been collecting comprehensive data on cancer patients since 1977. Data on FOBT employment can be obtained from health care payers, and was provided by the Czech National Reference Centre. Results: Around 8,000 patients are diagnosed with colorectal cancer in the Czech Republic each year, and the number of CRC deaths is about 4,000. Despite the ongoing screening programme, significant improvements in the proportional representation of cancer stages (i.e., improvements in early detection of CRC cases) have yet to be seen. Although the number of FOBTs performed in the Czech Republic has significantly grown in the long term (which is accompanied by an increase in coverage by this screening test), the total coverage of the Czech population aged over 50 was only 25.5% in 2012. The Olomouc Region, the Zlin region, and the Usti nad Labem region had the highest coverage rates by CRC screening based on FOBT (over 28%), while the Capital of Prague had the lowest coverage rate (18%). Since 2008, FOBT positivity rates have seen a continuous and significant increase, reaching 6.9% in 2012. Between 13 to 14% of FOBTs in women are performed by practical gynaecologists.Conclusion:
Despite a significant increase in the participation rate in recent years, which was partially improved by the involvement of practical gynaecologists, the programme unfortunately still covers only a quarter of the eligible population. Implementation of effective measures aimed at getting people interested in preventive examinations (including the recently introduced programme of personalized invitations) is therefore essential; otherwise, the screening programme will not be successful on the population level.Key words:
colorectal neoplasms – mass screening – occult blood – primary health care
This study was supported by the project 36/14//NAP “Development and implementation of methodology for the evaluation of effectiveness of personalised invitations of citizens to cancer screening programmes” as part of the programme of the Czech Ministry of Health “National action plans and conceptions”.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
18. 9. 2014Accepted:
30. 10. 2014
Autoři: B. Seifert 1; O. Májek 2,3; M. Zavoral 4; N. Král 1; Š. Suchánek 4; O. Ngo 2; L. Dušek 2,3
Působiště autorů: Ústav všeobecného lékařství, 1. LF UK v Praze 1; Institut bio statistiky a analýz, LF a PřF MU, Brno 2; Ústav zdravotnických informací a statistiky ČR, Praha 3; Interní klinika 1. LF UK a ÚVN Praha 4
Vyšlo v časopise: Klin Onkol 2014; 27(Supplementum 2): 87-97
doi: https://doi.org/10.14735/amko20142S87Souhrn
Úvod:
Národní program screeningu kolorektálního karcinomu byl v ČR zahájen v roce 2000. Předkládané sdělení popisuje využívání testů na okultní krvácení ve stolici (TOKS) českou populací ve screeningovém programu a informuje o jeho výsledcích.Materiál a metody:
Údaje o vývoji zátěže české populace kolorektálním karcinomem (colorecal cancer – CRC) poskytuje Národní onkologický registr ČR, databáze definovaná zákonem a sbírající komplexní údaje o nemocných zhoubnými nádory již od roku 1977. Údaje o využívání TOKS v ČR lze získat z údajů plátců zdravotní péče, které byly poskytnuty Národním referenčním centrem.Výsledky:
Ročně je diagnostikováno přes 8 000 nových onemocnění CRC, přibližně 4 000 mužů a žen na toto onemocnění každoročně umírá. Přes probíhající screeningový program bohužel prozatím nelze pozorovat významné zlepšení v zastoupení stadií a tedy časném záchytu CRC. Počet prováděných TOKS v ČR sice dlouhodobě zřetelně roste a s ním i pokrytí tímto screeningovým testem, nicméně celkové pokrytí české populace od 50 let věku v roce 2012 činilo pouze 25,5 %. Nejvyšší pokrytí screeningem CRC prostřednictvím TOKS je v Olomouckém, Zlínském a Ústeckém kraji (přes 28 %), naopak nejnižší je pokrytí v hlavním městě Praze (18 %). Od roku 2008 pozitivita TOKS setrvale a znatelně roste, v roce 2012 dosáhla již 6,9 %. U žen provádějí 13 – 14 % TOKS praktičtí gynekologové. Závěr: I přes znatelný nárůst účasti populace v posledních letech, na níž se podílí i zapojení praktických gynekologů, bohužel program stále pokrývá pouze čtvrtinu populace. Nezbytným předpokladem úspěchu programu na populační úrovni tak musí být účinná opatření směřující k vyššímu zájmu občanů o preventivní vyšetření, zejm. nově zavedené adresné zvaní k preventivnímu vyšetření.Klíčová slova:
kolorektální nádory – plošný screening – okultní krev – primární zdravotní péčeÚvod
Screening kolorektálního karcinomu (colorecal cancer – CRC) patří, vedle screeningu nádorů prsu a hrdla děložního, mezi tři screeningové programy, jejichž implementace byla doporučena Radou EU (2003/ 878/ EC [1]). V Evropě i ve světě přibývá zemí, které zavádějí národní programy screeningu CRC [2]. Screening CRC je živé odborné téma, které je předmětem intenzivního výzkumu, je charakterizované dynamickým rozvojem a narůstající publicitou. Ve screeningu CRC patří lékařům primární péče významná role, a to nejen v samotném provádění testů, ale také ve správné komunikaci screeningu směrem k občanům. Populační strategie je tak v praxích ambulantních gynekologů a všeobecných praktických lékařů překládána do osobní medicíny, do individuální péče.
Eliminace CRC prostřednictvím primární prevence (změn životního stylu, medikamentózní profylaxe) je prozatím v nedohlednu a lékařům v praxi tak nezbývá, než se soustředit na včasný záchyt – sekundární prevenci nádorů (screening). Záchyt časných stadií nádorů a prekanceróz významně ovlivňuje perspektivu nemocných, jak z hlediska 5letého relativního přežití [3], tak z hlediska kvality života. Sekundární prevence vyžaduje dobrou spolupráci lékaře a jeho pacienta a vnější podporu obou. Aby byla laiky pochopena a akceptována, potřebuje silnou osvětu a mediální podporu. Aby byla přijata lékaři, musí existovat motivace odborná, profesionální i ekonomická.
Národní program screeningu kolorektálního karcinomu v ČR byl zahájen v roce 2000 a novelizován v roce 2009 [4] – od 50 let věku je v jednoročním intervalu prováděn test na okultní krvácení ve stolici (TOKS) v ordinacích lékařů primární péče (všeobecných praktických lékařů a gynekologů). V případě pozitivity je pacient odeslán na TOKS+ (screeningovou) kolonoskopii. V 55 letech má občan možnost volby mezi primární screeningovou kolonoskopií (PSK) a pokračováním TOKS ve dvouletých intervalech. Je‑li PSK normální, následuje 10letý screeningový interval. Horní věková hranice pro TOKS není vyhláškou MZ ČR č. 3/ 2010 Sb. o stanovení obsahu a časového rozmezí preventivních prohlídek stanovena; je ponecháno na zhodnocení lékaře, zdali je pacient schopen absolvovat diagnostický program v případě pozitivity TOKS.
TOKS je základním testem screeningových programů v Evropě [5]. Provádí se v jedno ‑ nebo dvouročních intervalech ze stolice vyšetřované osoby. Pro praxi jsou v současné době k dispozici testy na bázi guajakové pryskyřice (gTOKS) a testy imunochemické (FIT). TOKS je primárně screeningovým testem, který v asymptomatické nízkorizikové populaci pomáhá vyhledávat jedince vhodné k diagnostickému programu. Test má relativně nízkou diagnostickou hodnotu; negativní TOKS nevylučuje přítomnost nádoru ani polypu. Vzhledem k předpokladu, že krvácení z polypů nebo nádorů je intermitentní, test je třeba opakovat v určeném intervalu. Pozitivní TOKS je indikací k zahájení postupu k zjištění příčiny krvácení; tedy k provedení totální kolonoskopie.
Starší gTOKS je nejvíce prostudovanou screeningovou metodou a je v organizovaných programech v Evropě stále intenzivně využíván. Je levný, jednoduchý, proveditelný pacientem a vyhodnotitelný přímo v ordinaci. Tento test byl jako screeningová metoda doporučen na základě výzkumu amerického lékaře D. H. Greegora, publikovaného v roce 1971 [6]. Metaanalýza nejvýznamnějších randomizovaných kontrolovaných studií, provedených v 80. a 90. letech 20. století v USA (Minnesota [7]), Velké Británii (Nottingham [8]), Dánsku (Funen [9]) a Švédsku (Göteborg, původně nepublikované výsledky) s guajakovým testem, ukázala snížení mortality v pozvané populaci o 16 % (RR 0,84, 95% CI 0,78 – 0,90) [10]. Nevýhodou gTOKS je způsob odběru, při kterém musí vyšetřovaná osoba manipulovat se stolicí, tedy roztírat ji na okénka testové obálky. Test nelze automaticky odečítat a nelze nastavovat cut‑off, tj. hodnotu koncentrace hemoglobinu, při které je již vzorek považován za pozitivní. Dietní omezení test zpřesňují, ale zároveň komplikují.
V současné době existuje dostatek podkladů pro doporučení k náhradě guajakových testů ve screeningu testy imunochemickými (FIT). FIT se ve srovnání s guajakovým testem vyznačují významně vyšší senzitivitou pro nádory a pokročilé adenomy a při vhodně nastavené úrovni cut‑off rovněž vyšší specificitou [11]. Odběr se provádí bez předchozího dietního nebo lékového omezení, jednodušším způsobem a postačí jen z jedné stolice. Přijatelnost odběru, jednoduchá manipulace a způsob vyhodnocení imunochemického testu zvyšují adherenci cílové populace [12] i zdravotnického personálu. Imunochemické testy jsou založeny na principu stanovení lidského hemoglobinu ve stolici reakcí s protilátkou v testu. Jsou využívány různé metodologie, jako kvalitativní hemaglutinace a latexová aglutinace. Imunoturbidimetrický test využívá mikročástice pokryté prasečím antisérem, obsahujícím polyklonální protilátky proti lidskému hemoglobinu. Hemoglobin přítomný ve vzorku reaguje s mikročásticemi a výsledná změna turbidity roztoku je fotometricky měřena.
Cílem tohoto sdělení je prezentovat výsledky Národního programu screeningu kolorektálního karcinomu v ČR s ohledem na primární péči, tedy se zaměřením na využívání a výsledky TOKS v české populaci.
Materiál a metody
V rámci screeningového programu je kladen velký důraz na kontrolu kvality a bezpečnosti vyšetření. Doporučení Rady EU o programech screeningu zhoubných nádorů [1] stanoví, že má být vytvořen systém informační podpory screeningových programů, který má sbírat, uchovávat a hodnotit údaje o všech screeningových testech, doplňujících vyšetřeních a výsledných diagnózách. Evropská komise pro monitoring screeningu CRC vydala i velmi obsáhlá doporučení, tzv. European Guidelines [13], která podrobně popisují, jak má být tento screeningový program implementován a jak má probíhat jeho sledování a vyhodnocení.
Klíčovým předpokladem účinnosti a tedy i nákladové efektivity screeningového programu na populační úrovni je dostatečná účast klientů z cílové populace. Účast je nezbytné podporovat edukačními kampaněmi nebo centralizovaným zvaním osob. Věrohodné hodnocení populačního programu vyžaduje analýzu populačních dat, v případě ČR ideálně dat plátců zdravotní péče, která jsou velmi přesná a zároveň již nasbíraná, není je tedy potřeba nákladně nově zaznamenávat. Tato data je pro účely monitoringu screeningových programů možné získat prostřednictvím Národního referenčního centra (NRC, www.nrc.cz), které agreguje údaje všech plátců na celonárodní úrovni.
Konečným měřítkem úspěšného screeningového programu je však jen prokázané snížení incidence nebo mortality na příslušné zhoubné nádorové onemocnění. Takový důkaz lze poskytnout pouze na podkladě analýzy epidemiologických dat. Registrace novotvarů prostřednictvím Národního onkologického registru ČR (NOR) je legislativně zakotvena a je povinná. Propracovaný monitoring epidemiologie zhoubných nádorů je v ČR úspěšně nastaven, konkrétním výstupem je portál o nádorové epidemiologii se široce dostupnými informacemi o dlouhodobých trendech v populačních charakteristikách SVOD (Software pro vizualizaci onkologických dat, www.svod.cz) [14]. Údaje NOR o zátěži populace CRC jsou hodnoceny standardními metodami popisné nádorové epidemiologie [15], je uplatněna analýza trendů incidence a mortality, vývoj zastoupení klinických stadií hodnocení relativního populačního přežití [16].
Výsledky
CRC představuje po jiných kožních nádorech nejčastější zhoubný nádor v české populaci, v roce 2011 tvořil 10,6 % všech nově diagnostikovaných malignit. Po dlouhodobém nárůstu se přibližně od roku 2000 incidence stabilizovala a u mortality dokonce sledujeme mírný pokles (obr. 1). Ročně je diagnostikováno přes 8 000 nových onemocnění, přibližně 4 000 mužů a žen každoročně umírá. Přes probíhající screeningový program bohužel prozatím nelze pozorovat významné zlepšení v zastoupení stadií, dlouhodobě je v časnějších stadiích I nebo II diagnostikováno pouze necelých 50 % onemocnění (obr. 2). Přesto lze i u CRC sledovat znatelné zlepšení v 5letém relativním přežití – zatímco u pacientů diagnostikovaných v letech 1995 – 1999 činilo 42,0 %, v recentní periodě (2008 – 2011) dosahuje již 54,3 %.
Obr. 1. Časové trendy v incidenci a mortalitě kolorektálního karcinomu v ČR. 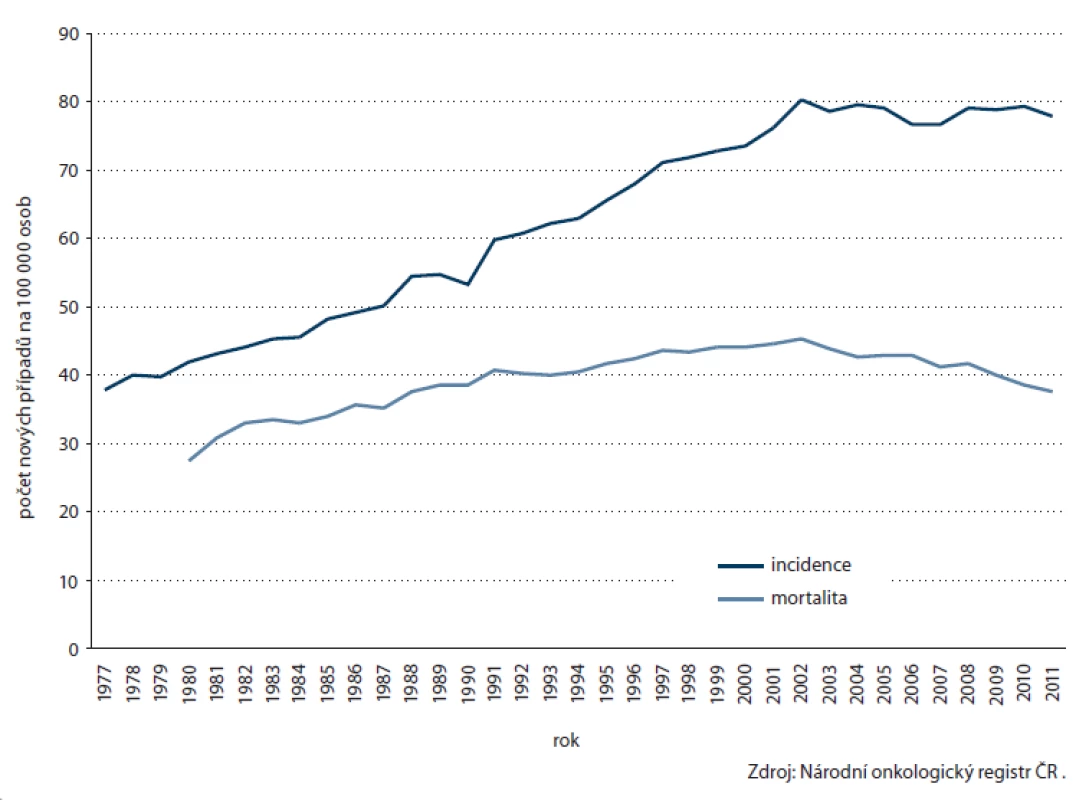
Obr. 2. Vývoj zastoupení klinických stadií kolorektálního karcinomu v ČR. 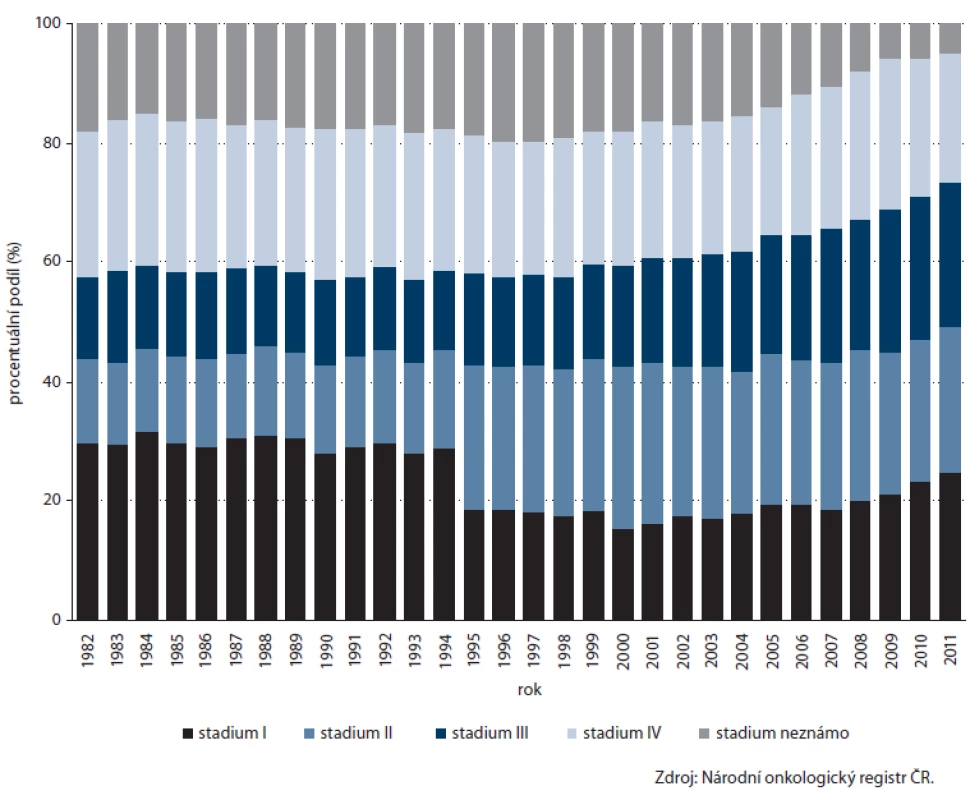
Počet prováděných TOKS v ČR dlouhodobě zřetelně roste (obr. 3) a s ním i pokrytí tímto screeningovým testem. Celkové pokrytí české populace od 50 let věku v roce 2012 činilo 25,5 % (obr. 4). Při výpočtu pokrytí se v jednotlivých věkových skupinách zohledňuje screeningový interval definovaný vyhláškou MZ ČR (tab. 1). Pokrytí screeningem je definováno jako poměr počtu osob vyšetřených daným screeningovým testem v průběhu screeningového intervalu a počtu osob v populaci. Pro výpočet aktuálního pokrytí na konci roku 2012 jsou tak pro věkovou skupinu 50 – 54 let (jednoletý screeningový interval dle vyhlášky) uvažována vyšetření provedená v roce 2012, pro věkovou skupinu nad 55 let (dvouletý screeningový interval dle vyhlášky) uvažována vyšetření provedená v roce 2011 – 2012. Pokrytí se snižuje s věkem, do přibližně 75 let dosahuje pokrytí přibližně 30 %, poté prudce klesá. Pokrytí je dále vyšší u žen, rozdíl je výrazný zejm. v mladších věkových skupinách (obr. 5). Právě u žen došlo v letech 2009 – 2012 k výraznému nárůstu pokrytí (obr. 6). V současnosti dosahuje pokrytí u mužů 23,0 % a u žen 27,5 %.
Tab. 1. Znázornění výpočtu pokrytí cílové populace TOKS v jednotlivých věkových skupinách na konci roku 2012. 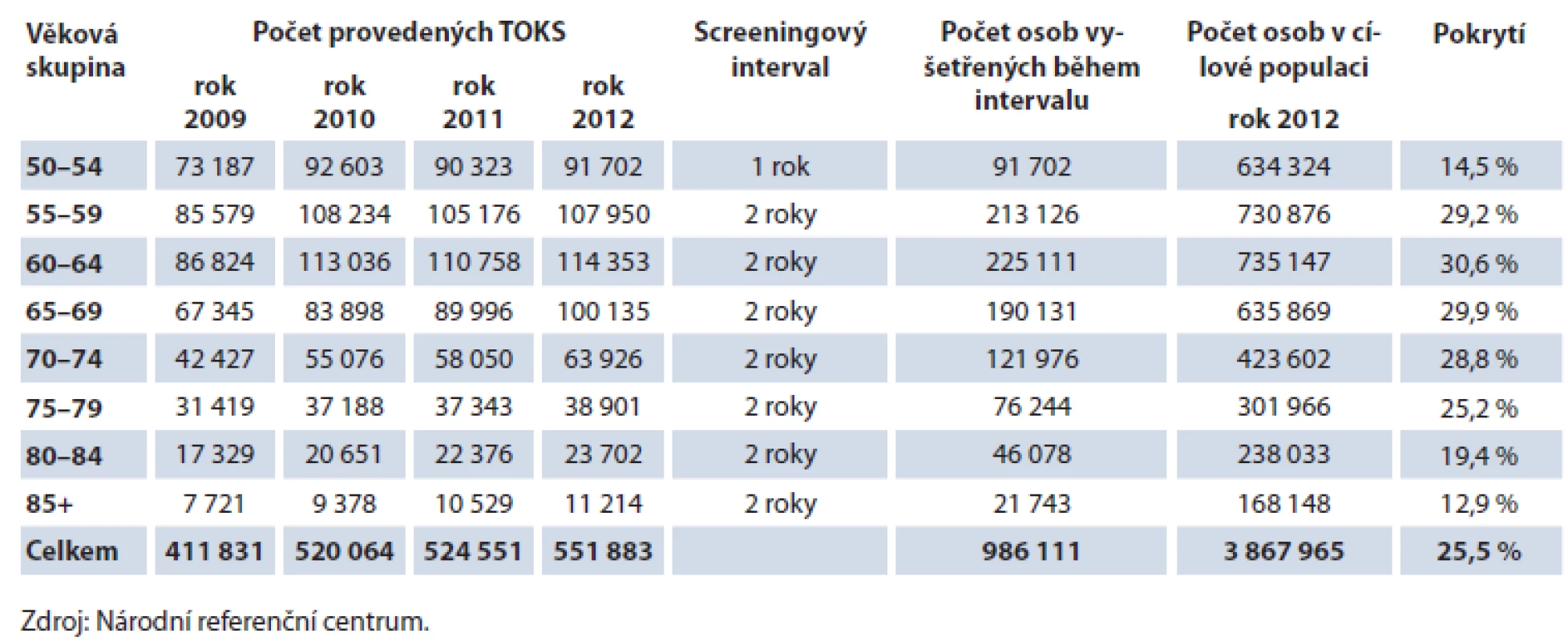
Obr. 3. Časové trendy počtů vyšetřených jedinců v jednotlivých letech (všechny věkové skupiny). 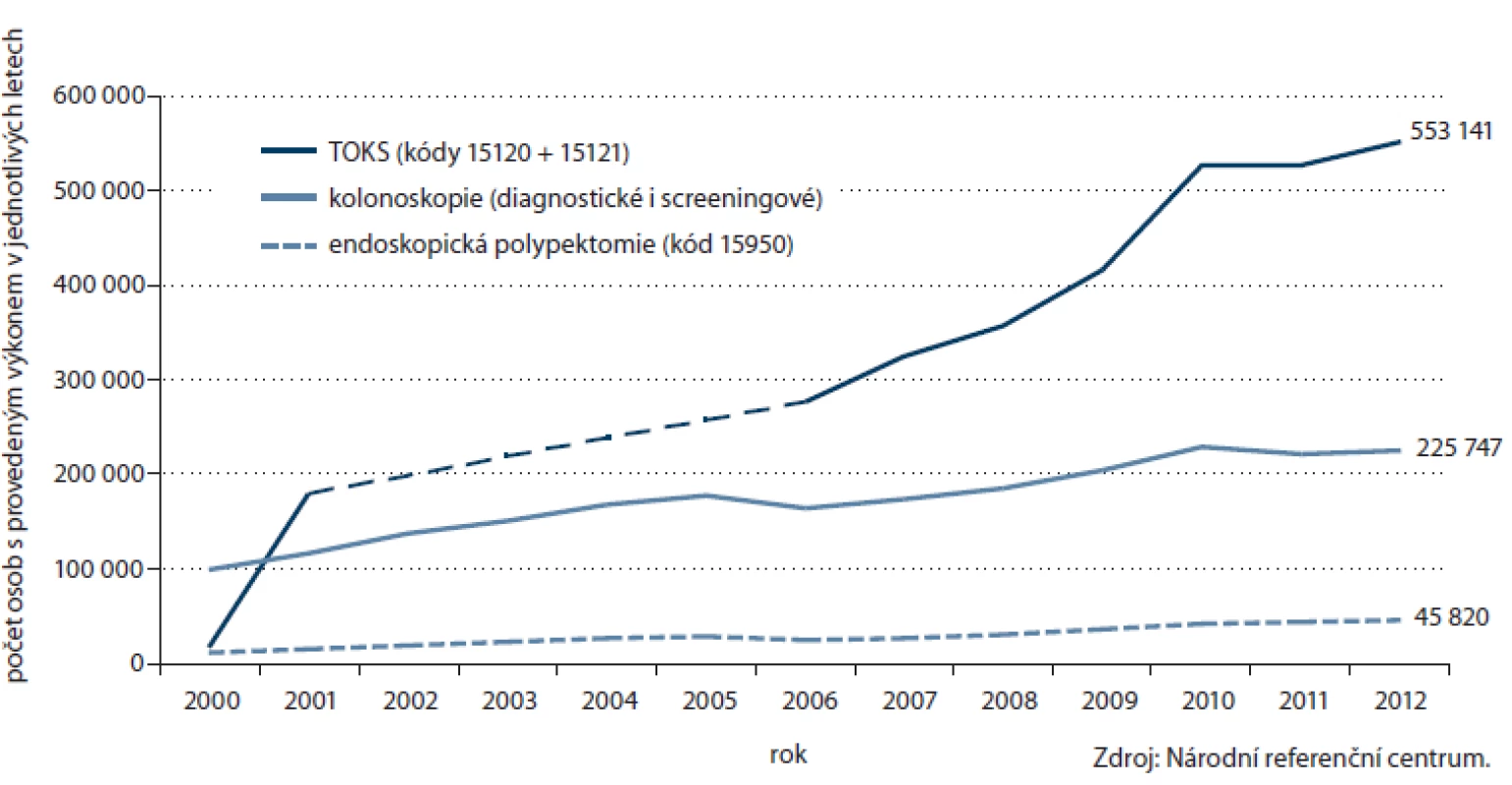
Obr. 4. Vývoj pokrytí cílové populace (muži a ženy od 50 let věku) v ČR screeningem kolorektálního karcinomu prostřednictvím TOKS. Od roku 2009 je pro věkovou skupinu 50–54 let uvažován jednoletý screeningový interval. 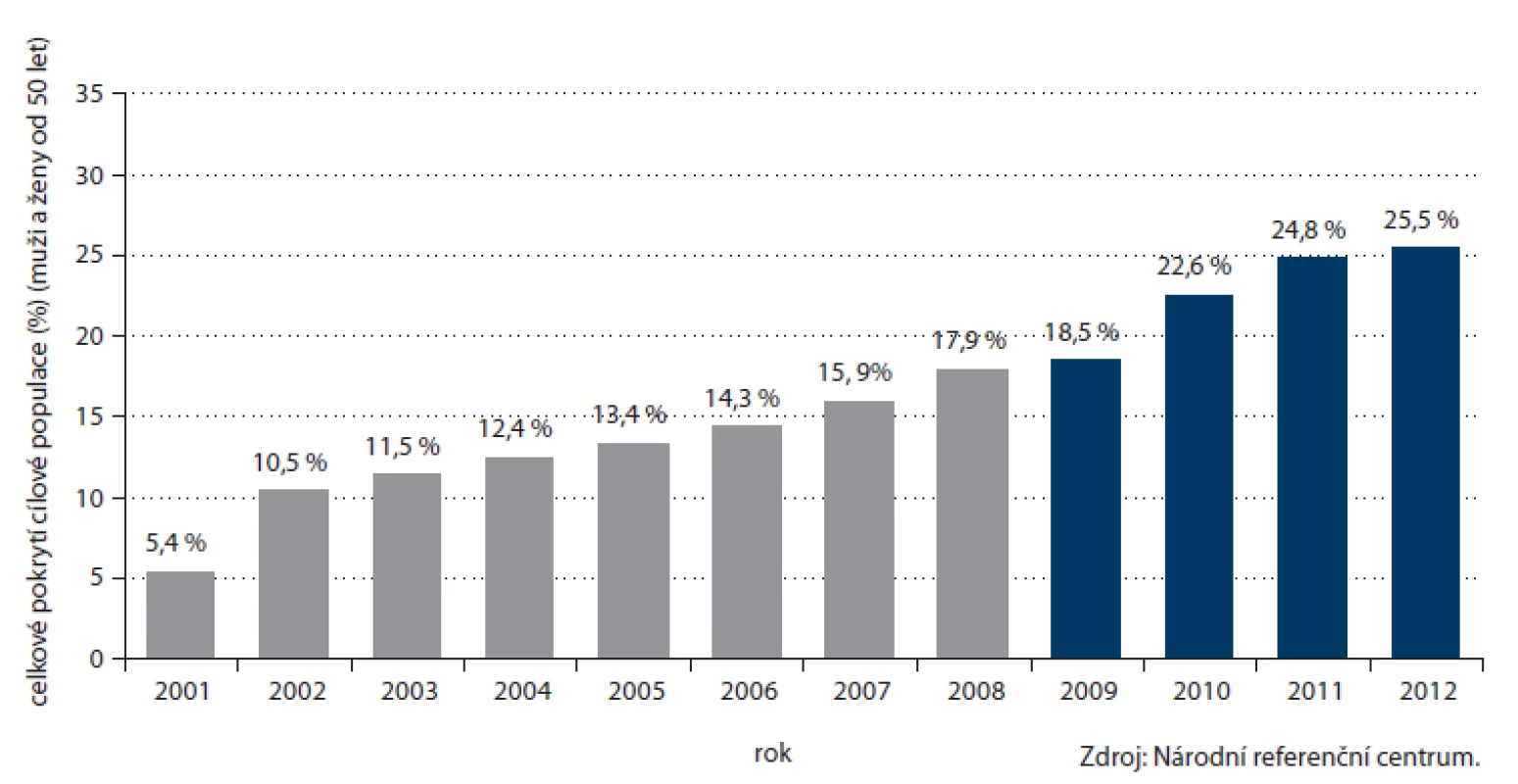
Obr. 5. Pokrytí cílové populace v ČR screeningem kolorektálního karcinomu prostřednictvím TOKS v jednotlivých věkových skupinách dle pohlaví (na konci roku 2012). 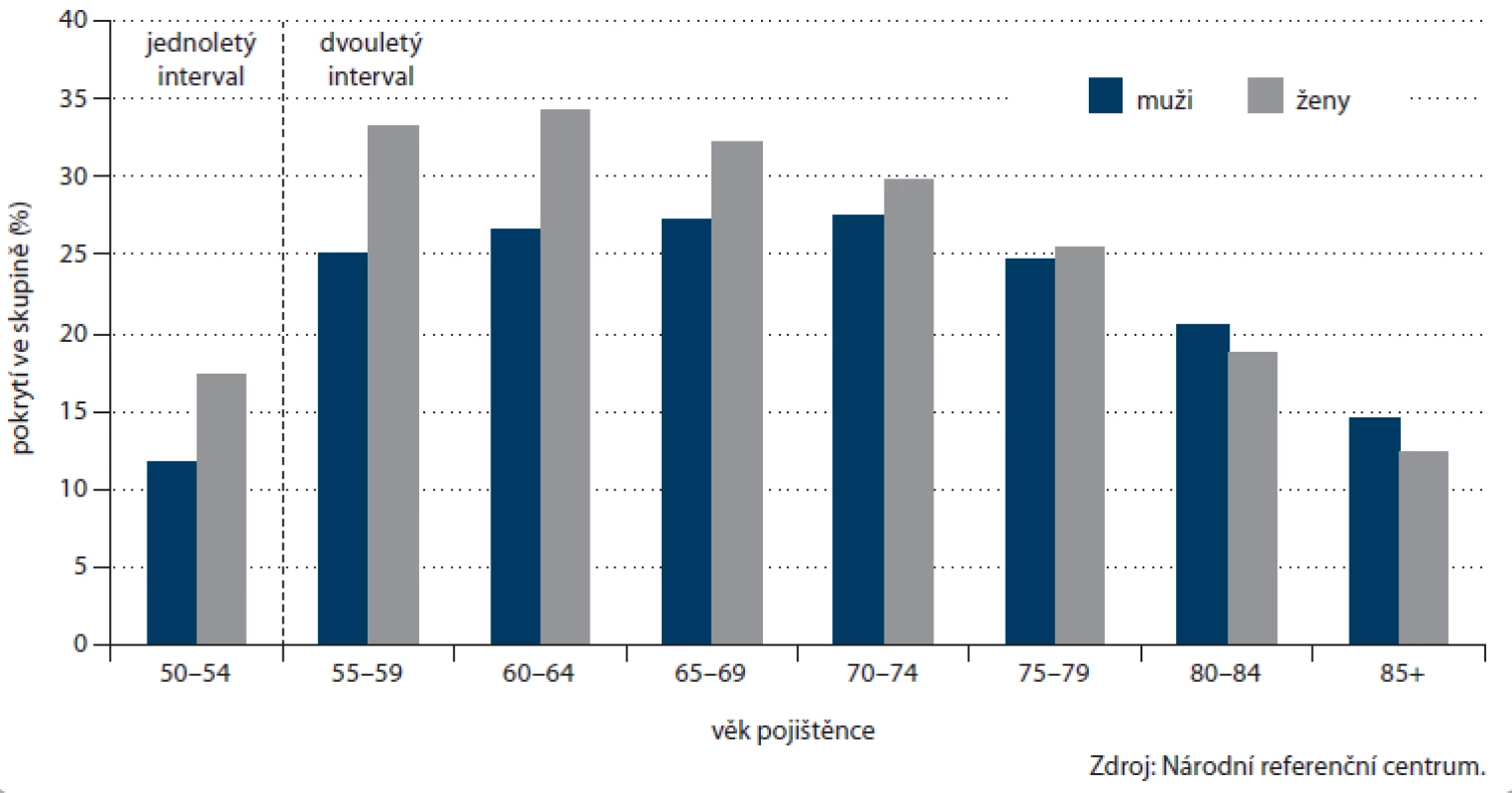
Obr. 6. Vývoj pokrytí cílové populace (od 50 let věku) screeningem TOKS dle pohlaví. 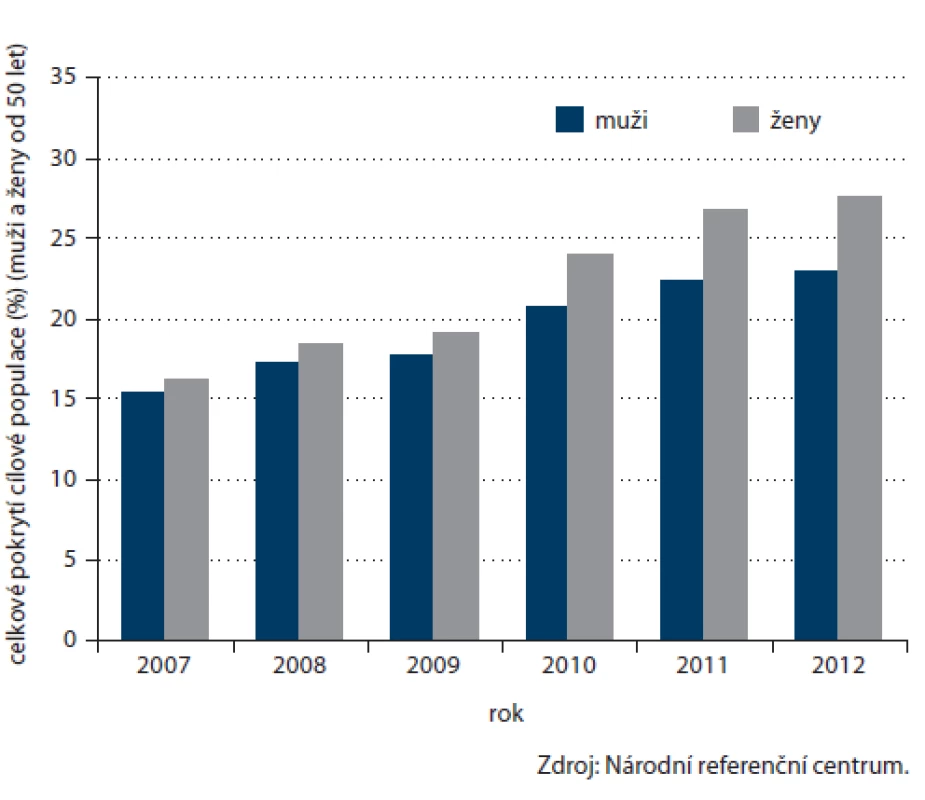
Dostupná data NRC umožňují i zmapování prevence na úrovni jednotlivých krajů a okresů ČR (obr. 7, 8). Nejvyšší pokrytí screeningem CRC prostřednictvím TOKS je v Olomouckém, Zlínském a Ústeckém kraji (přes 28 %), naopak nejnižší je pokrytí, obdobně jako v ostatních screeningových programech, v hlavním městě Praze (18 %). Rozsah v jednotlivých okresech daného kraje je obvykle přibližně 10 – 15 %, velmi rovnoměrného pokrytí je však dosaženo ve Zlínském kraji, který tak podle dostupných dat může sloužit jako ukázka úspěšné regionální organizace. Na úrovni okresů je pokrytí nejvyšší v okresech Šumperk, Olomouc a Chomutov (přes 34 %).
Obr. 7. Pokrytí cílové populace v jednotlivých krajích ČR screeningem kolorektálního karcinomu prostřednictvím TOKS (na konci roku 2012). 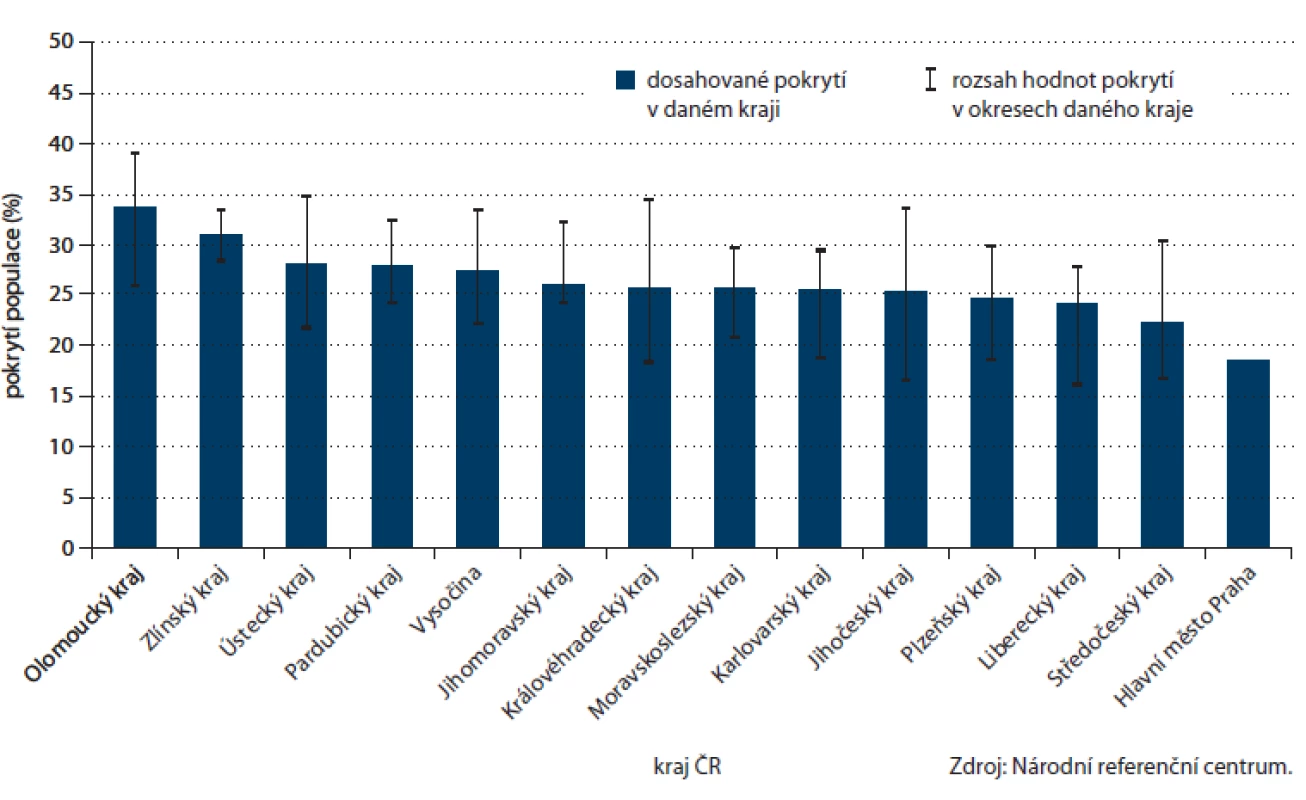
Obr. 8. Pokrytí cílové populace v jednotlivých okresech ČR screeningem kolorektálního karcinomu prostřednictvím TOKS (na konci roku 2012). 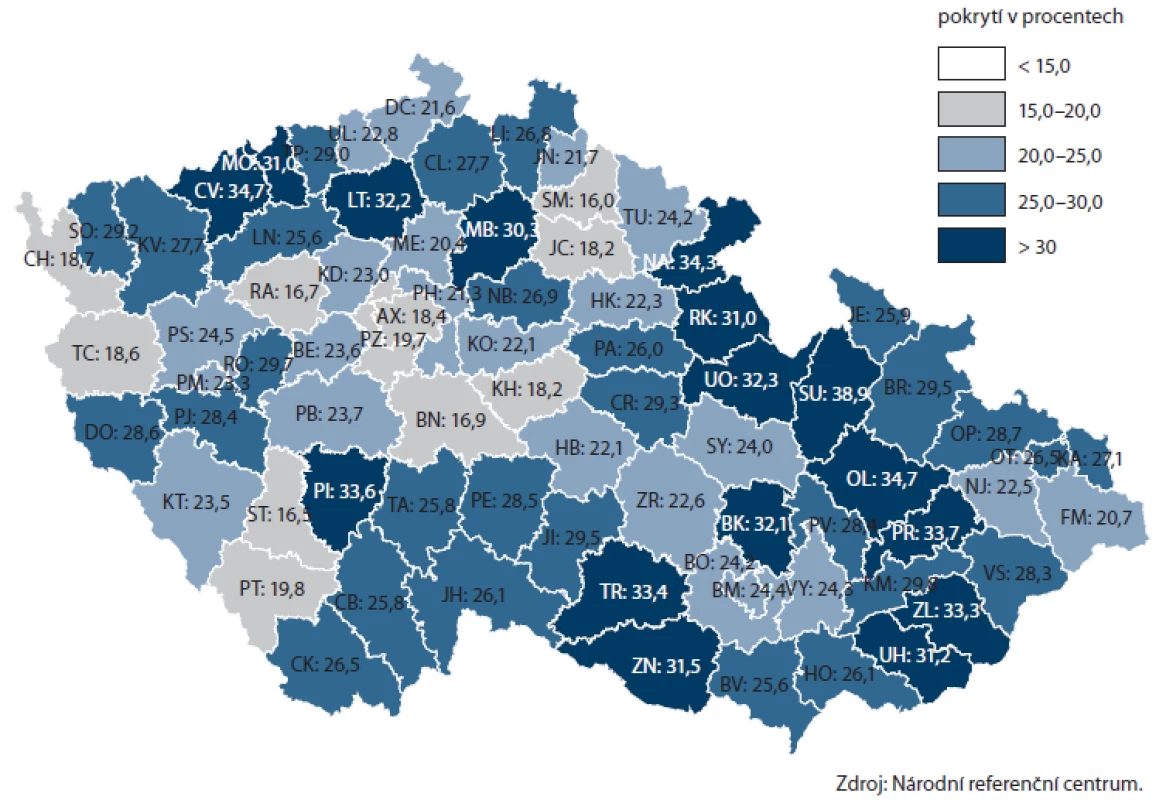
Data NRC lze rovněž velmi dobře využít v monitoringu pozitivity TOKS. Dostupná data umožňují vyhodnotit podíl pozitivních výsledků od roku 2006. Zatímco v roce 2006 činila pozitivita 3,6 % a v roce 2007 dokonce pouhých 3,3 %, od roku 2008 pozitivita setrvale a znatelně roste. V roce 2012 dosáhla již 6,9 %, v jednotlivých krajích se pozitivita pohybuje mezi 5,2 a 8,6 % (obr. 9).
Obr. 9. Časový vývoj pozitivity TOKS. 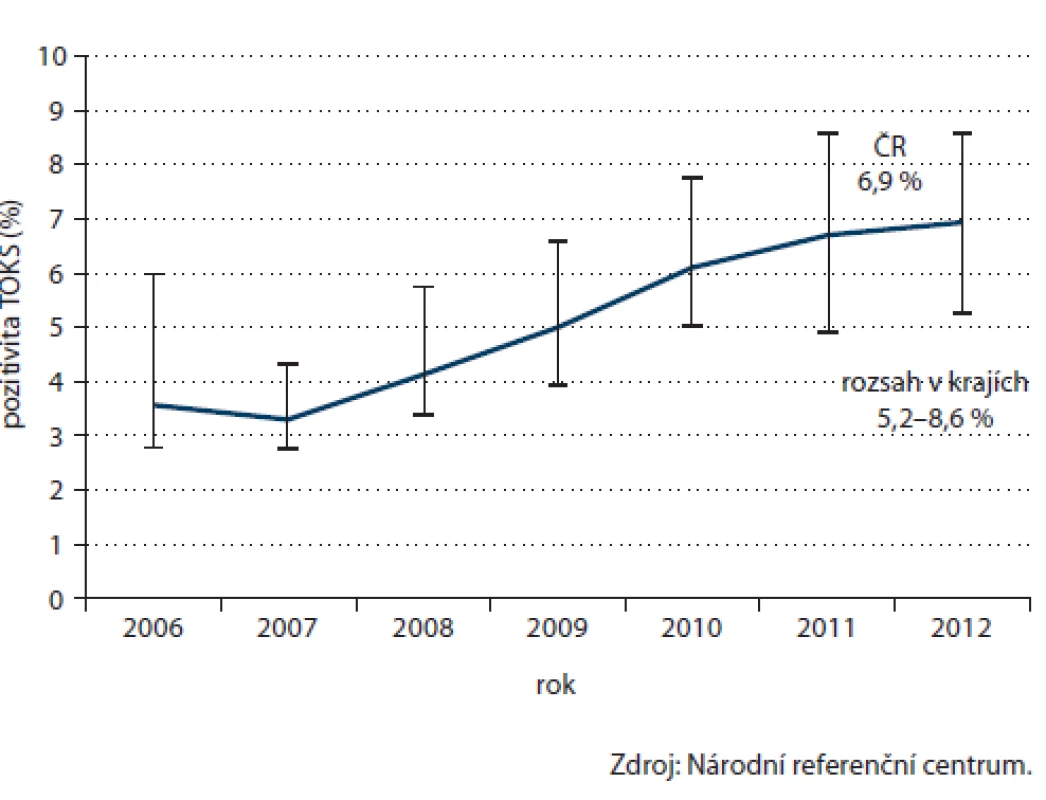
Zásadní změnou v nastavení programu byl vstup gynekologů v roce 2009. Ti od tohoto roku mohou nabízet svým klientkám vyšetření TOKS stejně jako všeobecní praktičtí lékaři. Soustředíme‑li se na populaci žen, po pomalejším vstupu v roce 2009, kdy gynekologové provedli u žen 6 % vyšetření, se podíl gynekologů na prováděných testech ustálil na 13 – 14 % (obr. 10). Na celkovém pokrytí ženské populace, které v roce 2012 činilo 27,5 %, se gynekologové podíleli 3,4 procentními body. Příspěvek gynekologů k pokrytí je vyšší u mladších žen (5,5 procentních bodů u žen ve věku 55 – 59 let, obr. 11). V zapojení gynekologů lze vysledovat regionální odlišnosti, kdy např. v Pardubickém kraji je příspěvek gynekologů celých 6,4 procentních bodů (pětina vyšetření v daném kraji u žen), což významně přispívá k úspěšnosti regionu na celonárodní úrovni (obr. 12).
Obr. 10. Zastoupení odborností u provedených TOKS v jednotlivých letech (pouze ženy). 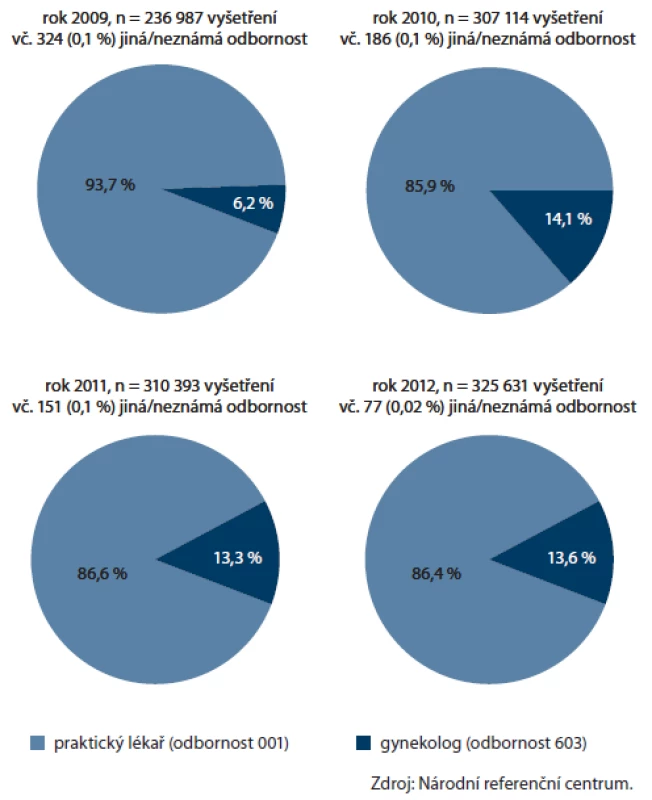
Obr. 11. Příspěvek jednotlivých odborností k pokrytí populace screeningem kolorektálního karcinomu dle věku (pouze ženy). 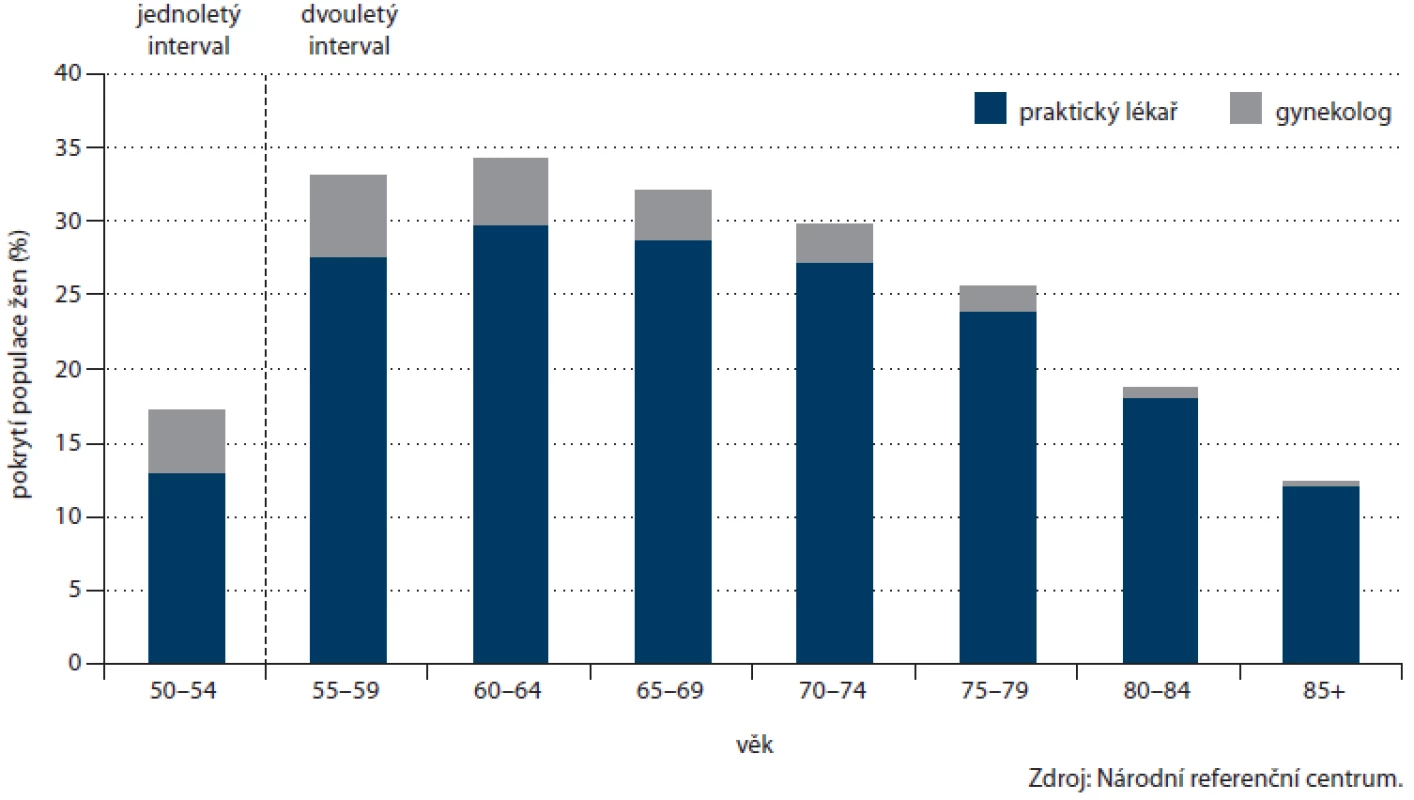
Obr. 12. Příspěvek jednotlivých odborností k pokrytí populace screeningem kolorektálního karcinomu dle kraje ČR (pouze ženy). 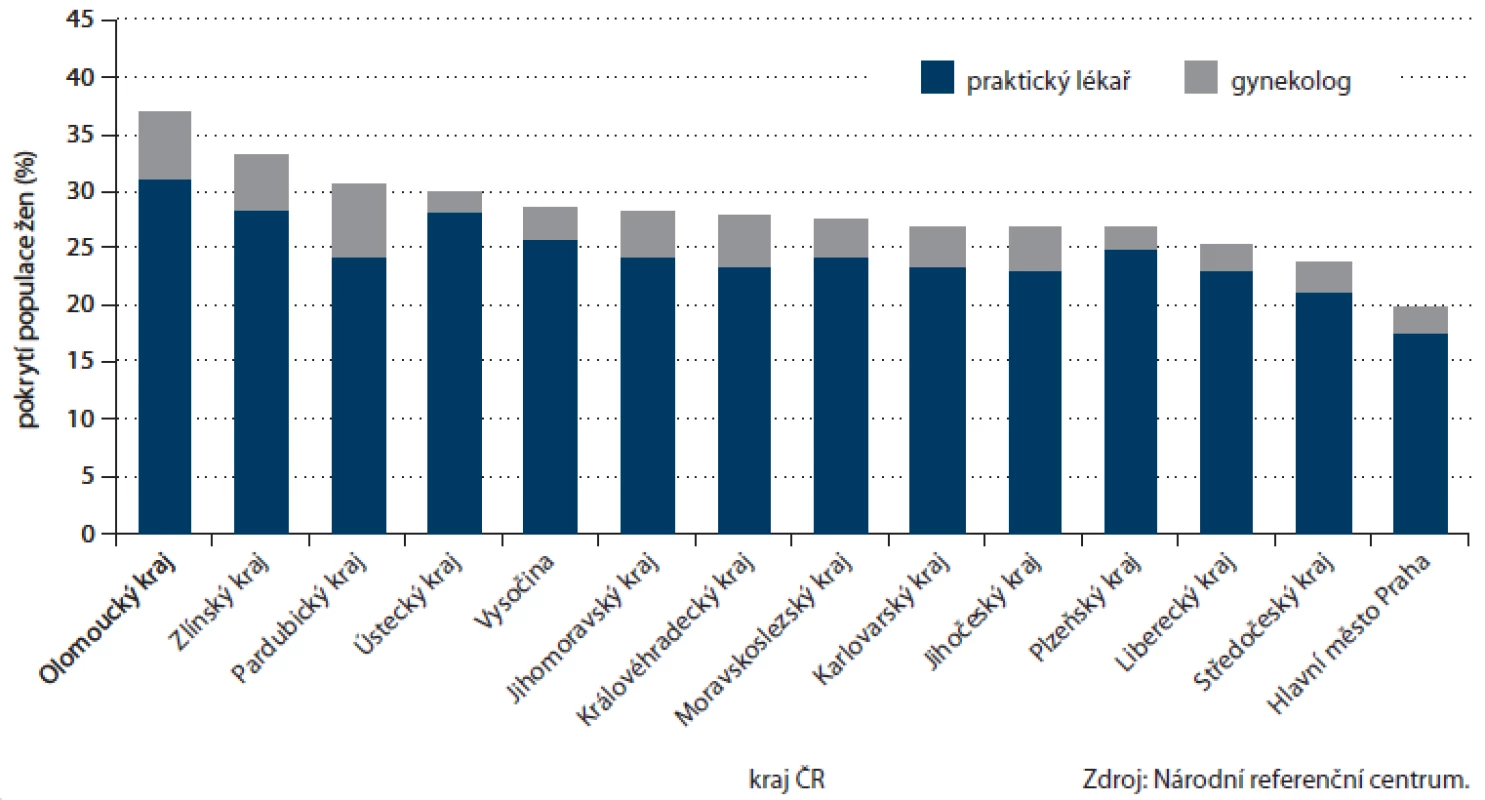
Diskuze
CRC představuje jedno z nejčastějších onkologických onemocnění v ČR. Incidence nicméně od roku 2000 dále neroste a mortalita dokonce mírně klesá. Z důvodu poměrně nízkého pokrytí screeningovým programem na začátku minulého desetiletí se bohužel prozatím nepodařilo výrazně ovlivnit časný záchyt CRC v ČR. V posledních letech nicméně pokrytí programem znatelně roste, stále lze však pozorovat rezervy ve srovnání s mezinárodními standardy a značnou variabilitu mezi jednotlivými regiony ČR.
Screeningový program prostřednictvím TOKS má prokázaný potenciál snižovat incidenci a mortalitu CRC [10,17]. Vývoj nemocnosti a úmrtnosti na nádorová onemocnění po zahájení screeningu v konkrétním státě se však od příznivých výsledků klinických studií může významně lišit, a to mimo jiné z následujících důvodů – v cílové populaci nadále dochází k úmrtím pacientů diagnostikovaných v pokročilejším stadiu před zahájením screeningu nebo diagnostikovaných mimo screening, programy selhávají v zvaní osob z cílové populace a optimální kvalita poskytovaných vyšetření může být dosažena až po nějakém čase [18].
Pomocí dat zdravotních pojišťoven lze v ČR prokazatelně doložit setrvalý růst pokrytí cílové populace screeningem CRC. Nicméně zatímco programy screeningu karcinomu prsu a hrdla děložního v ČR dosahují pokrytí přibližně poloviny populace, screening CRC má pokrytí jen čtvrtinové. Mezinárodní doporučení ovšem stanoví pro náběr osob do screeningu CRC cíl alespoň 45 %, lépe však dokonce 65 % [19]. Adherenci občanů k preventivním programům a preventivním i dispenzárním prohlídkám zvyšuje jejich zvaní [20]; poštou, elektronicky, telefonicky nebo prostřednictvím krátké textové zprávy. Nejvyšší účasti ve screeningových onkologických programech dosahují země, které organizují „cílené zvaní“ z občanských nebo pojištěneckých registrů.
Adresné zvaní osob z cílové populace je klíčovou podmínkou populačního screeningu. Přechod na adresné zvaní cílové populace je považován za rozhodující moment pro zvýšení účasti cílové populace ve screeningu. Zahraniční studie ukazují, že při centrálním/ adresném zvaní pacientů se dá dosáhnout výrazně vyšší účasti, která může dosáhnout dokonce až 70 – 80 % [21]. V mnoha zemích se hledá způsob, jak optimálně zorganizovat adresné zvaní pacientů pro screeningové programy. Přesvědčivá data z pilotních studií byla získána např. ve Velké Británii [22] nebo v Nizozemsku [23]. V obou zemích proběhl projekt v podobné režii s výtěžností 50 – 60 %. Praktický lékař měl roli informativní, imunochemické testy na okultní krvácení byly odesílány v setech s průvodním dopisem přímo do domácností národní agenturou. Po provedení je pacienti odesílali do laboratorního centra k vyhodnocení, v případě pozitivity testu byl pacient kontaktován vyškoleným pracovníkem (screeningová sestra) a informován o dalším postupu, kolonoskopii na příslušném screeningovém pracovišti.
Systém adresného zvaní klade zvýšené nároky na všechny odbornosti ve screeningu zúčastněné. Před jeho zavedením je třeba provést kapacitní rozvahu, rozhodnout o velikosti aktuálně pozvané populace a časovém harmonogramu zvaní. Rozhodující je přitom kapacita center pro screeningovou kolonoskopii, kde hrozí prodlužování čekací doby na vyšetření a ztráta ochoty TOKS pozitivních osob podrobit se dalšímu diagnostickému postupu. Nárůst zájmu o screening o 20 procentních bodů (na doporučených 45 %) by znamenal téměř dvojnásobné zatížení center screeningovou kolonoskopií při současné míře pozitivity TOKS. Při přechodu na testy s vyšší senzitivitou (a z ní vyplývající pozitivitou) by ovšem byly kapacitní požadavky ještě vyšší. Roli sehrává i obsah a forma vlastního dopisu. V českém prostředí se jeví jako racionální příprava a distribuce oslovení zdravotními pojišťovnami.
Závěr
V ČR je dostupný průběžně monitorovaný screening CRC prostřednictvím TOKS. I přes znatelný nárůst účasti populace v posledních letech, na níž se podílí i zapojení praktických gynekologů, bohužel program stále pokrývá pouze čtvrtinu populace. Nezbytným předpokladem úspěchu programu na populační úrovni tak musí být účinná opatření směřující k vyššímu zájmu občanů o preventivní vyšetření, zejm. adresné zvaní k preventivnímu vyšetření.
Práce byla podpořena v rámci projektu 36/14//NAP „Vývoj a implementace metodiky hodnocení účinnosti adresného zvaní občanů do onkologických screeningových programů ČR“ v rámci programu „Národní akční plány a koncepce“ Ministerstva zdravotnictví ČR na rok 2014.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Bohumil Seifert, Ph.D.
Ústav všeobecného lékařství
1. LF UK v Praze
Albertov 7
128 00 Praha 2
e-mail: bohumil.seifert@lf1.cuni.cz
Obdrženo: 18. 9. 2014
Přijato: 30. 10. 2014
Zdroje
1. The Council of the European Union. Council Recommendation of 2 December 2003 on cancer screening (2003/ 878/ EC). Off J Eur Union 2003; L 327 : 34 – 38.
2. Zavoral M, Suchanek S, Zavada F et al. Colorectal cancer screening in Europe. World J Gastroenterol 2009; 15(47): 5907 – 5915.
3. Majek O, Gondos A, Jansen L et al. Survival from colorectal cancer in Germany in the early 21st century. Br J Cancer 2012; 106(11): 1875 – 1880.
4. Zavoral M, Suchanek S, Majek O et al. Colorectal cancer screening: 20 years of development and recent progress. World J Gastroenterol 2014; 20(14): 3825 – 3834. doi: 10.3748/ wjg.v20.i14.3825.
5. Karsa L, Anttila A, Ronco G et al (eds). Cancer screening in the European Union: report on the implementation of the Council Recommendation on cancer screening. Luxembourg: European Communities 2008.
6. Greegor DH. Occult blood testing for detection of asymptomatic colon cancer. Cancer 1971; 28(1): 131 – 134.
7. Mandel JS, Bond JH, Church TR et al. Reducing mortality from colorectal cancer by screening for fecal occult blood. Minnesota Colon Cancer Control Study. N Engl J Med 1993; 328(19): 1365 – 1371.
8. Hardcastle JD, Chamberlain JO, Robinson MH et al. Randomised controlled trial of faecal ‑ occult‑blood screening for colorectal cancer. Lancet 1996; 348(9040): 1472 – 1477.
9. Kronborg O, Fenger C, Olsen J et al. Randomised study of screening for colorectal cancer with faecal ‑ occult‑blood test. Lancet 1996; 348(9040): 1467 – 1471.
10. Hewitson P, Glasziou P, Watson E et al. Cochrane systematic review of colorectal cancer screening using the fecal occult blood test (hemoccult): an update. Am J Gastroenterol 2008; 103(6): 1541 – 1549. doi: 10.1111/ j.1572 ‑ 0241.2008.01875.x.
11. Segnan N, Patnick J, von Karsa L (eds). European guidelines for quality assurance in colorectal cancer screening and diagnosis. Luxembourg: Publications Office of the European Union 2010.
12. van Rossum LG, van Rijn AF, Laheij RJ et al. Random comparison of guaiac and immunochemical fecal occult blood tests for colorectal cancer in a screening population. Gastroenterology 2008; 135(1): 82 – 90. doi: 10.1053/ j.gastro.2008.03.040.
13. Segnan N, Patnick J, Karsa L (eds). European guidelines for quality assurance in colorectal cancer screening and diagnosis. 1st ed. Luxembourg: Publications Office of the European Union 2010.
14. Dušek L, Mužík J, Kubásek M et al (eds). Epidemiologie zhoubných nádorů v České republice [Internet]. Brno: Masarykova univerzita 2005 [citováno 30. srpna 2014]. Dostupný z: http:/ / www.svod.cz.
15. dos Santos Silva I (ed). Cancer epidemiology: principles and methods. Lyon: IARC press 1999.
16. Pavlik T, Majek O, Buchler T et al. Trends in stage ‑ specific population‑based survival of cancer patients in the Czech Republic in the period 2000 – 2008. Cancer Epidemiol 2014; 38(1): 28 – 34. doi: 10.1016/ j.canep.2013.11.002.
17. Mandel JS, Church TR, Bond JH et al. The effect of fecal occult‑blood screening on the incidence of colorectal cancer. N Engl J Med 2000; 343(22): 1603 – 1607.
18. Vainio H, Bianchini F (eds). Breast cancer screening. Lyon: IARC Press 2002.
19. Moss S, Ancelle ‑ Park R, Brenner H. Evaluation and interpretation of screening outcomes. In: Segnan N, Patnick J, Karsa L (eds). European guidelines for quality assurance in colorectal cancer screening and diagnosis. 1st ed. Luxembourg: Publications Office of the European Union 2010.
20. Jepson R, Clegg A, Forbes C et al. The determinants of screening uptake and interventions for increasing uptake: a systematic review. Health Technol Assess 2000; 4(14): 1 – 133.
21. Malila N, Oivanen T, Malminiemi O et al. Test, episode, and programme sensitivities of screening for colorectal cancer as a public health policy in Finland: experimental design. BMJ 2008; 337: a2261. doi: 10.1136/ bmj.a2261.
22. Steele RJ, McClements PL, Libby G et al. Results from the first three rounds of the Scottish demonstration pilot of FOBT screening for colorectal cancer. Gut 2009; 58(4): 530 – 535. doi: 10.1136/ gut.2008.162883.
23. Hol L, van Leerdam ME, van Ballegooijen M et al. Screening for colorectal cancer: randomised trial comparing guaiac‑based and immunochemical faecal occult blood testing and flexible sigmoidoscopy. Gut 2010; 59(1): 62 – 68. doi: 10.1136/ gut.2009.177089.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Editorial
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2014 Číslo Supplementum 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Indikátory kvality screeningových programů
- Implementace indikátorů kvality v českém programu screeningu karcinomu prsu – výsledky pravidelného monitoringu
- Národní portály jako oficiální komunikační platforma screeningových programů
- Role a význam občanských aktivit v podpoře screeningu zhoubných nádorů
- Nová evropská konferenční a informační platforma usilující o zlepšení péče o pacienty s kolorektálním karcinomem – www.crcprevention.eu
- Epidemiologie zhoubných nádorů cílených screeningem dle nových dat Národního onkologického registru České republiky
- Editorial
- Epidemiologie zhoubných nádorů se zavedeným screeningem v mezinárodním srovnání
- Stav a vývoj informační základny pro hodnocení onkologických screeningových programů v České republice
- Koncepce populačního screeningu v České republice, metodika a první výsledky adresného zvaní občanů do preventivních onkologických programů
- Výsledky Národního programu screeningu karcinomu prsu v České republice
- Objektivní potřeba a stav nádorové prevence v České republice a v Evropě
- Výsledky Národního programu screeningu karcinomu děložního hrdla v České republice
- Výsledky Národního programu screeningu kolorektálního karcinomu v České republice – testy na okultní krvácení do stolice
- Výsledky Národního programu screeningu kolorektálního karcinomu v České republice – kolonoskopická vyšetření
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Indikátory kvality screeningových programů
- Výsledky Národního programu screeningu karcinomu děložního hrdla v České republice
- Výsledky Národního programu screeningu karcinomu prsu v České republice
- Výsledky Národního programu screeningu kolorektálního karcinomu v České republice – kolonoskopická vyšetření
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



