-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaKapalné biopsie se přibližují rutinním klinickým laboratořím
Liquid biopsies are approaching routine clinical laboratories
This work is created for education of laboratory professionals in routine clinical laboratories and deals with possibility applying the liquid biopsy in routine mode. The determination of circulating DNA (cfDNA, ctDNA) are main topics of liquid biopsy. Low invasiveness and possibility of often using are big advantages of these tests. Liquid biopsy methods are part of the disruption and digitalization in the of the laboratory medicine. Routine laboratories should be one tool of precision medicine and methods of liquid biopsy, based on genomic (PCR, NGS) methods are surely the part of this process. Important factor for adaptation liquid biopsy to routine work is development of CDx (companion diagnostics tests). Problems of results harmonizing and comparability of these methods are mentioned by means of several cases.
Keywords:
liquid biopsy – Genomics – PCR – NGS – cfDNA – ctDNA – miRNA
Autoři: B. Friedecký
Působiště autorů: Ústav klinické biochemie a diagnostiky FN Hradec Králové
Vyšlo v časopise: Klin. Biochem. Metab., 28, 2020, No. 3, p. 121-126
Souhrn
Sdělení pojednává o možnostech využití velkého potenciálu kapalných biopsií při diagnostice a terapii tumorů v podmínkách rutinních klinických laboratoří. Jde o stanovení cirkulujících DNA (cfDNA a ctDNA) a snad i miRNA. Pro tyto metody se významně rozvíjí produkce a používání komerčních kitů (CDx/IVD). To vytváří podmínky pro jejich aplikaci v rutinních klinických laboratořích. Hlavními výhodami kapalných biopsií je jejich nízká invazivnost, podmiňující možnost častého použití podle potřeb pacientů a kliniků. Metody kapalné biopsie by se měly společně s aplikací big dat, genomiky (metod PCR a NGS), digitalizací diagnostiky („machine learning“) podílet na zásadním převratu v práci rutinních klinických laboratoří a laboratorních profesionálů. A také na vstupu rutinních laboratoří do oblasti precizní, na pacienty orientované medicíny. V práci jsou stručně uvedeny problémy harmonizace kapalných biopsií a informace o úrovni mezilaboratorní a mezimetodické srovnatelnosti.
Klíčová slova:
Kapalné biopsie – genomika – PCR – NGS – cfDNA – ctDNA – miRNA
Kapalné biopsie k diagnostice a monitorování terapie tumorů jsou nesporným kandidátem na brzké rutinní používání genomiky, big dat a metod digitalizované strojové diagnostiky („machine learning“, „deep learning“) v klinických laboratořích. Podstatou této skupiny metod je hodnocení mutací některých genů metodami PCR nebo NGS. Již několik let existují postupy, použitelné nejen pro analýzu tkáňových vzorků v laboratořích patologií, ale také pro klasické laboratorní vzorky tělních tekutin (krevní plasmy a dalších). Jsou známé jako kapalné biopsie (liquid biopsies) a k jejich praktickému využívání je k dispozici již nezanedbatelné množství literatury a zkušeností. Jaké jsou jejich zásadní výhody? Nízká invazivita pro pacienty a možnost častého opakování podle klinických potřeb. Metodologie kapalných biopsií a jejich klíčové analyty jsou uvedeny v Tabulkách 1 a 2. Za první přehlednou, instruktivní práci o principech a perspektivách kapalných biopsií lze považovat článek Maderové a Pantela [1].
Tab. 1. Main methods used in liquid biopsies 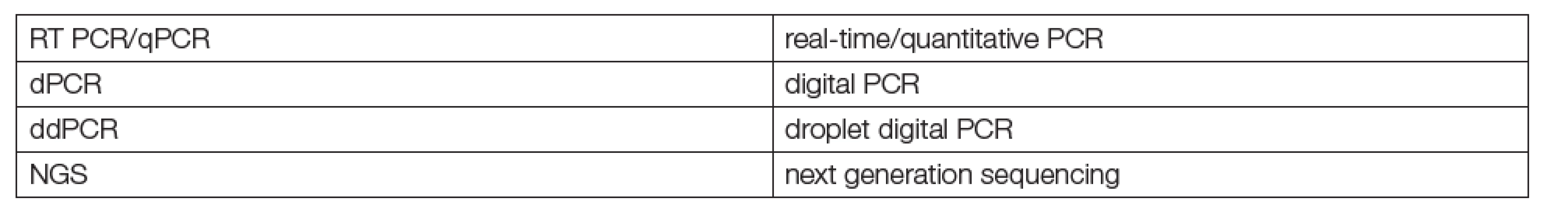
Tab. 2. Main analytes used in liquid biopsy 
Klíčovým faktorem k možnosti aplikace kapalných biopsií v rutinních laboratořích je stav vývoje diagnostických testů výrobců-CDx (companion diagnostics test), uvedených na trh a validovaných FDA, analogických IVD-In Vitro Devices v zemích EU. První (od roku 1998) využívaly metod imunohistochemie a byly určené k testování vzorků tkání, od roku 2016 to již byly kapalné biopsie, nejprve s hodnocením mutací genů EGFR a PIK3CA a pak i dalších (KRAS a jiné) ve vzorcích krevní plasmy [2]. Teprve masová produkce CDx (IVD) kitů umožní intenzivní používání kapalných biopsií v rutinní laboratorní praxi. Momentálně můžeme pozorovat nedořešení administrativních problémů s kity CDx/IVD v zemích EU, kde nebyl dosud vypracován způsob jejich značení CE, bez kterého není možný přístup na trh.
Diskuse expertů kapalné biopsie v časopise Clin Chem [2] shrnuje jejich aktuální problémy následně:
- Potřeba standardizace preanalytické fáze, která je zde extrémně náročná
- Harmonizace mezi výsledky testů v tkáních a kapalnou biopsií
- Harmonizace mezi jednotlivými kity různých výrobců CDx (vlivy hodnot LoD, matricí vzorků, kalibrace metod)
- Nezbytnost kooperace s geneticky vzdělanými pracovníky při interpretaci výsledků
Experti jednoznačně předvídají velký potenciál rutinního používání kapalných biopsií.
Metody, analyty, vyšetření
Jsou stručně shrnuty v Tabulkách 1-3. Metody vyžadují pořizování přístrojových platforem pro metodiky k provádění genomických vyšetření na bázích PCR nebo NGS, na jejichž obsluhu sice nejsou pracovníci rutinních klinických laboratoří ani školeni, ani cvičení, nicméně, které jsou už řadu let používány na mikrobiologických, genetických, patologických a zejména pak na mnoha soukromých pracovištích vcelku běžně. Zkušenosti s platformami Taqman (PCR), Illumina (NGS) a podobnými jsou již letité a běžně dostupné v dokumentaci výrobců (Roche, Thermo Fisher, Bio-Rad, Abbott). Jen je třeba se o ně zajímat co nejaktivněji. V tabulce 2 jsou uvedeny hlavní entity vyšetřování kapalných biopsií. Zdá se, že v současnosti jsou nejnadějnější cfDNA a specifičtější, ale vlivem nižší analytické senzitivity obtížnější ctDNA. V tabulce 3 je pak orientační přehled genů, jejichž mutace jsou obvyklým cílem kapalných biopsií. Většinou se pracuje s 1-4 geny, které se osvědčily již při biopsiích tkání. Větší počet hodnocených genů je spíš doménou NGS metod (targeted), jinak postačí techniky PCR. Je řada důvodů pro nasazení těchto metod do rutinního používání a situace kolem Covid-19 ukázala víc, než názorně, že čas pro to je již dávno tady.
Tab. 3. Main gene mutations tested in liquid biopsy 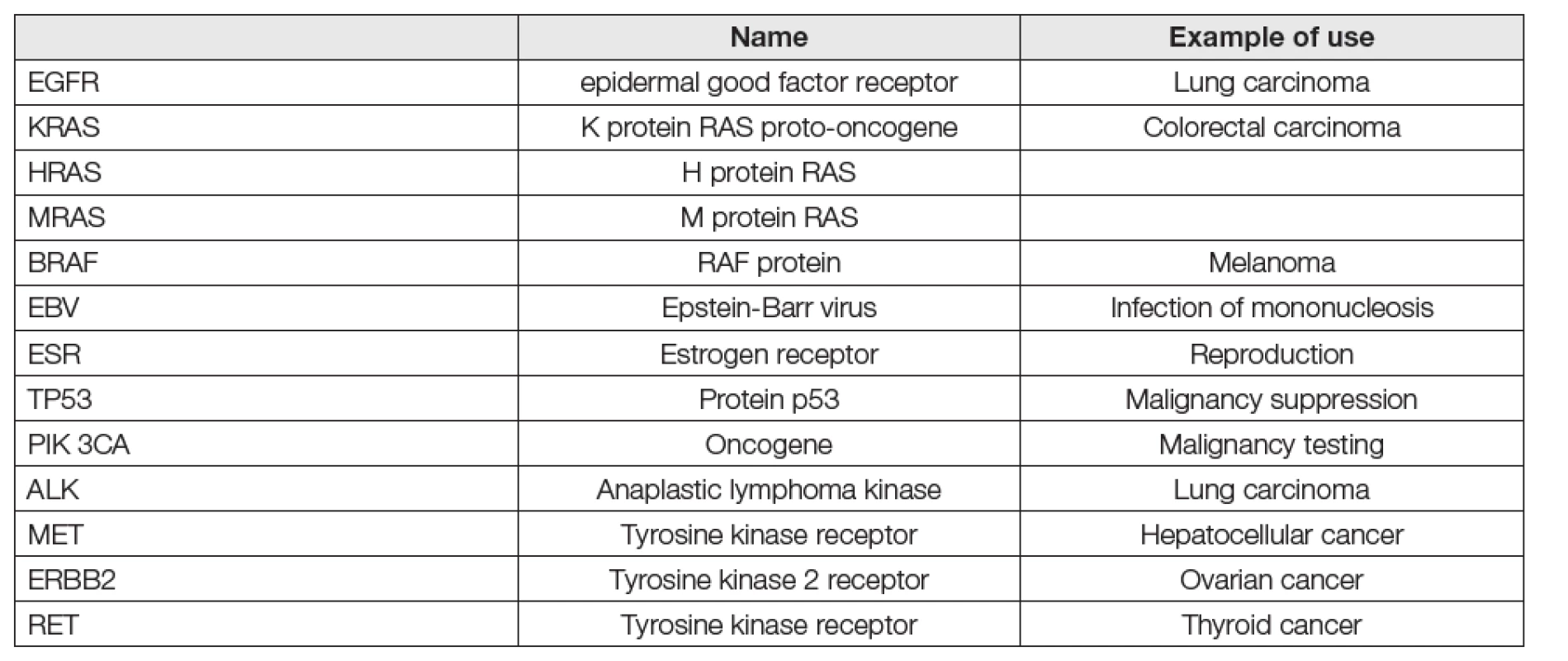
Preanalytika
Zásadní podmínkou úspěšnosti metod kapalné biopsie je dosažení dostatečné úrovně harmonizace a ta zde začíná velkými nároky na preanalytickou fázi:
- Potřeba speciálních odběrových zkumavek: typy PAXgene, Roche, Streck, Norgen, CellSave [3]
- Podmínky centrifugace (rychlost, doba) jsou klíčové a nestejné pro různé analyty [4]
- Počty trombocytů a podmínky skladování vzorků velmi silně ovlivňují stanovení cfDNA i miRNA [5]
- Ani odběrové zkumavky, jmenovitě určené pro odběr kapalných biopsií nejsou zárukou dostatečné srovnatelnosti a jejich testy neposkytují u různých autorů totožné výsledky [3, 6]. Podle nejkomplexněji vypadající studie [5] byly nejstabilnější odběry do zkumavek Norgen (jak pro miRNA, tak pro cfDNA). Další srovnávané byly PAX, Roche, Streck.
- Silně ovlivňujícími faktory byly metody extrakce ze vzorku biologického materiálu, druhy použitých antikoagulancií, hemolýza, trombocytóza, zatímco vliv použitých metod PCR nebyl tak velký [7].
- Vysoce signifikantní diference jsou mezi sérem a plasmou, plasma je vhodnější; podrobně studováno nedávno u stanovení ctDNA [8].
CellSearch
Jedná se o více než 15 let fungující, průběžně inovovaný systém detekce a kvantifikace cirkulujících tumorových buněk (CTC), pocházejících z epitelových tkání. Jde o první funkční test kapalných biopsií, navíc s certifikací FDA. Tumorové buňky jsou separovány imunomagneticky a detekovány fluorescenční reakcí. Metoda se uplatnila zejména při detekci metastáz karcinomu prsu a kolorektálního karcinomu. Systém má podobu poloautomatické platformy [9].
Podrobná analýza struktury a složení cirkulujících tumorových buněk CTC je publikovaná v recentní práci [10]. Práce popisuje jejich genomiku (sedm genů), proteomiku (proteiny jejich povrchových membrán) a transkriptomiku (jejich miRNA).
Cirkulující volná DNA (cfDNA)
Na webových stránkách IFCC www.ifcc.org lze od září 2019 vyhledat údaje o pracovní skupině WG-cfDNA (cell-free DNA and related circulating biomarkers), která má přímou souvislost s problémy realizace kapalnými biopsiemi a seznámit se s jejími plány činnosti. Jde o harmonizaci preanalytiky, formulaci analytických požadavků a na tvorbu programů EHK. Samotný fakt ustanovení této pracovní skupiny silně podporuje domněnku, že rutinní provádění kapalných biopsií se blíží.
Důležité informace o cirkulujících tumorových buňkách a s nimi souvisejících nukleových kyselinách (cfDNA, ctDNA, miRNA) jsou k nalezení v databázích na adresách:
- www.cancer-id.eu (cancer treatment and monitoring through identification of circulating tumour cells and tumor relating nucleic acids in blood)
- www.nci.gov (US National Cancer Institute. Liquid Biopsy 2019)
Tyto a podobné databáze budou zřejmě patřit k základním pracovním nástrojům laboratorních profesionálů, kteří budou kapalnými biopsiemi a vůbec aplikacemi genomiky pověřováni.
Perspektivy, srovnání, multicentrické studie
Certifikovaný referenční materiál pro metabolomiku SRM-NIST 1950 obsahuje referenční hodnoty pro řadu analytů: substráty, elektrolyty, stopové prvky, aminokyseliny, hormony, vitaminy, mastné kyseliny, získané metodami hmotnostní spektrometrie. Materiál byl prověřen několika velkými multicentrickými studiemi, zahrnujícími 189 analytů a shledán cenným. Medián hodnoty preciznosti pro celý soubor laboratoří a všech analytů byl CV% = 6,7. U 83 % měření bylo dosaženo hodnot CV% ≤ 20 a u 82 % měření systematické chyby ≤ 20 % [11].
Grail testy firmy MDDI (Menlo Park US) mají za cíl vyvinout metody detekce až 12 druhů karcinomů kapalnou biopsií v séru a 20 druhů tkáňovou biopsií na bázi metylace cfDNA. Součástí plánu je tvorba databáze CCGA-Circulating Cell-free Genomic Atlas, nezbytné pro interpretaci výsledků [12].
Na webovýh stránkách německého Refererenčního institutu v Bonnu (http://www.dgkl-rfb.de) jsou volně dostupné výsledky programu EHK ctDNA. Provádí se dvakrát ročně. Testují se tři mutace EGFR, BRAF, KRAS. Počet účastníků 2019 se pohyboval mezi 22-31 ze 7-9 zemí [13].
Porovnání metod NGS a dPCR (digitální PCR) pro detekci devíti mutací genů u plicního karcinomu (EFGR, KRAS, BRAF, PIK3, ALK, TP53, MAR2K, ERBB2, MET) ukázalo velmi dobrou shodu hodnocení u obou metod [14].
Další recentní evropská multicentrická studie stanoveni cfDNA důkladně srovnávala výsledky při použití dvou typů odběrových zkumavek (Streck, PAX), devíti způsobů extrakce DNA, čtyř metod vlastního měření (2x ddPCR a 2x NGS). Výsledky jsou zamýšleny jako základ budoucího EBM doporučení o preanalytických a analytických postupech stanovení cfDNA. Studii organizovala Innovative Medicines Initiative Consortium CANCER-ID (http://cancer-id.eu). Podílelo se na ní 32 evropských autorů, materiály byly poskytnuty biobankou IBBL, Luxemburg [15].
Velmi zajímavý a extrémně důležitý pro představu o současné úrovni kvality stanovení je program externího hodnocení kvality s účastí 92 australských a čínských laboratoří od výzkumných pracovišť k laboratořím rutinním [16]. Bylo použito pěti kontrolních vzorků s obsahem, čtyř genů (EGFR, HRAS, NRAS, BRAF) a šesti jejich genotypů Pro hodnocení bylo jako indikátoru kvality použito hodnot Z-skóre. 71 laboratoří použilo metodu NGS, 18 metodu dPCR, dvě zbývající metodu microassay-čipové analýzy. Shodnost výsledků byla v intervalu 92, 5-98, 3.
Další přehled metod cfDNA s důrazem na možné chyby preanalytické fáze, řešené odběrem do speciálních zkumavek (viz výše), na možné chyby metody ddPCR (Bio-Rad), na chyby při extrakci DNA u hodnocení důležitých genových mutací (BRAF, EBV, EGFR, ESR, HRAS, TP53, PIK 3CA) je uveden v review [17].
V séru bylo zatím identifikováno přes 2800 miRNA. Složitost interpretace multiplexních analýz v séru použitím RTqPCR vyhodnocené 566 miRNA patrně vyžaduje použit k optimalizaci vyhodnocení náročných počítačových programů typu „machine learning“ i „deep learning“ [18]. Tyto problémy by měly být vzaty do úvahy, jak reagovat na počínajícím úsilí některých výrobců stanovení miRNA nabízet.
V tabulce 4 jsou shrnuta data, potřebná k standardizaci a srovnatelnosti výsledků miRNA [19]. Řešení problémů standardizace miRNA je stále na počátku a zejména chybí zatím obecně akceptovaný standardizační postup a obecně akceptované referenční geny [20].
Tab. 4. List of questions for standardization of miRNA measurement 
Vcelku lze říci, že z hlediska harmonizace a srovnatelnosti je sice nutno vykonat řadu práce, ale prozatímní výsledky jsou nadějné.
Kapalné biopsie v rutinních klinických laboratořích
Proč by měly být metody kapalné biopsie bez velkého zdržování zařazeny do repertoáru aspoň větších rutinních klinických laboratoří? Tvoří součást procesu digitalizace laboratorní medicíny. Na používání big dat, jejich velkého množství, zpracovaného za použití „umělé inteligence“ programy, které jsou již dobře vyzkoušeny. Tvorba EHR-electronic health results jako nástroje diagnostiky a terapie. Doposud byla laboratorní data v obrovském počtu obvykle bez užitku skladována (a ztrácena). Zpracování big dat do podoby diagnostického nástroje je primárně podmíněné jejich obrovským počtem, získávaným zejména genomickými metodami (obzvláště metodami NGS) a sekundárně právě možností jejich zpracování pomocí metod AI (arteficial intelligency). V současnosti je možné vyústění big dat do programů strojové diagnostiky - „machine learning“nebo do sítě biomarkerů „deep learning“. Všechno to je pak nezbytným nástrojem precizní medicíny, kam kapalné biopsie nepochybně patří [21-23].
Je také logické a nebezpečné, že v případě nezájmu o tyto metody se vždy najdou subjekty, které využijí situace k realizaci svých komerčních zájmů, subjekty, od nichž nemůžeme očekávat kooperaci s klinickými pracovišti [22]. Tato skutečnost by měla znít našim laboratořím důvěrně známě. A údaje Tabulek 5 a 6 zřetelně ukazují, že digitalizace medicíny a laboratoří nejsou zdaleka již záležitostí exkluzivní, určené pouze pro zvídavé jedince, ale právě naopak faktem, indikujícím budoucnost, rozvoj a životaschopnost rutinních klinických laboratoří.
Tab. 5. Increasing the frequency of use big data in Pubmed 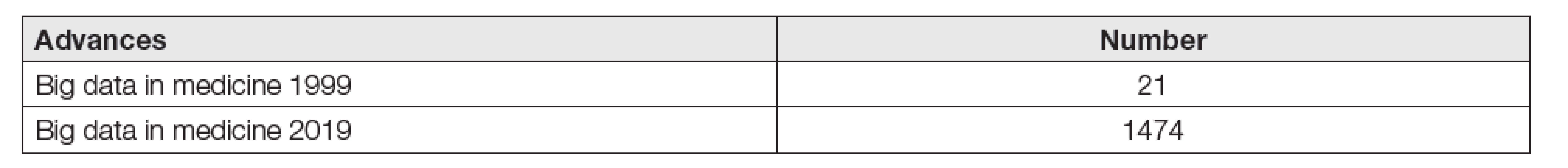
Tab. 6. Machine learning /deep learning. Frequency of publication in 2019 
Limitujícím faktorem je dosavadní profesionální a odborné zaměření laboratorních profesionálů, jehož reálný stav a odbornou způsobilost v oblasti digitalizace a genomiky je dost troufalé predikovat. Nicméně na druhé straně je jasné, jaký typ pracovníků (zejména mladých) bude v laboratořích nezbytný, aby bylo držení kroku s požadavky velmi blízké budoucnosti vůbec možné.
Převrat v laboratorní medicíně, sestávající z aplikací big dat, genomiky (včetně kapalných biopsií, zásadní digitalizace a ustanovení precizní medicíny, je již cca 3 roky brán jako vývojový trend, který je nezbytné respektovat. Soudobý přístup k laboratorní medicíně v ČR, založený na číselníku metod, sdílení kódu pojišťoven, atomizaci na autonomní podobory, je beznadějně zastaralý a v příkrém rozporu s tímto trendem.
Několik zajímavých aplikací v klinické praxi
Velmi dobře se metoda stanovení cfDNA uplatňuje při screeningu Downova syndromu [24, 25]. Ve srovnání se standardní metodou screeningu se při použití cfDNA (metoda NGS Illumina) snížila falešná pozitivita na 0,3 % z původních 3,6 % a hodnota NPV byla prakticky 100 %. Bylo dosaženo četnosti použití cfDNA u 50 % pacientů oblasti Rhode Island (Providence). První provedený cyklus EHK (CAP US) měl 59 participantů, 70 % z nich použilo metody NGS. Bylo zaznamenáno velké zlepšení diagnostiky [26].
Velmi zajímavá je korejská práce o měření ctDNA metodou ddPCR (droplet digital PCR) po předchozí extrakci cena, jehož je ctDNA částí [8]. Byla použita metoda ddPCR výrobce Bio-Rad a hodnoceny mutace genu KRAS. Popisuje jasnou prioritu použití EDTA plasmy vůči séru při paralelních analýzách u stejných pacientů ve stejných časech.
Etické problémy metod kapalné biopsie
Mají souvislost s aplikací umělé inteligence a big dat [21, 22] i s riziky, která s oběma přístupy běžně souvisí. S možností zneužití dat a s neosobním, nehumánním přístupem k pacientům. Z aspektů, které nejčastěji patří do řešení etických rizik, uvádíme [27]:
- Použité zařízení a postupy jsou přístupné nezávislému testování
- Eliminace zneužití reklamy pro jiné, než zdravotnické potřeby
- Ochrana osobních dat pacientů při práci s big daty
Procesy digitalizace jsou nezastavitelné, schopné poskytovat velký benefit pacientům, ovšem za předpokladu, že ani v nejmenším nepovedou k omezování humanitárních aspektů zdravotnictví.
Biobanking
Biobanky jsou nenahraditelným zdrojem stabilizovaného materiálů vzorků tělesných tekutin a tkání a jejich dat o původu a složení (včetně sekvencí DNA/RNA), potřebných pro výzkum, experimenty, validace a externí hodnocení kvality v moderní laboratorní medicíně. Biobanking se týká postupů získávání, skladování a zacházení jak se vzorky tekutin a tkání, tak i registru příslušných dat vzorků. Názory a zkušenosti panelu diskutujících expertů, probírající aspekty biobankingu byly publikovány v Clinical Chemistry [23]. Zásadním obsahem pravidel biobankingu jsou:
- dokonalá preanalytika při skladování materiálů,
- důkladné SOP pro registry dat,
- harmonizace s etickými pravidly a zásadami ochrany dat (GDPR).
Problémům biobankingu a všech jeho aspektů bylo věnováno celé speciální číslo časopisu J Lab Med 2019, 43, 6. V uvedených pracích lze naleznout dostatek poznatků o dílčích problémech procesu [28]:
- centralizace, organizace, sítě biobank,
- automatizace procesů, mechanismy,
- kryoprezervace, kryozkumavky,
- možnost skladování při extrémně nízkých teplotách (až -190°C),
- současná kapacita (miliony zkumavek),
- norma kvality biobankingu ISO20387 : 2018,
- demonstrace nejčastějších zdrojů chyb [29].
První výsledky dotazníku o preanalytickém zacházení se vzorky krve pacientů, určenými k dalšímu výzkumu v genomice, proteomice a metabolomice (v biobankingu) v dánských laboratořích a institucích ukazují (podle očekávání) nedostatečně nízkou harmonizaci postupů a nutnost jejího zlepšení [30].
Autor prohlašuje, že není ve střetu zájmů.
Do redakce došlo 31. 3. 2020.
Adresa pro korespondenci
RNDr. Bedřich Friedecký, Ph.D.
Střelničná 1680
182 00 Praha 8
e-mail: friedecky@sekk.cz
Zdroje
1. Mader, S., Pantel, K. Liquid Biopsy. Current status and Future Perspectives. Oncol. Res. Threat., 2017, 40, p. 404-408
2. Tsui, D. W. Y., Blumenthal, G. M., Phillip, R. et al. Development, Validation and Regulatory Considerations for a Liquid Biopsy Test. Clin. Chem., 2020, 66, p. 408-414
3. Sorber, L., Zvaenepoel, K., Jakobs, J. et al. Specialized Blood Collection Tubes for Liquid Biopsy: Improving the Pre-analytical Conditions. Mol. Diagn. Ther., 2019, https://doi. org/10171/s40291-019-00442cx
4. Sorber, L., Zvaenepoel, K., Jakobs, J. et al. Circulation Cell-Free DNA and RNA Analysis in Liquid Biopsy: Optimal Centrifugation Protocols Cancers, 2019 DOI:10. 3390/cancers11040458
5. Faraldi, M., Sansoni, V., Perego, S. et al. Study of preanalytical Variables Affecting the Measurement of Clinically Relevant Free-Circulating microRNA“Focus on Sample Matrix, Platelet Depletion and Storage Conditions. Biochem. Med., (Zagreb) 2019, 30, 010703
6. Ward, G. A., Lenhardt, J., Witte, T. et al. Evaluation of Storage Tubes for Combined Analysis of Circulating Nucleic Acids in Liquid Biopsies, Int. J Mol. Sci., 2019, DOI:10. 3390/ijms20030704
7. Feng, X., Lin, Y., Wan, N. Plasma microRNA detection standardization test. JCCA, 2019, https://doi.org/10.1002/jcla23059
8. Lee, J. S., Kim, M., Seong, M.-W. et al. Plasma vs Serum in circulating tumor DNA measurement: characterization by DNA fragment siting and digital droplet polymerase chain reaction. Clin. Chem. Lab. Med., 2020, 58, p. 527-532
9. Beije, N., Jager, A., Sleijfer, S. Circulation tumor cell enumeration on by the CellSearch syslem. the clinician guide to breast cancer treatment? Cancer Treat. Rev., 2015, 41, p. 144-150
10. Cortés-Hernandez, L. E., Eslani, Z., Pantel, K., Panabinás, C. A. Molecular and Function Characterization of Circulation Tumour Cells: From Discovery to Clinical Application. Clin. Chem., 2019, doi:10. 1373/clinchem-2019. 303586.
11. Siskos, A. P., Pooja, J., Margl-Romisch, W. et al. Inter-laboratory Reproducibility of a Targeted Metabolomics Platform for Analysis of Human Serum and Plasma. Anal. Chem., 2017, 89, p. 656-665
12. AACC Smart Brief 2020 Feb 19. Grail Conducts Interventional Trial of Multi-cancer blood test
13. http://www.dgkl-rfb.de Referenzinstitut fur Bioanqlytic. Ringversuch ctDNA 2019
14. Provencio, M., Peréz-Barrios, C., Barquin, M. et al. Next-generation sequencing for tumor station quantification using liquid biopsies. Clin. Chem. Lab. Med., 2020, https://doi. org/10. 1515/cclm-2019-0745
15. Lampignano, A., Neumann, M. H. D., Weber, S. et al. Multicenter evaluation of Circulating Cell-Free DNA Extraction and Downstream Analyses for the Development of (Pre)analytical Work Flow. Clin. Chem., 2020, 66, p. 149-160
16. Chai, S. Y., Peng, R., Zhang, R. et al. External Qua-lity Assurance of Currentr Technology for the Testing of Cancer-Associated Circulating Free DNA Variants. Pathog. Oncol. Res., 2019, http://doi. org/10. 1007/s12253-019-0074-8
17. Jiang, F., Yang, X., He, X., Yang, M. Circulating DNA, A Potentially Sensitive and Specific Diagnostic Tool for Future Medicine. Dose-Response, 2019, doi.10.1177/1559325819891010
18. Zhao, X., Kang, J., Svetnik, V. et al. A machine learning approach to identify a circulating microRNA signatur for Alzheimer Disease. J Appl. Lab. Med., 2019, doi:10.1373/jalm. 2019. 029595.
19. Faraldi, M., Gamarasca, M., Banfi, G., Lombardi, G. Free Circulating miRNAs Measurement in Clinical Settings:The Still Unsolved Issue of the Normalization. Adv. Clin. Chem., 2018, 87, p. 113-139
20. Donati, S., Ciuffi, S., Brandi, M. L. Human circulating miRNA Real-Time qPCR-based Analysis. An Overview of Endogenous Reference Genes Used for Data Normalization. Int. J Mol. Sci., 2019, doi:10.3390/ijms20184353
21. Tolan, N., Parnas, M. Big data in laboratory medicine. Clin. Chem., 2015, 61, p. 1433-1440.
22. Badrick, T. Banfi, G., Bietenbeck, A. et al. Machine Learning in Clinical Chemists. Clin. Chem., 2019, doi:10.1373/clinchem. 2019.309812
23. Lippi, G., Plebani, M. Integrated diagnostics. the future of Laboratory Medicine? Biochem. Med., (Zagreb) 2020, 30, 010501.
24. Bianchi, D. W., Lamar Parker, R., Werworth, J. et al. DNA sequencing versus standard prenatal aneuploidy screening. N Engl. J Med., 2014, 37, p. 799-808
25. Palomaki, G. E., Kloza, E. M., O´Brien, B. M. et al. The clinical reliability of DNA based screening for fetal aneuploidy screening by primaty obstetrical care providers in the general frequency population. Genet. Med., 2017, 17, p. 778-786
26. Palomaki, G. E., Wyath, P., Glen-Best, R. et al. Assessment of laboratories offering cell free (cf)DNA screening for Down syndrome: results of the 2018-College of American Pathology External Educational Exercises. Genet. Med., 2020, doi:10.1038/s41436-019-0718-4
27. AACC. Ethics of AI and Big Data in Laboratory Medicine. Clin. Lab. News, Jan-Feb 2020
28. Kirwan, J. A., Keddurah-Daouk, R., Mitchell, T. et al. Biobanking for Metabolomic and Lipidomic in Precision Medicine. Clin. Chem., 2019, doi:10.1373/clinchem.2018.298620
29. Baber, R., Kiehntopf, M. Automation in biobanking from a laboratory medicine perspective. J Lab. Med., 2019, 43, p. 329-338
30. Gils, C., Nybo, M. Quality kontrol of preanalytical handling of blood samples for future research: a national survey, J Appl. Lab. Med., 2019, doi:10-1373/jalm.2019.029942
Štítky
Biochemie Nukleární medicína Nutriční terapeut
Článek Editorial
Článek vyšel v časopiseKlinická biochemie a metabolismus
Nejčtenější tento týden
2020 Číslo 3- Moderní přístupy zvyšující efektivitu antibiotické léčby v nemocniční praxi
- Význam výživy v léčbě nehojících se ran – prakticky a v kostce
- Zpracované masné výrobky a červené maso jako riziko rozvoje kolorektálního karcinomu u žen? Důkazy z prospektivní analýzy
- GLP-1RA a PCOS: Je to „jenom“ o hmotnosti?
- Efektivita léčby a možné indikace liraglutidu v gynekologii
-
Všechny články tohoto čísla
- Vitamin D - prevence a léčba u dětí a dospívajících
- Vitamin D a kardiovaskulární choroby. Co víme v roce 2020?
- Vitamin D 2019 - standardizace i chaos. Miniaturní model prezentace vědy v současnosti.
- Současný stav kontinuálního sledování glukózy. Minirewiew.
- Kapalné biopsie se přibližují rutinním klinickým laboratořím
- Čestné členství ČSKB pro doc. RNDr. Kristiana Šafarčíka
- Editorial
- Laboratorní diagnostika COVID-19
- Laboratorní aspekty COVID-19. Diagnostika, epidemiologie, prognóza pacientů.
- Klinická biochemie a metabolismus
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Laboratorní diagnostika COVID-19
- Vitamin D - prevence a léčba u dětí a dospívajících
- Vitamin D 2019 - standardizace i chaos. Miniaturní model prezentace vědy v současnosti.
- Vitamin D a kardiovaskulární choroby. Co víme v roce 2020?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



