-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Celiakie – současný pohled na etiopatogenezi, diagnostiku a terapii
Coeliac disease
Coeliac disease is a common lifelong autoimmune disorder triggered by gluten consumption in genetically predisposed patients. Chronic inflammatory response damages the mucosa of the small intestine resulting in villous atrophy with chronic maldigestion and malabsorption. Untreated coeliac disease may present with a variety of intestinal and extraintestinal symptoms and complications, the most serious of which is a small intestine lymphoma. The diagnosis is usually established by specific serology markers and villous atrophy in duodenal biopsy. The causal and, in most cases, effective treatment modality is a strict and life ‑ long gluten‑free diet that leads to regeneration of the intestinal mucosa and reduces the risk of serious complications.
Keywords:
coeliac disease – gluten – malabsorption – gluten‑free diet
Autoři: Přemysl Falt 1,2
; P. Fojtík 1; V. Šmajstrla 1
Působiště autorů: Centrum péče o zažívací trakt, Vítkovická nemocnice, Ostrava 1; LF OU v Ostravě 2
Vyšlo v časopise: Kardiol Rev Int Med 2014, 16(3): 219-223
Kategorie: Interní medicína
Souhrn
Celiakie je časté celoživotní autoimunitní onemocnění spuštěné konzumací lepku u geneticky predisponovaných jedinců. Chronické zánětlivé změny vedou k poškození sliznice tenkého střeva s následnou vilózní atrofií provázenou chronickou maldigescí a malabsorpcí. Neléčená celiakie je spojena s širokým spektrem střevních a mimostřevních obtíží a komplikací, z nichž nejzávažnější je lymfom tenkého střeva. Zlatým standardem diagnostiky je stanovení specifických autoprotilátek a průkaz vilózní atrofie v biopsii z duodenální sliznice. Kauzální a ve většině případů efektivní léčbou je celoživotní striktní bezlepková dieta, která vede k restituci sliznice tenkého střeva a snížení rizika závažných komplikací.
Klíčová slova:
celiakie – gluten – malabsorpce – bezlepková dietaÚvod
Celiakie (celiakální sprue, gluten ‑ senzitivní enteropatie, nontropická sprue) je celoživotní geneticky podmíněné autoimunitní onemocnění spuštěné konzumací obilovin s obsahem lepku (gluten) a manifestující se atrofií tenkého střeva s následnou malabsorpcí. Klinické projevy celiakie jsou velmi různorodé od plně rozvinutého malabsorpčního syndromu po izolované extraintestinální manifestace. Vzhledem k polymorfní symptomatologii, častému výskytu, možnosti kauzální léčby a riziku závažných komplikací při neléčeném průběhu je znalost onemocnění vhodná napříč lékařskými specializacemi.
Historie
Onemocnění, pravděpodobně odpovídající celiakii, poprvé popsal Aretaeus z Kapadocie v 1. století n. l. Samuel Gee popsal v roce 1888 klinické projevy celiakie ve všech věkových kategoriích a jako jedinou možnou léčbu navrhuje dietu. Vztah mezi celiakií a některými druhy obilnin popsal v polovině 20. století holandský pediatr Willem Karel Dicke, který při nedostatku pečiva v průběhu 2. světové války pozoroval zlepšení stavu dětí s celiakií. Van de Kamer následně identifikoval glutenovou frakci jako příčinu vzniku celiakie. V 50. letech 20. století byly popsány typické změny na sliznici tenkého střeva, v 80. letech asociace onemocnění s haplotypem HLA‑DQ2 a v 90. letech byl popsán enzym tTG ‑ 2 jako hlavní autoantigen, což vedlo k rozvoji sérologické diagnostiky celiakie [1].
Epidemiologie
Celiakie je jednou z nejčastějších příčin malabsorpce. Celosvětově se výskyt odhaduje na 1 : 70 – 550 (Evropa, USA, severní Afrika). Prevalence v ČR se odhaduje na 1 : 200 – 250. Předpokládá se, že diagnostikováno a sledováno je pouze asi 10 – 15 % nemocných [2]. V populaci dominují atypické formy celiakie s nespecifickými příznaky. Klasicky probíhající celiakie tvoří pouze „špičku ledovce“ („celiac iceberg“). Vzestup výskytu diagnostikované celiakie lze vysvětlit lepší diagnostikou, stoupajícím povědomím lékařů všech odborností i laické veřejnosti a zřejmě i faktory zevního prostředí (tab. 1).
Tab. 1. Klasifikace celiakie („celiakální ledovec“). 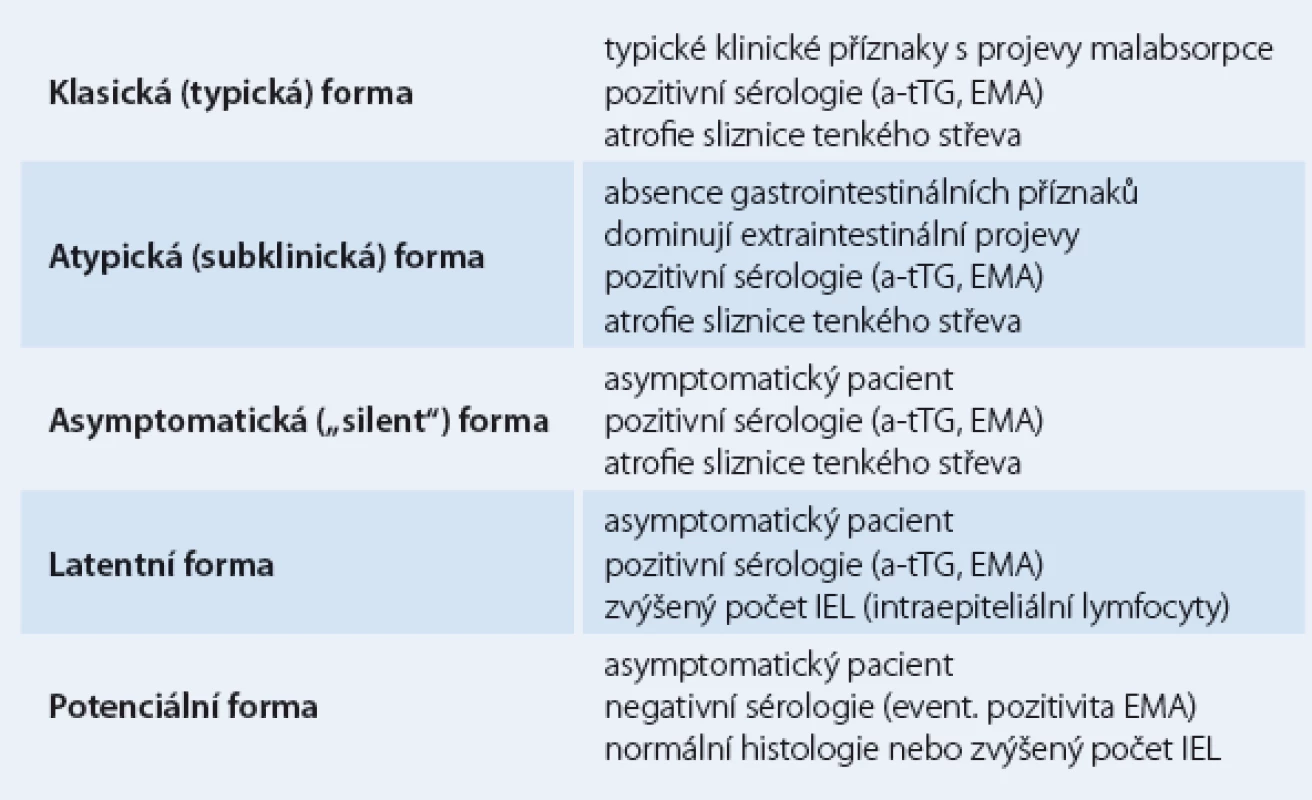
Obr. 1. Fyziologická sliznice duodena u pacienta s funkční dyspepsií. 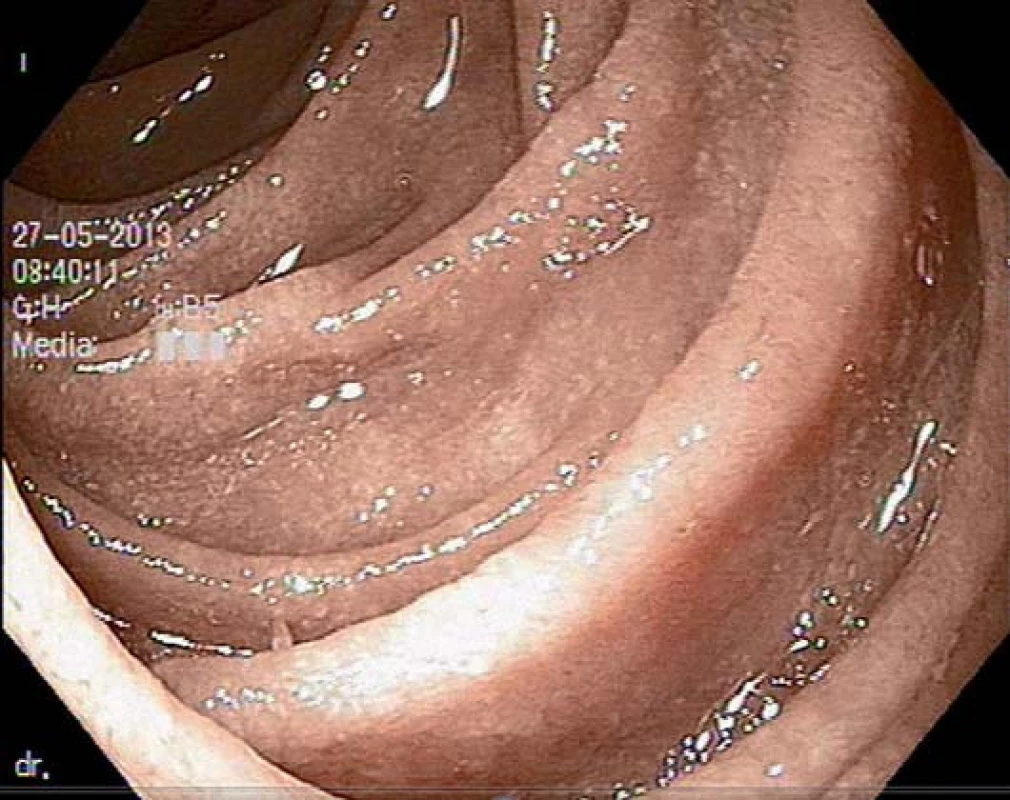
Obr. 2. Atrofická sliznice duodena u pacienta s celiakií. 
Etiopatogeneze
Genetické faktory
Genetická predispozice je asociována s HLA geny II. třídy s autozomálně dominantní dědičností s nekompletní penetrancí. Konkordance u prvostupňových příbuzných je 8 – 18 % a mezi jednovaječnými dvojčaty dosahuje 70 %. Povrchový glykoprotein HLA‑DQ2 je kódován alelami DQ a1*0501 nebo méně často DQ a1*0201 (MHC, chromozom 6p), je zodpovědný za vazbu antigenních peptidů a je přítomen asi u 95 % evropských pacientů. Jen několik procent výskytu je asociováno s HLA‑DQ8 (alela DQ a1*0301 / DQ b1*0302). Pozitivita HLA‑DQ2 je popisována až u 25 – 35 % zdravé evropské populace. Negativní prediktivní hodnota absence obou typů HLA se blíží 100 % a prakticky vylučuje vznik onemocnění [3,4].
Zevní faktory
Proteiny pšenice se rozdělují podle rozpustnosti na prolaminy (rozpustné v etanolu), gluteniny (částečně rozpustné v kyselém nebo zásaditém roztoku), globuliny (rozpustné v 10% roztoku NaCl) a albuminy (rozpustné ve vodě). Termín gluten zahrnuje jak prolaminy, tak gluteniny. Za toxicitu jsou zodpovědné zejména prolaminy, které se v zrnech pšenice nazývají gliadin (sekaliny u žita, hordeiny u ječmene a aveniny u ovsa). Toxicita prolaminů u jednotlivých druhů je dána jejich genetickou příbuzností. Pšenice, žito a ječmen patří do společné skupiny Triticinae, zatímco nejméně toxický oves je z jiné skupiny Aveneae. Ještě vzdáleněji příbuzné obilniny (rýže, kukuřice, čirok, proso) onemocnění nevyvolávají. Prolaminy jsou unikátní vysokým obsahem prolinu (asi 15 %) a glutaminu (asi 30 %), který zodpovídá za relativně špatnou digestibilitu v tenkém střevě (prolin) a současně představují substrát pro enzym tkáňovou transglutaminázu t ‑ TG2 (glutamin), která dále zvyšuje imunogenicitu proteinových fragmentů. Gliadin může být elektroforeticky rozdělen do čtyř frakcí (α, β, γ, ω) s molekulovou hmotností 20 – 75 kd. V roce 2000 byl identifikovaný epitop aktivující T lymfocyty – parciálně deamidovaná složka α ‑ gliadinu o délce 56 – 75 aminokyselin [1].
Imunitní faktory
Hlavní úlohu v patogenezi celiakie hraje komplexní imunitní systém sliznice tenkého střeva (GALT – Gut Associated Lymphoid Tissue). Gliadin je absorbován enterocyty a prezentován ve spojení s HLA‑DQ2 na povrchu antigen prezentujících buněk pomocným T lymfocytům, které indukují komplexní imunitní reakci s produkcí řady cytokinů (IL‑4, IL‑15, IFN ‑ γ, TNF‑α) a aktivací dalších T ‑ , B lymfocytů a NK buněk, což vede k postupné destrukci enterocytů a vilózní atrofii. Současně dochází k mohutné protilátkové odpovědi se vznikem řady v séru detekovatelných protilátek – AGA (antigliadinové protilátky), a ‑ DGP (protilátky proti deamidovanému gliadinu), EMA (antiendomyziální protilátky) a a ‑ tTG ‑ 2 (protilátky proti tkáňové transglutamináze). tTG ‑ 2 je ubikviterním enzymem, je specifickým antigenem endomyzia a podílí se deamidací neutrálního gliadinu na vzniku negativně nabitých kyselých peptidových fragmentů s vysokou afinitou k HLA‑DQ2 [1].
Diagnostika
Diagnostika celiakie se opírá o doporučené postupy ESPGHAN revidované v roce 1990 s nutností splnění následujících kritérií [5]:
- Anamnéza a klinické příznaky kompatibilní s celiakií.
- Pozitivita protilátek asociovaných s celiakií.
- Histologie ze sliznice tenkého střeva kompatibilní s celiakií.
- Vyloučení přítomnosti onemocnění s obdobnými klinickými projevy.
- Nemocný je starší než dva roky.
1) Klinické projevy
Typ a tíže klinických projevů závisí na věku, genetické predispozici, délce expozice glutenem, rozsahu a stupni střevního postižení. Projevy mohou být velmi rozmanité od plně rozvinutého malabsorbčního syndromu po zcela asymptomatického pacienta.
Gastrointestinální projevy
Klasická celiakie je častěji vyjádřena v dětském věku. Projevuje se průjmy charakteru steatorey, kolikovitými bolestmi břicha, meteorizmem, flatulencí, anémií, svalovou atrofií, osteopenií, neprospíváním, retardací růstu a psychomotorického vývoje. Časté průjmy mohou vést až k metabolickému rozvratu (celiakální krize).
V pozdějším věku ubývá gastrointestinálních symptomů a převažují extraintestinální projevy. Při podrobné anamnéze ale dospělí pacienti často udávají určité dyspeptické obtíže – břišní dyskomfort, nadýmání, borborygmy, pocit netrávení, zapáchající flatulence, nauzea, váhový úbytek, únava, adynamie a slabost. Častá je i intolerance laktózy v důsledku sekundárního deficitu laktázy. Symptomy se mohou překrývat s příznaky syndromu dráždivého tračníku (IBS). V britské studii byla celiakie diagnostikována u 4,6 % pacientů splňujících Římská kritéria IBS [6]. Silné bolesti břicha nejsou typické a mohou naznačovat přítomnost komplikací jako střevní intususcepce, ulcerativní jejunoileitida a střevní lymfom.
Poměrně častá je rekurentní aftózní stomatitida, která může být jediným příznakem, a většina pacientů dobře reaguje na bezlepkovou dietu [1].
Neléčená celiakie může být spojena s chronickou mírnou elevací sérových transamináz (většinou ALT > AST) při nespecifické reaktivní hepatitidě. U většiny pacientů dochází na bezlepkové dietě k normalizaci [7].
Hematologické projevy
Celiakie je poměrně častou příčinou sideropenické mikrocytární anémie, která je způsobena malabsorpcí železa v orálních částech jejuna. U asymptomatické sideropenické anemie je celiakie diagnostikována až v 10 %, v podskupině pacientů nereagujících na substituci železa až ve 20 % případů [8]. Vzácněji při postižení ilea dochází také k malabsorpci vitaminu B12.
Až u 50 % dospělých pacientů jsou patrny projevy hyposplenizmu nejasné etiologie, u dětských pacientů je vídán vzácně. Při těžší malabsorpci vitaminu K může docházet k projevům hemoragické diatézy [1].
Tab. 2. Doporučené indikace k testování celiakie [13]. ![Doporučené indikace k testování celiakie [13].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/d5ba4d04faaa1a99e2be47b5b5b23f3b.png)
Muskuloskeletální projevy
Poměrně častým nálezem při neléčené celiakii je metabolická kostní choroba; osteopenie je nalézána až u 70 % a osteoporóza až u 24 % pacientů. Hlavní příčinou je malabsorpce kalcia a vitaminu D s následnou sekundární hyperparatyreózou. Roli hraje i celková malnutrice a časnější menopauza [9]. Častá je svalová slabost a při malnutrici svalová atrofie. U dětských pacientů s celiakií lze pozorovat specifické vady zubní skloviny.
Kožní projevy
Dermatitis herpetiformis Duhring je svědivá papulovezikulární dermatitida postihující extenzorovou stranu končetin, hýždě, trup a skalp. Onemocnění je charakteristické kožními IgA depozity a ložiskovou enteropatií neodlišitelnou od celiakie. Zdá se, že Duhringova dermatitida a celiakie jsou velmi blízké, ale odlišné gluten ‑ senzitivní entity. Hlavní léčebnou modalitou je dapson a bezlepková dieta.
Dalšími možnými kožními projevy malabsorpce jsou ekchymózy a petechie (vitamin K), edémy (hypoproteinemie) a folikulární hyperkeratóza (vitamin A) [1].
Neuropsychiatrické projevy
Celiakie může být asociována s nonhereditární ataxií (glutenová ataxie), svalovou slabostí, periferní neuropatií a epilepsií. Poměrně častým příznakem provázejícím neléčenou celiakii je deprese a i pacienti bez zjevných psychiatrických abnormalit v době diagnózy uvádí výrazné zlepšení nálady po zahájení bezlepkové diety.
Urogynekologické projevy
Mezi gynekologické projevy celiakie patří amenorea a opožděná menarche. Neléčená celiakie může být provázena infertilitou a není neobvyklé časné otěhotnění po zahájení bezlepkové diety. Vysoká prevalence celiakie je uváděna i u žen s rekurentními spontánními aborty a intrauterinní růstovou retardací. Snížená fertilita mužů souvisí s impotencí a oligospermií.
Choroby asociované s celiakií
Celiakie je asociována s řadou autoimunitních chorob. U pacientů s diabetes mellitus 1. typu je reportována pozitivita a ‑ tTG a EMA mezi 2,6 a 7,8 % a u většiny z nich byla diagnóza ověřena biopticky [10]. Celiakie může zhoršovat kompenzaci diabetu vzhledem k variabilní absorpci nutrientů. Autoimunitní tyreopatií trpí asi 10 – 20 % nemocných s celiakií a její průběh se nezdá být ovlivněn zahájením bezlepkové diety. Častější je hypotyreóza. Naopak 0,2 – 0,5 % pacientů s tyreopatií se dočká v průběhu života rozvoje celiakie [11]. Známá je i asociace s idiopatickými střevními záněty a mikroskopickou kolitidou. Dalšími známými asociovanými autoimunitními chorobami jsou sklerozující cholangioitida, primární biliární cirhóza, eozinofilní ezofagitida, IgA nefropatie, intersticiální plicní choroby, sarkoidóza, systémový lupus erythematodes, Sjögrenův syndrom a polymyozitida [1].
Asi u 2 % pacientů s celiakií se vyskytuje selektivní deficit IgA, což je asi 20× vyšší prevalence než v kontrolní populaci. Tento stav může vest k falešné negativitě specifických protilátek ve třídě IgA (IgA a ‑ tTG).
2) Laboratorní diagnostika
Sérologické testy stanovující autoprotilátky patognomické pro celiakii se v běžné praxi využívají při screeningu, diagnostice a sledování adherence k dietnímu režimu.
Antiendomyziální protilátky (IgA EMA) jsou se svou specificitou a pozitivní prediktivní hodnotou blížící se 100 % (pozitivní výsledek prakticky potvrzuje celiakii) a senzitivitou kolem 90 % považovány za zlatý standard. Stanovení se provádí metodou nepřímé imunofluorescence, výsledek testu je proto vyhodnocován jako pozitivní a negativní, proto i nízké hladiny jsou vysoce specifické.
Protilátky proti tkáňové transglutamináze (IgA a ‑ tTG) jsou namířeny proti specifickému epitopu endomyzia – tTG ‑ 2, stanovují se metodou ELISA a jejich vyšetření je levnější a snadnější než EMA. Jejich spolehlivost je o něco menší (specificita 95 % a senzitivita 93 %), ale negativní prediktivní hodnota se blíží 100 % (negativní výsledek prakticky vylučuje celiakii). Falešnou pozitivitu můžeme pozorovat u některých autoimunitních chorob. Stanovení a ‑ tTG ve třídě IgG se užívá u pacientů se selektivním deficitem IgA, jejich specificita a senzitivita je ale o něco nižší.
Protilátky proti gliadinu (IgA, IgG AGA) bývají pozitivní u pacientů s neléčenou celiakií, ale se svou nižší specificitou a senzitivitou a nízkou pozitivní prediktivní hodnotou (vysoké procento falešně pozitivních nálezů) nejsou v současné době vhodné k primární diagnostice celiakie. AGA ve třídě IgG mohou být užitečné u pacientů s IgA deficitem.
Protilátky proti deamidovanému peptidu gliadinu (IgA, IgG DGP) jsou namířeny proti deamidovanému peptidu působením tTG a dosahují vysoké přesnosti a nejvyšší pozitivní prediktivní hodnoty. V praxi je lze využít u pacientů s atrofií tenkého střeva a negativitou a ‑ tTG, dále u pacientů s pozitivitou AGA a negativitou a ‑ tTG. Kombinace a ‑ tTG a DGP by se v budoucnu mohla stát přesným diagnostickým testem bez nutnosti biopsie sliznice duodena [1].
3) Histopatologie
Biopsie sliznice tenkého střeva stále zůstává standardním testem potvrzení celiakie. U dětí se provádí metodou kapslové enterobiopsie (Crosbyho kapsle) a u dospělých pacientů při gastroduodenoskopii. Již v endoskopickém obraze lze pozorovat známky vilózní atrofie v podobě snížení a redukce počtu semicirkulárních řas, mozaikového vzhledu sliznice, vroubkování či rýhování sliznice [12]. V současné době je doporučen odběr 1 – 2 vzorků z bulbu duodena a nejméně čtyři biopsie z distální části bulbu duodena. Celiakie se projevuje širokým spektrem histopatologických změn, které se standardně hodnotí podle tzv. Marshovy klasifikace (Marsh 0 = norma, 1 = infiltrativní typ, 2 = infiltrativní ‑ hyperplastický, 3 = destruktivní, 4 = atroficko‑hypoplastický). Mezi hlavní histologické známky celiakie patří zvýšený počet intraepiteliálních lymfocytů, hyperplazie krypt a parciální až totální atrofie klků [13].
Distálnější etáže tenkého střeva je možno vyšetřit enteroskopickými technikami (push enteroskopie, jedno ‑ a dvoubalonová enteroskopie, spirální enteroskopie), nejčastěji je ale užívána metoda bezdrátové kapslové enteroskopie schopná vyšetřit celé tenké střevo. Tyto modality jsou ale většinou využívány při podezřeních na komplikaci celiakie.
Strukturální intraabdominální změny při celiakii (kolonizace jejuna, jejunizace ilea, edém řas, hypersekrece, dysmotilita, intermitentní intususcepce tenkého střeva, hyposplenizmus, mezenteriální lymfadenopatie, volná tekutina v dutině břišní, lymfom) mohou být patrné i při radiologických zobrazovacích metodách (USG, CT, MR) [14].
4) Diferenciální diagnostika
Při diagnostice celiakie je nutno pomýšlet i na choroby, které mohou mít obdobné klinické projevy (idiopatické střevní záněty (IBD), intolerance laktózy a fruktózy, syndrom dráždivého tračníku (IBS), syndrom bakteriálního přerůstání (SIBO), pankreatopatie, mikroskopická kolitida) a mohou vést k atrofii sliznice tenkého střeva (SIBO, Crohnova choroba tenkého střeva, alergie na kravské mléko, eozinofilní gastroenteritida, giardióza, lymfomy tenkého střeva, peptická duodenitida, stav po virových gastroenteritidách, tropická sprue, variabilní imunodeficience).
Nonceliakální glutenová senzitivita je heterogenní klinická jednotka postihující významnou část populace a projevující se dyspeptickými i extraintestinálními symptomy po požití lepku bez průkazu celiakie nebo alergické reakce na obiloviny [15]. Známý je také pozitivní efekt bezlepkové diety na symptomy pacientů s průjmovou formou syndromu dráždivého tračníku, a to zejména v přítomnost HLA‑DQ2/ DQ ‑ 8 [16].
Alergie na pšenici je IgE ‑ zprostředkovaná alergická reakce projevující se během minut až hodin po požití obiloviny gastrointestinálními (bolesti břicha, křeče, zvracení) a zejména extraintestinálními symptomy (otoky, pruritus, nazální kongesce, astmatické projevy) až anafylaktickou reakcí. Onemocnění je častější u dětí. Diagnostika spočívá ve stanovení specifických IgE protilátek a v kožních testech [17].
Autoimunitní enteropatie je vzácné onemocnění charakterizované malabsorpčním syndromem, atrofií sliznice tenkého střeva a častou přítomností některých autoprotilátek (proti enterocytům a pohárkovým buňkám). Musí být vyloučeny jiné příčiny vilózní atrofie včetně celiakie. Časté jsou i přidružené extraintestinální projevy. V léčbě jsou užívány kortikosteroidy, imunosupresiva, nutriční suplementace, u závažných forem je užívána i transplantace kostní dřeně [18].
Komplikace celiakie
Nonresponzivní celiakie je definována jako přetrvávající symptomy a laboratorní abnormality provázející celiakii přes zjevné dodržování bezlepkové diety po dobu 6 – 12 měsíců. Vyskytuje se u 7 – 30 % léčených pacientů. Nejčastější příčinou je nechtěný příjem lepku, dále musíme zvažovat jiné choroby, jako je intolerance laktózy a fruktózy, syndrom bakteriálního přerůstání, pankreatická insuficience, syndrom dráždivého tračníku a celá řada dalších onemocnění, která mohou být provázena vilózní atrofií.
Specifickou podskupinou postihující asi 1 – 2 % pacientů s celiakií je refrakterní celiakie, která je definována jako symptomatická perzistující atrofie sliznice tenkého střeva, která nereaguje na striktní bezlepkovou dietu trvající 12 měsíců. Typ I refrakterní celiakie je spojen s lymfocytární infiltrací sliznice podobnou jako při klasické celiakii, má poměrně dobrou prognózu (pětileté přežití 93 %) a v léčbě jsou zkoušeny kortikosteroidy, azathioprin, budesonid a mesalazin. Typ II je charakterizován infiltrací T lymfocyty s abnormálním imunofenotypem (absence exprese CD8) a oligoklonální expanzí, výraznou malnutricí, horší odpovídavostí na léčbu a špatnou prognózou (pětileté přežití 44 %). Typ II je asociován s vysokým rizikem transformace do intestinálního lymfomu se špatnou prognózou [13].
Ulcerativní jejunoileitida je vzácná, ale závažná komplikace celiakie charakterizovaná ulceracemi a strikturami tenkého střeva a provázená váhovým úbytkem, bolestí břicha a průjmy neodpovídajícími na bezlepkovou dietu. U některých pacientů je současně identifikován lymfom tenkého střeva, léčba spočívá v chirurgické resekci nejvíce postiženého segmentu nebo imunosupresivní terapii [1].
Nejobávanější komplikací celiakie nastupující obvykle po 20 – 40 letech průběhu choroby je intestinální lymfom (EATL – Enteropathy Associated T ‑ cell Lymphoma), který se projeví deteriorací klinického stavu, ulceracemi tenkého střeva a je provázen špatnou prognózou (pětileté přežití 11 %). Jeho léčba spočívá v resekci postiženého úseku a chemoterapii. Celiakie je ale asociována i se zvýšeným rizikem jiných malignit – karcinomu hltanu, jícnu a tenkého střeva. Zdá se, že zvýšené riziko EATL i jiných malignit se vyrovnává s běžnou populací po pěti letech striktní bezlepkové diety [1].
Léčba
Základní a kauzální léčebnou modalitou je striktní a celoživotní bezlepková dieta (GFD – Gluten ‑ Free Diet) spočívající ve vynechání obilovin s obsahem lepku. Obsah gliadinu v bezlepkových potravinách by neměl přesáhnout 1 mg na 100 g sušiny (přirozeně bezlepkové potraviny) nebo 10 mg na 100 g sušiny (bezlepkové potraviny a nápoje). Základním zdrojem lepku jsou zrna pšenice, ječmene a žita. V dietě jsou využívány přirozeně bezlepkové potraviny (rýže, brambory, kukuřice, pohanka, luštěniny, sója, amarant, proso, čirok). Klinickou odezvu na bezlepkovou dietu lze pozorovat již během dvou týdnů. Atrofie sliznice tenkého střeva se upravuje nejdříve v orálních částech a k negativizaci protilátek dochází během 3 – 12 měsíců.
Možný cíl terapie celiakie v budoucnosti může představovat modulace propustnosti slizniční bariéry (antagonisté zonulinu), inhibice HLA, inhibice zánětlivé reakce (imunosupresiva, blokáda TNF‑α, antiintegriny, blokáda IL‑15 a indukce tvorby IL‑10), navození slizniční tolerance a vakcinace.
Závěr
Celiakie je modelovým příkladem autoimunitní choroby se známou genetickou predispozicí, spouštěčem v podobě konzumace lepku a chronickou zánětlivou reakcí sliznice tenkého střeva s následnou atrofií a malabsorpcí. Pro širokou paletu gastrointestinálních i extraintestinálních komplikací se s pacientem s nediagnostikovanou celiakií mohou setkat lékaři všech odborností a klíčem k diagnóze je na možnost onemocnění vůbec pomyslet. Kauzální léčba v podobě bezlepkové diety ve většině případů regeneruje sliznici tenkého střeva, normalizuje zdravotní stav pacienta a eliminuje riziko potenciálně závažných komplikací celiakie.
Doručeno do redakce: 16. 5. 2014
Přijato po recenzi: 6. 6. 2014
MUDr. Přemysl Falt, Ph.D.
nemocnicevitkovice.agel.cz
faltprem@centrum.cz
Zdroje
1. Farrell RJ, Kelly CP. Celiac Disease and Refractory Celiac Disease. In: Feldman M, Friedman LS, Brandt LJ (eds). Slesinger and Fordtrans’s Gastrointestinal and Liver Disease. Philadelphia: Saunders 2010 : 1797 – 1820.
2. Rostom A, Murray JA, Kognoff MF. American Gastroenterological Association Instituce Technical Review on the Diagnosis and Management of Celiac Disease. Gastroenterology 2006; 131 : 1981 – 2002.
3. Romanos J, van Diemen CC, Nolte IM et al. Analysis of HLA and non‑HLA alleles can identify individuals at high risk for celiac disease. Gastroenterology 2009; 137 : 834 – 840. doi: 10.1053/ j.gastro.2009.05.040.
4. Wolters VM, Wijmenga C. Genetic background of celiac disease and its clinical implications. Am J Gastroenterol 2008; 103 : 190 – 195. doi: 10.1111/ j.1572 ‑ 0241.2007.01471.x.
5. Walker ‑ Smith JA, Guandalini S, Schmitz J et al. Report of Working Group of European Society of Paediatric Gastroenterology and Nutrition. Revised criteria for diagnosis of celiac disease. Arch Dis Child 1990; 65 : 909 – 911.
6. Sanders DS, Carter MJ, Hurlstone DP et al. Association of adult coeliac disease with irritable bowel syndrome: a case ‑ control study in patiens fulfilling Rome II criteria referred to secondary care. Lancet 2001; 358 : 1504 – 1508.
7. Bardella MT, Vecchi M, Conte D et al. Chronic unexplained hypertransaminasemia mey be caused by occult celiac disease. Hepatology 1999; 29 : 654 – 657.
8. Carroccio A, Iannitto E, Cavataio F et al. Sideropenic anemia and celiac disease: one study, two points of view. Dig Dis Sci 1998; 43 : 673 – 678.
9. Fojtík P, Novosad P, Urban O et al. Screening celiakie u pacientů s osteoporózou a osteopenií. Vnitr lek 2011; 57 : 1000 – 1005.
10. Schuppan D, Hahn EG. Celiac disease and its link to type 1 diabetes mellitus. J Pediatr Endocrinol Metab 2001; 14 (Suppl 1): 597 – 605.
11. Badenhoop K, Dieterich W, Segni M et al. HLA‑DQ2 and/ or HLA‑DQ8 is associated with celiac disease ‑ specific autoantibodies to tissue transglutaminase in families with thyroid autoimmunity. Am J Gastroenterol 2001; 96 : 1648 – 1649.
12. Bureš J, Rejchrt S, Kopáčová M et al. Endoscopic features of coeliac disease. Folia Gastroenterol Hepatol 2005; 3 : 32 – 41.
13. Rubio ‑ Tapia A, Hill ID, Kelly CP et al. ACG Clinical Guidelines: Diagnosis and Management of Celiac Disease. Am J Gastroenterol 2013; 108 : 656 – 676. doi: 10.1038/ ajg.2013.79.
14. Smělá M, Bartušek D, Válek V et al. Využití ultrazvuku u pacientů s celiakií. Ces Radiol 2013; 67 : 46 – 51.
15. Mansueto P, Seidita A, D’Alcamo A et al. Non ‑ celiac gluten sensitivity: literature review. J Am Coll Nutr 2014; 33 : 39 – 54. doi: 10.1080/ 07315724.2014.869996.
16. Vazquez ‑ Roque MI, Camilleri M, Smyrk T et al. A controlled trial of gluten‑free diet in patients with irritable bowel syndrome ‑ diarrhea: effects on bowel frequency and intestinal function. Gastroenterology 2013; 144 : 903 – 911. doi: 10.1053/ j.gastro.2013.01.049.
17. Palosuo K. Update on wheat hypersensitivity. Curr Opin Allergy Clin Immunol 2003; 3 : 205 – 209.
18. Gentile NM, Murray JA, Pardi DS. Autoimmune enteropathy: a review and update of clinical management. Curr Gastroenterol Rep 2012; 14 : 380 – 385. doi: 10.1007/ s11894 ‑ 012 ‑ 0276 ‑ 2.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek Editorial – Interní medicínaČlánek Refluxní nemoc jícnuČlánek Idiopatické střevní zánětyČlánek Chronická pankreatitida
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2014 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- prof. MUDr. Miloš Štejfa, DrSc., FESC (*28. 5. 1929)
- Léčba akutního srdečního selhání
- Pravidelné supraventrikulární tachykardie – diagnóza, léčba a zkušenosti vysokoobjemového kardiocentra
- Moderní trendy v léčbě dlouhodobé perzistující fibrilace síní
- Standardizace ošetřovatelské péče k dekanylaci sheathu na intervenčních pracovištích v České republice
- HOT lines na sjezdu České kardiologické společnosti
- AUTORSKÁ SOUTĚŽ ČASOPISU KARDIOLOGICKÁ REVUE – INTERNÍ MEDICÍNA
- Editorial – Interní medicína
- Perorální endoskopická myotomie (POEM) – nová endoskopická možnost léčby achalázie jícnu
- Refluxní nemoc jícnu
- Léčba inhibitory protonové pumpy
- Celiakie – současný pohled na etiopatogenezi, diagnostiku a terapii
- Dráždivý tračník – diagnostika a léčba
- Divertikulární choroba tlustého střeva – nové trendy v léčbě
- Screening kolorektálního karcinomu
- Idiopatické střevní záněty
- Chronická pankreatitida
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Divertikulární choroba tlustého střeva – nové trendy v léčbě
- Dráždivý tračník – diagnostika a léčba
- Chronická pankreatitida
- Léčba inhibitory protonové pumpy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



