-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nemoc z kočičího škrábnutí – opomíjená zoonóza
Cat scratch disease – a neglected zoonosis
Cat scratch disease is a relatively rare infection that is caused by the bacterium Bartonella henselae. This disease occurs after cat scratch or bite. The course of the disease depends on the patient’s immunity status. In immunocompetent patients, the disease typically runs as a lymph node syndrome. Sometimes, mild general symptoms may appear, or the course can be atypical with a more serious clinical manifestation involving various organs. In immunocompromised patients, Bartonella henselae can cause bacillary angiomatosis or peliosis with a severe course.
KEYWORDS:
cat scratch disease – lymph node syndrome – atypical course – diagnosis – treatment
Autoři: L. Hozáková 1,2; L. Rožnovský 2; V. Janout 1
Působiště autorů: Ústav epidemiologie a ochrany veřejného zdraví, Lékařská fakulta OU Ostrava 1; Klinika infekčního lékařství, FN Ostrava 2
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 66, 2017, č. 2, s. 99-104
Kategorie: Souhrnné sdělení
Souhrn
Nemoc z kočičího škrábnutí je relativně vzácné onemocnění způsobené bakterií Bartonella henselae, která se rozvíjí po poškrábání nebo pokousání infikovanou kočkou. Průběh onemocnění závisí na imunitním stavu pacienta. U imunokompetentních pacientů probíhá typicky jako uzlinová forma, někdy s mírnými celkovými příznaky nebo atypicky se závažnějším klinickým obrazem s postižením různých orgánů. U imunokompromitovaných pacientů stejný původce vyvolává bacilární angiomatózu nebo peliózu se závažným průběhem.
KLÍČOVÁ SLOVA:
felinóza – uzlinový syndrom – atypický průběh – diagnostika – léčbaROZŠÍŘENÍ A BIOLOGIE
Syndrom horečky z kočičího škrábnutí poprvé popsal H. Parinaud v roce 1889 [1]. Souvislost mezi onemocněním projevujícím se protrahovanou horečkou a regionální lymfadenitidou a poškrábáním kočkou prokázal R. Debré v roce 1950 [1]. Až v roce 1989 byla Bartonella henselae (B. henselae) identifikována jako původce této nemoci. V roce 1990 byla poprvé prokázána souvislost mezi B. henselae a bacilární angiomatózou [2].
PŮVODCE
Původcem nemoci z kočičího škrábnutí, neboli felinózy, je B. henselae, vzácně Bartonella claridgeiae. Tyto bartonely patří do rodu Bartonella (dříve Rochalimea). Bartonely jsou malé gramnegativní fakultativní aerobní bakterie, které jsou adaptovány na intracelulární prostředí endotelu a erytrocytů [3]. V současnosti je známo 25 druhů a 3 poddruhy bartonel, které se vyskytují u různých druhů savců ve všech světadílech, kde žijí vhodní přenašeči, zejména blechy [3, 4]. B. henselae je nejčastějším druhem bartonely, který se vyskytuje u kočky a člověka [3]. Dříve se předpokládalo, že původcem felinózy může být i Afipia felis, avšak její izolace se u domácích koček nepodařila, je proto nepravděpodobné, že by A. felis mohla být původcem felinózy [5].
U domácích koček byla izolována nejen B. henselae, ale i další druhy bartonel, a to B. claridgeiae a B. koehlerae, které jsou schopné u nich způsobit bakteriémii. Pro druhy B. bovis, B. quintana a B. vinsonii subsp. berkhoffi kočka není přirozený hostitel, protože se u nich experimentálně nepodařilo vyvolat bakteriémii [5]. Rezervoárovým hostitelem B. quintana a B. baciliformis je člověk. B. quintana může způsobit zákopovou horečku (Trench fever) a bacilární angiomatózu, přenašečem je veš Pediculus humanus. Bakterie B. baciliformis je původcem horečky Oroya, neboli Carriónovy nemoci, která se vyskytuje v peruánských Andách v Jižní Americe. Přenašečem je flebotomus rodu Lutzomyia [1, 6, 7].
EPIDEMIOLOGIE
Nejvýznamnějším rezervoárem B. henselae jsou kočky, zejména koťata a mladé kočky do jednoho roku, které se pohybují venku [8, 9, 10]. Vzácně jsou rezervoárem B. henselae psi a hlodavci. Koťata mají protilátky proti B. henselae od matky. Protilátky přetrvávají 6–10 týdnů po narození a jsou protektivní jen proti stejnému kmenu, kterým byla matka infikovaná. V té době koťata mohou být infikována jiným kmenem B. henselae [8]. Vektorem přenosu bartonely mezi kočkami je blecha kočičí, Ctenocephalides felis. Bartonely, které jsou v erytrocytech kočky, se po nasátí blechou množí v zažívacím traktu blechy a trusem se dostávají na srst kočky [3]. Trus se pak dostane na drápky, zuby a do slin, když si kočka upravuje srst nebo se škrábe. Bartonela perzistuje v bleším trusu v zevním prostředí nejméně 9 dnů [3]. V prostředí, kde žije infikovaná kočka s neinfikovanou kočkou, k přenosu bakterie na neinfikovanou kočku nedochází, pokud se v prostředí nevyskytují blechy, a to ani po poškrábání infikovanou kočkou, trusem kočky, při páření, rovněž nebyl prokázán vertikální přenos z infikované kočky na plod [3]. Po prodělání nákazy mají kočky protilátky proti B. henselae, v Evropě je séroprevalence u koček 8–53 %, v teplých oblastech např. v Kolumbii uvádí séroprevalenci u koček 15–90 % [3, 6]. Séroprevalence je vyšší u starších koček než u koťat, zatímco bakteriémie je častější u koček do 1 roku [3, 10]. Protilátky proti B. henselae nejsou protektivní, kočky mohou být opakovaně infikované, dokonce i stejným kmenem, proto se mohou vyskytovat recidivující bakteriémie [3, 7]. Tato chronická relabující bakteriémie může trvat až 24 měsíců. Umožňuje ji intracelulární lokalizace bartonely v erytrocytech a endoteliálních buňkách cév, která zároveň má za následek vyhnutí se imunitnímu systému a chrání bartonelu před působením antibiotik [3]. U koček se infekce většinou neprojevuje, v některých případech při experimentální inokulaci patogenu byla zjištěna krátkodobá horečka, lehká anémie, lymfadenopatie, lehké neurologické příznaky a reprodukční selhání [3].
Možným vektorem přenosu B. henselae z rezervoárových zvířat na člověka může být i klíště Ixodes ricinus a klíšťata rodu Dermacentor [2, 7, 8, 9, 11].
Onemocnění se častěji vyskytuje v teplých a vlhkých oblastech světa [12]. Celosvětově se roční incidence uvádí 3,7–9,3 případů na 100 000 obyvatel [13]. V USA uvádějí výskyt felinózy u 22 000–25 000 pacientů ročně, ale tento počet může být podhodnocen, protože onemocnění nepodléhá hlášení [7, 14]. V České republice felinóza také nepodléhá hlášení. Od roku 2004 bylo na Klinice infekčního lékařství v Ostravě ošetřeno 57 pacientů s felinózou, přitom od roku 2013 do dubna 2016 to bylo již 33 pacientů, v našem souboru převažovali dospělí pacienti, kterých bylo 37. Předpokládáme, že jsme na felinózu v posledních letech pomýšleli častěji než v minulosti a že se nejednalo o narůstající počet onemocnění. Dříve se uvádělo, že se onemocnění vyskytuje převážně u dětí, ale podle novějších údajů se felinóza vyskytuje u dospělých častěji, než se dříve myslelo [15]. Člověk se nakazí po poškrábání, pokousání kočkou nebo při lízání ran kočkou. Přes 90 % pacientů uvádí kontakt s kočkou, z toho 50–87 % je kočkou poraněno [16]. V našem souboru uvádělo kontakt s kočkou 88 % pacientů [17].
PATOGENEZE
Na rozdíl od koček není patogeneze u člověka dosud zcela objasněna. V místě vstupu infekce se mikrob pomnoží a lymfatickou cestou se dostává do regionálních lymfatických uzlin, ve kterých vzniká granulomatózní zánět. Při hematogenním rozsevu mohou být postiženy různé orgány, nejčastěji játra a slezina, dále mohou být postiženy plíce, kostní dřeň nebo mozek, v nich dochází k hyperplazii stěny cév, tvorbě granulomů nebo mikroabscesů [1]. U pacientů s imunodeficitem bývá lokalizace patologické proliferace cév nejčastěji v kůži, podkoží, ale mohou být postiženy různé orgány (bacilární angiomatóza), postižení jater a sleziny je označováno jako pelióza [18].
KLINICKÝ OBRAZ
Průběh onemocnění závisí na imunologickém stavu pacienta. U imunokompetentních pacientů je hlavním příznakem uzlinový syndrom, který může být provázen mírnými celkovými příznaky. Uvedený klinický obraz se vyskytuje přibližně u 88 % pacientů [7]. U zbývajících pacientů onemocnění probíhá atypicky s postižením různých orgánů, vzácně jako bacilární angiomatóza [7]. U imunosuprimovaných pacientů či pacientů s imunodeficitem se může rozvinout bacilární angiomatóza nebo pelióza.
Felinóza – typický průběh
Onemocnění se projevuje změnami na kůži v místě pokousání nebo poškrábání kočkou. Za 3–10 dnů po inokulaci patogenu do kůže se objeví jedna nebo více erytémových papul, které se mění přes vezikuly a pustuly v krusty a které přetrvávají 1–3 týdny (obr. 1). V typickém případě se rozvíjí regionální lymfadenitida během 1–3 týdnů a trvá několik týdnů až měsíců [7, 19]. King uvádí, že k vymizení uzlinového syndromu dochází do 2–8 týdnů, Mandel uvádí, že uzlinový syndrom přetrvává 2–4 měsíce, i podstatně déle [7, 13]. U téměř poloviny pacientů bývá postižena jen jedna uzlina, u dalších 20 % pacientů bývá postiženo více uzlin v jedné regionální oblasti, u zbývající třetiny pacientů bývají postiženy uzliny v několika regionech [7, 9, 19, 20]. Asymetrická lymfadenopatie se nejčastěji objeví v axile a epitrochleárně (46 %), na krku a hlavě (26 %) a v třísle (18 %) [9]. Podle jiných autorů jsou nejčastěji postiženy uzliny na hlavě a krku, zejména uzliny v předním krčním trigonu, submandibulární a preaurikulární [19]. V našem dříve publikovaném souboru 21 pacientů byly krční uzliny postiženy u 38 % pacientů, axilární uzliny u 29 %, tříselné uzliny rovněž u 29 % a supraklavikulární uzliny u 4 % pacientů [17]. Uzliny bývají bolestivé a pohyblivé proti kůži. Kůže nad uzlinou může být barevně změněna, zarudlá až nafialovělá, např. náš pacient měl zarudlou kůži nad krční uzlinou (obr. 2). Lindeboom uvádí, že až 92 % z 53 dětí mělo nad uzlinou změněnou barvu kůže [19]. Přibližně u šestiny pacientů dochází k supuraci v uzlině. Někdy může dojít i ke vzniku píštěle [7, 19]. K typickému průběhu kromě lymfadenitidy patří i lehké systémové příznaky, jako horečka (30–60 %), únava a nauzea (25 %), bolesti hlavy a krku (10 %) [7, 9].
Obr. 1. Vezikulózní exantém v místě poškrábání kočkou a zvětšená regionální uzlina nad lopatkou vpravo u naší 52leté pacientky Figure 1. Vesicular exanthema at the site of cat scratch and enlarged regional nodule above the shoulder to the right of our 52-year-old female patient 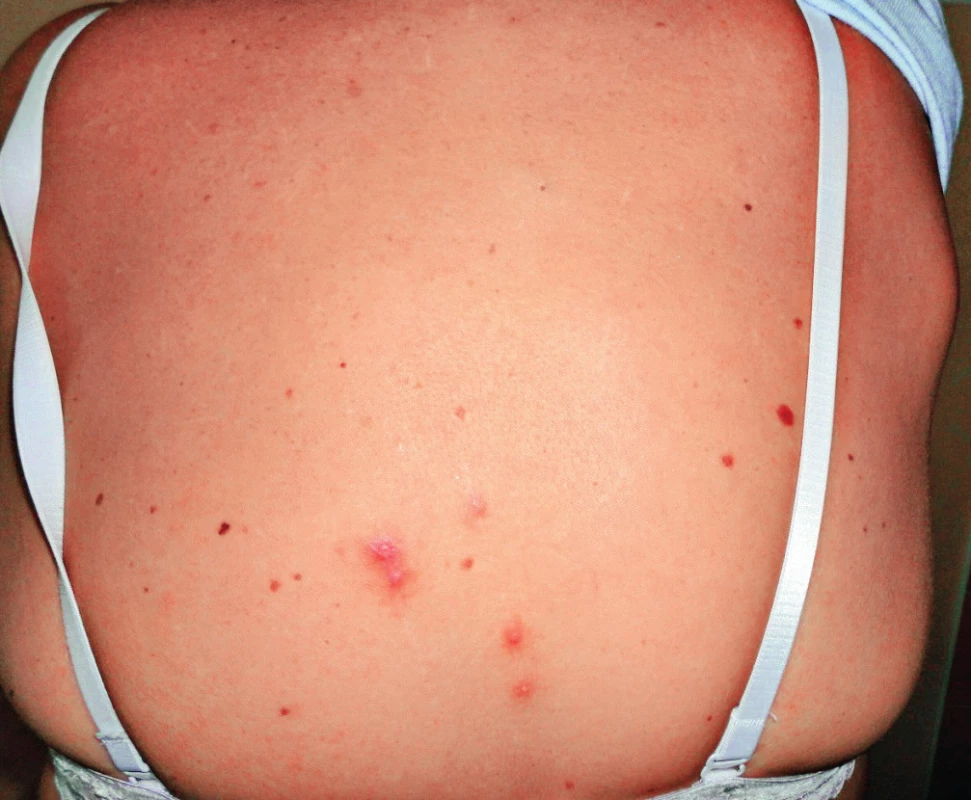
Obr. 2. Zvětšená uzlina na pravé straně krku se zarudnutím nad uzlinou u našeho 19letého pacienta Figure 2. Enlarged nodule on the right side of the neck with redness above the nodule in our 19-year-old patient 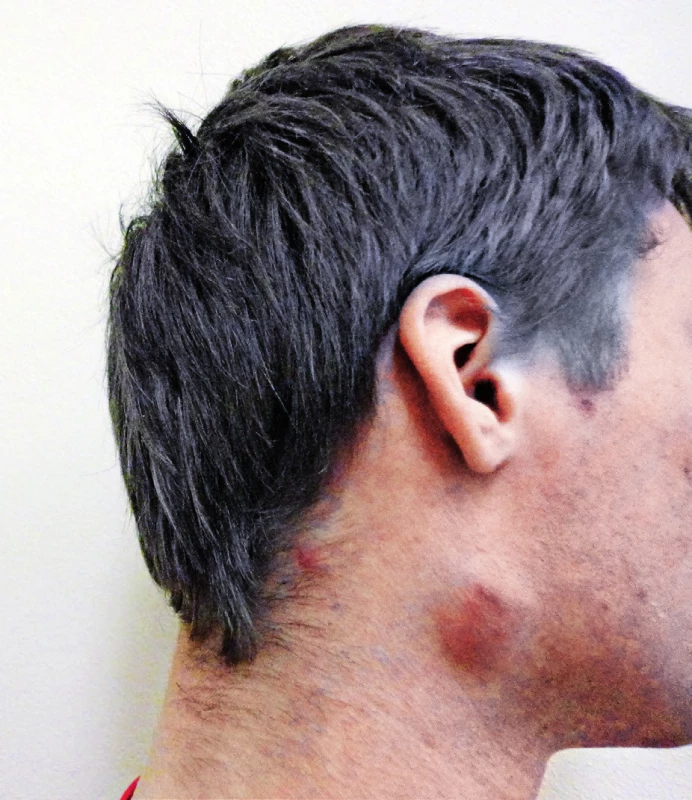
Felinóza – atypický průběh
Onemocnění s atypickým průběhem se vyskytuje přibližně u desetiny pacientů, podle jiných autorů u 5 až 24 % pacientů [7, 18]. Onemocnění se může manifestovat zejména postižením oka, jater, srdce a centrálního nervového systému, hnisavým zánětem kostí, přitom periferní uzliny nemusí být zvětšené.
Oční postižení je druhé nejčastější po postižení uzlin, objevuje se u 5–10 % pacientů s felinózou [21]. Může se jednat o uveitidu, konjuktivitidu a Parinaudův okuloglandulární syndrom (granulomatózní konjuktivitida s preaurikulární lymfadenitidou při vstupu infekce přes spojivku). Na Parinaudův syndrom se většinou nepomýšlí, a proto se většinou řadí mezi atypické projevy felinózy [7].
Dalším atypickým projevem felinózy je hepatosplenická forma felinózy. Při sonografickém vyšetření se postižení jater projevuje několika nebo vícečetnými hypodenzními ložisky, která způsobuje nekrotizující granulomatózní zánět obdobný granulomatóznímu zánětu při postižení uzlin [18]. Aminotransferázy bývají zvýšené u 38 % pacientů [22]. Pravidlem jsou horečky, bolesti břicha, ztráta hmotnosti, laboratorně bývá vyšší hodnota C-reaktivního proteinu a zvýšená sedimentace erytrocytů [15, 22, 23]. Postižení jater a sleziny bývá často současné, uvedená forma se častěji vyskytuje u dětí než u dospělých. Současné postižení periferních uzlin bývá jen ve 33 % případů [15, 23, 24]. Izolované postižení sleziny je vzácné [15]. Splenická forma může být často považována za lymfom, v jedné kazuistice bylo popsáno krvácení po diagnostické punkci a následná splenektomie [15]. Na hepatosplenickou formu by se mělo pomýšlet při ložiscích v játrech a slezině, která jsou provázena horečkou, je pravděpodobné, že uvedena forma není vždy správně diagnostikována [15]. Většina případů byla hlášena v Evropě, zvláště v oblasti Středomoří a ve Francii. To by svědčilo pro invazivnější kmen B. henselae, ale je pravděpodobnější, že lékaři v uvedených oblastech myslí častěji na tento atypický průběh [23]. Radiologické projevy při sonografickém vyšetření, počítačové tomografii, ale ani při magnetické rezonanci nejsou specifické pro felinózu. Kontrolní vyšetření by mělo být provedeno za 4 týdny a 4 měsíce, aby bylo zřejmé, že došlo k úplné regresi nálezu v játrech či slezině [15, 23]. Léze v atypických případech felinózy však mohou i spontánně vymizet během 6 měsíců [7].
Neurologické komplikace při felinóze jsou vzácné, v literatuře se uvádí, že encefalopatie nebo další neurologické příznaky se objevují u 0,17–2 % pacientů s felinózou [25]. Encefalopatie může být provázena křečemi, dokonce může dojít ke status epilepticus [26]. Encefalopatie byla častěji pozorována u dětí. EEG odhalí difuzní zpomalení mozkové aktivity. Zvýšená bílkovina a zvýšený počet elementů bývá pozorován u třetiny pacientů [7]. Na naší klinice jsme zaznamenali encefalopatii u jednoho staršího pacienta [17]. Patofyziologie není známá, někteří uvádí jako možnou příčinu přímé působení bakterie nebo působení neurotoxinů, zvažována je i vaskulitida jako imunitní odpověď organismu na patogen [7, 26, 27]. Felinóza by se měla zvažovat u pacientů s refrakterním status epilepticus, kteří nemají v anamnéze epilepsii a pokud se vyloučí toxická, metabolická, autoimunitní etiologie a další infekční agens, a to dokonce i při nepřítomnosti periferní lymfadenitidy [26]. Felinóza může raritně způsobit i transverzální myelitidu, radikulitidu a cerebelární ataxii [16]. Vzácná neuroretinitida se manifestuje jako náhlá jednostranná ztráta zraku, předchází ji rozvoj unilaterální lymfadenitidy nebo chřipkové příznaky, vyšetřením se zjistí edém papily [7]. Naštěstí neuritida spontánně odezní, o efektivnosti léčby antibiotiky a kortikoidy se stále diskutuje [7].
Při felinóze může dojít k postižení srdce, zejména se může jednat o endokarditidu. Endokarditidu může způsobit kromě B. henselae a B. quintana i další druhy bartonel, a to B. elizabethae a B. vinsonii subsp. berkoffi [7, 28]. Při postižení endokardu se jedná většinou o subakutní endokarditidu. B. henselae se uvádí jako jedna z vedoucích příčin endokarditid, u kterých nebyl patogen při hemokultivaci prokázán, obvykle bývá postižena aortální chlopeň [9, 18]. Shasha et al. popsali soubor 348 pacientů s bakteriologicky negativní endokarditidou, při diagnostice byla použita sérologie proti širokému spektru atypických patogenů a vyšetření chlopenní tkáně metodou PCR a kultivací. V tomto souboru byla Bartonella sp. příčinou endokarditidy u 28 % pacientů, z nichž B. henselae byla identifikována ve 24 % a B. quintana v 75 % případů. Endokarditida měla letalitu v dřívějších dobách kolem 27 %, nyní kolem 7 % [18]. Příčinou vysoké letality v dřívějších dobách bylo zpoždění diagnózy a nutnost kardiochirurgické operace pro těžké postižení chlopně až u 95 % pacientů [18]. I podle Slatera mnoho případů endokarditidy způsobené bartonelami vyžaduje operaci chlopně, navzdory antibiotické léčbě [7]. I když se felinóza vyskytuje častěji u dětí, endokarditida způsobená B. henselae je u dětí vzácná [7]. B. henselae může pravděpodobně způsobit i myokarditidu, např. Barson et al. uvádějí, že během let 1979–1992 bylo ve Švédsku popsáno 16 náhlých úmrtí na myokarditidu u elitních švédských závodníků v orientačním běhu. U 5 sportovců byl myokard vyšetřený na přítomnost bartonel. B. henselae byla prokázána v srdečním svalu ve 3 případech a B. quintana v 1 případě [18]. Opět se zvažuje postižení myokardu na imunologickém podkladě.
Kožní projevy jiné než v místě inokulace patogenu zahrnují makulopapulární a urtikární exantém, erythema nodosum a erythema marginatum [9, 18].
Dále byly popsány kazuistiky pacientů s osteomyelitidou, hemolytickou anémií, trombocytopenickou purpurou, glomerulonefritidou, pneumonií s pleuritidou, septickým šokem [14, 22, 29]. Japonští autoři uvádějí kazuistiku dítěte s pneumonií a pleuritidou bez lymfadenitidy, B. henselae byla prokázána v plné krvi metodou PCR, punkce pleurálního výpotku nebyla provedena pro rychlou regresi nálezu při antibiotické léčbě [30].
U pacientů s imunodeficitem, zejména u AIDS, může infekce způsobená B. henselae probíhat jako závažné onemocnění pod obrazem bacilární angiomatózy s postižením různých orgánů nebo peliózy s postižením jater a sleziny, s dobrou odezvou na léčbu antibiotiky [7, 15]. Viscerální forma může mít dramatický průběh [7]. Bylo zjištěno, že nejméně u 4 % HIV pozitivních pacientů byla demence a zhoršování psychického stavu výsledkem infekcí způsobených bartonelami, které jsou léčitelné antibiotiky [7]. Onemocnění se naštěstí častěji projevuje jako kožní forma s nebolestivými sytě červenými až hnědými papulami o velikosti několika milimetrů, citlivými tužšími uzlíky bez změny barvy kůže nebo až několik centimetrů velkými erytémovými plochami. Morfy jsou fixované nebo mobilní, mohou ulcerovat, bývají provázeny zvětšením regionálních lymfatických uzlin [7]. Onemocnění může být provázeno schváceností, horečkou a hubnutím. Vyskytuje se u pacientů se středně až velmi těžkým imunodeficitem [31].
DIAGNOSTIKA
Diagnóza bývá často zpožděna při nepřítomnosti uzlinového syndromu [7]. Pokud je uzlinový syndrom přítomen, je situace jednodušší. Diagnóza uzlinového syndromu je založena na sérologických testech, používá se metoda nepřímé imunofluorescence (IF) a enzymová imunoanalýza (ELISA). ELISA se jeví senzitivnější než IF [24]. Pozitivita IgM protilátek svědčí pro akutní onemocnění, ale IgM protilátky přetrvávají krátkou dobu, takže až u 50 % pacientů nebývají zachyceny. Protilátky třídy IgG přetrvávají většinou 22–28 týdnů, ale u 25 % pacientů přetrvávají přes 1 rok [22]. Právě dlouhodobé přetrvávání protilátek třídy IgG proti B. henselae limituje klinickou hodnotu tohoto testu. Nízká senzitivita sérologických testů způsobuje, že negativní sérologie nevylučuje felinózu [7, 19]. U několika našich pacientů jsme zaznamenali opožděnou tvorbu protilátek proti B. henselae, u nichž došlo k vzestupu hladiny protilátek třídy IgG z hraniční hodnoty na pozitivní až po léčbě antibiotiky nebo až po provedené exstirpaci uzliny, přitom pozitivitu IgM protilátek jsme u nich nezachytili [17]. Někdy je možné použít PCR metodu, ale protože bakteriémie je krátkodobá, PCR vyšetření v plné krvi není většinou přínosné [30]. Přímý průkaz B. henselae metodou PCR bývá častější u pacientů s imunodeficitem, protože je vyšší bakteriémie v krvi a imunitní odpověď pacienta je nedostatečná [18]. Kultivace pomalu rostoucí B. henselae je málo úspěšná, její izolace je obtížná a je závislá na počtu mikroorganismů v buňkách bartonelou postižené tkáně [30, 32]. PCR diagnostika se u nás provádí jen v některých pracovištích (např. Bioptická laboratoř s. r. o. Plzeň).
Pro zjištění velikosti a charakteru uzlin se nejčastěji používá sonografické vyšetření. Uzliny jsou většinou četnější, hypoechogenní a značně vaskularizované se zvýšenou echogenitou měkké tkáně ohraničující uzlinu [9]. Pokud výsledky sérologie nejsou pro felinózu jednoznačné (nízký titr IgG a negativita IgM protilátek proti B. henselae) a je vyloučena jiná infekční etiologie lymfadenitidy, je vhodné přistoupit k exstirpaci uzliny a histologickému vyšetření. K diagnostice bartonel v histologickém preparátu se používá barvení stříbrem podle Steinera nebo barvení podle Warthin-Starryho. Vyšetření má nízkou specificitu a senzitivitu a vysoké procento falešně pozitivních výsledků [33]. Imunohistochemické vyšetření pomocí monoklonálních protilátek proti B. henselae má také nízkou senzitivitu (25–39 %) [33]. PCR metoda má vyšší specificitu a senzitivitu než předešlé metody [33]. Využití PCR metody při vyšetření histologického preparátu má však také své limitace, specificita PCR metody je téměř 100%, ale senzitivita jen 43–76% [30].
Histologicky se časné stadium infekce projevuje nedostatkem neutrofilů, folikulární hyperplazií a zvýšeným počtem histiocytů a B-lymfocytů monocytoidního vzhledu [33]. Pozdní stadium je typické množstvím neutrofilů, tvořícími mikroabscesy, které jsou často ohraničené epiteloidními histiocyty, někdy je provázeno výskytem mnohojaderných obrovských buněk [24, 33]. Jabcuga uvádí, že typický mikroskopický nález nekrotizujícího granulomatózního zánětu s hvězdicovitými mikroabscesy pozorovali v uzlinách u 57 % pacientů ze 100 pacientů s felinózou, ale 43 % vyšetřených uzlin bylo pro felinózu „atypických“ [33]. Z těch „atypických“ nálezů mělo 53 % známky mykotického/mykobakteriálního zánětu s množstvím nekróz a palisádovitých histiocytů bez neutrofilů, 14 % mělo charakter nekrózy bez neutrofilů a dezorganizovanou proliferaci histiocytů připomínající Kikuchiho nemoc, v 9 % byl obraz podobný nálezu při toxoplazmóze. Tyto „atypické“ nálezy byly došetřeny metodou PCR a bylo prokázáno, že se jednalo o postižení uzlin při felinóze, což potvrzuje, že morfologické závěry nejsou zcela specifické ani senzitivní pro felinózu [33]. Histologické závěry v atypických případech by měly být interpretovány opatrně a závěry by měly být konfirmovány sérologicky, případně i metodou PCR [24, 33].
Diagnóza bacilární angiomatózy je možná histologickým vyšetřením vzorku z biopsie, kdy se prokáže proliferace malých cév obsahujících kypré kubické endoteliální buňky spolu se zánětlivými buňkami s převahou neutrofilů [7,31].
Diferenciální diagnóza
Pro nemoc z kočičího škrábnutí mluví hlavně unilaterální lymfadenitida, výjimečně může být lymfadenitida bilaterální. Podle lokalizace zvětšených lymfatických uzlin je nutno pomýšlet kromě felinózy zejména na další lokální bakteriální infekce, infekční mononukleózu, toxoplazmózu, tularémii, atypické mykobakteriózy, Kaposiho sarkom, HIV, syfilis, ale i na hemoblastózy a metastatické postižení uzlin. Vzácně připadá v úvahu histoplazmóza, sporotrichóza, Kawasakiho nemoc, Kikuchiho nekrotizující lymfadenitida, brucelóza a lymfogranulom venerum [6, 30, 33]. Malignita bývá zvažována u tvrdých, gumovitých nebo fixovaných uzlin, při supraklavikulární lokalizaci, lymfatických uzlinách větších než 2 cm a pokud nedojde ke zmenšení uzlin při antibiotické léčbě nebo bez ní po 4–6 týdnech. Krční uzliny bývají často zvětšeny, ale u dětí platí, že nádorové postižení krčních uzlin je vzácné [20]. Jeremy uvádí, že až 44 % dětí mladších 5 let mělo hmatné lymfatické uzliny, což potvrzuje běžný výskyt benigní lymfadenopatie v této populaci [20].
LÉČBA
Názory na antibiotickou léčbu se rozcházejí. Felinóza bývá často považována za onemocnění se spontánní úzdravou, tzv. „self-limited disease“, proto někteří autoři nedoporučují léčbu uzlinových syndromů při felinóze s nekomplikovaným průběhem. Perzistující lymfadenopatie je vzácná, dokonce i u pacientů s imunodeficitem. Při neustupující lymfadenitidě, při které zvětšená uzlina přetrvává déle než 4 měsíce, by proto měla být uzlina odstraněna a histologicky vyšetřena [20]. U pacientů s abscedující lymfadenitidou se doporučuje aspirovat hnisavý obsah, což vede u bolestivých uzlin k úlevě, incize se nedoporučuje, protože může dojít ke vzniku chronické píštěle [19, 24].
Přesto většina autorů antibiotickou léčbu doporučuje, za lék volby u lehčích průběhů se považují makrolidy. Například americká pediatrická společnost doporučuje pětidenní léčbu azitromycinem jako lékem volby pro imunokompetentní i imunokompromitované děti s typickým i atypickým průběhem nemoci [13]. U dospělých pacientů nebo starších dětí lze zvolit i další makrolidy (např. klaritromycin) nebo tetracykliny, které by se měly podávat po dobu 10–14 dnů.
U atypických forem se doporučuje kombinace doxycyklinu s rifampicinem, optimální délka léčby není dosud stanovena. U těžších forem se doporučuje kombinace azitromycinu s rifampicinem nebo gentamicinem [15]. Při osteoartritidě samotná antibiotická léčba nestačí, ložisko musí být drénované. Například Mirous et al. při osteoartritidě C1–C2 obratle u 14letého pacienta použili k léčbě amoxicilin-klavulanát s gentamicinem po dobu 2 týdnů. Gentamicin byl následně změněn na perorální ciprofloxacin a spolu s amoxicilin-klavulanátem léčba pokračovala 2,5 měsíce. B. henselae byla prokázána kultivačně v punktátu [34]. Při neurologickém postižení s epileptickými záchvaty má léčba antiepileptiky a kortikosteroidy zásadní význam, antibiotika jsou asi méně přínosná. Doporučuje se doxycyklin a rifampicin jako potenciálně účinné léky [26]. U neuroretinitidy se doporučují makrolidy nebo tetracykliny s rifampicinem nebo bez něj [7]. U myokarditidy se uvádí příznivý efekt azitromycinu, který má i imunomodulační účinek a dobrou antibakteriální aktivitu proti B. henselae [16]. Antibiotická léčba endokarditidy zahrnuje aplikaci aminoglykosidů po dobu nejméně 2 týdnů v kombinaci s doxycyklinem, který se podává 6–8 týdnů [7, 18]. U HIV pozitivních pacientů, pokud horečka nebo bakteriémie perzistuje, by léčba měla být prodloužena na 8–12 týdnů [7]. U bacilární angiomatózy s postižením kůže se doporučuje perorální léčba rovněž po dobu 8–12 týdnů [7].
Nejednota v názorech na léčbu je způsobena faktem, že citlivost B. henselae na antibiotika se značně liší in vitro a in vivo. In vitro je B. henselae citlivá na řadu antibiotik, jako jsou makrolidy, aminoglykosidy, tetracykliny, fluorochinolony, beta-laktámová antibiotika, cefalosporiny 3. generace, cotrimoxazol, rifampicin [7]. Většina antibiotik má však pouze bakteriostatický účinek na B. henselae, jen aminoglykosidy mají baktericidní účinek. Slabá propustnost buněčné membrány pro antibiotika a jejich bakteriostatický účinek jsou hlavním důvodem selhávání antibiotické léčby [9,22]. Nebylo prokázáno, že by antibiotická léčba měla vliv na délku trvání nemoci či zabránila progresi zánětu uzliny v absces, což jsme pozorovali také u našich pacientů [17, 19, 22]. Přes sporný efekt antibiotické léčby onemocnění u léčených pacientů vymizí za 2–6 měsíců, podle některých autorů až za 10 měsíců [19, 22].
PREVENCE
Omezení kontaktu s kočkami u imunokompetentních lidí není nutné. U imunokompromitovaných pacientů je situace odlišná, doporučuje se vyhýbat kontaktu s kočkou, zejména s koťaty, která se pohybují venku, nebo s domácími kočkami, které se pohybují doma i venku. Pokud pacienti se sníženou imunitou chtějí vlastnit kočku, neměla by kočka pocházet z útulku nebo z domácnosti, kde žije více koček, měla by být zdravá a starší než 1 rok, po provedené dezinsekci, případně vyšetřena na B. henselae. Kočka by měla být držena doma, aby se vyhnula případné expozici blechám a dalším vektorům. V případě poranění kočkou se vždy doporučuje ránu omýt vodou a mýdlem. Antibiotická profylaxe ani vyšetřování koček se rutinně nedoporučuje [6]. Vakcinace koček není možná vzhledem k velkému spektru kmenů B. henselae a nedostatku zkřížené imunity [8].
ZÁVĚR
Felinóza je onemocnění, na které se dosud málo pomýšlí, zejména pokud není spojena s uzlinovým syndromem. Onemocnění probíhá většinou pod obrazem uzlinového syndromu, atypický průběh nemoci se širokým spektrem klinických projevů má většinou také dobrou prognózu. Pouze u imunokompromitovaných pacientů může být průběh závažnější. Stanovení diagnózy je někdy obtížné, spektrum vyšetřovacích metod by bylo vhodné rozšířit zejména o PCR diagnostiku, která se v ČR zatím rutinně neprovádí. Terapeuticky jsou nejčastěji doporučovány makrolidy, zejména azitromycin.
Do redakce došlo dne 2. 7. 2016.
Adresa pro korespondenci:
MUDr. Lubomíra Hozáková
Fakultní nemocnice Ostrava
17. listopadu 1790
708 52 Ostrava-Poruba
e-mail: lubomira.hozakova@fno.cz
Zdroje
1. Černý Z. Infekce vyvolané bartonelami. In Beneš J. Infekční lékařství. 1. vyd. Praha: Galén; 2009. s. 301–303.
2. Sanago YO, Zeaiter Z, Caruso G. Bartonella henselae in Ixodes ricinus Ticks (Acari: Ixidida) removed from humans, Belluno province, Italy. Emerg Infect Dis, 2003;9(3):329–32.
3. Pennisi MG, Marsilio F, Hartmann K, Lloret A. Bartonella species infection in cats. ABCD guidelines on prevention and management. J Feline Med Surg, 2013;15(7):563–569.
4. Melter O. Novinky v problematice bartonelových infekcí. Klin Mikrobiol Infekc Lek, 2013;9(2):36–44.
5. Chomel BB, Kasten RW, Stuckey MJ. Experimental infection of cats with Afipia felis and various Bartonella species or subspecies. Vet Microbiol, 2014;172(3–4):505–510.
6. Maciás A, Aguirre C, Bustamante A, Garcés C, et al. Cat scratch disease in Colombia. Oxf Med Case Reports, 2014;1(3):43–45.
7. Slater LN, Welch DF. Bartonella, including Cat-Scratch Disease. In Mandell, Douglas, and Bennett. Principles and Practice of Infectious diseases. 6. edit. Philadelphia: Elsevier; 2005. s. 2733–2748.
8. Fleischman DA, Chomel BB, Burgos K. Impact of queen infetion on kotten susceptibility to different strains of Bartonella henselae. Vet Microbiol, 2015;180(3–4):268–272.
9. Melewska KM, Mania A, Kemnitz P, et al. Cat-scratch disease: a wide spectrum of clinical pictures. Postepy Dermatol Alergol, 2015;32(3):216–220.
10. Melter O, Hercík K, Weyant RS. Detection and characterization of feline Bartonella hensellae in the Czech Republic. Vet Microbiol, 2003;93(3):261–273.
11. Hercík K, Hásová V, Janecek J, Branny P. Molecular evidence of Bartonella DNA in ixodid ticks in Czechia. Folia Microbiol, 2007;52(5):503–509.
12. Brunetti E, Fabbi M, Ferraioli G, Prati P. Cat-scratch disease in Northern Italy: atypical clinical manifestations in humans and prevalence of Bartonella infection in cats. Eur J Clin Microbiol Infect Dis, 2013;32(4):531–534.
13. King KY, Hicks MJ, Mazziotti MV, Eldin KW. Persistent Cat Scratch Disease Requiring Surgical Excision in a Patient With MPGN. Pediatrics, 2015;135(6):e 1514-7.
14. High K, Van Meter J. An 8-year-old Boy with altered mental status. Air Med J, 2015;34(3):149–151.
15. Zenone T. Systemic Bartonella henselae Infection in Immuno-competent Adult Presenting as Fever of Unknown Origin. Case Rep Med, 2011;2011 : 183937.doi:10.1155/2011/183937.
16. Barson WJ, Honegger JR, Texter K. Acute myopericarsitis associated with cat scratch disease in an adolescent. Pediatr Infect Dis J, 2014;33(9):982–984.
17. Hozáková L, Rožnovský L, Franková H. Felinóza – stále aktuální zoonóza. Klin Mikrobiol Infekc Lek, 2014;20(1):4–10.
18. Shasha D, Gilon D, Vernea F, Moses AE, Strahilevitz J. Visceral Cat Scratch Disease with Endocarditis in an Immunocompetent Adult: A Case Report and Review of the Literature. Vector Borne Zoonotis Dis, 2014;14(3):175–181.
19. Lindeboom JA. Pediatric cervicofacial lymphadenitis caused by Bartonella henselae. Oral Surg Oral Med Oral Patho Oral Radiol, 2015;120(4):469–473.
20. Meier JD, Grimmer JF. Evaluation and Management of Neck Masses in Children. Am Fam Physician, 2014;89(5):353–358.
21. Pinto Jr VL, Curi AL. Cat scratch disease complicated with aseptic meningitis and neuroretinitis. Braz J Infect Dis, 2008;12(2):158–160.
22. Gradidge E, Chauhan A, Stelle RW, et al. Fever, lymphadenopathy, and splenomegaly: did the cat do it? Clin Pediatr (Phila), 2013;52(11):1072–1074.
23. García JC, Núňez MJ, Castro B, Fernández JM. Hepatosplenic Cat Scratch Disease in Immunocompetent Adults. Report of 3 Cases and Review of the Literature. Medicine (Baltimore), 2014;93(17):267–279.
24. Choi AH, Bolaris M, Nguyen DK, Panosyan EH. Clinicocytopathologic Correlation in an Atypical Presentation of Lymphadenopathy With Review of Literature. Am J clin Pathol, 2015;143(5):749–754.
25. Fouch B, Coventry S. A case of fatal dissemminated Bartonella henselae infection (Cat scratch disease) with encephalitis. Arch Pathol Lab Med, 2007;131(10):1591–1594.
26. Laswell EM, Chambers KD, Whitsl DR, Poudel K. New-Onset Refractory Epilepticus in an Adult with an Atypical Presentation of Cat-Scratch Disease: Successful Treatment with High-Dose Corticosteroids. Pharmacotherapy, 2015;35(6):e 106–110.
27. Nishio N, Kubota T. Cat scratch disease with encephalopathy in a 9-year-old girl. Pediatr Int, 2008;50(6):823–824.
28. Medková Z. Bartonelózy. Klin Mikrobiol Infekc Lek, 2004;10(5):207–213.
29. Palumbo E, Sodini F. Immune thrombocytopenic purpura as a complication of Bartonella henselae infection. Infez Med, 2008;16(2):99–102.
30. Kimura A, Hasegawa S, Yanagihara M, Inoue H. Cat-scratch disea-se with severe pleuritis in a 6-year-old girl. Pediatr Int, 2015;57(3):501–503.
31. Rozsypal H. Onemocnění kůže. In Rozypal H. AIDS – klinický obraz a léčba. Praha: Maxdorf; 1998, s. 111–114.
32. Safont M, Angelakis E, Richet H, Lepidi H. Bacterial Lymphadenitis at a Major Referral Hospital in France from 2008 to 2012. J Clin Microbiol, 2014;52(4):1161–1167.
33. Jabcuga CE, Jin L, Macon WR, Howard MT. Broadening the Morphologic Spectrum of Bartonela henselae Lymphadenitis. Analysis of 100 Molecularly Characterized Cases. Am J Surg Pathol, 2016;40(3):342–347.
34. Mirouse G, Journe A, Casabianca L, Moreau PE. Bartonella henselae osteoarthritis of the upper cervical spine in a 14-year-old boy. Orthop Traumatol Surg Res, 2015;101(4):519–522.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2017 Číslo 2- Stillova choroba: vzácné a závažné systémové onemocnění
- Diagnostika virových hepatitid v kostce – zorientujte se (nejen) v sérologii
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Geny virulence a rezistence k antibiotikům u Campylobacter spp. v České republice
- Efekt adenotómie, alergie a fajčenia na mikrobiálnu kolonizáciu horného aerodigestívneho traktu u detí
- Vliv sepse na úmrtnost v České republice: analýza vícečetných příčin úmrtí
- Diagnostický význam chemokinu CXCL13 a protilátek proti C6 peptidu u pacientů s neuroborreliózou
- Průkaz bakteriálních agens z hemokultur metodou fluorescenční in situ hybridizace
- Štěnice domácí (Cimex lectularius) – biologie, zdravotnický význam, možnosti detekce a hubení
- K významnému životnímu výročí MUDr. Mariny Maixnerové, CSc.
- Nemoc z kočičího škrábnutí – opomíjená zoonóza
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Diagnostický význam chemokinu CXCL13 a protilátek proti C6 peptidu u pacientů s neuroborreliózou
- Nemoc z kočičího škrábnutí – opomíjená zoonóza
- Štěnice domácí (Cimex lectularius) – biologie, zdravotnický význam, možnosti detekce a hubení
- Vliv sepse na úmrtnost v České republice: analýza vícečetných příčin úmrtí
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



