-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaVýznam acidolabilní podjednotky (ALS) v etiologii a v diagnostice malého vzrůstu
The role of acid-labile subunit (ALS) in aetiology and diagnostic procedures of short stature
Aims: Acid-labile subunit (ALS) as a glycoprotein component of the ternary complex IGF-1/IGFBP-3/ALS co-regulates bioactivity and prolongs half-life of IGF-1 and thus substantially contributes to regulation of statural growth. Protein component of ALS is encoded by IGFALS gene. We studied the impact of growth hormone (GH) on circulating levels of ALS and additional ternary complex components, and the option to identify carriers of pathogenic variants of IGFALS gene according to low ALS levels.
Methods: We studied interrelations between ternary complex components in 511 children on GH therapy. Children with low ALS levels underwent IGFALS sequencing. We monitored the effect of GH therapy on the ternary complex in 23 children treated for GH deficiency (GHD) or for short stature after having been born small for gestational age (SGA-SS).
Results: In 511 children with GHD and/or SGA-SS on long-term GH therapy ALS level was 8750 µg/l (median; Q1-Q3 : 6353–10963), IGF-1 was 233 µg/l (Q1-Q3 : 147–329), corresponding to +1.21 SD (Q1-Q3: from -0.11 to +2.45), and IGFBP-3 was 5660 µg/l (Q1-Q3 : 4668–6800), corresponding to +3.65 SD (Q1-Q3: from +1.81 to +5.97 SD). ALS is strongly interrelated with IGF-1 (r=0.70; p<0.0001) and with IGFBP-3 (r=0.61; p<0.0001). IGFALS Sanger sequencing in three children with low ALS levels (369, 487 and 1490 µg/l) displayed normal results. In 23 children following 3–4 months of GH therapy, ALS increased from 4859 (median; Q1-Q3 : 4176-6240) to 6681 (5413-8332) µg/l (p=0.0004), IGF-1 from 68 (46-114) to 146 (84-178) µg/l (p<0.0001) and IGFBP-3 from 3390 (2820–4030) to 4700 (3940–5300) µg/l (p<0.0001). The impact of GH is more pronounced in IGF-1 (213% increase) compared to IGFBP-3 (132%; p<0.0001) and ALS (139%; p<0.0001).
Conclusions: Our results suggest that estimation of ALS levels is ineffective to detect IGFALS gene mutations. Biochemical measurements of ALS do not substantially contribute to diagnostic work-up and to follow-up in short stature children, according to our experience.
Keywords:
Growth hormone – acid-labile subunit – IGF-1 – IGFBP-3 – ternary complex – IGFALS
Autoři: L. Toni 1; K. Pádrová 2; L. Plachý 1; P. Dušátková 1; L. Elblová 1; S. Koloušková 1; M. Pechová 2; M. Šnajderová 1; Z. Šumník 1; Š. Průhová 1; J. Lebl 1
Působiště autorů: Pediatrická klinika a 2Ústav lékařské chemie a klinické biochemie 2. lékařské fakulty UK a Fakultní nemocnice Motol, Praha 1
Vyšlo v časopise: Čes-slov Pediat 2020; 75 (4): 214-218.
Kategorie: Sympozium: poruchy růstu
Souhrn
* Toni L., Pádrová K. - obě autorky přispěly k této práci stejným dílem
Cíl studie: Acidolabilní pojednotka (ALS) jako glykoproteinová součást ternárního komplexu IGF-1/IGFBP-3/ALS reguluje bioaktivitu a prodlužuje poločas IGF-1, čímž přispívá k řízení tělesného růstu. Proteinovou složku ALS kóduje gen IGFALS. Zkoumali jsme vliv růstového hormonu (GH) na hladiny ALS a dalších složek ternárního komplexu a možnost identifikovat podle nízkých hladin ALS pacienty s patogenními variantami genu IGFALS.
Metody: U 511 dětí s deficitem GH (GHD) a/nebo u dětí s poruchou růstu navazující na malou velikost při narození (SGA-SS) jsme při léčbě GH analyzovali hladiny a vzájemnou korelaci všech tří složek ternárního komplexu. U tří dětí s nízkou hladinou ALS jsme následně sekvenovali gen IGFALS. Vliv podání GH na složky ternárního komplexu jsme studovali u 23 dětí s GHD nebo SGA-SS neurčené etiologie.
Výsledky: U 511 dětí s GHD a/nebo SGA-SS na dlouhodobé léčbě GH byla hladina ALS 8750 µg/l (medián; Q1-Q3 : 6353–10 963), hladina IGF-1 233 µg/l (Q1-Q3 : 147–329), což odpovídalo +1,21 SD (Q1-Q3: -0,11 až +2,45), a hladina IGFBP-3 5660 µg/l (Q1-Q3 : 4668–6800), což odpovídalo +3,65 SD (Q1-Q3: +1,81 až +5,97 SD). Hladiny ALS těsně korelovaly s IGF-1 (r = 0,70; p <0,0001) i s IGFBP-3 (r = 0,61; p <0,0001). Sangerova sekvenace IGFALS u dětí s nízkou hladinou ALS (369, 487 a 1490 µg/l) neprokázala patogenní ani jinou variantu genu. U 23 dětí s GHD nebo SGA-SS stoupla po 3–4 měsících podávání GH hladina ALS z 4859 (medián; Q1-Q3 : 4176–6240) na 6681 (5413–8332) µg/l (p = 0,0004), hladina IGF-1 z 68 (46–114) na 146 (84–178) µg/l (p <0,0001) a hladina IGFBP-3 z 3390 (2820–4030) na 4700 (3940–5300) µg/l (p <0,0001). Vliv GH na IGF-1 (213 % výchozí hodnoty) je výraznější než na IGFBP-3 (132 %; p <0,0001) a ALS (139 %; p <0,0001).
Závěry: Měření hladin ALS není efektivní pro detekci mutací IGFALS. GH zvyšuje hladiny ALS, ale biochemické stanovení ALS má jen nevýznamnou přidanou hodnotu pro diagnostiku a sledování dětí s malým vzrůstem.
Klíčová slova:
acidolabilní podjednotka – IGF-1 – IGFBP-3 – ternární komplex – růstový hormon – IGFALS
ÚVOD
Inzulinu-podobné růstové faktory IGF-1 a IGF-2 (insulin-like growth factor-1 a -2) hrají klíčovou roli v růstu a vývoji. Oba IGF se syntetizují v játrech v endokrinně aktivních hepatocytech, odkud přecházejí do cirkulující krve a působí na cílové buňky ve vzdálených tkáních. Vedle toho se část IGF-1 a IGF-2 produkuje lokálně v řadě typů buněk a působí autokrinně a parakrinně. Oba IGF ovlivňují lineární růst, proliferaci a diferenciaci buněk a apoptózu [1].
V cirkulující krvi jsou téměř všechny molekuly IGF-1 a IGF-2 vázány v ternárním komplexu o velikosti 150 kDa, který se skládá z molekuly IGF, z molekuly vazebného proteinu pro IGF (IGF-binding protein; IGFBP), nejčastěji zastoupeného IGFBP-3 a v menším rozsahu IGFBP-5, a z acidolabilní podjednotky (acid-labile subunit; ALS) – glykoproteinu o velikosti 85 kDa [2]. Vedle IGFBP-3 a IGFBP-5 jsou v omezeném množství přítomny další vazebné proteiny – IGFBP-1, 2, 4 a 6, které mají menší molekulovou hmotnost 50 kDa. Zatímco binární komplex tvořený IGF a některým z IGFBP může pronikat přes endoteliální bariéru, navázání ALS a vytvoření ternárního komplexu prodlužuje dobu, kdy je IGF přítomen v cirkulující krvi a zároveň chráněn před destrukcí [3] (obr. 1). Poločas volně cirkulujícího IGF-1 je pouhých 10 minut; binární komplex IGF-1 – IGFBP-3 přetrvává v krvi 30–90 minut a ternární komplex s ALS prodlužuje poločas na více než 12 hodin [3].
Obr. 1. IGF-1 a IGF-2 cirkulují v krvi v podobě ternárního komplexu s vazebným proteinem (převážně vazebným proteinem 3. typu; IGFBP-3) a s acidolabilní podjednotkou (ALS). Tato vazba prodlužuje poločas jejich působení a zajišťuje jejich rezervoár v krvi. 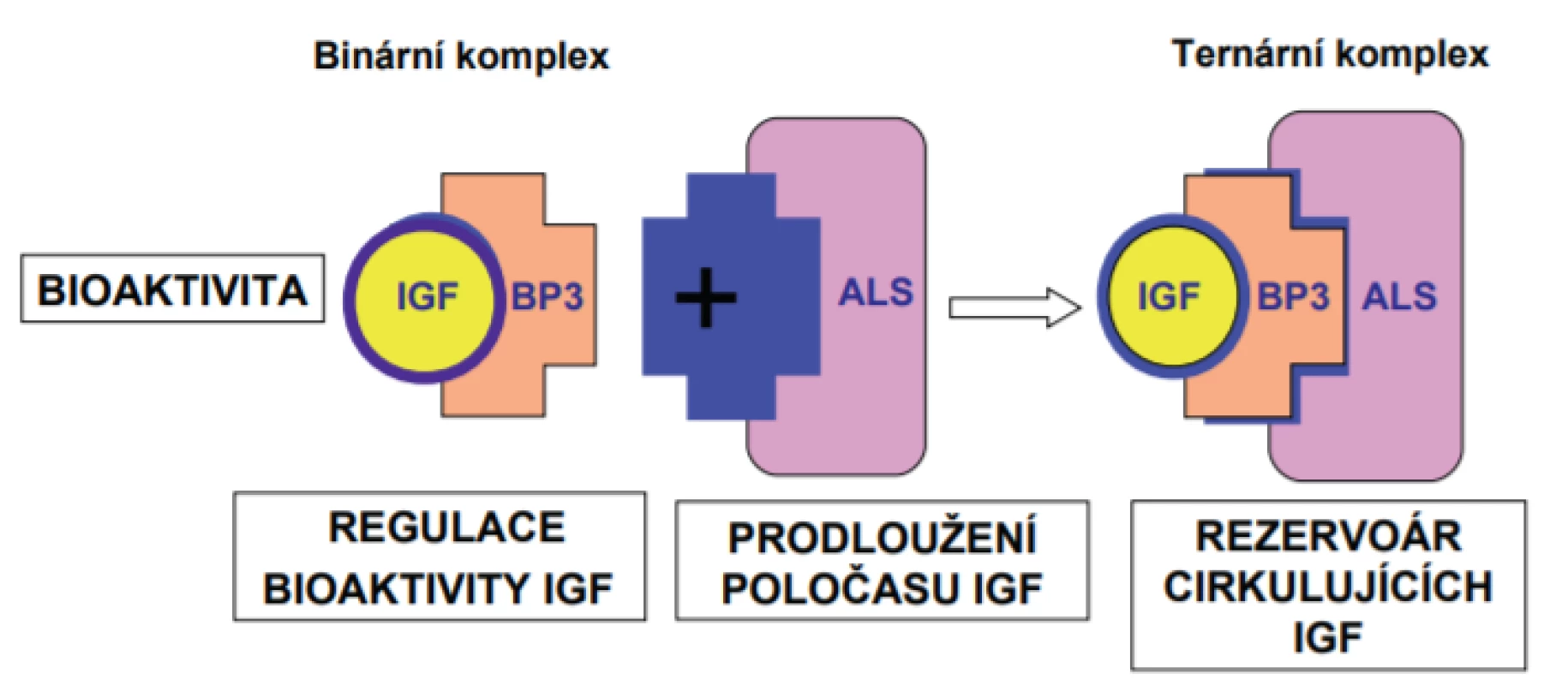
ALS je kódována genem IGFALS [4]. Patogenní varianty IGFALS snižují nebo zvyšují stabilitu ternárního komplexu a způsobují růstovou poruchu, která je závažná zvláště v případě homozygotních mutací, delecí nebo duplikací. U heterozygotních patogenních variant je porucha růstu mírnější [5–8].
I když brzy po objevu ALS v 90. letech 20. století proběhlo několik in vitro studií u různých živočišných druhů a později i některé klinické studie [9], zatím není jasný diagnostický význam stanovení hladiny ALS u dětí s růstovou poruchou ani u dětí s poruchou růstu na podkladě patogenních variant IGFALS genu [10].
Cílem naší studie bylo:
(1) Stanovit hladiny složek ternárního komplexu IGF-1/IGFBP-3/ALS v periferní krvi v rozsáhlé skupině 511 dětí dlouhodobě léčených růstovým hormonem (GH) a klasifikovaných jako deficit GH (GHD) nebo jako porucha růstu navazující na malou velikost při narození (small for gestational age – short stature; SGA-SS). Cílem tohoto vyšetření bylo nalézt dosud neznámé nositele homozygotních nebo heterozygotních patogenních variant genu IGFALS a ověřit hypotézu, že nízká hladina ALS při léčbě růstovým hormonem může predikovat nerozpoznanou patogenní variantu genu IGFALS.
(2) Formou semilongitudinální studie s párovým měřením posoudit vliv zahájení léčby GH na hladiny složek ternárního komplexu IGF-1/IGFBP-3/ALS v periferní krvi u nově diagnostikovaných dětí s GHD a u dětí SGA-SS.
SOUBOR PACIENTŮ A METODIKA
Všichni pacienti zařazení do studie jsou dlouhodobě sledováni na Pediatrické klinice 2. lékařské fakulty UK a Fakultní nemocnice v Motole a jsou léčeni růstovým hormonem z indikace GHD nebo SGA-SS.
Studie 1 – Stanovení složek ternárního komplexu u velké kohorty dětí s GHD a SGA-SS léčených GH
V této studii jsme vyšetřili jednotlivé složky ternárního komplexu během dlouhodobé léčby GH u 511 dětí (321 chlapců, 190 dívek) ve věku 2–18 let (medián 10 let). V případě nízké hladiny ALS bylo pacientům nabídnuto molekulárně genetické vyšetření genu IGFALS. Po podpisu informovaného souhlasu byla odebrána krev na izolaci DNA. Studie byla schválena Etickou komisí Fakultní nemocnice v Motole.
Studie 2 – Semilongitudinální studie vlivu GH na vývoj hladin složek ternárního komplexu
U 23 dětí (18 chlapců, 5 dívek) ve věku 3–15 let (medián 7 let) s GHD (n = 19) nebo SGA-SS (n = 4) jsme vyšetřili hladiny IGF-1, IGFBP-3 a ALS před zahájením léčby a po 3–4 měsících podávání GH, který byl aplikován v přesně definované dávce 0,033 mg/kg/den v každodenní s.c. injekci.
Stanovení acidolabilní podjednotky (ALS)
Stanovení ALS v séru bylo provedeno ELISA sendvičovou metodou za použití komerčního kitu (Human ALS, Mediagnost, Německo). Principem metody je vazba molekul ALS obsažených ve vzorku na protilátky, které jsou imobilizovány na povrchu jamek mikrotitrační destičky. Následně se k imobilizovaným molekulám ALS přidá biotinizovaná protilátka anti-ALS, která s nimi interaguje a vzniklý komplex následně váže konjugát streptavidin/peroxidáza, který v závěrečném kroku katalyzuje přeměnu přidaného substrátu. Enzymatická reakce dává vznik barevnému produktu, který je kvantitativně závislý na množství ALS ve vzorku a jehož množství se detekuje spektrofotometricky (450 nm). Linearita systému měření byla deklarována v rozsahu 0,5330 µg/mL ALS. Pro více koncentrované vzorky bylo měření opakováno po větším naředění. Analýza všech vzorků, kontrolních a kalibračních roztoků byla provedena duplicitně. Koncentrace ALS ve vzorku byla vypočítána z rovnice získané nelineární regresí kalibrační křivky.
Stanovení IGF-1 a IGFBP-3
Stanovení IGF-1 a IGFBP-3 v séru bylo provedeno pomocí automatického imunoanalyzátoru Immulite 1000 (Siemens Healthcare Diagnostics). Princip metody je založen na enzymatické chemiluminiscenční imunochemické reakci v pevné fázi.
Sekvenace genu IGFALS
DNA byla izolována pomoci QIAmp DNA Blood Mini kit, Sangerovo sekvenování genu IGFALS jsme prováděli s využitím metodiky publikované v naší předchozí studii [11].
Statistika
Ke statistickému hodnocení výsledků byl použit párový a nepárový t-test a test lineární regrese se stanovením korelačního koeficientu „r“. Za statisticky významné byly považovány výsledky s hodnotou p <0,05.
VÝSLEDKY
Studie 1 – Stanovení složek ternárního komplexu u velké kohorty dětí s GHD a SGA-SS na léčbě růstovým hormonem
U 511 dětí s GHD a/nebo SGA-SS na dlouhodobé léčbě GH jsme nalezli střední hladinu ALS 8750 µg/l (medián; Q1-Q3 : 6353–10 963), střední hladinu IGF-1 233 µg/l (Q1-Q3 : 147–329), což odpovídalo standardizované hodnotě +1,21 SD (Q1-Q3: -0,11 až +2,45), a střední hladinu IGFBP-3 5660 µg/l (Q1-Q3 : 4668–6800), což odpovídalo standardizované hodnotě +3,65 SD (Q1-Q3: +1,81 až +5,97 SD).
Hladiny ALS těsně korelovaly s hladinami IGF-1 (r = 0,70; p <0,0001 – obr. 2) i s hladinami IGFBP-3 (r = 0,61; p <0,0001).
Obr. 2. Korelace mezi hladinami IGF-1 a ALS u dětí s GHD a/nebo SGA-SS, které jsou léčené růstovým hormonem. Měření hladin ALS nepřináší novou významnou informaci o průběhu léčení. 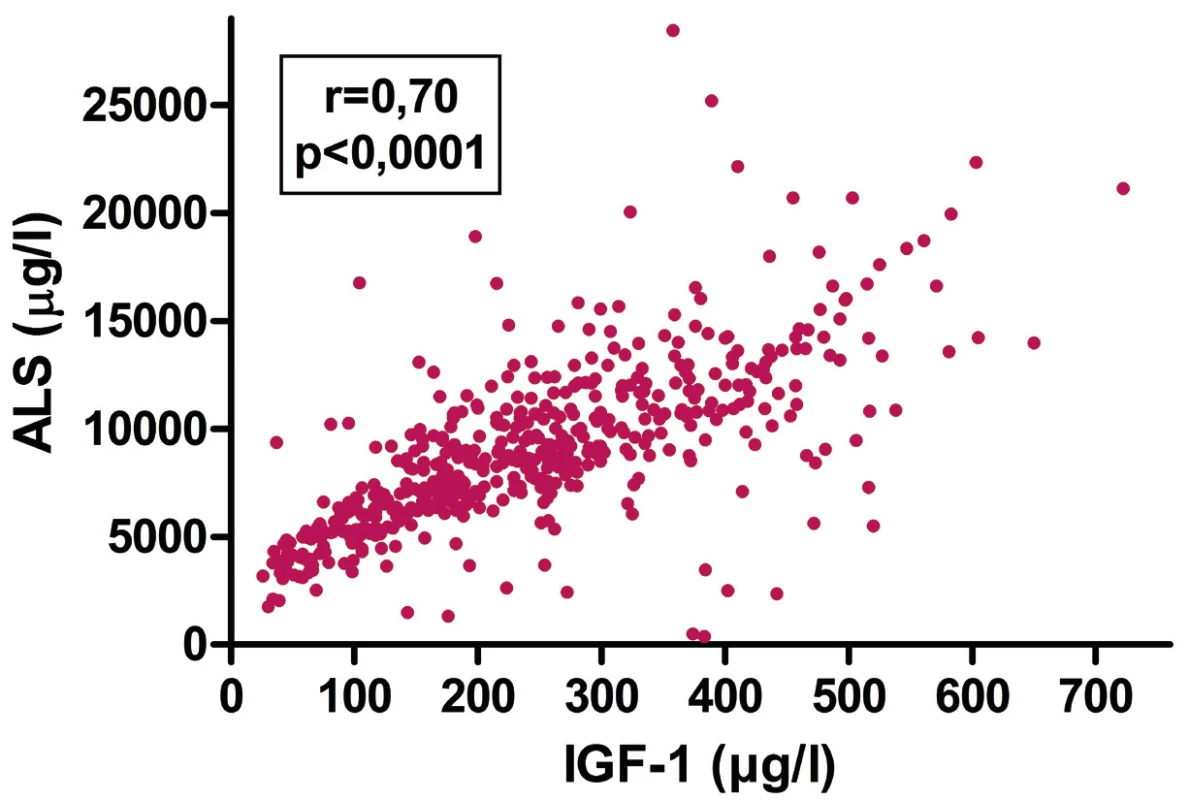
V tabulce 1 jsou uvedeny nálezy u 3 pacientů s mimořádně nízkými hodnotami ALS a současně s nenápadnými hodnotami IGF-1 a IGFBP-3 na léčbě GH. U těchto pacientů jsme provedli sekvenaci genu IGFALS. Sangerovým sekvenováním jsme nenalezli patogenní ani jinou variantu genu IGFALS.
Tab. 1. Laboratorní výsledky při léčbě růstovým hormonem u tří dětí s nízkými hladinami ALS, u kterých byla následně provedena sekvenace genu IGFALS. 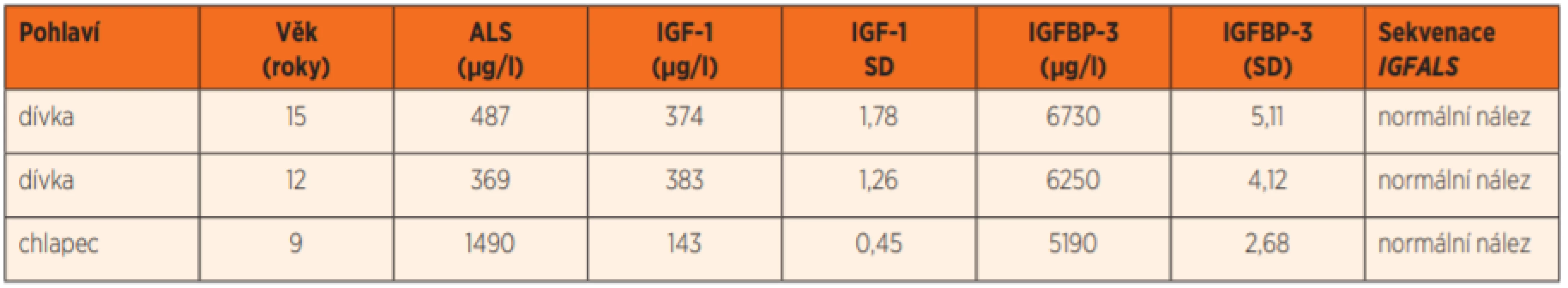
Studie 2 – Semilongitudinální studie vlivu GH na hladiny složek ternárního komplexu
U 23 dětí stoupla během 3–4 měsíců léčby GH hladina ALS z 4859 (medián: Q1-Q3 : 4176–6240) na 6681 (5413–8332) µg/l (p = 0,0004; obr. 3), hladina IGF-1 z 68 (46–114) na 146 (84–178) µg/l (p <0,0001) a hladina IGFBP-3 z 3390 (2820–4030) na 4700 (3940–5300) µg/l (p <0,0001). GH tedy ovlivňuje všechny složky ternárního komplexu, ale jeho vliv na IGF-1 (vzestup na 213 % výchozí hodnoty) je výraznější než vliv na IGFBP-3 (132 %; p <0,0001) a ALS (139 %; p <0,0001, obr. 4).
Obr. 3. Hladiny ALS před zahájením léčby růstovým hormonem a za 3–4 měsíce trvání léčby u 23 dětí s GHD a/nebo SGA-SS. 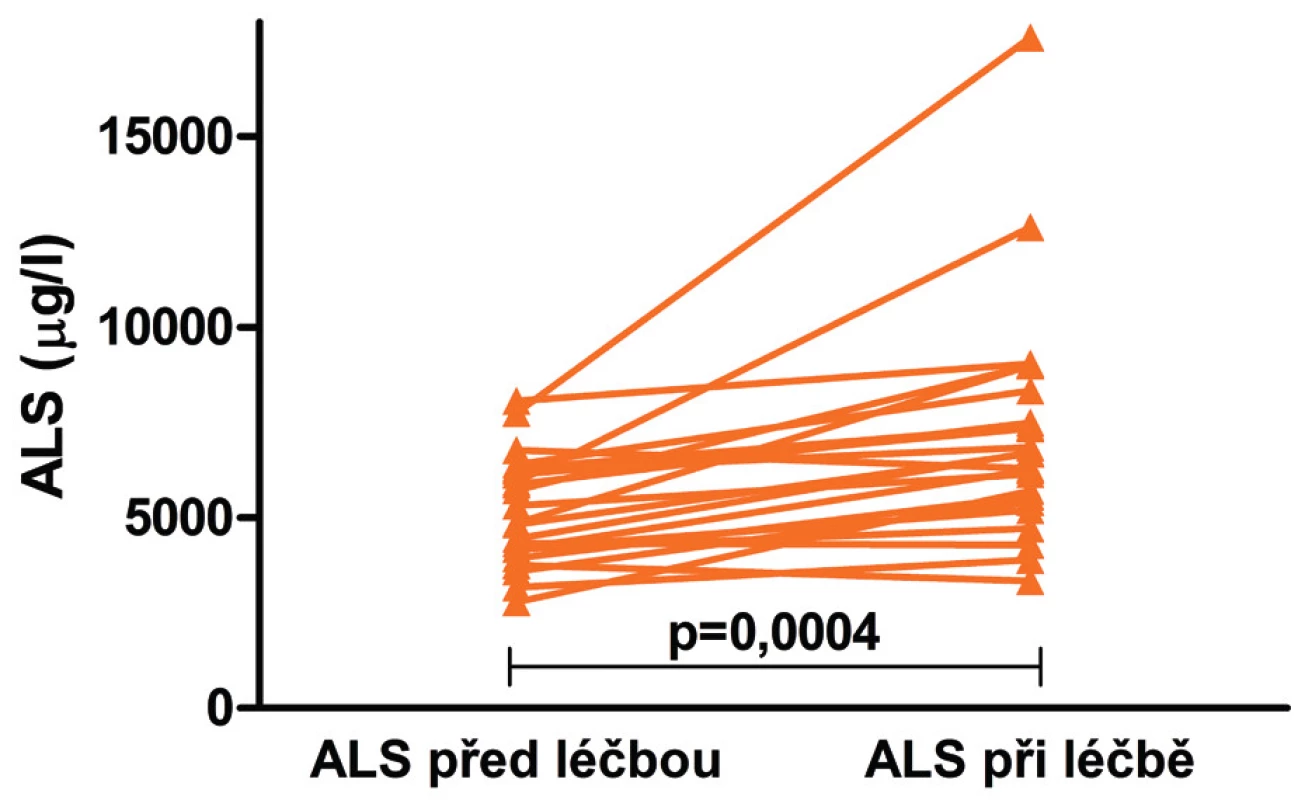
Obr. 4. Koeficient vzestupu hladin IGF-1, ALS a IGFBP-3 po 3–4 měsících trvání léčby růstovým hormonem u 23 dětí s GHD a/nebo SGA-SS. 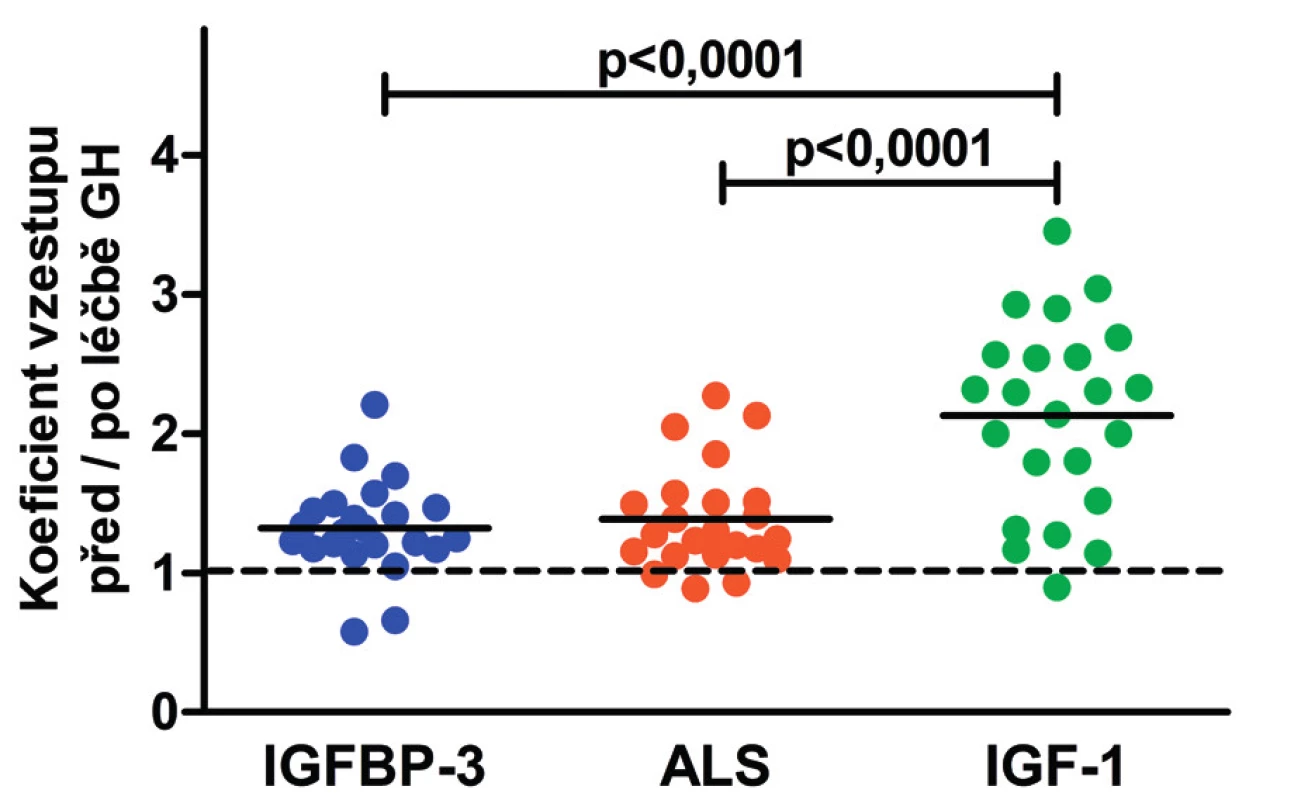
DISKUSE
Přestože zájem o ALS trvá již přes tři desetiletí, jsou údaje o jejím fyziologickém významu a o její patofyziologii fragmentární. Pro pochopení role ALS v organismu v roce 2001 Ueki se spolupracovníky [12] modelovali inaktivaci IGFALS genu u myši. Zjistili, že tato myš má jen mírnou růstovou retardaci, přestože cirkulující složky IGF systému jsou závažně alterované. O několik let později byl genový defekt IGFALS a jeho fenotyp poprvé popsán u člověka [6]. Byl identifikován u 17letého mladého muže s opožděným nástupem a pomalým průběhem puberty, ale jen s hraniční růstovou poruchou. Tento původní fenotyp byl na základě pozorování u dalších desítek nositelů mutace zpřesněn: Narušení pubertálního vývoje může být jedním z příznaků, ale porucha růstu je konzistentní, i když v jednotlivých případech různě závažná [8].
Identifikace chlapce s patogenní variantou IGFALS v naší předchozí studii [13] vzbudila náš zájem o ALS. Proto jsme se v několika dílčích studiích pokusili doplnit chybějící poznatky, které mohou mít význam pro klinickou praxi v dětské endokrinologii.
S cílem identifikovat patogenní varianty genu IGFALS jsme vyšetřili koncentraci ALS v cirkulující krvi u kohorty pacientů při léčbě GH. U tří z nich s nízkými hladinami ALS jsme sekvenovali gen IGFALS. U žádného z nich jsme neprokázali patogenní ani jinou variantu genu. K podobnému závěru dospěli i Renes se spolupracovníky [9], kteří sekvenovali gen IGFALS u 34 dětí s nízkou koncentrací ALS v séru a též nenašel patogenní variantu. Naše studie byla limitována chyběním pacientů s potvrzenou patogenní variantou IGFALS, u kterých bychom stanovili nativní hladiny ALS.
Je zajímavé, že většina dosud identifikovaných pacientů s patogenními variantami IGFALS nebyla zjištěna na základě měření ALS, ale na základě velmi nízkých hladin IGF-1 a IGFBP-3 v době diagnostiky – protože chybění aktivní ALS výrazně zkracuje jejich poločas. Teprve dodatečně byly u některých těchto pacientů změřeny nízké až neměřitelné hladiny ALS a následné sekvenování IGFALS prokázalo patogenní variantu [14–16]. V jiných případech byly varianty IGFALS nalezeny metodami celoexomového sekvenování dětí s malým vzrůstem, podobně jako v naší předchozí studii [13].
Vliv GH na všechny složky ternárního komplexu jsme jednoznačně prokázali v semilongitudinální studii u 23 dětí s GHD nebo SGA-SS. Působení na sekreci IGF-1 je výraznější (vzestup na 213 % výchozí hodnoty) než vliv na IGFBP-3 (132 %), což je v souladu s předchozími studiemi [17, 18]. Signifikantní byl i vzestup koncentrace ALS po zahájení terapie růstovým hormonem ALS (139 %), který dosud publikován nebyl a který prokazuje, že exprese genu IGFALS je řízena růstovým hormonem – ALS patří mezi tzv. „GH-dependentní peptidy“.
Měření hladin IGF-1, IGFBP-3 a ALS v početné skupině 511 dětí s GHD a/nebo SGA-SS dlouhodobě léčených GH ukázalo, že stanovení ALS nepřináší o diagnóze ani o průběhu léčby další významnou novou informaci v porovnání s měřením IGF-1, případně IGFBP-3, vzhledem k těsné korelaci mezi naměřenými hodnotami těchto peptidů.
Uvedené závěry naznačují, že laboratorní stanovení ALS má v současné době jen nevýznamnou přidanou hodnotu pro diagnostiku a další sledování dětí s malým vzrůstem.
Poděkování
Studie byla provedena s podporou grantu Agentury pro zdravotnický výzkum (AZV) č. 18-07-00283.
MUDr. Ledjona Toni
Pediatrická klinika 2. lékařské fakulty UK
a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: ledjonatoni@gmail.com
Zdroje
1. Werner H, Stannard B, Bach MA. Regulation of insulin-like growth factor I receptor gene ex-pression in normal and pathological states. Adv Exp Med Biol 1991; 293 : 263–272.
2. Allard JB, Duan C. IGF-binding proteins: Why do they exist and why are there so many? Front Endocrinol 2018; 9 : 117.
3. Boisclair Y, Rhoads RP, Ueki I, et al. The acid-labile subunit (ALS) of the 150 kDa IGF-binding protein complex: an important but forgotten component of the circulating IGF system. J Endocrinol 2001; 170 (1): 63–70.
4. Domené HM, Bengolea SV, Martínez AS, et al. Deficiency of the circulating insulin-like growth factor system associated with inactivation of the acid-labile subunit gene. N Engl J Med 2004; 350 (6): 570–577.
5. Renes JS, van Doorn J, Hokken-Koelega A, et al. Current insights into the role of the growth hormone–insulin-like growth factor system in short children born small for gestational age. Horm Res Paediatr 2019; 92 : 15–27.
6. Fofanova-Gambetti OV, Hwa V, Wit JM, et al. Impact of heterozygosity for acid-labile subunit (IGFALS) gene mutations on stature: results from the international acid-labile subunit consortium. J Clin Endocrinol Metab 2010; 95 (9): 4184–4191.
7. Högler W, Martin DD, Crabtree N, et al. IGFALS gene dosage effects on serum IGF-I and glucose metabolism, body composition, bone growth in length and width, and the pharmacokinetics of recombinant human IGF-I administration. J Clin Endocrinol Metab 2014; 99 (4): 703–712.
8. Domené HM, Scaglia PA, Martínez AS, et al. Heterozygous IGFALS gene variants in idiopa-thic short stature and normal children: impact on height and the IGF system. Horm Res Paediatr 2013; 80 (6): 413–423.
9. Renes JS, van Doorn J, Breukhoven PE, et al. Acid-labile subunit levels and the association with response to growth hormone treatment in short children born small for gestational age. Horm Res Paediatr 2014; 8 (2): 126–132.
10. Ertl D, Gleiss A, Sagmeister S, et al. Determining the normal range for IGF-I, IGFBP-3, and ALS: new reference data based on current internal standards. Wien Med Wochenschr 2014; 164 : 343–352.
11. Pruhova S, Dusatkova P, Sumnik Z, et al. Glucokinase diabetes in 103 families from a country based study in the Czech Republic: geographically restricted distribution of two prevalent GCK mutations. Pediatr Diabetes 2010; 11 (8): 529–535.
12. Ueki I, Ooi GT, Tremblay ML, et al. Inactivation of the acid labile subunit gene in mice results in mild retardation of postnatal growth despite profound disruptions in the circulating insulin-like growth factor system. Proc Natl Acad Sci USA 2000; 97 (12): 6868–6873.
13. Plachy L, Strakova V, Elblova L, et al. High prevalence of growth plate gene variants in children with familial short stature treated with GH. J Clin Endocrinol Metab 2019; 104 (10): 4273–4281.
14. Heath KE, Argente J, Barrios V, et al. Primary acid-labile subunit deficiency due to recessive IGFALS mutations results in postnatal growth deficit associated with low circulating insulin growth factor (IGF)-I, IGF binding protein-3 levels, and hyperinsulinemia. J Clin Endocrinol Metab 2008; 93 (5): 1616–1624. Erratum in: J Clin Endocrinol Metab 2008; 93 (6): 2426.
15. Dominguez-Menéndez G, Poggi Mayorga H, Arancibia M, et al. ALS deficiency caused by an exon 2 deletion and a novel missense variant in the gene encoding ALS. Growth Horm IGF Res 2019; 48–49 : 5–8.
16. Hwa V, Haeusler G, Pratt KL, et al. Total absence of functional acid labile subunit, resulting in severe insulin-like growth factor deficiency and moderate growth failure. J Clin Endocrinol Metab 2006; 91 (5): 1826–1831.
17. Shanxiang R., Yuxiang N, Aihong W. Effects of recombinant human growth hormone in the treatment of dwarfism and relationship between IGF-1, IGFBP-3 and thyroid hormone. Exp Ther Med 2016; 12 : 3579–3582.
18. Ballerini MG, Braslavsky D, Scaglia PA, et al. Circulating IGF-I, IGFBP-3 and the IGF-I/IGFBP-3 molar ratio concentration and height outcome in prepubertal short children on rhGH treatment over two years of therapy. Horm Res Paediatr 2013; 80 : 413–423.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Prenatální fenotyp RASopatií
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2020 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Jak včas rozpoznat vzácné onemocnění? S diagnostickou rozvahou pomůže accelRare
-
Všechny články tohoto čísla
- Dětský růst v zrcadle času – a věčný třetí percentil
- Analýza dat z celostátního registru pacientů léčených růstovým hormonem REPAR
- Význam acidolabilní podjednotky (ALS) v etiologii a v diagnostice malého vzrůstu
- Syndrom Noonanové a další RASopatie: Etiologie, diagnostika a terapie
- Syndrom Noonanové z pohledu dětského kardiologa
- Prenatální fenotyp RASopatií
- Etiologie a diagnostika poruchy růstu u dětí, které se narodily malé na svůj gestační věk (SGA) s přetrvávající malou výškou v dětství (SGA-SS)
- Růstové databáze a registry – cesta k poznání fyziologických účinků růstového hormonu
- Porucha růstu u 11leté dívky s diabetem
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Syndrom Noonanové a další RASopatie: Etiologie, diagnostika a terapie
- Etiologie a diagnostika poruchy růstu u dětí, které se narodily malé na svůj gestační věk (SGA) s přetrvávající malou výškou v dětství (SGA-SS)
- Syndrom Noonanové z pohledu dětského kardiologa
- Prenatální fenotyp RASopatií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



