-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaModerní technologie v terapii diabetu 1. typu v dětském věku
The role of modern technologies in management of Type 1 diabetes in children
Type 1 diabetes (T1D) treatment in children has been changed significantly by the implementation of modern technologies into clinical practice in the last decade. Novel insulins and its combinations enables tailoring the insulin program personally in accord with the patients´ needs. Major changes have been achieved in the development of continuous glucose monitoring systems (CGM). These devices help our patients to follow, archive and analyze complete glycemic profiles, and – if necessary – to send it to the physician. Modern insulin pumps sense data from CGM devices and adjust insulin dosage automatically to effectively prevent hypo - and hyperglycemia and prolong time in glycemic target. There is no doubt that the process of tighter connection between CGM and insulin pumps will continue in the near future aiming to develop full closed-loop system independent on patient’s diet and regimen. Current data show that such progress seems to be realistic in the relative short run.
Keywords:
insulin analogs – continuous glucose monitoring – insulin pump
Autoři: Z. Šumník; L. Petruželková; S. Koloušková; Š. Průhová
Působiště autorů: Pediatrická klinika 2. LF UK a FN Motol, Praha
Vyšlo v časopise: Čes-slov Pediat 2019; 74 (1): 5-10.
Kategorie: Sympozium: Dětská diabetologie
Souhrn
Léčba diabetu 1. typu (DM1) se v posledních 10 letech výrazně proměnila v důsledku zavádění moderních technologií do každodenní praxe. Sledujeme výrazný posun ve spektru a dostupnosti inzulinových analog, pomocí nichž je možné sestavit inzulinový program na míru svému nositeli, a tím zlepšit kompenzaci DM1 a zvýšit kvalitu života diabetických dětí a jejich rodin. Největšího pokroku bylo v posledních letech dosaženo díky vývoji kontinuálních monitorů glykémie (CGM) a jejich rychlé implementaci do běžné klinické praxe. Pomocí těchto přístrojů je nyní možné sledovat dynamiku vlastních glykémií v reálném čase, reagovat na aktuální hodnoty a trendy, tyto údaje archivovat a podle potřeby odesílat ošetřujícímu lékaři. Moderní inzulinové pumpy jsou schopny upravovat dávkování inzulinu na základě dat získaných z CGM a zabránit tak vzniku hypo - a hyperglykémií. Je nepochybné, že blízká budoucnost patří stále užšímu spojení mezi oběma systémy – CGM a inzulinovou pumpou – za vzniku tzv. uzavřené smyčky. Klinické studie jednoznačně ukazují, že takové spojení je v poměrně krátké době možné.
Klíčová slova:
inzulinová analoga – kontinuální monitorování glykémie – inzulinová pumpa
ÚVOD
Rozšíření technologických možností v posledních několika letech do určité míry proměnilo celou medicínu, nicméně existují obory, kde je změna vpravdě revoluční. Mezi ně se bezpochyby řadí diabetologie, což přináší pacientům reálné možnosti dlouhodobého dosažení optimální kompenzace a současně lékařům tomuto oboru se věnujícím nové výzvy. Ty je třeba vyslyšet, protože jen tak lze našim pacientům poskytovat péči na úrovni 21. století. Je zřejmé, že se nejedná o jednoduchý proces, jde o změnu paradigmat ve smyslu celkového nahlížení na diabetes jako nemoc. Znamením této doby je pro diabetology schopnost učit se novým přístupům a své zaběhané postupy neustále konfrontovat s výsledky klinických studií zabývajících se moderními technologiemi, jež odborné časopisy chrlí ve stále se stupňující frekvenci. Následující článek shrnuje aktuální možnosti moderních technologií v diabetologii.
NOVINKY V INZULINOTERAPII
Po úspěšné extrakci inzulinu ze psích pankreatů Bantingem a Bestem v roce 1922 se až do 80. let 20. století využívaly inzuliny zvířecí, nejčastěji vepřové. S rozvojem biotechnologií začal být k dispozici humánní inzulin a v roce 1998 se dostal do distribuce první inzulinový analog lispro (Humalog Lilly) [1], čímž začala éra inzulinových analog, tedy upravených, v přírodě se nevyskytujících inzulinů s různými farmakokinetickými vlastnostmi. V současné době máme k dispozici sedm preparátů, které se mohou u jednoho pacienta kombinovat mezi sebou i s inzuliny humánními. Složení inzulinového programu tak záleží na domluvě mezi pacientem a diabetologem s cílem maximálně přizpůsobit inzulinové schéma dennímu režimu konkrétního dítěte.
Inzulinová analoga
Podle rychlosti nástupu a délky působení rozdělujeme inzulinová analoga na rychlá (tedy s působením rychlejším v porovnání s humánními inzuliny) a depotní (tedy pomalejší než depotizovaný střednědobý humánní inzulin NPH). Rychlost nástupu a délku působení jednotlivých inzulinů a inzulinových analog shrnuje obrázek 1.
Obr. 1. Farmakokinetika nejčastějších typů inzulinu užívaných v léčbě diabetu 1. typu u dětí. 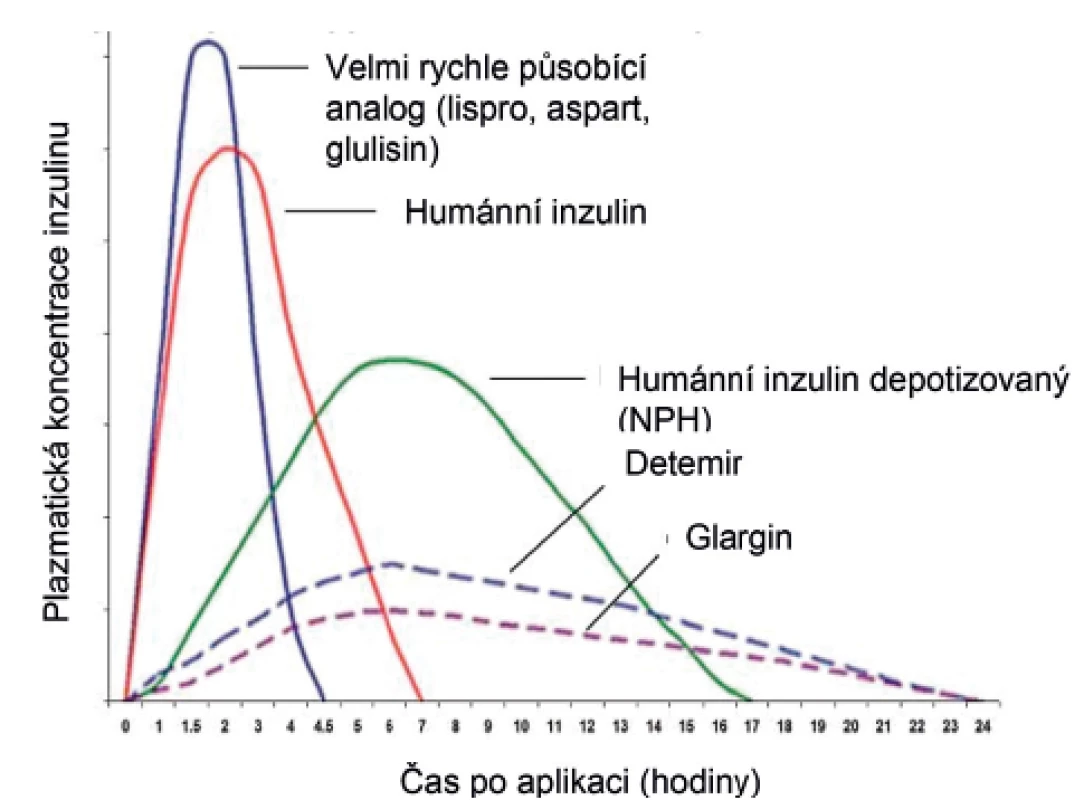
Po subkutánní aplikaci tvoří inzulin v místě vpichu depo, ze kterého se postupně resorbuje ve formě monomerů do krevního oběhu. Rychlost a kvalita absorpce závisí na fyzikálně-chemickém charakteru inzulinu, velikosti dávky a prokrvení tkáně v místě vpichu.
Rychle působící analoga inzulinu („rapid-acting“) se vstřebávají ze všech inzulinů nejrychleji. Zahrnují inzuliny lispro, aspart a glulisin a nejnověji ultrarychlý inzulin aspart, který je prozatím možné podávat pouze dospělým. Všechny tyto inzuliny sice mají rozdílnou strukturu, ale (s výjimkou ultrarychlého aspartu, který působí nejrychleji) prakticky totožné farmakokinetické vlastnosti. Záměna aminokyselin v jejich molekule narušuje vazbu mezi monomerními peptidovými řetězci a umožňuje rychlou disociaci hexametrů a dimerů inzulinu na monomery, čímž je zajištěno rychlejší uvolnění do cirkulace.
Rychlá analoga inzulinu začínají působit již za několik minut po injekci, doba mezi aplikací a jídlem se tedy může v porovnání s humánními inzuliny zkrátit na 10‒15 minut, což zlepšuje adherenci k léčbě. Výhodou rychlých analog je cílenější účinek vzhledem k jídlu, prevence postprandiální hyperglykémie a snížení glykemické variability. Jejich krátký účinek je naopak nevýhodou u dětí, které jsou zvyklé konzumovat svačiny s vyšším obsahem sacharidů – v době svačiny už rychlá analoga podaná před předcházejícím velkým jídlem dostatečně nepůsobí, což může vést k vzestupu glykémie před dalším hlavním jídlem. Jejich aplikace by tedy vyžadovala podání před každým jídlem, většinou 6x denně. Proto u těchto dětí s úspěchem využíváme humánní rychlé inzuliny. Rychlá analoga inzulinu exkluzivně používáme při léčbě inzulinovou pumpou, výhodná jsou pro svůj rychlý nástup účinku i při korekci hyperglykémie.
Ze skupiny pomalu působících inzulinových analog jsou na našem trhu k dispozici přípravky na bázi glarginu (Lantus Sanofi a Abasaglar Lilly v běžné koncentraci 100 U/ml a Toujeo Sanofi v koncentraci 300 U/ml) s dobou působení až 24 hodin. O něco kratší dobu účinnosti (cca 16 hodin v běžném dávkování) vykazuje inzulin detemir (Levemir NovoNordisk). V některých zemích je v distribuci též inzulin degludec (Tresiba NovoNordisk) s délkou působení 24 až 42 hodin.
Hlavní výhodou těchto preparátů je pomalý nástup účinku a dlouhé rovnoměrné působení. To poněkud snižuje riziko nočních hypoglykémií a pomáhá s udržením stabilnějších ranních glykémií. Proto jsou první volbou v terapii dawn fenoménu, nepříjemného vzestupu glykémie ve druhé polovině noci [2]. V některých inzulinových režimech představují skutečnou bazální dodávku inzulinu a mohou být podávány např. v kombinaci s rychle působícími analogy 1–2x denně.
SYSTÉMY PRO KONTINUÁLNÍ MONITORY GLYKÉMIE (CGM – CONTINUOUS GLUCOSE MONITORING)
První přístroje schopné kontinuálního monitorování glykémie v reálném čase přešly do praxe těsně po přelomu tisíciletí [3]. Šlo o poměrně robustní výrobky, jejichž přesnost sice zdaleka nebyla optimální (průměrné rozdíly proti běžnému vyšetření glykémie z krve osobním glukometrem činily přibližně 30 %), nicméně díky nim měli pacienti poprvé možnost vidět průběh vlastních glykémií v celé jejich dynamice. S rozvojem technických možností od té doby přesnost, velikost i design CGM přístrojů prodělaly několik generačních výměn a v současnosti se jedná o malé přístroje nebudící pozornost (obr. 2A) s přesností pouze nepatrně horší v porovnání s glukometry. Prakticky univerzálně platí, že systém CGM se skládá ze tří základních částí:
- senzoru, který je zaveden do podkoží a který je schopen po určitou dobu (většinou 7‒14 dní) zaznamenávat změny koncentrace glukózy ve svém okolí;
- vysílače, který je spojen se senzorem, vyhodnocuje jeho údaje a odesílá je za pomoci bezdrátové technologie do přijímače;
- přijímače, jenž signály vycházející z vysílače zpracovává a ukazuje uživateli na displeji. Přijímačem může být buď mobilní telefon, inzulinová pumpa, nebo speciální glukometr schopný komunikovat s vysílačem. Dosah signálu přenášeného mezi vysílačem a přijímačem může být několik metrů.
Senzor se zavádí podkožně speciálním zavaděčem do míst běžně používaných pro injekce inzulinu, resp. pro sety inzulinové pumpy. Senzory se doporučuje umístit nejméně 8 cm od místa podávání inzulinu nebo zavedení kanyly inzulinové pumpy. Hloubka vpichu je několik milimetrů, je tedy možné senzory využívat i při monitoraci glykémie u novorozenců a kojenců.
Obr. 2. Senzor pro kontinuální monitorování glykémie zavedený subkutánně (A), přijímač (displej inzulinové pumpy) se základními informacemi o aktuální dynamice glykémií (B). 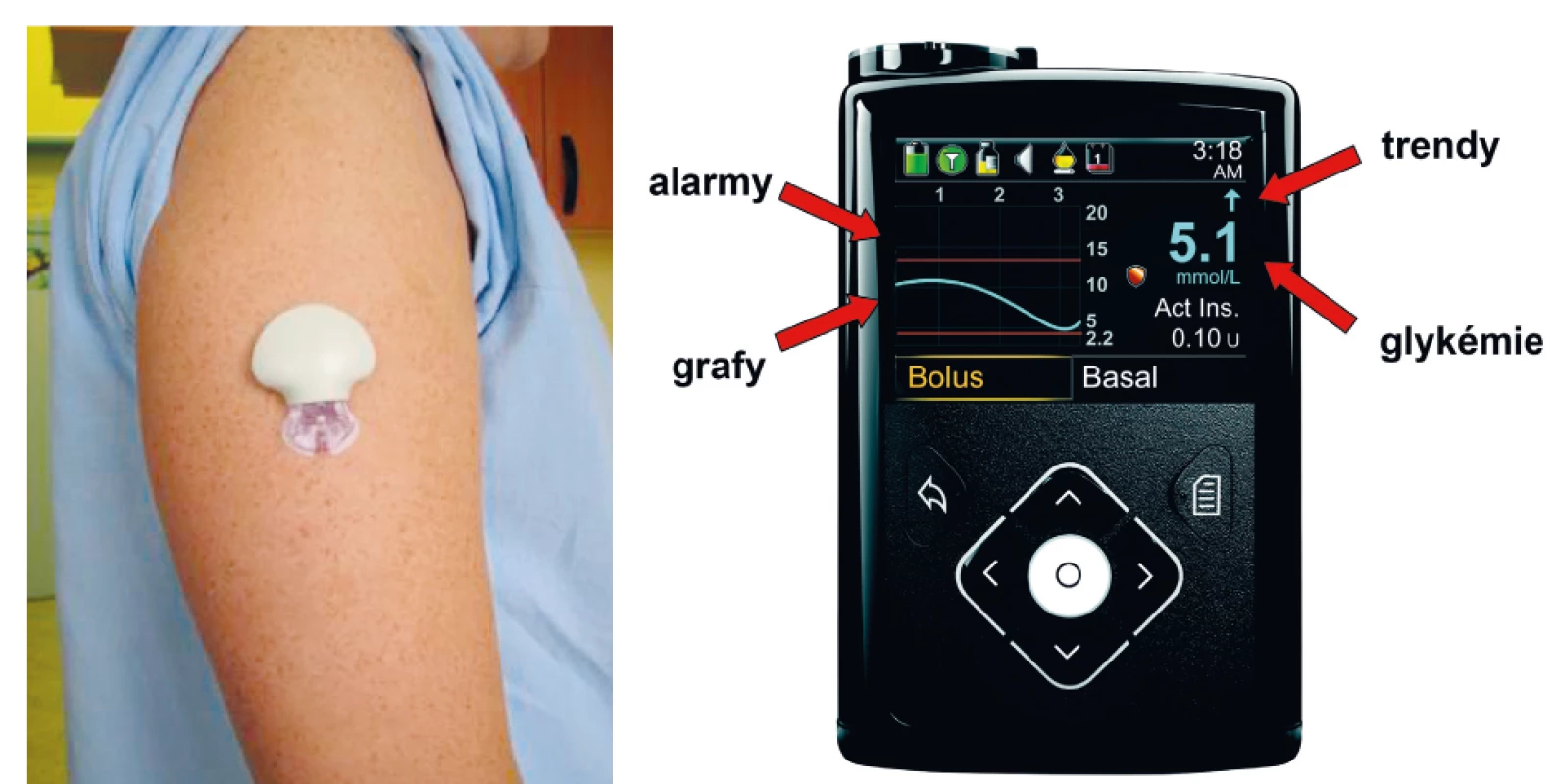
Hodnocení a interpretace výsledků CGM
Při hodnocení a interpretaci výsledků CGM je nutné zohlednit fakt, že senzor kontinuálního monitoru glykémie neměří „glykémii“, tedy koncentraci glukózy v krvi, ale ve svém bezprostředním okolí, tedy v intersticiu. Měření probíhá metodou glukózooxidázové reakce na jehlové elektrochemické elektrodě implantované do podkoží. Vzniklý elektrochemický potenciál je registrován každých několik sekund a průběžně ukládán do paměti zařízení (obr. 3). K vyrovnání obou koncentrací glukózy (v krvi a mezibuněčné tekutině) dochází v určitém časovém posunu ‒ změna glykémie je rychlejší a o určitý čas předchází změně koncentrace glukózy v mezibuněčné tekutině. Při vzestupu glykémie musíme vzít v úvahu zpoždění v délce přibližně 15 minut. Pokles glykémie vede ke snížení koncentrace glukózy v mezibuněčné tekutině rychleji, prodleva je pouze 5‒10 minut [4]. Při používání senzoru se tedy může stát, že při rychlém vzestupu glykémie senzor ukazuje podstatně nižší hodnotu v porovnání s osobním glukometrem, a naopak ‒ při rychlejším poklesu glykémie bývá hodnota zaznamenaná CGM vyšší, než je skutečná glykémie. V tomto smyslu je třeba edukovat uživatele této technologie.
Obr. 3. Denní záznam z kontinuálního monitoru glykémie. 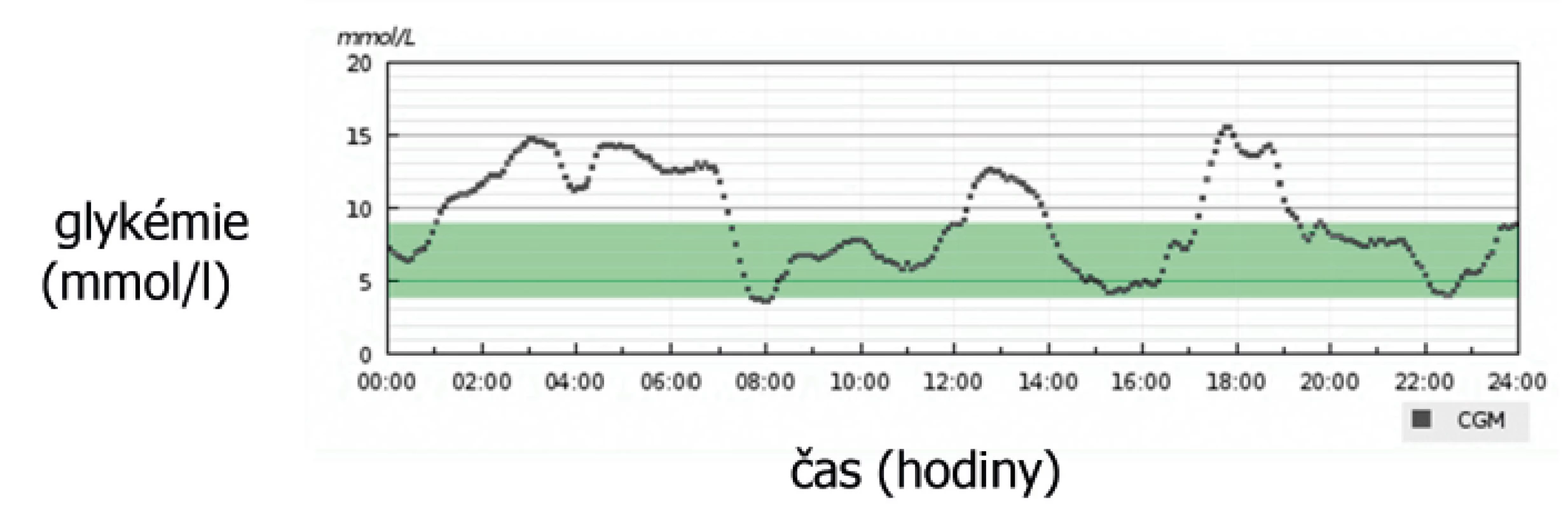
Hodnoty odečtené senzorem lze číst na displeji přijímače (obr. 2B) a následně stáhnout do počítače pomocí speciálních aplikací. Kromě koncentrace glukózy displej ukazuje předpokládané trendy vývoje glykémie. Pomocí jedné až tří šipek směrem nahoru či dolů naznačuje, zda bude v následujících minutách glykémie stabilní, nebo se bude měnit pomalu (jedna šipka dolů či nahoru) nebo rychle (dvě či tři šipky) (obr. 2B). Tato velmi praktická funkce do určité míry překonává výše popsaný problém se zpožděním ve vyrovnávání koncentrací glukózy v krvi a mezibuněčné tekutině. Zkušenějším uživatelům doporučujeme reagovat na tyto trendy zvýšením nebo snížením bolusových dávek inzulinu o 10‒30 % podle předpokládaného stupně změny ukázaného počty trendových šipek [5].
Další praktickou výhodou kontinuálního monitoru glykémie je možnost nastavení alarmů pro hypo - a hyperglykémie. Pomocí této funkce se snižuje na minimum riziko zejména nočních hypoglykémií – pokud koncentrace glukózy klesne pod nastavenou hodnotu, přístroj vydá zvukový signál, který pacienta upozorní na tuto skutečnost. Hranice pro nastavení alarmů jsou individuální. Nejčastěji používáme hranici 4 mmol/l pro hypoglykémii a 10‒12 mmol/l pro hyperglykémie, toto nastavení se však může individuálně lišit podle rizika hypoglykémie.
Většinu aktuálně dostupných přístrojů CGM je nutné pravidelně kalibrovat prostřednictvím zadání aktuální hodnoty glykémie z měření glukometrem. Kalibrujeme minimálně dvakrát denně v době, kdy neočekáváme velké výkyvy, tedy nejlépe nalačno, mimo období hypoglykémie. Výjimkou z tohoto pravidla je na náš trh právě přicházející systém FreeStyle Libre Abbott (obr. 4), který je schopen měřit koncentraci glukózy v intersticiu po dobu 2 týdnů, aniž by byl kalibrován. Tento výrobek v některých zemích zcela změnil situaci na trhu s glukometry. Jeho nevýhodou je ne zcela optimální přesnost měření v krajních polohách a absence alarmů. Ke stažení dat dochází pouze při přiložení glukometru k zavedenému senzoru, neprobíhá tedy trvalá komunikace mezi vysílačem a přijímačem jako v případě klasických CGM senzorů.
Obr. 4. Senzor pro kontinuální monitorování glykémie FreeStyle Libre (Abbott) zavedený osmiletému chlapci s diabetem 1. typu. 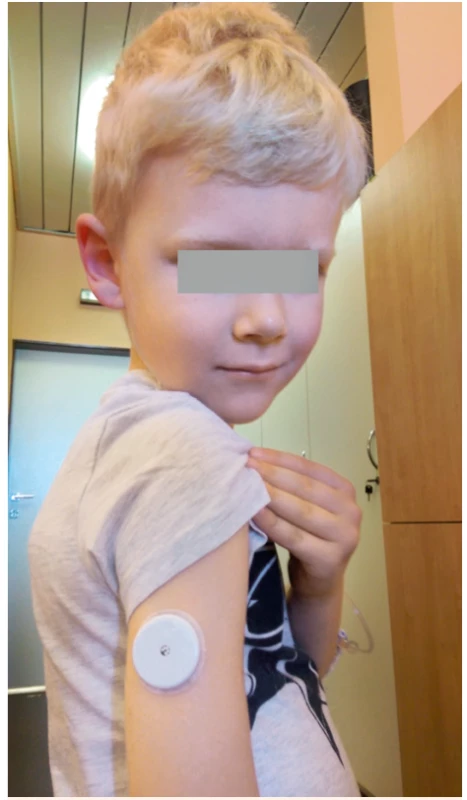
Otázka, zda tato technologie může zásadním způsobem zlepšit kompenzaci diabetu 1. typu, se zdá být jednoznačně zodpovězena. Máme k dispozici velmi dobře designované studie, které jednoznačně prokázaly, že používání technologie CGM zlepšuje kontrolu diabetu bez ohledu na to, zda je pacient léčen inzulinovými pery nebo inzulinovou pumpou [6‒8]. Rozdílovým hráčem se v této souvislosti skutečně zdá být možnost sledovat své glykémie v reálném čase a adekvátně na ně zareagovat. Pro ovlivnění kontroly diabetu v dlouhodobém horizontu je nezbytné používat CGM po co nejdelší dobu, tedy ideálně trvale, minimálně však po 70 % času [9]. Data z národního registru dětského diabetu ČENDA ukazují, že využívání senzorů po dobu delší než 70 % času bylo asociováno se snížením HbA1c o více než 6 mmol/mol. Tento rozdíl může způsobit snížení rizika pozdních komplikací o 30 %.
Výrazný krok k přiblížení této nové technologie našim pacientům nastal na podzim roku 2016, kdy systémy pro CGM začaly být u nás hrazeny z prostředků veřejného zdravotního pojištění. Přestože zejména u dospělých není úhrada stoprocentní, je pro většinu pacientů s diabetem 1. typu splňujících indikační kritéria reálné začít CGM využívat.
INZULINOVÉ PUMPY (CSII – CONTINUOUS SUBCUTANEOUS INSULIN INFUSION)
Inzulinové pumpy nejsou žádnou novinkou na trhu, zaměřím se tedy na nové prvky, které přinesl technologický rozvoj v diabetologii. Tím nejdůležitějším je možnost spojení inzulinové pumpy s CGM. Displej pumpy může být „přijímačem“ pro CGM technologii, nicméně na rozdíl od pacientů léčených pery umí inzulinové pumpy samy automaticky zareagovat na nepříznivý vývoj glykémie vypnutím a částečně též naopak přidáním inzulinu. Pumpa Medtronic model 640G, která je dostupná v ČR, využívá systému tzv. prediktivních alarmů, které upozorňují na riziko hypoglykémie ještě předtím, než skutečně nastane. Pokud na ně pacient nezareaguje, samostatně vypnou, což zabrání poklesu glykémie do nebezpečných pásem (tzv. SmartGuard Technology) (obr. 5) [10]. V prevenci posthypoglykemické hyperglykémie se bazální dávkování inzulinu pumpou automaticky zapne za 30‒120 minut podle vývoje glykémie. Další generace inzulinových pump (Medtronic 670G ‒ dostupná prozatím pouze v USA) [11] je vybavena funkcí automatického zvýšení bazální dávky, pokud senzor hlásí vzestup glykémie. Obě tyto funkce jsou užitečnými pomocníky při korekci glykémie zejména v nočních hodinách [12], nicméně denním hypoglykémiím většinou nezabrání, protože ty jsou způsobeny neadekvátní dávkou bolusového inzulinu aplikovaného před jídlem.
Obr. 5. Funkce prediktivního vypnutí v prevenci nočních hypoglykémií (technologie SmartGuard Medtronic). Šipky ukazují automatické vypnutí bazální dávky inzulinovou pumpou v nočních hodinách, pokles glykémie se následně zastavil, což způsobilo prevenci hypoglykémie. 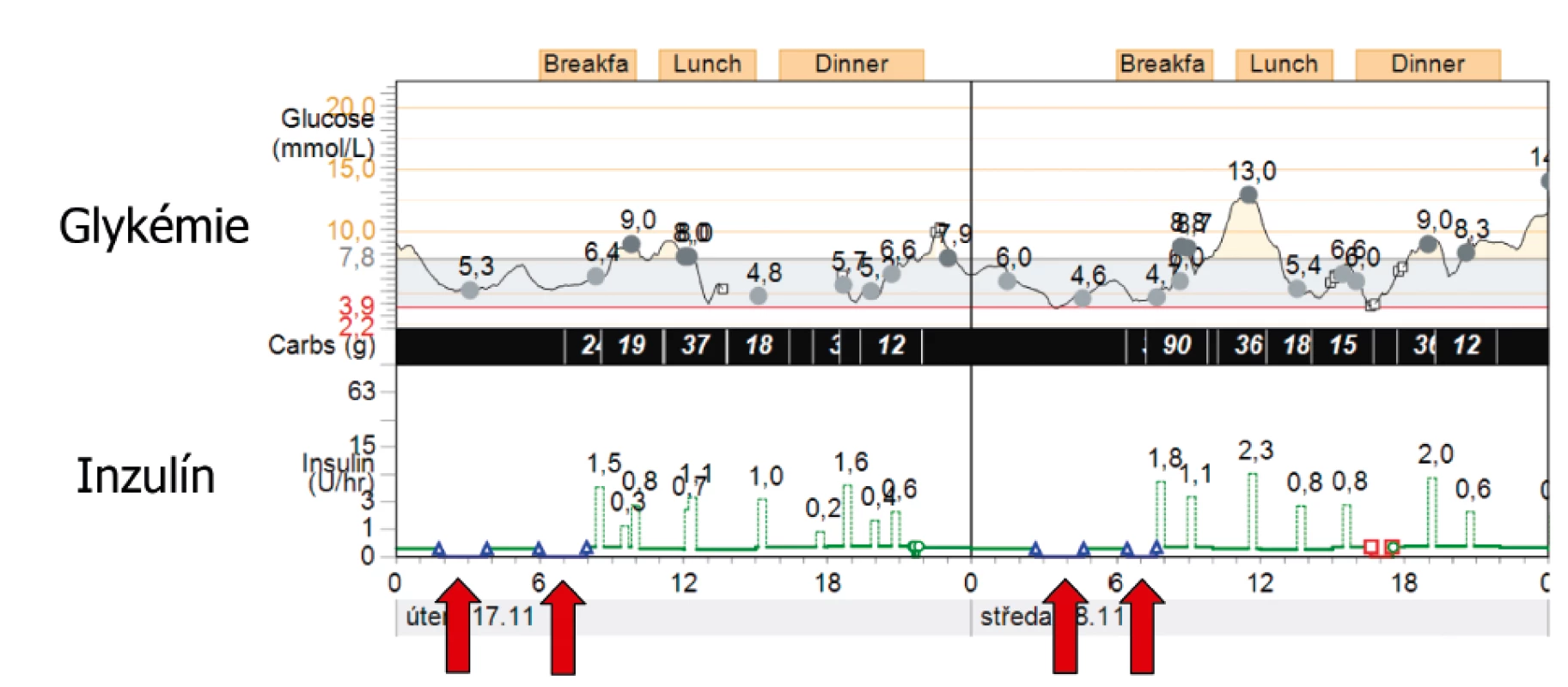
V dohledné době se můžeme těšit na nástup tzv. náplasťových pump (patch pumps). Na rozdíl od klasických pump, které má pacient umístěné na pásku či v kapse a inzulin se aplikuje prostřednictvím setu, jsou tyto malé přístroje nalepeny přímo na kůži a jsou ovládány na dálku prostřednictvím ovladače či mobilního telefonu. Jde o velmi nenápadné přístroje, jejichž prozatímní nevýhodou je nemožnost komunikovat s technologií CGM.
SPOJENÍ INZULINOVÉ PUMPY A KONTINUÁLNÍHO MONITORU GLYKÉMIE – UZAVŘENÁ SMYČKA
Přes veškerou snahu a pokrok na poli diabetologických technologií není plné spojení CGM a CSII dosud v klinické praxi dostupné. Probíhají klinické studie na toto téma, jejich výsledky jsou více než povzbudivé [13‒15]. Současné systémy pracují na principu tzv. hybridní uzavřené smyčky, před jídly je tedy třeba aplikovat bolus manuálně. Pro úplné spojení mezi monitoringem glykémií a inzulinovou pumpou by bylo třeba mj. zpřesnit současné senzory (pokud nejsou správně kalibrovány, jejich přesnost se výrazně zhoršuje) a mít k dispozici inzulin, který by se z podkožního depa vstřebával rychleji než dnes dostupné výrobky [16]. Velmi rychlý inzulin by výrazně snížil riziko hypoglykémie v případě neadekvátně spočítaného bolusu, falešné hyperglykémie nebo jiného selhání systému.
Dlouhodobě se na stránkách odborného tisku vede diskuse o tom, zda pro úspěch uzavřené smyčky stačí pouze jeden zásobník s inzulinem, nebo zda je nutné použít do druhého zásobníku téže pumpy glukagon, který by se automaticky aplikoval v případě rychlého poklesu glykémie. Tato otázka prozatím nebyla uspokojivě vyřešena, nicméně přístroje pracující na bázi obou klíčových hormonů vykazují v klinických studiích o něco lepší výsledky v porovnání s jednohormonální pumpou [17‒18].
JAKÁ JE KOMPENZACE DIABETU U DĚTÍ S DM1 V ČESKÉ REPUBLICE (PROJEKT ČENDA)
V roce 2013 byl zahájen provoz webového registru léčby diabetu ČENDA, pomocí něhož je možné sledovat vybrané parametry terapie a kontroly diabetu. V roce 2017 se na tomto projektu účastnilo 52 českých a moravských center, registr zahrnoval data od 3353 dětí, což odpovídá přibližně 90 % všech dětí s DM1.
Z těchto dat jednoznačně vyplývá, že kompenzace diabetu vyjádřená hodnotou glykovaného hemoglobinu se za posledních 5 let výrazně snížila (obr. 6) [19], přičemž nejvýraznější pokles jsme zaznamenali mezi lety 2016 a 2017. Je nepochybné, že jedním z důvodů tohoto pozitivního trendu je lepší dostupnost a častější využívání moderních technologií.
Obr. 6. Vývoj střední hodnoty HbA1c jako markeru kompenzace diabetu v ČR za posledních pět let. Vidíme trvalý pokles HbA1c s největším skokem v roce 2017, kdy došlo ke schválení úhrady technologie CGM ze zdravotního pojištění (údaje národního registru ČENDA). 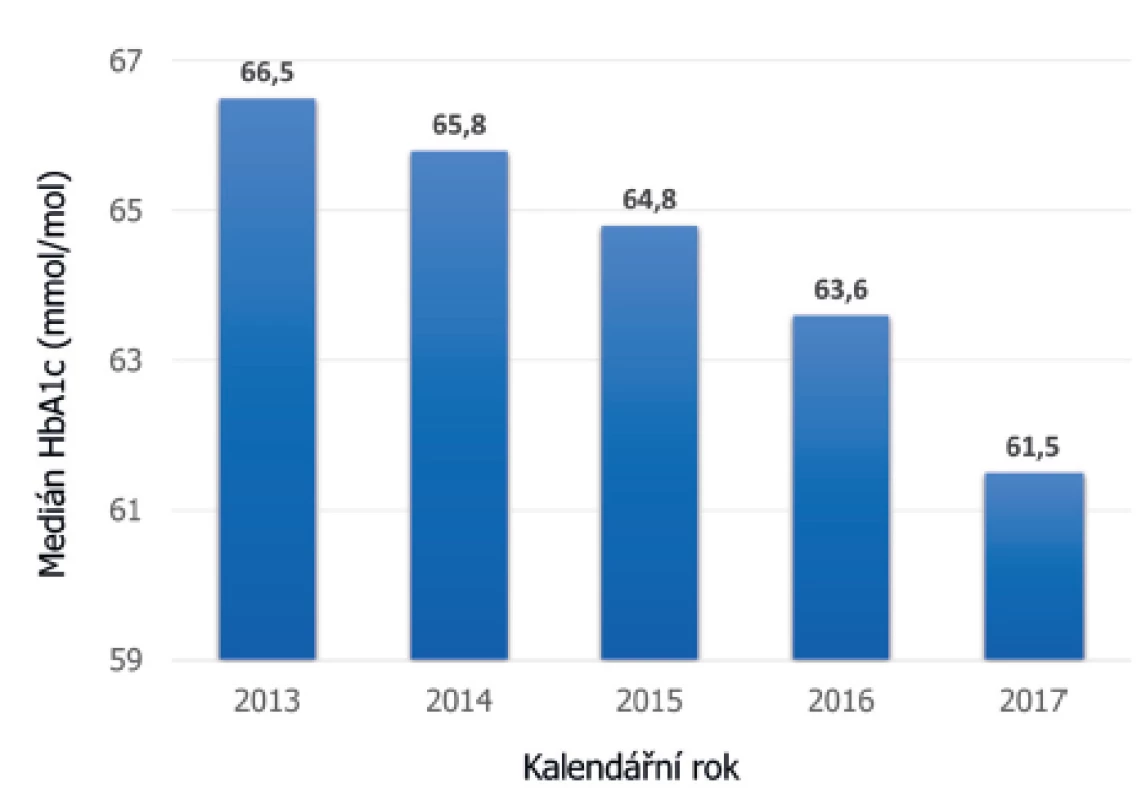
ZÁVĚR
Moderní technologie umožňují diabetickým dětem dosahovat nižších glykémií za sníženého rizika těžkých hypoglykémií a zlepšení kvality života. Kontrola DM1 u českých dětí se i z tohoto důvodu každým rokem zlepšuje, jejich prognóza, která je závislá zejména na rozvoji pozdních diabetických komplikací, je tak nesrovnatelně lepší, než tomu bylo ještě před několika málo lety. Je nepochybné, že tento trend bude pokračovat i nadále.
Prof. MUDr. Zdeněk Šumník, Ph.D.
Pediatrická klinika
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: zdenek.sumnik@lfmotol.cuni.cz
Zdroje
- Kucera ML, Graham JP. Insulin lispro, a new insulin analog. Pharmacotherapy 1998; 18 (3): 526–538.
- Wolf J, Kapellen T, Stachow R, et al. Morning hyperglycemia in children and adolescents with type 1 diabetes and different modes of therapy: an evaluation of the DPV data pool. Klin Padiatr 2012; 224 (7): 471–475.
- Mastrototaro J. The MiniMed Continuous Glucose Monitoring System (CGMS). J Pediatr Endocrinol Metab 1999; 12 (Suppl 3): 751–758.
- Schmelzeisen-Redeker G, Schoemaker M, Kirchsteiger H, et al. Time Delay of CGM Sensors: Relevance, causes, and countermeasures. J Diabetes Sci Technol 2015; 9 : 1006–1015.
- Pettus J, Price DA, Edelman SV. How patients with type 1 diabetes translate continuous glucose monitoring data into diabetes management decisions. Endocr Pract 2015; 21 : 613–620.
- Battelino T, Conget I, Olsen B, et al. The use and efficacy of continuous glucose monitoring in type 1 diabetes treated with insulin pump therapy: a randomised controlled trial. Diabetologia 2012; 55 : 3155–3162.
- Lind M, Polonsky W, Hirsch IB, et al. Continuous glucose monitoring vs conventional therapy for glycemic control in adults with Type 1 diabetes treated with multiple daily insulin injections: The GOLD Randomized Clinical Trial. JAMA 2017; 317 : 379–387.
- Beck RW, Riddlesworth TD, Ruedy KJ, et al. Effect of initiating use of an insulin pump in adults with type 1 diabetes using multiple daily insulin injections and continuous glucose monitoring (DIAMOND): a multicentre, randomised controlled trial. Lancet Diabetes Endocrinol 2017; 5 : 700–708.
- Szypowska A, Ramotowska A, Dzygalo K, et al. Beneficial effect of real-time continuous glucose monitoring system on glycemic control in type 1 diabetic patients: systematic review and meta-analysis of randomized trials. Eur J Endocrinol 2012; 166 : 567–574.
- Petruzelkova L, Pickova K, Sumnik Z, et al. Effectiveness of SmartGuard Technology in the prevention of nocturnal hypoglycemia after prolonged physical activity. Diabetes Technol Ther 2017; 19 : 299–304.
- Messer LH, Forlenza GP, Sherr JL, et al. Optimizing hybrid closed-loop therapy in adolescents and emerging adults using the MiniMed 670G System. Diabetes Care 2018; 41 (4): 789–796.
- Garg SK, Weinzimer SA, Tamborlane WV, et al. Glucose outcomes with the in-home use of a Hybrid Closed-Loop Insulin Delivery System in adolescents and adults with Type 1 diabetes. Diabetes Technol Ther 2017; 19 : 155–163.
- Bally L, Thabit H, Kojzar H, et al. Day-and-night glycaemic control with closed-loop insulin delivery versus conventional insulin pump therapy in free-living adults with well controlled type 1 diabetes: an open-label, randomised, crossover study. Lancet diabetes Endocrinol 2017; 5 : 261–270.
- Stewart ZA, Wilinska ME, Hartnell S, et al. Closed-Loop Insulin Delivery during pregnancy in women with Type 1 Diabetes. N Engl J Med 2016; 375 : 644–654.
- Dovc K, Macedoni M, Bratina N, et al. Closed-loop glucose control in young people with type 1 diabetes during and after unannounced phy-
- sical activity: a randomised controlled crossover trial. Diabetologia 2017; 60 (11): 2157–2167.
- Cengiz E, Bode B, Van Name M, et al. Moving toward the ideal insulin for insulin pumps. Expert Rev Med Devices 2016; 13 : 57–69.
- El-Khatib FH, Balliro C, Hillard MA, et al. Home use of a bihormonal bionic pancreas versus insulin pump therapy in adults with type 1 diabetes: a multicentre randomised crossover trial. Lancet 2017; 389 (10067): 369–380.
- Weisman A, Bai JW, Cardinez M, et al. Effect of artificial pancreas systems on glycaemic control in patients with type 1 diabetes: a systematic review and meta-analysis of outpatient randomised controlled trials. Lancet Diabetes Endocrinol 2017; 5 (7): 501–512.
- Sumnik Z, Venhacova J, Skvor J, et al. Improvement of diabetes control in Czech children: data from the National Childhood Diabetes register ČENDA. Pediatr Diabetes 2017; 18 (Suppl 1): 153.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2019 Číslo 1- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Jak včas rozpoznat vzácné onemocnění? S diagnostickou rozvahou pomůže accelRare
-
Všechny články tohoto čísla
- Etiologie a léčba novorozeneckého diabetu
- Monogenně podmíněný diabetes MODY v dětském věku: retrospektivní studie pacientů diagnostikovaných na Dětské klinice FN Plzeň v letech 2000–2017
- Depresívne a úzkostné symptómy vo vzťahu k spánku u detí a adolescentov s diabetes mellitus 1. typu
- Editorial: Česko-slovenská pediatrie v roce 2019
- Rizikové faktory ovlivňující výsledek léčby novorozenců s hypoxicko-ischemickou encefalopatií léčených řízenou hypotermií
- Editorial: Dětský diabetes na prahu nové éry
- Možnosti antibiotické léčby akutní sinusitidy
- Poděkování spolupracovníkům za rok 2018
- 20. dny dětské endokrinologie Ostrov u Tisé, Ústecký kraj 25.–26. 1. 2019
- Moderní technologie v terapii diabetu 1. typu v dětském věku
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Možnosti antibiotické léčby akutní sinusitidy
- Etiologie a léčba novorozeneckého diabetu
- Moderní technologie v terapii diabetu 1. typu v dětském věku
- Rizikové faktory ovlivňující výsledek léčby novorozenců s hypoxicko-ischemickou encefalopatií léčených řízenou hypotermií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



