-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaDepresívne a úzkostné symptómy vo vzťahu k spánku u detí a adolescentov s diabetes mellitus 1. typu
Depressive and anxiety symptoms in relation to sleep architecture in children and adolescents with type 1 diabetes
Objectives:
Youth with type 1 diabetes (T1D) are more susceptible to develop depressive and anxiety symptoms. In combination with disturbed sleep, these conditions may significantly affect adherence to treatment. We investigated the depressive and anxiety symptoms, personality traits, sleep architecture, compensation, and duration of T1D and their possible intercorrelations in a sample of children and adolescents.
Methods:
The sample consisted of 50 subjects aged 10–18 years hospitalized at the time of research at the Pediatric Department. We used self-report validated scales for detecting depressive and anxiety symptoms. Sleep architecture was measured by single night polysomnography (PSG). The values of patients' glycated hemoglobin (HbA1c) reflecting glycemic control and disease duration was determined according to the data in the medical record.
Results:
The depressive and anxiety symptoms were detected in 28% and 27.91% subjects, respectively. The main differences between depressed and non-depressed groups included significantly longer central apnoeic events (12.24±1.69 vs 8.15±6.16, p=0.038) as well as apnoeic–hypopnoeic events (12.82±2.31 vs 8.71±5.77, p=0.045) despite the comparable HbA1c, age, and duration of T1D. In contrast to our expectations, no significant association between HbA1c and depressive (r=-0.02; p<0.05) nor anxiety (r=0.09; p<0.05) symptoms was found. Depressive and anxiety symptoms correlated on a statistically significant level (r=0.51; p<0.05). Personality trait of extraversion-introversion correlated on the moderate level with sleep parameters total sleep time (r=-0.40; p<0.05), deep sleep efficiency (r=-0.42; p<0.05), the percentage of total sleep time spent in sleep stages NREM N2 (r=0.52; p<0.05) and NREM N3 (r=-0,42; p<0.05).
Conclusion:
The longer duration of central apnoeic and apnoeic–hypopnoeic events found in youth with T1D and depressive symptoms, suggest possible role of depressive symptomatology between sleep disordered breathing and metabolic control. Further research in possible shared mechanisms underlying these conditions is needed.
Keywords:
depressive symptoms – anxiety symptoms – Personality traits – sleep
Autoři: M. Jančinová 1; M. Čiljaková 1; J. Vojtková 1; M. Kostková 1; K. Pozorčiaková 1; A. Šujanská 1; Z. Sňahničanová 1,2; A. Müllerová 1; O. Chromá 1; P. Ďurdík 1; Peter Bánovčin 1
Působiště autorů: Klinika detí a dorastu JLF UK a UNM, Martin 1; Divízia Onkológia, Martinské centrum pre biomedicínu (BioMed), JLF UK, Martin 2
Vyšlo v časopise: Čes-slov Pediat 2019; 74 (1): 22-29.
Kategorie: Sympozium: Dětská diabetologie
Souhrn
Cieľ:
U mládeže s diabetes mellitus 1. typu (DM1) je popisovaný zvýšený výskyt depresívnych a úzkostných symptómov, ktoré môžu v kombinácii s narušeným spánkom významne vplývať na adherenciu k liečbe i celkovú kvalitu života pacientov. V predkladanej práci sme skúmali depresívne a úzkostné symptómy, osobnostné charakteristiky, spánkovú architektoniku, parametre liečby DM1 ako aj ich vzájomné vzťahy v skupine detí a adolescentov.
Metóda:
Skúmaný súbor tvorilo 50 detí a adolescentov s DM1 vo veku od 10–18 rokov. Na zisťovanie depresívnych a úzkostných symptómov boli použité štandardizované sebaposudzovacie škály. Na objektívne zhodnotenie spánku bolo u probandov vykonané polysomnografické vyšetrenie (PSG). Hodnoty glykovaného hemoglobínu (HbA1c) odrážajúce kompenzáciu DM1 ako aj ďalšie parametre liečby boli pacientom zisťované počas hospitalizácie.
Výsledky:
Depresívne symptómy a príznaky úzkosti boli prítomné u 28 % a 27,91 % probandov. Medzi skupinou pacientov s depresívnou symptomatológiou a skupinou bez príznakov depresie boli zistené signifikantné rozdiely v dĺžke centrálnych apnoických udalostí (12,24 ± 1,69 vs. 8,15 ± 6,16, p = 0,038) ako aj apnoicko-hypopnoických udalostí (12,82 ± 2,31 vs. 8,71 ± 5,77, p = 0,045) napriek porovnateľným hodnotám HbA1c, veku a dĺžke trvania DM1. V protiklade s našimi očakávaniami nebol zistený vzťah medzi glykemickou kompenzáciou (HbA1c) a depresívnymi (r = -0,02; p <0,05) či úzkostnými (r = 0,09; p <0,05) symptómami. Depresívne a úzkostné symptómy však vzájomne súviseli na štatisticky významnej úrovni (r = 0,51; p <0,05). Zistili sme stredne tesné vzťahy osobnostnej premennej extroverzia-introverzia so spánkovými parametrami celková doba spánku (r = -0,40; p <0,05), účinnosť hlbokého spánku (r = -0,42; p <0,05), percentuálne zastúpenie štádií spánku NREM N2 (r = 0,52; p <0,05) a NREM N3 (r = -0,42; p <0,05).
Záver:
Prítomnosť dlhších centrálnych apnoických a apnoicko-hypopnoických udalostí u detí a adolescentov s DM1 a s depresívnymi symptómami naznačuje možnú úlohu depresivity vo vzťahu medzi spánkovými poruchami dýchania a metabolickou kontrolou. Je potrebný ďalší výskum zameraný na zistenie spoločných patomechanizmov uvedených porúch.
Klíčová slova:
depresívne symptómy – úzkostné symptómy – osobnostné črty – spánok
ÚVOD
Diabetes mellitus 1. typu (DM1) je považovaný za jedno z najnáročnejších chronických ochorení z hľadiska záťaže na psychické prežívanie a je spojený s vysokým rizikom celoživotných zdravotných komplikácií. Depresia je najčastejšie uvádzaná komorbidná psychiatrická diagnóza u mládeže s DM1, nasledovaná úzkostnými poruchami a poruchami správania [1]. Depresívne symptómy sú často spájané so zlou metabolickou kompenzáciou a nonadherenciou k liečbe, s komplikáciami ako je zvýšená hodnota glykovaného hemoglobínu (HbA1c), opakované diabetické ketoacidózy (DKA) a hospitalizácie, prítomnosť závažných hypoglykémií a ďalšie [2, 3]. Dlhodobé dosahovanie optimálnej kontroly diabetu je najefektívnejšou prevenciou rozvoja neskorších diabetických komplikácií [4].
Napriek rastúcemu počtu štúdií zaoberajúcich sa vzájomnými vzťahmi úzkostných a depresívnych symptómov u pacientov s DM1, bolo doposiaľ málo pozornosti venovanej ich možným súvislostiam s narušeným spánkom. U dospelých s DM1 van Dijk et al. [5] zistili, že vyššie skóre depresie súviselo so zhoršenou kvalitou spánku. Poruchy spánku často predisponujú rozvoj depresie a sú tiež rizikovým faktorom pre jej rekurenciu a závažnejší priebeh [6]. Profil depresie súvisiaci s dysreguláciou cirkadiánneho rytmu by mohol pomôcť pri objasnení úlohy spánku u komorbidnej depresie a diabetu [7]. Narušený spánok, predovšetkým jeho krátke trvanie, sa na epidemiologickej i experimentálnej úrovni považuje za nepriaznivý faktor rozvoja diabetu u dospelých, zhoršenia glukózovej regulácie a inzulínovej senzitivity u DM1 [8] i DM2 [9]. Výskum generoval zistenia o úlohe pomalovlnného spánku (SWS) v regulácii glykémií a inzulínovej senzitivity a uvažuje sa nad pravidelným posudzovaním porúch spánku v rámci liečby detí a dospievajúcich s DM1 [10, 11]. Depresívne a úzkostné symptómy, non-optimálna kontrola DM1 a poruchy spánku môžu vytvárať bludný kruh a závažne komplikovať liečbu pacientov s pridruženými ochoreniami.
Cieľom predkladanej práce bolo preskúmať korelácie symptómov depresie a úzkosti, osobnostných vlastností, spánkových parametrov a kompenzácie DM1 u skupiny detí a adolescentov. Predpokladali sme, že deti a adolescenti s neuspokojivou glykemickou kompenzáciou DM1 (HbA1c ≥9 %) budú vykazovať zmeny v objektívnych parametroch spánku meraných polysomnografiou (PSG) a dosiahnu vyššie skóre depresívnych a úzkostných symptómov meraných štandardizovanými sebaposudzovacími škálami.
METÓDY A SÚBOR PACIENTOV
Súbor pacientov
Sledovaný súbor tvorilo 50 detí a adolescentov (21 chlapcov a 29 dievčat) vo veku od 10 do 18 rokov s diagnózou DM1, ktorí boli v čase výskumu hospitalizovaní na Klinike detí a dorastu JLF UK a UNM. Väčšina probandov spĺňala kritériá suboptimálnej (HbA1c = 7,5–9 %) alebo neuspokojivej (HbA1c ≥9 %) kompenzácie DM1 podľa usmernení ISPAD [12]. Pacienti boli na hospitalizáciu odoslaní prevažne regionálnymi endokrinológmi za účelom zlepšenia metabolickej kompenzácie. Menšiu časť súboru tvorili deti a adolescenti sledovaní v Detskej endokrinologickej ambulancii Kliniky detí a dorastu UNM, s nedostatočnou kontrolou diabetu v domácom prostredí. V sledovanom súbore bolo 46 probandov na liečbe kontinuálnou subkutánnou infúziou inzulínu (CSII) pomocou inzulínovej pumpy (IP) a 4 pacienti používali viacpočetné denné inzulínové injekcie (MDII).
Vylučovacími kritériami zaradenia subjektov do výskumu boli prítomnosť pridruženého neurologického, psychiatrického, genetického, kardiologického ochorenia, poruchy funkcie štítnej žľazy a celiakie. Probandi s akútnym respiračným infektom, DKA alebo ťažkou hypoglykémiou pri prijatí alebo 4 týždne pred prijatím na hospitalizáciu neboli do výskumu zaradení. Vylučovacie kritériá boli overené štúdiom zdravotnej dokumentácie a konzultované s ošetrujúcim lekárom. Výskum prebiehal v rokoch 2014–2016 po schválení Etickou komisiou JLF UK v súlade s Helsinskou deklaráciou. Zber dát prebiehal po informovanom súhlase zákonného zástupcu dieťaťa a poučení a súhlase dieťaťa/adolescenta s účasťou na štúdii.
Metódy
Dlhodobá glykemická kontrola probandov vo výskume bola hodnotená pomocou hodnoty HbA1c získaného v priebehu hospitalizácie ošetrujúcim zdravotníckym personálom. Hodnoty HbA1c, ako aj demografické, antropometrické a ďalšie zdravotné údaje pacientov vrátane veku, pohlavia, BMI, výšky, hmotnosti, dátumu nástupu a trvania DM1 a typ inzulínovej liečby boli následne odobraté zo zdravotnej dokumentácie. Všetci pacienti zaradení do nášho výskumného súboru mali nezmenený režim inzulínovej liečby po dobu najmenej troch mesiacov.
Štandardné celonočné polysomnografické vyšetrenie (PSG) bolo u pacientov realizované na tretí deň hospitalizácie v Detskom spánkovom laboratóriu KDaD JLF UK a UNM. Na hodnotenie spánku bol použitý štandardizovaný polysomnografický prístroj ALICE Sleepware 5. Na určenie štádií spánku definovaných podľa kritérií autorov Rechtschaffen a Kales [13] boli použité nasledujúce PSG parametre: elektroencefalogram (EEG), elektrookulogram (EOG) oboch očí, elektromyogram (EMG) svalov brady, elektrokardiogram (EKG), respiračný záznam (prietok vzduchu nosom a ústami, dýchacie pohyby hrudníka a brucha), mikrofón, pulzný oxymeter, polohový snímač a elektromyogram (EMG) mm. tibiales anteriores. Komplexný PSG záznam bol hodnotený špecialistom na pediatrickú spánkovú medicínu podľa odporúčaní pre pediatrickú populáciu [14] a Americkej akadémie pre spánkovú medicínu [15].
Pre účely našej práce boli z komplexného PSG záznamu sledované nasledujúce parametre: celková doba spánku (TST), spánková latencia (SL), počet prebúdzacích reakcií za hodinu spánku (AI), efektivita spánku (SE), účinnosť hlbokého spánku, trvanie jednotlivých štádií spánku z celkovej doby spánku vyjadrené v percentách (NREM N1, NREM N2, NREM N3 a REM % TST), trvanie bdelosti počas spánku (WASO), latencia REM spánku (REM SL), apnoicko/hypopnoický index (AHI) za hodinu spánku, apnoicko/hypopnoický index respiračných udalostí obštrukčného typu (OAHI) za hodinu spánku, centrálne apnoické udalosti (CA), apnoicko-hypopnoické udalosti (A+H).
Depresívne symptómy boli hodnotené Sebaposudzovacou škálou depresivity pre deti – CDI [16]. Skríningová škála je určená pre deti a mládež od 7 do 17 rokov a meria súčasný stav alebo zmenu kognitívnych, afektívnych a behaviorálnych depresívnych symptómov. Metódu tvorí 27 položiek, ktoré dieťa hodnotí na trojbodovej škále. Jednotlivé položky tvoria päť subškál: A) zlá nálada, B) interpersonálne ťažkosti, C) nevýkonnosť, D) anhedónia a E) negatívne sebahodnotenie. Celkové skóre vyššie ako 13 bodov (možný rozsah: 0–54 bodov) indikuje zvýšené depresívne symptómy. Výsledné skóre i skóre z jednotlivých subškál sa pomocou manuálu prevádza na percentily. Metóda má udávanú spoľahlivú vnútornú reliabilitu jednotlivých škál (Cronbachova alfa: 0,79–0,89).
Úzkostné symptómy sme zisťovali pomocou Škály zjavnej anxiety pre deti – CMAS [17] určenej pre deti vo veku od 9 do 14 rokov a Dotazníku na meranie úzkosti a úzkostnosti – STAI [18] pre deti staršie ako 14 rokov. Sebaposudzovacie škály sa často používajú na zhodnotenie stupňa a povahy úzkosti u detí a adolescentov. Škála CMAS pozostáva zo 42 položiek merajúcich úzkosť a 11 položiek zisťujúcich tzv. lži skóre. Dotazník STAI pozostáva z dvoch 20-položkových škál merajúcich aktuálny stav úzkosti (STAI_S) a zvyčajné prežívanie, relatívne stálu predispozíciu k úzkostnému prežívaniu – úzkostnosť (STAI_T). Metóda má udávanú dobrú vnútornú konzistenciu (Cronbachova alpha: 0,86–0,95). Pre účely našej práce sme použili sten ≥7 ako indikátor zvýšených úzkostných symptómov.
Na meranie osobnostných vlastností u detí do 14 rokov sme použili osobnostný dotazník B-JEPI [19], u probandov starších ako 14 rokov bol použitý dotazník DOPEN [20]. Osobnostné dotazníky sú koncipované podľa Eysenckovho modelu osobnostných dimenzií: emocionálna stabilita – labilita a extroverzia – introverzia a pozostávajú zo štyroch škál, ktorými sú neuroticizmus, psychoticizmus, extroverzia – introverzia a tzv. škála lži, ktorá zisťuje sklon dieťaťa odpovedať sociálne žiaducim spôsobom, prípadne disimulovať. Dotazníky sú vhodné k rýchlej orientácii v základnej osobnostnej štruktúre jedinca. B-JEPI obsahuje 78 položiek a má udávanú spoľahlivú vnútornú reliabilitu jednotlivých škál (Cronbachova alfa: 0,70–0,83). DOPEN pozostáva z 86 položiek a má uspokojivú vnútornú reliabilitu jednotlivých škál (Cronbachova alfa: 0,63–0,86). Osobnostné premenné zistené pomocou jednotlivých škál sú vyjadrené v percentiloch.
Štatistická analýza
Štatistická analýza výsledkov bola vykonaná pomocou štatistického programu Statistica (verzia 12). Pri charakterizovaní skúmaného súboru sme použili jednoduchú deskriptívnu štatistiku. Vzhľadom k tomu, že skúmaný súbor nebol z hľadiska viacerých premenných normálne distribuovaný, použili sme pri následnej analýze neparametrické štatistické testy. Na zistenie vzťahu medzi jednotlivými premennými sme použili Spearmanove poradové korelácie. Vyhodnocovali sme korelácie medzi výsledkami psychologických skríningových škál, osobnostných dotazníkov, spánkových parametrov meraných PSG, parametrami DM1 (HbA1c, dĺžka ochorenia) a základnými antropometrickými premennými. Číselné premenné boli vyjadrené ako priemer ± štandardná odchýlka (sd). Na posúdenie signifikantných rozdielov medzi podskupinami sme použili neparametrickú verziu t-testu pre nezávislé výbery Mannov-Whitneyov U test. Za štatisticky významné boli považované hodnoty p <0,05. Hodnota r (korelačného koeficientu) 0–0,19 bola považovaná za veľmi slabú, 0,20–0,39 za slabú, 0,40–0,59 za strednú, 0,60–0,79 za silnú a 0,80–1,0 za veľmi silnú koreláciu [21].
VÝSLEDKY
Demografické a klinické charakteristiky súboru
Súbor pacientov tvorilo 50 detí a adolescentov s DM1, z toho 21 (42 %) chlapcov a 29 (58 %) dievčat. Vek probandov sa pohyboval v rozmedzí 10–18 rokov, priemerný vek súboru bol 14,10 ± 2,40 roka. Priemerná dĺžka trvania ochorenia DM1 bola 7,12 ± 3,44 roka. Priemerná hodnota HbA1c bola 9,18 ± 1,76 %. Neuspokojivo kompenzovaných (HbA1c ≥9 %) bolo celkom 24 (48 %) probandov, 17 (34 %) pacientov malo suboptimálnu a 9 (18 %) probandov uspokojivú glykemickú kompenzáciu. Na liečbe inzulínovou pumpou (CSII) bolo 46 (92 %) probandov a 4 (8 %) probandi používali viacpočetné denné inzulínové injekcie (MDII).
Celkové priemerné skóre depresívnych symptómov v našom súbore bolo 10,14 ± 5,93 bodov, čím nedosiahlo hraničné skóre v CDI >13 bodov, ktoré indikuje zvýšené depresívne symptómy. Priemerné skóre symptómov úzkosti ako stabilnej osobnostnej tendencie k úzkosti, t.j. úzkostnosti (STAI_T) dosiahlo u skúmaného súboru hodnotu 5,09 ± 2,24 stenu, čo je hodnota nachádzajúca sa pod dolnou hranicou zvýšených symptómov úzkosti (CMAS/STAI_T ≥ sten 7). Z celkového súboru 50 probandov malo 14 (28 %) subjektov zvýšené depresívne symptómy a 12 (27,91 %) zo 43 probandov zvýšené symptómy úzkosti ako osobnostnej charakteristiky – úzkostnosti. Zo skúmaných osobnostných premenných (psychoticizmus, neuroticizmus, extroverzia – introverzia, lži skóre) nedosiahla žiadna z priemerných hodnôt (vyjadrených v percentiloch) pre celý sledovaný súbor hranicu indikujúcu zvýšenie hodnôt (≥75. percentil).
Obštrukčné spánkové apnoe (OSA) bolo zistené na základe PSG u 2 jedincov (ľahký stupeň OSA: 1, stredne závažný stupeň OSA: 1), centrálne apnoické udalosti boli zistené u 5 probandov. Priemerné percento trvania spánku stráveného v štádiách NREM N1 a NREM N2 zodpovedalo odporúčaným hodnotám pre túto vekovú skupinu [22]. Priemerný čas (vyjadrený v percentách) strávený v štádiu NREM N3 dosiahol v našom súbore zvýšenú hodnotu v porovnaní s udávanými optimálnymi hodnotami (30,34 % vs. 15–20 %). Naopak, priemerné percento trvania spánku stráveného v štádiu spánku REM bolo nižšie ako v literatúre udávané priemerné hodnoty (17,90 % vs. 20–25 %).
Základné antropometrické, klinické a psychologické charakteristiky skúmaného súboru sú uvedené v tabuľke 1, spánkové parametre v tabuľke 2.Tab. 1. Popisná štatistika antropometrických, klinických a psychologických charakteristík súboru (n = 50). 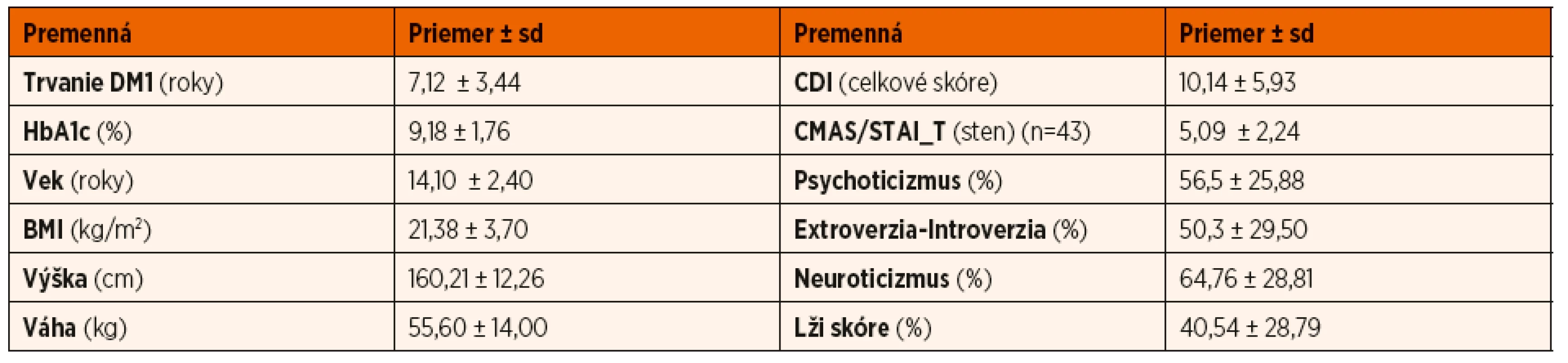
BMI: body mass index; CDI: Sebaposudzovacia škála depresivity pre deti; CMAS: Škála zjavnej anxiety pre deti; STAI_T: Dotazník na meranie úzkosti a úzkostnosti _subškála úzkostnosti Tab. 2. Deskriptívne údaje polysomnografických premenných u skúmaného súboru (n = 50). 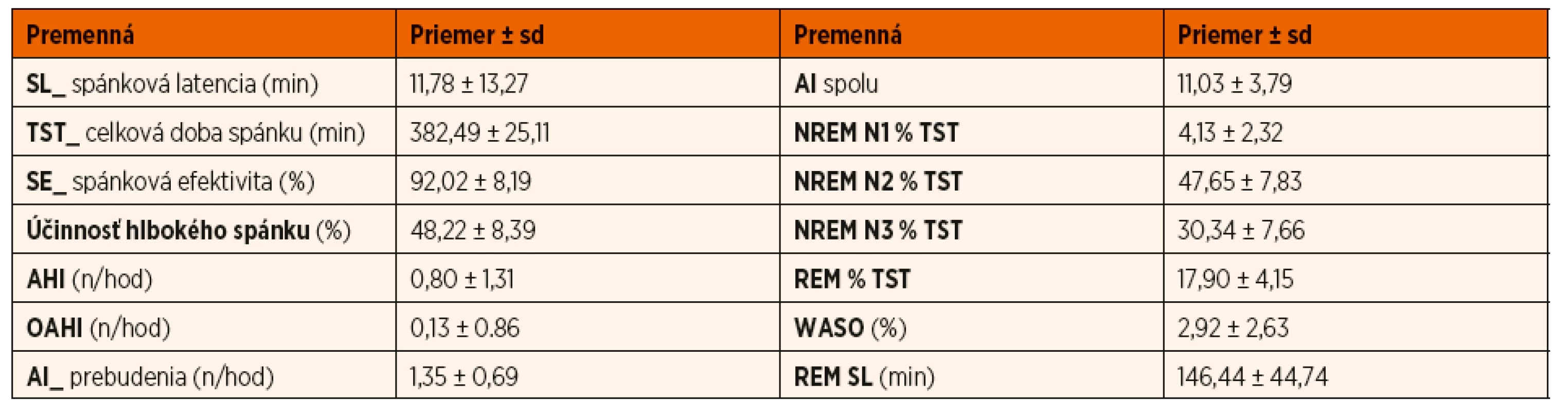
AI: počet prebúdzacích reakcií za hodinu spánku; AHI: apnoicko/hypopnoický index za hodinu spánku; OAHI: apnoicko/hypopnoický index respiračných udalostí obštrukčného typu za hodinu spánku; REM SL: latencia REM spánku; SE: TST/TIB (celková doba spánku/čas strávený v posteli); WASO: trvanie bdelosti počas spánku; NREM N1, NREM N2, NREM N3 a REM % TST: trvanie jednotlivých štádií spánku z celkovej doby spánku vyjadrené v percentách Korelácie medzi spánkovými, psychologickými a klinickými parametrami
V skúmanom súbore sme medzi väčšinou sledovaných premenných nezistili štatisticky významné vzťahy merané pomocou Spearmanovho korelačného koeficientu. V protiklade s našimi očakávaniami boli zistenia zanedbateľného vzťahu medzi depresívnymi symptómami a HbA1c (r = -0,02; p <0,05), ako aj nevýznamná korelácia medzi HbA1c a príznakmi úzkosti (r = 0,09). Na druhej strane sa niektoré zo zistených výsledkov preukázali ako štatisticky významné na stredne tesnej úrovni vzťahu. Osobnostná premenná extroverzia – introverzia pozitívne korelovala na stredne tesnej úrovni s vekom probandov (r = 0,51), dĺžkou trvania DM1 (r = 0,43) a percentuálnym zastúpením štádia spánku NREM N2 % TST (r = 0,52). Premenná extroverzia – introverzia ďalej negatívne korelovala na stredne tesnej úrovni s TST – celkovou dobou spánku (r = -0,40), s účinnosťou hlbokého spánku (r = -0,42) a percentuálnym zastúpením štádia spánku NREM N3% TST (r = -0,42). Zistili sme pozitívny stredne tesný vzťah medzi vekom probandov a dĺžkou trvania DM1 (r = 0,43), medzi vekom a percentuálnym zastúpením štádia spánku NREM N2% TST (r = 0,55). Stredne tesné negatívne korelácie boli preukázané medzi vekom a percentuálnym zastúpením štádia spánku NREM N3% TST (r = -0,49) a medzi vekom a účinnosťou hlbokého spánku (r = -0,53). Zistili sme slabý negatívny vzťah (r = -0,33) medzi trvaním bdelosti počas spánku – WASO a HbA1c. Vzájomné vzťahy medzi jednotlivými spánkovými, psychologickými a diabetickými parametrami sú popísané v tabuľke 3. Stredne tesné korelácie boli zistené medzi väčšinou psychologických premenných. Stredne tesný pozitívny vzťah (r = 0,51) bol zistený medzi depresívnymi (CDI) a úzkostnými (CMAS/STAI_T) symptómami.
Tab. 3. Spearmanove korelácie vybraných klinických, psychologických a spánkových parametrov; p <0,05. 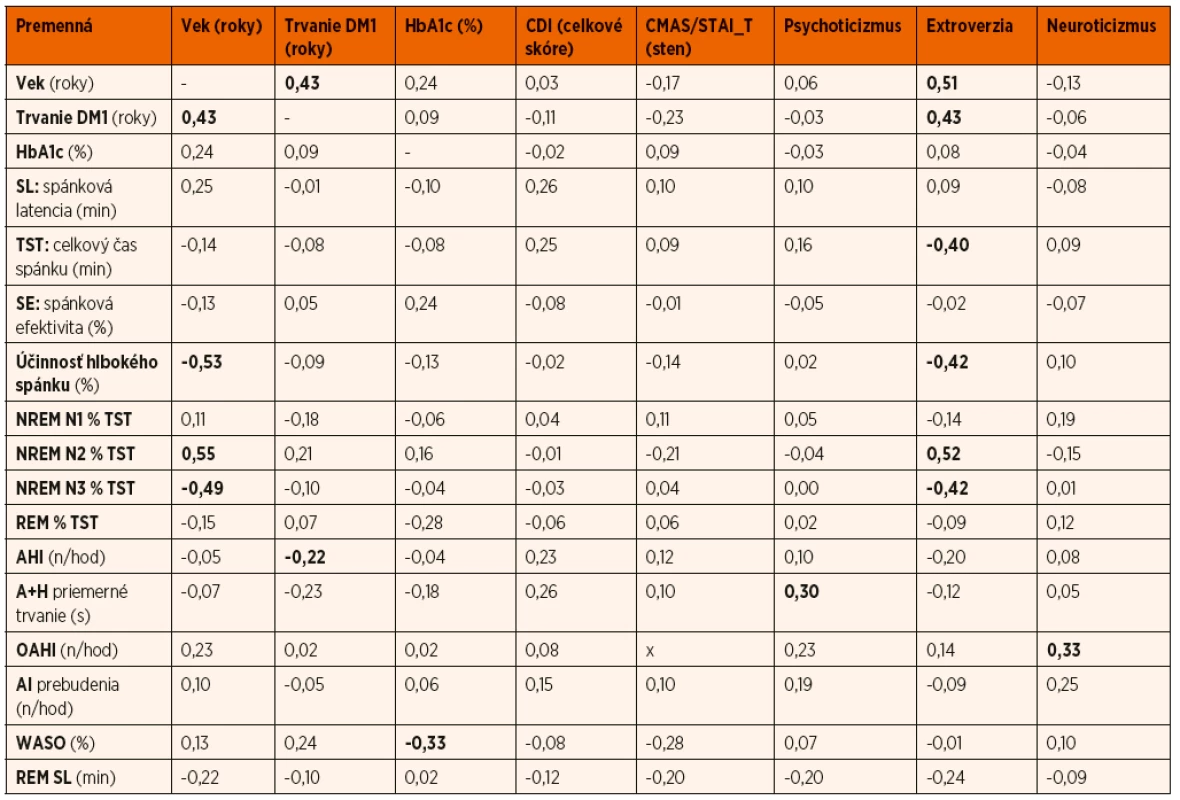
AI: počet prebúdzacích reakcií za hodinu spánku; AHI: apnoicko/hypopnoický index za hodinu spánku; CDI: Sebaposudzovacia škála depresivity pre deti; CMAS: Škála zjavnej anxiety pre deti; STAI_T: Dotazník na meranie úzkosti a úzkostnosti _subškála úzkostnosti; NREM N1, NREM N2, NREM N3 a REM % TST: trvanie jednotlivých štádií spánku z celkovej doby spánku vyjadrené v percentách; OAHI: apnoicko/hypopnoický index respiračných udalostí obštrukčného typu za hodinu spánku; REM SL: latencia REM spánku; SE: TST/TIB (celková doba spánku/čas strávený v posteli); WASO: trvanie bdelosti počas spánku Podľa dosiahnutého skóre depresívnych symptómov sme súbor rozdelili na skupinu so zvýšenými depresívnymi symptómami a skupinu bez depresívnych symptómov. Zistili sme signifikantné rozdiely medzi skupinami v dvoch spánkových premenných napriek porovnateľným hodnotám HbA1c, veku a dĺžke trvania DM1 (tab. 4). Priemerné trvanie centrálnych apnoických udalostí – CA (12,24 ± 1,69 vs. 8,15 ± 6,16, p = 0,019) a apnoicko-hypopnoických udalostí – A+H (12,82 ± 2,31 vs. 8,71 ± 5,77, p = 0,017) bolo signifikantne dlhšie u osôb s depresívnymi symptómami v porovnaní s probandmi bez depresívnych príznakov.
Tab. 4. Signifikantné rozdiely medzi skupinami podľa prítomnosti depresívnych symptómov (Mannov-Whitneyov U test); p <0,05. 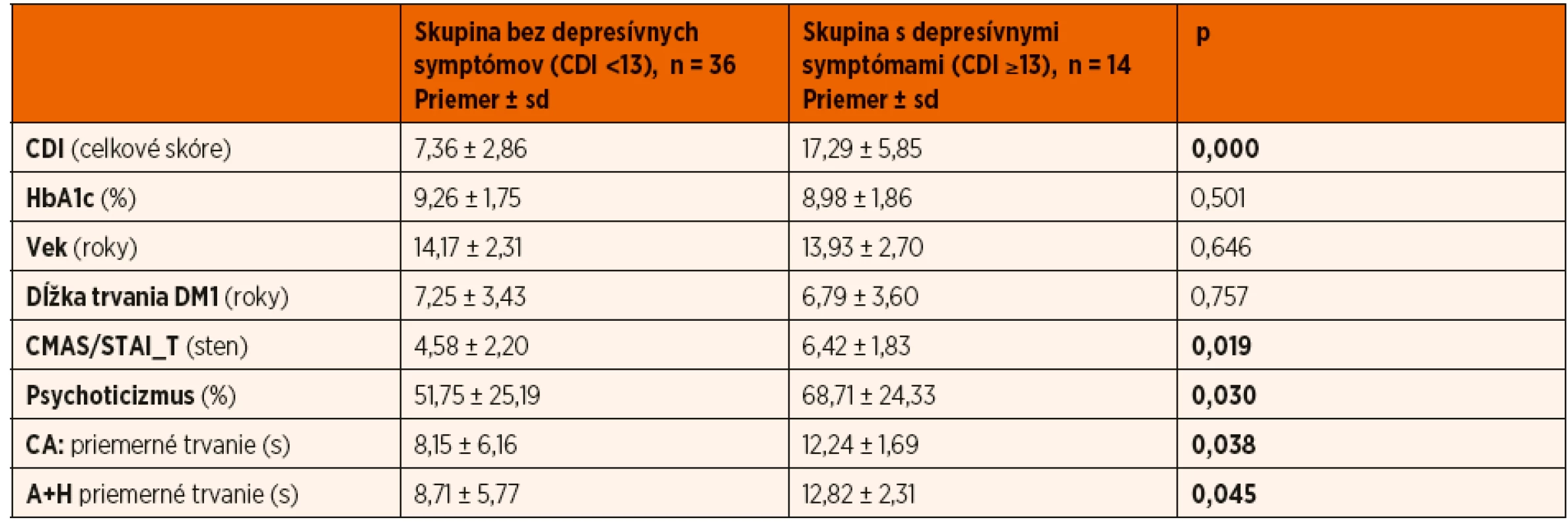
A+H: apnoicko-hypopnoické udalosti; CA: centrálne apnoické udalosti; CDI: Sebaposudzovacia škála depresivity pre deti; CMAS: Škála zjavnej anxiety pre deti; STAI_T: Dotazník na meranie úzkosti a úzkostnosti _subškála úzkostnosti DISKUSIA
V súbore 50 detí a adolescentov s DM1 sme zistili depresívne symptómy u 28 % a úzkostné symptómy u 27,91 % probandov. U mládeže s DM1 je odhadovaný výskyt depresívnych symptómov a depresie 20–30,04 % [23, 24]. Prítomnosť úzkostných symptómov sa uvádza až do výšky 32 % [23]. Bol naznačený pozitívny vzťah medzi hodnotou HbA1c a depresiou u mládeže s DM1 [25]. Hilliard et al. [26] zistili, že zvýšené skóre depresivity predikovalo zníženú frekvenciu kontroly hladiny glukózy v krvi (BGM) a zhoršenú kvalitu života, zvýšené skóre úzkosti ako aktuálneho stavu predikovalo vyššie hodnoty HbA1c. V našom výskume glykovaný hemoglobín nekoreloval s depresívnymi symptómami (r = -0,02), ani so symptómami úzkosti ako osobnostnej dispozície – úzkostnosti (r = 0,09), čo mohlo byť spôsobené relatívne malým počtom probandov a heterogenitou skúmaného súboru z hľadiska veku (10–18 rokov).
Štúdie zaoberajúce sa objektívne meranou architektonikou spánku v súvislosti s DM1 a pridruženou psychopatológiou sú v pediatrickej populácii vzácne a prinášajú nekonzistentné výsledky. Náš výskum je jedným z prvých, ktoré sa zaoberali vzájomnými vzťahmi polysomnograficky meraných spánkových premenných, depresívnou a úzkostnou symptomatológiou, osobnostnými vlastnosťami a parametrami súvisiacimi s liečbou DM1. PSG štúdie vykonané u detí a adolescentov s DM1 priniesli zistenia, že mládež s neuspokojivou glykemickou kontrolou uvádzala častejšie nočné prebudenia v porovnaní s kontrolnými skupinami [27, 28]. U detí s DM1 bol zistený trend k zníženiu celkovej doby spánku, redukcii spánkovej efektivity, zvýšenej spánkovej latencii a súvislosť medzi nočnými hypoglykémiami a nárastom efektivity spánku [27]. Spánok detí s DM1 bol v porovnaní s kontrolnou skupinou viac narušený zvýšeným počtom krátkych ako aj dlhších prebudení (vyúsťujúcich do skrátenej doby spánku), ktoré môžu spôsobiť psychologické zhoršenie v priebehu dňa [28].
V našom výskume sme zistili slabý negatívny vzťah (r = -0,33) medzi trvaním bdelosti počas spánku (WASO) a hodnotou glykovaného hemoglobínu (HbA1c), čo znamená, že zvýšené hodnoty HbA1c súviseli s kratším trvaním bdelosti počas spánku. Mohli by sme predpokladať, že skupina s nižším HbA1c mala vyššie riziko nočných hypoglykémií, čo by mohlo ovplyvniť bdelosť počas spánku. Avšak väčšina probandov v našom súbore bola na kontinuálnom glukózovom monitore. Pacienti s hypoglykémiou (hodnotou glukózy ≤3,9 mmol/l) 12 hodín pred alebo počas polysomnografického vyšetrenia neboli do štúdie zaradení, nakoľko samotná hypoglykémia môže vplývať na architektoniku spánku.
Predpokladá sa, že DM1 neovplyvňuje fungovanie pacientov počas dňa priamo, ale prostredníctvom vplyvu na spánok, ktorý môže byť následne narušený a vyúsťovať do neurokognitívnych, behaviorálnych a emocionálnych deficitov u mládeže s DM1 [29]. Nárast času stráveného v ľahkom spánku (štádium NREM N2) súvisel s vyšším výskytom obáv ohľadne DM1 a depresívnou náladou, väčšou dennou ospalosťou, behaviorálnymi problémami pri prechode spánok-bdenie, zníženou kvalitou života, zhoršeným školským prospechom, horšími matematickými výkonmi a zvýšenou frekvenciou porúch správania [11]. Metaanalýza zaoberajúca sa objektívnymi poruchami spánku spojenými s detskou depresiou [30] sumarizuje výsledky doposiaľ publikovaných štúdií, ktoré však neprinášajú jednoznačné závery. Ako najpravdepodobnejšie sa u juvelnilnej depresie uvádzajú skrátenie latencie REM spánku, predĺženie spánkovej latencie, zníženie efektivity spánku a nárast denzity REM spánku. Deficity pomalovlnného spánku neboli doposiaľ v pediatrickej populácii jednoznačne preukázané. S narastajúcim vekom a vážnejšími formami depresie sú však objektívne nálezy porúch spánku konzistentnejšie. V našej práci sme nezistili signifikantné rozdiely v uvedených spánkových parametroch ani po rozdelení súboru na skupinu s depresívnymi symptómami a skupinu bez príznakov depresie. Významnejšie korelácie by mohli byť prítomné v súbore pacientov s už diagnostikovanou depresívnou poruchou.
V štúdii Perfect et al. [11] strávili deti s DM1 v porovnaní s kontrolnou skupinou zdravých detí signifikantne viac času v štádiu spánku NREM N2 (ľahký spánok) a menej času v štádiu NREM N3 (SWS, hlboký spánok). Avšak, zistené rozdiely boli preukázané iba v prvej polovici noci. Čiljaková et al. [31] zistili len nesignifikantný rozdiel v percentuálnom zastúpení času stráveného v hlbokom spánku (NREM N3) medzi skupinou detí s neuspokojivou metabolickou kompenzáciou DM1 (HbA1c ≥9 %) a deťmi, ktoré mali suboptimálnu dlhodobú metabolickú kontrolu DM1 (HbA1c = 7,5–9 %).
My sme u probandov s DM1 zistili mierne zvýšené percento času stráveného v štádiu spánku NREM N3, normálne hodnoty zastúpenia NREM N2 štádia spánku a znížené priemerné percento času stráveného v štádiu REM spánku v porovnaní s priemernými podielmi zastúpenia jednotlivých štádií spánku u detí a dospievajúcich uvádzaných v literatúre [22]. Metaanalýza autorov Reutrakul et al. [8] preukázala len nevýznamné rozdiely medzi časom stráveným v ľahkom a hlbokom NREM spánku u dospelých pacientov s uspokojivou metabolickou kontrolou v porovnaní s dospelými so suboptimálnou metabolickou kompenzáciou.
Celkovo možno zhrnúť, že štúdie zaoberajúce sa distribúciou spánku u pacientov s DM1 zatiaľ nepriniesli jednoznačné výsledky. V dvoch štúdiách na detských pacientoch s DM1 rôznych vekových kategórií [11, 32] neboli preukázané signifikantné rozdiely medzi hodnotami HbA1c v závislosti od dĺžky trvania spánku. V našej práci sme podobne nezistili signifikantné korelácie medzi HbA1c a celkovou dobou spánku – TST (r = -0,08), medzi HbA1c a percentom času strávenom v štádiu spánku NREM N3 (r = -0,04), ani medzi HbA1c a štádiom spánku NREM N2 (r = 0,16).
U detí s neuspokojivou kompenzáciou DM1 bolo zistených viac apnoických páuz počas spánku, ktoré tiež trvali dlhšie, v porovnaní so zdravou kontrolou a pacientmi s dobre kompenzovaným DM1 [33]. V uvádzanej práci bolo u pacientov s neuspokojivou kompenzáciou DM1 zistených aj viac centrálnych apnoických udalostí v porovnaní s kontrolnou skupinou a s pacientmi s dobrou metabolickou kompenzáciou. Štúdia z roku 2018 zaoberajúca sa vplyvom krátkodobej metabolickej kontroly na kvalitu spánku a spánkové poruchy dýchania u 44 pediatrických pacientov (10–19 rokov) s DM1 a kontrolnej skupiny [34] priniesla zistenia, že detskí pacienti s lepšou krátkodobou metabolickou kontrolou DM1 (priemerná senzorová glukóza AvgSG <10 mmol/l) mali signifikantne nižší apnoicko-hypopnoický index (AHI) a kratšie trvanie apnoicko-hypopnoických udalostí ako aj respiračný index prebudení v porovnaní s deťmi so suboptimálnou krátkodobou kontrolou DM1. Autori práce medzi skupinami pacientov podľa úrovne krátkodobej metabolickej kontroly nezistili signifikantné rozdiely v parametroch spánkovej architektúry. Deti a adolescenti s DM1 sa signifikantne nelíšili v porovnaní s kontrolnou skupinou zdravých subjektov v parametroch celková doba spánku, spánková efektivita, percentuálne zastúpenie jednotlivých štádií spánku, v respiračných parametroch a počte centrálnych apnoických udalostí.
V našom súbore sme zistili dlhšie priemerné trvanie centrálnych apnoických udalostí ako aj apnoicko-hypopnoických udalostí u detí a adolescentov s DM1 a s depresívnymi symptómami v porovnaní so skupinou probandov bez depresívnych príznakov. Uvedené výsledky naznačujú, že súvislosti medzi spánkovými poruchami dýchania (SDB) a metabolickou kontrolou môžu byť sprostredkované aj prítomnosťou depresívnej symptomatológie u pacientov s DM1, čo rozširuje poznatky o ďalších možných spolupôsobiacich mechanizmoch týchto ochorení. V pediatrickej populácii je najčastejšou poruchou spánku OSA, s udávanou prevalenciou 1–5 % [35]. V našom výskume bolo OSA zistené u 2 probandov, čo predstavuje 4 % z celkového súboru pacientov a zodpovedá v literatúre uvádzanej prevalencii. Podľa výsledkov metaanalýzy z roku 2016 [8] sa OSA vyskytovalo až u 51,9 % dospelej populácie pacientov s DM1, pričom obezita nevysvetľovala vysokú prevalenciu OSA. Uvažuje sa nad vplyvom diabetickej autonómnej neuropatie na tonus faryngeálnych svalov a vznik OSA u dospelých i detských pacientov s DM1 [31, 36].
Bola preukázaná dôležitosť osobnostných vlastností vo vzťahu k adherencii k liečbe, glykemickej kontrole, kvalite života a copingových stratégií u pacientov s DM1 [37, 38]. Rassart et al. [39] zistili u pacientov s DM1 zníženú úroveň extroverzie a emocionálnej stability v porovnaní s kontrolnou skupinou zdravých jedincov. Autori navrhli ako možné čiastočné vysvetlenie nižšieho skóre extroverzie u pacientov s DM1 zníženú úroveň energie, vyplývajúcu zo zmien hladín glukózy v krvi, redukovanej telesnej aktivity a emočného distresu.
My sme v našej práci zistili možné vzťahy medzi osobnostnými charakteristikami, a to predovšetkým premennou extroverzia-introverzia, a niektorými spánkovými parametrami (celková doba spánku – TST, percentuálne zastúpenie štádií spánku NREM N2 a NREM N3, efektivita hlbokého spánku). S rastúcim vekom probandov a dlhším trvaním DM1 mala osobnostná premenná extroverzie tendenciu narastať. Percento času stráveného v štádiu spánku NREM N2 sa u viac extrovertovaných subjektov taktiež zvyšovalo. U detí a adolescentov s DM1 s vyšším skóre extroverzie bolo zistené zníženie celkovej doby spánku, pokles efektivity hlbokého spánku a nižšie percento času stráveného v štádiu spánku NREM N3 v porovnaní s introvertovanými subjektami. V našej práci sme nenašli korelácie medzi HbA1c a žiadnou z osobnostných premenných.
V našej práci musíme uznať niekoľko limitácií, ktorými sú predovšetkým neprítomnosť kontrolnej skupiny probandov bez DM1, relatívne malá vzorka probandov a vekovo heterogénna skupina zahŕňajúca detský, pubertálny ako aj adolescentný vek. Porovnanie výsledkov skúmaných parametrov u detí a u adolescentov s DM1 a kontrolnej skupiny by do budúcna mohlo priniesť obohacujúce zistenia. Zabezpečenie PSG vyšetrenia u kontrolnej skupiny zdravých subjektov by však bolo príliš finančne aj časovo náročné. V literatúre sa uvádza nárast psychických a somatických ťažkostí u pacientov s DM1 najmä v skupine adolescentov, a preto by ďalšia diferenciácia probandov do vekovo homogénnejších skupín mohla priniesť signifikantnejšie výsledky.
ZÁVER
Doposiaľ sa venovalo skúmaniu psychologických faktorov v kombinácii s objektívne meranou architektonikou spánku u mládeže s DM1 len niekoľko štúdií. Výsledky zostávajú nejednoznačné a je nutný ďalší výskum, ktorý by objasnil komplexné vzťahy medzi uvedenými oblasťami. Naša práca priniesla zistenia týkajúce sa prítomnosti dlhších centrálnych apnoických a apnoicko-hypopnoických udalostí u detí a adolescentov s DM1 a depresívnou symptomatológiou ako aj možnej súvislosti extroverzie s niektorými parametrami spánku.
Skríning porúch spánku, depresívnej a úzkostnej symptomatológie, ako aj hodnotenie vybraných osobnostných charakteristík u pacientov s DM1, by odborníkom mohli pomôcť identifikovať jedincov, ktorí sú rizikoví z hľadiska non-compliance v liečbe.
Práca bola podporená projektom VEGA č.1/0262/14 a projektom „CEKR2“ ITMS: 26220120034 a spolufinancovaná zo zdrojov EÚ.
Korešpondenčný autor:
Doc. MUDr. Miriam Čiljaková, PhD.
Klinika detí a dorastu
Jesseniova lekárska fakulta Univerzity Komenského v Bratislave
Univerzitná nemocnica Martin
Kollárova 2
036 59 Martin
Slovenská republika
e-mail: mimaciljak237@gmail.com
Zdroje
- Kovacs M, Goldston O, Obrosky DS, Bonar LK. Psychiatric disorders in youth with IDDM: Rates and risk factors. Diabetes Care 1997; 20 (1): 36–44.
- Holt RI, de Groot M, Lucki I, et al. NIDDK international conference report on diabetes and depression: current understanding and future directions. Diabetes Care 2014; 37 (8): 2067–2077.
- Johnson B, Eiser C, Young V, et al. Prevalence of depression among young people with type 1 diabetes: A systematic review. Diabet Med 2013; 30 (2): 199–208.
- Šumník Z. Novinky v dětské diabetologii. Pediatr prax 2013; 14 (6): 249–251.
- van Dijk M, Donga E, van Dijk JG, et al. Disturbed subjective sleep characteristics in adult patients with long-standing type 1 diabetes mellitus. Diabetologia 2011; 54 (8): 1967–1976.
- Alfano A, Gamble AL. The role of sleep in childhood psychiatric disorders. Child Youth Care Forum 2009; 38 (6): 327–340.
- Snoek FJ, Bremmer MA, Hermanns N. Constructs of depression and distress in diabetes: time for an appraisal. Lancet Diabetes Endocrinol 2015; 3 (6): 450–460.
- Reutrakul S, Thakkinstian A, Anothaisintawee T, et al. Sleep characteristics in type 1 diabetes and associations with glycemic control: systematic review and meta-analysis. Sleep Med 2016; 23 : 26–45.
- Barone MT, Menna-Barreto L. Diabetes and sleep: A complex cause-and-effect relationship. Diabetes Res Clin Pract 2011; 91 (2): 129–137.
- van Dijk DJ. Slow-wave sleep, diabetes, and the sympathetic nervous system. Proc Natl Acad Sci U S A 2008; 105 (4): 1107–1108.
- Perfect MM, Patel PG, Scott RE, et al. Sleep, glucose, and daytime functioning in youth with type 1 diabetes. Sleep 2012; 35 (1): 81–88.
- Rewers MJ, Pillay K, de Beaufort C, et al. Assessment and monitoring of glycemic control in children and adolescents with diabetes. Pediatr Diabetes 2014; 15 (20):102–114.
- Rechtshaffen A, Kales A. A manual of standardized terminology and scoring system for sleep stages of human subjects. Washington, DC: National Institutes of Health, 1968 : 1–57.
- Beck S, Marcus LC. Pediatric polysomnography. Sleep Med Clin 2009; 4 (3): 393–406.
- Berry RB, Budhiraja R, Gottlieb DJ, et al. Rules for scoring respiratory events in sleep: update of the 2007 AASM Manual for the Scoring of Sleep and Associated Events. Deliberations of the Sleep Apnea Definitions Task Force of the American Academy of Sleep Medicine. J Clin Sleep Med 2012; 8 (5): 597–619.
- Kovacs M. Children‘s depression inventory CDI. In: Preiss M. Sebaposudzovacia škála depresivity pre deti CDI. Bratislava: Psychodiagnostika, 1998 : 1–33.
- Ruisel I, Snopková N. Škála zjavnej anxiety pre deti. Bratislava: Psychodiagnostické a didaktické testy, 1975 : 1–39.
- Müllner J, Ruisel I, Farkaš G. Dotazník na meranie úzkosti a úzkostlivosti. Bratislava: Psychodiagnostické a didaktické testy, 1980 : 1–95.
- Senka J. B-JEPI – Eysenckov dotazník extraverzie, neuroticizmu a psychoticizmu. Bratislava: Psychodiagnostika, 1994 : 1–60.
- Ruisel I, Müllner J. DOPEN. Bratislava: Psychodiagnostické a didaktické testy, 1982 : 1–72.
- Evans JD. Straightforward statistics for the behavioral sciences. Pacific Grove, CA: Brooks/Cole Publishing, 1996 : 1–600.
- Příhodová I. Poruchy spánku u dětí a dospívajících. Praha: Maxdorf, 2013 : 1–152.
- Buchberger B, Huppertz H, Krabbe L, et al. Symptoms of depression and anxiety in youth with type 1 diabetes: A systematic review and meta-analysis. Psychoneuroendocrinology 2016; 70 (8): 70–84.
- Silverstein J, Klingensmith G, Copeland K, et al. Care of children and adolescents with type 1 diabetes: a statement of the American Diabetes Association. Diabetes Care 2005; 28 (1): 186–212.
- Sacco WP, Bykowski CA. Depression and hemoglobin A1c in type 1 and type 2 diabetes: The role of self-efficacy. Diabetes Res Clin Pract 2010; 90 (2): 141–146.
- Hilliard ME, Herzer M, Dolan LM, et al. Psychological screening in adolescents with type 1 diabetes predicts outcomes one year later. Diabetes Res Clin Pract 2011; 94 (1): 39–44.
- Pillar G, Schuscheim G, Weiss R, et al. Interactions between hypoglycemia and sleep architecture in children with type 1 diabetes mellitus. J Pediatr 2003; 142 (2): 163–168.
- Matyka KA, Crawford C, Wiggs L, et al. Alterations in sleep physiology in young children with insulin-dependent diabetes mellitus: Relationship to nocturnal hypoglycemia. J Pediatr 2000; 137 (2): 233–238.
- Caruso NC, Radovanovic B, Kennedy JD, et al. Sleep, executive functioning and behaviour in children and adolescents with type 1 diabetes. Sleep Med 2014; 15 (12): 1490–1499.
- Rao U. Sleep disturbances in pediatric depression. Asian J Psychiatr 2011; 4 (4): 234–247.
- Čiljaková M, Vojtková J, Šujanská A, et al. Kvalita spánku detí a adolescentov s diabetes mellitus 1. typu. Čes-slov Pediat 2017; 72 (1): 25–32.
- Estrada CL, Danielson KK, Drum ML, et al. Insufficient sleep in young patients with diabetes and their families. Biol Res Nurs 2012; 14 (1): 48–54.
- Villa MP, Multari G, Montesano M, et al. Sleep apnoea in children with diabetes mellitus: effect of glycaemic control. Diabetologia 2000; 43 (6): 696–702.
- Kostková M, Ďurdík P, Čiljaková M, et al. Short-term metabolic control and sleep in children and adolescents with type 1 diabetes mellitus. J Diabetes Complications 2018; March 22. doi: https://doi.org/10.1016/j.jdiacomp.2018.03.010 [in press].
- Lumeng JC, Chervin RD. Epidemiology of pediatric obstructive sleep apnoea. Proc Am Thorac Soc 2008; 5 : 242–252.
- Bottini P, Dottorini ML, Cordoni MC, et al. Sleep-disordered breathing in nonobese diabetic subjects with autonomic neuropathy. Eur Respir J 2003; 22 : 654–660.
- Lawson VL, Bundy C, Belcher J, et al. Mediation by illness perceptions of the effect of personality and health threat communication on coping with the diagnosis of diabetes. Br J Health Psychol 2010; 15 (3): 623–642.
- Wheeler K, Wagaman A, McCord D. Personality traits as predictors of adherence in adolescents with type 1 diabetes. J Child Adolesc Psychiatr Nurs 2012; 25 (2): 66–74.
- Rassart J, Luyckx K, Moons P, et al. Personality and self-esteem in emerging adults with type 1 diabetes. J Psychosom Res 2014; 76 (2): 139–145.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2019 Číslo 1- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Jak včas rozpoznat vzácné onemocnění? S diagnostickou rozvahou pomůže accelRare
-
Všechny články tohoto čísla
- Etiologie a léčba novorozeneckého diabetu
- Monogenně podmíněný diabetes MODY v dětském věku: retrospektivní studie pacientů diagnostikovaných na Dětské klinice FN Plzeň v letech 2000–2017
- Depresívne a úzkostné symptómy vo vzťahu k spánku u detí a adolescentov s diabetes mellitus 1. typu
- Editorial: Česko-slovenská pediatrie v roce 2019
- Rizikové faktory ovlivňující výsledek léčby novorozenců s hypoxicko-ischemickou encefalopatií léčených řízenou hypotermií
- Editorial: Dětský diabetes na prahu nové éry
- Možnosti antibiotické léčby akutní sinusitidy
- Poděkování spolupracovníkům za rok 2018
- 20. dny dětské endokrinologie Ostrov u Tisé, Ústecký kraj 25.–26. 1. 2019
- Moderní technologie v terapii diabetu 1. typu v dětském věku
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Možnosti antibiotické léčby akutní sinusitidy
- Etiologie a léčba novorozeneckého diabetu
- Moderní technologie v terapii diabetu 1. typu v dětském věku
- Rizikové faktory ovlivňující výsledek léčby novorozenců s hypoxicko-ischemickou encefalopatií léčených řízenou hypotermií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



