-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Neketotická hyperglycinémie: případ závažné kongenitální hypotonie diagnostikovaný magnetickou rezonancí
Nonketotic hyperglycinemia: a case of a serious congenital hypotonia diagnosed by magnetic resonance
Nonketotic hyperglycinemia: a case of a serious congenital hypotonia diagnosed by magnetic resonance
The authors present a case report of a full-term newborn with symptoms of hypotonia progressing into respiratory insufficiency with the need of artificial pulmonary ventilation.
Within the complex of diagnostic tests, magnetic resonance imaging and spectroscopy was performed and the diagnosis of nonketotic hyperglycinemia was suggested and finally confirmed by metabolic tests and eventually by DNA analysis.
The authors describe this congenital metabolic disease which is rare and with an unsatisfactory prognosis. Etiology, clinical course, therapy and prognosis of this rare entity are discussed. The value of non-invasive diagnosis by means of magnetic resonance is highlighted.Key words:
nonketotic hyperglycinemia, magnetic resonance imaging – MRI, magnetic resonance spectroscopy – MRS, metabolic inbornerrors
Autoři: J. Dušek 1; A. Sjöström 1; J. Žižka 2
Působiště autorů: Department of Neonatology, University Hospital of Northern Sweden, Umeå 1; Department of Radiology, University Hospital of Northern Sweden, Umeå a Radiologická klinika Fakultní nemocnice Hradec Králové 2
Vyšlo v časopise: Čes-slov Pediat 2016; 71 (2): 87-90.
Kategorie: Kazuistika
Souhrn
Autoři uvádějí kazuistiku donošeného novorozence s příznaky hypotonie progredující do respirační insuficience s nutností umělé plicní ventilace.
V rámci komplexní diagnostiky bylo provedeno vyšetření magnetickou rezonancí (MR) včetně MR spektroskopie, jež vyslovilo podezření na neketotickou hyperglycinémii, což bylo potvrzeno metabolickým vyšetřením a posléze průkazem genetické mutace.
Autoři popisují vrozené metabolické onemocnění s nepříznivou prognózou, které je poměrně vzácné, jeho příčiny, průběh a terapii. V rámci diagnostiky je zdůrazněna role magnetické rezonance.Klíčová slova:
neketotická hyperglycinémie, magnetická rezonance – MR, magnetická rezonanční spektroskopie – MRS, metabolické vadyÚvod
Těžká kongentální hypotonie progredující do respiračního selhání s nutností umělé plicní ventilace s fyziologickými hodnotami základních biochemických parametrů není častým jevem v klinické praxi. V námi publikovaném případě výsledky vyšetření magnetickou rezonancí spolu s EEG stanovily konečnou diagnózu dříve než výsledky metabolického vyšetření.
Hyperglycinémie je charakterizovaná zvýšenou koncentrací glycinu v plazmě [1, 2].
Ketotická hyperglycinémie se vyskytuje při řadě poruch metabolismu aminokyselin (např. při propionové, methylmalonové či izovalerové acidémii, při deficienci b-ketothiolázy) a jiných organických kyselin v rámci acidózy a ketózy. Při včasné diagnostice a správně vedené terapii nevede ketotická hyperglycinémie k ovlivnění psychomotorického vývoje [11].
Neketotická hyperglycinémie – glycinová encefalopatie je vrozené, autozomálně recesivně vázané onemocnění zasahující do odbourávání aminokyseliny glycinu. Důsledkem metabolické poruchy je ukládání glycinu v orgánech. Jako hlavní symptomy jsou uváděny epilepsie, apnoické pauzy, hypotonie, později hypertonie [2].
Příčiny onemocnění je možno vystopovat na několika genech. Nejčastější variantou (70–75 % postižených) je postižení genu kódujícího P protein (glycindekarboxyláza) a vázaného na chromozom 9 (9p24.1), další postižené geny jsou na 3. chromozomu (3p21.31) postižení T proteinu (aminometyltransferázy) a na 16. chromozomu (16q23.2) postižení H proteinu (tzv. glycine claevage systém H-proteinu) [3, 4, 12].
Neketotická hyperglycinémie byla poprvé popsána v roce 1963 americkým pediatrem Charltonem Mabrym [14]. Frekvence onemocnění je uváděna 2 : 100 000 [1], s vyšším výskytem v severním Švédsku v oblasti kolem finských hranic. Onemocnění se nejčastěji manifestuje již v prvním týdnu života (85 % postižených).
Diagnostika
EEG: obraz „burst supression“ – obraz diskontinuity, možnost výskytu epileptiformních elementů.
Magnetická rezonance prokáže opožděnou myelinizaci a abnormálně zvýšený T2 signál bílé hmoty, jejíž objem je redukován; častou doprovodnou anomálií je dysgeneze kalózního tělesa. Více specifickým nálezem je snížená difuze patologicky změněné a vakuolizované bílé hmoty, typicky popisovaná v zadních raménkách capsula interna, pallidech a laterálních jádrech thalamů, případně také v dorzálních partiích mezencefala a pontu [10]. Je důležité vědět, že tento významný patologický, nikoliv však zcela specifický nález na difuzně vážených obrazech v průběhu onemocnění regreduje, což se vysvětluje splýváním mikrovakuol v bílé hmotě do větších cyst, které naopak difuzi usnadňují. MR spektroskopie nabízí ještě specifičtější nález patologicky zvýšených hladin glycinu v mozkové tkáni. Peak glycinu se při MR spektroskopii nachází na 3,56 ppm, kde se nachází i peak myoinozitolu. Proto je nutné při MR spektroskopii použít sekvenci s dlouhým echo časem TE, kde myoinozitol již nedává měřitelný signál a tak je možné oba metabolity od sebe odlišit. Správně provedené a interpretované MR vyšetření doplněné o MR spektroskopii tedy může v případě neketotické hyperglycinémie zcela neinvazivně poskytnout velmi přesnou a specifickou diagnostickou informaci [10].
Biochemické stanovení aminokyselin v plazmě a likvoru potvrdí diagnózu [2, 6, 7, 11]. Je však nutno doplnit genetické vyšetření pro potvrzení mutace jednoho z výše uvedených genů [3, 4].
Klinický průběh
U infantilní formy je přítomen hypotonus, mentální a motorická retardace, později dominuje epilepsie.
Terapie
U těžkých neonatálních forem je častá nutnost respirační podpory. Speciální výživa chudá na aminokyseliny s dostatkem esenciálních aminokyselin, vitaminů, mastných kyselin a kalorií [5].
Natrium benzoát je používán k vázání glycinu v plazmě. Vysoká dávkování 250–750 mg/kg/den benzoátu sodného během prvních dvou let zlepšuje průběh onemocnění a intelekt. Bohužel benzoát sodný často způsobuje potíže zažívacího traktu a dlouhodobé podávání má za důsledek nedostatek karnitinu. Karnitin je proto nutno substituovat a monitorovat hladiny.
NMDA receptor antagonisty (Dextometorfan, Ketamin) je možné používat ke snížení škodlivých účinků glycinu.
Léčba epilepsie probíhá za pomocí standardní terapie, pouze s vyloučením valproatu. U některých případů se setkala s pozitivním účinkem ketogenní dieta, která zlepšuje průběh epilepsie. Ketogenní dieta je bohatá na tuky a cukry. Často je nutná medikamentózní léčba refluxu.
Dechová rehabilitace a inhalace mukolytik se stává celoživotní nutností.
Obligatorní je ortopedická dispenzarizace: častý výskyt dysplazie kyčelního kloubu, skoliózy, výskyt spastických kontraktur vyžadující aplikace botulotoxinu nebo korekční ortopedické operace. Rehabilitace je nutná celoživotně [8, 9].
Kazuistika
Anamnéza
Matka se přistěhovala do Švédska z Finska, jde o druhé těhotenství z druhé gravidity. Z předchozího vztahu má šestiletou zdravou dceru. Matka se trvale s ničím neléčí. Otec tohoto dítěte pochází ze severního Finska. Gravidita byla bez komplikací.
Porod: V intermediárním centru, spontánní vaginální, v termínu 40+0. Chlapec, Apgar skóre 7/9/9. Porodní hmotnost 3050 g, délka 50 cm. Nesestouplá varlata, jinak somatický nález v normě, vyjma významné hypotonie – „floppy infant“. Nezvládá kojení, sondován. Základní biochemické parametry (glykémie, pH, laktát, minerály) v normě, infekční parametry zcela negativní. Hypotonie progreduje v respirační selhání s retencí CO2, následně s nutností umělé plicní ventilace. Domluven překlad na pracoviště vyššího typu.
Vyšetření v perinatologickém centru
Kardiologické vyšetření je zcela v normě.
Ultrazvukové vyšetření mozku ukazuje dysgenezi corpus callosum, jinak bez ložiskových změn, krvácení nebo edému.
Provedeno metabolické vyšetření, výsledek bude dostupný za 10 dnů.
Zde provedeno EEG: burst supression – obraz diskontinuity bez epileptogenní aktivity, vysloveno podezření na metabolickou vadu (obr. 1).
Obr. 1. aEEG obraz diskontinuity bez epileptogenní aktivity. Fig. 1. Burst supression – without spike activity. 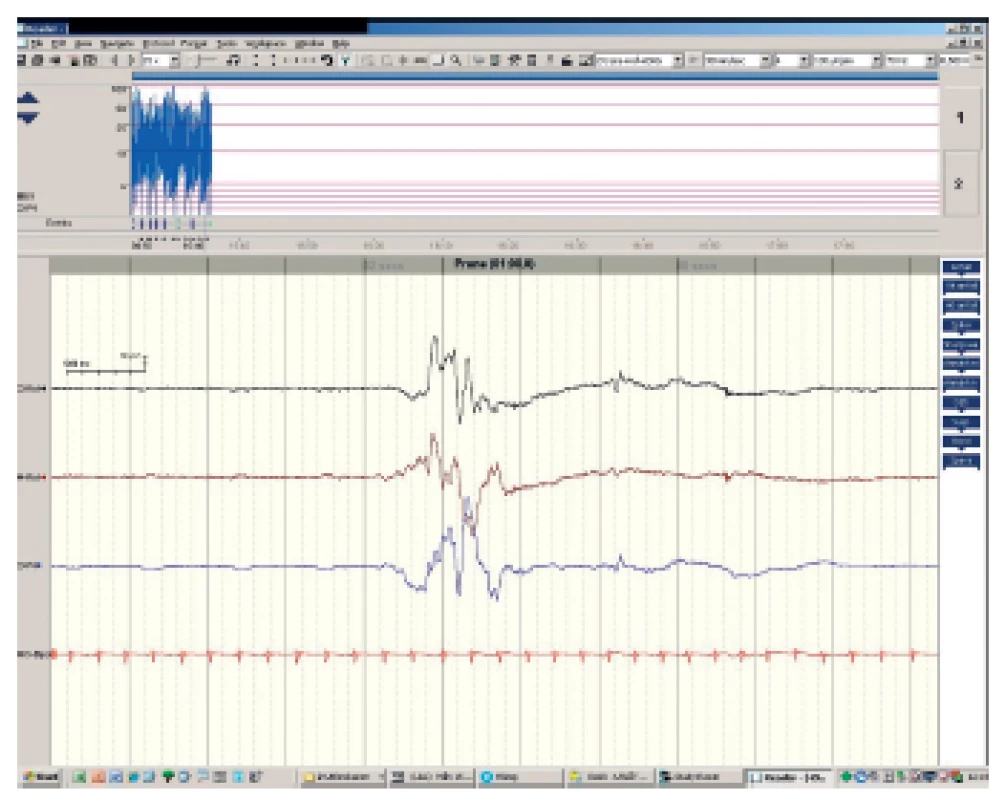
Magnetická rezonance prokázala kromě dysgeneze kalózního tělesa (obr. 2) také patologicky vysoký signál v zadních raménkách capsula interna na T2-vážených obrazech: ten je u zdravých donošených novorozenců za normálních okolností nízký, protože obsahují již vysoké procento myelinizovaných vláken (obr. 3). Na difuzně vážených obrazech byl patologicky zvýšený signál symetricky přítomný v zadních raménkách capsula interna, dále v pontu a v oblasti horních a středních mozečkových pedunkulů (obr. 4); nález snížené difuze byl potvrzen nízkým signálem těchto struktur na ADC mapách. MR spektroskopie (MRS) prokázala patologicky zvýšený peak 3,56 ppm (obr. 5), a to jak v šedé hmotě bazálních ganglií, tak i v bílé hmotě centrum semiovale. Na základě MR a MRS nálezu bylo vysloveno významné podezření na neketotickou hyperglycinémii.
Obr. 2. MR dysgeneze kalózního tělesa. Fig. 2. Magnetic resonance imaging – corpus callosum dysgenesis. 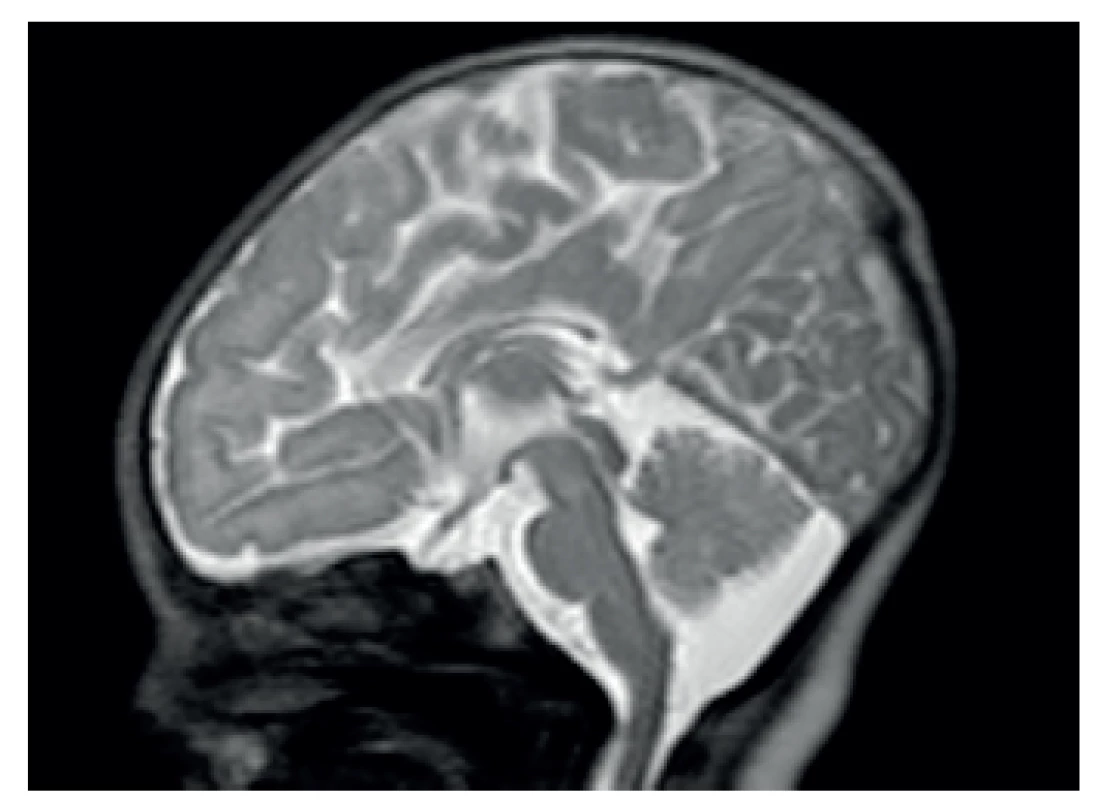
Obr. 3. MR patologicky vysoký signál v zadních raménkách capsula interna na T2-vážených obrazech. Fig. 3. MRI pathologically high signal in posterior bridge capsula interna in T2 high weight scan. 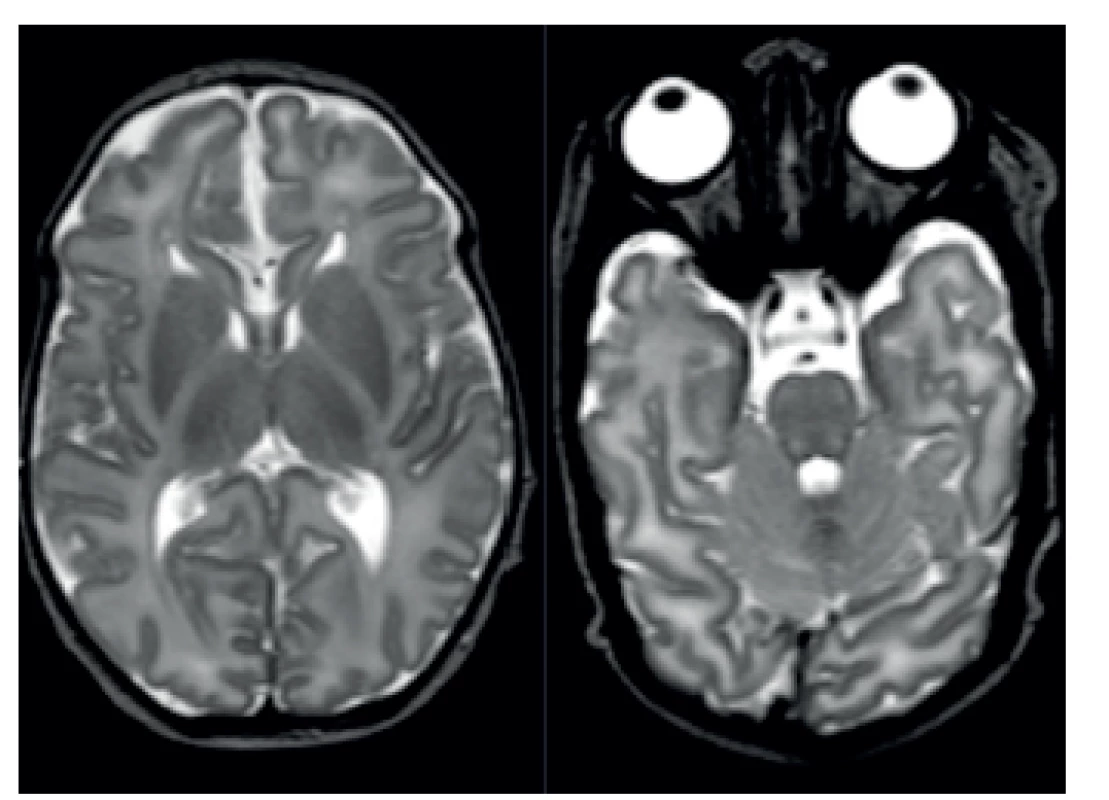
Obr. 4. MR patologicky zvýšený signál symetricky v pontu a v oblasti horních a středních mozečkových pedunkulů. Fig. 4. MRI pathologically high signal in pontus and midle pedunculus cerebellaris. 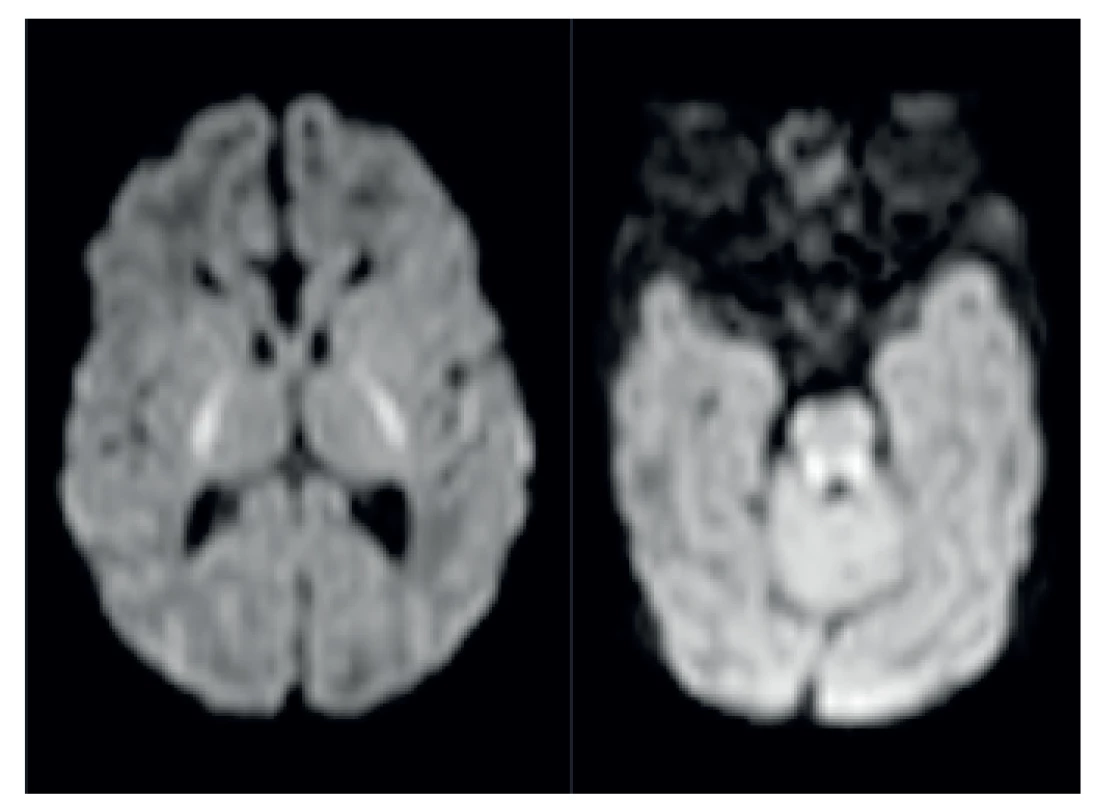
Obr. 5. MR spektroskopie: patologicky zvýšený peak 3.56 ppm. Fig. 5. MRI spectroscopy: pathologically high peak 3.56 ppm. 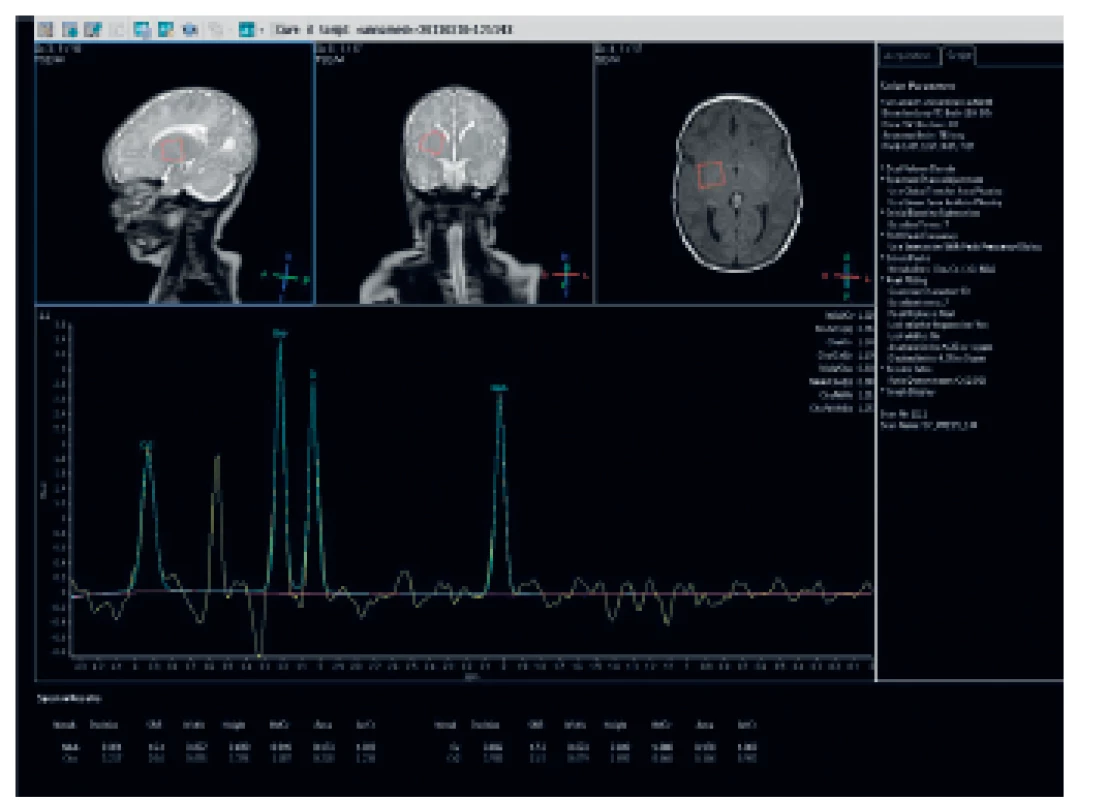
O dva dny později byly obdrženy výsledky metabolického vyšetření s vysokými hodnotami glycinu, které potvrdily diagnózu neketotické hyperglycinémie.
Genetické vyšetření rodičů a dítěte potvrzuje diagnózu: pozitivita mutace 9p24.1.
Zahájena terapie benzoátem sodným a karnitinem se zlepšením klinického stavu, s možností ukončení dechové podpory a překladu zpět do intermediárního centra.
Závěr
Neketotická hyperglycinémie je vzácné metabolické onemocnění, projevující se od nejútlejšího věku významnou svalovou hypotonií, která může rychle progredovat až do respirační insuficience. Specifický nález při vyšetření mozku magnetickou rezonancí s potvrzením abnormálně vysoké koncentrace glycinu v mozku pomocí MR spektroskopie umožňuje tuto diagnózu stanovit ještě dříve, než jsou dostupné výsledky laboratorních metabolických vyšetření.
Prognóza onemocnění je závažná, a je proto velmi důležité stanovit diagnózu co nejdříve, a to mimo jiné i s ohledem na genetické poradenství a možnosti prenatální diagnostiky tohoto onemocnění u dalších těhotenství.
Došlo: 1. 11. 2015
Přijato: 2. 12. 2015
MUDr. Jiří Dušek
Department of Neonatology
University Hospital of Northern Sweden
903 60 Umeå
e-mail: jiri.dusek@umu.se
Zdroje
1. Aliefendioğlu D, Tana Aslan Ay, Coşkun T, et al. Transient nonketotic hyperglycinemia: two case reports and literature review. Pediatr Neurol 2003; 28 : 151–155.
2. Applegarth DA, Toone JR. Glycine encephalopathy (nonketotic hyperglycinaemia): review and update. J Inherit Metab Dis 2004; 27 : 417–422.
3. Baker PR 2nd, Friederich MW, Swanson MA, et al. Variant nonketotic hyperglycinemia is caused by mutations in LIAS, BOLA3 and the novel gene GLRX5. Brain 2014; 137 : 366–379.
4. Brunel-Guitton C, Casey B, Coulter-Mackie M, et al. Late-onset nonketotic hyperglycinemia caused by a novel homozygous missense mutation in the GLDC gene. Mol Genet Metab 2011; 103 : 193–196.
5. Cusmai R, Martinelli D, Moavero R, et al. Ketogenic diet in early myoclonic encephalopathy due to nonketotic hyperglycinemia. Eur J Paediatr Neurol 2012; 16 : 509–513.
6. Dinopoulos A, Matsubara Y, Kure S. Atypical variants of nonketotic hyperglycinemia. Mol Genet Metab 2005; 86 : 61–69.
7. Gerritsen T, Kaveggia E, Waisman HA. A new type of idiopathic hyperglycinemia with hypo-oxaluria. Pediatrics 1965; 36 : 882–891.
8. Hennermann JB, Berger JM, Grieben U, et al. Prediction of long-term outcome in glycine encephalopathy: a clinical survey. J Inherit Metab Dis 2012; 35 : 253–261.
9. Hoover-Fong JE, Shah S, Van Hove JL, et al. Natural history of nonketotic hyperglycinemia in 65 patients. Neurology 2004; 63 : 1847–1853.
10. Kanekar S, Byler D. Characteristic MRI findings in neonatal nonketotic hyperglycinemia due to sequence changes in GLDC gene encoding the enzyme glycine decarboxylase. Metab Brain Dis 2013; 28 : 717–720.
11. Keating JP, Feigin RD, Tenenbaum SM, Hillman RE. Hyperglycinemia with ketosis due to a defect in isoleucine metabolism: A preliminary report. Pediatrics 1972; 50 : 890–895.
12. Kure S, Kato K, Dinopoulos A, et al. Comprehensive mutation analysis of GLDC, AMT, and GCSH in nonketotic hyperglycinemia. Hum Mutat 2006; 27 : 343–352.
13. Lang TF, Parr JR, Matthews EE, et al. Practical difficulties in the diagnosis of transient non-ketotic hyperglycinaemia. Dev Med Child Neurol 2008; 50 : 157–159.
14. Mabry CC, Karam FA. Idiopathic hyperglycinemia and hyperglycinuria. Sth Med J 1963; 56 : 1444.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Záhadná erupce na břiše
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2016 Číslo 2- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Diagnostika primární ciliární dyskineze
- Psychosociální aspekty nespecifických střevních zánětů u dětí
- Průdušková obstrukce v časném dětském věku
- Recidivující respirační infekce
- Aktuálne poznatky o diabetes mellitus. Správa z edukačného Salzburského seminára 2015
-
Odešel významný pediatr, profesor MUDr. Jan Vavřinec, DrSc.
(23. 6. 1947 – 29. 2. 2016) - Školy při nemocnicích a dalších zdravotnických zařízeních
- Význam stanovovania nazálneho oxidu dusnatého u detí – prvé skúsenosti
- Primární bifázický synoviální sarkom jazyka u kojence: Kazuistika vzácného onemocnění s přehledem literatury
- Čo sa môže skrývať za diagnózou atypickej cystickej fibrózy?
- Neketotická hyperglycinémie: případ závažné kongenitální hypotonie diagnostikovaný magnetickou rezonancí
- Hlboká venózna trombóza u dieťaťa s nefrotickým syndrómom
- Záhadná erupce na břiše
- Infekce způsobené Shiga toxin-produkujícími Escherichia coli u dětí
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Infekce způsobené Shiga toxin-produkujícími Escherichia coli u dětí
- Recidivující respirační infekce
- Čo sa môže skrývať za diagnózou atypickej cystickej fibrózy?
- Neketotická hyperglycinémie: případ závažné kongenitální hypotonie diagnostikovaný magnetickou rezonancí
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



