-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Etické aspekty rozšiřování novorozeneckého screeningu dědičných metabolických poruch
Expansion of newborn screening for inherited metabolic disorders – ethical questions
Newborn screening program in the Czech Republic includes 10 inherited metabolic disorders and its expansion is planned as a result of ongoing pilot study. Which disorders should be added and what criteria used for their selection are the key ethical questions closely connected with every screening panel expansion. Traditional screening criteria can function as guidelines even if their universal applicability has been questioned by new biotechnologies and scientific progress. Apart from the benefit from early diagnosis and effective treatment the newborn screening program also poses risks from false-positive and false-negative results as well as detection of conditions with no clinical significance. Before adding a new disorder to the screening panel it is necessary to evaluate the balance between health benefits and potential harms. Furthermore it is important to assess its cost-effectiveness also from the perspective of the whole healthcare system. All newborn screening programs need to evaluate these aspects regularly also for already established panel of diseases and search for new biotechnological solutions to minimize associated risks. Another essential task is to provide parents with all the necessary information in accessible form.
Key words:
newborn screening, inherited metabolic disorders, ethics
Autoři: V. Franková 1,2; F. Votava 3; V. Kožich 1
Působiště autorů: Ústav dědičných metabolických poruch, UK 1. lékařská fakulta a Všeobecná fakultní nemocnice, Prahapřednosta prof. MUDr. V. Kožich, CSc. 1; Ústav humanitních studií v lékařství, UK 1. lékařská fakulta, Prahapřednosta doc. ThDr. V. Ventura, ThD. 2; Klinika dětí a dorostu, UK 3. lékařská fakulta a FN Královské Vinohrady, Prahapřednosta doc. MUDr. F. Votava, Ph. D. 3
Vyšlo v časopise: Čes-slov Pediat 2014; 69 (2): 87-94.
Kategorie: Původní práce
Souhrn
V současné době se v České republice novorozeneckým screeningem vyhledává 10 různých dědičných metabolických poruch a na základě výsledků probíhající pilotní studie je plánováno spektrum vyhledávaných chorob rozšířit. Rozšiřování panelu novorozeneckého screeningu vždy otevírá základní etickou otázku týkající se výběru onemocnění, která mají být do panelu zařazena. Jako vodítko stále slouží tradiční kritéria výběru screenovaných onemocnění, přestože nové biotechnologie a vědecké poznatky zkomplikovaly náhled na jejich univerzální aplikovatelnost. Stejně jako každý jiný screeningový program, přináší novorozenecký screening pro sledovanou populaci nejenom prospěch plynoucí z včasného stanovení diagnózy a zahájení léčby, ale i rizika, mezi která patří detekce klinicky nezávažných stavů, falešně negativní a falešně pozitivní výsledky. Pro nově zařazená onemocnění je proto nutné odborně posoudit, zda je správně vyvážen poměr prospěchu a rizik. Důležitým hodnotícím kritériem je i hledisko efektivity vynaložených finančních zdrojů a jejich vyváženost vzhledem k ostatním oblastem zdravotnictví. Úkolem novorozeneckého screeningového programu je pro všechna nová i dříve zařazená onemocnění pravidelně vyhodnocovat úspěšnost a efektivitu jeho provádění, hledat biotechnologická řešení vedoucí k minimalizaci rizik spojených s jeho prováděním a zajistit odpovídající informovanost rodičů.
Klíčová slova:
novorozenecký screening, dědičné metabolické poruchy, etikaÚvod
Dědičné metabolické poruchy (DMP) představují heterogenní skupinu více než 800 vzácných genetických onemocnění. Přesný výskyt DMP není znám, velmi konzervativní odhady ze zahraničí předpokládají kumulativní incidenci všech známých DMP nejméně 1 : 500. Většina DMP je způsobená geneticky podmíněným deficitem aktivity enzymů, u některých nemocí je postižena funkce transportérů na membránách, různých pomocných proteinů a dalších genových produktů. Klasickým příkladem DMP je fenylketonurie (PKU) – první DMP, pro kterou byla objevena účinná léčba. Pro PKU byl jako pro první onemocnění vyvinut a zahájen i celoplošný novorozenecký screening, který je v České republice (ČR) prováděn od roku 1975. Panel novorozeneckého screeningu byl rozšířen o dalších 9 DMP v říjnu 2009 (viz tab. 2 v článku Votavy a kol. v tomto čísle, s. 80). Těchto 10 vybraných DMP má souhrnný výskyt přibližně 1 : 4000.
Tab. 1. Onemocnění vyhledávaná novorozeneckým screeningem v ČR. 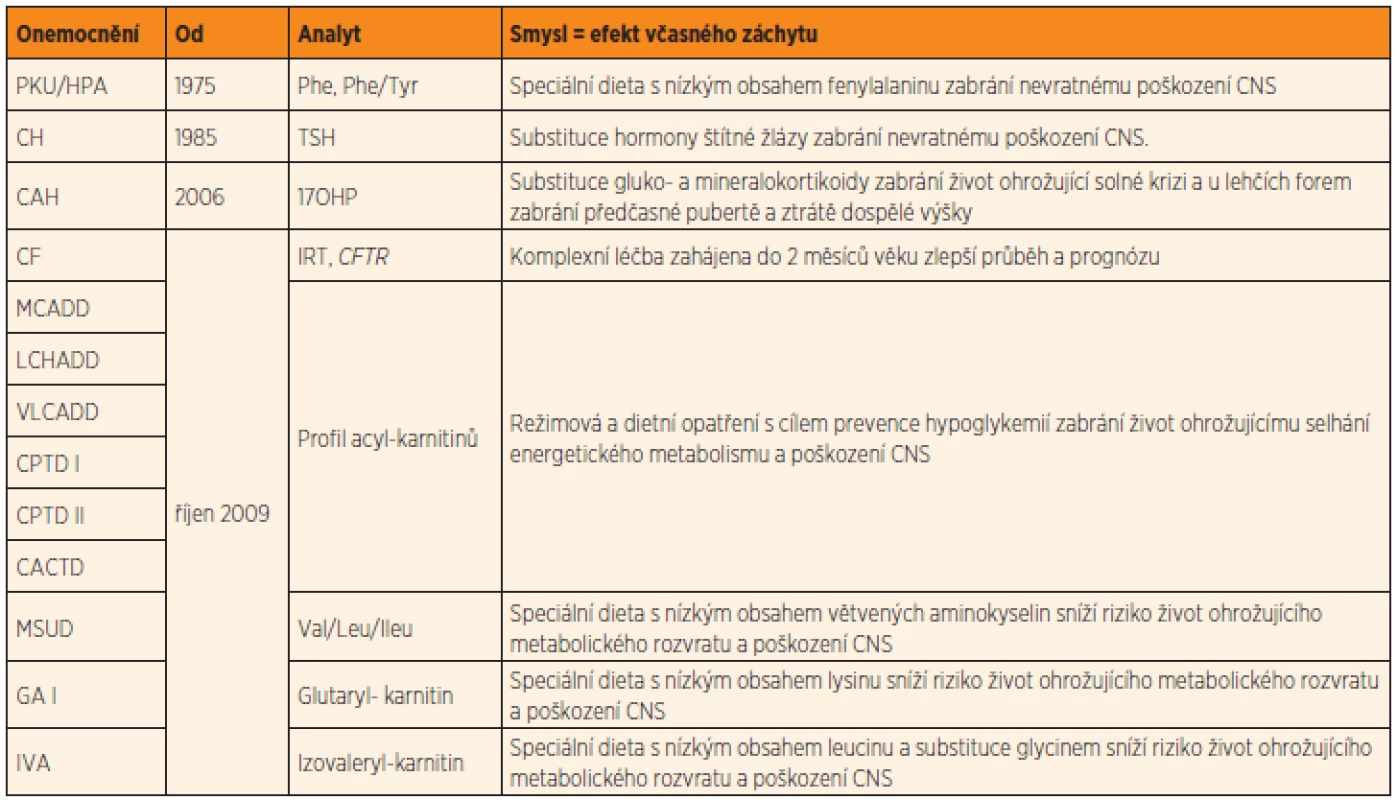
Vysvětlivky: PKU/HPA = fenylketonurie nebo hyperfenylalaninemie; CH = kongenitální hypotyreóza; CAH = kongenitální adrenální hyperplazie, resp. deficit 21-hydroxylázy; CF = cystická fibróza; MCADD = deficit acyl-CoA dehydrogenázy mastných kyselin se středně dlouhým řetězcem; LCHADD = deficit 3-hydroxyacyl-CoA dehydrogenázy mastných kyselin s dlouhým řetězcem; VLCADD = deficit acyl-CoA dehydrogenázy mastných kyselin s velmi dlouhým řetězcem; CPTD I a II = deficit karnitinpalmitoyltransferázy I a II; CACTD = deficit karnitinacylkarnitintranslokázy; MSUD = leucinóza (nemoc javorového sirupu); GA I = glutarová acidurie typ I; IVA = izovalerová acidurie; Phe = fenylalanin, Tyr = tyrosin; TSH = tyreotropin; 17OHP = 17-hydroxyprogesteron; IRT = imunoreaktivní trypsinogen; CFTR = gen pro cystickou fibrózu; Val = valin; Leu = leucin; Ileu = isoleucin Novorozenecký screening je již od svých počátků provázen řadou etických otázek. Tou hlavní a stále aktuální je otázka výběru onemocnění, která mají být screeningem vyhledávána, a s tím související stanovení kritérií, podle nichž by se výběr měl řídit. Tento problém byl reflektován již v prvopočátcích zavádění novorozeneckého screeningu do praxe, proto z iniciativy Světové zdravotnické organizace (WHO) bylo v roce 1968 formulováno Wilsonem a Jungnerem deset obecných pravidel včasné diagnostiky a detekce chorob [1]. Tato pravidla byla koncipována jako vodítko i pro ostatní screeningové programy. Znění Wilsonových-Jungnerových pravidel je uvedeno v tabulce 1.
Tab. 2. Principy včasné detekce chorob formulované Wilsonem a Jungnerem v roce 1968. 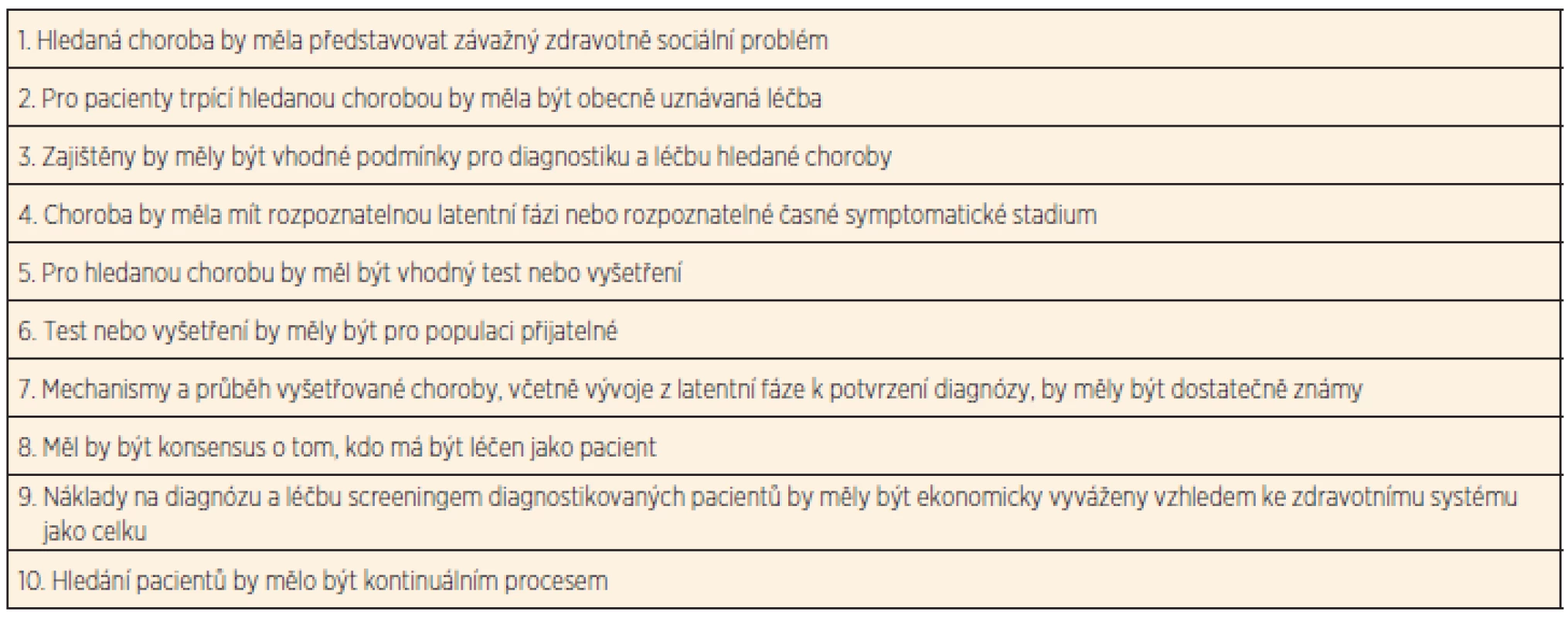
Další vlna diskuse etických problémů spojených s novorozeneckým screeningem se zvedla v souvislosti s nástupem nových biotechnologií, zejména tandemové hmotnostní spektrometrie (MS/MS). MS/MS umožňuje vyšetřit v suché krevní kapce až několik desítek různých DMP, a to během jediné rychlé laboratorní analýzy. Nové možnosti rychlé a relativně levné laboratorní analýzy podnítily diskusi o možné revizi původních Wilsonových-Jungnerových pravidel [2–4]. Možnost využití nových biotechnologií však otázku výběru screeningem vyhledávaných onemocnění nezjednodušila, naopak s možností zařazení podstatně většího počtu chorob se stala ještě komplikovanější. Hlavním důvodem je to, že novorozenecký screening přináší stejně jako každý jiný screeningový program pro sledovanou populaci nejenom prospěch, ale i určitá rizika. V případě novorozeneckého screeningu je vzhledem k jeho celopopulačnímu provádění vystaveno rizikům poměrně velké množství novorozenců a jejich rodin (v ČR je nyní vyšetřeno řádově 100 000 novorozenců ročně). Proto je nutno při naplňování jeho cílů vždy zvažovat, za jakých podmínek lze dosáhnout maximálního prospěchu při minimalizaci rizik.
Zároveň etické problémy spojené s prováděním novorozeneckého screeningu nelze analyzovat pouze z pohledu prospěchu zdraví pro jednotlivce. Důležitým hodnotícím kritériem je i hledisko efektivity vynaložených finančních zdrojů a jejich vyváženost vzhledem k ostatním oblastem zdravotnictví (viz tab. 1, pravidlo 9). V případě novorozeneckého screeningu finanční náklady nezahrnují pouze provedení primárních laboratorních analýz, které jsou relativně levné (na screeningové vyšetření jednoho novorozence činí náklady zdravotní pojišťovny v současnosti 750, - Kč, z toho na DMP 165, - Kč). Další náklady představují laboratorní vyšetření nutná k definitivnímu potvrzení diagnózy, následná dlouhodobá (celoživotní) zdravotní péče o diagnostikované jedince, eventuálně zjištění zdravotního a genetického stavu vytipovaných rodinných příslušníků a zajištění prenatální péče v případě dalších těhotenství. Náklady se mohou navyšovat i v souvislosti s riziky novorozeneckého screeningu, kterým se budeme podrobněji věnovat dále. V případě rozšiřování screeningového panelu o další onemocnění je tedy nutno vždy zvažovat, zda jsou všechny tyto náklady vynaloženy efektivně, zda si je konkrétní zdravotní systém může dovolit vynaložit, a to i vzhledem k jiným oblastem zdravotní péče.
Více onemocnění = více prospěchu?
Nejdůležitějším cílem novorozeneckého screeningu je celoživotní zlepšení zdravotního stavu vyšetřované populace. Z tohoto pohledu má screening svoje opodstatnění pouze v případě, jestliže včasná diagnóza a léčba povede k výrazně lepšímu zdravotnímu stavu, než je-li onemocnění diagnostikováno klinicky až po nástupu symptomů. Efekt včasného záchytu onemocnění a zahájení zdravotní péče u onemocnění zařazených v panelu novorozeneckého screeningu v ČR shrnuje tabulka 2 v článku Votavy a kol. v tomto čísle (s. 80). V případě včasného záchytu onemocnění a zahájení efektivní léčby přináší novorozenecký screening prospěch jednotlivci, zároveň jsou prostředky vynaložené na diagnostiku a léčbu využity maximálně efektivně. Přestože léčba může být například u některých metabolických onemocnění, jako jsou poruchy metabolismu aminokyselin a organické acidurie, poměrně nákladná (100–300 tisíc Kč ročně [5]), lze jejím včasným nasazením zabránit podstatně větším nákladům, které by vznikaly v důsledku sociální péče nutné v případě trvalého poškození CNS. Zároveň jsou náklady na léčbu mnohonásobně vyváženy ekonomickým přínosem pro společnost (tvorba hrubého domácího produktu, platba daní, platba sociálního a zdravotního pojištění), kterého je léčený jedinec v produktivním věku potenciálně schopen.
Mimo prospěchu představujícího výrazné zlepšení kvality a délky života může novorozenecký screening přinášet i sekundární tzv. reprodukční prospěch [6]. Ten již není směrován přímo na pacienta, ale na jeho rodinné příslušníky, pro které zjištění výskytu vzácného dědičného onemocnění v rodině a zjištění jejich genetického stavu může mít významnou roli v jejich dalších reprodukčních plánech. Za sekundární prospěch plynoucí z novorozeneckého screeningu je považována i jistota stanovení diagnózy a tím i možnost vyhnutí se „diagnostickému martyriu“. To vzniká proto, že počáteční symptomy vzácných dědičných onemocnění jsou často nespecifické a správná diagnóza je většinou stanovena až po vyloučení častějších a snáze zjistitelných příčin. Je-li onemocnění zařazeno ve screeningovém panelu, je správná diagnóza stanovena bezprostředně po jeho provedení. Tento prospěch je významný jak pro pacienta, který je ušetřen řady často i invazivních vyšetření, tak i pro rodiče, pro které jsou opakované návštěvy zdravotnických zařízení a nejistota ohledně stanovení diagnózy značně psychicky zatěžující.
Otázkou zůstává, zda tyto typy sekundárního prospěchu jsou dostatečnými kritérii pro rozšíření novorozeneckého screeningu o onemocnění, u nichž není dostupná efektivní léčba a tudíž nenaplňují Wilsonova-Jungnerova pravidla uvedená v bodech 2 a 3 tabulky 1. V odborných kruzích se názory na tuto problematiku liší. Zastánci rozšiřování novorozeneckého screeningu argumentují tím, že další laboratorní testy provedené ze suché krevní kapky nepředstavují pro novorozence žádnou další zátěž a náklady na jejich provedení jsou minimální [2, 3]. Pro zařazení neléčitelných onemocnění do novorozeneckého screeningu se překvapivě kladně vyjádřila i laická veřejnost ve dvou studiích provedených v Nizozemí [7, 8]. V dotazníkovém šetření se pro zařazení Duchennovy muskulární dystrofie vyjádřilo 73 % z 1372 respondentů. Nejvíce uváděným důvodem bylo právě včasné stanovení diagnózy, vyhnutí se diagnostickému martyriu a umožnění informovaného přístupu k dalšímu těhotenství [8]. Ze studií taktéž vyplynulo, že pro část laické veřejnosti by seznámení s diagnózou v novorozeneckém věku bylo výhodou ve smyslu přípravy na pozdější zdravotní komplikace dítěte. Část by naopak preferovala před nástupem symptomů o závažném onemocnění nevědět a „bezstarostně si užít období, kdy je dítě zdravé“ [7, 8].
Část odborné veřejnosti zastává k rozšiřování novorozeneckého screeningu více kritický přístup a argumentuje zejména faktem, že čím více onemocnění je do novorozeneckého screeningu zařazeno, tím větší je i pravděpodobnost výskytu rizik a zátěže zdravé populace [9, 10]. Obzvlášť kriticky je nahlíženo právě na neléčitelná onemocnění [11], z jejichž zařazení nevyplývá žádný primární prospěch pro pacienta a stejně tak efektivita vynaložených finančních prostředků je oproti léčitelným onemocněním mizivá.
Více onemocnění = více rizik?
Mezi hlavní rizika novorozeneckého screeningu patří především falešně negativní a falešně pozitivní nálezy. Jejich výskyt je spjat s každou biologicko-analytickou laboratorní metodou a je určen její senzitivitou a specificitou. Ideální screeningový test je dostatečně senzitivní (zachytí všechny pacienty) a zároveň dostatečně specifický (zachytí pouze pacienty a nikoliv zdravé jedince). Reálně však takovýchto výsledků žádné screeningové vyšetření nedosahuje. Výskyt falešně negativních a falešně pozitivních výsledků v ČR je shrnut v tomto čísle v článku Votavy a kol. (tab. 3 a text, s. 77–86). Jedním z dalších rizik představujících zátěž jak pro zdravou populaci, tak i pro zdravotní systém jako celek je detekce klinicky nezávažných stavů.
Tab. 3. Výsledky novorozeneckého screeningu v ČR v období 1. 1. 2002 – 31. 12. 2012. 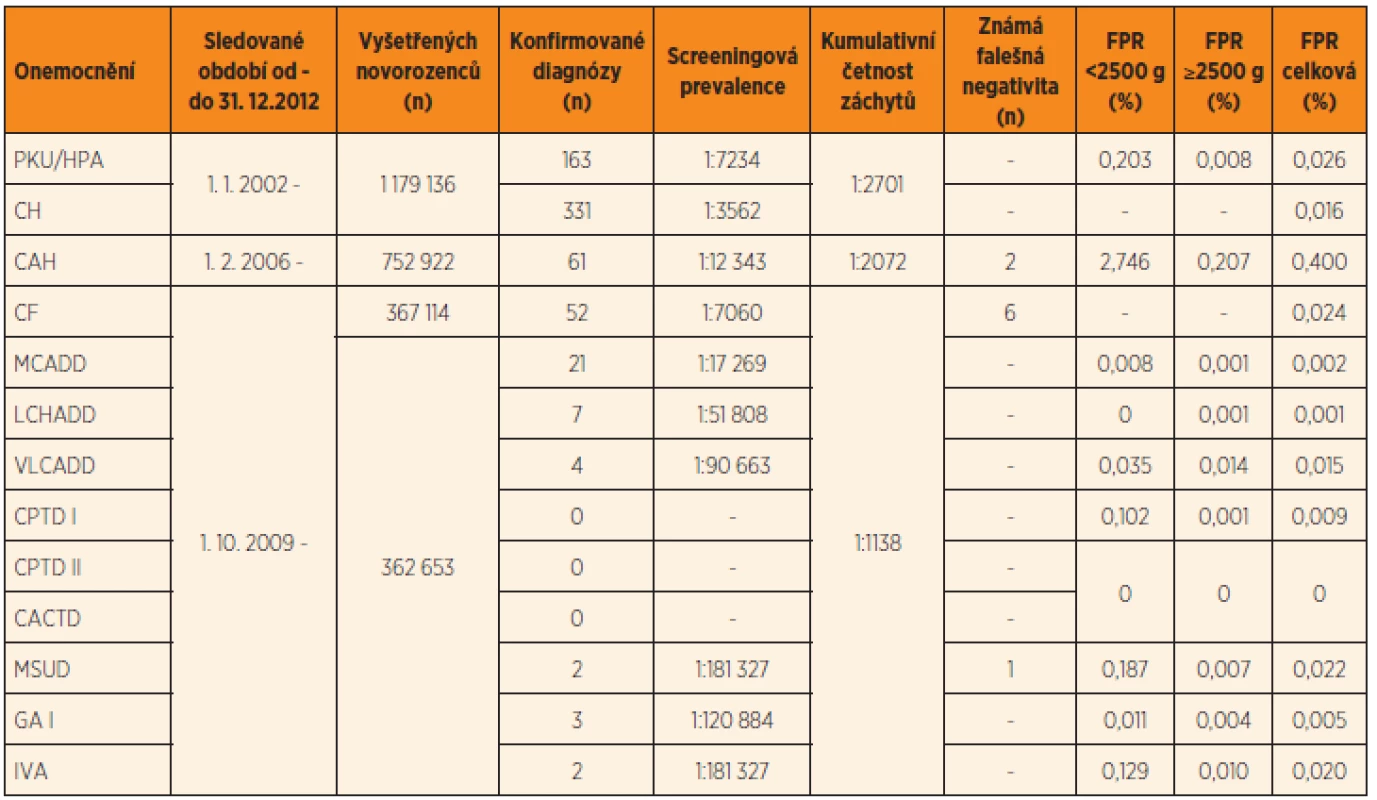
Vysvětlivky: PKU/HPA = fenylketonurie nebo hyperfenylalaninemie; CH = kongenitální hypotyreóza; CAH = kongenitální adrenální hyperplazie resp. deficit 21-hydroxylázy; CF = cystická fibróza; MCADD = deficit acyl-CoA dehydrogenázy mastných kyselin se středně dlouhým řetězcem; LCHADD = deficit 3-hydroxyacyl-CoA dehydrogenázy mastných kyselin s dlouhým řetězcem; VLCADD = deficit acyl-CoA dehydrogenázy mastných kyselin s velmi dlouhým řetězcem; CPTD I a II = deficit karnitinpalmitoyltransferázy I a II; CACTD = deficit karnitinacylkarnitintranslokázy; MSUD = leucinóza (nemoc javorového sirupu); GA I = glutarová acidurie typ I; IVA = izovalerová acidurie; FPR = „false positivity rate“, četnost opakování odběru screeningu s konečným negativním výsledkem pro předchozí nejasný nález v prvním pravidelném odběru mezi 48. a 72. hodinou života, počítáno v období 1. 1. 2010 – 31. 12. 2012 Falešně negativní nálezy
V případě falešně negativních nálezů selhává novorozenecký screening ve svém hlavním úkolu – tedy prospěchu pro zdraví jednotlivce. Falešně negativní nálezy se mohou vyskytnout z řady důvodů. Jestliže pomineme technické a logistické chyby při odběru, transportu či vyšetření, jejich nejčastější biologickou příčinou je mírná forma nemoci, při které se u novorozence v době odběru suché kapky krve neprojeví typické změny koncentrace metabolitů.
Při výskytu falešně negativních nálezů dochází ke stanovení diagnózy až po rozvoji symptomů, kdy již může být zdraví novorozence nevratně poškozeno. Správnému stanovení diagnózy většinou předchází řada dalších více nákladných vyšetření. Falešně negativní výsledky tedy představují navýšení nákladů jak na diagnostiku, tak i na následnou péči, která může být komplikována nevratným celoživotním poškozením zdraví jedince.
Falešně pozitivní nálezy
Riziko falešně pozitivních nálezů spočívá především v jejich vlivu na psychický stav rodičů novorozence. Rodiče jsou po určitou dobu vystaveni informaci, že jejich dítě může trpět závažným onemocněním. I když je dalšími vyšetřeními toto podezření vyvráceno, stres, úzkost a obavy o zdraví dítěte mohou u některých rodičů dlouhodobě přetrvávat. Studie prokázaly, že více než jedna třetina rodičů má stálé obavy o zdraví dítěte, matky uvádějí zvýšenou míru stresu, lze sledovat i dysfunkci ve vztahu rodič – dítě [12–15]. Zároveň bylo prokázáno, že menší míru stresu v takovéto situaci prožívají rodiče, kteří jsou o podstatě novorozeneckého screeningu dostatečně informováni [13]. Je však nutno uvést, že falešně pozitivní výsledky se častěji vyskytují u nezralých novorozenců s nízkou porodní hmotností (viz tab. 3 v článku Votavy a kol. v tomto čísle, s. 82). U rodičů této skupiny novorozenců nezpůsobuje opakování vyšetření další zvýšení psychologické zátěže, je jimi vnímáno jako součást intenzivní péče, která je dítěti poskytována.
U finančních nákladů dochází v případě falešně pozitivních nálezů k navýšení, zejména v důsledku provádění dalších vyšetření nutných ke stanovení skutečného zdravotního stavu dítěte, eventuálně nutnosti hospitalizace, je-li prvotní výsledek novorozeneckého screeningu alarmující. Finanční náklady mohou narůstat i v souvislosti s výše uvedeným psychologickým efektem falešně pozitivního výsledku. Jedna z prvních studií provedených v USA prokázala, že děti, jejichž novorozenecký screening byl falešně pozitivní, jsou následně až dvakrát častěji hospitalizovány z důvodu různých onemocnění nesouvisejících s novorozeneckým screeningem [12, 13]. Tyto výsledky se však v dalších studiích nepotvrdily [16, 17] a zůstává tudíž otázkou, zda je zvýšení nákladů spojených s falešně pozitivním výsledkem novorozeneckého screeningu důležitým aspektem.
Detekce klinicky nezávažných stavů
Wilsonova-Jungnerova pravidla včasné detekce chorob uvedené pod bodem 7 a 8 (tab. 1) zdůrazňují znalost biologické podstaty onemocnění a jeho příznaků u jedinců, kteří mají být léčeni. U některých onemocnění je to však teprve novorozenecký screening, který přinese poznatky o šíři jejich fenotypových projevů. Pomocí screeningu byl u některých chorob (např. deficit acyl-CoA dehydrogenázy mastných kyselin se středně dlouhým řetězcem – MCADD) zjištěn podstatně vyšší výskyt, než se předpokládalo na základě jejich klinického záchytu [18, 19]. Takovýto nárůst má dvě možná vysvětlení. Tím prvním je možnost, že před zavedením novorozeneckého screeningu se u řady případů na příslušnou diagnózu nepomyslelo a správná diagnóza nebyla nikdy stanovena. Jestliže je onemocnění takto klinicky poddiagnostikováno, provádění screeningu má pro jedince postižené touto chorobou jednoznačný prospěch, který spočívá především v jistotě stanovení diagnózy a zahájení léčby. Na druhou stranu, je zřejmé, že novorozeneckým screeningem dochází k záchytu onemocnění i u jedinců, u kterých se celoživotně vyskytnou pouze lehké nebo žádné příznaky [18]. V tomto případě novorozenecký screening detekuje i klinicky nezávažné stavy a mohl by být příčinou negativních jevů, které nejlépe vystihují anglické termíny „overdiagnosis“ a „overtreatment“. Proto je nutné dlouhodobě sledovat klinický průběh onemocnění u screeningem zachycených jedinců a na základě těchto pozorování definovat odborná stanoviska o léčbě a sledování zdravotního stavu jedinců s lehkými nebo žádnými příznaky, eventuálně onemocnění z panelu novorozeneckého screeningu vyřadit.
Příkladem může být deficit 3-methylkrotonyl-koenzym A karboxylázy (MCCD), což je vzácné dědičné onemocnění, které se řadí mezi organické acidurie s atakami v kojeneckém až batolecím věku. Enzym 3-methylkrotonyl-koenzym A karboxyláza se podílí na katabolismu leucinu a skládá se ze dvou podjednotek, u nichž byla na úrovni genů již popsána řada mutací zapříčiňujících MCCD. Doporučená léčba zahrnuje režimová opatření zabraňující katabolickým epizodám, nízkobílkovinnou dietu a podávání karnitinu. Novorozenecký screening vyhledává jedince pomocí MS/MS, podezření na MCCD je následně prokázáno přítomností mutací detekovaných molekulárně genetickou analýzou. Ještě před zahájením novorozeneckého screeningu bylo prokázáno, že klinický průběh tohoto onemocnění je značně variabilní, od absence jakýchkoliv symptomů až po úmrtí v dětském věku [20, 21]. Předtím, než bylo v některých státech zařazeno do panelu novorozeneckého screeningu, bylo MCCD považováno za velmi vzácné onemocnění. V současné době se jeho odhadovaná incidence pohybuje mezi 1 : 64 000 až 1 : 250 000 [22]. Srovnávací analýzou kazuistik a dat získaných z novorozeneckého screeningu bylo odhaleno, že k rozvoji symptomů MCCD dochází pouze u malé části diagnostikovaných jedinců (méně než 10 %). Zároveň bylo také prokázáno, že ani na základě genotypu nelze předpovědět, zda u jedince k vývoji klinických symptomů dojde nebo ne.
Detekce klinicky nezávažných stavů tedy představuje především zátěž pro zdravou populaci. Jedincům je na základě výsledků novorozeneckého screeningu a dalších např. genetických vyšetření stanovena diagnóza, na jejímž základě jsou dlouhodobě, někdy i celoživotně stigmatizováni. Jako další faktory dlouhodobě zatěžující především rodinu novorozence lze uvést časté návštěvy a vyšetření ve zdravotnických zařízeních, dodržování režimových opatření, eventuální obavy o zdraví dalších potomků. Z ekonomického hlediska jsou v tomto případě finanční náklady použité na diagnostiku a léčbu jedinců využity neúčelně.
Minimalizace výskytu uvedených rizik
Jak lze výskyt výše uvedených rizik minimalizovat? Z výsledků novorozeneckého screeningu v ČR vyplývá, že falešně negativní nálezy se u DMP vyskytly stejně jako u ostatních chorob pouze v minimálním počtu (viz článek Votavy a kol., tab. 3 a text). Je samozřejmou snahou snížit i počet falešně pozitivních nálezů na minimum. Přesto nelze jejich výskytu zcela zabránit, protože rozšiřováním kritické hranice analytů (cut-off hladina) by nutně docházelo ke zvýšení výskytu falešné negativity a tím i selhání novorozeneckého screeningu v jeho základním úkolu. Zároveň i z ekonomického hlediska jsou náklady spojené s falešně negativními nálezy (diagnostická vyšetření, léčba zdravotních komplikací způsobených rozvojem onemocnění, sociální péče nutná v případě trvalého poškození CNS) nepoměrně vyšší než u nálezů falešně pozitivních (diagnostické vyšetření).
Možné řešení přináší výzkum zaměřený na využitelnost a efektivitu zavádění druhostupňových markerů (second tier tests), které lze testovat přímo v prvotně odebraném vzorku suché krevní kapky. Tyto testy se vyznačují vysokou specificitou a obvykle však i vyšší analytickou, eventuálně finanční náročností. Protože jsou použity pouze u malého počtu vzorků (~2 %), které byly selektovány v prvním stupni screeningu, představují pouze malé navýšení finančních nákladů (jednotky procent celkových nákladů vynaložených na novorozenecký screeningový program) při výrazném zvýšení specificity a tím i snížení počtu falešně pozitivních nálezů.
Zavádění druhostupňových markerů, systematické provádění pilotních studií a pravidelné a kritické hodnocení efektivity novorozeneckého screeningového programu může taktéž zamezit detekci klinicky nezávažných stavů. Právě na základě pilotní studie, která byla provedena v Bavorsku a podrobně vyhodnocovala výsledky novorozeneckého screeningu MCCD včetně klinických a genetických nálezů, bylo doporučeno toto onemocnění do celoněmeckého standardního screeningového panelu nezařazovat [22].
Druhou možností, kterou sice nelze ovlivnit výskyt rizik, ale lze předcházet jejich negativním vlivům, je rozšíření informovanosti laické veřejnosti o podstatě, způsobu provádění, rizicích a možných výsledcích novorozeneckého screeningu. Zahraniční studie prokázaly, že informovanost o novorozeneckém screeningu mezi laickou veřejností je poměrně nízká [13, 23]. Gurian se spolupracovníky (2006) dotazníkovým šetřením u skupiny rodičů, u jejichž dítěte se vyskytl falešně pozitivní výsledek novorozeneckého screeningu, došli k závěrům, že pouze jedna třetina rodičů pochopila, proč byl dítěti proveden opakovaný odběr [13]. Zároveň matky, které chápaly důvod opakovaného odběru, byly podstatně méně stresovány. Studiemi bylo navíc poukázáno na to, že rodiče v případě pozitivních nálezů novorozeneckého screeningu nejprve čerpají informace z poměrně nespolehlivých zdrojů, jako jsou známí, příbuzní a internet [13, 23]. Pro zprostředkování přesných informací jak pro laickou, tak i odbornou veřejnost byl v ČR v roce 2009 spuštěn internetový portál novorozeneckého screeningu (www.novorozeneckyscreening.cz).
Závěr
Hlavní otázkou a zároveň i určujícím kritériem při rozšiřování novorozeneckého screeningu není to, kolik onemocnění je možné do screeningového panelu zařadit, ale jakého zlepšení zdravotního stavu sledované populace lze docílit. Z tohoto úhlu pohledu jsou jednoznačnými kandidáty onemocnění, jejichž včasná diagnóza vede k významnému zlepšení zdravotního stavu a následně i kvality života jedince. Přesto je nutno vždy kriticky vyhodnotit, zda při zařazení těchto chorob nedojde k neúměrnému zatížení zdravé populace v důsledku nízké specificity použitých markerů. Jedním z úkolů programu novorozeneckého screeningu je proto hledání technologických řešení umožňujících minimalizaci rizik, a to i u onemocnění, která jsou již v panelu zařazena. Minimalizace rizik zároveň vede i k maximálně efektivnímu využití všech finančních nákladů spojených se zajištěním diagnostiky a léčby. Přesto je před zařazením každého nového onemocnění nutno odborně zhodnotit, zda je poměr prospěchu a finančních nákladů vyvážený a zda by jejich využití v jiné oblasti zdravotní péče nevedlo k většímu prospěchu (např. jiná forma bezplatného preventivního programu).
Dalším důležitým úkolem programu novorozeneckého screeningu je zvýšení informovanosti laické veřejnosti, a to zejména budoucích rodičů. Prvním krokem je nalezení způsobů, jak tento úkol nejlépe organizačně zajistit. Z tohoto důvodu byly v současné době i v ČR zahájeny studie sledující míru informovanosti o novorozeneckém screeningu a dopadu jeho falešně pozitivního výsledku na rodiče pacientů. Výsledky těchto studií by měly zmapovat faktory specifické pro českou populaci, praktické možnosti předcházení negativního vlivu falešně pozitivního výsledku a zároveň se i promítnout do dalšího postupu rozšiřování novorozeneckého screeningu.
Práce vznikla za podpory: PRVOUK-P24//LF1/3, MZ ČR – RVO VFN64165, projekt IGA MZ NT12213 pro VF1,2 a VK1; PRVOUK P31 pro FV3.
Došlo: 8. 1. 2014
Přijato: 14. 2. 2014
Mgr. Věra Franková, Ph.D.
Ústav dědičných metabolických poruch UK 1. LF a VFN
Ke Karlovu 2
128 08 Praha 2
e-mail: vera.frankova@lf1.cuni.cz
Zdroje
1. Wilson JM, Jungner YG. Principles and Practise of Screening for Disease. In: Public Health Papers. Geneva: World Health Organization, 1968 : 163.
2. Pollitt RJ. Principles and performance: assessing the evidence. Acta Paediatr Suppl 1999; 88 (432): 110–114.
3. Therrell BL Jr. U.S. newborn screening policy dilemmas for the twenty-first century. Mol Genet Metab 2001; 74 (1-2): 64–74.
4. Wilcken B. Ethical issues in newborn screening and the impact of new technologies. Eur J Pediatr 2003; 162 (Suppl 1): S62–66.
5. Honzík T, Kožich V, Zeman J. Dědičné poruchy metabolismu. In: Kubáčková K, et al. Vzácná onemocnění v kostce. Praha: Mladá Fronta, 2014 : 168–187.
6. Bombard Y, Miller FA, Hayeems RZ, et al. The expansion of newborn screening: is reproductive benefit an appropriate pursuit? Nat Rev Genet 2009; 10 (10): 666–667.
7. Detmar S, Dijkstra N, Nijsingh N, et al. Parental opinions about the expansion of the neonatal screening programme. Community Genet 2008; 11 (1): 11–17.
8. Plass AM, van El CG, Pieters T, et al. Neonatal screening for treatable and untreatable disorders: prospective parents‘ opinions. Pediatrics 2010; 125 (1): e99–106.
9. Tarini BA, Christakis DA, Welch HG. State newborn screening in the tandem mass spectrometry era: more tests, more false-positive results. Pediatrics 2006; 118 (2): 448–456.
10. Baily MA, Murray TH. Ethics, evidence, and cost in newborn screening. Hastings Cent Rep 2008; 38 (3): 23–31.
11. Ross LF. Screening for conditions that do not meet the Wilson and Jungner criteria: the case of Duchenne muscular dystrophy. Am J Med Genet A 2006; 140 (8): 914–922.
12. Waisbren SE, Albers S, Amato S, et al. Effect of expanded newborn screening for biochemical genetic disorders on child outcomes and parental stress. JAMA 2003; 290 (19): 2564–2572.
13. Gurian EA, Kinnamon DD, Henry JJ, et al. Expanded newborn screening for biochemical disorders: the effect of a false-positive result. Pediatrics 2006; 117 (6): 1915–1921.
14. Morrison DR, Clayton EW. False positive newborn screening results are not always benign. Public Health Genomics 2011; 14 (3): 173–177.
15. Tu WJ, He J, Chen H, et al. Psychological effects of false-positive results in expanded newborn screening in China. PLoS One 2012; 7 (4): e36235.
16. Lipstein EA, Perrin JM, Waisbren SE, et al. Impact of false-positive newborn metabolic screening results on early health care utilization. Genet Med 2009; 11 (10): 716–721.
17. Tarini BA, Clark SJ, Pilli S, et al. False-positive newborn screening result and future health care use in a state Medicaid cohort. Pediatrics 2011; 128 (4): 715–722.
18. Wilcken B. Expanded newborn screening: reducing harm, assessing benefit. J Inherit Metab Dis 2010; 33 (Suppl 2): S205–210.
19. Wilcken B, Wiley V, Hammond J, et al. Screening newborns for inborn errors of metabolism by tandem mass spectrometry. N Engl J Med 2003; 348 (23): 2304–2312.
20. Bannwart C, Wermuth B, Baumgartner R, et al. Isolated biotin-resistant deficiency of 3-methylcrotonyl-CoA carboxylase presenting as a clinically severe form in a newborn with fatal outcome. J Inherit Metab Dis 1992; 15 (6): 863–868.
21. Mourmans J, Bakkeren J, de Jong J, et al. Isolated (biotin-resistant) 3-methylcrotonyl-CoA carboxylase deficiency: four sibs devoid of pathology. J Inherit Metab Dis 1995; 18 (5): 643–645.
22. Stadler SC, Polanetz R, Maier EM, et al. Newborn screening for 3-methylcrotonyl-CoA carboxylase deficiency: population heterogeneity of MCCA and MCCB mutations and impact on risk assessment. Hum Mutat 2006; 27 (8): 748–759.
23. Araia MH, Wilson BJ, Chakraborty P, et al. Factors associated with knowledge of and satisfaction with newborn screening education: a survey of mothers. Genet Med 2012; 14 (12): 963–970.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek MikropenisČlánek Antonín Mrskoš
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2014 Číslo 2- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Antropometrické, hormonálne a metabolické zmeny u prepubertálnych detí, narodených ako SGA, so zníženým rastom, liečených rastovým hormónom, po prvom roku liečby
- Osteogenesis imperfecta asociovaná s izolovaným deficitom rastového hormónu
- Polohové anomálie varlat a kryptorchismus v prvním roce života
- Mikropenis
- 11. Český pediatrický kongres s mezinárodní účastí
- „EVIDENCE BASED PHARMACOTHERAPY IN NEWBORNS AND CHILDREN“
- Odešel prof. Dr. med. Dr. med. h. c. mult. Theodor Hellbrügge
- Antonín Mrskoš
- Vzťah medzi obezitou a závažnosťou hypertenzie u detí a adolescentov
- Výsledky rozšířeného novorozeneckého screeningu v České republice
- Etické aspekty rozšiřování novorozeneckého screeningu dědičných metabolických poruch
- Chirurgická liečba hydrocefalu a jej komplikácie
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Mikropenis
- Chirurgická liečba hydrocefalu a jej komplikácie
- Polohové anomálie varlat a kryptorchismus v prvním roce života
- Výsledky rozšířeného novorozeneckého screeningu v České republice
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



