-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaVliv jodového stavu a mateřských tyreopatií na vývoj štítné žlázy a jeho poruchy u plodu a novorozence
Influence of iodine supplementation level and maternal thyroid disorders on thyroid gland development and its disorders in fetus and newborn
This survey article connects physiology of anatomical and functional development of thyroid gland with maternal iodine supplementation and maternal disorders of thyroid gland. The fetus is fully dependent on maternal thyroid hormones until week 14 to 16 of gestation. The production of its own thyroid hormones gradually increases in the third trimester. Maternal iodine supplementation is essential for the developing fetus in the whole course of gestation. If the mother suffers from thyroid disease or iodine deficiency, the child´s neurocognitive functions are more affected despite being treated for congenital hypothyroidism in time.
Key words:
newborn, thyroid hormones, congenital hypothyroidism, dysgenesis, dyshormonogenesis, genes, iodine deficiency
Autoři: K. Krylová 1; D. Neumann 1; E. Al Taji 2; Z. Límanová 3; P. Dejmek 2; J. Horáček 4
Působiště autorů: Dětská klinika LF UK a Fakultní nemocnice, Hradec Králové přednosta prof. MUDr. M. Bayer, CSc. 1; Klinika dětí dorostu UK 3. LF a Fakultní nemocnice Královské Vinohrady, Praha přednosta doc. MUDr. F. Votava, CSc. 2; III. interní klinika UK 1. LF a Všeobecné fakultní nemocnice, Praha přednosta prof. MUDr. Š. Svačina, DrSc. 3; IV. interní klinika LF UK a Fakultní nemocnice, Hradec Králové přednosta doc. MUDr. P. Žák, Ph. D. 4
Vyšlo v časopise: Čes-slov Pediat 2013; 68 (4): 260-265.
Kategorie: Přehledový článek
Souhrn
Článek dává do vztahu fyziologii anatomického a funkčního vývoje štítné žlázy s příjmem jodu těhotnou a vlivem mateřských tyreopatií. Do 14.–16. týdne těhotenství je plod plně závislý na hormonech štítné žlázy matky. Ve 2. a 3. trimestru postupně stoupá tvorba vlastních hormonů štítné žlázy plodu. Zásobení matky jodem je pro plod nezbytné v průběhu celého těhotenství. Tyreopatie matky a její jodový deficit, pokud je v těhotenství měla, zhoršují neurologický vývoj dítěte v případě, že se narodí s kongenitální hypotyreózou.
Klíčová slova:
novorozenec, hormony štítné žlázy, kongenitální hypotyreóza, dysgeneze, dyshormonogeneze, geny, jodový deficitÚVOD
Vývoj štítné žlázy u plodu a její funkci u plodu a novorozence ovlivňují mimo jiné patologické stavy matky, zvlášť zásobení jodem, a mateřské tyreopatie. Časné zjištění poruch mohou umožnit screeningové programy s včasnou intervencí zaměřené na těhotné ženy.
Prenatálně a až do 2 let věku hormony štítné žlázy tyroxin (T4) a trijodtyronin (T3) působí při vývoji nervového systému na diferenciaci a migraci neuronů a glie a na myelinizaci CNS. Jejich deficit ve „vývojových oknech“ [1, 2] poškozuje jednotlivé části mozku s následnými specifickými neurologickými projevy. Prenatálně a postnatálně T4 a T3 ovlivňují růst a diferenciaci tkání, energetickou homeostázu organismu a metabolismus účinkem na transkripci genů. Syntézu a uvolňování hormonů štítné žlázy matky v těhotenství stimuluje současně s TSH i lidský choriový gonadotropin (hCG) [3, 4], takže těhotenské TSH je nižší ve srovnání s negravidními ženami. Ve 2. a 3. trimestru těhotenství je tvorba vlastních hormonů štítné žlázy plodu řízena zpětnovazebně osou hypotalamus - hypofýza - štítná žláza plodu. Hypotalamický tripeptid tyreoliberin (TRH) stimuluje tyreo-stimulační hormon (TSH) adenohypofýzy. TSH se váže na receptory (TSH-R) folikulárních buněk štítné žlázy. Aktivovaný receptor cestou G-proteinu stimuluje vychytávání jodu z krve, jeho oxidaci působením tyreoidální peroxidázy (TPO) a organifikaci do mono - a dijodtyroninů na specifickém zásobním jodoproteinu štítné žlázy tyreoglobulinu (Tg). Mono - a dijodtyroniny jsou spojovány do T3 a T4. Z koloidu folikulů štítné žlázy se po stimulaci TSH uvolňují do oběhu (obr. 1).
Obr. 1. Schéma tyreoidální hormonogeneze. 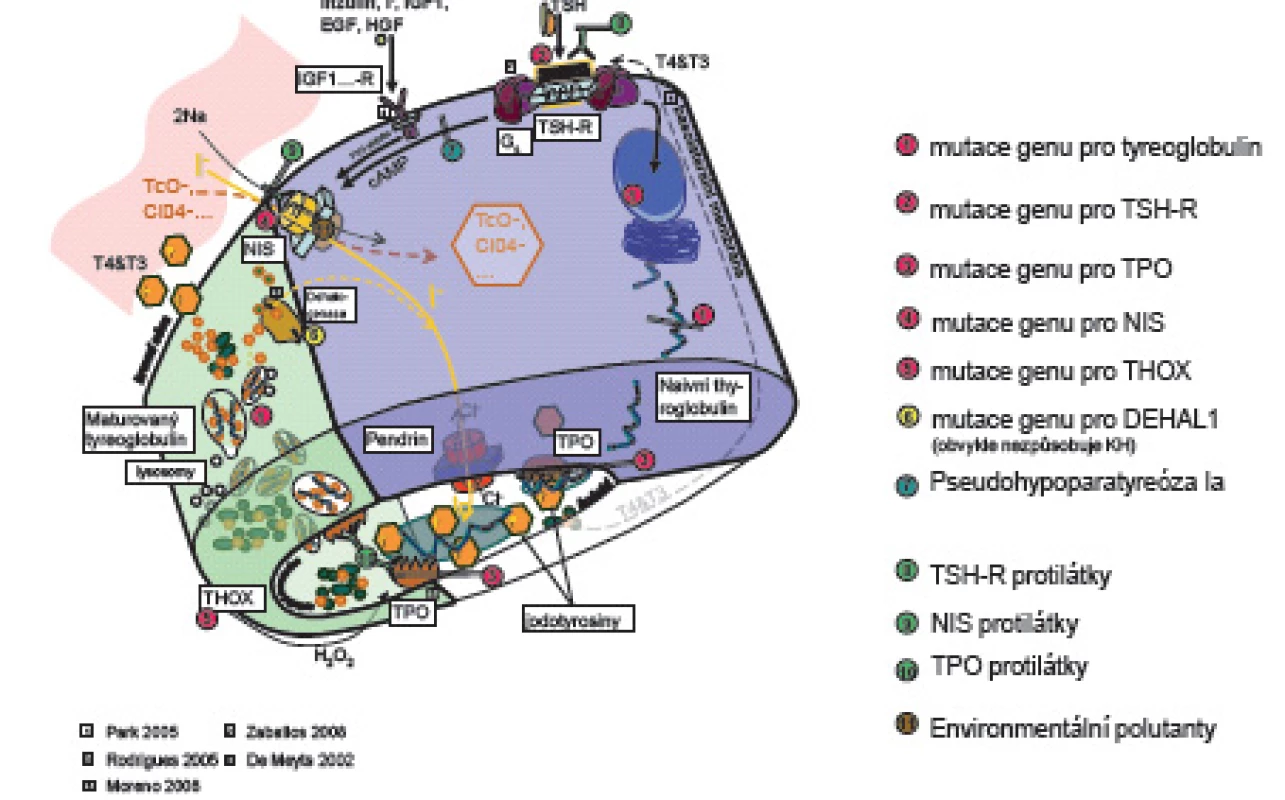
V něm jsou z 99,7 % vázané na tyroxin vážící globulin (TBG – 70 %), transtyretin a albumin. Zbytek (0,03 %) jsou volné, pro tkáně dostupné a účinné hormony (free – fT3, fT4). Volná frakce hormonů negativní zpětnou vazbou působí na hypotalamus a hypofýzu [5]. Tkáňový účinek tyreoidálních hormonů je kontrolován dejodázami DI – DIII. Dejodázy DI a DII mění tyroxin na vlastní receptorový ligand T3, DI převážně v játrech, ledvinách a štítné žláze, DII v CNS, hypofýze a hnědém tuku. DIII mění tyroxin na neúčinný reverzní rT3 a inaktivuje T3. Je přítomna zvláště v CNS, kůži a střevu. Trijodtyronin po vstupu do buněk tkání aktivuje jaderné receptory TR alfa a TR beta. Působením na regulační části cílových genů DNA ovlivňuje transkripci, která je ale ještě dále modifikována působením dalších koaktivátorů a korepresorů [4].
VLIV JODOVÉHO STAVU A TYREOPATIÍ TĚHOTNÝCH NA VÝVOJ PLODU A FUNKCI JEHO ŠTÍTNÉ ŽLÁZY
Jodový stav populace a jednotlivce
Denní potřeba jodu u zdravých netěhotných žen činí přibližně 100 mcg. V těhotenství se zvyšuje o 50 %, aby pokryla požadavky mateřského organismu i plodu. Mateřské mléko obsahuje přibližně 150 mcg/l; nárůst potřeby jodu je v laktaci asi o 115 mcg/den. Více než 90 % požitého jodu se rychle absorbuje v horní části tenkého střeva. Jeho vstřebání může být ovlivněno přítomností strumigenů a mikronutrienty (selen, železo) [6]. Patnáct procent vstřebaného jodu je do 24 hodin uloženo ve štítné žláze, zbytek je vyloučen močí. Zásobení populace jodem lze posoudit měřením jodurie, hladiny TSH a tyreoglobulinu, nebo vyšetřením objemu štítné žlázy. Metoda určující zásobení jodem musí být specifikovaná, záměna výsledků jednotlivých metod a generalizovaná informace vede k nesprávným závěrům [7]. Nejčastěji se jodový stav stanovuje jodurií, pro těhotné je referenční množství (epidemiologická norma) 150–249 mcg/l při 24hodinovém sběru moči. Epidemiologická norma znamená, že při posuzování individuálního případu nelze nízké hodnoty jodurie považovat za obecný deficit [8]. Vyšetření jodurie z jednorázového vzorku je zatíženo diurnálními změnami (až trojnásobné rozdíly hodnot) a rozdíly mezi jednotlivými dny [9]. ICCIDD (International Council for the Control of Iodine Deficiency Disorders) proto k vyloučení diurnální variability doporučuje vždy vyšetření vzorku ranní moči, aby metodika epidemiologických šetření byla standardizována.
Pokud má matka jodový deficit, je plod v každé z fází svého vývoje citlivější k působení dalších faktorů ovlivňujících funkci a vývoj štítné žlázy a jeho neurologický vývoj [10, 11]. Jodový deficit zároveň posunuje hladiny TSH novorozenců směrem k horní hranici normy. Rozlišujeme populaci bez jodového deficitu, populaci s mírným až středním deficitem (epidemiologická norma jodurie 50–149 mcg/l) a populaci s těžkým jodovým deficitem (jodurie <50 mcg/l). V populaci s mírným až středním deficitem jodu je vyšší výskyt novorozenců s kongenitální hypotyreózou [12]. Těžký jodový deficit matky je příčinou nedostatečného přívodu a vytvoření zásob jodu plodu. Nejzávažnějším neurologickým a vývojovým projevem je kretenismus, s formou neurologickou (závažná mentální retardace, strabismus, hluchoněmost, spasticita), myxedematózní formou (méně závažná mentální retardace spolu s klinickým obrazem závažné vrozené hypotyreózy – porucha růstu, otoky, porucha vývoje obličejového skeletu, myxedematózní prosáknutí pokožky) a formou smíšenou [13].
WHO/ICCIDD doporučuje denní příjem jodu 150 mcg pro netěhotné a 250 mcg pro těhotné a kojící ženy [8]. Jedná se o odhad dolní hranice nutričního přívodu jodu, který zabezpečí dostatečné množství jodu pro těhotnou i plod a matku s kojeným novorozencem. Tato doporučení reflektuje i ČR (SZÚ). Těhotné a kojící ženy jsou však považovány za rizikovou skupinu, i když je ČR řazena mezi země s dostatečným zásobením jodem. Je jasné, že jodace soli není dostatečná k pokrytí potřeb v těhotenství. Na nižší dodávce jodu v těhotenství se dále podílí doporučení omezit solení, existence nejodidovaných solí, specifické dietní zvyky (vegetariánství) a nedůsledná preskripce jodidu těhotným zvláště v posledním trimestru těhotenství, kdy jsou omezovány multivitaminy ve snaze zabránit hypertrofii plodu. Navíc existují i multivitaminové přípravky pro těhotné bez jodidu nebo s jeho omezeným množstvím. Situaci potvrzují i studie v dalších zemích bez jodového deficitu. Část těhotných žen má jodový deficit v Austrálii [14], na Slovensku [15] nebo v Nizozemí [16]. Při substituci těhotných jodem je kladen důraz na časný začátek před 10. týdnem těhotenství [17]. Zajištění potřebného příjmu jodu je součástí péče o těhotné a je plně v kompetenci gynekologů; k informovanosti žen mohou přispět i praktičtí lékaři. Pediatři, neonatologové a endokrinologové péči podporují a urgují, v zásadě však v praxi nemají možnost zásobení těhotných jodem ovlivnit.
Tyreopatie těhotných
Změny funkce štítné žlázy jsou nejčastější endokrinopatií těhotných žen. Těhotenská tyreotoxikóza je vzácná (v ČR podle dat Límanové z r. 2011 <0,5 % těhotných) [18], ale pro plod závažná. Snížená funkce štítné žlázy (subklinická a manifestní hypotyreóza) je v ČR diagnostikována podle recentních údajů až u 7–8 % těhotných [18]. Hladiny TSH gravidních jsou významně nižší než mimo těhotenství (posun doleva vlivem hCG) a za fyziologické hodnoty podle ATA (American Thyroid Association) jsou považovány hodnoty 0,1–2,5 mIU/l v prvním trimestru, 0,2–3,0 mIU/l ve druhém a 0,3–3,0 mIU/l ve třetím trimestru. Snížení TSH pod 0,1 mIU/l je nutné posuzovat opatrně s ohledem na vliv hCG a možnost hypertyreózy.
Pro ČR připravila ČES ČLS JEP ve spolupráci s SKLB ČLS JEP „Doporučení pro diagnostiku a léčbu onemocnění štítné žlázy v těhotenství a pro ženy s poruchou fertility“ [29], která respektují evropské a české zvyklosti přístupu ke gravidním ženám a upravují doporučenou referenční normu pro TSH v I. trimestru těhotenství v ČR na 0,06–3,67 mIU/l [19].
Hypofunkce štítné žlázy matky má vliv na těhotenství (zvýšená mateřská morbidita, hypertenze, sterilita, zamlklá těhotenství, spontánní potraty, abrupce placenty, předčasný porod) a na plod a dítě (intrauterinní růstová restrikce, poruchy neurologického vývoje) [20, 21, 22]. Záleží však na stanovených kritériích považovaných za hypofunkci (TSH >97,5. percentil vs. fT4 <2,5. percentil; délka gestace při vyšetření: 9.–11. týden vs. 13.–15. týden těhotenství). O dopadu hraničních hodnot TSH gravidních žen na neurologický vývoj plodu [23] se vedou diskuse a problematika není zdaleka uzavřena. Izolovaná hypotyroxinemie těhotných je relativně častá, zvláště ve 2. po-lovině těhotenství. Výskyt protilátek proti tyreoidální peroxidáze (anti-TPO) ovlivňuje početí a průběh těhotenství, spontánní potraty jsou dvakrát častější [17]. Pětkrát se zvyšuje riziko přechodu do tyreoidální hypofunkce ženy v době těhotenství a kojení [24].
Mezinárodní [17, 24] a národní doporučení [18, 25, 26] se shodují ve vhodnosti screeningu subklinické hypotyreózy těhotných žen, a to vyšetřením TSH, anti-TPO a ev. fT4. O tom, zda screening má být cílený jen na ženy s rizikovými faktory nebo celoplošný, se stále diskutuje. Prvořadá je informovanost těhotných žen. Obecně by nejen těhotné ženy s rizikovými faktory měly mít o vyšetření funkce štítné žlázy aktivní zájem.
Podle platného postupu ATA [17] a ČES ČLS JEP je včasná léčba L-tyroxinem indikována u manifestní hypotyreózy (TSH >2,5 mIU/l při fT4 pod referenční mezí; nebo TSH >10 mIU/l). Při hypotyreóze léčené již před těhotenstvím se dávkování L-tyroxinu obvykle zvyšuje o 25–80 % s velkou interindividuální variabilitou. Pro léčbu subklinické hypotyreózy (TSH v těhotenství >2,5 mIU/l při referenční hodnotě fT4) nejsou dostatečné EBM důkazy, ale spíše by měla být léčena (podle ATA)/jistě by měla být léčena (podle ČES ČLS JEP). Pozitivita protilátek proti TPO je indikací k pravidelnému sledování funkce štítné žlázy v těhotenství, ale v případě současné subklinické hypotyreózy je důvodem k léčbě. Izolovaná hypotyroxinemie (fT4 <5. percentil při normálním TSH) není indikací k léčbě L-tyroxinem, ale je nutný zvýšený příjem jodu u těhotné. Autoimunitní tyreoiditida těhotné s eufunkcí nebo hypofunkcí může rovněž vést přenosem mateřských protilátek ke vzniku tranzientní hypertyreotropinemie u novorozence (protilátky proti TPO, TSH-receptoru) [27]. Klinicky skutečnou pozitivitu screeningu kongenitální hypotyreózy způsobuje zřídka (<2 %) [28].
ZÁVĚR
Hormony štítné žlázy jsou nezbytné pro normální vývoj plodu a novorozence. Nedostatek jodu a poruchy štítné žlázy matky plod nepříznivě ovlivňují. Dostatečný přívod jodu po celou dobu gravidity předchází možným komplikacím jak u matky, tak u vyvíjejícího se plodu. Doporučený příjem jodu v těhotenství a laktaci je 250 mcg na den. Sledování funkce štítné žlázy v těhotenství je indikované zejména u žen s přítomností rizikových faktorů. Plošný screening těhotných je dosud výjimkou (např. Slovensko), ČES ČLS JEP ho v této formě prosazuje i pro ČR.
V případě prokázané hypotyreózy matky je doporučena včasná léčba L-tyroxinem. U těhotných s pozitivními protilátkami proti TPO a současně zjištěnou subklinickou hypotyreózou by měla být rovněž zahájena léčba. Izolovaná hypotyroxinemie není indikací k léčbě L-tyroxinem, ale je nutný zvýšený příjem jodu těhotnou. V případě autoimunitní tyreoiditidy u těhotné s eufunkcí nebo hypofunkcí může přenosem protilátek dojít ke vzniku tranzientní hypertyreotropinemie u novorozence. Stav obvykle nevede k pozitivitě screeningu na kongenitální hypotyreózu.
Použité zkratky:
DI-DIII – tkáňové dejodázy, g.t. – gestační týden, hCG – lidský choriový gonadotropin, KH – kongenitální hypotyreóza, rT3 – reverzní trijodtyronin, T3 – trijodtyronin, T4 – tyroxin, TBG – tyroxin vážící globulin, Tg – tyreoglobulin, THOX – tyreoidální oxidáza, TPO – tyreoidální peroxidáza, TR – jaderný receptor pro tyreoidální hormony, TRH – tyreoliberin, TSH – tyreostimulační hormon, TSH-R – receptor pro tyreostimulační hormon
Autoři jsou vděčni panu profesoru MUDr. Václavu Zamrazilovi, DrSc., za revizi textu a cenné poznámky.
Podpořeno MZ ČR – RVO (FNHK, 00179906).
Došlo: 2. 12. 2012
Přijato: 1. 5. 2013
MUDr. Kateřina Krylová
Dětská klinika FN
Sokolská tř. 581
500 05 Hradec Králové
Zdroje
1. Chan S, Kilby MD. Thyroid hormone and central nervous system development. J Endocrinol 2000; 16 : 1–8.
2. Zoeller RT, Rovet J. Timing of thyroid hormone action in the developing brain: clinical observations and experimental findings. J Neuroendocrinol 2004; 16 : 809–818.
3. Ogilvy-Stuart A, Midgley P. Practical Neonatal Endocrinology. Cambridge University Press, 2006 : 1–218. ISBN 978-0-521-83849-8.
4. Raine JE, Donaldson MDC, Gregory JW, et al. Practical Endocrinology and Diabetes in Children. John Wiley & Sons, 2006 : 1–256. ISBN 13 : 978-1-4051-2233-7. ISBN 10 : 1-4051-2233-1.
5. Bursell JDH, Warner JT. Interpretation of thyroid function in chidren. Ped Child Health 2007; 17 : 361–366.
6. Ristic-Medic D, Piskackova Z, Hooper L, et al. Methods of assessment of iodine status in humans: a systemic review. Am J Clin Nutr 2009; S9 : 2052S–2069S.
7. Laurberg P, Andersen S, Bjarnadottir RI, et al. Evaluating iodine deficiency in pregnant women and young infants – complex physiology with a risk of misinterpretation. Public Health Nutr 2007;10 (12A): 1547–1552.
8. Zimmermann MB. The impact of iodised salt or iodine supplementation on iodine status during pregnancy, lactation and infancy. Public Health Nutr 2007; 10 : 1584–1595.
9. Rasmussen LB, Ovesen L, Christiansen E. Day-to-day and within-day variation in urinary iodine excretion. Eur J Clin Nutr 1999; 53 : 401–407.
10. Alvarez-Pedrerol A, Guxens M, Mendez M, et al. Iodine levels and thyroid hormones in healthy pregnant women and birth weight of their offsprings. Eur J Endocrinol 2009; 160 : 423–429.
11. Zimmermann MB. Iodine deficiency in pregnancy and the effect of maternal iodine supplementation on the offspring: a review. Am J Clin Nutr 2009; 89 : 668S–672S.
12. Sullivan KM. Increase in congenital hypothyroidism due to inadequate iodine nutrition? Mol Genet Metab 2008; 93 : 485.
13. Zimmermann MB. The effects of iodine deficiency in pregnancy and infancy. Paediatric Perinatal Epidemiology 2012; 26 (Suppl 1): 108–117.
14. Travers CA, Guttikonda K, Norton CA, et al. Iodine status in pregnant women and their newborns: are our babies at risk of iodine deficiency? MJA 2006; 184 : 617–620.
15. Dluholucký S, Knapková M, Cibirová M, Hrubá F. Hodnotenie zvýšených hladín neonatálneho skríningového TSH na Slovensku. Čes-slov Pediat 2006; 9 : 524–529.
16. Hoogendoorn EH, Hermus AR, De Vegt F, et al. Thyroid function and prevalence of anti-thyroperoxidase antibodies in a population with borderline sufficient iodine intake: influences of age and sex. Clin Chem 2006; 52 : 104–111.
17. Stagnaro-Green A, Abalovich M, Alexander E, et al. Guidelines of the American thyroid association for the diagnosis and management of thyroid disease during pregnancy and postpartum. Thyroid 2011; 21 : 1–45.
18. Límanová Z, Springer D. Současné zkušenosti s vyšetřováním tyreopatií v graviditě – výsledky pilotního projektu. Čas Lék čes 2011; 150 : 389–393.
19. Springer D, Zima T, Limanova Z. Reference intervals in evaluation of maternal thyroid function during the first trimestr of pregnancy. Eur J Endocrinol 2009; 160 : 791–797.
20. Herbstmann J, Apelberg BJ, Witter FR, et al. Maternal, infant and delivery factors associated with neonatal thyroid hormone status. Thyroid 2008; 18 : 67–76.
21. LaFranchi S. Thyroid hormone in hypopituitarism, Grave´s disease, congenital hypothyroidism and maternal thyroid disease during pregnancy. Growth Horm IGF Res 2006; 16: S20–S24.
22. Vargová V, Mechírová V, Pytliak M, Tajtáková M. Ochorenia štítnej žľazy matky a vrodené vývojové chyby plodu. Čes Gynek 2008; 73 : 35–40.
23. Lazarus JH, Bestwick JP, Channon S, et al. Antenatal thyroid screening and childhood cognitive function. N Engl J Med 2012; 366 : 493–501.
24. Moleti M, Lo Presti VP, Mattina F, et al. Gestational thyroid function abnormalities in conditions of mild iodine deficiency: early screening versus continuous monitoring of maternal thyroid status. Eur J Endocrinol 2009; 160 : 611–617.
25. Kořenek A. Screening poruch štítné žlázy v graviditě a po porodu. Prakt Gyn 2009; 3 : 137–141.
26. Límanová Z, Laňková J, Zamrazil V. Funkční poruchy štítné žlázy. Praha: Společnost všeobecného lékařství ČLS JEP, 2008 : 1–16. ISBN 978-80-86998-24-4.
27. Parks JS, Lin M, Grosse SD, et al. The impact of transient hypothyroidism on the increasing rate of congenital hypothyroidism in the United States. Pediatrics 2010; 125: S54–S63.
28. Brown RS, Bellisario RL, Botero D, et al. Incidence of transient congenital hypothyroidism due to maternal thyrotropin receptor-blocking antibodies in overone million babies. J Clin Endocrinol Metab 1996; 81 : 1147–1151.
29. Horáček J, Jiskra J, Límanová Z, et al. Doporučení pro diagnostiku a léčbu onemocnění štítné žlázy v těhotenství a pro ženy s poruchou fertility. Diab Metab Endokrinol Výž 2013; 1 : 38–61.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2013 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Fexofenadin – nesedativní a imunomodulační antihistaminikum v léčbě alergických projevů
-
Všechny články tohoto čísla
- Prevalencia nadhmotnosti a obezity u študentov bratislavských stredných škôl – predbežné výsledky štúdie „Rešpekt pre zdravie“
- Kineticky řízená léčba gentamicinem u kriticky nemocných septických nedonošených novorozenců v prvním týdnu života – otevřená prospektivní studie (část I)
- XV. Hradecké pediatrické dny 2013
- Analgetický potenciál různých typů cukerných roztoků v prevenci procedurální bolesti u zralých novorozenců
- Snídaně jako determinanta hmotnosti u dětí ve věku 9–10 let
- Možnosti ovplyvnenia recidivujúcich infekcií dýchacích ciest prírodnou imunomodulačnou liečbou
- Vliv jodového stavu a mateřských tyreopatií na vývoj štítné žlázy a jeho poruchy u plodu a novorozence
- Diagnostika a intervence u zdravých dětí, jejichž sourozenec je vážně nemocný
- Hazard a obec
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Možnosti ovplyvnenia recidivujúcich infekcií dýchacích ciest prírodnou imunomodulačnou liečbou
- Diagnostika a intervence u zdravých dětí, jejichž sourozenec je vážně nemocný
- Analgetický potenciál různých typů cukerných roztoků v prevenci procedurální bolesti u zralých novorozenců
- Snídaně jako determinanta hmotnosti u dětí ve věku 9–10 let
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



