-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Metotrexát u dětí s juvenilní idiopatickou artritidou
Methotrexate in Children with Juvenile Idiopathic Arthritis
Despite the significant development of biologics, methotrexate (MTX) remains the most commonly used disease-modifying antirheumatic drug in children with juvenile idiopathic arthritis (JIA). There is considerable variability among clinicians in the use of methotrexate. Unique guidelines based on clinical trials would contribute to optimization of MTX use. Revision of scientific literature has shown lack of randomised controlled trials concerning this topic.
Our proposed therapeutic algorithm is based on analysis of accessible data on both paediatric and adult rheumatology patients and unclear points are solved with regard to experts´ opinion. Its final version will be revised by an international expert group and will be a subject to regular updates.Key words:
methotrexate, juvenile idiopathic arthritis, guidelines
Autoři: J. Tuková; D. Němcová; J. Hoza; P. Doležalová
Působiště autorů: Klinika dětského a dorostového lékařství UK 1. LF a VFN, Praha přednosta prof. MUDr. J. Zeman, DrSc.
Vyšlo v časopise: Čes-slov Pediat 2010; 65 (6): 394-400.
Kategorie: Přehledový článek
Souhrn
I přes významné pokroky ve vývoji biologické terapie zůstává metotrexát (MTX) lékem první volby u dětí s juvenilní idiopatickou artritidou (JIA) s nedostatečnou odpovědí na nesteroidní antiflogistika a/či intraartikulární kortikoidy. Vedení terapie metotrexátem se v praxi mezi jednotlivými specialisty a pracovišti liší a ani publikovaná doporučení nejsou ve shodě. Jednotná doporučení vycházející ze závěrů klinických studií by přispěla k optimalizaci vedení léčby metotrexátem. Revize vědecké literatury odhalila nedostatek randomizovaných kontrolovaných studií v této oblasti.
Prezentovaný léčebný algoritmus je založen na analýze dostupných informací z oblasti dětské i dospělé revmatologie a ve sporných bodech je doplněn názory odborníků. Jeho finální podoba bude výstupem revize skupinou evropských expertů a nepochybně bude v budoucnu pravidelně aktualizovaná.Klíčová slova:
metotrexát, juvenilní idiopatická artritida, klinická doporučeníÚvod
Juvenilní idiopatická artritida (JIA) patří k nejčastějším revmatickým onemocněním u dětí s roční incidencí 0,8 až 22,6 na 100 000 dětí a prevalencí 0,7 až 40,1 na 10 000 dětí [1]. I přes intenzivní rozvoj biologické terapie zůstává metotrexát (MTX) lékem volby u dětí s JIA, které neodpověděly dostatečně na terapii nesteroidními antiflogistiky a/nebo intraartikulárními kortikoidy. Jeho předností je dobrá účinnost spolu s relativně nízkou toxicitou i cenou.
I přes celoplošné rozšíření tohoto léku se vedení terapie v klinické praxi liší. Ani publikovaná doporučení pracovních skupin a expertů v různých státech nejsou ve shodě.
Cílem této práce bylo vyhledat publikované klinické studie k jednotlivým krokům zahájení a vedení terapie metotrexátem u dětí s JIA a na základě jejich analýzy navrhnout léčebný algoritmus, který by mohl pomoci sjednotit používání MTX v klinické praxi u dětí s JIA.
Provedli jsme rozsáhlou rešerši české i zahraniční vědecké literatury. Procházeli jsme standardní učebnice, elektronické databáze (PubMed, MEDLINE, EMBASE, Cochrane Library), kde jsme vyhledávali klinické studie po zadání klíčových slov (“methotrexate”, “juvenile” a “arthritis”). Dále jsme použili ruční vyhledávání prací v citacích uváděných v zobrazených článcích. Doporučením vysloveným na základě nalezených klinických studií a závěrů expertních komisí jsme přiřadili váhu (kategorii) důkazu podle návrhu vypracovaného komisí EULAR (European League Against Rheumatism) [2], viz tabulka1.
Indikace terapie metotrexátem u dětí s juvenilní idiopatickou artritidou
Účinnost a nízká toxicita MTX u dětí s JIA byla prokázána randomizovanými kontrolovanými studiemi [3–5] (kategorie důkazu 1B). Podávání MTX omezilo u dětí výskyt kloubních erozí [6–8] (kategorie důkazu 3). Indikace MTX se u jednotlivých podtypů JIA liší. Zatímco je MTX jednoznačně účinný a doporučovaný při výskytu polyartritidy [3, 5, 7, 9–11] (kategorie důkazu 1B), někteří autoři jeho efekt u systémové formy JIA zpochybňují [4, 12, 13]. Ukazuje se, že MTX má pravděpodobně u systémové formy terapeutický efekt, ovšem pravděpodobně nižší ve srovnání s ostatními podtypy [14] (kategorie důkazu 3).
Metotrexát je obecně považován za lék volby pro pacienty s JIA, kteří nedostatečně odpověděli na terapii nesteroidními antiflogistiky (NSA) a/či nitrokloubní podání kortikoidů [15, 16]. Za nedostatečnou odpověď se běžně považuje podávání NSA po dobu 6–8 týdnů, které nevede ke klinickému zlepšení [12, 17, 18] (kategorie důkazu 4). MTX je rovněž indikován v případě, že po dvou aplikacích nitrokloubních kortikoidů u pacientů s oligoartikulárním postižením klinické zlepšení trvá méně než 4 týdny [19] (kategorie důkazu 3).
Vyšetření před zahájením léčby metotrexátem
Laboratorní vyšetření prováděné před zahájením terapie MTX má vyloučit poruchu funkce orgánů (např. ledvin, jater, krvetvorby) a tím zabránit nárůstu toxicity MTX. Běžně se vyšetřuje plný krevní obraz, ledvinné funkce, jaterní enzymy, močový sediment a moč chemicky, anamnestické protilátky proti varicella-zoster viru (VZV) [17, 20, 21].
Někteří specialisté zjišťují také koncentraci laktát dehydrogenózy (LD), bilirubinu a celkové bílkoviny [17]. Jiní doporučují vyšetření protilátek proti infekčním hepatitidám, aby se včas ozřejmila případná akutní či chronická jaterní infekce a předešlo se závažnému jaternímu postižení [17, 18, 22]. Vzácně se doporučuje vyšetření tuberkulinového testu, to je nutné před zahájením biologické léčby [17] (kategorie důkazu 4). Rentgen plic se obvykle provádí v rámci komplexního vyšetření před stanovením diagnózy JIA. Funkční vyšetření plic se neprovádí, pokud děti neprodělaly závažnější plicní onemocnění a nemají příznaky tohoto postižení, jako např. dlouhodobý kašel či dechové obtíže.
Doba zahájení metotrexátu, dávka a cesta podání
Několik studií u dětí s JIA upozornilo na možnou souvislost krátkého intervalu od stanovení diagnózy do zahájení terapie MTX a vyšší pravděpodobnosti terapeutické odpovědi [7, 11, 23] (kategorie důkazu 3). Optimální terapeutické okno pro léčbu MTX u dětí s JIA však není známo. Kratší doba trvání choroby do nasazení léku (<2 roky) a nepřítomnost rentgenových změn pozitivně korelovaly s vyšším účinkem terapie ve studii vedené Ravellim [23] (kategorie důkazu 3). V jiné velké kohortové studii měli pacienti léčení MTX do 1 roku od počátku choroby větší pravděpodobnost remise než pacienti s pozdějším zahájením léčby [24] (kategorie důkazu 3). V další práci Albers rozdělil po 6 měsících od zahájení terapie pacienty na skupinu dětí s dobrou odpovědí na terapii a s nedostatečnou odpovědí a zjistil u dobře odpovídajících dětí kratší interval mezi začátkem choroby a zahájením léčby (respondéři vs. nonrespondéři, 9,5 měsíce vs. 16,3 měsíce) (kategorie důkazu 3) [25].
Podle studií u dospělých s revmatoidní artritidou (RA) by měl být ale interval mezi začátkem choroby a nasazením léku ještě mnohem kratší. V nedávno publikované studii Nella je popsána existence terapeutického okna během prvních několika měsíců, nejlépe během prvních tří měsíců od začátku příznaků (!) (kategorie důkazu 2B) [26].
U dětí s JIA má být MTX podáván jednou týdně v tabletách či podkožní injekcí. Doporučovaná účinná dávka u dětí je obecně vyšší než u dospělých. Pohybuje se mezi 10 a 15 mg/m2 týdně (0,3–0,6 mg/kg/týden) [3, 11] (kategorie důkazu 1B), přednost má výpočet dávky vztažené na m2 povrchu těla.
Počáteční dávka je obvykle 10 mg/m2 per os [9, 16, 27, 28]. Někteří specialisté doporučují začít s parenterální formou aplikace u dětí s předchozí zhoršenou spoluprací, u dětí s nedostatečnou odpovědí na orální lékovou formu [28] a u kojenců a batolat [29]. Wallace ve své práci navrhla upřednostnit parenterální lékovou formu do dosažení kompletní inaktivity onemocnění s možností pozdějšího přechodu na orální lékovou formu pro udržení terapeutického efektu [30]. Dosud není rozšířena léková forma pro batolata (sirup), britská revmatologická společnost (BSPAR) doporučuje použití magistraliter připraveného orálního roztoku u těchto dětí [20]. Účinek MTX je úměrný dávce léku [3, 31] (kategorie důkazu 1B, 3). Dávka může být postupně zvyšována podle klinického účinku a případných známek toxicity. Jako maximální doporučovaná dávka se uvádí 15–25 mg/m2 týdně. Další zvyšování dávky nad tuto hodnotu u většiny pacientů nevede k významnému klinickému zlepšení [5] (kategorie důkazu 1B).
Při podávání dávek vyšších než 10 mg/m2 týdně by měla být orální léková forma zaměněna za parenterální formu podávání. Biologická dostupnost orálně podané dávky MTX vyšší než 10 mg/m2 jednoznačně klesá ve srovnání s parenterálním podáním [32] (kategorie důkazu 3). Přechod na parenterální podávání může být výhodný i v případě nedostatečné terapeutické odpovědi či při výskytu zažívacích potíží, zejména nauzey [9].
Randomizované studie dokládají vyšší sérové hladiny léku po podání nalačno [33] (kategorie důkazu 1B). Většina specialistů dává přednost podávání tablet nalačno [12, 22, 30], někteří vliv stravy na účinek terapie nepřipouštějí [17, 18].
Naše doporučení:
Ve shodě s publikovanými studiemi doporučujeme zahájit terapii dávkou 10 mg/m2 týdně. Obecně je možno začít s orální lékovou formou podanou nalačno. Terapeutický účinek lze hodnotit nejdříve po cca 8 týdnech, při nedostatečné odpovědi dávku zvyšujeme. Při dávce nad 10 mg/m2 a nedostatečném efektu léčby je vhodné přejít na subkutánní aplikaci léku. Výjimkou jsou malé děti (do 5 let), u kterých většinou hned zahajujeme terapii parenterální cestou, a dále pacienti s počáteční vysoce aktivní chorobou (polyartritida, vysoká zánětlivá aktivita), kde zahajujeme intenzivní terapii již na začátku (15 mg/m2 subkutánně) a při dobré klinické odpovědi ev. dávku postupně snižujeme.
Obecně se snažíme o maximální zkrácení intervalu mezi začátkem choroby a zahájením terapie a o rychlé dosažení účinné hladiny MTX u dětí, zvláště u dětí s vysoce aktivní chorobou.
Hodnocení aktivity choroby, trvání terapie, ukončení léčby
Dosud není známo, kdy je vhodné u pacientů s plnou terapeutickou odpovědí léčbu ukončit. Přibližně u poloviny pacientů dochází k relapsu po 2,5 až 13 měsících od vysazení MTX (kategorie důkazu 3) [10]. V jiné studii se ukázalo riziko relapsu shodné u dětí, kde byl MTX vysazen 3,8 měsíců oproti 12,7 měsícům po navození klinické remise [34] (kategorie důkazu 3). Přestože je hlavním cílem terapie dosáhnout trvalého potlačení choroby, u většiny dětí se zatím nedaří lékem ani kombinací léků dosáhnout trvalé remise a onemocnění má u nich chronický relabující průběh [35] (definice inaktivity viz tab. 2). Dosažení inaktivního onemocnění alespoň jednou během prvních 5 let je spojeno s příznivějším průběhem choroby (menší kloubní poškození, lepší funkční stav) (kategorie důkazu 3) [36].
Tab. 2. Kritéria hodnocení aktivity onemocnění JIA [35]. ![Kritéria hodnocení aktivity onemocnění JIA [35].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/0d92a50c3b3c892c856453f76306ff47.jpg)
FW = rychlost sedimentace erytrocytů, CRP = C-reaktivní protein Panuje obecná shoda, že je vhodné pokračovat v terapii MTX i přes navození klinické remise, ale dávka ani délka tohoto podávání není určena (kategorie důkazu 3). Děti trpící oligoartritidou mají větší pravděpodobnost dosáhnout příznivé terapeutické odpovědi na MTX, ale zdá se, že po vysazení u nich častěji choroba relabuje (kategorie důkazu 3) [11]. V současných doporučeních specialisté upřednostňují podávání stabilní dávky MTX ještě nejméně jeden rok po dosažení inaktivity choroby [28–30]. Při relapsu onemocnění po vysazení terapie vede znovunasazení léku k velmi dobré klinické odpovědi (kategorie důkazu 3) [10], z toho důvodu není podávání léku déle než rok po dosažení klinické remise odůvodněné.
Nová studie (PRINTO, Pediatric Rheumatology International Trials) by mohla tento problém objasnit, neboť zkoumá, zda doba vysazení léku po dosažení klinické remise (6 vs. 12 měsíců) nějak souvisí s rizikem a průběhem relapsu a dalším klinickým stavem pacientů s JIA.
Nežádoucí účinky a projevy toxicity metotrexátu, jejich monitorace
Děti obecně tolerují MTX lépe než dospělí. Mezi časté nežádoucí účinky patří gastrointestinální obtíže (nauzea, nechutenství, zvracení, stomatitida) a přechodné zvýšení jaterních testů. Doporučení vydaná pro dospělé pacienty nemohou být automaticky převzata, neboť u dospělých se nachází mnohem více možných hepatotoxických vlivů (konzumace alkoholu, hepatitidy atd.) [30].
Během zvyšování dávky by měly být krevní obraz a jaterní testy vyšetřovány každé 4 týdny [17, 28, 29, 37], po dosažení stabilní dávky se udává interval 4–12 týdnů [12, 17, 22, 28, 29, 37]. Také frekvence kontrol renálních funkcí (kreatinin) se značně liší (každé 4 týdny až 6 měsíců). Přechodné zvýšení alaninaminotransferázy (ALT) nacházíme asi u 10 % pacientů. Ravelli doporučuje spolu s transaminázami vyšetřovat i albumin [22]. Přetrvávající dvojnásobné zvýšení horní hranice koncentrace ALT vyžaduje snížení dávky [20] či přerušení terapie a kontrolní vyšetření ALT [21, 29, 37]. Při trojnásobném zvýšení horní hranice normy transamináz by měl být MTX vysazen do normalizace jaterních testů [17, 28]. Jaterní biopsie by měla být zvážena u dětí, které měly více než 40 % vyšetření jaterních testů během roku abnormálních [38] (kategorie důkazu 3), ale tato doporučení jsou zřejmě příliš přísná, neboť závažné histologické postižení jater u dětí na terapii MTX je velmi vzácné [17, 39] (kategorie důkazu 3).
Přechod na parenterální aplikaci léku často snižuje gastrointestinální obtíže [28].
Speciální screening a monitorace plicních známek toxicity nejsou nutné, neboť u dětí s JIA je okultní plicní onemocnění velmi vzácné stejně jako výskyt akutní pneumonitidy navozené MTX [28, 40].
Očkování a infekce
Praxe očkování dětí s revmatickým onemocněním se velmi liší mezi jednotlivými centry a specialisty. Většina specialistů doporučuje nepodávat živé vakcíny dětem s JIA [12, 21], přestože nové retrospektivní studie nezjistily vliv těchto vakcín na aktivitu choroby, výskyt relapsu před a po podání vakcíny proti příušnicím, spalničkám a zarděnkám, ani zjevnou infekci spalničkami [41] (kategorie důkazu 3).
Ukazuje se, že očkování proti pneumokoku, meningokoku C, chřipce a hepatitidě B je bezpečné u dětí s JIA a vede i přes protizánětlivou terapii MTX k adekvátní sérologické odpovědi [42–45] (kategorie důkazu 2A, 3). Ideální je podat vakcínu v době, kdy dítě dostává nejnižší účinnou dávku léku [43] (kategorie důkazu 3). Ramanam ve svých doporučení varuje i před podáváním živé polio vakcíny u ostatních rodinných příslušníků [21]. Vhodné je očkování proti varicelle před zahájením terapie, pokud dítě tuto chorobu neprodělalo [12, 20, 29], v případě propuknutí neštovic během léčby se běžně nasazuje aciclovir [18, 20, 21].
Děti s JIA obvykle dobře snášejí virové i bakteriální infekty během terapie MTX [40] (kategorie důkazu 3). Skupina dětí s JIA na terapii MTX neměla vyšší frekvenci infektů ve srovnání se skupinou dostávající placebo [3] (kategorie důkazu 1B). Někteří autoři občas referují vyšší výskyt pásového oparu s benigním průběhem či opakovaná paronychia [28, 40] (kategorie důkazu 3), podle našich zkušeností bývá častější výskyt kožních virových infektů, např. molusek či bradavic.
Konkomitantní terapie, kombinace léků
Děti užívající MTX velmi často současně užívají i nesteroidní antirevmatika (NSA). Oba léky mají podobné možné nežádoucí účinky (např. nauzea, bolesti břicha, průjem, bolesti hlavy, hepatopatie a postižení krvetvorby) [28]. Tuto kombinaci ale většina dětí snáší velmi dobře a je žádoucí vzhledem k jejich komplementárnímu efektu [17, 20, 21]. Někteří lékaři se obávají lékové interakce a doporučují vynechat NSA v den podávání MTX [28].
Kortikosteroidy se někdy používají u pacientů s vysoce aktivní JIA jako tzv. přemosťující terapie, mají tedy hlavní úlohu do dosažení účinných koncentrací MTX v krvi [17].
Několik menších studií zkoumalo efekt různých kombinací chorobu modifikujích léků (tzv. DMARDs), ale žádná z kombinací neukázala přesvědčivý zisk [17].
Dlouhodobé souběžné podávání co-trimoxazolu s MTX může zvýšit toxicitu léku. Byl popsán případ, kdy tato kombinace vedla k makrocytární anémii, která po vysazení léku vymizela [40].
Toxicitu MTX může prohlubovat co-trimoxazol, ciprofloxacin, tetracyklin, aminoglykosidy, sulfonamidy a salicyláty [20].
Kombinace MTX s léky řazenými do biologické terapie, zvláště s antagonisty tumor nekrotizujícího faktoru alfa (etanercept, adalimumab, infliximab) je účinnou variantou pro léčbu polyartikulárních forem JIA rezistentních na MTX monoterapii (kategorie důkazu 1B) [46,47].
Kyselina listová a leukovorin
Deriváty kyseliny listové jsou nezbytné pro DNA syntézu, pro dva kroky během syntézy purinů a tři kroky během tvorby aminokyselin [48]. Přijaté foláty s MTX přímo soutěží o přechod přes buněčné přenašeče, o polyglutamylaci (folylglutamázou) a o vazbu na enzymy vázající foláty. Foláty přítomné v potravě jsou v redukované formě a mohou přímo vstupovat do metabolických drah [48]. Deficit folátů by mohl vysvětlit některé projevy toxicity během terapie MTX. Studie u dospělých a v menší míře i u dětí prokázaly snížení výskytu nežádoucích účinků MTX (zvlášt slizničních a gastrointestinálních) při podávání suplementace kyselinou listovou bez snížení klinického účinku léku [49–52] (kategorie důkazu 1A, 1B, 2A). Nižší dávky leukovorinu (1–7 mg/týdně) též snížily projevy MTX toxicity, ale vyšší dávky již vedly ke snížení účinnosti léku (kategorie důkazu 1B) [53].
Vzhledem k těmto poznatkům by měla být suplementace kyselinou listovou zvažována u všech pacientů, ale vždy při výskytu nežádoucích účinků [17].
Běžně se v praxi suplementace kyselinou listovou podává, ovšem v různých režimech. Žádný z režimů nebyl u dětí dostatečně zhodnocen, většinou se různé režimy tolerují [21, 37]. V zahraničí je kyselina listová obvykle předepisována v denní dávce 1 mg s vynecháním podání 24 hodin před a po užití MTX. Další alternativou je podání 5 až 10 mg kyseliny listové jednou týdně 24 až 72 hodin po podání MTX, což je pro pacienty pohodlnější. Tento režim je zaveden i v České republice, kde jsou dostupné tablety po 10 mg, u malých dětí se předepisuje 5 mg jednou týdně (polovina tablety).
Závěr
V současnosti nejsou všechny kroky vedení terapie MTX u dětí s JIA dostatečně vědecky podloženy vzhledem k omezenému počtu kontrolovaných studií. V poslední době randomizovaných kontrolovaných studií k tomuto tématu přibývá.
Prezentovaný léčebný algoritmus (tab. 3) je založen na analýze dostupných informací z oblasti dětské i dospělé revmatologie a ve sporných bodech doplněn zkušenostmi odborníků. Nepochybně by měl v budoucnu podléhat pravidelným revizím.
Tab. 3. Praktická doporučení během podávání terapie metotrexátem (MTX). KO + dif – plný krevní obraz s diferenciálním rozpočtem, CRP – C-reaktivní protein, FW – rychlost sedimentace erytrocytů, moč CH + S – vyšetření moče chemicky a močového sedimentu, kreat – kreatinin, ionty – Na<sup>+</sup>, K<sup>+</sup>, Cl<sup>-</sup>, Ca<sup>2+</sup>, ALT – alaninaminotransferáza, AST – aspartátaminotransferáza, sérologie VZV – varicella-zoster virus 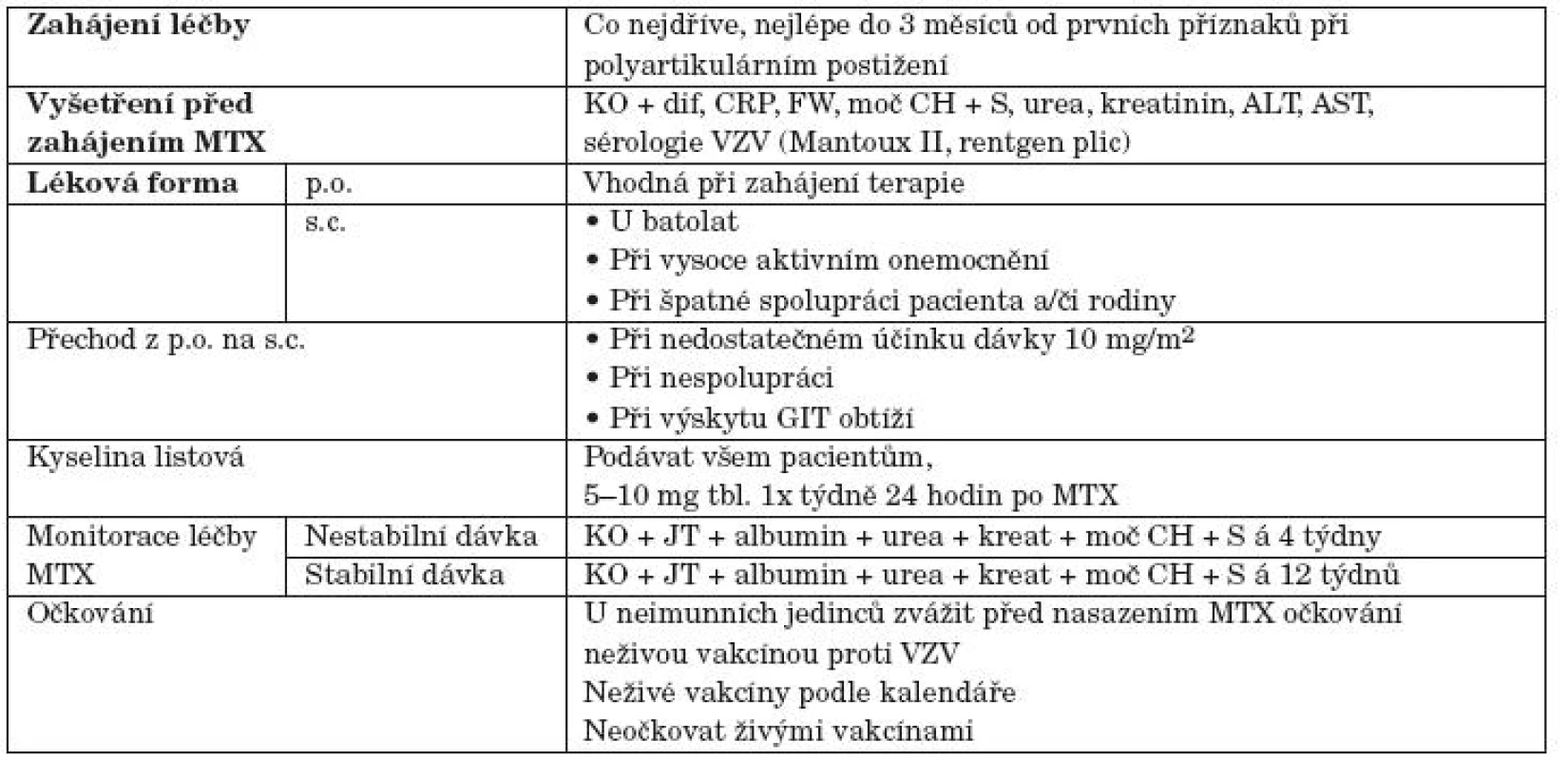
Grant: MZ ČR [IGA MH CR No. NE6681-3/2001].
Doc. MUDr. Pavla Doležalová, CSc.
Klinika dětského a dorostového lékařství
UK 1. LF a VFN
Ke Karlovu 2
128 00 Praha 2
e-mail: pavla.dolezalova@vfn.cz
Zdroje
1. Manners PJ, Bower C. Worldwide prevalence of juvenile arthritis – why does it vary so much? J. Rheumatol. 2002; 29 : 1520–1530.
2. Dougados M, Betteridge N, Burmester GR, et al. EULAR standardised operating procedures for the elaboration, evaluation, dissemination, and implementation of recommendations endorsed by the EULAR standing committees. Ann. Rheum. Dis. 2004; 63 : 1172–1176.
3. Giannini EH, Brewer EJ, Kuzmina N, et al. Methotrexate in resistant juvenile rheumatoid arthritis. Results of the U.S.A. – U.S.S.R. double-blind, placebo-controlled trial. The Pediatric Rheumatology Collaborative Study Group and The Cooperative Children’s Study Group. N. Engl. J. Med. 1992; 326(16): 1043–1049.
4. Woo P, Southwood TR, Prieur AM, et al. Randomized, placebo - controlled, crossover trial of low - dose oral methotrexate in children with extended oligoatricular or systemic arthritis. Arthr. and Rheum. 2000; 43(8): 1849–1857.
5. Ruperto N, Murray KJ, Gerloni V, et al. A randomized trial of parenteral methotrexate comparing an intermediate dose with a higher dose in children with juvenile idiopathic arthritis who failed to respond to standard doses of methotrexate. Arthritis Rheum. 2004; 50(7): 2191–2201.
6. Harel L, Weiner LW, Poznanski AK, Spencer CH, Ekwo E, Magilavy DB. Effects of methotrexate on radiologic progression in juvenile rheumatoid arthritis. Arthritis Rheum. 1993; 36(10): 1370–1374.
7. Wallace CA, Sherry DD, Mellins ED, Aiken RP. Predicting remission in juvenile rheumatoid arthritis with methotrexate treatment. J. Rheumatol. 1993; 20(1): 118–122.
8. Ravelli A, Viola S, Ramenghi B, Beluffi G, Zonta LA, Martini A. Radiologic progression in patients with juvenile chronic arthritis treated with methotrexate. J. Pediatr. 1998; 133(2): 262–265.
9. Alsufyani K, Vares OO-A, Cabral DA, Tucker LB, Petty RE, Malleson PN. The role of subcutaneous administration of methotrexate in children with juvenile idiopathic arthritis who have failed oral methotrexate. J. Rheumatol. 2004; 31 : 179–182.
10. Gottlieb BS, Keenam GF, Lu T, Ilowite NT. Discontinuation of methotrexate treatment in juvenile rheumatoid arthritis. Pediatrics 1997; 100(6): 994–997.
11. Ravelli A, Viola S, Migliavacca D, Ruperto N, Pistorio A, Martini A. The extended oligoarticular subtype is the best predictor of methotrexate efficacy in juvenile idiopathic arthritis. J. Pediatr. 1999; 135(3): 316–320.
12. Hashkes PJ, Laxer RM. Medical treatment of juvenile idiopathic arthritis. JAMA 2005; 294(13): 1671–1684.
13. Davies K, Woo P. Immunization in rheumatic diseases of childhood: an audit of the clinical practice of British Paediatric Rheumatology Group members and a review of the evidence. Rheumatology 2002; 41 : 937–941.
14. Halle F, Prieur A. Evaluation of methotrexate in the treatment of juvenile chronic arthritis according to the subtype. Clin. Exp. Rheumatol. 1991; 9 : 297–302.
15. Cassidy JT, Petty RE. Juvenile rheumatoid arthritis. In: Cassidy JT, Petty RE (eds.) Textbook of Pediatric Rheumatology. Philadelphia: WB Saunders. 2001 : 218–321.
16. Cron RQ, Sharma S, Sherry DD. Current treatment by United States and Canadian pediatric rheumatologists. J. Rheumatol. 1999; 26 : 2036–2038.
17. Niehues T, Horneff G, Michels H, Hock MS, Schuchmann L. Evidence-based use of methotrexate in children with rheumatic diseases: a consensus statement of the Working Groups Pediatric Rheumatology Germany (AGKJR) and Pediatric Rheumatology Austria. Rheumatol. Int. 2005; 25 : 169–178.
18. Niehues T, Lankisch P. Recommendations for the use of methotrexate in juvenile idiopathic arthritis. Pediatric Drugs 2006; 8(6): 347–356.
19. Brik R, Gepstein V, Berkovitz D. Low-dose methotrexate treatment for oligoarticular juvenile idiopathic arthritis nonresponsive to intra-articular corticosteroids. Clin. Rheumatol. 2005; 24 : 612–614.
20. BSPAR guidelines on methotrexate use in paediatric rheumatology. 2005 [updated 2007; last viewed 2010 February 12]. Available from: http:// www.bspar.org.uk/downloads/clinical_guidelines/BSPAR_METHR.pdf.
21. Ramanam AV, Whitworth P, Baildam EM. Use of methotrexate in juvenile idiopathic arthritis. Arch. Dis. Child. 2002; 88 : 197–200.
22. Ravelli A, Martini A. Methotrexate in juvenile idiopathic arthritis: Answers and questions. J. Rheumatol. 2000; 27(8): 1830–1833.
23. Ravelli A, Ramenghi B, Di Fuccia G, Ruperto N, Zonta L, Martini A. Factors associated with response to methotrexate in systemic-onset juvenile chronic arthritis. Acta Paediatr. 1994; 83(4): 428–432.
24. Fantini F, Gerloni V, Gattinara M, Cimaz R, Arnoldi C, Lupi E. Remission in juvenile chronic arthritis: A cohort study of 683 consecutive cases with a mean 10 year follow up. J. Rheumatol. 2003; 30 : 579–584.
25. Albers HM, Wessels JA, van der Straaten RJ, et al. Time to treatment as an important factor for the response to methotrexate in juvenile idiopathic arthritis. Arthritis Rheum. 2009; 61(1): 46–51.
26. Nell VPK, Machold KP, Eberl G, Stamm TA, Uffmann M, Smolen JS. Benefit of early referral and very early therapy with disease-modifying anti-rheumatic drugs in patients with early rheumatoid arthritis. Rheumatology 2004; 43 : 906–914.
27. Wallace CA, Bleyer WA, Sherry DD, Salmonson KL, Wedgwood RJ. Toxicity and serum levels of methotrexate in children with juvenile rheumatoid arthritis. Arthritis Rheum. 1998; 32(6): 677–681.
28. Singsen BH, Goldbach-Mansky R. Methotrexate in the treatment of juvenile rheumatoid arthritis and other pediatric rheumatic and nonrheumatic disorders. Rheum. Dis. Clin. North Am. 1997; 23 : 811–841.
29. Doležalová P. Methotrexát u juvenilní idiopatické artritidy. Lék. Listy 2007; 8 : 15–17.
30. Wallace CA. The use of methotrexate in childhood rheumatic diseases. Arthritis Rheum. 1998; 3 : 381–391.
31. Furst DE, Koehnke R, Burmeister LF, Kohler J, Cargill I. Increasing methotrexate effect with increasing dose in the treatment of resistant rheumatoid arthritis. J. Rheumatol. 1989; 16 : 313–320.
32. Tuková J, Chládek J, Nemcová D, Chládková J, Doležalová P. Methotrexate bioavailability after oral and subcutaneous administration in children with juvenile arthritis. Clin. Exp. Rheumatol. 2009; 27 : 1047–1053.
33. Dupuis LL, Koren G, Silverman ED, Laxer RM. Influence of food on the bioavalability of oral methotrexate in children. J. Rheumatol. 1995; 22 : 1570–1573.
34. Foell D, Frosch M, Wiesch ASz, Vogl T, Sorg C, Roth J. Methotrexate in juvenile idiopathic arthritis: when is the right time to stop? Ann. Rheum. Dis. 2004; 63 : 206–208.
35. Wallace CA, Bin H, Marcia B, Ravelli A, Giannini EH. Patterns of clinical remission in select categories of juvenile idiopathic arthritis. Arthritis Rheum. 2005; 52(11): 3554–3562.
36. Magnani A, Pistorio A, Magni-Manzoni S, et al. Achievement of a state of inactive disease at least once in the first 5 years predicts better outcome of patients with polyarticular juvenile idiopathic arthritis. J. Rheumatol. 2009; 36(3): 628–634.
37. American College of Rheumatology Subcommittee on Rheumatoid Arthritis Guidelines. Guidelines for the Management of Rheumatoid Arthritis. Arthritis Rheum. 2002; 46 : 328–346.
38. Hashkes PJ, Balistreri WF, Bove KE, Ballard ET, Passo MH. The relationship of hepatotoxic risk factors and liver histology in methotrexate therapy for juvenile rheumatoid arthritis. J. Pediatr. 1999; 134 : 47–52.
39. Hashkes PJ, Balistreri WF, Bove KE, Ballard ET, Passo MH. The long-term effect of methotrexate therapy on the liver in patients with juvenile rheumatoid arthritis. Arthritis Rheum. 1997; 40 : 2226–2234.
40. Graham LD, Myones BL, Rivas-Chacon RF, Pachman LM. Morbidity associated with long-term methotrexate therapy in juvenile rheumatoid arthritis. J. Pediatr. 1992; 120 : 468–473.
41. Heijstek MW, Pileggi C, Zonneveld-Huijssoon E, et al. Safety of measles, mumps and rubella vaccination in juvenile idiopathic arthritis. Ann. Rheum. Dis. 2007; 66 : 1384–1387.
42. Zonneveld-Huijssoon E, Ronaghy A, Rossum MAJ, et al. Safety and efficacy of meningococcal C vaccination in juvenile idiopathic arthritis. Arthritis Rheum. 2007; 56 : 639–646.
43. Koca B, Kasapcopur O, Aslan M, et al. Pneumococcal vaccine response and antibody levels in juvenile idiopathic arthritis. Ann. Rheum. Dis. 2006; 65(Suppl 2): 112.
44. Kasapçopur Ö, Çullu F, Kamburoðlu-Goksel A, et al. Hepatitis B vaccination in children with juvenile idiopathic arthritis. Ann. Rheum. Dis. 2004; 63 : 1128–1130.
45. Kanakoudi-Tsakalidou F, Trachana M, Pratsidou-Gertsi P, Tsitsami E, Kyriazopoulou-Dalaina V. Influenza vaccination in children with chronic rheumatic diseases and long-term immunosuppressive therapy. Clin. Exp. Rheumatol. 2001; 19 : 589–594.
46. Lovell DJ, Ruperto N, Goodman S, et al. Adalimumab with or without methotrexate in juvenile rheumatoid arthritis. N. Engl. J. Med. 2008; 359(8): 810–820.
47. Ruperto N, Lovell DJ, Cuttica R, et al. A randomized, placebo-controlled trial of infliximab plus methotrexate for the treatment of polyarticular-course juvenile rheumatoid arthritis. Arthritis Rheum. 2007; 56 : 3096–3106.
48. Hillson JL, Furst DE. Pharmacology and pharmacokinetics of methotrexate in rheumatic disease. Rheum. Dis. Clin. North Am. 1997; 23 : 757–778.
49. Cronstein BN. The mechanism of action of methotrexate. Rheum. Dis. Clin. North Am. 1997; 23 : 739–756.
50. Morgan SL, Bagott JE, Vaughn WH, et al. Supplementation with folic acid during methotrexate therapy for rheumatoid arthritis: A double-blind, placebo-controlled trial. Ann. Intern. Med. 1994; 121 : 833–841.
51. Ortiz Z, Shea B, Suarez-Almazor ME, Moher D, Wells GA, Tugwell P. The efficacy of folic acid and folinic acid in reducing methotrexate gastrointestinal toxicity in rheumatoid arthritis. A metaanalysis of randomized controlled trials. J. Rheumatol. 1998; 25 : 36–43.
52. Hunt PG, Rose CD, McIlvain-Simpson G, Tejani S. The effects of daily intake of folic acid on the efficacy of methorexate therapy in children with juvenile rheumatoid arthritis. A controlled study. J. Rheumatol. 1997; 24 : 2230–2232.
53. Joyce DA, Will RK, Hoffman DM, Laing B, Blackbourn SJ. Exacerbation of rheumatoid arthritis in patients treated with methotrexate after administration of folinic acid. Ann. Rheum. Dis. 1991; 50 : 913–914.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Hydroa vacciniforme
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2010 Číslo 6- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Rizika hormonálních kontraceptiv u adolescentních dívek
- Tromboembolické příhody u dívek a mladých žen užívajících hormonální antikoncepci
- Vrozená trombofilní dispozice a hormonální antikoncepce
- Rychle progredující komplikace chřipky typu A u dětí
- Metotrexát u dětí s juvenilní idiopatickou artritidou
- Tělesná teplota a termoregulace u novorozence
- Hydroa vacciniforme
- Návrh České lékařské společnosti J.E.Purkyně na novelizaci vyhlášky 185/2009 Sb. o specializačním vzdělávání lékařů
-
XII. hradecké pediatrické dny
19.–20. listopadu 2010 Hradec Králové - Doc. MUDr. Alois Kopecký – devadesátiletý
- Prof. MUDr. Jiří Dunovský, DrSc. – 80 let
- Dětský gynekolog profesor MUDr. Jan Hořejší, DrSc., sedmdesátníkem
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Tělesná teplota a termoregulace u novorozence
- Rychle progredující komplikace chřipky typu A u dětí
- Metotrexát u dětí s juvenilní idiopatickou artritidou
- Prof. MUDr. Jiří Dunovský, DrSc. – 80 let
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




