-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Dermatofibrosarcoma protuberans s fibrosarkomatózní transformací: kazuistika
Dermatofibrosarcoma protuberans with fibrosarcomatous transformation: a case report
Dermatofibrosarcoma protuberans is a quite rare local aggressive tumor of dermis and subcutis, revealing characteristic morphology and chromosomal translocation (17; 22)(q21;q13) with gene fusion COL1A1-PDGFB. The tumour almost never metastasizes and complete excision signs an excellent prognosis. Approximately in 10% of cases, dermatofibrosarcoma undergoes a fibrosarcomatous transformation associated with metastatic disease and worse prognosis. In this paper, we refer a case of a male patient with subcutaneous tumor in back region, in which the small biopsy lead to diagnosis of a spindle cell sarcoma. However, only the histopathological examination of the entire tumor in the material from the radical surgery detected the dermatofibrosarcoma protuberans with fibrosarcomatous transformation. Both components of the tumor showed the characteristic genetic alteration. Identification of fibrosarcomatous component within the DFSP matters in prognosis. Distinction between fibrosarcoma arising within the dermatofibrosarcoma protuberans and fibrosarcoma arising de novo is of therapeutic consequence: the patients with metastatic or inoperable DFSP with fibrosarcomatous transformation may profit form imatinib treatment.
Keywords:
dermatofibrosarcoma protuberans – Fibrosarcoma – fibrosarcomatous – transformation – change
Autoři: Jan Hrudka 1; Martin Charvát 2; Petr Grossmann 3; Zdeněk Kinkor 3
Působiště autorů: Ústav patologie 3. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Královské Vinohrady, Praha. 1; Klinika plastické chirurgie 3. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Královské Vinohrady, Praha. 2; Šiklův ústav patologie, Fakultní nemocnice Plzeň, Lékařská fakulta Univerzity Karlovy v Plzni a Bioptická laboratoř s. r. o., Plzeň. 3
Vyšlo v časopise: Čes.-slov. Patol., 56, 2020, No. 2, p. 89-93
Kategorie: Původní práce
Souhrn
Dermatofibrosarcoma protuberans je poměrně vzácný lokálně agresivní nádor kůže a podkoží vykazující charakteristickou morfologii a chromozomální přestavbu t(17; 22)(q21;q13) s fúzí genů COL1A1-PDGFB. DFSP téměř nemetastazuje a při kompletní excizi je prognóza výborná. Přibližně v desetině případů dochází ke vzniku fibrosarkomu v rámci dermatofibrosarkomu (fibrosarkomatózní transformace/přeměna), což je spojeno s vyšším rizikem metastatického onemocnění a agresivnějšího průběhu. V tomto článku popisujeme případ muže, u něhož probatorní biopsie podkožního tumoru na zádech vedla k diagnóze blíže neurčeného vřetenobuněčného sarkomu a teprve histologické vyšetření celého tumoru v radikální excizi odhalilo dermatofibrosarcoma protuberans s fibrosarkomatózní přeměnou, přičemž i nádor v předchozí probatorní biopsii vykazoval diagnostickou genetickou přeměnu. Identifikace fibrosarkomové komponenty v rámci DFSP má význam prognostický. Odlišení fibrosarkomu vzniklého v dermatofibrosarcoma protuberans od fibrosarkomu vzniklého de novo má význam léčebný, neboť pacienti s metastázami či inoperabilním nádorem s fibrosarkomatózní přeměnou mohou profitovat z biologické léčby imatinibem.
Klíčová slova:
dermatofibrosarcoma protuberans – fibrosarkom – fibrosarkomatózní – přeměna – transformace
Dermatofibrosarcoma protuberans (DFSP) je poměrně vzácný lokálně agresivní nízce maligní nádor kůže a podkožních měkkých tkání. Nádor se vyskytuje nejvíce u dospělých mladšího a středního věku, obvykle na trupu a v proximálních částech končetin (1). Makroskopicky se jedná o pomalu rostoucí indurované plaky či noduly červeno-hnědé či fialové barvy (2). Mikroskopicky nacházíme v dermis a v podkožní tukové tkáni difúzní infiltraci blandními vřetenitými buňkami se storiformní architektonikou. Charakteristické je rohožkovité uspořádání svazků nádorových buněk (1). Typická je difúzí „intersticiální“ infiltrace podkoží, zachovávající nenádorové adipocyty mezi úseky nádorové tkáně. Mezi varianty DFSP patří myxoidní DFSP a pigmentovaný DFSP (tzv. Bednářův tumor). Nádorové buňky DFSP jsou histogeneticky blízké CD34+ fibroblastům charakteru dermálních dendrocytů, které se vyskytují v okolí kožních adnex. DFSP má tendenci ke vzniku recidiv, při kompletní exstirpaci je však prognóza výborná (1).
Imunohistologicky je většina případů DFSP pozitivní v průkazu CD34. K potvrzení diagnózy lze využít molekulární vyšetření DFSP-specifické nebalancované chromozomální translokace t(17; 22)(q21;q13) ve formě nadpočetného prstenčitého chromozomu, s fúzí genu COL1A1 na chromozomu 17 s genem pro platelet-derived growth factor B (PDGFB) na chromozomu 22. Dostupnost tohoto vyšetření může však být zejména na menších pracovištích omezená, diagnóza se proto často zakládá na morfologii a imunohistochemii.
Přibližně v 10-15 % případů dochází v rámci DFSP k fibrosarkomatózní transformaci/přeměně, která je spojena s rizikem metastáz a agresivního průběhu onemocnění (3). V tomto článku popisujeme případ nemocného s DFSP s ložiskovitou fibrosarkomatózní transformací, přičemž nález v limitované probatorní excizi imponoval jako blíže neurčený vřetenobuněčný sarkom a úplná diagnóza byla zřejmá až po definitivním histopatologickém vyšetření celého nádoru v radikální excizi.
POPIS PŘÍPADU
57letý muž přichází do chirurgické ambulance regionální nemocnice pro asi 4cm velký palpačně tuhý podkožní útvar mezi lopatkami. Chirurg provedl probatorní excizi v lokální anestezii. K histopatologickému vyšetření byla dodána 10% formolem fixovaná částka rozměrů 13x7x5mm. Materiál byl zpracován standardním způsobem, zalit do parafinu (formalin-fixed paraffin-embedded, FFPE), nakrájen na mikrotomu a obarven hematoxylinem-eosinem. Mikroskopicky byl zastižen fascikulárně utvářený vysoce buněčný tumor s vzájemně se křížícími tlustými svazky vřetenitých nádorových buněk (tzv. „herringbone pattern“), které vykazovaly doutníkovitá hyperchromní jádra (Obr. 1). Byla patrná vysoká mitotická aktivita odpovídající v „hot-spots“ až 5 mitózám / 1 zorné pole 400x zvětšení (Obr.1B). Nádor zaujímal celý objem vzorku a vykazoval v celém rozsahu stejný vzhled a imunofenotyp. V imunohistochemii CD34 (Dako; klon QBEnd10, ředění 1 : 100) byly nádorové buňky zcela negativní, při pozitivní vnitřní kontrole v endoteliích cév v nádorovém stromatu (Obr.2A). Proliferační aktivita (Ki67, Ventana; klon 30-9, ready to use) byla v „hot-spots“ pozitivní v cca 40 % nádorových buněk (Obr. 2B).
Obr. 1. Foto z digitálního scanu histologického preparátu z probatorní biopsie - vřetenobuněčný fascikulárně uspořádaný tumor s hyperchromními jádry a mitotickou aktivitou. HE, zvětšení 13x (A) a 53x (B). 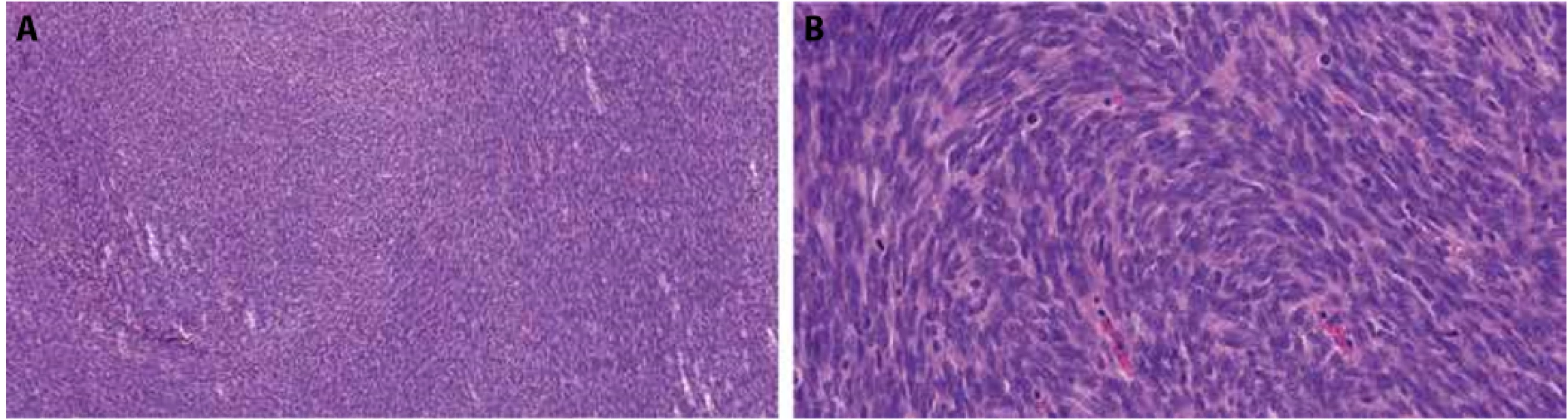
Obr. 2. Foto z digitálního scanu histologického preparátu z probatorní biopsie. A – CD34 je pozitivní pouze v endoteliích. B – proliferační aktivita (Ki67) přítomna v hot-spots až v 40 % nádorových buněk. Imunohistochemie CD34, zvětšení 18x (A), imunohistochemie Ki67, zvětšení 28x (B). 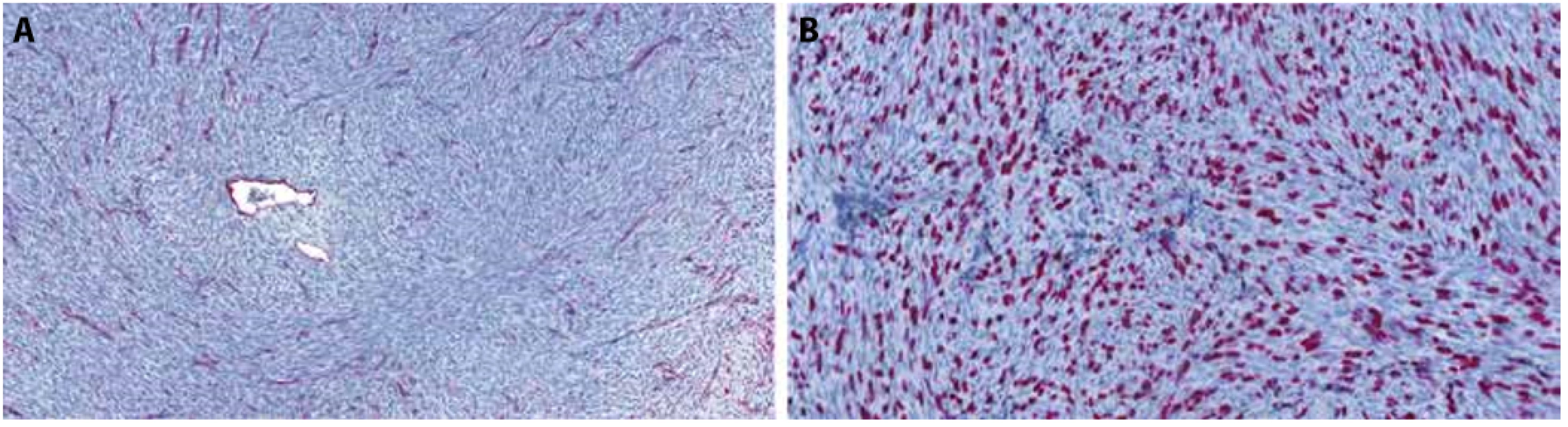
Na základě popsaného obrazu byl diagnostikován low-grade vřetenobuněčný sarkom měkkých tkání, nejspíše fibrosarkom, nekompletně excidovaný. Podle zvyklostí pracoviště nebyl při gradingu nádoru použit žádný skórovací systém, při retrospektivní aplikaci např. amerického gradovacího systému podle National Cancer Institute (NCI) by tento tumor měl grade 1 při morfologii dobře diferencovaného fibrosarkomu s pravidelným herringbone pattern. Na základě diagnózy byl pacient odeslán na specializovanou kliniku plastické chirurgie k radikálnímu odstranění tumoru. Byla doporučena a provedena radikální excize kůže a podkoží až na hlubokou svalovou fascii, se širokým bezpečnostním lemem a s plastikou defektu Limbergovým lalokem (Obr. 3). Klinicky byl tumor omezený na podkoží bez známek vrůstání do svalové fascie. Hojení rány a pooperační průběh byly nekomplikované. Operační preparát byl fixován v 10% formolu a odeslán k histopatologickému vyšetření.
Obr. 3. Makroskopická fotografie lokálního nálezu před radikální excizí – fialovo-hnědý palpačně tuhý podkožní útvar na zádech. Kresba fixou zobrazuje plánovanou linii chirurgického řezu s plánovanou plastikou Limbergovým lalokem. 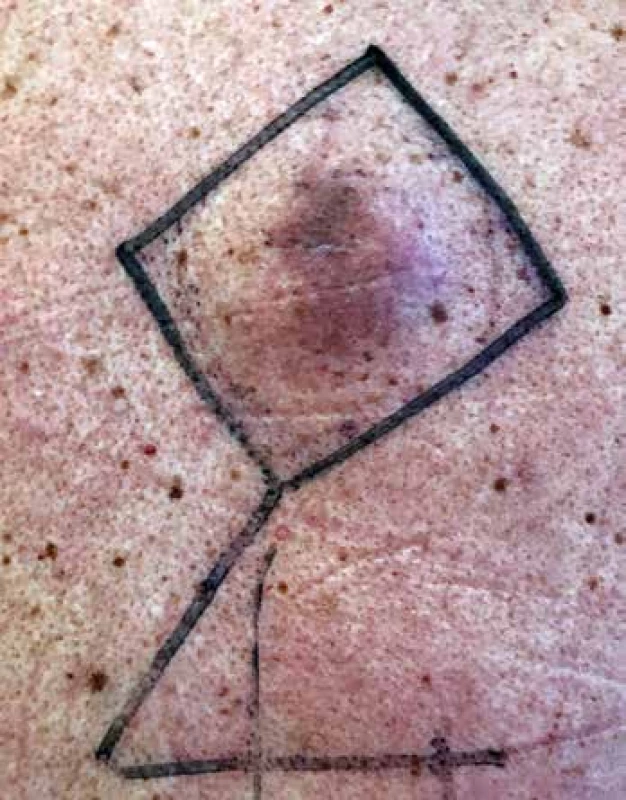
Ve formolu byla dodána přibližně čtvercovitá excize kůže a podkoží plochy 79x80mm a výšky 32mm. Povrch byl centrálně mírně vystouplý s hmatným tuhým ložiskem pod kůží. Na řezu bylo patrné poměrně dobře ohraničené šedobílé ložisko velikosti 40x38x23mm nedosahující do okrajů excize. Materiál byl přikrojen a zpracován standardním způsobem v parafinu a obarven hematoxylinem-eosinem.
Mikroskopicky byl patrný dermálně a podkožně situovaný vřetenobuněčný tumor, který vykazoval ve většině objemu storiformní „rohožkovité“ uspořádání, sestával z hojných cytologicky blandních buněk v lehce bazofilním stromatu, s charakteristickou infiltrací podkožní tukové tkáně zachovávající adipocyty (Obr.4A). Uvnitř masy nádoru s popsanou morfologií byly zastiženy dva okrouhlé ostrůvky, ve kterých byla patrna nápadně buněčná fascikulární proliferace vřetenitých buněk s hyperchromními jádry (Obr.4B). V imunohistochemii CD34 (Dako; klon QBEnd10, ředění 1 : 100) byla v „rohožkovité“ většině objemu nádoru patrná jednoznačná pozitivita nádorových buněk, zatímco v buněčných fascikulárních úsecích byla CD34 negativní při pozitivitě v endoteliích (Obr. 5). Nádor byl vzdálen 4,5mm od spodiny a bližšího laterálního okraje chirurgické excize.
Obr. 4. Foto z digitálního scanu histologického preparátu z radikální excize tumoru.
A – klasická morfologie DFSP vykazující storiformní „rohožkovité“ uspořádání blandních buněk v lehce bazofilním stromatu, zachovávající adipocyty, HE, 7x.
B – uvnitř DFSP jsou dva nápadně buněčné fibrosarkomatózní noduly, HE, 1,7x.
C – rozhraní „klasického“ DFSP a fibrosarkomatózního úseku, HE, 17x.
D – detail fibrosarkomatózního úseku s hyperchromními jádry a mitózami, HE, 73x.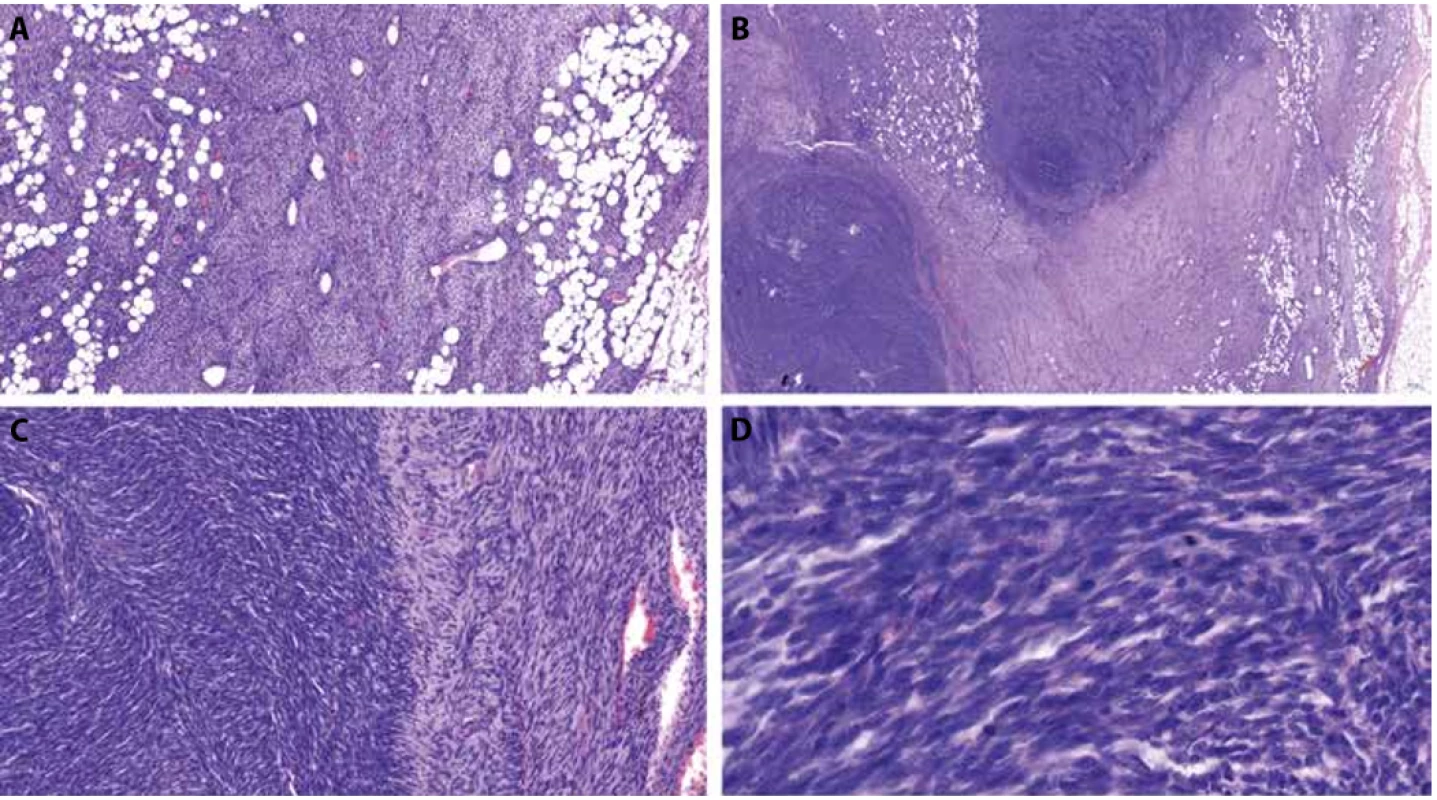
Obr. 5. Foto z digitálního scanu histologického preparátu z radikální excize tumoru, imunohistochemie CD34. A – klasický DFSP je CD34-pozitivní, zatímco ve fibrosarkomovém nodulu je patrná pozitivita jen v cévách, 2,8x. B – detail rozhraní CD34-pozitivního klasického DFSP a negativního fibrosarkomu, 20x. 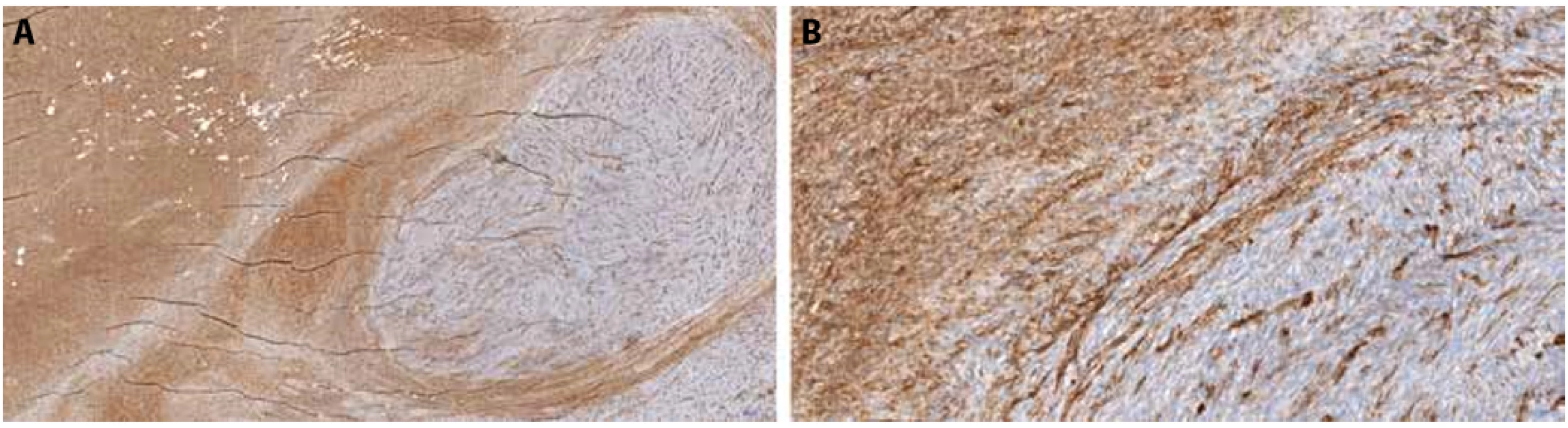
Nález v radikální excizi byl konzultován a porovnán s pracovištěm vyšetřujícím předchozí probatorní excizi. Na základě morfologie imponující v radikální excizi jednoznačně jako dermatofibrosarcoma protuberans byla v materiálu z probatorní excize provedena molekulární analýza - detekce translokace (17; 22)(q22;q13)(COL1A1/PDGFB) v FFPE materiálu metodou fluorescenční in-situ hybridizace (FISH) s použitím specifické „break apart“ sondy PDGFB a fúzní COL1A1/PDGFB sondy (ZytoVision, Bremerhaven, Germany). Průkaz fúze PDGFB-COL1A1 byl pozitivní (Obr. 6).
Obr. 6. Foto z mikroskopické detekce translokace (17;22)(q22;q13) (COL1A1/PDGFB) v FFPE tkáni metodou fluorescenční in-situ hybridizace (FISH) s použitím specifické „break apart“ sondy PDGFB a fúzní COL1A1/PDGFB sondy.
A - PDGFB break apart sonda. Interfázní jádra obsahují žluté signály indikující intaktní kopii genu PDGFB, naopak oddělené oranžové signály ukazují nadpočetné kopie reranžovaného lokusu PDGFB.
B - COL1A1/PDGFB fúzní sonda. Interfázní jádra obsahují separované oranžové a zelené signály normálních lokusů COL1A1 a PDGFB, naopak fúzní oranžovo-žluto-zelené signály detekují COL1A1/PDGFB translokaci.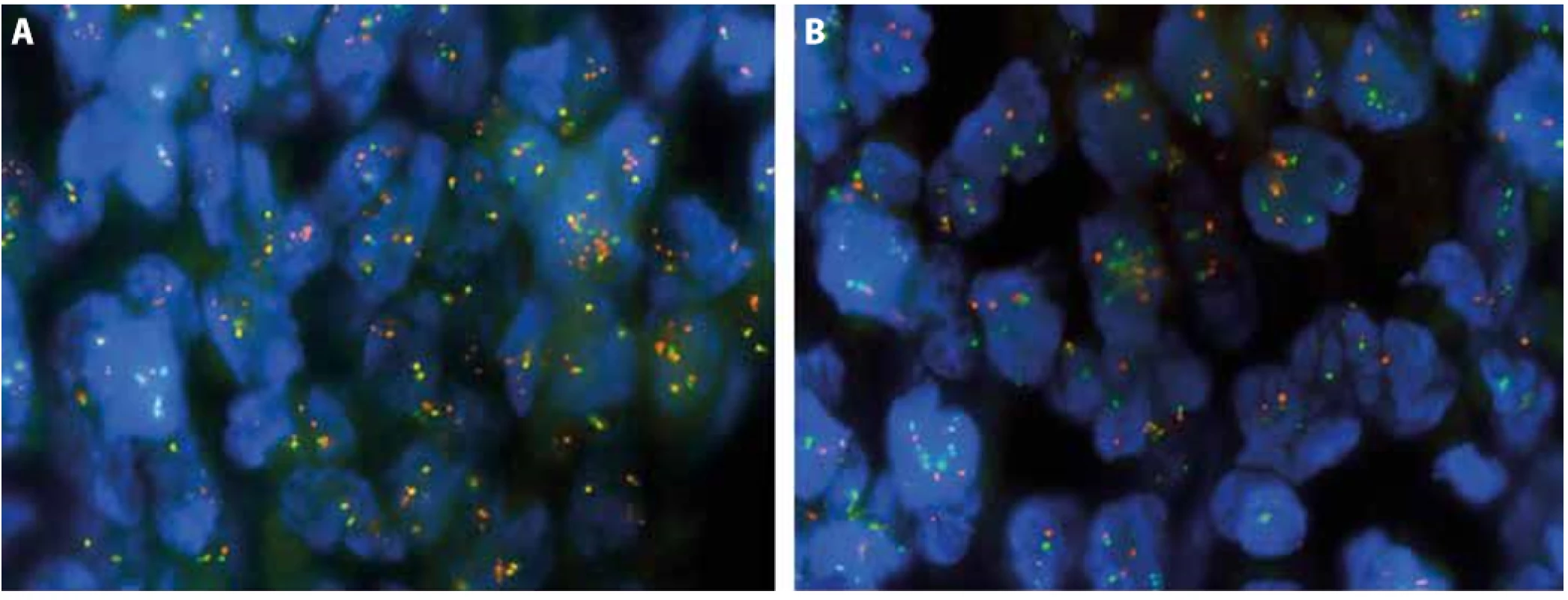
Na základě typické morfologie, imunofenotypu a molekulárního vyšetření byla stanovena diagnóza dermatofibrosarcoma protuberans s ložiskovou fibrosarkomatózní transformací. Vzhledem k poměrně malému lemu (4,5mm) byla následně provedena reexcize jizvy s lemem 1-2cm. Při histologickém vyšetření materiálu z reexcize již rezidua nádoru nalezena nebyla. Stagingová vyšetření (tomografie hrudníku a břicha) neprokázala vzdálené metastázy. Na základě diagnózy fibrosarkomatózní transformace byla nemocnému doporučena radioterapie. Nemocný podstoupil několika týdenní sérii ozařování s celkovou dávkou 66Gy v 33 frakcích. Pacient byl při poslední kontrole 17 měsíců po radikálním výkonu bez obtíží a bez známek lokální recidivy.
DISKUZE
Morfologie klasického DFSP je natolik charakteristická, že patolog obvykle nemá potíže stanovit správnou diagnózu. S výhodou je užití imunohistochemické detekce CD34, pozitivní ve většině případů DFSP, ačkoliv byly popsány i nádory negativní (4); v těchto případech je rozhodující genetické vyšetření. Pozitivita CD34 umožní v případě nejistoty odlišit např. dermatofibrom, difúzní neurofibrom, atypický fibroxantom či jiné typy sarkomů. V rámci morfologické diferenciální diagnózy je třeba zmínit synoviální sarkom, solitární fibrózní tumor, desmoplastický melanom, vřetenobuněčný rabdomyosarkom a maligní nádor periferní nervové pochvy (MPNST), které všechny mohou být také CD34-pozitivní (5-7).
Kromě notoricky známého CD34 vykazuje DFSP téměř vždy pozitivitu apolipoproteinu-D (2). Jak bylo uvedeno, v menšině případů dochází v DFSP k fibrosarkomatózní transformaci, která je asociovaná s výskytem metastáz v cca 10-15% případů, zatímco běžný DFSP téměř nemetastazuje (2). Histopatologická identifikace této transformace má tedy značný význam; důležité je zejména přikrojení dostatečného množství bloků (zpracování alespoň 1 bloku na 1 cm velikosti nádoru v největším rozměru). Podobně jako v našem případě lze najít reference o případech, kdy v mase tkáně DFSP byly zastiženy úseky s vysokou celularitou, s cytonukleárními atypiemi, s vyšší mitotickou aktivitou a s fascikulárním uspořádáním (tzv. herringbone-pattern). Zároveň úseky fibrosarkomatózní transformace vykazují v porovnání s běžným DFSP slabou pozitivitu či negativitu CD34 (8, 9) a apolipoproteinu-D (2, 9). Zajímavým zjištěním je, že část DFSP s fibrosarkomatózní transformací vykazuje oproti úsekům běžného DFSP zmnožení kopií fúzního genu COL1A1-PDGFB, zatímco v části případů fibrosarkomatózně transformovaných DFSP žádný rozdíl v počtu kopií fúzního genu prokázán nebyl (10). V našem případě již „klasický“ DFSP geneticky vyšetřován nebyl.
Translokace (17; 22)(q21;q13) s fúzí genů COL1A1/PDGFB není významná jen pro diagnostiku: receptor pro platelet-derived growth factor (PDGFR) lze terapeuticky inhibovat imatinibem (11) s dobrým klinickým efektem. Produkt fúze COL1A1 a PDGFB lze detekovat pomocí real time polymerázové řetězové reakce (RT-PCR) nebo pomocí o něco senzitivnější fluorescenční in situ hybridizace (FISH)(12, 13). Kombinace metod RT-PCR a FISH pak detekuje přítomnost fúzního genu prakticky ve všech případech DFSP (14). V onkogenezi hraje patrně hlavní roli chimérický fúzní protein, který stimuluje buněčnou proliferaci skrze apokrinní/parakrinní stimulaci PDGF receptoru (15). Obdobný mechanismus nádorové transformace je popisován u tzv. Bednářova tumoru či u obrovskobuněčného fibroblastomu, což je patrně juvenilní varianta DFSP (16).
Odlišení DFSP s diagnostickou cytogenetickou COL1A1-PDGFB-fúzí od fibrosarkomu má klíčový význam, neboť pacienti s DFSP mohou profitovat z biologické léčby imatinib mesylátem (17-19). Totéž se pak týká odlišení fibrosarkomu vzniklého transformací DFSP od fibrosarkomu vzniklého de novo, neboť i nemocní s fibrosarkomatózní transformací DFSP vykazují terapeutickou odpověď na tuto léčbu (17, 18), byť mají horší prognózu než pacienti s DFSP bez fibrosarkomatózní transformace (17).
Svízelná může být identifikace DFSP s fibrosarkomatózní přeměnou v probatorní biopsii, pokud se jedná o limitovaný vzorek, který, jako v našem případě, obsahuje pouze fibrosarkomovou komponentu nádoru. Samotná morfologie a imunohistochemie pak neumožňuje dospět k diagnóze fibrosarkomu vzniklém v rámci DFSP. Pokud na tuto neobvyklou možnost patolog vyšetřující probatorní excizi z podkožního mezenchymálního tumoru pomyslí, může mu být vodítkem jen molekulární vyšetření translokace COL1A1/PDGFB. Správná indikace tohoto vyšetření může mít i své praktické dopady, neboť v případě metastatického onemocnění může nemocný s fibrosarkomatózně transformovaným DFSP profitovat z biologické léčby.
Kromě zmíněné charakteristické genetické změny byly popsány i alternativní fúze, např. COL6A3-PDGFD (20) nebo EMILIN2-PDGFD (21). Na tuto skutečnost je třeba v případě použití pouze FISH metody myslet a výsledky konfirmovat ještě pomocí RT-PCR nebo metody next generation sequencing (NGS).
U pacientů s CD34-pozitivními vřetenobuněčnými sarkomy může být přínosné genetické vyšetření fúze NTRK3. Recentní publikace popisuje dva případy CD34-pozitivních fibrosarkomů, přičemž pacienti mohou profitovat z léčby tyrozin-kinázovými inhibitory (22).
Zlatým standardem léčby DFSP, ať již s fibrosarkomatózní transformací nebo bez, je radikální chirurgická excize tumor s lemem šíře nejméně 2cm (23). U inoperabilních tumorů se doporučuje předchozí ozáření nebo biologická léčba imatinibem s cílem snížení objemu nádoru, biologickou léčbu je třeba nasadit i u nádorů diseminovaných, samozřejmě při pozitivním průkazu diagnostické translokace t(7; 22) v nádorových buňkách (24).
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
∗ Adresa pro korespondenci:
MUDr. Jan Hrudka, Ph.D.
Ústav patologie 3. LF UK a FNKV
Šrobárova 1150/50, Praha 10, PSČ 100 34
tel: +420 267 16 2500
e-mail: jan.hrudka@lf3.cuni.cz
Zdroje
- Povýšil C. Mezenchymové nádory. In: Povýšil C, Šteiner I (eds.). Obecná patologie. Galén, Praha, 2011. P. 205.
- Gharazin D, Labonte S, Dickson BC, Al Habeeb A. Immunohistology and molecular studies of fibrohistiocytic and myofibroblastic tumors. In: Plaza JA, Prieto VG (eds.). Applied immunohistochemistry in the evaluation of skin neoplasms. Springer International Publishing Switzerland 2016. Pp. 124-127.
- Mentzel T, Pedeutour F, Lazar A, Coindre JM. Dermatofibrosarcoma protuberans. In: Fletcher DMC, Bridge JA, Hogendoorn PCW, Mertens F (Eds.). WHO Classification of tumours of soft tissue and bone. IARC: Lyon 2013. Pp. 77-79.
- Song JS, Kim EJ, Park CS, Cho KJ. Dermatofibrosarcoma protuberans: an immunomarker study of 57 cases that included putative mesenchymal stem cell markers. Appl Immunohistochem Mol Morphol 2017; 25(8):586-591.
- Hoang MP, Selim MA, Bentley RC, Burchette JL, Shea CR. CD34 expression in desmoplastic melanoma. J Cutan Pathol 2001; 28(10): 508-512.
- Kacar A, Demir HA, Durak H, Derisoglu S. Spindle cell rhabdomyosarcoma displaying CD34 positivity: a potential diagnostic pitfall; report of two pediatric cases. Turk Patoloji Derg 2013; 29(3): 221-226.
- Sangiorgio V, Zanagnoio V, Aletti G, et al. Fibroblastic malignant peripheral nerve sheath tumour of the uterine cervix: report of a case and literature review with emphasis on possible differential diagnosis. Int J Gynecol Pathol 2018; 37(5): 497-503.
- Reifs CMA, Salido-Vallejo R. Dermatofibrosarcoma protuberans with fibrosarcomatous transformation. An Bras Dermatol 2016; 91(5): 700-701.
- Palmerini E, Gambarotti M, Staals EL, et al. Fibrosarcomatous changes and expression of CD34+ nad apolipoprotein-D in dermatofibrosarcoma protuberans. Clin Sarcoma Res 2012; 2(1): 4.
- Abbott JJ, Erickson-Johnson M, Wang X, Nascimento AG, Oliveira AM. Gains of COL1A1-PDGFB genomic copies occur in fibrosarcomatous transformation of dermatofibrosarcoma protuberans. Mod Pathol 2006; 19(11): 1512-1518.
- McArthur GA. Molecular targeting of dermatofibrosarcoma protuberans: a new approach to a surgical disease. J Natl Compr Canc Netw 2007; 5(5): 557-562.
- Salgado R, Llombart B, Pujol RM, et al. Molecular diagnosis of dermatofibrosarcoma protuberans: a comparison between reverse transcriptase-polymerase chain reaction and fluorescence in situ hybridization methodologies. Genes Chromosomes Cancer 2011; 50(7): 510-517.
- Karanian M, Pérot G, Coindre JM, Chibon F, Pedeutour F, Neuville A. Fluorescence in situ hybridization analysis is a helpful test for the diagnosis of dermatofibrosarcoma protuberans. Mod Pathol 2015; 28(2): 230-237.
- Patel KU, Szabo SS, Hernandez VS, Prieto VG, Abruzzo LV, Lazar AJ, López-Terrada D. Dermatofibrosarcoma protuberans COL1A1-PDGFB fusion is identified in virtually all dermatofibrosarcoma protuberans cases when investigated by newly developed multiplex reverse transcription polymerase chain reaction and fluorescence in situ hybridization assays. Hum Pathol 2008; 39(2): 184-193.
- Sirvent N, Maire G, Pedeutour F. Genetics of dermatofibrosarcoma protuberans family of tumors: from ring chromosomes to tyrosine kinase inhibitor treatment. Genes Chromosomes Cancer 2003; 37(1): 1-19.
- Terrier-Lacombe MJ, Guillou L, Maire G, et al. Dermatofibrosarcoma protuberans, giant cell fibroblastoma, and hybrid lesions in children: clinicopathologic komparative analysis of 28 cases with molecular data: a study from the french federation of cancer centers sarcoma group. Am J Surg Pathol 2003; 27(1): 27-39.
- Rutkowski P, Klimczak A, Lugowska I, et al. Long-term results of treatment of advanced dermatofibrosarcoma protuberans (DFSP) with imatinib mesylate - The impact of fibrosarcomatous transformation. Eur J Surg Oncol 2017;43(6): 1134-1141.
- Rutkowski P, Van Glabbeke M, Rankin CJ, et al. Imatinib mesylate in advanced dermatofibrosarcoma protuberans: pooled analysis of two phase II clinical trials. J Clin Oncol 2010; 28(10): 1772-1779.
- Ugurel S, Mentzel T, Utikal J, et al. Neoadjuvant imatinib in advanced primary or locally recurrent dermatofibrosarcoma protuberans: a multicenter phase II DeCOG trial with long-term follow-up. Clin Cancer Res 2014; 20(2): 499-510.
- Dickson BC, Hornick JL, Fletcher CDM, et al. Dermatofibrosarcoma protuberans with a novel COL6A3-PDGFD fusion gene and apparent predilection for breast. Genes Chromosomes Cancer 2018; 57(9): 437-445.
- Dadone-Montaudié B, Alberti L, Duc A. Alternative PDGFD rearrangements in dermatofibrosarcomas protuberans without PDGFB fusions. Mod Pathol 2018; 31(11): 1683-1693.
- Yamazaki F, Nakatani F, Asano N, et al. Novel NTRK3 fusions in fibrosarcomas of adults. Am J Surg Pathol 2019; 43(4): 523-530.
- Voth H, Landsberg J, Hinz T, et al. Management of dermatofibrosarcoma protuberans with fibrosarcomatous transformation: an evidence-based review of the literature. J Eur Acad Dermatol Venereol 2011; 25(12): 1385-1391.
- Serra-Guillén C, Llombart B, Nagore E, et al. Mohs micrographic surgery in dermatofibrosarcoma protuberans allows tumour clearance with smaller margins and greater preservation of healthy tissue compared with conventional surgery: a study of 74 primary cases. Br J Dermatol 2015; 172(5): 1303-1307.
Štítky
Patologie Soudní lékařství Toxikologie
Článek EditorialČlánek Jaká je vaše diagnóza?
Článek vyšel v časopiseČesko-slovenská patologie

2020 Číslo 2-
Všechny články tohoto čísla
- Editorial
- Už asi není udržitelné fungovat bez subspecializací
- Monitor aneb nemělo by Vám uniknout, že...
- Úvod do diagnostiky vaskulitid – „pattern based“ přístup a diferenciální diagnostika z pohledu morfologie
- Patofyziologické mechanismy rozvoje ANCA asociovaných vaskulitid
- Jak v praxi zlepšit morfologickou diagnostiku systémových vaskulitid
- Primární vaskulitidy – současná diagnostika a léčba
- Sekundární vaskulitidy – opomíjené manifestace řady onemocnění
- Dermatofibrosarcoma protuberans s fibrosarkomatózní transformací: kazuistika
- Jaká je vaše diagnóza?
- Případ amébové kolitidy s endoskopickými i histopatologickými rysy Crohnovy choroby
- Jaká je vaše diagnóza? Odpověď: Mukozálny hamartóm zo Schwannovych buniek pripomínajúci taktilné Wagnerove-Meissnerove telieska
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Primární vaskulitidy – současná diagnostika a léčba
- Sekundární vaskulitidy – opomíjené manifestace řady onemocnění
- Dermatofibrosarcoma protuberans s fibrosarkomatózní transformací: kazuistika
- Patofyziologické mechanismy rozvoje ANCA asociovaných vaskulitid
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



