-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Peroperační biopsie v gynekopatologii
Intraoperative consultation in gynecologic pathology
Intraoperative consultation represents an integral part of diagnostic protocols in gynecologic oncology. It may be indicated 1) to evaluate the biologic nature of a pathologic process (distinction between nonneoplastic lesions and tumors), 2) to classify the histologic type of tumor and assess its biologic behavior (typing), 3) to confirm or rule out the metastatic origin of a tumor, 4) to determine the degree of differentiation and extent of local spread of a malignant tumor (grading and staging), 5) to detect tumor deposits in lymph nodes, 6) to examine surgical resection margins, 7) to detect products of conception in uterine curettings when ectopic pregnancy is suspected and 8) to collect native tumor tissue for ancillary studies (molecular methods, flow cytometry). A frozen section of adnexal masses is commonly requested and focused primarily on the recognition of malignant tumors, the distinction between borderline tumors and carcinomas, and the identification of a metastatic process in the ovary. An intraoperative consultation may also be beneficial in the risk stratification of patients with endometrial carcinoma for the indication of lymphadenectomy, in the assessment of an endocervical surgical resection margin during fertility sparing and less radical surgery for the carcinoma of uterine cervix and in the detection of tumor spread into the lymph nodes (including sentinel lymph nodes). For the appropriate evaluation of a frozen section, awareness of the relevant clinical data and history of the patient, interpretation of the histologic findings in the context of macroscopic appearance of a specimen and an active interaction with the surgeon are required as essential conditions.
Keywords:
intraoperative consultation – frozen section – gynecologic pathology – tumors of ovary – metastases – sentinel lymph node
Autoři: Petr Škapa; Marek Pluta 1
Působiště autorů: Oddělení patologie a molekulární medicíny, Thomayerova nemocnice, Praha 1; Ústav patologie, 3. lékařská fakulta Univerzity Karlovy a FNKV, Praha 2; Ústav patologie, 1. lékařská fakulta Univerzity Karlovy a VFN, Praha 3
Vyšlo v časopise: Čes.-slov. Patol., 54, 2018, No. 3, p. 105-118
Kategorie: Přehledový článek
Souhrn
Peroperační biopsie je nedílnou součástí diagnostických protokolů v onkogynekologii a může být indikována za účelem 1) stanovení biologické povahy patologického procesu (odlišení nenádorových lézí a nádorů), 2) určení histologického typu nádoru a odhadu biologického chování (typing), 3) potvrzení či vyloučení metastatického původu nádoru, 4) stanovení stupně diferenciace a lokálního rozsahu maligního nádoru (grading a staging), 5) detekce nádorových depozit v lymfatických uzlinách, 6) vyšetření chirurgických resekčních okrajů, 7) detekce těhotenských reziduí v kyretáži děložní dutiny při podezření na extrauterinní graviditu a 8) odběru nativní nádorové tkáně pro specializovaná vyšetření (molekulární metody, průtoková cytometrie). Nejčastěji je vyžadováno peroperační vyšetření adnexálních expanzivních procesů s důrazem na identifikaci a klasifikaci maligních nádorů, rozlišení borderline nádorů a karcinomů a rozpoznání metastatického postižení ovaria. Mezi další typické aplikace peroperačního vyšetření spadá stratifikace pacientek s karcinomem korporálního endometria do rizikových skupin pro indikaci lymfadenektomie, hodnocení stavu endocervikálního chirurgického okraje při fertilitu šetřících a méně radikálních operacích pro karcinom děložního hrdla a detekce nádorového postižení lymfatických uzlin (včetně sentinelových lymfatických uzlin). Pro správnou interpretaci peroperačního vyšetření je nezbytná znalost relevantních klinických a anamnestických údajů pacientky, posouzení histologického nálezu v kontextu makroskopického vzhledu zaslaného materiálu a v neposlední řadě aktivní komunikace s klinikem.
Klíčová slova:
peroperační biopsie – gynekopatologie – onkogynekologie – nádory ovaria – metastázy – sentinelová lymfatická uzlina
PEROPERAČNÍ BIOPSIE V GYNEKOPATOLOGII
Peroperační vyšetření nativního bioptického materiálu je v současnosti již nedílnou součástí diagnostických protokolů v onkogynekologii (1). Ve větších nemocničních centrech se gynekologická pracoviště řadí dokonce mezi jedny z nejčastějších žadatelů o peroperační zhodnocení nálezu patologem. Český termín „peroperační biopsie“, ale ani anglická varianta „frozen section“, nepostihují v plné šíři komplexitu služby, kterou poskytuje patolog svému klinickému kolegovi na operačním sále. Vhodnějším termínem je spíše v zahraniční literatuře užívané slovní spojení „intraoperative consultation“, které lépe charakterizuje interakci mezi patologem a klinikem v průběhu operace a neomezuje definici pouze na prosté sdělení histologické diagnózy anebo technické provedení zmrazeného řezu (2-4). Specifické onkogynekologické indikace pro peroperační biopsii rámcově vycházejí z obecných indikačních kritérií pro peroperační vyšetření a lze je stručně shrnout v následujících bodech (3,4):
- (i) Stanovení biologické povahy patologického procesu. Nejčastěji je vyžadováno peroperační vyšetření expanzivních procesů malé pánve, které většinou odpovídají patologickému útvaru v ovariu. Diferenciálně diagnosticky připadá v úvahu široké spektrum lézí od zánětlivých procesů a nenádorových cyst přes benigní a borderline nádory až k nádorům maligním.
- (ii) Určení histologického typu nádoru a odhad biologického chování (typing). V ovariální lokalizaci jde především o klasifikaci nádoru do jedné ze čtyř základních skupin (epitelové, gonadostromální, germinální a metastatické) a zhodnocení stupně malignity. Typickým příkladem jsou epitelové nádory ovaria, kde peroperační diagnóza adenomu, borderline nádoru nebo karcinomu rozhoduje o dalším rozsahu chirurgického výkonu. Dalším příkladem je peroperační typizace karcinomu korporálního endometria.
- (iii) Potvrzení či vyloučení metastatického původu nádoru. Jedná se o kriticky důležitý moment v peroperačním vyšetření ovariálních malignit. Správná identifikace metastatického původu nádoru zabrání zbytečně radikálnímu resekčnímu výkonu a umožní pátrat po primárním zdroji již během operace.
- (i) Orientační grading a staging maligního nádoru. Příkladem je peroperační stanovení stupně diferenciace a hloubky myometrální invaze karcinomu korporálního endometria, na jejichž podkladě může být indikována pánevní a/nebo paraaortální lymfadenektomie.
- (ii) Detekce nádorových depozit v lymfatických uzlinách. V úvahu připadá peroperační vyšetření lymfatických uzlin z důvodu stagingu maligního nádoru. Specifickou kapitolou je peroperační biopsie sentinelových lymfatických uzlin, mezi onkogynekologickými pracovišti se však nejedná o univerzálně přijímanou proceduru.
- (iii) Vyšetření chirurgických resekčních okrajů. Vzhledem k anatomickým poměrům v malé pánvi a charakteru gynekologických operací se nejedná o příliš časté vyšetření. Jednou z indikací je například peroperační vyšetření endocervikálního resekčního okraje děložního hrdla při vaginální nebo abdominální radikální trachelektomii anebo při konizaci.
- (iv) Detekce těhotenských reziduí v kyretáži děložní dutiny při suspekci na extrauterinní graviditu. Vzácně indikovaná metodika používaná v případě diagnostických nejasností pouze u pacientek, u kterých je silně žádoucí zkrátit dobu vedoucí k potvrzení nebo vyloučení ektopické gravidity na minimum anebo omezit počet anestezií.
- (v) Odběr nativní nádorové tkáně pro specializovaná vyšetření. Jedná se o plánovaný odběr nefixovaného materiálu nejčastěji pro molekulární metody nebo průtokovou cytometrii, například při diagnostice hematologických malignit anebo pro výzkumné účely. Provedení zmraženého řezu z odebraného vzorku zaručí reprezentativní odběr vitální nádorové tkáně bez artefaktů a nekrózy.
Tento přehledový článek klade důraz především na problematiku adnexálních expanzivních procesů, které jsou dle našich zkušeností nejčastější onkogynekologickou indikací k peroperační biopsii. Kromě poznámek věnovaných primárním ovariálním nádorům je podrobně diskutována diagnostika ovariálních metastáz, což je v gynekopatologii dlouho opomíjené téma s dalekosáhlým klinickým dopadem, neboť sekundární nádory tvoří nezanedbatelnou část ovariálních malignit (běžně udáváno 7-10 %, dle některých zdrojů až 15 %)(5-7). Stručněji bude pojednáno o peroperačních vyšetřeních karcinomů korporálního endometria, endocervikálního chirurgického resekčního okraje děložního hrdla a sentinelových lymfatických uzlin. Předmětem tohoto sdělení nejsou situace, které stojí na hranici správné indikace k peroperační biopsii anebo jsou již za hranou (například kompletní peroperační zpracování konizátu děložního hrdla s prekancerózní lézí, vyšetření mezenchymálních nádorů dělohy, diagnostických odběrů z vulvy a děložního hrdla, kyretáží děložní dutiny se suspekcí na nádor, hodnocení chirurgických resekčních okrajů u Pagetovy choroby vulvy a další).
SPOLEHLIVOST A LIMITACE PEROPERAČNÍCH BIOPSIÍ V GYNEKOPATOLOGII
Celková spolehlivost peroperačních vyšetření v gynekopatologii (shoda s definitivní diagnózou) je vysoká a dle publikovaných souborů lézí z různých anatomických lokalizací ženského genitálu se orientačně pohybuje v rozmezí 91 – 99 % (2,4). Míra falešné negativity v peroperační diagnostice gynekologických nádorů zpravidla nedosahuje 2 % a falešně pozitivní případy jsou zmiňovány ojediněle s frekvencí maximálně 0,5 % (8-11). Poměr diagnóz odložených na definitivní vyšetření je nízký a na většině pracovišť nepřesahuje 2 % (8,10,11). Přítomnost gynekopatologa při rutinních peroperačních biopsiích pro gynekologická pracoviště tedy není nezbytně nutná (4), nicméně může být ve sporných a diferenciálně diagnosticky obtížných situacích výhodou, především pokud hrozí odložení diagnózy až na definitivní zpracování materiálu.
Selhání peroperační biopsie se nemusí odvíjet z diagnostického omylu patologa. Většina chyb a odložených diagnóz je ve skutečnosti způsobena technickými limitacemi této metodiky (2,8-12). Zmrazené řezy se vyznačují horší kvalitou a obtížnou interpretací ve srovnání s histologickými řezy z formolem fixovaného materiálu zalitého do parafínu (11). Roli samozřejmě hraje i časový faktor a stresové situace vyplývající například z koincidence více peroperačních vyšetření v jedné době. Také nemožnost rychlé konzultace nálezu s druhým patologem anebo gynekopatologem může vést k nepřesnému hodnocení některých nálezů. V neposlední řadě je nutno vzít v úvahu, že histopatologické vyšetření tkání je ve své podstatě založeno na pravděpodobnosti a že patolog není schopen mikroskopicky analyzovat veškerý objem zaslaného bioptického materiálu. To lze výjimečně provádět vyšetřením tkáně standardními histologickými technikami v přesně indikovaných případech (například kompletní zpracování sentinelových lymfatických uzlin anebo děložní tuby u BRCA1/2 pozitivních pacientek). Z technických, časových a personálních důvodů však pochopitelně není možno extenzivně vyšetřovat větší resekáty zaslané k peroperační biopsii (3). V tomto případě je primární úlohou patologa pečlivé makroskopické zhodnocení patologického procesu, což může zabránit odběru nereprezentativního materiálu a falešně negativním výsledkům a je prvním krokem ke správné histologické diagnóze (12).
Není pravdy, je jen pravděpodobnost.
(Prótagorás z Abdér, filozof)
PEROPERAČNÍ VYŠETŘENÍ ADNEXÁLNÍCH EXPANZIVNÍCH PROCESŮ
Adnexální léze zahrnují heterogenní skupinu nenádorových proliferací a benigních, borderline i maligních nádorů postihujících nejen samotné ovarium, ale i děložní tubu, pánevní peritoneum a přilehlé anatomické struktury. Předoperační diagnostika sestávající z fyzikálního vyšetření, zobrazovacích metod (především transvaginální ultrasonografie) a stanovení hladin nádorových markerů nedokáže ani v současnosti vzhledem k limitované senzitivitě a specificitě nálezy spolehlivě klasifikovat, proto je provedení peroperační biopsie často nezbytné (1,13). Nejčastějšími diferenciálně diagnostickými problémy, se kterými se pak může patolog setkat je identifikace a histologická klasifikace maligních nádorů, rozlišení borderline nádorů a karcinomů a rozpoznání metastatického postižení ovaria (4). Na základě výsledku peroperační biopsie rozhoduje operatér s přihlédnutím k věku pacientky a případnému požadavku na zachování fertility o rozsahu chirurgického výkonu, který se pohybuje od prosté enukleace nenádorové cysty nebo parciální resekce ovaria, přes adnexektomii (salpingo-ooforektomii) u benigních nádorů nebo metastáz až po radikální hysterektomii s bilaterální adnexektomií, omentektomií, apendektomií, odstraněním peritoneálních depozit a lymfadenektomií u karcinomů (1).
Prvotní analýzu a interpretaci nálezu provádí klinik během operace na základě makroskopického vzhledu léze a následně zvolí odběr odpovídajícího množství materiálu (14). U benigně vyhlížejících afekcí (například nenádorových cyst typu endometriózy, cystických diferencovaných zralých teratomů, adenofibromů, atd.) je peroperační vzorek typicky tvořený enukleátem anebo resekátem povrchových proliferací na ovariu. K potvrzení nebo vyloučení maligního nádoru je většinou provedena přímo adnexektomie, což na většině pracovišť bývá nejčastějším typem resekátu zasílaného k peroperační biopsii pro adnexální expanzivní proces. V menší míře jsou peroperačně odesílány i excize z omenta a peritonea pro potvrzení a klasifikaci diseminovaného maligního nádoru, případně lymfatické uzliny suspektní z přítomnosti metastatického rozsevu. Pro úspěšné vyhodnocení peroperační biopsie je nutná syntéza relevantních klinických a anamnestických údajů o pacientce, makroskopického vzhledu resekátu, mikroskopického nálezu a aktivní interakce s operatérem.
Klinické údaje a anamnestická data pacientky
Mezi důležitá klinická data patří především věk pacientky a anamnestické údaje o případných předchozích nádorech, které by mohly do ovaria metastazovat. Roli při peroperační analýze mohou hrát i biochemické hodnoty, například hladina onkomarkerů (AFP, beta-HCG a LDH) u germinálních nádorů (15) anebo hodnota kalcémie při diferenciální diagnóze mezi malobuněčným karcinomem hyperkalcemického typu a juvenilním typem nádoru z buněk granulózy (16). V našem centru jsme u pacientky s malobuněčným karcinomem hyperkalcemického typu pozorovali po odstranění nádoru dokonce přesmyk z hyperkalcémie do hypokalcémie, který byl detekován již během chirurgického výkonu na základě cíleného dotazu patologa při peroperační biopsii. Pro patologa naopak nemá výraznější význam hladina markeru CA 125, neboť k jeho elevaci může docházet i při nenádorových procesech (17,18) a ani k rozlišení primárních a metastatických karcinomů ovaria spolehlivě nepřispívá (19).
Makroskopické parametry
Unilateralita anebo bilateralita adnexálního procesu je nejen dalším údajem, který patolog při peroperační biopsii nezjistí jiným způsobem než komunikací s klinikem, ale též základním hodnoceným makroskopickým parametrem. Informace o lateralitě nabývá zásadního významu především u mucinózních nádorů ovaria, kde do diferenciální diagnózy vždy vstupuje možnost metastázy (4). Primární mucinózní karcinom ovaria je nádorem velmi vzácným (reprezentujícím okolo 3 % ovariálních karcinomů) (20) a v době záchytu je téměř vždy „low grade & low stage“ (jinými slovy unilaterální a bez peritoneálních metastáz), zatímco prakticky všechny agresivní mucinózní karcinomy diseminované v břišní dutině a postihující obě ovaria jsou extraovariálního původu (20,21). Také téměř všechny případy pseudomyxoma peritonei jsou nyní interpretovány jako extraovariální s primárním původem nejčastěji v apendixu (22-24). Při nepřítomnosti peritoneálního rozsevu mucinózního karcinomu a nálezu mucinózního nádoru v jednom anebo obou ovariích nutno nález posuzovat s přihlédnutím k velikosti ovarií. Za tímto účelem byl vyvinut diagnostický algoritmus, na jehož základě je bilaterální postižení ovarií jakéhokoliv rozměru považováno vždy za metastázy, unilaterální nádory menší než 10 cm jsou hodnoceny též jako metastázy a unilaterální nádory velikosti ≥ 10 cm jako léze primární (25-27). Alternativně byla jednou studií doporučena i hraniční velikost 13 cm (27). Jednoduchost tohoto algoritmu a důraz výlučně na makroskopické parametry ovariálních nádorů jej přímo předurčují k použití při peroperačním vyšetření (25). Pouze na podkladě makroskopických kritérií laterality a velikosti je možno správně interpretovat primární nebo metastatický původ mucinózního nádoru v 84 - 90 % případů (25,27). Výjimky samozřejmě existují a právě z nich se rekrutují zbývající léze, které se algoritmicky nepodařilo správně klasifikovat. Nelze například vyloučit vzácnou možnost vysoce agresivních primárních ovariálních mucinózních karcinomů s bilaterálním postižením ovarií a peritoneální diseminací (28,29), stejně tak ani unilaterální, velké a cysticky změněné metastázy, které se relativně nejčastěji doprovázejí pankreatobiliární, kolorektální a endocervikální adenokarcinomy (25-27,30-32). Další výjimkou je pseudomyxoma peritonei v asociaci s ovariálním teratomem (33,34). Pravidlo o lateralitě a velikosti též nelze vztáhnout na high grade serózní karcinomy (HGSC), neboť inherentní vlastností tohoto typu nádoru je časný rozsev v peritoneální dutině (20,35,36). Při aplikaci tohoto algoritmu plošně na všechny histologické typy ovariálních karcinomů jeho výkonnost klesá (37).
Ponecháme-li stranou význam velikosti ovariálního nádoru v diferenciální diagnóze primárních a metastatických procesů, mají rozměry postiženého ovaria samozřejmě vliv i na přesnost peroperační klasifikace primárních ovariálních lézí. Benigní výsledek peroperačního vyšetření u ovariálních nádorů velikosti ≥ 10 cm je méně spolehlivý a zatížený větší mírou falešné negativity než u nádorů menších než 10 cm (38,39). K tomuto typu chyby (sampling error) inklinují typicky mucinózní nádory ovaria (11,14,40,41), které mají tendenci dosahovat větších rozměrů než ostatní histologické typy (především HGSC), často jsou histologicky heterogenní a mohou tedy obsahovat více komponent od cystadenomu přes borderline nádor, intraepiteliální karcinom až po invazivní karcinom (22,42-44). Ve srovnání s benigními a maligními nádory jsou nižší diagnostickou přesností při peroperační diagnostice zatíženy i borderline nádory (9,39,45,46), z výše uvedených důvodů především mucinózní borderline nádory (11,45,47,48). Pro zpřesnění peroperační diagnózy je proto patologům doporučeno odebírat z postiženého ovaria 2-3 řezy z různých oblastí nádoru po pečlivém makroskopickém zhodnocení léze (2,3) anebo minimálně 1 tkáňový blok na každých 10 cm průměru nádoru (11). Onkogynekologové si jsou dobře vědomi rizika falešné negativity peroperační biopsie u mucinózních i borderline nádorů ovaria, a proto by je případné upřesnění diagnózy po definitivním vyšetření resekátu nemělo překvapit.
Při makroskopickém popisu peroperačního resekátu je nutno vzít v úvahu i vzhled povrchu ovaria. Primární ovariální mucinózní nádory včetně borderline nádorů jsou typicky hladkého povrchu, zatímco povrchové implantáty a depozita hlenu svědčí spíše pro metastatický proces (26). To je však charakteristické pro nádory porogenně se šířící v břišní dutině, například z oblasti apendixu. Při lymfogenní diseminaci karcinomu (nejčastější mechanismus propagace ze žaludku do ovaria) (49) anebo hematogenním šíření (typicky z mléčné žlázy) bývá povrch ovaria bez nádorové infiltrace (50-52), kterou lze v těchto případech očekávat primárně v oblasti hilu ovaria (26,51). Hladký povrch ovaria tedy metastatický původ nádoru jednoznačně nevylučuje (30). Nezbývá než znovu upozornit, že výše uvedená pravidla se opět z již popsaných důvodů nevztahují na HGSC.
Dalším makroskopicky hodnoceným parametrem je architektonika nádorové tkáně, kdy je nutno v sériových řezech resekátem posoudit proporcionální zastoupení cystické a solidní komponenty a popsat charakter vnitřní výstelky cyst s důrazem na přítomnost papilárních formací. Čistě cystické nádory s hladkou výstelkou jsou až na vzácné výjimky benigní (53), zatímco střídající se cystické a solidní partie a papilární proliferace jsou charakteristické spíše pro borderline nádory a karcinomy (3). Výlučně solidní architektonika nádoru však není typická pro primární ovariální karcinom a není ani jednoznačným dokladem malignity (3), neboť do diferenciální diagnózy je v tomto případě nutno zahrnout i širokou skupinu gonadostromálních nádorů různého biologického chování. Na základě proporcí cystické a solidní složky také není možno spolehlivě rozlišit primární ovariální nádor a metastázu (26). Metastázy karcinomů různých primárních zdrojů do ovaria mohou být pouze cystické, se střídajícími se cystickými a solidními úseky anebo naopak převážně solidní, jako je tomu například u tzv. Krukenbergova nádoru (49,52), který tím společně se svým hladkým povrchem může makroskopicky připomínat gonadostromální nádory (43). Poměrně charakteristickým znakem metastatického původu však bývá nodularita vyplývající z členění nádoru fibrózními septy, kterou lze pozorovat jak u solidních, tak i u cysticky utvářených metastáz (26).
Makroskopicky patrná nekróza nádorové tkáně svědčí pro maligní povahu procesu s výjimkou hemoragické nekrózy, která může doprovázet torzi adnex jako komplikaci benigních nádorů anebo nenádorových expanzivních procesů (54). Rozsah nekrózy signifikantně nepřispívá k odlišení primárních a metastatických ovariálních nádorů (26), nicméně mikroskopický vzhled a distribuce nekrotických ložisek pomoci může, jak bude diskutováno níže.
Makroskopické posouzení materiálu zaslaného k peroperačnímu vyšetření adnexálních expanzivních procesů je zcela zásadní pro ustanovení správné anebo alespoň co nejpřesnější provizorní histologické diagnózy, zvláště pokud je předmětem analýzy resekát celého ovaria a tuby (adnexektomie). Peroperační řezy by měly reprezentativně zastihovat nejsuspektnější partie nádoru (papilární formace v cystách a na povrchu ovaria, solidní úseky, prorůstání na povrch ovaria, infiltrace periovariálních struktur, ložiska v hilu a mezovariu, atd.) i za cenu odběru více tkáňových bloků (2,3,11). Zvýšenou pozornost je třeba věnovat rozpoznání metastáz a skupině mucinózních nádorů ovaria. Tabulka 1 znázorňuje mimo jiné i základní makroskopické znaky, na jejichž podkladě je možno odlišit primární ovariální mucinózní nádor od metastázy.
Tab. 1. Makroskopické a mikroskopické charakteristiky primárních a metastatických mucinózních karcinomů v ovariu. Obě skupiny parametrů lze poměrně spolehlivě hodnotit již peroperačně. 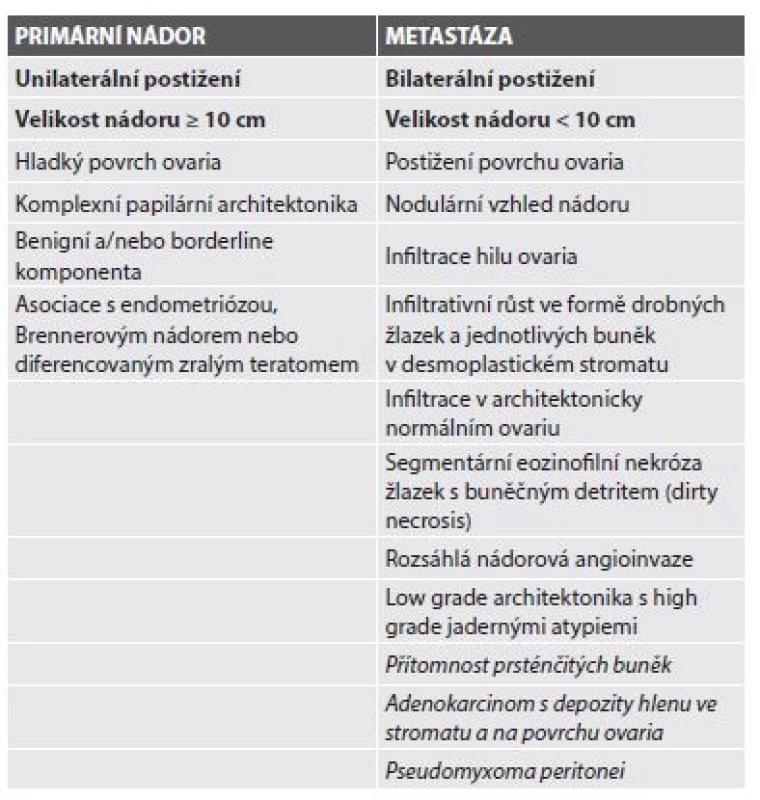
Základní makroskopické parametry jsou uvedeny tučně a nejsilnější známky metastatického původu nádoru jsou znázorněny kurzívou. Modifikováno dle Lee et al. (26) a Leen et al. (21). Mikroskopické parametry
Úspěšná mikroskopická peroperační analýza adnexální léze se vždy odvíjí z poctivě provedeného makroskopického vyhodnocení nálezu a cíleného odběru suspektních partií k histologickému vyšetření. Systematický popis jednotlivých diagnostických jednotek přesahuje rozsah této publikace, proto budou následující odstavce formulovány spíše jako poznámky a doporučení zaměřené na chronicky známé diferenciálně diagnostické problémy v peroperační interpretaci adnexálních procesů, mezi které spadá především identifikace a histologická klasifikace maligních nádorů, rozlišení borderline nádorů a karcinomů a rozpoznání metastatického postižení ovaria (4).
Ovariální nádory lze rozdělit do čtyř základních skupin: epitelové, gonadostromální, germinální a metastatické (55). Nejčastěji se patolog při peroperačním vyšetření setkává s epitelovými nádory, kdy je jeho primárním úkolem rozlišit adenomy, borderline nádory a karcinomy. V úvahu je přitom nutno vzít všechny možné diferenciační směry nádorových buněk (serózní, endometroidní, světlobuněčný, mucinózní, seromucinózní a brennerovský) (55). Obrázek 1 představuje pět nejběžnějších histologických kategorií ovariálních karcinomů, které jsou jednoznačně definovány jak morfologicky, tak i po molekulárně genetické stránce: HGSC, endometroidní karcinom, světlobuněčný karcinom, low grade serózní karcinom a mucinózní karcinom (35,36). Histologická typizace primárních karcinomů ovaria je často možná již peroperačně, nicméně postrádá zásadní význam pro rozhodování klinika o rozsahu operace. Závažnější chybou bývá záměna ovariálního karcinomu za nádor z jiné skupiny (gonadostromální, germinální nebo metastatický), neboť v tom případě se již rozsah operačního výkonu může lišit, zejména v provedení lymfadenektomie a omentektomie. Nejvyšší chybovostí je zatížena peroperační diagnostika světlobuněčného karcinomu ovaria, což je dáno širokým morfologickým spektrem tohoto typu nádoru (56,57). Typickým příkladem je záměna světlobuněčného karcinomu za HGSC (4,57). Méně známým faktem je riziko záměny světlobuněčného karcinomu za serózní borderline nádor, které hrozí především při suboptimálním makroskopickém zhodnocení léze a odběru nereprezentativních tkáňových bloků (obr. 2) (56,57). Do diferenciální diagnózy světlobuněčného karcinomu dále spadá nádor ze žloutkového váčku, dysgerminom, endometroidní karcinom se sekretorickými změnami a metastatický světlobuněčný karcinom z renálních buněk (57). Endometroidní karcinom ovaria může mimikovat gonadostromální nádor, zejména nádor z buněk granulózy adultního typu anebo nádory ze Sertoliho-Leydigových buněk (4,43). Spásou patologa pak v této situaci může být nález dlaždicobuněčné diferenciace svědčící pro karcinomový původ léze (4).
Obr. 1. Ukázky peroperačního a definitivního vyšetření pěti nejčastějších histologických typů ovariálních karcinomů.
A – high grade serózní karcinom (peroperační vyšetření, HE, 200x); B – high grade serózní karcinom (definitivní vyšetření, HE, 200x); C – endometroidní karcinom (peroperační vyšetření, HE, 200x); D – endometroidní karcinom (definitivní vyšetření, HE, 200x); E – světlobuněčný karcinom (peroperační vyšetření, HE, 200x); F – světlobuněčný karcinom (definitivní vyšetření, HE, 200x); G – low grade serózní karcinom (peroperační vyšetření, HE, 200x); H – low grade serózní karcinom (definitivní vyšetření, HE, 200x); CH – mucinózní karcinom (peroperační vyšetření, HE, 200x); I – mucinózní karcinom (definitivní vyšetření, HE, 200x)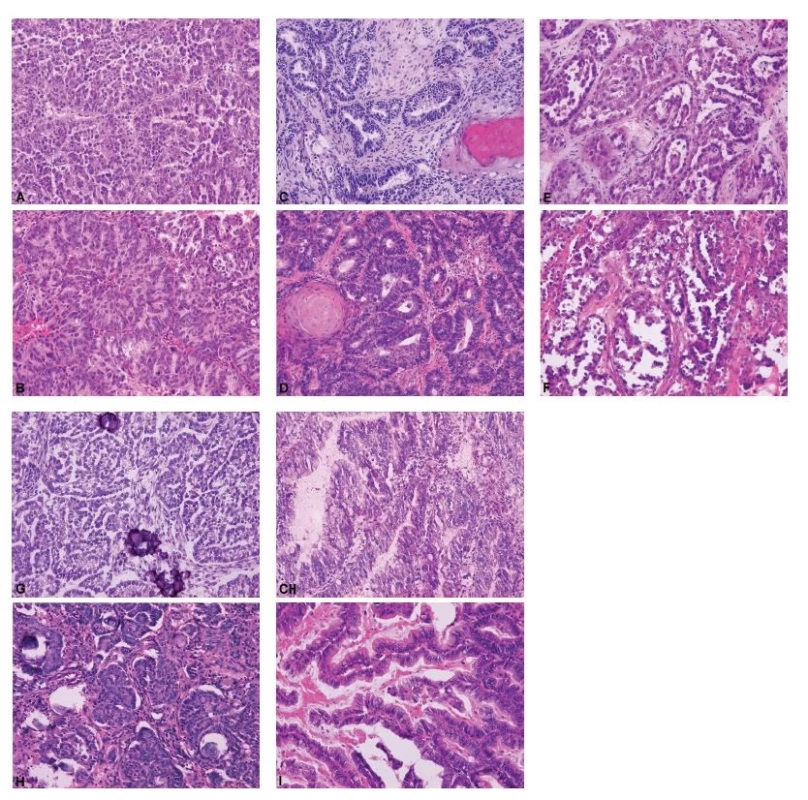
Obr. 2. Světlobuněčný karcinom ovaria mimikující v peroperačním vyšetření serózní borderline nádor. Makroskopicky byl nádor tvořen cystickou a solidní složkou. Z každé komponenty byl odebrán jeden řez k peroperačnímu vyšetření. Cystopapilární architektonika v cystické složce peroperačně připomíná serózní borderline nádor. Tubulocystická architektonika v solidní složce je peroperačně diagnostická pro světlobuněčný karcinom ovaria.
A – cystopapilární komponenta (peroperační vyšetření, HE, 100x); B – tubulocystická komponenta (peroperační vyšetření, HE, 100x); C – cystopapilární komponenta (definitivní vyšetření, stejný tkáňový blok jako v sub A, HE, 100x); D – tubulocystická komponenta (definitivní vyšetření, stejný tkáňový blok jako v sub B, HE, 100x); E – cystopapilární komponenta (definitivní vyšetření, jiný tkáňový blok než v sub A, HE, 100x); F – tubulocystická komponenta (definitivní vyšetření, jiný tkáňový blok než v sub B, HE, 100x)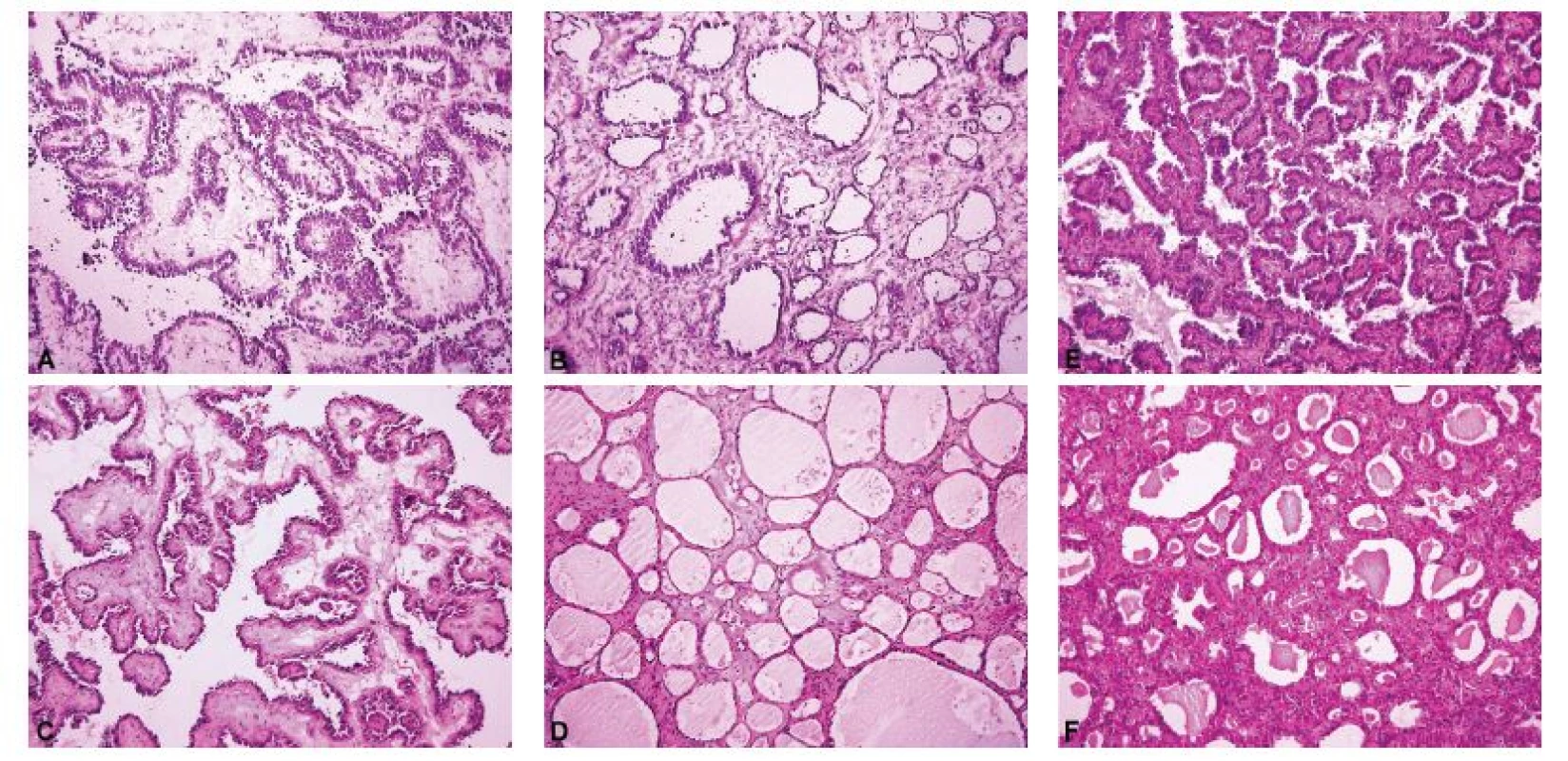
Diagnostické možnosti peroperační biopsie u gonadostromálních nádorů jsou omezené. Úkolem patologa je především identifikovat gonadostromální diferenciaci nádoru, vyloučit možnost Krukenbergova nádoru a odložit bližší klasifikaci až na definitivní vyšetření. Peroperačně by se patolog k biologickému chování gonadostromálních nádorů neměl vyjadřovat, což zásadně platí pro nádory z buněk granulózy a skupinu nádorů ze Sertoliho-Leydigových buněk, u kterých histologický vzhled nekoreluje s biologickým chováním (14). Peroperační diagnostika adultního nádoru z buněk granulózy je z důvodu jeho morfologické variability zatížena obdobnou mírou nespolehlivosti jako u borderline nádorů ovaria (58). Závažnější peroperační chybou může být záměna adultního nádoru z buněk granulózy za HGSC tranzicionálního vzhledu (59). Specifickou diferenciálně diagnostickou kapitolou jsou fascikulárně stavěné ovariální nádory, ze kterých se rekrutují gonadostromální léze od fibromu, celulárního fibromu a fibrosarkomu, přes sarkomatoidní variantu adultního nádoru z buněk granulózy až po vzácné mezenchymální jednotky typu leiomyomu a leiomyosarkomu (60) (obr. 3).
Obr. 3. Fascikulárně stavěné gonadostromální a mezenchymální nádory ovaria jako diferenciálně diagnostický problém při peroperačním vyšetření.
A – celulární fibrom (peroperační vyšetření, HE, 200x); B – celulární fibrom (definitivní vyšetření, HE, 200x); C – nádor z buněk granulózy, adultní typ, sarkomatoidní varianta (peroperační vyšetření, HE, 200x); D – nádor z buněk granulózy, adultní typ, sarkomatoidní varianta (definitivní vyšetření, HE, 200x); E – leiomyom (peroperační vyšetření, HE, 200x); F – leiomyom (definitivní vyšetření, HE, 200x); G – leiomyosarkom (peroperační vyšetření, HE, 200x); H – leiomyosarkom (definitivní vyšetření, HE, 200x)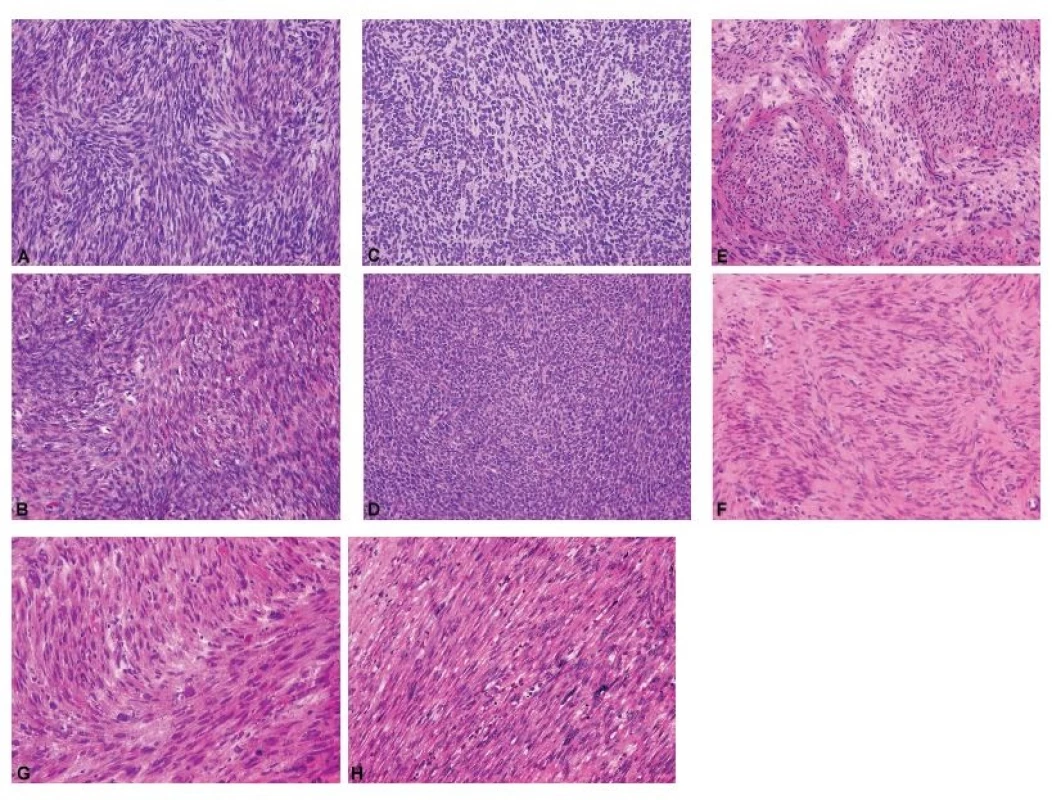
Při peroperační biopsii germinálních nádorů je třeba mít opět na paměti, že jde často o nádory smíšené a zmrazený řez tedy nemusí být zcela reprezentativní (14). Poměrně přímočará bývá diagnóza cystického diferencovaného zralého teratomu, často již na podkladě typického makroskopického vzhledu, nicméně při jeho sekundární malignizaci se v solidních partiích nádoru může skrývat nejčastěji dlaždicobuněčný karcinom (61). Monodermální teratom typu struma ovarii má makroskopický vzhled hyperplastického uzlu štítné žlázy a tomu odpovídá i jeho charakteristická histologická stavba (obr. 4). Jinou modelovou situací je peroperační odlišení dysgerminomu (obr. 4) a velkobuněčného lymfomu (4,14) anebo nádoru ze žloutkového váčku a juvenilního nádoru z buněk granulózy (4). Další příklady peroperačního vyšetření nádorů různé histogeneze dokládá též Obrázek 4.
Obr. 4. Spektrum peroperačních nálezů ovariálních nádorů různé histogeneze a biologického chování.
A – Brennerův nádor (peroperační vyšetření, HE, 200x); B – Brennerův nádor (definitivní vyšetření, HE, 200x); C – monodermální teratom (struma ovarii) (peroperační vyšetření, HE, 200x); D – monodermální teratom (struma ovarii) (definitivní vyšetření, HE, 200x); E – dysgerminom (peroperační vyšetření, HE, 200x); F – dysgerminom (definitivní vyšetření, HE, 200x); G – maligní smíšený Mülleriánský nádor (karcinosarkom) s rhabdomyoblastickou komponentou (peroperační vyšetření, HE, 200x); H – maligní smíšený Mülleriánský nádor (karcinosarkom) s rhabdomyoblastickou komponentou (definitivní vyšetření, HE, 200x)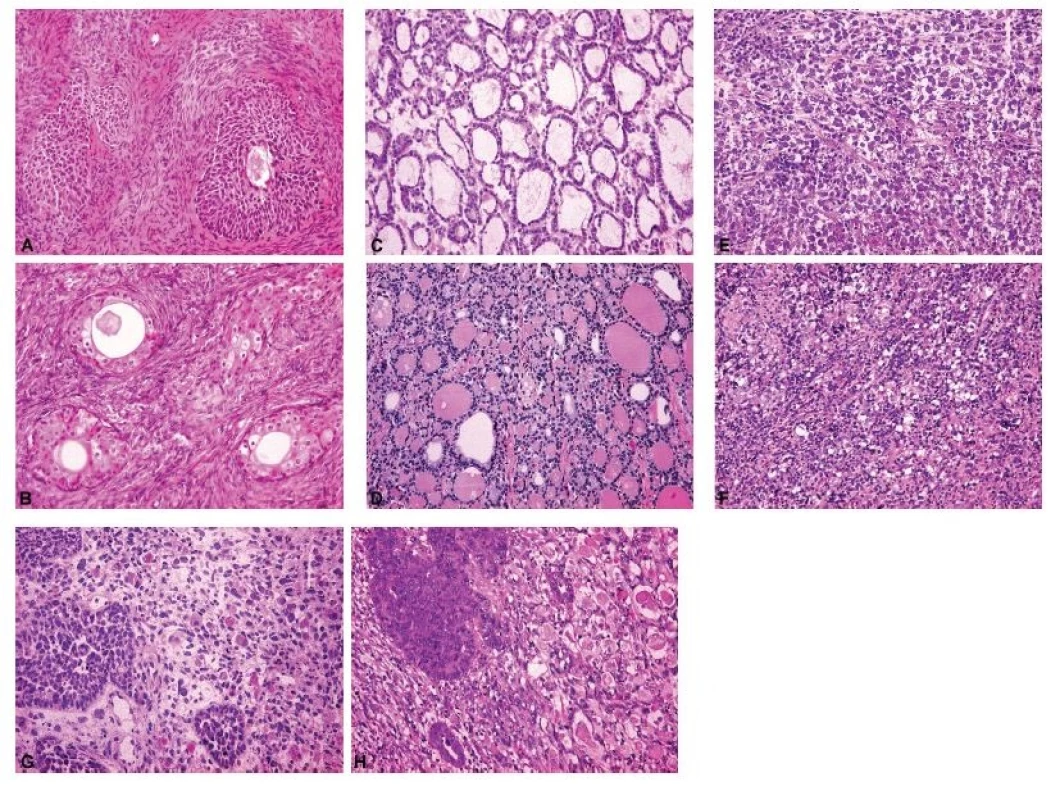
Peroperační odlišení borderline nádoru od karcinomu patří mezi obtížnější úkoly patologa (4,14), zároveň je ale zásadní z hlediska možnosti redukovat rozsah chirurgického resekčního výkonu anebo zachovat fertilitu pacientky (62). Při peroperační biopsii je nutno posoudit architektoniku léze a cíleně pátrat po ložiscích invazivního růstu, která lze nejčastěji zachytit v solidních partiích nádoru (4,14). Hodnocení cytologických atypií může být zavádějící vzhledem k výskytu artefaktů ve zmrazených řezech, a proto by samo o sobě nemělo být podkladem pro diagnózu karcinomu, s výjimkou nádorů se zcela jednoznačnými atypiemi vysokého stupně (4). V těchto případech může diagnózu karcinomu podpořit přítomnost mitotické aktivity anebo atypických mitóz. Obrázek 5 dokládá příklad HGSC, který peroperačně imituje serózní borderline nádor. Pokud při peroperační biopsii přetrvává diagnostická nejistota mezi borderline nádorem a karcinomem, je nejvhodnějším řešením použít termín „přinejmenším borderline nádor“ (4,14,47) a prodiskutovat situaci s klinikem, který zvolí odpovídající postup dle jemu známých faktů (věk pacientky, zachování fertility, riziko dalších operačních výkonů, atd.). Obdobná situace může nastat v případě výskytu architektonických a cytologických atypií v nádoru jinak převážně benigního vzhledu, kdy je nutno diagnózu odložit na definitivní vyšetření, nicméně operatér musí být upozorněn na suspektní nález nejlépe formulací „nelze vyloučit borderline nádor“. V takové situaci klinik může přistoupit k chirurgickému stagingu (včetně omentektomie a apendektomie), aby ušetřil pacientku případné následné operace. Z již popsaných důvodů bývají tradičně největším diagnostickým problémem mucinózní borderline nádory (11,45,47,48) a z této skupiny se také rekrutuje nejvíc nádorů, u nichž byla po definitivním vyšetření změněna peroperační diagnóza (63).
Obr. 5. High grade serózní karcinom ovaria mimikující v peroperačním vyšetření serózní borderline nádor. Zorná pole A, B a C pocházejí z prvního tkáňového bloku, druhý tkáňový blok byl peroperačně přikrojen k upřesnění diagnózy po záchytu cytologických atypií v zorném poli C.
A – cystopapilární architektonika typická pro serózní borderline nádor (peroperační vyšetření, HE, 100x); B – nádorové buňky s minimálními atypiemi konzistentní s diagnózou serózního borderline nádoru (peroperační vyšetření, HE, 200x); C – nádorové buňky s atypiemi vyššího stupně, nález již není konzistentní s diagnózou serózního borderline nádoru (peroperační vyšetření, HE, 200x); D – mitoticky aktivní atypické nádorové buňky proliferující za tvorby tzv. „slit-like spaces“, nález je peroperačně diagnostický pro high grade serózní karcinom (peroperační vyšetření, HE, 200x)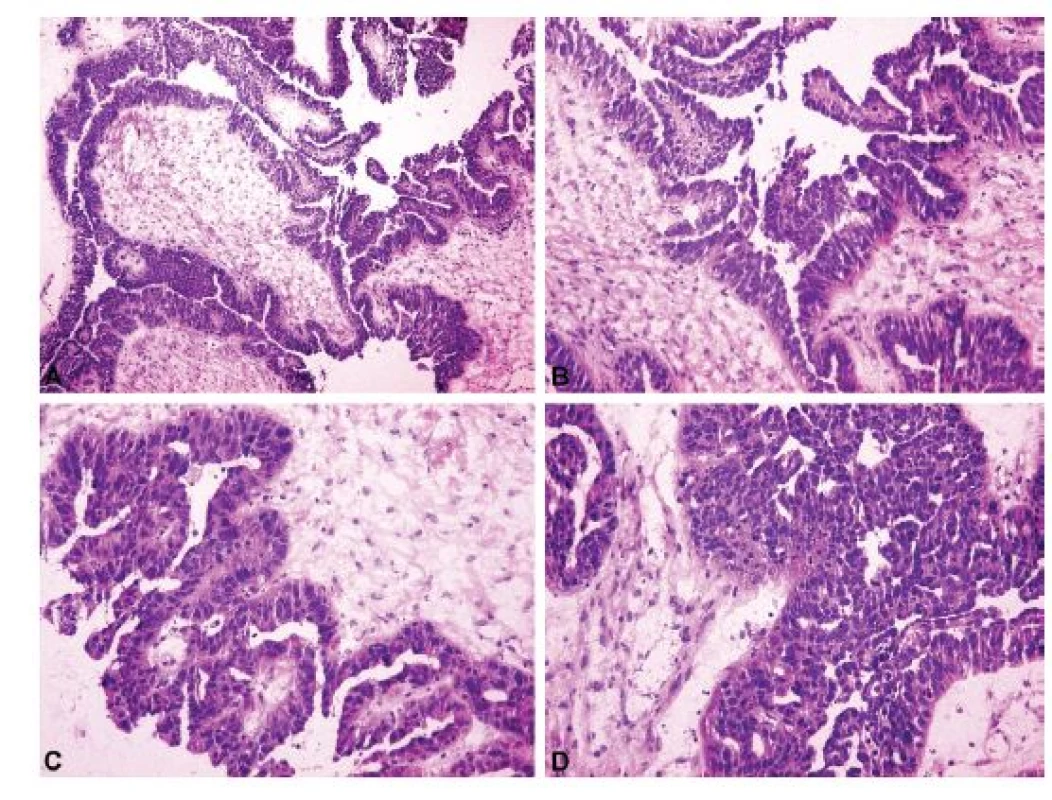
Identifikace mucinózní diferenciace, endometroidní vzhled anebo architektonika netypická pro primární ovariální nádor musí nutně vést k nastolení otázky možného metastatického původu (4,7), v sestupné frekvenci především z gastrointestinálního traktu (žaludek, tlusté střevo), pankreatobiliární oblasti, děložního hrdla, mléčné žlázy a děložního těla (64). Příklady ovariálních metastáz z různých primárních lokalizací uvádí Obrázek 6. Kromě již diskutovaných makroskopických kritérií mohou metastatický původ karcinomu naznačovat i určité histologické charakteristiky (Tabulka 1). Mezi nejsilnější známky metastatického původu nádoru patří přítomnost prsténčitých buněk, extenzivní hlenotvorba s jezírky hlenu ve stromatu a na povrchu ovaria a asociace s pseudomyxoma peritonei (4,21,26). Prsténčité buňky u Krukenbergova nádoru mohou být ve zmrazených řezech přehlédnuty a vzhledem k fibroblastickému stromatu lze nález chybně interpretovat jako gonadostromální nádor (14). Výjimečně se lze setkat s primárními ovariálními nádory s prsténčitými buňkami, většinou však jde o komplexní epitelové nádory s komponentou adenofibromu, jejíž přítomnost indikuje primární ovariální původ (26,65,66), vzácněji pak o světlobuněčný karcinom (43). Postižení povrchu ovaria, nodulární architektonika a infiltrace hilu ovaria a mezovaria s relativním zachováním zbylé ovariální tkáně již byly diskutovány v sekci týkající se makroskopických znaků ovariálních metastáz, nicméně jsou samozřejmě patrné i při mikroskopickém vyšetření (4,21,26). Rozsáhlá nádorová angioinvaze, šíření nádoru ve formě drobných žlazek v desmoplastickém stromatu a tendence k disociaci svědčí též pro metastatický původ, zatímco asociace s benigním anebo borderline nádorem, endometriózou, Brennerovým nádorem nebo diferencovaným zralým teratomem jsou známky primárního nádoru (4,21,26). Komplexní papilární architektonika nádoru je též typická spíše pro primární nádory, nelze ji ale vyloučit ani u některých metastáz (21,26,31,43). Metastatický karcinom tlustého střeva může histologicky připomínat primární nebo metastatický endometroidní karcinom ovaria (pseudoendometroidní vzhled) (67), avšak jeho poměrně silným diagnostickým znakem je segmentární eozinofilní nekróza žlazek s buněčným detritem (tzv. „dirty necrosis“) (21,30,67,68), která mnohdy umožní správnou diagnózu již peroperačně. Buněčný detritus v lumen žlazek bez jednoznačné nekrózy (obr. 6) není sám o sobě diagnostický pro metastázu, neboť se může vyskytovat v endometroidních a mucinózních karcinomech ovaria a mucinózních borderline nádorech s intraepiteliálním karcinomem. Dlaždicobuněčná diferenciace naopak svědčí pro endometroidní karcinom a prakticky vylučuje metastatický kolorektální karcinom (4). Zajímavým fenoménem metastáz především z pankreatobiliární oblasti a v menší míře i z tlustého střeva je paradoxní maturace, kdy nabývají nádorové buňky schopnosti vyzrávat a ztrácet cytologické atypie. Bohužel bývají metastázy z této lokalizace často velké a cysticky utvářené, což vede k věrné simulaci primárních ovariálních mucinózních nádorů v celém spektru biologického chování od adenomu, přes borderline nádor až ke karcinomu (30,31,43,69). Patolog by tedy při peroperační diagnóze mucinózního nádoru jakéhokoliv stupně biologického chování (včetně adenomu a borderline nádoru) neměl nikdy zapomínat na možnost metastázy, i když léze nejeví jednoznačné známky malignity (obr. 7). I z tohoto důvodu používáme v tomto přehledovém článku v kontextu diferenciální diagnózy mezi primárním mucinózním ovariálním nádorem a metastázou obecný termín „mucinózní nádor ovaria“. Diskrepance mezi low grade architektonikou nádoru a high grade jadernými atypiemi je další známkou metastatického původu, kterou vykazují opět nejčastěji karcinomy pankreatobiliární oblasti, vzácněji pak karcinom kolorektální (4,43,68). Peroperační rozpoznání metastáz z vnitřního nebo zevního genitálu je značně obtížné a zejména v případě adenokarcinomů korporálního endometria a děložního hrdla až prakticky nemožné. Metastatické endocervikální adenokarcinomy mohou podobně jako pankreatobiliární a kolorektální karcinomy věrně mimikovat primární ovariální borderline nádory a karcinomy (32).
Obr. 6. Široké morfologické spektrum metastatických karcinomů do ovaria.
A – metastatický špatně kohezivní adenokarcinom žaludku s výraznou extracelulární hlenotvorbou a stromálními jezírky hlenu (Krukenbergův nádor) (peroperačně hlášeno jako metastatický adenokarcinom nejspíše z gastrointestinálního traktu) (peroperační vyšetření, HE, 200x); B – metastatický špatně kohezivní adenokarcinom žaludku s výraznou extracelulární hlenotvorbou a stromálními jezírky hlenu (Krukenbergův nádor) (definitivní vyšetření, HE, 200x); C – metastatický adenokarcinom tlustého střeva (peroperačně hlášeno jako vysoce suspektní metastatický adenokarcinom nejspíše z tlustého střeva, nicméně diferenciálně diagnosticky nelze jednoznačně vyloučit primární nebo metastatický endometroidní karcinom) (peroperační vyšetření, HE, 200x); D – metastatický adenokarcinom tlustého střeva (definitivní vyšetření, HE, 200x); E – metastatický lobulární karcinom mléčné žlázy (peroperačně hlášeno jako metastatický adenokarcinom nejspíše z mléčné žlázy anebo z gastrointestinálního traktu) (peroperační vyšetření, HE, 200x); F – metastatický lobulární karcinom mléčné žlázy (definitivní vyšetření, HE, 200x)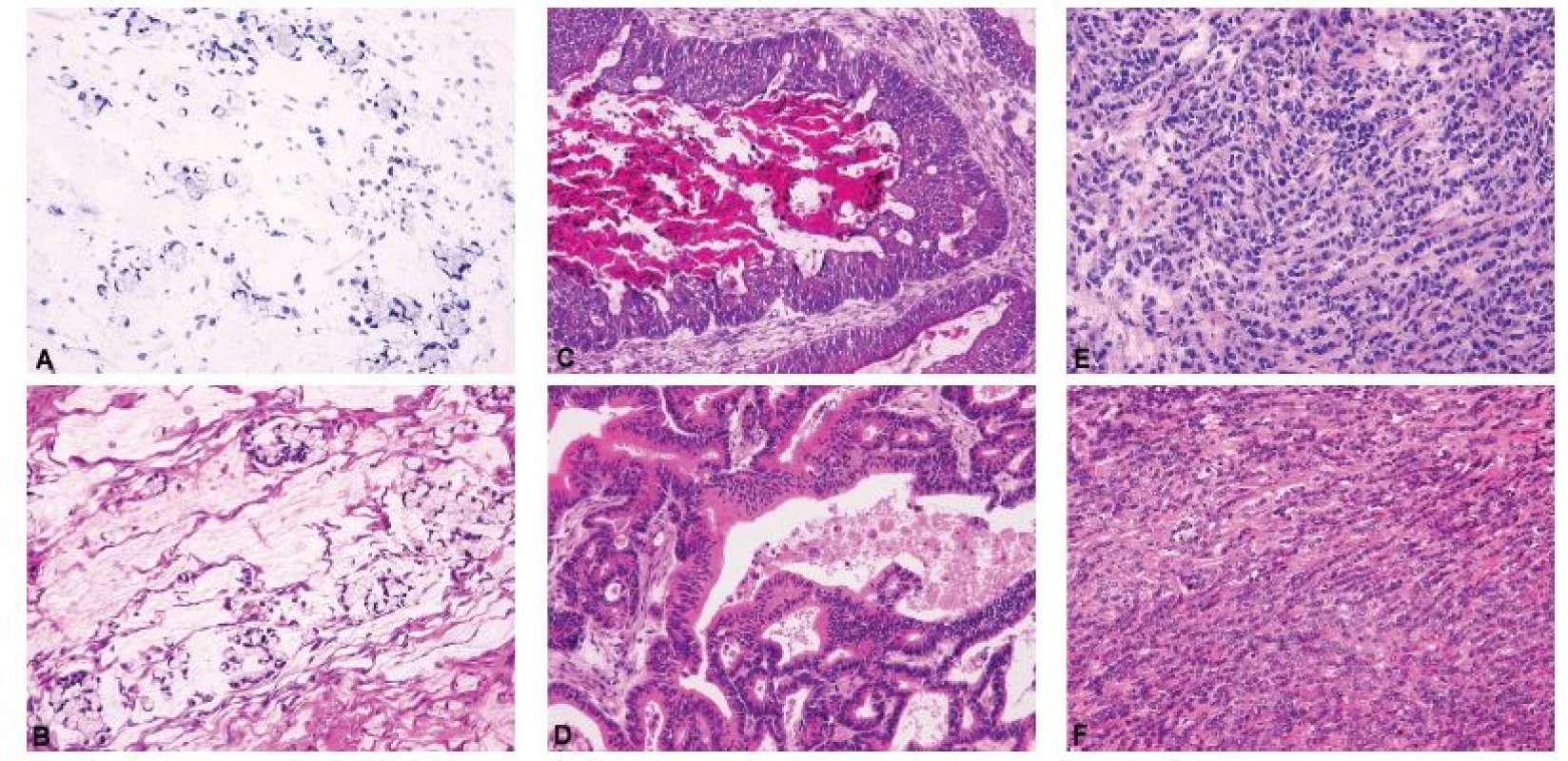
Obr. 7. Metastatický adenokarcinom pankreatu demonstrující znaky typické pro metastázy mucinózních adenokarcinomů do ovaria.
A – acelulární stromální jezírka hlenu v ovariu (pseudomyxoma ovarii), shodný nález ve dvou peroperačně vyšetřených tkáňových blocích (peroperačně hlášeno jako diseminace extraovariálního mucinózního nádoru) (peroperační vyšetření, HE, 100x); B – acelulární stromální jezírka hlenu v blízkosti nádorového proliferujího mucinózního epitelu (definitivní vyšetření, HE, 100x); C – cystopapilární komponenta nádoru mimikující mucinózní borderline nádor ovaria (paradoxní maturace) (definitivní vyšetření, HE, 200x); D – disociace nádorových buněk do stromatu (definitivní vyšetření, HE, 200x); E – cystopapilární komponenta nádoru mimikující mucinózní cystadenom ovaria (paradoxní maturace) (definitivní vyšetření, HE, 200x); F – acelulární depozita hlenu na povrchu ovaria (pseudomyxoma ovarii) (definitivní vyšetření, HE, 100x)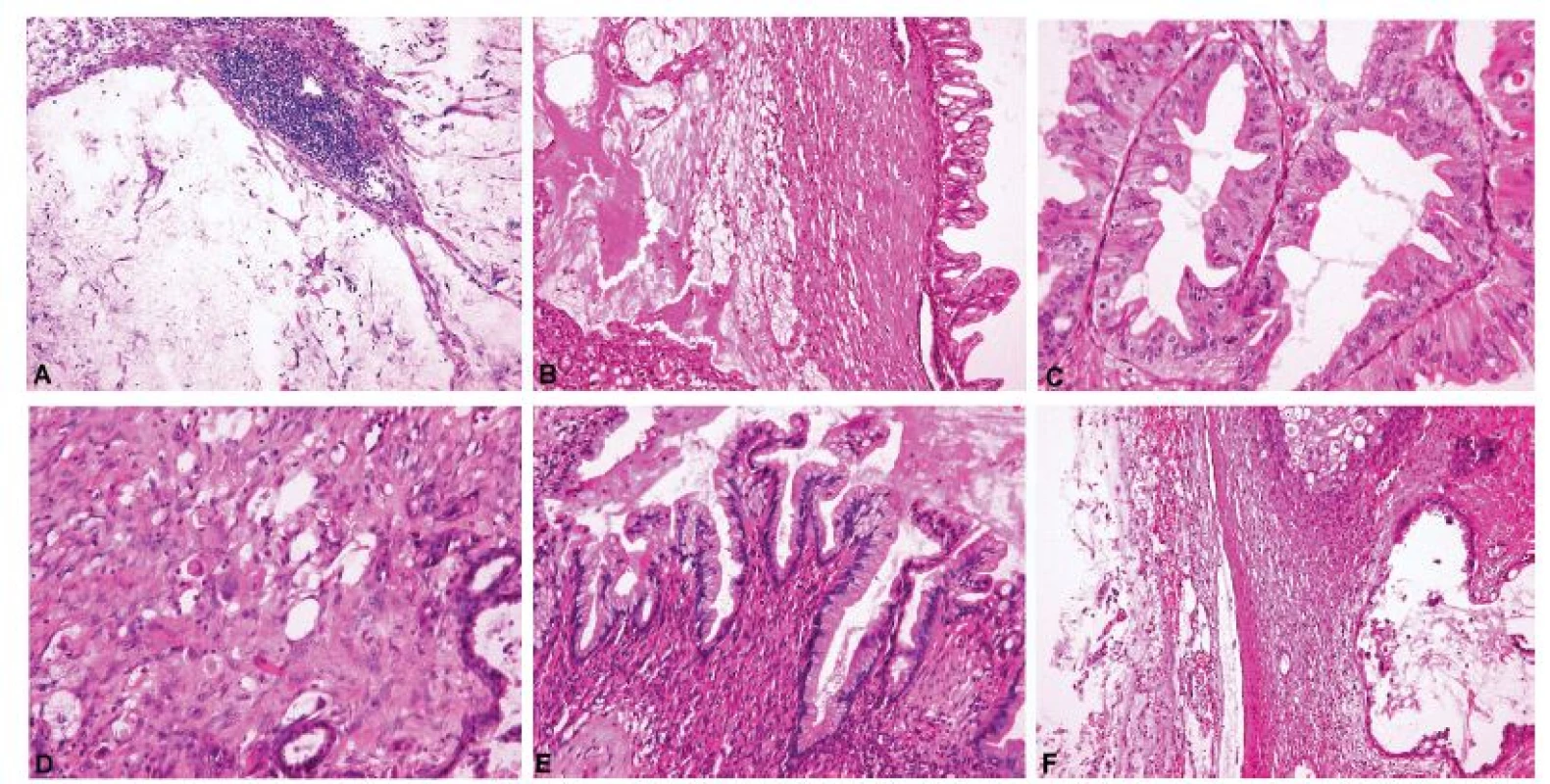
Při podezření na ovariální metastázu je úkolem operatéra zrevidovat možná místa primárního zdroje nádoru, především žaludek, tlusté střevo, vnitřní genitál a pankreatobiliární oblast, která však bývá při gynekologických operacích obtížně dostupná vizuální kontrole, a proto se klinik musí většinou spokojit s palpačním vyšetřením (64). Při neúspěchu se operace ukončí a po primárním ložisku se pátrá pomocí gastroskopie, kolonoskopie a zobrazovacích vyšetření včetně mamografie (64). Při mucinózní diferenciaci suspektní ovariální metastázy je nutno věnovat zvýšenou pozornost apendixu. Makroskopicky změněný apendix a/nebo přítomnost pseudomyxoma peritonei jsou jednoznačnou indikací k apendektomii. Resekci apendixu doporučujeme provést i v případě makroskopicky normálního vzhledu, ačkoliv není pravděpodobnost okultního primárního nádoru v apendixu vysoká. Nicméně jde o chirurgický výkon s minimální přidanou operační zátěží a pooperačním rizikem pro pacientku, která aktuálně podstupuje břišní operaci (70-72). Navíc je apendektomie součástí platných doporučených postupů léčby časných i pokročilých stádií primárního ovariálního karcinomu (1) a v případě pochybnosti o primárním nebo sekundárním původu nádoru by měla být indikována. Většina onkogynekologů se shoduje, že odstranění makroskopicky nezměněného apendixu není nutné u mucinózních cystadenomů a borderline nádorů, u nichž není suspekce na metastatický původ (72-75).
Nádory ovaria jsou jako bonboniéra, nikdy nevíš, jaký kousek si vytáhneš.
(Forrest Gump, gynekopatolog)
PEROPERAČNÍ VYŠETŘENÍ KARCINOMŮ KORPORÁLNÍHO ENDOMETRIA
Součástí kompletního chirurgického stagingu karcinomu korporálního endometria je pánevní případně i paraaortální lymfadenektomie (76), která však může být doprovázena signifikantní pooperační morbiditou (77,78). Z onkologického hlediska lze endometriální karcinomy na základě histologického typu, stupně diferenciace, hloubky invaze a dalších parametrů rozdělit do dvou základních skupin – nízce rizikové (low grade endometroidní a mucinózní karcinom (grade 1-2), invaze méně než do poloviny šíře myometria, nádor lokalizovaný na dělohu, bez infiltrace stromatu děložního hrdla) a vysoce rizikové (high grade endometroidní karcinom (grade 3), serózní karcinom, světlobuněčný karcinom, maligní smíšený Mülleriánský nádor (karcinosarkom), smíšené a nediferencované karcinomy, invaze minimálně do poloviny šíře myometria, infiltrace stromatu děložního hrdla, infiltrace adnex) (76,79). Vysoce rizikové parametry jsou spojeny s častějším výskytem metastáz v lymfatických uzlinách (80-82), zatímco při jejich nepřítomnosti je frekvence extrauterinní diseminace nádoru minimální (83). Z těchto důvodů je u pacientek s vysoce rizikovým endometriálním karcinomem standardně prováděn kompletní chirurgický staging s lymfadenektomií (84). Názory na nutnost lymfadenektomie u nízce rizikového endometriálního karcinomu se však liší (78,85-90). U serózního a světlobuněčného karcinomu je také indikována omentektomie, apendektomie a laváž břišní dutiny.
Stratifikace pacientek do rizikových skupin se provádí již předoperačně na základě fyzikálního vyšetření, zobrazovacích metod a diagnostické kyretáže (82,91). V nejasných případech může být indikováno peroperační vyšetření resekátu dělohy a úkolem patologa je identifikovat vysoce rizikové pacientky na podkladě orientačního hodnocení základních nádorových parametrů – histologický typ, stupeň diferenciace, hloubka invaze, infiltrace stromatu děložního hrdla a postižení adnexálních struktur (3,4,14). Resekát by měl být důkladně makroskopicky zhodnocen v sériových řezech k identifikaci místa nejhlubší myometrální invaze. V ideálním případě by měla být v jednom nebo více zmrazených řezech histologicky vyšetřena celá šíře postižené stěny dělohy zahrnující endometrium, myometrium a serózu, včetně přilehlé nepostižené endomyometrální junkce (3). Suspektní infiltrace děložního hrdla a adnexální léze by měly být též histologicky zpracovány (3).
Stupeň diferenciace nádoru je parametr s nejvyšší mírou neshody mezi peroperačním a definitivním vyšetřením karcinomu korporálního endometria (92). Nejčastěji je grade nádoru při peroperačním vyšetření podhodnocený (92). Hloubka myometrální invaze bývá peroperačně interpretována přesněji se shodou až 95 % s definitivním vyšetřením (3). Často lze rozsah myoinvaze rozpoznat již makroskopicky, nicméně spolehlivost hodnocení invaze prostým okem signifikantně klesá se snižujícím se stupněm diferenciace nádoru, proto je zmrazený řez doporučováno provést v každém případě (93).
Peroperační typing, grading a staging karcinomu korporálního endometria není standardně prováděná procedura a názory na její efektivitu se značně rozcházejí. Dle nedávného dotazníkového průzkumu tuto metodiku pro indikaci lymfadenektomie nepoužívá více než polovina onkogynekologů (94). Vynikající zkušenosti některých pracovišť popisující optimální korelaci peroperačních a definitivních vyšetření (81,82,91,92) jsou prakticky vyváženy negativními zprávami dalších autorů, kteří naopak uvádějí signifikantní míru neshody (79,86,87,95,96). Tato variabilita bývá nejčastěji způsobena již zmíněným podhodnocením stupně diferenciace nádoru nebo hloubky myoinvaze v peroperačních vyšetřeních, což pro pacientku může v konečném důsledku znamenat další operační zátěž nebo extenzivnější použití radioterapie s rizikem zvýšené morbidity (83,84).
PEROPERAČNÍ VYŠETŘENÍ CHIRURGICKÝCH RESEKČNÍCH OKRAJŮ DĚLOŽNÍHO HRDLA
Histologické vyšetření chirurgických resekčních okrajů nebývá příliš častou indikací k peroperační biopsii při gynekologických operacích. Specifickou kapitolu představuje peroperační vyšetření endocervikálního chirurgického okraje děložního hrdla při fertilitu zachovávajících a méně radikálních operacích pro karcinom diagnostikovaný v časném stádiu. Prvním prakticky používaným fertilitu šetřícím chirurgickým výkonem byla vaginální radikální trachelektomie (97) následovaná abdominální radikální trachelektomií (98). Rozsah chirurgických výkonů lze u nádorů minimální velikosti pomocí vyšetření sentinelové lymfatické uzliny omezit ještě ve větší míře až na simplexní trachelektomii nebo pouhou konizaci (99,100). Cílem alternativních chirurgických postupů je minimalizace recidivy nádoru (onkologické výsledky) při zachování možnosti úspěšně završené gravidity (těhotenské výsledky). Toho lze docílit optimálním rozsahem resekce děložního hrdla, která bude dostatečná z onkologického hlediska a zároveň ponechá přiměřenou rezervu cervikální tkáně k zajištění případné gravidity. Přítomnost nádorového rezidua v děložním hrdle je jedním z nejdůležitějších faktorů vedoucích k recidivě nádoru a nutnosti aplikovat adjuvantní onkologickou terapii (101). Z těchto důvodů indikuje část onkogynekologů peroperační biopsii k ověření stavu endocervikálního chirurgického okraje resekátu děložního hrdla při abdominální radikální trachelektomii (101,102) nebo vaginální radikální trachelektomii (103,104). Pro tyto účely neexistuje jednotný histopatologický protokol (101). Část pracovišť zpracovává peroperačně tranverzální řez děložním hrdlem (97), další preferují řez longitudinální (105). Ostatní pracoviště kombinují obě roviny řezu (101,102,104), longitudinální řez je však někde prováděn pouze v případě makroskopicky patrného nádoru (104). Za bezpečnou vzdálenost invazivního nádoru nebo in situ léze od endocervikálního chirurgického resekčního okraje je považováno 5-10 mm (97,104). Při interpretaci peroperační biopsie z děložního hrdla je nutno dbát zvýšené opatrnosti především u glandulárních lézí, neboť odlišení endocervikálních adenokarcinomů a jejich prekurzorů od benigních proliferací metaplastického a reaktivního charakteru může být ve zmrazených řezech značně problematické (102). Nejčastěji dochází k záměně tubární metaplázie, tuboendometroidní metaplázie a atypické tubární metaplázie za adenokarcinom in situ (102). Některé onkogynekologické týmy využívají peroperační biopsii i k ověření stavu endocervikálního chirurgického resekčního okraje u konizátů s prekancerózními lézemi, nicméně tato metodika nedosáhla širšího využití (106,107). Peroperační vyšetření celých konizátů a dalších diagnostických odběrů z děložního hrdla není obecně doporučováno (4), i když je na některých zahraničních pracovištích prováděno (108).
PEROPERAČNÍ VYŠETŘENÍ SENTINELOVÉ LYMFATICKÉ UZLINY
Sentinelová lymfatická uzlina (SLN) je definována jako první uzlina v přímé lymfatické drenáži primárního nádoru. Nádorové postižení sentinelové lymfatické uzliny koreluje se stavem lymfatických uzlin ve vyšších etážích, jak již bylo prokázáno u různých nádorů v odlišných anatomických lokalizacích – především u melanomu (109), karcinomů mléčné žlázy (110,111) a karcinomů dolního ženského pohlavního systému (112-114) a vnitřního genitálu (115). Na základě velikosti nádorového ložiska v SLN lze nález klasifikovat jako makrometastázu (> 2 mm), mikrometastázu (0,2 – 2 mm) a izolovanou skupinu nádorových buněk (ITC; ≤ 0,2 mm)(obr. 8). Zatímco histopatologické vyšetření SLN fixované ve formolu a zalité v parafínu, eventuálně s ultramikrostagingem a imunohistochemickým vyšetřením, je dnes již standardním diagnostickým postupem, peroperační vyšetření SLN je dosud metodou experimentální. Z chirurgického hlediska je u pacientek s gynekologickými nádory detekce SLN pomocí Patentové modři, radiokoloidu technecia (99mTc) anebo jejich kombinací vysoce spolehlivá (116-118). Nicméně peroperační histologické zpracování SLN není univerzálně přijímáno z důvodu nižší senzitivity a vyššího rizika falešné negativity především při detekci malých nádorových ložisek charakteru mikrometastáz a ITC (119-121), což vyplývá nejen z limitovaných možností prokrájení lymfatické uzliny při peroperačním histopatologickém protokolu, ale i ze ztráty materiálu pro následné definitivní zpracování. Přístup k peroperační biopsii SLN se tedy mezi jednotlivými onkogynekologickými centry liší. Peroperační vyšetření SLN je na některých pracovištích indikováno například při fertilitu šetřících a méně radikálních operacích pro karcinomy děložního hrdla (99,122), kdy stav SLN rozhodne o provedení radikální hysterektomie anebo méně agresivního chirurgického výkonu. V takovém případě lze při negativitě SLN dělohu ušetřit a provést pouze simplexní trachelektomii, případně rozšířenou konizaci, anebo výkon limitovat na simplexní hysterektomii s omezenou resekcí parametrií, která je jinak spojena se signifikantní pooperační morbiditou.
Obr. 8. Nádorové postižení lymfatických uzlin u pacientky s adenoskvamózním karcinomem děložního hrdla. V každé ze 3 nalezených SLN byl peroperačně zastižen jiný typ nádorového depozita.
A – SLN č. 1 – makrometastáza viditelná prostým okem při makroskopickém hodnocení resekátu, průměr 6 mm (peroperační vyšetření, HE, 20x); B – SLN č. 2 – mikrometastáza, průměr 1,8 mm (peroperační vyšetření, HE, 40x); C – SLN č. 2 – mikrometastáza, průměr 0,3 mm (peroperační vyšetření, HE, 100x); D – SLN č. 3 – ITC, průměr 0,05 mm (peroperační vyšetření, HE, 100x a 400x).
SLN – sentinelová lymfatická uzlina, ITC – izolované nádorové buňky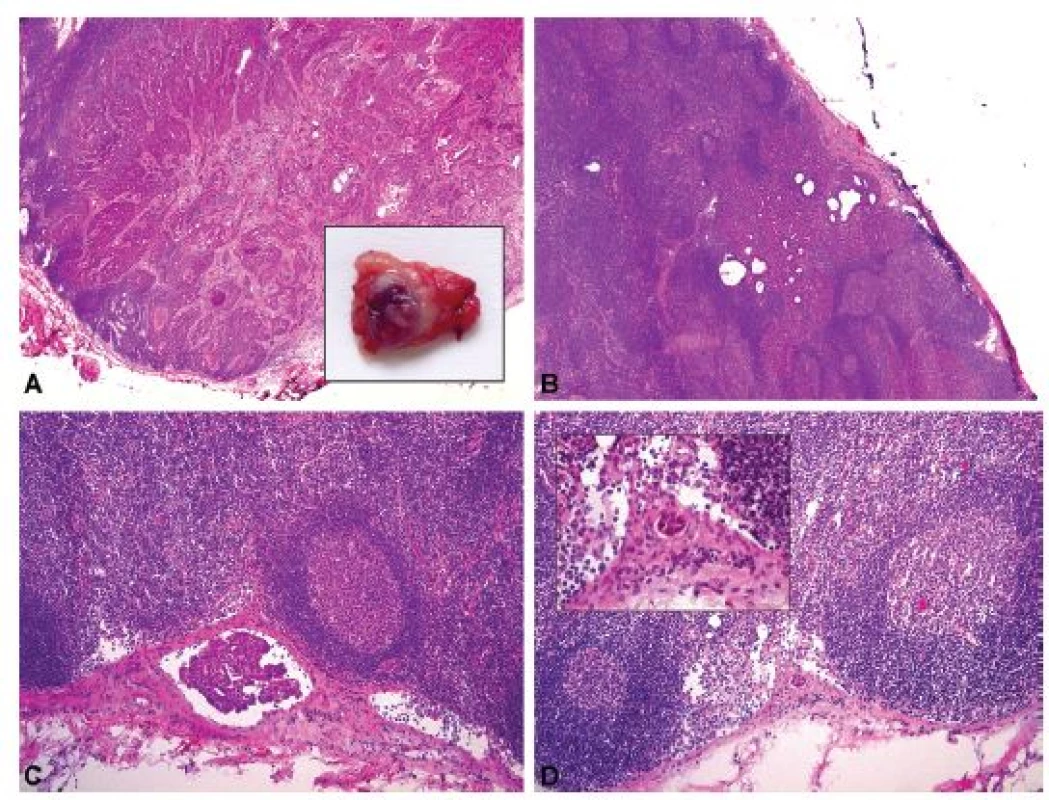
ZÁVĚR
Správně indikovaná peroperační biopsie je pro onkogynekologa neocenitelným pomocníkem v rozhodovacím procesu probíhajícím přímo na operačním sále. Nezastupitelnou úlohu má především v diferenciální diagnóze expanzivních adnexálních procesů s důrazem kladeným na identifikaci a typizaci maligních nádorů, rozlišení borderline nádorů a karcinomů a rozpoznání metastatického postižení ovaria. Dále může být využita ke stratifikaci pacientek s karcinomem korporálního endometria do rizikových skupin na základě peroperačního typingu, gradingu a stagingu, hodnocení stavu endocervikálního chirurgického okraje děložního hrdla a detekci nádorového postižení lymfatických uzlin včetně sentinelových lymfatických uzlin. Pro správnou interpretaci peroperačního vyšetření musí vzít patolog v úvahu klinicky relevantní údaje o pacientce, makroskopické charakteristicky zaslaného materiálu, histologický vzhled a v neposlední řadě musí aktivně komunikovat s klinikem, který je schopen cíleně poskytnout další nezbytné informace týkající se anamnestických dat a operačního nálezu. Za těchto podmínek se peroperační biopsie posune na optimální úroveň a stane se skutečnou peroperační konzultací. Jako slova závěrem si dovolíme použít citaci z abstraktu jedné z publikací, které poskytovaly podněty pro tento přehledový článek (10): „Nejcennější výsledek peroperační biopsie je ten, který nejvíce ovlivní průběh operace.“
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
MUDr. Petr Škapa, Ph.D.
Ústav patologie a molekulární medicíny 2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
tel.: +420-224 435 623
e-mail: petr.skapa@lfmotol.cuni.cz
Zdroje
1. Zikán M, Cibula D, Fischerová D, et al. Guideline gynekologických zhoubných nádorů: Standard – Komplexní léčba ovariálních epiteliálních zhoubných nádorů [online]. 2013 [cit. 16.12.2017]. Dostupné z: http://www.onkogynekologie.com/wp-content/uploads/2011/03/Guideline_C56_Epit_2013.pdf
2. Moodley M, Bramdev A. Frozen section: Its role in gynaecological oncology. J Obstet Gynaecol 2005; 25(7): 629-634.
3. Acs G. Intraoperative consultation in gynecologic pathology. Semin Diagn Pathol 2002; 19(4): 237-254.
4. Baker P, Oliva E. A practical approach to intraoperative consultation in gynecological pathology. Int J Gynecol Pathol 2008; 27(3): 353-365.
5. Ulbright TM, Roth LM, Stehman FB. Secondary ovarian neoplasia. A clinicopathologic study of 35 cases. Cancer 1984; 53(5): 1164-1174.
6. de Waal YR, Thomas CM, Oei AL, Sweep FC, Massuger LF. Secondary ovarian malignancies: frequency, origin, and characteristics. Int J Gynecol Cancer 2009; 19(7): 1160-1165.
7. Young RH, Scully RE. Metastatic tumors in the ovary: a problem-oriented approach and review of the recent literature. Semin Diagn Pathol 1991; 8(4): 250-276.
8. Dankwa EK, Davies JD. Frozen section diagnosis: an audit. J Clin Pathol 1985; 38(11): 1235-1240.
9. Rose PG, Rubin RB, Nelson BE, Hunter RE, Reale FR. Accuracy of frozen-section (intraoperative consultation) diagnosis of ovarian tumors. Am J Obstet Gynecol 1994; 171(3): 823-826.
10. Scurry JP, Sumithran E. An assessment of the value of frozen sections in gynecological surgery. Pathology 1989; 21(3): 159-163.
11. Wang KG, Chen TC, Wang TY, Yang YC, Su TH. Accuracy of frozen section diagnosis in gynecology. Gynecol Oncol 1998; 70(1): 105-110.
12. Obiakor I, Maiman M, Mittal K, Awobuluyi M, DiMaio T, Demopoulos R. The accuracy of frozen section in the diagnosis of ovarian neoplasms. Gynecol Oncol 1991; 43(1): 61-63.
13. Wakahara F, Kikkawa F, Nawa A, et al. Diagnostic efficacy of tumor markers, sonography, and intraoperative frozen section for ovarian tumors. Gynecol Obstet Invest 2001; 52(3): 147-152.
14. Coffey D, Kaplan AL, Ramzy I. Intraoperative consultation in gynecologic pathology. Arch Pathol Lab Med 2005; 129(12): 1544-1557.
15. Shaaban AM, Rezvani M, Elsayes KM, et al. Ovarian malignant germ cell tumors: cellular classification and clinical and imaging features. Radiographics 2014; 34(3): 777-801.
16. Wang JJ, Liu Q, Wu N, et al. Ovarian small-cell carcinoma hypercalcemic type successfully treated: a case report and literature review. Onco Targets Ther 2016; 9 : 1409-1414.
17. Moley KH, Massad LS, Mutch DG. Pelvic inflammatory disease. Correlation of severity with CA-125 levels. J Reprod Med 1996; 41(5): 341-346.
18. Muyldermans M, Cornillie FJ, Koninckx PR. CA125 and endometriosis. Hum Reprod Update 1995; 1(2): 173-187.
19. Lewis MR, Euscher ED, Deavers MT, Silva EG, Malpica A. Metastatic colorectal adenocarcinoma involving the ovary with elevated serum CA125: a potential diagnostic pitfall. Gynecol Oncol 2007; 105(2): 395-398.
20. Seidman JD, Horkayne-Szakaly I, Haiba M, Boice CR, Kurman RJ, Ronnett BM. The histologic type and stage distribution of ovarian carcinomas of surface epithelial origin. Int J Gynecol Pathol 2004; 23(1): 41-44.
21. Leen SL, Singh N. Pathology of primary and metastatic mucinous ovarian neoplasms. J Clin Pathol 2011; 65(7): 591-595.
22. Hart WR. Mucinous tumors of the ovary: a review. Int J Gynecol Pathol 2005; 24(1): 4-25.
23. Mukherjee A, Parvaiz A, Cecil TD, Moran BJ. Pseudomyxoma peritonei usually originates from the appendix: a review of the evidence. Eur J Gynaecol Oncol 2004; 25(4): 411-414.
24. Misdraji J, Yantiss RK, Graeme-Cook FM, Balis UJ, Young RH. Appendiceal mucinous neoplasms: a clinicopathologic analysis of 107 cases. Am J Surg Pathol 2003; 27(8): 1089-1103.
25. Seidman JD, Kurman RJ, Ronnett BM. Primary and metastatic mucinous adenocarcinomas in the ovaries: incidence in routine practice with a new approach to improve intraoperative diagnosis. Am J Surg Pathol 2003; 27(7): 985-993.
26. Lee KR, Young RH. The distinction between primary and metastatic mucinous carcinomas of the ovary: gross and histologic findings in 50 cases. Am J Surg Pathol 2003; 27(3): 281-292.
27. Yemelyanova AV, Vang R, Judson K, Wu LS, Ronnett BM. Distinction of primary and metastatic mucinous tumors involving the ovary: analysis of size and laterality data by primary site with reevaluation of an algorithm for tumor classification. Am J Surg Pathol 2008; 32(1): 128-138.
28. Zaino RJ, Brady MF, Lele SM, Michael H, Greer B, Bookman MA. Advanced stage mucinous adenocarcinoma of the ovary is both rare and highly lethal: a Gynecologic Oncology Group study. Cancer 2011; 117(3): 554-562.
29. Hess V, A‘Hern R, Nasiri N, et al. Mucinous epithelial ovarian cancer: a separate entity requiring specific treatment. J Clin Oncol 2004; 22(6): 1040-1044.
30. Lewis MR, Deavers MT, Silva EG, Malpica A. Ovarian involvement by metastatic colorectal adenocarcinoma: still a diagnostic challenge. Am J Surg Pathol 2006; 30(2): 177-184.
31. Young RH, Hart WR. Metastases from carcinomas of the pancreas simulating primary mucinous tumors of the ovary. A report of seven cases. Am J Surg Pathol 1989; 13(9): 748-756.
32. Ronnett BM, Yemelyanova AV, Vang R, et al. Endocervical adenocarcinomas with ovarian metastases: analysis of 29 cases with emphasis on minimally invasive cervical tumors and the ability of the metastases to simulate primary ovarian neoplasms. Am J Surg Pathol 2008; 32(12): 1835-1853.
33. Ronnett BM, Seidman JD. Mucinous tumors arising in ovarian mature cystic teratomas: relationship to the clinical syndrome of pseudomyxoma peritonei. Am J Surg Pathol 2003; 27(5): 650-657.
34. McKenney JK, Soslow RA, Longacre TA. Ovarian mature teratomas with mucinous epithelial neoplasms: morphologic heterogeneity and association with pseudomyxoma peritonei. Am J Surg Pathol 2008; 32(5): 645-655.
35. Prat J. Ovarian carcinomas: five distinct diseases with different origins, genetic alterations, and clinicopathological features. Virchows Arch 2012; 460(3): 237-249.
36. Škapa P, Dundr P. Onkopatologické aspekty inaktivace genů BRCA1 a BRCA2 v nádorech ovaria, děložní tuby a pánevního peritonea. Cesk Patol 2016; 52(4): 199-204.
37. Stewart CJ, Brennan BA, Hammond IG, Leung YC, McCartney AJ. Accuracy of frozen section in distinguishing primary ovarian neoplasia from tumors metastatic to the ovary. Int J Gynecol Pathol 2005; 24(4): 356-362.
38. Geomini PM, Zuurendonk LD, Bremer GL, de Graaff J, Kruitwagen RF, Mol BW. The impact of size of the adnexal mass on the accuracy of frozen section diagnosis. Gynecol Oncol 2005; 99(2): 362-366.
39. Brun JL, Cortez A, Rouzier R, et al. Factors influencing the use and accuracy of frozen section diagnosis of epithelial ovarian tumors. Am J Obstet Gynecol 2008; 199(3): 244 e241-247.
40. Twaalfhoven FC, Peters AA, Trimbos JB, Hermans J, Fleuren GJ. The accuracy of frozen section diagnosis of ovarian tumors. Gynecol Oncol 1991; 41(3): 189-192.
41. Maheshwari A, Gupta S, Kane S, Kulkarni Y, Goyal BK, Tongaonkar HB. Accuracy of intraoperative frozen section in the diagnosis of ovarian neoplasms: experience at a tertiary oncology center. World J Surg Oncol 2006; 4 : 12.
42. Hart WR. Borderline epithelial tumors of the ovary. Mod Pathol 2005; 18(Suppl 2): S33-50.
43. Prat J. Ovarian carcinomas, including secondary tumors: diagnostically challenging areas. Mod Pathol 2005; 18(Suppl 2): S99-111.
44. Riopel MA, Ronnett BM, Kurman RJ. Evaluation of diagnostic criteria and behavior of ovarian intestinal-type mucinous tumors: atypical proliferative (borderline) tumors and intraepithelial, microinvasive, invasive, and metastatic carcinomas. Am J Surg Pathol 1999; 23(6): 617-635.
45. Song T, Choi CH, Kim HJ, et al. Accuracy of frozen section diagnosis of borderline ovarian tumors. Gynecol Oncol 2011; 122(1): 127-131.
46. Medeiros LR, Rosa DD, Edelweiss MI, et al. Accuracy of frozen-section analysis in the diagnosis of ovarian tumors: a systematic quantitative review. Int J Gynecol Cancer 2005; 15(2): 192-202.
47. Menzin AW, Rubin SC, Noumoff JS, LiVolsi VA. The accuracy of a frozen section diagnosis of borderline ovarian malignancy. Gynecol Oncol 1995; 59(2): 183-185.
48. Kayikcioglu F, Pata O, Cengiz S, et al. Accuracy of frozen section diagnosis in borderline ovarian malignancy. Gynecol Obstet Invest 2000; 49(3): 187-189.
49. Al-Agha OM, Nicastri AD. An in-depth look at Krukenberg tumor: an overview. Arch Pathol Lab Med 2006; 130(11): 1725-1730.
50. Moore RG, Chung M, Granai CO, Gajewski W, Steinhoff MM. Incidence of metastasis to the ovaries from nongenital tract primary tumors. Gynecol Oncol 2004; 93(1): 87-91.
51. Hirono M, Taniyama K, Matsuki K, Nakagami K, Niimoto M, Hattori T. Clinico-pathological studies on ovarian metastasis from gastric cancer. Jpn J Surg 1983; 13(1): 25-31.
52. Kiyokawa T, Young RH, Scully RE. Krukenberg tumors of the ovary: a clinicopathologic analysis of 120 cases with emphasis on their variable pathologic manifestations. Am J Surg Pathol 2006; 30(3): 277-299.
53. Lim FK, Yeoh CL, Chong SM, Arulkumaran S. Pre and intraoperative diagnosis of ovarian tumours: how accurate are we? Aust N Z J Obstet Gynaecol 1997; 37(2): 223-227.
54. Sasaki KJ, Miller CE. Adnexal torsion: review of the literature. J Minim Invasive Gynecol 2014; 21(2): 196-202.
55. Tumours of the ovary. In: Kurman RJ, eds. WHO Classification of Tumours of Female Reproductive Organs. Lyon, PA: IARC Press; 2014 : 11-83.
56. Stewart CJ, Brennan BA, Hammond IG, Leung YC, McCartney AJ, Ruba S. Intraoperative assessment of clear cell carcinoma of the ovary. Int J Gynecol Pathol 2008; 27(4): 475-482.
57. Offman SL, Longacre TA. Clear cell carcinoma of the female genital tract (not everything is as clear as it seems). Adv Anat Pathol 2012; 19(5): 296-312.
58. Pinto PB, Andrade LA, Derchain SF. Accuracy of intraoperative frozen section diagnosis of ovarian tumors. Gynecol Oncol 2001; 81(2): 230-232.
59. Eichhorn JH, Young RH. Transitional cell carcinoma of the ovary: a morphologic study of 100 cases with emphasis on differential diagnosis. Am J Surg Pathol 2004; 28(4): 453-463.
60. Irving JA, Alkushi A, Young RH, Clement PB. Cellular fibromas of the ovary: a study of 75 cases including 40 mitotically active tumors emphasizing their distinction from fibrosarcoma. Am J Surg Pathol 2006; 30(8): 929-938.
61. Kikkawa F, Ishikawa H, Tamakoshi K, Nawa A, Suganuma N, Tomoda Y. Squamous cell carcinoma arising from mature cystic teratoma of the ovary: a clinicopathologic analysis. Obstet Gynecol 1997; 89(6): 1017-1022.
62. Menzin AW, Gal D, Lovecchio JL. Contemporary surgical management of borderline ovarian tumors: a survey of the Society of Gynecologic Oncologists. Gynecol Oncol 2000; 78(1): 7-9.
63. Houck K, Nikrui N, Duska L, et al. Borderline tumors of the ovary: correlation of frozen and permanent histopathologic diagnosis. Obstet Gynecol 2000; 95(6 Pt 1): 839-843.
64. Frumovitz M, Schmeler KM, Malpica A, Sood AK, Gershenson DM. Unmasking the complexities of mucinous ovarian carcinoma. Gynecol Oncol 2010; 117(3): 491-496.
65. Reichert RA. Primary ovarian adenofibromatous neoplasms with mucin-containing signet-ring cells: a report of 2 cases. Int J Gynecol Pathol 2007; 26(2): 165-172.
66. McCluggage WG, Young RH. Primary ovarian mucinous tumors with signet ring cells: report of 3 cases with discussion of so-called primary Krukenberg tumor. Am J Surg Pathol 2008; 32(9): 1373-1379.
67. Lash RH, Hart WR. Intestinal adenocarcinomas metastatic to the ovaries. A clinicopathologic evaluation of 22 cases. Am J Surg Pathol 1987; 11(2): 114-121.
68. Lerwill MF, Young RH. Ovarian metastases of intestinal-type gastric carcinoma: A clinicopathologic study of 4 cases with contrasting features to those of the Krukenberg tumor. Am J Surg Pathol 2006; 30(11): 1382-1388.
69. Meriden Z, Yemelyanova AV, Vang R, Ronnett BM. Ovarian metastases of pancreaticobiliary tract adenocarcinomas: analysis of 35 cases, with emphasis on the ability of metastases to simulate primary ovarian mucinous tumors. Am J Surg Pathol 2011; 35(2): 276-288.
70. Fontanelli R, Paladini D, Raspagliesi F, di Re E. The role of appendectomy in surgical procedures for ovarian cancer. Gynecol Oncol 1992; 46(1): 42-44.
71. Salom EM, Schey D, Penalver M, et al. The safety of incidental appendectomy at the time of abdominal hysterectomy. Am J Obstet Gynecol 2003; 189(6): 1563-1567. Discussion: 1567-1568.
72. Lin JE, Seo S, Kushner DM, Rose SL. The role of appendectomy for mucinous ovarian neoplasms. Am J Obstet Gynecol 2013; 208(1): 46 e41-44.
73. Ozyurek ES, Karacaoglu UM, Kaya E, Gundogdu EC, Odacilar E. Appendectomy in the surgical treatment of benign ovarian mucinous cystadenomas - is it necessary? Ginekol Pol 2016; 87(5): 338-341.
74. Ozcan A, Toz E, Turan V, et al. Should we remove the normal-looking appendix during operations for borderline mucinous ovarian neoplasms?: A retrospective study of 129 cases. Int J Surg 2015; 18 : 99-103.
75. Cheng A, Li M, Kanis MJ, et al. Is it necessary to perform routine appendectomy for mucinous ovarian neoplasms? A retrospective study and meta-analysis. Gynecol Oncol 2017; 144(1): 215-222.
76. Mikuta JJ. International Federation of Gynecology and Obstetrics staging of endometrial cancer 1988. Cancer 1993; 71(4 Suppl): 1460-1463.
77. Franchi M, Ghezzi F, Riva C, Miglierina M, Buttarelli M, Bolis P. Postoperative complications after pelvic lymphadenectomy for the surgical staging of endometrial cancer. J Surg Oncol 2001; 78(4): 232-237. Discussion: 237-240.
78. Hidaka T, Kato K, Yonezawa R, et al. Omission of lymphadenectomy is possible for low-risk corpus cancer. Eur J Surg Oncol 2007; 33(1): 86-90.
79. Kumar S, Bandyopadhyay S, Semaan A, et al. The role of frozen section in surgical staging of low risk endometrial cancer. PLoS One 2011; 6(9): e21912.
80. Fanning J, Tsukada Y, Piver MS. Intraoperative frozen section diagnosis of depth of myometrial invasion in endometrial adenocarcinoma. Gynecol Oncol 1990; 37(1): 47-50.
81. Shim JU, Rose PG, Reale FR, Soto H, Tak WK, Hunter RE. Accuracy of frozen-section diagnosis at surgery in clinical stage I and II endometrial carcinoma. Am J Obstet Gynecol 1992; 166(5): 1335-1338.
82. Mikuta JJ. Preoperative evaluation and staging of endometrial cancer. Cancer 1995; 76(10 Suppl): 2041-2043.
83. Kilgore LC, Partridge EE, Alvarez RD, et al. Adenocarcinoma of the endometrium: survival comparisons of patients with and without pelvic node sampling. Gynecol Oncol 1995; 56(1): 29-33.
84. Creasman WT, Morrow CP, Bundy BN, Homesley HD, Graham JE, Heller PB. Surgical pathologic spread patterns of endometrial cancer. A Gynecologic Oncology Group Study. Cancer 1987; 60(8 Suppl): 2035-2041.
85. Mariani A, Webb MJ, Keeney GL, Haddock MG, Calori G, Podratz KC. Low-risk corpus cancer: is lymphadenectomy or radiotherapy necessary? Am J Obstet Gynecol 2000; 182(6): 1506-1519.
86. Watanabe M, Aoki Y, Kase H, Fujita K, Tanaka K. Low risk endometrial cancer: a study of pelvic lymph node metastasis. Int J Gynecol Cancer 2003; 13(1): 38-41.
87. Seracchioli R, Solfrini S, Mabrouk M, et al. Controversies in surgical staging of endometrial cancer. Obstet Gynecol Int 2010; 2010 : 181963.
88. Kitchener H, Swart AM, Qian Q, Amos C, Parmar MK. Efficacy of systematic pelvic lymphadenectomy in endometrial cancer (MRC ASTEC trial): a randomised study. Lancet 2009; 373(9658): 125-136.
89. Walker JL, Piedmonte MR, Spirtos NM, et al. Laparoscopy compared with laparotomy for comprehensive surgical staging of uterine cancer: Gynecologic Oncology Group Study LAP2. J Clin Oncol 2009; 27(32): 5331-5336.
90. Mourits MJ, Bijen CB, Arts HJ, et al. Safety of laparoscopy versus laparotomy in early-stage endometrial cancer: a randomised trial. Lancet Oncol 2010; 11(8): 763-771.
91. Kumar S, Medeiros F, Dowdy SC, et al. A prospective assessment of the reliability of frozen section to direct intraoperative decision making in endometrial cancer. Gynecol Oncol 2012; 127(3): 525-531.
92. Quinlivan JA, Petersen RW, Nicklin JL. Accuracy of frozen section for the operative management of endometrial cancer. BJOG 2001; 108(8): 798-803.
93. Goff BA, Rice LW. Assessment of depth of myometrial invasion in endometrial adenocarcinoma. Gynecol Oncol 1990; 38(1): 46-48.
94. Soliman PT, Frumovitz M, Spannuth W, et al. Lymphadenectomy during endometrial cancer staging: practice patterns among gynecologic oncologists. Gynecol Oncol 2010; 119(2): 291-294.
95. Case AS, Rocconi RP, Straughn JM, Jr., et al. A prospective blinded evaluation of the accuracy of frozen section for the surgical management of endometrial cancer. Obstet Gynecol 2006; 108(6): 1375-1379.
96. Frumovitz M, Slomovitz BM, Singh DK, et al. Frozen section analyses as predictors of lymphatic spread in patients with early-stage uterine cancer. J Am Coll Surg 2004; 199(3): 388-393.
97. Dargent D, Martin X, Sacchetoni A, Mathevet P. Laparoscopic vaginal radical trachelectomy: a treatment to preserve the fertility of cervical carcinoma patients. Cancer 2000; 88(8): 1877-1882.
98. Smith JR, Boyle DC, Corless DJ, et al. Abdominal radical trachelectomy: a new surgical technique for the conservative management of cervical carcinoma. Br J Obstet Gynaecol 1997; 104(10): 1196-1200.
99. Rob L, Charvat M, Robova H, et al. Less radical fertility-sparing surgery than radical trachelectomy in early cervical cancer. Int J Gynecol Cancer 2007; 17(1): 304-310.
100. Rob L, Pluta M, Strnad P, et al. A less radical treatment option to the fertility-sparing radical trachelectomy in patients with stage I cervical cancer. Gynecol Oncol 2008; 111(2 Suppl): S116-120.
101. Zhang D, Ge H, Li J, Wu X. A new method of surgical margin assuring for abdominal radical trachelectomy in frozen section. Eur J Cancer 2015; 51(6): 734-741.
102. Park KJ, Soslow RA, Sonoda Y, Barakat RR, Abu-Rustum NR. Frozen-section evaluation of cervical adenocarcinoma at time of radical trachelectomy: pathologic pitfalls and the application of an objective scoring system. Gynecol Oncol 2008; 110(3): 316-323.
103. Chenevert J, Tetu B, Plante M, et al. Indication and method of frozen section in vaginal radical trachelectomy. Int J Gynecol Pathol 2009; 28(5): 480-488.
104. Tanguay C, Plante M, Renaud MC, Roy M, Tetu B. Vaginal radical trachelectomy in the treatment of cervical cancer: the role of frozen section. Int J Gynecol Pathol 2004; 23(2): 170-175.
105. Ismiil N, Ghorab Z, Covens A, et al. Intraoperative margin assessment of the radical trachelectomy specimen. Gynecol Oncol 2009; 113(1): 42-46.
106. Bretelle F, Agostini A, Rojat-Habib MC, Cravello L, Roger V, Blanc B. The role of frozen section examination of conisations in the management of women with cervical intraepithelial neoplasia. BJOG 2003; 110(4): 364-370.
107. Rouzier R, Feyereisen E, Constancis E, Haddad B, Dubois P, Paniel BJ. Frozen section examination of the endocervical margin of cervical conization specimens. Gynecol Oncol 2003; 90(2): 305-309.
108. Torres JE, Moorman J, Shiu A, Gyer D. Colposcopically directed conization for frozen-section examination in the management of cervical intraepithelial neoplasia. J Reprod Med 1983; 28(2): 123-125.
109. Cochran AJ, Wen DR, Huang RR, Wang HJ, Elashoff R, Morton DL. Prediction of metastatic melanoma in nonsentinel nodes and clinical outcome based on the primary melanoma and the sentinel node. Mod Pathol 2004; 17(7): 747-755.
110. Fleming FJ, Kavanagh D, Crotty TB, et al. Factors affecting metastases to non-sentinel lymph nodes in breast cancer. J Clin Pathol 2004; 57(1): 73-76.
111. Viale G, Maiorano E, Pruneri G, et al. Predicting the risk for additional axillary metastases in patients with breast carcinoma and positive sentinel lymph node biopsy. Ann Surg 2005; 241(2): 319-325.
112. Lecuru F, Mathevet P, Querleu D, et al. Bilateral negative sentinel nodes accurately predict absence of lymph node metastasis in early cervical cancer: results of the SENTICOL study. J Clin Oncol 2011; 29(13): 1686-1691.
113. Moore RG, DePasquale SE, Steinhoff MM, et al. Sentinel node identification and the ability to detect metastatic tumor to inguinal lymph nodes in squamous cell cancer of the vulva. Gynecol Oncol 2003; 89(3): 475-479.
114. Cibula D, Zikan M, Slama J, et al. Risk of micrometastases in non-sentinel pelvic lymph nodes in cervical cancer. Gynecol Oncol 2016; 143(1): 83-86.
115. Barlin JN, Khoury-Collado F, Kim CH, et al. The importance of applying a sentinel lymph node mapping algorithm in endometrial cancer staging: beyond removal of blue nodes. Gynecol Oncol 2012; 125(3): 531-535.
116. Rob L, Strnad P, Robova H, et al. Study of lymphatic mapping and sentinel node identification in early stage cervical cancer. Gynecol Oncol 2005; 98(2): 281-288.
117. Plante M, Renaud MC, Tetu B, Harel F, Roy M. Laparoscopic sentinel node mapping in early-stage cervical cancer. Gynecol Oncol 2003; 91(3): 494-503.
118. Marnitz S, Kohler C, Bongardt S, Braig U, Hertel H, Schneider A. Topographic distribution of sentinel lymph nodes in patients with cervical cancer. Gynecol Oncol 2006; 103(1): 35-44.
119. Slama J, Dundr P, Dusek L, Cibula D. High false negative rate of frozen section examination of sentinel lymph nodes in patients with cervical cancer. Gynecol Oncol 2013; 129(2): 384-388.
120. Fader AN, Edwards RP, Cost M, et al. Sentinel lymph node biopsy in early-stage cervical cancer: utility of intraoperative versus postoperative assessment. Gynecol Oncol 2008; 111(1): 13-17.
121. Bats AS, Buenerd A, Querleu D, et al. Diagnostic value of intraoperative examination of sentinel lymph node in early cervical cancer: a prospective, multicenter study. Gynecol Oncol 2011; 123(2): 230-235.
122. Pluta M, Rob L, Charvat M, et al. Less radical surgery than radical hysterectomy in early stage cervical cancer: a pilot study. Gynecol Oncol 2009; 113(2): 181-184.
Štítky
Patologie Soudní lékařství Toxikologie
Článek Peroperační biopsie (2. díl)
Článek vyšel v časopiseČesko-slovenská patologie

2018 Číslo 3-
Všechny články tohoto čísla
- Peroperační biopsie v gynekopatologii
- Monitor aneb nemělo by vám uniknout, že...
- Peroperačná diagnostika nádorov centrálneho nervového systému
- Peroperační biopsie plíce, pleury a mediastina: Retrospektivní analýza 5 let praktických zkušeností a přehled literatury
- Metody detekce molekulárních prognostických a prediktivních markerů v diagnostice adenoidně cystického karcinomu slinných žláz
- Klinicko-patologická analýza dôkazu ligandy proteínu 1 programovanej smrti v nádorových bunkách 325 pacientov s nemalobunkovým karcinómom pľúc: Prediktívny a potenciálny prognostický význam
- Aberantní axilární tkáň mléčné žlázy s pseudoangiomatózní stromální hyperplázií u muže
- JOSE VEROCAY - “Pražský patolog”.
- Peroperační biopsie (2. díl)
- Pathology will stay as a cornerstone of personalized medicine
- Monitor aneb nemělo by vám uniknout, že...
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Peroperačná diagnostika nádorov centrálneho nervového systému
- Peroperační biopsie v gynekopatologii
- Aberantní axilární tkáň mléčné žlázy s pseudoangiomatózní stromální hyperplázií u muže
- Klinicko-patologická analýza dôkazu ligandy proteínu 1 programovanej smrti v nádorových bunkách 325 pacientov s nemalobunkovým karcinómom pľúc: Prediktívny a potenciálny prognostický význam
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



