-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaVýznam detekcie cyklínu D1 (a CD5) v diagnostike malígnych lymfómov iných než je lymfóm z plášťových buniek
Importance of cyclin D1 (and CD5) detection in the diagnosis of malignant lymphomas other than mantle cell lymphoma
In association to our undestanding of the pathogenesis and biopsy diagnosis of mantle cell lymphoma using immunohistochemical detection of cyclin D1 expression and/or FISH detection of t(11;14)(q13;q32) all the lymphomas interfering with these factors are discussed in a form of a review. This includes a cyclin D1 negative mantle cell lymphoma, as well as other than MCL lymphomas showing positive intranuclear cyclin D1 positivity due to the changes either at transcriptional or postranscriptional levels. In addition to the MCL, the cyclin D1 positivity might be detected in the cells of hairy cell leukemia, plasmocytic lymphoma and diffuse large B-cell lymphoma. In the first two lymphomas the differential diagnostic problems usually do not arise (with exception of G3 plasmacytoma) and cyclin D1 expression might be of interess to understand better their biology, or to represent a prognostically significant factor. In contrast, cyclin D1 positivity in diffuse large B-cell lymphomas demonstrates the possible role of cyclins in the pathogenesis of this lymphoma and may lead to the problems of the differential diagnosis of aggressive variant of pleomorphic MCL (especially when occuring with CD5 positivity coexpression ). The review includes discussion related to the significance of cyclin D1 positivity and to the approach in the immunohistochemical and FISH analysis of the biopsy material.
Keywords:
lymphoma biopsy diagnosis – mantle cell lymphoma – cyclin D1 – CCND1 gene – FISH analysis
Autoři: L. Plank 1,2
Působiště autorů: Ústav patologickej anatómie a Konzultačné centrum bioptickej diagnostiky ochorení krvotvorby JLF UK a UNM v Martine 1; Martinské bioptické centrum, s. r. o. v Martine 2
Vyšlo v časopise: Čes.-slov. Patol., 47, 2011, No. 3, p. 96-100
Kategorie: Přehledový článek
Souhrn
V práci sa v náväznosti na fakty o poznaní patogenézy a bioptickej diagnostike lymfómu z plášťových buniek (MCL) s využitím imunohistochemickej dôkazu expresie cyklínu D1, resp. dôkazu t(11;14)(q13;q32) FISH metódou uvádza prehľad tých lymfómov, ktoré vykazujú interferenciu s uvedenými faktormi. Sem patrí jednak problematika cyklín D1 - negatívneho MCL, ako aj prehľad iných než MCL lymfómov s možnou jadrovou pozitivitou cyklínu D1 bez ohľadu na to, či deregulácia cyklínu je dôsledkom zmien na transkripčnej alebo postranskripčnej úrovni. Medzi tieto lymfómy patria najmä prípady cyklín D1 pozitívnej trichocelulárnej leukémie, plazmocytového myelómu a difúzneho veľkobunkového B-lymfómu. V prvých dvoch prípadoch nevznikajú bioptické diferenciálno-diagnostické problémy (s výnimkou G3 plazmocytómu) a expresia cyklínu D1 prispieva k pochopeniu ich biológie, prípadne je prognosticky relevantná. Naopak, expresia cyklínu D1 v difúznom veľkobunkovom B-lymfóme poukazuje na možnú úlohu cyklínov v patogenéze tohoto nádoru a môže, najmä v kombinácii so súčasnou CD5 pozitivitou, spôsobovať rozpaky pri diagnostike agresívnej varianty pleomorfného MCL. V práci sa diskutuje o význame tejto expresie a o postupe pri imunohistochemickej a FISH analýze bioptického materiálu.
Kľúčové slová:
bioptická diagnostika lymfómov – lymfóm z plášťových buniek – cyklín D1 – CCND1 gén – FISH analýzaDnes je tak v rutínnej, ako aj špecializovanej bioptickej diagnostike non-Hodgkinových malígnych lymfómov (ďalej NHL) akceptovaný imunohistochemický dôkaz cyklínu D1 ako „markera“ diagnostiky lymfómu z plášťových buniek (MCL) v kontexte jeho pomerne stabilného fenotypu (najmä pozitivita CD20 a CD5 a negativita CD23 a CD10) (1,2). Vo väčšine prípadov je takýto postup oprávnený a v praxi užitočný, najmä ak je v súlade s kritériami klasifikácie SZO z r. 2008 (3) podporený nálezom „typickej“ morfológie nádoru a dôkazom translokácie t(11;14) (q13;q32), najlepšie metódou FISH (4). Tento postup mal umožniť klinicky významnú identifikáciu:
- a) MCL ako malobunkového nevyliečiteľného B-NHL (resp. všetkých jeho malobunkových variantov podľa klasifikácie SZO) s krátkym mediánom prežívania (v priemere len 3–4 roky) a jeho odlíšenie od iných prognosticky priaznivejších malobunkových lymfómov,
- b) agresívnych variantov(blastoidného a pleomorfného) MCL a jeho odlíšenie od iných blastických B-NHL, najmä difúzneho veľkobunkového B-lymfómu (DLBCL) a lymfoblastómu, resp. ALL B-radu,
- c) ako aj prípadov „MCL in situ“ (3, 5).
Na druhej strane je takýto postup zaťažený istým zjednodušením a s tým súvisiacimi rizikami, medzi ktoré patria nasledovné skutočnosti:
- a) v podstate od spresnenia definície MCL sú známe prípady MCL bez imunohistochemickej expresie cyklínu D1 a bez translokácie t(11;14)(q13;q32),
- b) nie každý malobunkový MCL predstavuje klinicky „konvenčný MCL“ (cMCL) ako nádor s nepriaznivou prognózou, lebo existujú aj pacienti s MCL s dlhodobým prežívaním a lepšou terapeutickou odpoveďou, vtedy sa nádor označuje ako tzv. indolentný MCL (iMCL – 6),
- c) existujú aj iné CD20+ B-NHL než je MCL s koexpresiou CD5, dokonca aj CD20+/CD5+ B-NHL s pozitívnou expresiou aj cyklínu D1.
Cieľom nášho prehľadu nie je a nemôže byť úplné teoretické objasnenie celej problematiky cyklínu D1 vo vzťahu k MCL – len pre pochopenie tu diskutovaných údajov uvádzame niekoľko teoretických poznatkov. V prípade cyklín D1 pozitívneho MCL je primárnou genetickou udalosťou jeho patogenézy translokácia t(11;14)(q13;q32), v dôsledku ktorej dochádza k aktivácii tzv. CCND1 génu, ktorý kóduje expresiu cyklínu D1 a ktorý leží v oblasti chromozómu 11q23 (5). Je známe, že translokácia prináša zmenu na úrovni mRNA, keď pribl. 90 % prípadov MCL má zvýšenú hladinu mRNA cyklínu D1a súčasne aj na úrovni imunohistochemickej expresie v podobe nadmernej pozitivity CCND1 génom kódovaného proteínu – cyklínu D1 v jadrách buniek MCL. Využívanie dôkazu expresie cyklínu D1 ako „excelentného markera“ bioptickej diagnostiky MCL podporila najmä skutočnosť, že:
- nenádorové lymfocyty nevykazujú pozitivitu cyklínu D1 a že
- to isté platí pre bunky väčšiny NHL B-pôvodu iných než MCL, a to najmä tých, ktoré najčastejšie prichádzajú do úvahy v rámci diferenciálnej bioptickej diagnostiky MCL (2,3).
Nález nadmernej expresie cyklínu D1 v MCL ako markera rýchlo rastúceho „agresívneho“ NHL sa zdá byť logický v rámci poznatkov o jeho biológii. Cyklíny, vrátane cyklínu D1, sú totiž regulačné proteíny, ktoré sa (spolu s na nich závislými kinázovými komplexami) podieľajú na regulácii bunkového cyklu, najmä prechodu z G1 do S fázy. V mnohých nádoroch dochádza k zvýšenej regulácii cyklínu CD1 a to vedie k zrýchleniu rastu nádoru a zvýšeniu jeho agresivity, prípadne strate jeho diferenciácie. Preto viaceré histogeneticky rôznorodé nádory (najmä karcinómy prsníka, hlavy a krku, pažeráka, žalúdka, čreva, urotelu, neuroendokrinné nádory a pod.) majú zvýšenú expresiu cyklínu D1, čo viedlo k diskusiám o jej možnom prognostickom a aj prediktívnom význame (7–9). Zvýšenú reguláciu cyklínu D1 však nemožno automaticky spájať s agresivitou nádoru, keď súčasne vieme, že zvýšenú imunohistochemicky detekovateľnú expresiu cyklínu D1 možno zaznamenať aj v niektorých „normálnych“ tkanivách a aj nezhubných nádoroch (napr. prsníka, slinnej žľazy a pod. – 10).
Aj v tomto kontexte sa ukazuje byť dôležité poznať biologické pozadie príčiny dysregulácie a zvýšenej expresie cyklínu D1. Tá môže byť spôsobená:
- a) buď preskupením génov v zmysle už citovanej translokácie t(11;14)(q13;q32) pri cMCL, alebo amplifikáciou DNA na úrovni 11q23, čo spôsobí tzv. transkripčnú zvýšenú reguláciu – zvýšenie príslušnej mRNA a proteínu cyklínu D1. V prípade cyklín D1 pozitívneho MCL je expresia spôsobená už citovanou cytogenetickou zmenou, translokáciou t(11;14)(q13;q32), resp. aktiváciou génu CCND1, pričom v niektorých, najmä blastoidných variantoch MCL, sa na nej spolupodieľa aj polyzómia chromozómu 11.
- b) pri absencii translokácie či amplifikácie CCND1 génu aj inými pomerne zložitými mechanizmami tzv. posttranskripčnej zvýšenej regulácie cyklínu D1. Táto býva pozorovaná v benígnych neoplastických procesoch, ako aj v iných (najmä epitelových) nádoroch a menej často v NHL B-pôvodu, ktoré prichádzajú do úvahy v rámci diferenciálnej diagnostiky MCL (7,8,10).
CYKLÍN D1 NEGATÍVNY MCL
V časti prípadov MCL nie je prítomná zvýšená expresia cyklínu D1, resp. nedochádza k translokácii t(11;14)(q13;q32). Zdá sa, že v týchto prípadoch absenciu regulačnej a rast podporujúcej funkcie cyklínu D1 nahrádza zvýšená aktivita ďalších proteínov z rodiny cyklínov, najmä cyklínu D2 a cyklínu D3 (11, 12). Patogenéza ich dysregulácie nie je celkom objasnená. Niektorí (13) tvrdia, že v týchto prípadoch možno metódou FISH alebo kvantitatívnej RT-PCR identifikovať translokácie CCND2 génu a lokusu buď IgK typu t(2;12)(p12;p13), alebo lokusu IgH typu t(12;14)(p13;q32), iní naopak ani pri aplikácii interfázovej FISH analýzy nedokázali chromozómové translokácie ani amplifikácie lokusov CCND2, resp. CCND3, hoci hladina príslušnej mRNA bola v nádorovom tkanive zvýšená (11).
Existencia cyklín D1 negatívnych prípadov MCL si vyžaduje odpoveď na prinajmenej dve otázky:
- a) či je možné v rutínnej diagnostickej praxi tieto prípady MCL správne typizovať a
- b) či existujú biologicky a klinicky významné rozdiely medzi cyklín D1 negatívnymi a pozitívnymi prípadmi MCL.
Odpoveď na prvú otázku je stále predmetom diskusií. Niektorí (14) sú skeptickí keď konštatujú, že stanovenie diagnózy cyklín D1 negatívneho MCL nie je možné bez mikroerejových analýz expresie génového profilu. Pritom tieto nie sú bežne dostupné ani pre mnohé lymfómové centrá. Iní autori (13) ponúkli už uvedené riešenie identifikácie translokácií CCND2 resp. 3 lokusov. Pomerne jednoduchým a elegantným východiskom sa tu ukazuje byť imunohistochemický dôkaz neurálneho transkripčného faktora SOX11. V priebehu posledných rokov totiž pribúdali správy o jadrovej pozitivite tohoto antigénu v pribl. 90 % prípadov MCL a o asociácii tejto expresie s t(11;14) s nadmernou expresiou cyklínu D1. Súčasne sa ukázalo, že pozitivita SOX11 býva prítomná aj v cyklín D1 negatívnych prípadoch MCL a že nebýva vyznačená v prípadoch CLL a FL ako potenciálnych problémov diferenciálnej diagnostiky MCL (5,15,16).
Hoci implentáciu dôkazu SOX11 do imunohistochemického panelu prinajmenej konzultačných centier možno odporúčať, tak súčasne je vhodné si uvedomiť jeho limity. Nejde totiž o pre MCL jedinečný a špecifický marker, lebo okrem expresie prítomnej v bunkách iných NHL (T-prolymfocytovej leukémie, klasického Hodgkinovho lymfómu a pribl. 30 % Burkittových lymfómov) býva pozitivita SOX11 prítomná aj v bunkách lymfoblastového lymfómu a akútnej lymfoblastovej leukémie B - aj T-radu, čo určite patrí do diferenciálnej diagnostiky agresívnych variantov MCL, najmä blastoidného MCL (3,5). Okrem toho problematiku dôkazu SOX11 zaťažujú aj najnovšie údaje, podľa ktorých je expresia SOX11 konštantne pozitívna v cMCL a naopak negatívna v iMCL (6). Táto skutočnosť by tak síce mohla byť prínosná pre identifikáciu prognosticky priaznivejšej varianty MCL, ale doteraz nie je celkom zrejmé, či aj v podskupine iMCL existujú cyklín D1 negatívne prípady.
Druhá otázka sa týka prípadných rozdielov v klinickej manifestácii: aj keď nemožno zveličovať prognostický význam analýzy zatiaľ pomerne limitovaných skupín cyklín D1 negatívnych prípadov MCL, tak sa zdá, že genetická odlišnosť „primárnej genetickej zmeny“ zrejme nevedie k zmene biologického správania a že klinické prejavy týchto nádorov boli rovnaké, ako pri iných cMCL. Agresívnejšia biológia cMCL zrejme súvisí až so vznikom sekundárnych genetických zmien, ako sú zmeny TP53 a pod. (5,6,14).
Presné údaje o frekvencii výskytu cyklín D1 negatívnych, resp. cyklín D2 alebo D3 pozitívnych MCL nie sú známe. Zväčša sa uvádza, že ide o „malé percento“, resp. „zriedkavé prípady“ MCL, resp. k dispozícii sú parciálne údaje o pozitivite cyklínu D2 v 22 % a cyklínu D3 v 6 % prípadov MCL (3,12).
CYKLÍN D1 POZITÍVNE NHL INÉ NEŽ MCL
V minulosti, v období „menej spoľahlivých“ protilátok na imunohistochemickú detekciu cyklínu D1, sa objavovali správy o pozitivite cyklínu D1, zväčša v prietokovocytometrických analýzach v rôznych typoch B-NHL: napr. v 4 z 30 prípadov CLL, 1 zo 4 prípadov B-PLL, 1 zo 7 prípadov HCL, 4 z 13 prípadov splenického NHL z buniek marginálnej zóny a pod. (17). Okrem toho, že boli zaťažené hendikepom malého počtu prípadov, tak v niektorých z nich neskoršie FISH metódou dokázaná t(11;14)(q13;q32) viedla k revízii nálezu v zmysle diagnózy MCL, čo negatívne zaťažuje porovnávanie „starších“ a recentných dát (18).
Dnes sa považuje za všeobecne akceptované, že okrem MCL sa rôzny stupeň imunohistochemickej expresie cyklínu D1 môže vyskytnúť v rôzne veľkej časti prípadov len troch ďalších typov NHL B-radu, a to v jadrách buniek trichocelulárnej leukémie (HCL), plazmocytového myelómu (PcM) a DLBCL. V prvých dvoch prípadoch ide o nádory, ktoré by nemali vzbudiť diferenciálno-diagnostické rozpaky v rámci diagnostiky MCL. Toto konštatovanie však neplatí najmä pre cyklín D1 pozitívny DLBCL a jeho diferenciálno-diagnostické odlíšenie od agresívnych variantov MCL, najmä blastoidného MCL. Problematická môže byť aj diferenciálna diagnostika zriedkavého tzv. malobunkového („lymfoidného“) variantu PcM, ktorý býva aj CD20 pozitívny (3).
Dysregulácia a nadmerná expresia je v uvedenej skupine troch NHL dôsledkom translokácie t(11;14)(q13;q32) len v prípade PcM, v ostatných prípadoch je cyklínová expresia zrejme posttranskripčného typu. Aj preto možno imunohistochemický dôkaz cyklínu D1 so súčasnou verifikáciou t(11;14)(q13;q32) považovať za skutočne relatívne vysoko špecifický pre diagnózu MCL.
Na rozdiel od cyklínu D1 sa expresia cyklínu D2 a D3 môže vyskytnúť aj v časti normálnych B-buniek a v celom rade iných B-NHL (ale aj T-NHL a niektorých myeloidných nádoroch) a preto dôkaz expresie týchto dvoch cyklínov nemožno použiť pre diferenciálno diagnostické odlíšenie cyklín D1 negatívneho MCL od iných NHL B-pôvodu (5).
POZITIVITA CYKLÍNU D1 V PRÍPADOCH HCL
Už takmer 20 rokov sa v literatúre uvádzajú údaje o tom, že jadrová imunohistochemicky dokázateľná expresia cyklínu D1 (hoci slabšieho stupňa než v MCL) sa vyskytuje aj v bunkách trichocelulárnej leukémie (ďalej HCL). Dokonca niektorí túto pozitivitu považujú za „vysoko špecifickú“ pre MCL aj HCL (19,20). Na rozdiel od MCL v cyklín D1 pozitívnych prípadoch HCL translokácia t(11;14)(q13;q32) chýba a známe sú len ojedinelé správy o súvislosti expresie cyklínu D1 v bunkách niektorých prípadov HCL s variantnou translokáciou t(11;20)(q13;q11) (21). Pri tom je zaujímavé, že aj v prípadoch cyklín D1 pozitívnej HCL sa vyskytuje pozitívna nukleárna expresia SOX11 (16). Súčasne je korektné dodať, že správy o cyklínovej pozitivite sú kontroverzné - podľa niektorých názorov táto expresia v bunkách HCL sa dokazuje len pri použití monoklónovej protilátky proti cyklínu D1 a nie pri použití králičej primárnej protilátky, v iných prácach sa dokázala nukleárna pozitivita v 14 zo 14 testovaných prípadov HCL aj pri použití králičej protilátky (20).
Z hľadiska diagnostiky a diferenciálnej diagnostiky či už MCL alebo HCL by pozitívna expresia cyklínu D1 nemala spôsobovať rozpaky (viď aj obr. 1). Ide o morfologicky a (histo-)cytologicky odlišné nádory, navyše obyčajne primárne diagnostikované v rôznych tkanivových kompartmentoch, s odlišnou klinickou prezentáciou a s možnosťou identifikácie imunohistochemickej pozitivity buniek HCL s použitím protilátok DBA.44 a anti-CD25 (event. aj ANXA1 proteínu - 22).
Obr. 1. Náčrt možného postupu imunohistochemickej analýzy v diagnostike a diferenciálnej diagnostike lymfómu z plášťových buniek (MCL)(skratky viď text). 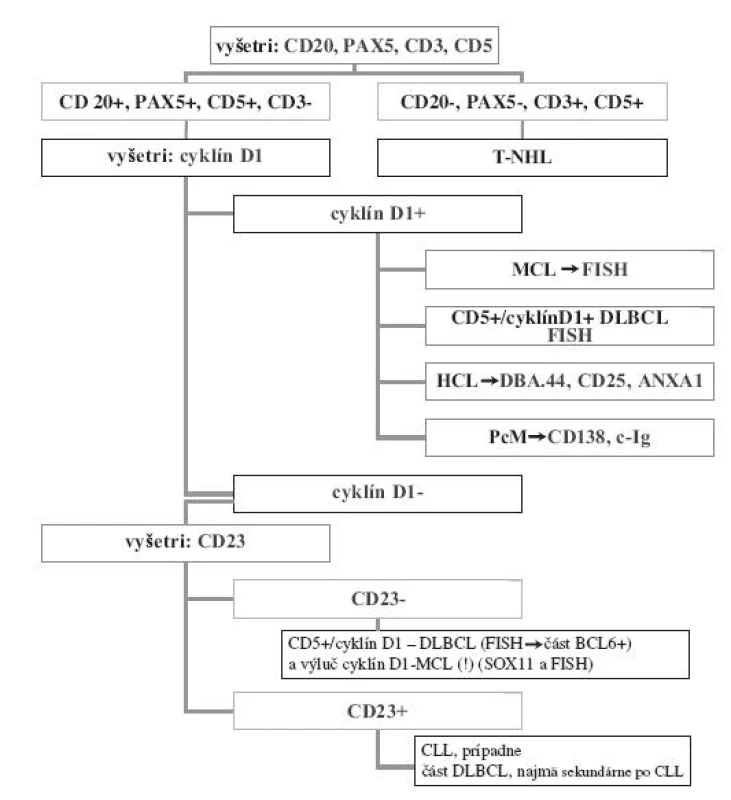
POZITIVITA CYKLÍNU D1 V PRÍPADOCH PLAZMOCYTOVÉHO MYELÓMU
Jadrová imunohistochemicky dokázateľná expresia cyklínu D1 sa vyskytuje podľa rôznych údajov v bunkách pribl. 10–40 % prípadov plazmocytového myelómu (PcM) a je v prevažnej časti pozitívnych prípadov spôsobená translokáciou t(11;14)(q13;q32), alebo polyzómiou chromozómu 11 (23-25). Na tomto mieste je vhodné dodať, že na rozdiel od MCL a HCL všetky dosiaľ analyzované prípady PcM, bez ohľadu na stav génu CCND1, nevykazujú pozitivitu expresie SOX11 (16).
Dôkaz cyklínu D1 v bunkách PcM je pre bioptickú diagnostiku takmer zanedbateľný, výnimku snáď môžu predstavovať niektoré prípady s blastickou morfológiou (G3 PcM). Z hľadiska histomorfologickej analýzy, prípadne podporenej dôkazom CD138 antigénu a monotypického c-Ig, by totiž ani prípadná expresia cyklínu D1 nemala spôsobovať rozpaky v diferenciálnej diagnostike MCL versus PcM. Zdá sa, že hlavný význam analýzy génu CCND1 (v kontexte komplexných genetických zmien a ploidity nádoru) spočíva v lepšom pochopení patogenézy včasných štádií vývoja myelómu a jeho prekurzora, monoklonovej gamapatie neistého významu (MGUS). Vo včasných štádiách pozitívnych prípadov vznikajú rekurentné translokácie Ig génu, ktoré môžu postihnúť viacero rôznych lokusov a viesť k deregulácii cyklínu D1 aj D2, ako aj ďalších regulačných proteínov. (24–26). V klinickej praxi je dôkaz translokácie t(11;14)(q13;q32) a cyklínu D1 žiadaný, hoci zhodnotenie prínosu týchto analýz je rozporuplné. Niektoré práce konštatujú, že dôkaz stavu CCND1 génu je prognostický nevýznamný. V časti údajov sa dokázala asociácia translokácie t(11;14) (q13;q32) s nepriaznivým biologickým priebehom (vrátane tendencie k leukemickej prezentácii, extramedulárnemu postihu a zlej prognóze) a v ďalšej skupine prác sa táto prestavba spájaná s lepším prežívaním a indolentným priebehom ochorenia (24-28). V zásade tak prevláda presvedčenie o tom, že identifikácia translokácie a jej typu by mala umožniť prognostickú stratifikáciu pacientov. Preto aj česko-slovenské kritériá diagnostiky a liečby PcM zahŕňajú aj komplexnú genetickú analýzu prípadov PcM, pričom translokáciu t(11;14)(q13;q32) zaraďujú do skupiny prognosticky priaznivých faktorov (28).
POZITIVITA CYKLÍNU D1 V PRÍPADOCH DLBCL
DLBCL ako jeden z najčastejších NHL (aj u našich pacientov) predstavuje biologicky, histologicky a geneticky heterogénnu skupinu agresívnych B-NHL. Podľa definície WHO klasifikácie (3) diskriminujúcim faktormi odlíšenia DLBCL od morfologicky neraz podobnej a biologicky tiež agresívnej (pleomorfnej) varianty formy MCL má byť imunohistochemická pozitivita antigénu CD5, prípadne translokácia t(11;14)(q13;q32) detekovaná v bunkách MCL. Napriek tomu recentne pribúdajú správy o prípadoch CD5 pozitívneho DLBCL, ktoré podľa niektorých údajov tvoria až do 10 % všetkých DLBCL (29). V niektorých z nich by expresia CD5+ mohla súvisieť s tým, že ide o sekundárne DLBCL, ktoré vznikajú blastickou transformáciou z CD5+ malobunkových B-NHL (napr. v rámci tzv. richterovskej transformácie z CLL). Prinajmenej v časti prípadov však ide o primárne (de novo) CD5+ DLBCL, bez anamnézy predchádzajúcej CD5+ lymfoproliferácie, ktoré by údajne mohli tvoriť zvláštnu podskupinu DLBCL, s vyšším stupňom klinickej agresivity a odlišným fenotypom či genotypom (30). V poslednej dobe sa ukazuje, že časť z CD5+ DLBCL vykazuje aj imunohistochemickú pozitivitu cyklínu D1, a to bez koexpresie SOX11. Morfologicky má ísť o nadmerne pleomorfné lymfómy, s extrémne vysokou proliferačnou (Ki-67) frakciou a častou pozitivitou proteínov bcl6+/MUM1(IRF-4)+ (29,31). Ojedinelé z publikovaných prípadov boli negatívne pri dôkaze CD5 (31), takže v praxi je potrebné zvažovať aj fenotypový variant DLBCL s profilom CD5-/cyklín D1+ (31).
Možno teda konštatovať, že aberantná expresia cyklínu D1 môže hrať úlohu aj v patogenéze (prinajmenej časti) DLBCL a že imunohistochemicky dokázaná pozitivita cyklínu D1 per se nepostačuje pre rozlíšenie pleomorfného variantu MCL a DLBCL. Vo všetkých doteraz známych prípadoch CD5+/cyklín D1+ DLBCL nebola prítomná translokácia t(11;14)(q13;q32) (CCND1/IgH) a v niektorých z nich bola prítomná translokácia BCL6 génu (3q27) (12,29,31,32). Tieto údaje by nás mali pri diferenciálnej diagnostike blastoidného (pleomorfného) variantu MCL a DLBCL viesť k implementácii dôkazu SOX11 a FISH analýzy na dôkaz translokácie CCND1/IgH, resp. BCL6.
ZÁVER
Cieľom predloženého prehľadu je upozorniť na možné riziká nadmernej dôvery v špecificitu imunohistochemickej pozitivity cyklínu D1, a to aj vo väzbe na dôkaz expresie CD5 v rámci rutínne používaných algoritmov bioptickej diagnostiky a diferenciálnej diagnostiky MCL. Na základe tu sumarizovaných poznatkov predkladáme v obraze č 1. pokus o návod postupu pri imunohistochemickej analýze v prípade bioptickej diagnostiky MCL. Tá by sa však mala vždy opierať o dôkladný rozbor rastových a histocytologických parametrov nádorovej lymfoproliferácie, čo sa neraz v rutínnej praxi podceňuje. MCL je totiž nádor, ktorý z hľadiska rastových charakteristík môže vykazovať rôzne črty v spektre istého kontinua: lymfoproliferácia začína v plášťovej zóne reaktívnych lymfatických folikulov (čo viedlo aj k názvu „lymfóm z plášťových buniek“, resp. buniek plášťovej zóny), neskôr sú tieto prítomné v rôznom stupni zachovania, resp. infiltrácie. V priebehu ďalšej proliferácie nádorové bunky deštruujú aj reziduá folikulov a nádor má nodulárne usporiadanie, neskôr zanikajú aj črty nodularity a MCL sa stáva difúznym. Histocytologicky je podľa klasifikácie SZO (3) žiadúce rozlišovať konvenčný a dalšie dva typy „malobunkového“ MCL a agresívne varianty MCL „blastického“ vzhľadu, a to blastoidný a pleomorfný (2,3,15,33). V kontexte uvedeného prehľadu možno zhrnúť, že:
- a) bioptická diagnostika MCL v rámci diferenciálnej diagnostiky malobunkových CD20+ B-NHL môže využiť analýzu rastových a cytologických črtách MCL, v kombinácii s dôkazom expresie cyklínu D1 (a CD5, príp. aj SOX 11) a translokácie t(11;14)(q13;q32) najlepšie metódou FISH, pričom chýbanie týchto parametrov je relatívne zriedkavé,
- b) v rámci diferenciálnej diagnostiky veľkobunkových (blastických) CD20+ B-NHL je bioptická diagnostika agresívnych variantov MCL zložitejšia. Tieto varianty MCL majú difúzny spôsob rastu, podobne ako iné blastické NHL typu DLBCL a cytologické črty tu nie sú nijako špecifické pre MCL. Pleomorfný MCL je nutné odlíšiť od DLBCL, najmä tých, ktoré sú tiež pozitívne pri dôkaze cyklínu D1, prípadne CD5, a to s podporou FISH analýzy v zmysle pátrania po t(11;14) (q13;q32), resp. iných translokáciách asociovaných s DLBCL (najmä BCL6 a pod.). Blastoidný variant MCL vyžaduje odlíšenie lymfoblastómu, resp. ALL, použijúc jednak panel protilátok na dôkaz ALL, ako aj komplexnú genetickú analýzu (dôkazu translokácie t(11;14) (q13;q32), resp. genetických abnormalít asociovaných s ALL).
POĎAKOVANIE
Podporené projektom OPVaV-2008/2.1/01-SORO – Centrum excelentnosti CEPV I. (IMTS kód 26220120016) a CEPV II. (IMTS kód 26220120036) na Jesseniovej lekárskej fakulte Univerzity Komenského v Martine, ktorý je spolufinancovaný z prostriedkov EÚ.
Adresa pro korespondenci:
Prof. MUDr. Lukáš Plank, CSc.
Ústav patologickej anatómie JLF UK a UNM
Kollárova 2, 036 01 Martin, Slovenská republika
tel: (+421)-434133002
e-mail: plank@jfmed.uniba.sk
Zdroje
1. Yang WI, Zukerberg LR, Motokura T. Cyclin D1 (Bcl-1, PRAD1) protein expression in low-grade B-cell lymphomas and reactive hyperplasia. Am J Pathol 1994; 145(1): 86–96.
2. De Boer CJ, van Krieken JHJM, Schuuring E, Kluin PM. Bcl-1/cyclin D1 in malignant lymphoma. Annals of Oncology 1997; Suppl. 2 : 109–119.
3. Swerdlow SH, Campo E, Harris, N.L. et al: WHO Classification of Tumours of Heamatopoietic and Lymphoid Tissues. 4th Ed. IARC, Lyon 2008, 439 s.
4. Kodet R, Mrhalová M, Krsková L, et al. Mantle cell lymphoma: improved diagnostics using a combined approach of immunohistochemistry and identification of(11;14) (q13;q32) by polymerase chain reaction and fluorescence in situ hybridization. Virchows Archiv 2003; 442 (6): 538–547.
5. Pileri SA, Falini B. Mantle cell lymphoma. Haematologica 2009; 94(11): 1488–1492.
6. Fernandez V, Salamero O, Espinet B, et al. Genomic and gene expression profiling defines indolent forms of mantle cell lymphoma. Cancer Res 2010; 70(4): 1408–1418.
7. Tut VM, Braithwaite KL, Angus B, Neal DE, Lunec J, Mellon JK. Cyclin D1 expression in transitional cell carcinoma of the bladder: correlation with p53, waf1, pRb and Ki67. British J Cancer 2001; 84(2): 270–275.
8. Guo SS, Wu X, Shimoide AT, Wong J, Moatamed F, Sawicki MP. Frequent overexpression of cyclin D1 in sporadic pancreatic endocrine tumours. J Endocrinol 2003; 179 : 73–79.
9. Plevova P, Cerna D, Foretova L, et al. CCND1 and ZNF217 gene amplification is equally frequent in BRCA1 and BRCA2 associated and non-BRCA breast cancer. Neoplasma 2010; 57(4): 325–332.
10. Elayat G, Selim, A-GA, Gorman P, Tomlinson I, Wells CA. Cyclin D-1 protein overexpression is not associated with gene amplification in benign and atypical apocrine lesions of the breast. Pathol Res Pract. 2010; 207 (2): 75–136.
11. Fu K, Weisenburger DD, Greiner TC, et al. Cyclin D1-negative mantle cell lymphoma: a clinicopathologic study based on gene expression profiling. Blood 2005; 106(13): 4315–4321.
12. Metcalf RA, Zhao S, Anderson MW, et al. Characterization of D-cyclin proteins in hematolymphoid neoplasms: lack of specificity of cyclin-D2 and D3 expression in lymphoma subtypes. Mod Pathol 2010; 23(3): 420–433.
13. Quintanilla-Martinez L, Slotta-Huspenina J, Koch I, et al. Differential diagnosis of cyclin D2+ mantle cell lymphoma based on fluorescence in situ hybridization and quantitative real-time-polymerase chain reaction. Haematologica 2009; 94 : 1595–1598.
14. Jares P, Campo E. Advances in the understanding of mantle cell lymphoma. Br J Haematol 2008; 142 : 149–165.
15. Mozos A, Royo C, Hartmann E. SOX11 expression is highly specific for mantle cell lymphoma and identifies the cyclin D1-negative subtype. Haematologica 2009; 94(11): 1555–1562.
16. Chen YH, Gao J, Fan G, Peterson LC. Nuclear expression of sox11 is highly associated with mantle cell lymphoma but is independent of t(11;14)(q13;q32) in non-mantle cell B-cell neoplasms. Mod Pathol 2010; 23(1): 105–112.
17. Elnenaei MO, Jadayel DM, Matutes E, et al. Cyclin D1 by flow cytometry as a useful tool in the diagnosis of B-cell malignancies. Leuk Res 2001; 25(2): 115–123.
18. Ruchlemer R, Parry-Jones N, Brito-Babapulle V, et al. B-prolymphocytic leukaemia with t(11;14) revisited: a splenomegalic form of mantle cell lymphoma evolving with leukaemia. Br J Hematol 2004; 125(3): 330–336.
19. Bosch F, Campo E, Jares P, et al. Increased expression of the PRAD-1/CCND1 gene in hairy cell leukaemia. Br J Hematol 1995; 91(4): 1025–1030.
20. Miranda RN, Briggs RC, Kinney MC, et al. Immunohistochemical detection of cyclin D1 using optimized conditions is highly specific for mantle cell lymphoma and hairy cell leukemia. Mod Pathol 2000; 13(12): 1308–1314.
21. Ishida F, Kitano K, Ichikawa N, et al. Hairy cell leukemia with translocation (11;20)(q13;q11) and overexpression of cyclin D1. Leuk Res 1999; 23(8): 763–765.
22. Falini B, Tiacci E, Liso A, et al. Simple diagnostic assay for hairy cell leukaemia by immunocytochemical detection of annexin 1(ANXA1). Lancet 2004; 363(9424): 1869–1870.
23. Soverini S, Cavo M, Cellini C, et al. Cyclin D1 overexpression is a favorable prognostic variable for newly diagnosed multiple myeloma patients treated with high-dose chemotherapy and single or double autologous transplantation. Blood 2003;102 : 1588–1594.
24. Bergsagel PL, Kuehl WM. Molecular pathogenesis and a consequent classification of multiple myeloma. J Clin Oncol 2005; 23(26): 6333–6338.
25. Kuehl WM, Bergsagel PL. Early genetic events provide the basis for a clinical classification of multiple myeloma. Hematol Am Soc Educ Program 2005 : 346–352.
26. Chiecchio L, Dagrada GP, Ibrahim AH, et al. Timing of acquisition of deletion 13 in plasma cell dyscrasias is dependent on genetic context. Hematologica 2009; 94(12): 1708–1713.
27. Markovic O, Marisavljevic D, Cemerikic V, et al.: Immunohistochemical analysis of cyclin D1 and p53 in multiple myeloma: relationship to proliferative activity and prognostic significance. Med Oncol 2004; 21(1): 73–80.
28. Hájek R, Adam Zd, Maisnar V, et al.: Diagnostika a léčba mnohočetného myelomu. Doporučení vypracované Českou myelomovou skupinou, Myelomovou sekcí České hematologické společnosti a Slovenskou myelómovou spoločností pro diagnostiku a léčbu mnohočetného myelomu. Transfuze Hematol. dnes 2009, 15, Suppl.2 : 1–80.
29. Schneider A, Meyer P, DiMaio D, Fu K. Diffuse large B-cell lymphoma with both CD5 and cyclin D1 expression—a case report and review of the literature. J Hematopathol 2010; 3(4): 145–148.
30. Yamaguchi M, Seto M, Okamoto M, et al.: De novo CD5+ diffuse large B-cell lymphoma: a clinicopathologic study of 109 patients. Blood 2002; 99 : 815–821.
31. Rodriguez-Justo M, Huang Y, Ye H, et al. Cyclin D1-positive diffuse large B-cell lymphoma. Histopathology 2008; 52(7): 900–903.
32. Teruya-Feldstein J, Gopalan A, Moskowitz CH. CD5 negative, cyclin D1-positive diffuse large B-cell lymphoma (DLBCL) presenting as ruptured spleen. Appl Immunohistochem Mol Morphol 2009; 17(3): 255–258.
33. Plank L, Hansmann M-L, Lennert K. Centrocytic lymphoma. Am J Surg Pathol. 1993; 17(6): 638–639.
Štítky
Patologie Soudní lékařství Toxikologie
Článek Pokroky v hematopatologiiČlánek HEMATOPATOLOGIEČlánek ORTOPEDICKÁ PATOLOGIEČlánek JAKÁ JE VAŠE DIAGNÓZA?
Článek vyšel v časopiseČesko-slovenská patologie

2011 Číslo 3-
Všechny články tohoto čísla
- Kvantitativní molekulární analýza u lymfomu z buněk pláště
- Burkittův lymfom (BL): reklasifikace 39 lymfomů diagnostikovaných v minulosti jako BL nebo Burkitt-like lymfom s využitím imunohistochemie a fluorescenční in situ hybridizace
- Naše skúsenosti s vyšetrovaním JAK2 mutácií pacientov s myeloproliferatívnymi ochoreniami z trepanobioptického materiálu kostnej drene
- Koincidence chronické lymfatické leukémie a karcinomu z Merkelových buněk: delece RB1 genu v obou nádorech
- ORTOPEDICKÁ PATOLOGIE
- JAKÁ JE VAŠE DIAGNÓZA?
- Leiomyóm maternice s amianthoid-like vláknami
- Glomus tumor žaludku – popis případu a přehled literatury
- Změny sliznice tlustého po přípravě polyetylenglykolem jsou méně výrazné než po přípravě sodiumfosfátem
- HEMATOPATOLOGIE, NEUROPATOLOGIE, PATOLOGIE MAMMY...
- Pokroky v hematopatologii
- Dobré nápady stejně jako dobré víno zrají dlouho
- PATOLOGIE GIT, PATOLOGIE ORL OBLASTI, PULMOPATOLOGIE ...
- Hematopatologická diagnostika
- Histologická diagnostika Ph-negativních myeloproliferativních neoplázií
- HEMATOPATOLOGIE
- Maligní lymfomy aneb co očekává klinik od patologa?
- Význam detekcie cyklínu D1 (a CD5) v diagnostike malígnych lymfómov iných než je lymfóm z plášťových buniek
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Naše skúsenosti s vyšetrovaním JAK2 mutácií pacientov s myeloproliferatívnymi ochoreniami z trepanobioptického materiálu kostnej drene
- Histologická diagnostika Ph-negativních myeloproliferativních neoplázií
- JAKÁ JE VAŠE DIAGNÓZA?
- Význam detekcie cyklínu D1 (a CD5) v diagnostike malígnych lymfómov iných než je lymfóm z plášťových buniek
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



