-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Atopická dermatitida a psychické komorbidity
Atopic Dermatitis and Mental Comorbidities
Atopic dermatitis is an inflammatory skin disease associated with an increased risk of a number of comorbidities, including mental disorders, which can worsen the course of the skin disease. The most common mental comorbidities include depressive disorder, anxiety disorder, attention deficit, hyperactivity disorder, autism and increased suicidal activity (suicidal thoughts or self-harm in suicidal ideation). Pathophysiology is multifactorial, currently there is increasing evidence of the involvement of multiple immune mechanisms, stress, sleep deprivation and other socioeconomic and behavioral factors play an important role. Concerning the course and prognosis of atopic dermatitis, mental comorbidities must be recognized in time. Simple instruments in the form of selfevaluation scales can be used for detection. Treatment should take place in collaboration with psychiatrists and psychologists using targeted psychotropic drugs or psychotherapy. Hope in the treatment of atopic dermatitis are monoclonal antibodies directed against pro-inflammatory cytokines, which could bring relief to patients also in the area of mental health.
Keywords:
etiopathogenesis – atopic dermatitis – treatment – psychological comorbidities
Autoři: M. Anders 1; S. Gkalpakiotis 2; F. Rob 3; M. Salavec 4; A. Machovcová 5; M. Selerová 6; H. Obluková 7; E. Kitzlerová 1
Působiště autorů: Psychiatrická klinika 1. LF UK a VFN v Praze, přednosta doc. MUDr. Martin Anders, Ph. D. 1; Dermatovenerologická klinika 3. LF UK a FNKV, Praha, přednosta prof. MUDr. Petr Arenberger, DrSc., MBA, FCMA 2; Dermatovenerologická klinika 2. LF UK a FNB, Praha, přednosta doc. MUDr. Filip Rob, Ph. D. 3; Klinika nemocí kožních a pohlavních LF UK v Hradci Králové a FN Hradec Králové, přednosta doc. MUDr. Miloslav Salavec, CSc. 4; Dermatovenerologické oddělení FNM, Praha, primářka MUDr. Alena Machovcová, Ph. D., MBA 5; Dermatovenerologické oddělení Nemocnice Agel Nový Jičín, primářka MUDr. Jana Chlebková 6; Dětské kožní oddělení Pediatrické kliniky FN Brno, primářka MUDr. Blanka Pinková, Ph. D. 7
Vyšlo v časopise: Čes-slov Derm, 97, 2022, No. 5, p. 196-208
Kategorie: Terapie, farmakologie a klinické studie
Souhrn
Atopická dermatitida je zánětlivé kožní onemocnění spojené se zvýšeným rizikem výskytu celé řady komorbidit, včetně duševních poruch, které mohou negativně ovlivňovat průběh kožního onemocnění. Mezi nejčastější psychické komorbidity patří depresivní porucha, úzkostná porucha, porucha pozornosti a hyperaktivita, autismus; je přítomna zvýšená suicidální aktivita (suicidální myšlenky či sebepoškození v suicidálním úmyslu). Patofyziologie je multifaktoriální, v současné době přibývá evidence o zapojení více imunitních mechanismů, důležitou roli hraje stres, spánková deprivace a další socioekonomické a behaviorální faktory. Z hlediska průběhu a prognózy atopické dermatitidy je třeba psychické komorbidity včas rozpoznat. K detekci lze využít i jednoduché instrumenty v podobě autoevaluačních škál. Léčba by měla probíhat ve spolupráci s psychiatry a psychology s využitím cílených psychofarmak či psychoterapie. Nadějí v léčbě atopické dermatitidy jsou monoklonální protilátky zaměřené proti prozánětlivým cytokinům, které by mohly přinést úlevu pacientům i v oblasti psychického zdraví.
Klíčová slova:
etiopatogeneze – léčba – atopická dermatitida – psychické komorbidity
ÚVOD
Atopická dermatitida (AD) (synonymum atopický ekzém) je zánětlivé kožní onemocnění charakterizované recidivujícími ekzematózními ložisky provázené intenzivním svěděním. Postihuje osoby všech věkových kategorií a etnických skupin s roční prevalencí odhadovanou na 20 % u dětí, 4–10 % u dospělých, a výrazným psychosociálním dopadem jak na samotné pacienty, tak na jejich příbuzné [1, 65]. Vyskytuje se převážně v kojeneckém a dětském věku. U 60 % postižených se poprvé manifestuje v prvním roce života, u 85 % do 5 let věku [65].
Atopická dermatitida je spojena se zvýšeným rizikem výskytu celé řady komorbidit včetně potravinové alergie, astmatu, alergické rýmy, duševních poruch atd. Patofyziologie je multifaktoriální, zahrnuje genetickou predispozici, narušenou epidermální bariéru s přemnožením Staphylococuss aureus, abnormality kožního mikrobiomu a imunitní dysregulaci, převážně zánětlivou reakci podmíněnou aktivací Th lymfocytů a environmentální spouštěče (např. alergeny, které aktivují imunitní systém). V současné době přibývá ale stále více důkazů o zapojení více imunitních mechanismů [33]. Před mnoha lety, než se potvrdila zánětlivá etiologie atopického ekzému, bylo toto nemocnění považováno čistě za „psychosomatické“ a patřilo spolu s bronchiálním astmatem mezi sedm základních psychosomatických chorob [2]. Zásadní roli v patogenezi atopické dermatitidy hraje stres. Dysregulace homeostatických neuronálních, endokrinních a imunologických mechanismů při chronickém stresu vede k chronické hyperreaktivitě, která je spouštěčem nemoci, a zároveň ovlivňuje náladu a míru osobní pohody [40]. Ovlivnění psychického stavu nemocných závisí na stupni závažnosti onemocnění.
Prevalence atopické dermatitidy se liší u jednotlivých etnik. Americké studie zaznamenaly vyšší prevalenci u africko-amerického etnika (17 %) než u bílé rasy (11 %) [27]. V USA postihuje toto kožní onemocnění 18 milionů dospělých (7,2 %) a 9,6 milionů dětí (13 %) [67, 68]. Celosvětově postihuje 20–30 % dětí a 3–10 % dospělých [23, 73].
VÝSKYT PSYCHOPATOLOGIE DOPROVÁZEJÍCÍ ATOPICKOU DERMATITIDU
U pacientů trpících AD je vyšší riziko výskytu duševních poruch. Mezi základní psychické komorbidity AD patří depresivní porucha, úzkostná porucha, porucha pozornosti a hyperaktivita, autismus; je přítomna zvýšená suicidální aktivita (suicidální myšlenky či sebepoškození v suicidálním úmyslu) [50, 52].
Diskutuje se o více hypotézách vzniku a rozvoje psychických komorbidit u atopického onemocnění. Za jeden ze zásadních faktorů společné patogeneze je považována dlouhodobá spánková deprivace, resp. poruchy spánku, které souvisejí s pruritem a škrábáním kůže v nočních hodinách [14, 34, 54, 64]. Kvalita spánku je narušena přímo úměrně s mírou závažnosti kožního onemocnění. Na poruchách spánku se může dále podílet psychická nepohoda nemocných, což má následně negativní dopad na jejich denní aktivity a fungování, roste počet dní strávených v pracovní neschopnosti, a také počet návštěv u lékařů [64]. Bylo prokázáno, že AD bez doprovodných spánkových poruch nezvyšovala riziko vzniku duševních chorob u dětí, z čehož lze usuzovat, že poruchy spánku hrají centrální roli při rozvoji psychopatologie spojené s AD [61].
Společné biologické patofyziologické mechanismy zahrnují dále aktivaci imunitního systému, resp. prozánětlivých cytokinů schopných penetrovat hematoencefalickou bariérou a aktivovat neurobiologický substrát přispívající k rozvoji duševních poruch [14, 59, 77]. Roli hraje hypothalamo-pituito-adrenální osa, sympatoadrenomedulární systém, periferní nonadrenergní noncholinergní nervová vlákna a senzorické podněty z periferních atopických zánětlivých lézí [22, 40, 76]. Kromě centrální role T helperů (Th1, Th2) jsou do možných patofyziologických mechanismů zapojeny oxidativní stres, glukokortikoidní rezistence a střevní dysmikrobie [75]. Přehled je na obrázku 1.
Obr. 1. Etiopatogeneze psychických potíží při atopické dermatitidě a vliv cytokinů na funkci mozku 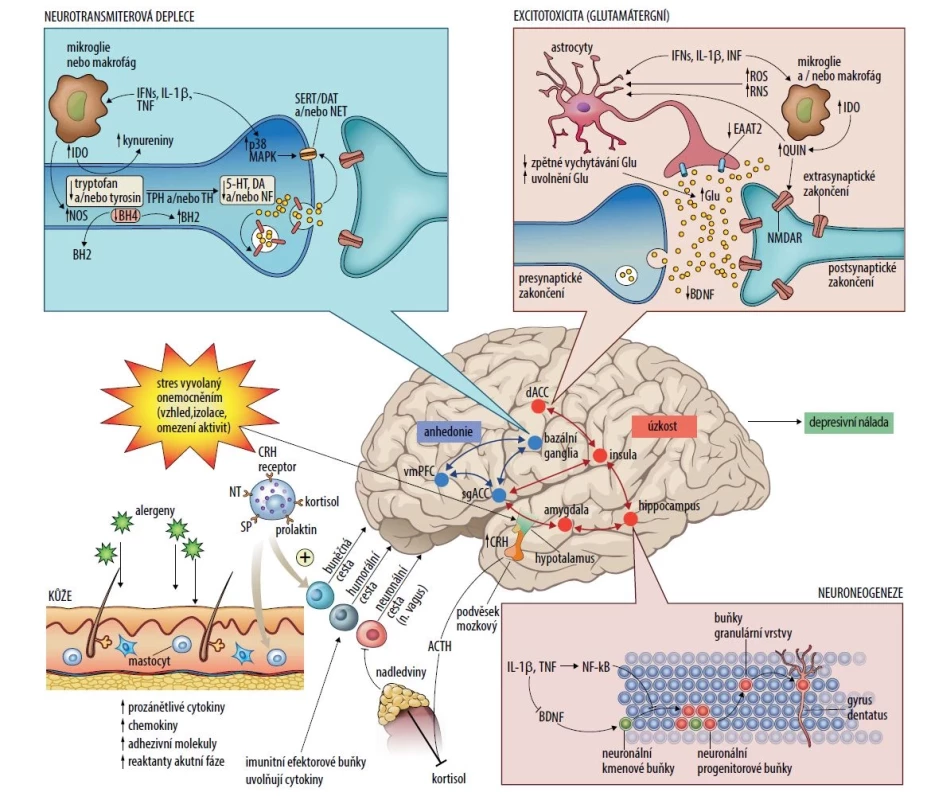
Kromě psychosociálních stresových faktorů propagujících se do funkce organismu cestou hypotalamicko-hypofyzární-nadledvinové osy je odolnost jedince vůči této zátěži negativně ovlivňována zásadními biologickými mechanismy. Aktivace imunitního systému (nízkoaktivní zánětlivé procesy) probíhající kdekoliv v organismu mohou ovlivnit cestou metabolických a molekulárních mechanismů neurotransmiterové systémy, čímž změní funkci neuronálních sítí regulujících chování jedince. Změna se týká především emotivity (anhedonie), motivace (apatie), úzkosti a vyhýbání se, což jsou symptomy některých psychických onemocnění včetně depresivní poruchy.
Na molekulární úrovni mohou prozánětlivé cytokiny včetně interferonů typu I a II, interleukinu 1β a tumor nekrotizujícího faktoru snižovat dostupnost monoaminů – serotoninu, dopaminu a noradrenalinu, tím, že zvyšují expresi a funkční aktivitu presynaptických transportérů zpětného vychytávání pro serotonin, dopamin a noradrenalin prostřednictvím aktivace dráhy mitogenem aktivované proteinkinázy, a snížením syntézy monoaminů prostřednictvím poklesu enzymatických kofaktorů, jako je tetrahydrobiopterin. Průnik cytokinů do mozku se děje cestou buněčnou, humorální nebo neuronální (via axony hlavových nervů). Cytokiny mohou snižovat množství monoaminových prekurzorů aktivací enzymu indoleamin-2,3-dioxygenázy, který metabolizuje tryptofan, primární prekurzor serotoninu, na kynurenin. Aktivovaná mikroglie může přeměnit kynurenin na kyselinu chinolinovou, která se váže na N-metyl-D-aspartátové receptory (receptory pro glutamát). Spolu s cytokiny indukovaným snížením zpětného vychytávání glutamátu astrocyty a stimulací uvolňování glutamátu astrocyty, částečně indukcí reaktivních forem kyslíku a reaktivních forem dusíku, může vést k nadměrnému množství excitačního glutamátu. Nadměrné množství glutamátu, zejména pokud se váže na extrasynaptické NMDA receptory, může následně vést ke snížení tvorby neurotrofického faktoru BDNF a k excitotoxicitě. Vliv zánětu na růstové faktory v gyrus dentatus hipokampu může také ovlivnit přežívání a základní integritu neuronů včetně neuroneogeneze, schopnosti vzniku dlouhodobé potenciace a dendritického pučení, což v konečném důsledku ovlivňuje učení a paměť. Účinky cytokinů na neurotransmiterové systémy, zejména dopamin, mohou inhibovat funkci systému odměny (i motivace k odměně) a vyvolat anhedonii změnami v kortikostriatálních spojeních zahrnujících bazální ganglia, ventromediální prefrontální kůru a subgenuální a dorzální část předního cingulátového kortexu. Současně dochází k aktivaci neuronálního processingu regulujícího úzkost, podráždění, poplachovou reakci a strach, na čemž se podílí amygdala, hipokampus, dorzální přední cingulátový kortex a inzula.
Zkratky: 5-HT – serotonin, BNDF – neurotrofický faktor (brain derived neurotrofic factor), BH2 – dihydrobiopterin, BH4 – tetrahydrobiopterin, CRH – kortikoliberin, DA – dopamin, DAT – dopaminový transportér, dACC – dorzální přední cingulární kortex, EAAT2 – transportér excitačních aminokyselin 2, GLU – glutamát, IDO – indoleamin-2,3-dioxygenáza, IFN – interferony, IL 1β – interleukin 1β, MAPK – mitogenem aktivovaná proteinkináza, NET – noradrenalinový transportér; NF-κB – nukleární faktor-κB, NA – noradrenalin, NMDA – receptory N-metyl-D-aspartátové receptory, NT – neurotransmiter, RNS – reaktivní formy dusíku, ROS – reaktivní formy kyslíku, SERT – serotoninový transportér, sgACC – subgenuální přední cingulární kortex, SP – substance P, TH – tyrosinhydroxyláza; TNF – tumor nekrotizující faktor, TPH – tryptofanhydroxyláza, vmPFC – ventromediální prefrontální kůra, QUIN – kyselina chinolinová.Dalšími společnými patofyziologickými faktory jsou faktory psychosociální (behaviorální a socioekonomické), jejichž působení je obousměrné. Stres může mít negativní dopad na chování, negativně ovlivňovat stravovací návyky, vést k nedostatku fyzické aktivity, poruchám spánku, intenzivnějšímu kouření, zneužívání psychoaktivních látek a lékové nonadherenci, což vede k progresi AD. Na druhou stranu AD může negativně ovlivňovat duševní zdraví prostřednictvím chronických a nestabilních symptomů, dlouhodobě neuspokojivé léčby a kumulujících se nákladů na zdravotní péči, narušením sociálního fungování doma, ve škole, na pracovišti [40]. AD představuje sama o sobě závažný stresor, kožní projevy onemocnění způsobují rozpaky, stud nemocných, snižují jejich sebevědomí a mohou způsobovat spánkovou deprivaci, což prohlubuje závažnost průběhu nemoci, vede ke stigmatizaci a celkově negativním psychosociálním a zdravotním důsledkům [66].
V separátní metaanalýze tří typů psychosociálních faktorů bylo prokázáno, že psychická nepohoda, tíseň a nedostatečná sociální podpora, nikoliv však expozice vlastním stresorům běžného dne a života, mají statisticky signifikantní vliv na průběh atopického onemocnění. Prokazatelné jsou individuální rozdíly ve vulnerabilitě k rozvoji onemocnění pod vlivem stejných stresových životních událostí a kvalitě sociální podpory [43]. Data ze studií dvojčat naznačují vztah mezi AD a psychickou tísní, což by mohlo do jisté míry vysvětlit vztah mezi atopickým onemocněním a psychickými obtížemi typu deprese či anxiety. Při analýze dětské a dospělé populace byl prokázán výraznější vztah mezi psychosociálními faktory a atopií u dětí. Současné evidence dokládají, že u většiny dětí s atopickým onemocněním došlo k polarizaci jejich imunitního systému do atopického fenotypu ještě před narozením [9]. Navíc gestační expozice stresu matky může změnit látkovou (humorální) imunokompetenci potomků. Absence mateřské péče může být příčinou změny imunitní odpovědi a narušené emoční stability potomků. Je tedy evidentní, že prenatální i postnatální stres může akcelerovat rozvoj atopického dermatitidy.
Mezi psychické komorbidity AD v raném věku se řadí poruchy autistického spektra a porucha pozornosti s hyperaktivitou, nicméně etiopatogeneze není zcela vyjasněna. Vysvětlení by mohlo být i zde spatřováno ve vlivu cytokinů, resp. jejich biologické interakce, s vyvíjecím se mozkem, a to jak prenatálně, tak postnatálně. Věk výskytu AD, nespavost a užívání antihistaminik mohou hrát roli ve společné etiopatogenezi [11]. Je prokázáno, že alergie mají přímý vztah k onemocněním autistického spektra, Tourettova syndromu, tikovým poruchám, poruchám učení a psychotickým stavům [36, 77]. Děti trpící atopickým onemocněním dosahují nižších studijních výsledků, podobně jako dospělí trpící AD mají méně pracovních příležitostí ve srovnání se zdravými dospělými [49].
Systematické přehledy se zaměřují především na komorbiditu AD s depresivní a úzkostnou poruchou a zvýšeným rizikem výskytu suicidálních myšlenek [37, 62]. Systematické review a metaanalýza Sandhu et al. z roku 2018 vyhodnotila 15 studií s 310 681 nemocnými trpícími AD a prokázala, že u těchto nemocných byl o 44 % vyšší výskyt suicidálních myšlenek a o 36 % více suicidálních pokusů ve srovnání s nemocnými bez kožního onemocnění [55]. Data o dokonaných sebevraždách jsou omezená a nekonzistentní. Na zvýšené suicidální aktivitě se podílí fyzická i psychosociální zátěž, obtěžující pruritus, pálení a bolest kůže, a s tím související spánková deprivace [17, 29]. Z psychosociálních faktorů se jedná především o stigmatizaci, stud z onemocnění a narušení fungování ve škole i v zaměstnání. Na patogenezi zvýšené suicidality se dále podílejí prozánětlivé cytokiny. Jejich vyšší koncentrace v centrálním nervovém systému mohou významně narušit neuroneogenezi, zvýšit koncentraci neurotoxických látek a negativně ovlivnit tvorbu neurotransmiterů, a tím narušit funkční aktivitu specifických neuronálních okruhů [30] – obr. 2. Vyšší koncentrace prozánětlivých cytokinů byly zjištěny v mozkomíšním moku pacientů po suicidálním pokusu [38]. Existují první informace o tom, že biologická léčba AD cílená na interleukin 4 a interleukin 13 dupilumabem byla účinná v léčbě příznaků poruch nálady a anxiety u nemocných trpících AD [69], což je významným příslibem redukce doprovodné psychopatologie. Ve studii [48] bylo prokázáno, že vyšší riziko sebevražedných myšlenek a pokusů je u mladých dívek trpících AD, které vykazovaly vyšší míru nespokojenosti a nižší sebevědomí než u mladých chlapců.
Obr. 2. Zánětem indukované změny aktivity enzymů indoleamin-2,3-dioxygenázy a GTP-cyklohydrolázy 1 a jejich vliv na výskyt doprovodných neuropsychických symptomů 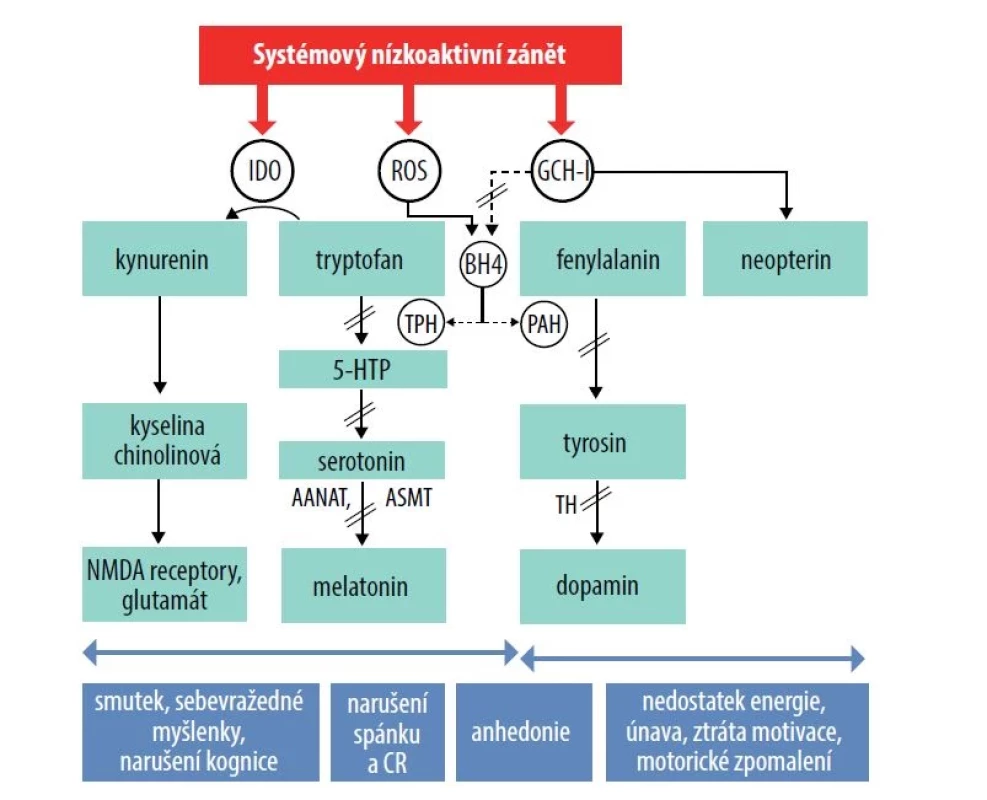
Zánětlivé faktory (cytokiny) aktivují enzymy indoleamin-2,3-dioxygenázy (IDO) a GTP-cyklohydrolázy 1, které jsou zapojeny do procesu biosyntézy serotoninu, dopaminu a glutamátu. Aktivace enzymu IDO vede ke zvýšené degradaci tryptofanu, esenciální aminokyseliny a prekurzoru serotoninu, za vzniku kynureninu, což přispívá ke vzniku serotoninové deplece. Kynurenin dále podléhá metabolismu za vzniku glutamátergních neuroaktivních látek, především kyseliny chinolinové, která stimuluje NMDA receptory a podporuje oxidativní stres. Tento mechanismus se podílí na rozvoji afektivních a kognitivních symptomů spojených se zánětlivým procesem, a to včetně smutné nálady, sebevražedných myšlenek, kognitivního narušení a anhedonie (ztráty schopnosti prožívat pozitivní emoce). Aktivace enzymu GCHI zánětlivými procesy vede k tvorbě neopterinu na úkor tetrahydrobiopterinu (BH4), který je esenciálním kofaktorem pro enzym fenylalanin hydroxylázu/tyrozin hydroxylázu, tryptofan hydroxylázu a syntetázy oxidu dusnatého, které se podílejí na syntéze serotoninu, dopaminu a oxidu dusnatého. Zánětlivé faktory rovněž vyvolávají tvorbu vysokého množství reaktivních forem kyslíku, které ničí oxidačně labilní BH4, čímž ještě prohlubují jeho deficit. Zánětem podmíněné změny v aktivitě GCH-I/BH4 přispívají k rozvoji únavy, nedostatku energie, snížené motivace, zpomalení motoriky a anhedonie.
Deplece serotoninu se projeví i v nedostatku syntetizovaného melatoninu, hlavního regulátoru cirkadiánního rytmu. Serotonin, prekurzor melatoninu, je metabolizován cestou aralkylamin N-acetyltransferázy na N-acetylserotonin a dále acetylserotonin methytransferázou na melatonin. Nedostatek melatoninu může přispět vzniku poruch spánku a narušení cirkadiánního rytmu. Zkratky: 5-HTP – 5-hydroxytryptofan, AANAT – aralkylamin N-acetyltransferáza, ASMT – acetylserotonin methytransferáza, BH4 – tetrahydrobiopterin, CR – cirkadiánní rytmus, GCH-I – GTP-cyklohydroláza-1, IDO – indoleamin-2,3-dioxygenáza, NMDAR – N-metyl- D-aspartátové receptory, PAH – fenylalaninhydroxyláza, ROS – reaktivní formy kyslíku, TH – tyrosinhydroxyláza, TPH – tryptofanhydroxyláza.Mezi nemocnými trpícími závažnějšími stupni kožního onemocnění se vyskytuje vyšší míra prevalence suicidálních úvah, nikoliv dokonaných suicidií. Závažnější formy AD jsou spojeny s výraznější spánkovou deprivací, závažnějším pruritem a závažnějšími epizodami depresivní poruchy a anxiety, což přispívá k vyšší míře suicidální aktivity [70].
DETEKCE NEJČASTĚJŠÍCH DUŠEVNÍCH PORUCH DOPROVÁZEJÍCÍCH ATOPICKOU DERMATITIDU
Komorbidní depresivní porucha
Podobně jako v jiných oblastech medicíny je včasné a adekvátní rozpoznání psychické komorbidity nezbytným předpokladem pro její další vývoj a léčebné ovlivnění. Někdy bývá složité především odlišení příznaků přímo souvisejících s tělesným onemocněním, ale typické mohou být stížnosti nemocných na jeden či spíše kombinaci více tělesných příznaků např. únavu, bolest, poruchy spánku, podrážděnost, úzkost nebo nervozitu. V některých případech změny psychického stavu nejsou vnímány samotnými pacienty a upozorní na ně blízké osoby nebo změna obvyklého chování (podrážděnost, hostilita) pacienta při kontaktu se specialistou. Lékař má příležitost otevřít dialog a cílenými dotazy odhalit například pokles nálady neodpovídající okolnostem či přítomnost ztráty zájmů. Varovným znamením přítomnosti depresivní poruchy bývají i častější návštěvy lékaře, časté využívání lékařské pohotovostní služby nebo konzumace jiné zdravotní péče, a to zvláště pro potíže, které přímo nesouvisí se specifickým tělesným onemocněním a jeho aktivitou. Pravděpodobnost přítomnosti depresivní poruchy obecně vzrůstá s počtem symptomů, které nemocný prezentuje [31]. Zvýšenou pozornost si zaslouží především nespavost, protože je velmi častá a nemocní trpící poruchami nálady udávají její výskyt až v 90 % [7]. Nespavost je pro nemocné „neutrální“ symptom, podobně jako bolest. Pacient se nebrání je prezentovat či přiznat, na rozdíl od řady psychických potíží, které mohou v nemocném budit obavy a strach z „dopadů“ přítomnosti duševní choroby. Nemocný si nemusí depresivní náladu plně uvědomovat anebo ji spojuje s nedostatkem spánku, a typicky prohlašuje, že kdyby se zbavil nespavosti, psychické potíže zmizí.
Pro případ identifikace komorbidní depresivní symptomatiky lze využít cílené rozpoznávání depresivních příznaků u jedinců podle Britského institutu NICE [45], který doporučuje lékařům, aby byli ostražití u nemocných s již prodělanými epizodami depresivní poruchy, ale také při dlouhodobém výskytu tělesných poruch spojených s funkčním poškozením, a aby svým pacientům položili dvě otázky:
1. Cítil jste se v průběhu posledního měsíce na dně, depresivní, bez nálady nebo beznadějně?
2. Ztratil jste v průběhu posledního měsíce zájem nebo potěšení z aktivit, které Vám je obvykle přinášely?
Tyto dvě jednoduché otázky vykazují 97% senzitivitu a 67% specificitu [4]. Pokud je alespoň jedna z odpovědí pozitivní, měl by lékař přistoupit k podrobnějšímu vyšetření a podle výsledku případně zahájit léčbu nebo odeslat pacienta ke specialistovi.
Existují i další užitečné nástroje, které mohou sloužit rozpoznání, měření závažností a funkčního poškození, podobně jako zachycení změn probíhajících v čase: Patient Health Questionnaire (PHQ-9), Quick Inventory of Depressive Symptomatology – lékařem administrovaný (QIDS-C) a sebehodnoticí (QIDS-SR) a Beckova sebeposuzovací stupnice deprese (BDI) [6], u které pro konstatování, že pacient trpí depresivní poruchou (klasifikovatelnou podle MKN-10), je nezbytné, aby odpověděl kladně (tj. 1–3 body) na dvě z otázek 1, 4, 12, a dále kladně hodnotil příznaky v otázkách 3, 5, 6, 7, 9, 10 a 13 tak, aby naplnil celkově minimálně 4 příznaky (mírná depresivní epizoda) nebo 6 (středně těžká depresivní epizoda) či 8 (těžká depresivní epizoda). BDI nezahrnuje položku spánku (insomnie nebo hypersomnie), kterou lze také považovat za jeden z důležitých, ale ne hlavních příznaků. Současně při hodnocení poruchy chuti k jídlu lze považovat za kladné hodnocení i zvýšení chuti k jídlu.
Stupnice může být nápomocna i při identifikaci suicidálního rizika. Beckova sebeposuzovací stupnice deprese obsahuje položku č. 7 „Myšlenky na sebevraždu“, která jednoznačně kvantifikuje míru suicidálního rizika (vůbec mi nenapadne na mysl, že bych si měl něco udělat; mám pocit, že by bylo lépe nežít; často přemýšlím, jak spáchat sebevraždu; kdybych měl příležitost, tak bych si vzal život). Zahájit rozhovor týkající se přítomnosti sebevražedných úvah a zajímat se o sebevražedné myšlenky či úvahy pacienta nemusí být snadné. Pro iniciaci lze s výhodou využít odpovědí, které pacient zaznamenal do autoevaluačních dotazníků. Doporučeno je, s ohledem na pacienta, téma postupně gradovat za využití prostoru vzájemné konzultace, spíše než kritického či přímo konfrontačního způsobu. Přímo otázkou: Myslel jste v poslední době na to, že by bylo lepší zemřít. Měl jste nějaký plán, jak to udělat? Možné je použít také nepřímé otázky: Nevadilo by vám zemřít?
Komorbidní úzkostná porucha
Pro potřeby nepsychiatrické a primární péče bylo vytvořeno několik nástrojů pro detekci úzkostných poruch. Jedním z nich je instrument s názvem General Anxiety Disorder-7 (GAD-7), jehož administrace je jednoduchá a časově nenáročná [71]. Hodnotí období předchozích dvou týdnů a vykazuje citlivost 89 % a specificitu 82 % vůči úzkostné poruše.
Pro velmi stručnou detekci byla testována ultrakrátká GAD-2 obsahující dvě otázky zahrnující jádrové příznaky generalizované úzkostné poruchy, kdy je třeba položit dvě otázky:
1. Jak často Vás v posledních dvou týdnech obtěžoval pocit nervozity, úzkosti nebo napětí?
2. Jak často Vás v posledních dvou týdnech obtěžovala neschopnost zastavit nebo kontrolovat obavy.
Hodnocení vychází především z přítomnosti a frekvence přítomných příznaků, a i zde platí, že při pozitivním záchytu by mělo být postupováno analogicky jako při depresivní poruše.
Dotazník GAD-7
Jak často Vás během posledních dvou týdnů trápilynásledující potíže?
Skóre GAD-7: závažnost je rozdělena dle celkového skóre do čtyř kategorií podle míry závažnosti úzkosti. Rostoucí celkové skóre stupnice souvisí s několika oblastmi funkčního poškození.
1. 0–4 minimální míra úzkosti
2. 5–9 mírná míra úzkosti
3. 10–14 střední míra úzkosti
4. 15–21 vysoká míra úzkosti
Využít lze i autoevaluační stupnici Beckův inventář úzkosti validovaný v České republice [24], kde celkové skóre určuje míru závažnosti (< 21 bodů značí nepřítomnost významné anxiety). I zde je třeba, aby byly naplněny základní příznaky, tj. výrazné napětí, obavy, zlé předtuchy (typický je pocit „jako by se mělo něco špatného stát“) u každodenních událostí a problémů.
ZÁKLADNÍ PRINCIPY FARMAKOTERAPIE KOMORBIDNÍCH DUŠEVNÍCH PORUCH U NEMOCNÝCH TRPÍCÍCH ATOPICKOU DERMATITIDOU
Ačkoliv v nepsychiatrické praxi bude patřit k nejčastěji používaným metodám léčby farmakoterapie, nelze opomíjet význam nespecifické formy psychoterapeutického působení terapeutického vztahu a autority lékaře, ale také placebo efektu, kterým jsou provázeny, jak somatická léčba, tak vyšetřovací metody a instrumentální zásahy [3].
Vlastním cílem psychofarmakologické intervence je potlačení nebo úplné odstranění psychických potíží, které vede ke zvýšení kvality života nemocného, ale často i k pozitivnímu ovlivnění průběhu základního onemocnění například vlivem na míru adherence k opatřením a léčbě. Nové poznatky potvrzují i možný vliv psychofarmak na vlastní etiopatogenetické procesy zánětlivých onemocnění.
I přes to, že existence a význam doprovodných psychických projevů při tělesném onemocnění jsou známy již mnoho let a stále expandují, neexistují dosud přesné formulace specifických farmakologických postupů léčby takových potíží, a proto se v klinické praxi většinou řídíme obecnými terapeutickými přístupy k léčbě depresivních a úzkostných poruch, samozřejmě s přihlédnutím k charakteristikám základního onemocnění a jeho jednotlivým projevům.
Antidepresiva
Antidepresiva jsou rozsáhlou skupinou léčiv, která odstraňují patologicky pokleslou, depresivní, náladu anebo úzkostné potíže. Mechanismus efektu antidepresiv je dlouhodobě spatřován v ovlivnění noradrenergních, serotoninergních, dopaminergních, glutamátergních a dalších systémů, inhibici zpětného vychytávání, přímého ovlivnění subtypů receptorů, inhibici enzymatického odbourávání apod. Podle nejmodernějších hypotéz antidepresiva napravují stresem nebo přítomností somatického onemocnění navozené změny v neuronálních sítích (deplece neurotransmiterů, neurotoxicita, zánik neuronů a inhibice novotvorby neuronů) a prostřednictvím genomických účinků zajišťují růstovými faktory podpořenou neuroprotektivitu či dokonce stimulují neuroneogenezu. V poslední době přibývají důkazy o schopnosti některých antidepresiv přímo snižovat tvorbu cytokinů charakteristickou pro jednotlivá tělesná onemocnění, čímž brzdí kaskádu následných dějů souvisejících s aktivací makrofágů a mikroglie. Pro jejich klinické působení je charakteristické, že léčebná odpověď se neprojeví hned po první dávce, ale s latencí několika dnů až 2–3 týdnů, což podporuje výše zmíněné hypotézy týkající se genomického působení.
Obecné zásady použití antidepresiv
Hlavním cílem léčby depresivní epizody je zmírnit její symptomy, a tím i utrpení pacienta, a to dříve, než by tato změna nastala v rámci přirozeného průběhu nemoci a předcházet vzniku dalších epizod. Jedna z největších metaanalýz prokázala, že antidepresiva jsou účinnější než placebo a jejich vzájemná účinnost je srovnatelná, odlišují se však v indukci nežádoucích účinků [8].
Pro základní léčbu antidepresivy lze doporučit následující praktická doporučení [3]:
1. Pokud pacient v minulosti reagoval dobře na určitý lék, měl by být tento použit znovu. Podobným způsobem je možné postupovat v případě pozitivní terapeutické reakce u přímých příbuzných.
2. Jde-li o první epizodu onemocnění, staršího nemocného nebo o pacienta s tělesnou komorbiditou, jsou dnes považovány za léčbu první volby SSRI. Rozhodneme - li se, po zvážení možného interakčního potenciálu, pro jeden z nich, zahajujeme v prvních několika dnech u nemocných s přítomnou úzkostí léčbu poloviční dávkou, abychom se vyhnuli prudkému iniciálnímu zvýšení anxiety. U starších pacientů kontrolujeme v průběhu léčby parametry vnitřního prostředí. Zcela nezbytné je monitorování suicidálního rizika v iniciální etapě léčby (především v prvním týdnu) obzvláště u mladších nemocných.
3. U nemocných s výraznou úzkostnou složkou nebo nespavostí bývá také výhodné užití kombinované léčby antidepresiva s anxiolytiky nebo hypnotiky. Existují vhodná antidepresiva, která dokážou upravit již v časných stadiích léčby poruchy spánku např. mirtazapin, trazodon a agomelatin.
4. Léčbu zahajujeme pouze jedním antidepresivem! Užitím kombinací se neúměrně zvyšuje riziko vzniku nežádoucích účinků. Složitější dávkovací schéma úzce souvisí s mírou adherence nemocného.
5. Pacient by měl lék užívat denně s tím, že pozitivní léčebnou odpověď lze očekávat za 2–3 týdny při užívání účinné terapeutické dávky antidepresiva. Při chybění pozitivní léčebné odpovědi je prvním krokem zvýšení dávky antidepresiva nebo při absenci jakéhokoliv účinku jeho záměna.
6. Nežádoucí účinky (nejčastěji gastrointestinálního typu) se mohou objevit v úvodu léčby, ale obvykle vymizí v průběhu 7–10 dní.
7. Vždy je nutné pacienta náležitě poučit a ideálně v akutní etapě léčby jej sledovat (nebo mu dát instrukce, kam se obrátit) jednou týdně po dobu 1. měsíce léčby, každé dva týdny ve 2. měsíci léčby. V pokračovací a udržovací etapě léčby je doporučeno pacienta sledovat v závislosti na klinickém stavu s frekvencí jednou za 4–6 týdnů (v některých případech i častěji) až jednou za 2–3 měsíce.
8. Léčbu účinným antidepresivem je možné ukončit až po 6–9měsíčním bezpříznakovém období, v přítomnosti trvalého tělesného onemocnění lze podávat dlouhodoběji.
9. Užíval-li nemocný terapeutickou dávku 3 měsíce a déle, mají se všechna antidepresiva vysazovat postupně. Náhlé vysazení tricyklických antidepresiv může způsobit syndrom z vysazení (závratě, pocení, chřipkovité potíže, nauzeu, vomitus, nechutentsví, parestezie, ataxii, třes, zvýšenou iritabilitu, akatizii, insomnii a děsivé sny, senzorickou hypersenzitivitu, cefalgie, únavnost, nesoustředěnost, agresivitu a suicidální úvahy) a cholinergní rebound fenomén, proto by vysazování mělo být pozvolné (o 25 % dávky každý týden). Syndrom z vysazení SSRI je nejčastější po paroxetinu a fluvoxaminu, výjimečně jej způsobuje odnětí citalopramu a setralinu, minimální potenciál má v tomto ohledu fluoxetin. Příznaky vymizí do 24 hodin p o opětovném nasazení SSRI, neléčené trvají 7–14 dní. Prevencí vzniku po výskytu je jen postupně sestupná titrace (o 20–30 % dávky každých 6–8 týdnů).
10. Především při přítomnosti úzkosti je vhodné již od počátku léčbu antidepresivem kombinovat s anxiolytiky, která urychlí nástup antidepresivního účinku, a kromě toho potlačí iniciální tenzi a nespavost. Jejich podávání podle možností omezujeme na krátké období při akutní léčbě a nemocného s tímto faktem předem seznámíme.
11. Hypnotikum ordinujeme tehdy, jestliže mezi hlavní příznaky depresivní poruchy patří také některá z forem insomnie nebo došlo k indukci insomnie (nejčastěji při léčbě SSRI). Lze použít jak skupinu benzodiazepinovou, tak i nebenzodiazepinová hypnotika III. generace. Jejich podávání bychom měli omezit, podobně jako podávání anxiolytik, jen na akutní etapu léčby.
Anxiolytika
Anxiolytika jsou obecně určena k tlumení patologické úzkosti a strachu [3]. Z hlediska terapie úzkostných poruch však došlo k výraznému názorovému posunu. Podobně jako u depresivních poruch je za neurobiologický korelát úzkostných poruch považováno narušení monoaminerngní neurotransmise a metodou volby se při průkazu účinnosti v řadě studií stávají první volbou od 90. let minulého století SSRI. Farmakoterapii úzkostných poruch lze rozdělit na fázi akutní léčby (8–12 týdnů), jejímž cílem je zejména zmírnění příznaků a zvýšení schopnosti adaptace pacienta a na udržovací léčbu (12–18 měsíců), která má za úkol zabránit relapsu. Farmakoterapeutické postupy je vhodné vždy kombinovat s psychoterapií.
Obecné zásady použití anxiolytik
1. Anxiolytika jsou sama o sobě jen velmi málo účinná v léčbě středně těžkých a těžkých depresivních epizod, a je považováno za chybu, léčíme-li depresivní epizodu s/bez úzkosti jen těmito preparáty.
2. Dlouhodobá léčba anxiolytiky benzodiazepinové řady (alprazolam, klonazepam, diazepam, oxazepam, chlordiazepoxid a další) není vhodná, protože snadno vzniká tolerance nebo přímo závislost, ale také se zvyšuje riziko narušení kognitivních funkcí s urychlením nástupu demence.
3. V terapii úzkostných poruch platí, že všechny benzodiazepiny mají srovnatelný účinek a jsou účinné v potlačení tělesných příznaků úzkosti, zatímco antidepresiva redukují vlastní psychickou komponentu poruchy. Pro léčbu úzkosti doprovázející AD jsou doporučována antihistaminergně působící tricyklická antidepresiva spíše než benzodiazepiny, protože příznaky z vysazení benzodiazepinů mohou exacerbovat pruritus.
4. Nástup účinku je rychlý, maxima dosahuje během 1–2 týdnů léčby, a uplatňují se proto v léčbě depresivních a úzkostných poruch zejména v iniciální etapě.
5. U každého pacienta je nutné pečlivé vyvážení profitu takové léčby s riziky, ke kterým patří sedace, psychomotorický útlum, kognitivní narušení, ovlivnění schopnosti řízení, potencování ostatních depresogenních látek, rozvoje závislosti a syndrom z vysazení, který může být spojen s výskytem deliriózních stavů nebo epileptických záchvatů.
6. Benzodiazepiny mohou vyvolat paradoxní dezinhibici s typickými behaviorálními projevy (hostilita a agresivita), mohu zvýšit riziko pádů a fraktur u nemocných vyššího věku a podnítit vznik deliriózních stavů.
7. Benzodiazepiny by neměly být podávány pacientům, v jejichž anamnestických údajích nalézáme údaje o předchozím abúzu alkoholu nebo jiných psychoaktivních látkách. Trvání léčby by mělo být časově omezené a doporučené jsou maximálně 4 týdny. Krátkodobě a střednědobě působící benzodiazepiny mají vyšší riziko vzniku rebound fenoménu i syndromu z vysazení a vzniku závislosti ve srovnání s dlouhodobě působícími látkami. Z důvodů prevence vzniku odvykacího stavu je nutné vysazovat benzodiazepiny postupně, a to o 10–20 % celkové dávky týdně.
8. Při léčbě depresivních poruch spojených s úzkostmi je výhodné od počátku léčbu antidepresivem kombinovat s anxiolytikem, které mimo jiné i omezí iniciální tenzi a nespavost indukovanou antidepresivy (SSRI). V praxi se nejčastěji pro své silné anxiolytické působení používá zejména alprazolam, diazepam, bromazepam a klonazepam. Vhodnými benzodiazepinovými preparáty pro kombinaci se SSRI jsou oxazepam a lorazepam, protože nejsou substráty pro izoenzym cytochromu P 450 3A3/4 inhibovaný hlavně fluvoxaminem, fluoxetinem, slaběji sertralinem, minimálně paroxetinem a citalopramem. Z benzodiazepinů by neměly být administrovány současně s fluvoxaminem, fluoxetinem a sertralinem především alprazolam, midazolam, bromazepam.
9. K dispozici jsou i nebenzodiazepinové přípravky hydroxyzin a buspiron, které mohou být velmi užitečnými přípravky pro léčbu úzkostných poruch, zvláště tam, kde není vhodné použít benzodiazepiny, avšak k jejich nevýhodám patří pozvolný nástup účinku, anticholinergní působení, ovlivnění QTc intervalu či prokonzulzivní efekt (hydroxyzin) nebo relativně široký interakční potenciál (buspiron). Účinnou formou léčby může být i podávání pregabalinu v dávkách 150–450 mg/den rozdělených do dvou denních dávek).
OPATŘENÍ A CÍLENÁ FARMAKOTERAPIE KOMORBIDNÍ INSOMNIE U NEMOCNÝCH TRPÍCÍCH ATOPICKOU DERMATITIDOU
Aktuálně neexistují žádné doporučené postupy pro léčbu poruch spánku doprovázejících AD. K základnímu pravidlu patří, že psychofarmakologická intervence by měla být použita až po vyčerpání úprav prostředí a chování ve vztahu ke spánku.
Prostředí
Nedostatečná kvalita spánku, zvláště u dětí trpících AD může být sekundárně zvyšována reaktivitou na podněty zevního prostředí. Důraz je kladen na kvalitu oděvu [41], teplotu prostředí, světelné a zvukové podněty [58]. Méně známo je, že zvýšená expozice modrému světlu, které běžně emitují obrazovky počítačů a mobilních zařízení, je spojena se sníženým zastoupení non-REM spánku [21], což se odrazí významně v kvalitě spánku. Snížení teploty v místnosti, a tím i povrchu kůže, vyvolává vazokonstrikci, což vede k potlačení aktivity zánětu a pruritu, a tím ke zlepšení spánku [10, 53].
K doplňkovým metodám patří také využití masážní terapie, o které je známo, že dokáže snížit výskyt nespavosti při chronických onemocněních svalovou relaxací a snížením míry úzkosti [25, 53]. Vhodně prováděná masážní terapie může pozitivně ovlivnit vazokonstrikci, jež se manifestuje dermografismem a centrálním zblednutím tváře. Zvýšení periferní cirkulace krve potlačuje diskomfort vyvolaný vazokonstrikcí [60], podobně jako některé symptomy úzkosti doprovázející onemocnění.
Efekt masáží byl testován u malých dětí a po jednom měsíci, kdy dětem byla poskytována masáž po dobu 20 minut denně, došlo k významnému poklesu míry depresivního ladění a úzkosti a zvýšení denní aktivity [60]. Rodiny by měly být poučeny o správné spánkové hygieně, vyhýbat se zdřímnutí a odpolednímu příjmu kofeinu, a měly by dodržovat konzistentní spánkový režim během pracovních dnů a víkendů [51].
Psychofarmakologická léčba
Psychofarmakologickou léčbu mohou doprovázet nežádoucích účinky anebo farmakologické interakce s již podávanou terapií AD. Pokud bude využita, tak by měly být využívány nejnižší možné účinné dávky k regulaci a dosažení kvalitního spánku. Rizikové je podávání nemocným vyššího věku, kdy některé skupiny psychofarmak mohou akcelerovat vznik nebo prohloubení kognitivního deficitu, což platí především o benzodiazepinech a léčivech s anticholinergním působením. Některá psychofarmaka mají také nezanedbatelný potenciál rizika vzniku závislosti.
Z výše uvedených důvodů je stále častěji používána látka tělu vlastní, melatonin. Melatonin je hlavním „neurohormonem“, který se podílí na regulaci cirkadiánního rytmu, spánkového tlaku, snižuje tělesnou teplotu a snižuje intrakutánní koncentraci zánětlivých markerů spojených s AD, jako je IL-4 a imunoglobulin E [72]. U nemocných byly nalezeny snížené plazmatické koncentrace melatoninu v době exacerbace onemocnění a metabolit melatoninu, 6-sulfatoxymelatonin v moči, negativně koreluje se závažností AD [19].
Randomizovaná, kontrolovaná studie u dětí trpících AD prokázala, že 3 mg melatoninu denně po dobu jednoho měsíce zkrátily spánkovou latenci o 21,4 minut ve srovnání s placebem [20]. Pokud se rozhodneme použít melatonin u dospělých pacientů, je vhodné použít 5–10 mg a ideálně ve formě s prodlouženým uvolňováním, která tak napodobí sekreční křivku endogenního melatoninu. Využití u nemocných vyššího věku není provázeno negativním ovlivněním kognitivních funkcí a nežádoucí účinky jsou minimální. Nebyla popsána závislost na této látce.
Antidepresiva
Obecně jsou sedativně působící antidepresiva efektivní pro navození a udržení spánku. Pokud jsou používána tricyklická antidepresiva (TCA), může jejich sedativní efekt zkvalitnit spánek, zkrátit spánkovou latenci, prodloužit celkovou dobu spánku a zvýšit spánkovou efektivitu [74]. Jejich významný vliv lze spatřovat v přerušení cyklu svědění/škrábání a optimalizaci nočního spánku [35]. Literatura popisuje efektivitu lokálně aplikovaných TCA (doxepin 5% krém), která potlačila pruritus doprovázející AD [12] a u dospělých je schválena FDA pro krátkodobou (do 8 dní) léčbu pruritu. Podobně je tricyklické antidepresivum doxepin pro své antihistaminergní sedativní působení shledáván efektivní i při perorálním podání [26]. Tricyklické antidepresivum (trimipramin) bylo efektivní při potlačení nočního škrábání, což bylo doprovázeno i významnými pozitivními změnami ve spánkové architektuře [57]. TCA, jsou-li použita v dostatečných dávkách, mohou pozitivně ovlivnit i depresivní a úzkostné poruchy doprovázející základní onemocnění. V současnosti nejsou v ČR dostupná antidepresiva testovaná v klinických hodnoceních (doxepin 25 mg, trimipramin 50 mg [26, 57], která byla vždy podávána v době ulehání do lůžka. Mezi dostupná patří imipramin, klomipramin, amitriptylin, nortriptylin, dosulepin a maprotilin. Lékem volby u mladých a zdravých jedinců může být amitriptylin, zvláště pro své silné anticholinergní působení, které ovlivní i acetylcholin hypersenzitivní ekrinní potní žlázy. Dále lze doporučit klomipramin a dosulepin.
TCA mají svá omezení, které pramení z receptorového profilu těchto přípravků. Opatrnosti je třeba při podávání nemocným vyššího věku pro jejich anticholinergní působení a kardiotoxicitu (prodloužení QTc).
V některých kazuistických sériích byl demonstrován účinek bupropionu [15], což doložila i menší otevřená studie podávání bupropionu s prodlouženým uvolňováním 150 mg/den po dobu 3 týdnů, následovaná 150 mg dvakrát denně opět po dobu 3 týdnů [44].
Mirtazapin patří k antidepresivům vybaveným adrenergním, histaminergním a serotonergním antagonismem, což může být využito v léčbě AD pro protisvědivý, anxiolytický a sedativní efekt. Kazuisticky byl demonstrován účinek podávání mirtazapinu 15 mg/den [18] a mirtazapinu 30 mg/den společně s olanzapinem do dávky 7,5mg, užívaných v době ulehání [39]. Kazuistiky popisují efekt 15 mg mirtazapinu denně u jedinců trpících nespavostí spojené se svěděním [18]. Kromě antidepresivního, protisvědivého, anxiolytického a sedativního efektu stimuluje chuť k jídlu, z čehož mohou profitovat nemocní s nízkou tělesnou hmotností. Sucho v ústech a ortostatická hypotenze patří k typickým nežádoucím účinkům mirtazapinu [18].
Neexistuje dostatek údajů, které by jednoznačně umožnily doporučit dávkování, ale léčbu lze zahájit u dospělých pacientů 15 mg s tím, že lze každý týden dávku zvyšovat až na maximálních 45 mg podávaných ve večerních hodinách [42].
Antihistaminika
Sedativní antihistaminika, jako je difenhydramin (Psilo-Balsam) a hydroxyzin (Atarax), jsou doporučována jako první volba pro jejich sedativní a protisvědivé účinky, ale některé doporučené postupy konstatují nedostatečné důkazy pro jejich používání kromě nespavosti spojené se svěděním [63]. I v této oblasti chybí početnější randomizované kontrolované studie, které by jednoznačně potvrdily schopnost antihistaminik potlačit svědění provázející atopickou dermatitidu, a některá klinická hodnocení to dokonce vyvracejí [28].
Benzodiazepiny
Benzodiazepiny, mezi které patří např. nitrazepam, jsou velmi často podávány při poruchách spánku. Mechanismem účinku je alosterická modulace GABAA receptorů, specificky subtypu A (32, 46) a vazba na kombinační typy alfa2beta3gamma2 a alfa1beta2gamma2, které tvoří 75–85 % všech GABAA receptorů senzitivních k benzodiazepinům. GABAA patří k hlavním inhibičně působícím neurotransmiterům v centrálním nervovém systému a ovlivňuje zhruba 30 % všech synapsí. Receptor GABAA zprostředkovává rychlou inhibiční aktivitu GABAA, která vede ke snížení neuronální aktivity.
Dlouhodobě působící benzodiazepiny mohou zkrátit spánkovou latenci, prodloužit trvání spánku, ale současně ovlivnit spánkovou architekturu snížením zastoupení REM fází spánku [47]. V menší, dvojitě slepé, placebem kontrolované studii nebyl prokázán efekt benzodiazepinu nitrazepamu, který nedokázal potlačit noční škrábání [13]. Nedostatečná odpověď pruritu na nitrazepam je konzistentní s tím, že ke škrábání dochází minimálně v NREM fázi 3 spánku, jehož zastoupení je potlačeno právě benzodiazepiny [16].
Klinické hodnocení se zkříženým designem sledovalo podávání nitrazepamu (5 mg po dobu 3 nocí) dospělým, které vedlo ke snížení frekvence, ale prodloužení epizod škrábání u pacientů trpících AD. Příčinu tohoto jevu se prozatím nepodařilo vysvětlit, ale je velmi pravděpodobné, že bude souviset s vlivem benzodiazepinů na spánková stadia [13].
Benzodiazepiny nejsou doporučovány pro děti a měly být používány pouze jako poslední možnost terapie [26].
Nebenzodiazepinová hypnotika
K zástupcům III. generace hypnotik, pro které se někdy používá označení „Z-substance“, patří v České republice dostupný zolpidem, zopiclon a eszopiclon. Tyto látky se selektivně váží na alfa1 podjednotku GABAA receptoru, farmakokineticky se liší od benzodiazepinů a jejich podávání je spojeno s nižším výskytem nežádoucích účinků [5, 56].
Eszopiclon je GABA agonistou a svým účinkem může zkrátit spánkovou latenci a prodloužit trvání spánku. Eszopiclon je ve srovnání s benzodiazepiny bezpečnější i stran výskytu rebound insomnie po přerušení léčby [26]. Benzodiazepiny a nonbenzodiazepinová hypnotika mohou vyvolat útlum dechového centra, zvláště u pacientů trpících astmatem, které je častou komorbiditou AD. Vzhledem k potenciálu vzniku závislosti bychom se těmto skupinám léčivých přípravků měli vyhýbat u dětí a starších nemocných, kde současně mohou být vyvolávající příčinou deliriózních stavů nebo prohloubení kognitivního deficitu [26].
ZÁVĚR
Psychické poruchy patří k častým komorbidním onemocněním doprovázejícím atopickou dermatitidu. Moderní poznatky přinášejí nové pohledy na oboustranné vztahy duše a těla, týkající se především vlivu imunitní reaktivity na neuronální systémy prostřednictvím cytokinů. Moderní postupy v léčbě atopické dermatitidy monoklonálními protilátkami zaměřenými proti prozánětlivým cytokinům přinášejí léčeným pacientům úlevu i v oblasti psychického zdraví. Nezbytné je však doprovodnou psychopatologii správně a včas identifikovat a adekvátně léčebně ovlivňovat.
Článek vznikl za podpory společnosti sanofi-aventis, s.r.o.
MAT-CZ-2200560-1.0-06/2022
Práce byla podpořena MZ ČR – RVO VFN64165.
Do redakce došlo dne 12. 7. 2022.
Adresa pro korespondenci:
doc. MUDr. Martin Anders, Ph.D.
Psychiatrická klinika 1. LF UK a VFN v Praze
Ke Karlovu 11
120 00 Praha 2
e-mail: martin.anders@vfn.cz
Zdroje
1. ABUABARA, K., YU, A. M., OKHOVAT, J. P. et al. The prevalence of atopic dermatitis beyond childhood: A systematic review and meta-analysis of longitudinal studies. Allergy, 2018, 73, p. 696–704.
2. ALEXANDER, F. Psychosomatic medicine. New York: Norton; 1950.
3. ANDERS, M. Psychofarmaka ve vnitřním lékařství. In Marek, J., Vráblík, M.: Markova farmakoterapie vnitřních nemocí; 5. zcela přepracované a doplněné vydání. Praha, 2019, s. 689–715.
4. ARROLL, B., KHIN, N., KERSE, N. Screening for depression in primary care with two verbally asked questions: cross sectional study. BMJ, 2003, 15, 327(7424), p. 1144–1146.
5. BATESON, A. N. The benzodiazepine site of the GABAA receptor: an old target with new potential? Sleep Med., 2004, 5(suppl1), p. S9–S15.
6. BECK, A. T., STEER, R. A., BALL, R. et al. Comparison of Beck Depression Inventories – IA and -II in psychiatric outpatients. J Pers Assess, 1996, 67, p. 588–597.
7. BENCA, R., PETERSON, M. Insomnia and depression. Sleep Medicine, 2008, 9 (Suppl. 1), p. S3–S9.
8. CIPRIANI, A., FURUKAWA, T. A., SALANTI, G. et al. Comparative efficacy and acceptability of 21 antidepressant drugs for the acute treatment of adults with major depressive disorder: a systematic review and network meta-analysis. Lancet, 2018, 391(10128), p. 1357–1366. doi: 10.1016/S0140 - 6736(17)32802-7.
9. COE, C. L., LUBACH, G. R. Mother-infant interactions and the development of immunity from conception through weaning. In: Ader, R. editor. Psychoneuroimmunology. Amsterdam: Academic Press, 2007, p. 455–474.
10. DABADE, T. S., DAVISDM, WETTERDA, et al. Wet dressing therapy in conjunction with topical corticosteroids is effective for rapid control of severe pediatric atopic dermatitis: experience with 218 patients over 30 years at Mayo Clinic. J Am Acad Dermatol., 2012, 67(1), p. 100–106.23.
11. DECKERT, S., KOPKOW, C., SCHMITT, J. Nonallergic comorbidities of atopic eczema: an overview of systematic reviews. Allergy, 2014, 69, p. 37–45.
12. DRAKE, L. A., MILLIKAN, L. E. Doxepin Study Group: The antipruritic effect of 5% doxepin cream in patients with eczematous dermatitis. Arch Dermatol, 131(12), p. 1403 – 1408, 1995 7492129.
13. EBATA, T., IZUMI, H., AIZAWA, H. et al. Effects of nitrazepam on nocturnal scratching in adults with atopic dermatitis: a double-blind placebo-controlled crossover study. Br J Dermatol, 138(4), p. 631 – 634, 1998 9640368.
14. GARG, N., SILVERBERG, J. I. Association between childhood allergic disease, psychological comorbidity, and injury requiring medical attention. Ann Allergy Asthma Immunol, 2014, 112, p. 525–532.
15. GONZÁLEZ, E., SANGUINO, R. M., FRANCO, M. A. Bupropion in atopic dermatitis. Pharmacopsychiatry, 2006, 39(6), 229, 17124645.
16. GUPTA, M. A., GUPTA, A. K. Sleep-wake disorders and dermatology. Clin Dermatol, 2013, 31(1), p. 118 – 126.
17. HALVORSEN, J. A., DALGARD, F., THORESEN, M. et al. Itch and pain in adolescents are associated with suicidal ideation: a population-based cross-sectional study. Acta Derm Venereol., 2012, 92(5), p. 543–546. doi:10.2340/00015555-1251.
18. HUNDLEY, J. L., YOSIPOVITCH, G. Mirtazapine for reducing nocturnal itch in patients with chronic pruritus: a pilot study. J Am Acad Dermatol, 2004, 50(6), p. 889–891, 15153889.
19. CHANG, Y. S., CHOU, Y. T., LEE, J. H. et al. Atopic dermatitis, melatonin, and sleep disturbance. Pediatrics, 2014, 134(2), p. e397–e405.
0. CHANG, Y. S., LIN, M. H., LEE, J. H. et al. Melatonin supplementation for children with atopic dermatitis and sleep disturbance: a randomized clinical trial. JAMA Pediatr, 2016, 170(1), p. 35–42.
21. CHELLAPPA, S. L., STEINER, R., OELHAFEN, P. et al. Acute exposure to evening blueenriched light impacts on human sleep. J Sleep Res, 2013, 22(5), p. 573–580.
22. CHIDA, Y., SUDO, N., SONODA, J. et al. Early-life psychological stress exacerbates adult mouse asthma via the hypothalamus-pituitary-adrenal axis. Am J Respir Crit Care Med., 2007, 175(4), p. 316–322. doi: 10.1164/rccm.200607-898OC. Epub 2006 Nov 16. PMID: 17110645.
23. CHIESA FUXENCH, Z. C., BLOCK, J., BOGUNIEWICZ, M. et al. Atopic Dermatitis in America Study: a crosssectional study examining the prevalence and disease burden of atopic dermatitis in the US adult population. J Invest Dermatol, 2019, 139, p. 583–590.
24. KAMARÁDOVÁ, D., PRAŠKO, J., LÁTALOVÁ, K. et al. Validizace české verze Beckova inventáře úzkosti. Čes a slov Psychiat, 2016, 112(4), p. 153–158.
25. KAYE, A. D., KAYE, A. J., SWINFORD, J. et al. The effect of deep-tissuemassage therapy on blood pressure and heart rate. J Altern Complement Med, 2008, 14(2), p. 125–128.
26. KELSAY, K. Management of sleep disturbance associated with atopic dermatitis. J Allergy Clin Immunol, 2006, 118(1), p. 198–201.
27. KIM, Y., BLOMBERG, M., RIFAS-SHIPMAN, S. L. et al. Racial/ethnic differences in incidence and persistence of childhood atopic dermatitis. J Invest Dermatol, 2019, 139, p. 827–834.
28. KLEIN, P. A., CLARK, R. A. An evidence-based review of the efficacy of antihistamines in relieving pruritus in atopic dermatitis. Arch Dermatol, 1999, 135(12), p. 1522–1525.
29. KONG, T. S., HAN, T. Y., LEE, J. H. et al. Correlation between severity of atopic dermatitis and sleep quality in children and adults. Ann Dermatol., 2016, 28(3), p. 321–326. doi:10.5021/ad.2016.28.3.321.
30. KOO, J., MARANGELL, L. B., NAKAMURAM et al. Depression and suicidality in psoriasis: review of the literature including the cytokine theory of depression. J Eur Acad Dermatol Venereol., 2017, 31(12), p. 1999–2009. doi:10.1111/jdv.14460.
31. KROENKE, K., SPITZER, R. L., WILLIAMS, J. B. et al. Physical symptoms in primary care. Predictors of psychiatric disorders and functional impairment. Arch Fam Med., 1994, 3 (9), p. 774–779.
32. KUPFER, D. J., REYNOLDS, C. F. Management of insomnia. N Engl J Med., 1997, 336, p. 341.
33. LANGAN, S. M., IRVINE, A. D., WEIDINGER, S. Atopic dermatitis. Lancet, 2020, 396(10247), p. 345–360. doi: 10.1016/S0140-6736(20)31286-1. Erratum in: Lancet, 2020, 396(10253), p. 758. PMID: 32738956.
34. LEE, S., SHIN, A. Association of atopic dermatitis with depressive symptoms and suicidal behaviors among adolescents in Korea: the 2013 Korean Youth Risk Behavior Survey. BMC Psychiatry, 2017, 17, p. 3.
35. LEVENSON, J. Psychiatric issues in dermatology, part 1: atopic dermatitis and psoriasis. Prim psychiatry, 2008, 15, p. 31–34.
36. LIAO, T. C., LIEN, Y. T., WANG, S. et al. Comorbidity of atopic disorders with autism spectrum disorder and attention deficit/hyperactivity disorder. J Pediatr., 2016, 171, p. 24–55.
37. LIM, V. Z., HO, R. C., TEE, S. I. et al. Anxiety and depression in patients with atopic dermatitis in a Southeast Asian tertiary dermatological centre. Ann Acad Med Singapore, 2016, 45(10), p. 451–455.
38. LINDQVIST, D., JANELIDZE, S., HAGELL, P. et al. Interleukin - 6 is elevated in the cerebrospinal fluid of suicide attempters and related to symptom severity. Biol Psychiatry, 2009, 66(3), p. 287–292. doi: 10.1016/j.biopsych.2009.01.030. Epub 2009 Mar 6. PMID: 19268915.
39. MAHTANI, R., PAREKH, N., MANGAT, I. et al. Alleviating the itch-scratch cycle in atopic dermatitis. Psychosomatics, 2005, 46(4), p. 373–374, 16000683.
40. MARSHALL, G. D., ROY, S. R. Stress and allergic diseases. In: Ader R, editor. Psychoneuroimmunology. Amsterdam: Academic Press; 2007, p. 799–824.
41. MASON, R. Fabrics for atopic dermatitis: Dr Rupert Mason discusses the pros and cons of different fabrics for use in atopic dermatitis. J Fam Health Care, 2008, 18(2), p. 63–66.
42. MCDOUGLE, C. J. Mirtazapine Treatment of Anxiety in Children and Adolescents With Pervasive Developmental Disorders. Accessed December 3, 2018. Available at: https:// ClinicalTrials.gov/show/ NCT01302964.
43. MCEWEN, B. S. Protective and damaging effects of stress mediators. N Engl J Med., 1998, 338, p. 171 – 179.
44. MODELL, J. G., BOYCE, S., TAYLOR, E. et al. Treatment of atopic dermatitis and psoriasis vulgaris with bupropion-SR: a pilot study. Psychosom Med, 2002, 64(5), p. 835–840, 12271115.
45. National Institute for Health and Care Excellence. NICE clinical guideline 90 Depression: The treatment and management of depression in adults. 2009.
46. NEUBAUER, D. N. Chronic insomnia: current issues. Clin Cornerstone, 2004, 6(suppl1C), p. S17–S22.
47. NICHOLSON, A. The use of short-and long-acting hypnotics in clinical medicine. Br J Clin Pharmacol, 1981, 11(S1), p. 61S–69S.
48. NOH, H. M., CHO, J. J., PARK, Y. S. et al. The relationship between suicidal behaviors and atopic dermatitis in Korean adolescents. J Health Psychol., 2016, 21(10), p. 2183–2194. doi:10.1177 /1359105315572453.
49. NORRESLET, L. B., EBBEHOJ, N. E., ELLEKILDE, BONDE, J. P. et al. The impact of atopic dermatitis on work life: a systematic review. J Eur Acad Dermatol Venereol., 2018, 32(1), p. 23–38. doi:10 .1111/ jdv.14523.
50. OLIVEIRA, C., TORRES, T. More than skin deep: the systemic nature of atopic dermatitis. Eur J Dermatol., 2019, 29(3), p. 250–258.
51. OWENS, J. A., MINDELL, J. A. Pediatric insomnia. Pediatr Clin North Am, 2011, 58 (3), p. 555–569.
52. PALLER, A., JAWORSKI, J. C., SIMPSON, E. L. Major Comorbidities of Atopic Dermatitis: Beyond Allergic Disorders. American Journal of Clinical Dermatology. Dostupné na www: https://doi.org/10.1007/ s40257-018-0383-4.
53. REID, P., LEWIS-JONES, M. Sleep difficulties and their management in preschoolers with atopic eczema. Clin Exp Dermatol., 1995, 20(1), p. 38–41.
54. RIIS, J. L., VESTERGAARD, C., DELEURAN, M. S. et al. Childhood atopic dermatitis and risk of attention deficit/hyperactivity disorder: a cohort study. J Allergy Clin Immunol, 2016, 138, p. 608–610.
55. SANDHU, J., KEVIN, K. W. U., THAN-LAN BUI, M. A. et al. Association between Atopic Detrmatitis and Suicidality. A systemativ review and Meta-analysis. JAMA Dermatology, 2018, doi:10.1001/jamadermatol. 2018.4566.
56. SANGER, D. J. The pharmacology and mechanisms of action of new generation, non-benzodiazepine hypnotic agents. CNS Drugs, 2004, 18(suppl1), p. 9–15.
57. SAVIN, J. A., PATERSON, W. D., ADAM, K. et al. Effects of trimeprazine and trimipramine on nocturnal scratching in patients with atopic eczema. Arch Dermatol, 115(3), p. 313 – 315, 1979 373632.
58. SHANI-ADIR, A., ROZENMAN, D., KESSEL, A. et al. The relationship between sensory hypersensitivity and sleep quality of children with atopic dermatitis. Pediatr Dermatol., 2009, 26(2), p. 143–149.
59. SHIN, J., CHOI, Y., PARK, E.-C. et al. Psychiatry outpatient visits by atopic dermatitis patients varying in the complexity of their prescriptions. Medicine (Baltimore), 2016, 95, p. e5411.
60. SCHACHNER, L., FIELD, T., HERNANDEZ-REIF, M. et al. Atopic dermatitis symptoms decreased in children following massage therapy. Pediatr Dermatol, 1998, 15(5), p. 390–395.
61. SCHMITT, J., CHEN, C. M., APFELBACHER, C. et al. Infant eczema, infant sleeping problems, and mental health at 10 years of age: the prospective birth cohort study LISAplus. Allergy, 2011, 66, p. 404–411.
62. SCHONMANN, Y., MANSFIELD, K. E., HAYES, J. F. Atopic eczema in adulthood and risk of depression and anxiety: a population-based cohort study. J Allergy Clin Immunol Pract, 2020, 8, p. 248–257.
63. SIDBURY, R., DAVIS, D. M., COHEN, D. E. et al. Guidelines of care for the management of atopic dermatitis: section 3. Management and treatment with phototherapy and systemic agents. J Am Acad Dermatol, 2014, 71(2), p. 327–349.
64. SILVERBERG, J. I., GARG, N. K., PALLER, A. S. et al. Sleep disturbances in adults with eczema are associated with impaired overal health: a US population - based study. J Invest Dermatol, 2015, 135, p. 56–66.
65. SILVERBERG, J. I., HANIFIN, J. M. Adult eczema prevalence and associations with asthma and other health and demographic factors: a US population - based study. J Allergy Clin Immunol., 2013, 132, p. 1132–1138.
66. SILVERBERG, J. I., SIMPSON, E. L. Association between severe eczema in children and multiple comorbid conditions and increased healthcare utilization. Pediatr Allergy Immunol., 2013, 24, p. 476 – 486.
67. SILVERBERG, J. I., SIMPSON, E. L. Associations of childhood eczema severity: a US population-based study. Dermatitis, 2014, 25(3), p. 107–114. doi:10.1097 /DER.0000000000000034.
68. SILVERBERG, J. I. Public health burden and epidemiology of atopic dermatitis. Dermatol Clin., 2017, 35(3), p. 283–289. doi:10.1016/j.det.2017.02.002.
69. SIMPSON, E. L., AKINLADE, B., ARDELEANU, M. Two phase 3 trials of dupilumab versus placebo in atopic dermatitis. N Engl J Med., 2017, 376(11), p. 1090–1091.
70. SIMPSON, E. L., GUTTMAN-YASSKY, E., MARGOLIS, D. J. et al. Association of inadequately controlled disease and disease severity with patient-reported disease burden in adults with atopic dermatitis. JAMA Dermatol., 2018, 154(8), p. 903 – 912. doi:10.1001 /jamadermatol.2018.1572.
71. SPITZER, R. L., KROENKE, K., WILLIAMS, J. B. et al. A brief measure for assessing generalized anxiety disorder: the GAD-7. Arch Intern Med., 2006, 166(10), p. 1092–1097.
72. TUREK, F. W., GILLETTE, M. U. Melatonin, sleep, and circadian rhythms: rationale for development of specific melatonin agonists. Sleep Med., 2004, 5(6), p. 523–532.
73. WEIDINGER, S., NOVAK, N. Atopic dermatitis. Lancet, 2016, 387, p: 1109–1122.
74. WILSON, S., ARGYROPOULOS, S. Antidepressants and sleep. Drugs, 2005, 65(7), p. 927–947.
75. WRIGHT, R. J., COHEN, R. T., COHEN, S. The impact of stress on the development and expression of atopy. Curr Opin Allergy Clin Immunol., 2005, 5, p. 23–29.
76. WRIGHT, R. J. Stress and atopic disorders. J Allergy Clin Immunol., 2005, 116, p. 1301–1306.
77. YAGHMAIE, P., KOUDELKA, C. W., SIMPSON, E. L. Mental health comorbidity in patients with atopic dermatitis. J Allergy Clin Immunol., 2013, 131, p. 428 – 433.
Štítky
Dermatologie Dětská dermatologie
Článek vyšel v časopiseČesko-slovenská dermatologie
Nejčtenější tento týden
2022 Číslo 5- Fexofenadin – nesedativní a imunomodulační antihistaminikum v léčbě alergických projevů
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Jak včas rozpoznat vzácné onemocnění? S diagnostickou rozvahou pomůže accelRare
- Léčba chronické blefaritidy vyžaduje dlouhodobou péči
-
Všechny články tohoto čísla
- Dermatoskopie – fyzika v rukou dermatologa
- KONTROLNÍ TEST
- Atopická dermatitida a psychické komorbidity
- Verukózní útvar na plosce
- Zápis ze schůze výboru ČDS konané dne 15. 9. 2022
- Poznatky z 28. Fortbildungswoche für praktische Dermatologie und Venerologie 2022 (FOBI) 13.–16. července 2022
- Kalendář odborných akcí
- Česko-slovenská dermatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Atopická dermatitida a psychické komorbidity
- Verukózní útvar na plosce
- Dermatoskopie – fyzika v rukou dermatologa
- Kalendář odborných akcí
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




