-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
NEOADJUVANTNÍ CHEMOTERAPIE U INVAZIVNÍCH UROTELIÁLNÍCH NÁDORŮ MĚCHÝŘE: KORELACE LÉČEBNÉ ODPOVĚDI A PŘEŽITÍ PACIENTŮ
NEOADJUVANT CHEMOTHERAPY IN MUSCLE-INVASIVE UROTHELIAL BLADDER CANCER: CORRELATION OF RESPONSE WITH PATIENTS SURVIVAL
Major statement:
Response rates to neoadjuvant chemotherapy were high in our cohort of 41 patients with muscle-invasive bladder cancer. Patients with a complete response had significantly improved 2-year progression-free survival compared with the patients with residual disease.Aims:
Neoadjuvant chemotherapy (NAC) was shown to improve the overall survival in randomized trials. The aim of the study was to evaluate the frequency of response to NAC and the impact on prognosis of the disease.Methods:
From January 2010 to October 2015 124 patients with bladder cancer underwent radical cystectomy and 41 of them (33 %) received NAC. Chemotherapy was indicated in cT3–4 or cN+ tumours, cT2N0 disease only in presence of risk factors like hydronephrosis or lymphovascular invasion.
Glomerular filtration rate >50 ml/min and ECOG performance status ≤1 were used as chemotherapy eligibility criteria. Gemcitabine and cisplatin was the most frequently used regimen (85 %). Response to chemotherapy was defined as complete (ypT0N0) or partial (≤ypT1N0). The median follow-up was 14 months (1–71). The Kaplan-Meier methods were used to calculate two-year progression-free survival (PFS) and subgroup survival comparison using log-rank test.Results:
Two-year PFS rates were 69 % (95 % CI 52–86) for the whole cohort and 81 % in patients with clinically negative lymph nodes (cT2–4N0). Complete or partial responses to NAC were seen in 41 % and 59 %, respectively. The probability of attaining at least partial response to NAC (≤ ypT1N0) was significantly higher in cT2 tumours (76 %) than in cT3–4 (40 %). Two-year PFS was significantly higher in case of response to chemotherapy: 93 % in ypT0, 83 % in ypT1, 50 % in ypT2 and 31 % in ypT3–4 (p=0.003).Conclusion:
Patients with a response to NAC had significantly improved 2-year PFS compared with the patients without the response. In the future, the development of new molecular biomarkers is warranted, that would allow better selection of patients to NAC.KEY WORDS:
Chemotherapy, neoadjuvant therapy, urinary bladder neoplasms.
Autoři: Michal Staník 1; Alexander Poprach 2; Daniel Macík 1; Ivo Čapák 1; Jiří Jarkovský 3; Denisa Malúšková 3; Natália Marečková 1; Radek Lakomý 2; Jan Doležel 1
Působiště autorů: Oddělení onkourologie, Masarykův onkologický ústav, Brno 1; Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 2; Institut biostatistiky a analýz, Masarykova univerzita, Brno 3
Vyšlo v časopise: Ces Urol 2016; 20(3): 221-228
Kategorie: Originální práce
Souhrn
Hlavní stanovisko:
V souboru 41 nemocných s invazivními nádory měchýře jsme zaznamenali vysoký podíl odpovědí na neoadjuvantní chemoterapii. Pacienti s kompletní odpovědí měli signifikantně lepší dvouleté přežití bez progrese než pacienti s reziduálním onemocněním.Cíl:
V randomizovaných studiích byl prokázán přínos neoadjuvantní chemoterapie (NACH) na celkové přežití. Cílem práce bylo zhodnotit frekvenci léčebné odpovědi na NACH a vliv na prognózu onemocnění.Soubor pacientů a metoda:
V období od 1/2010 do 10/2015 podstoupilo 124 pacientů s nádorem měchýře radikální cystektomii, z nichž 41 (33 %) dostalo NACH. K chemoterapii byly indikovány nádory cT3–4 nebo cN+, kategorie cT2N0 (37 %) pouze v případě výskytu rizikových faktorů jako hydronefróza, nebo lymfovaskulární invaze.
Kritériem způsobilosti pro chemoterapii byla glomerulární filtrace >50 ml/min a funkční stav dle ECOG 1. Nejčastěji byla podána kombinace gemcitabinu a cisplatiny (85 %). Odpověď na chemoterapii byla definována jako kompletní (ypT0N0) nebo parciální (≤ypT1N0).
Medián délky sledování dosáhl 14 měsíců (1–71). Dvouleté přežití bez progrese (PFS) jsme posuzovali pomocí Kaplan-Meierových křivek a srovnání přežití v rámci podskupin pomocí log-rank testu.Výsledky:
Dvouleté přežití bez progrese onemocnění bylo v celém souboru 69 % (95 % CI 52–86), u pacientů s klinicky negativními uzlinami (cT2–4N0) až 81 %. Kompletní nebo parciální odpověď jsme zaznamenali u 41 %, resp. 59 % pacientů. Pravděpodobnost dosažení alespoň parciální odpovědi na chemoterapii (≤ypT1N0) byla vyšší u nádorů cT2 (76 %) než u cT3–4 (40 %). Dvouleté přežití bez progrese onemocnění bylo signifikantně lepší v případě odpovědi na chemoterapii: 93 % u patologického ypT0, 83 % u ypT1, 50 % u ypT2 a 31 % u ypT3–4 (p=0,003).Závěr:
Pacienti s odpovědí na NACH měli signifikantně lepší dvouleté přežití bez progrese ve srovnání s pacienty bez odpovědi. Do budoucna je nutná lepší selekce pacientů k NACH, identifikace responderů, k čemuž by mohl přispět vývoj nových molekulárních markerů.KLÍČOVÁ SLOVA:
Chemoterapie, neoadjuvantní léčba, nádory močového měchýře.ÚVOD
V léčbě invazivních nádorů měchýře nedošlo za posledních 30 let k zásadnímu průlomu. Základem léčby je kvalitně provedená radikální cystektomie s pánevní lymfadenektomií. Bohužel 30–50 % pacientů má již v čase radikální operace okultní metastázy, což je argumentem pro časné podání systémové léčby – chemoterapie (1, 2).
Současná urologická a onkologická doporučení preferují neoadjuvantní chemoterapii (NACH) před adjuvantní na základě kvalitnějších dat z randomizovaných studií (3). Metaanalýza studií s NACH prokázala 5% zlepšení celkového přežití pacientů s invazivními nádory měchýře, což odpovídá efektu perioperační chemoterapie u jiných typů solidních nádorů, přesto není koncept NACH v urologické komunitě široce přijat (4).
V současnosti existuje shoda na indikaci NACH u lokálně pokročilých nádorů cT3–4 a/nebo cN+. U nádorů ohraničeného na měchýř (pT2) je i při samotné radikální cystektomii riziko rekurence relativně nízké (20–30 %), což je argumentem odpůrců NACH u tumorů cT2 (5). Nicméně nepřesnost zobrazovacích metod vede u kategorie cT2 až v 50 % k podhodnocení rozsahu onemocnění, a proto se také u těchto nádorů doporučuje zvážit chemoterapii, zejména v případě výskytu rizikových faktorů, jako jsou nález hydronefrózy nebo lymfovaskulární invaze (6–8).
Nález kompletní patologické odpovědi pT0 při radikální cystektomii snižuje riziko úmrtí o 55 % a je prognosticky příznivým ukazatelem bez ohledu na to, jestli k ní došlo po samotné transuretrální resekci (TUR) měchýře nebo po resekci a NACH (9). Pětileté nádorově-specifické přežití u těchto pacientů dosahuje 85–90 % a hlavním přínosem NACH se zdá být právě častější výskyt pT0 (3, 5).
Dalším problémem je biologická heterogenita uroteliálních nádorů, jejímž projevem je 30% podíl non-responderů mezi pacienty podstupujícími chemoterapii.V současnosti chybí spolehlivé klinické a molekulární prediktory, které by nám umožnily identifikovat tuto skupinu nemocných, kteří nebudou mít prospěch z NACH.
Cílem naší práce je retrospektivní zhodnocení frekvence odpovědi na NACH, posouzení jejího prognostického vlivu a identifikace klinických prediktorů odpovědi.
SOUBOR PACIENTŮ A METODA
Za období od 1/2010 do 10/2015 podstoupilo v Masarykově onkologickém ústavu 124 pacientů s invazivním nádorem měchýře radikální cystektomii, z nichž 45 (36 %) dostalo NACH. Z hodnocení byli vyřazeni tři pacienti s podezřením na vstupní postižení uzlin nad úrovní bifurkace aorty a jeden pacient s malobuněčným karcinomem. U 41 hodnocených nemocných tvořil uroteliální karcinom dominantní část histologie nádoru.
K chemoterapii byly indikovány nádory cT3–4 a/nebo cN+. U kategorie cT2N0 (37 %) pouze v případě výskytu rizikových faktorů jako hydronefróza, lymfovaskulární invaze nebo histologická varianta uroteliálního karcinomu (mikropapilární typ). Základní stratifikaci v rámci souboru tvořil nález lymfadenopatie při diagnóze onemocnění, čímž se soubor rozdělil na skupiny cT2–4N0 a cT2–4N1–3, čítající 27 (66 %), resp. 14 (34 %) nemocných.
Kritériem způsobilosti pro ChT byla glomerulární filtrace >50 ml/min a funkční stav dle ECOG ≤1. Nejčastěji byla podána kombinace gemcitabinu a cisplatiny (GC) v 85 %, v případě renální insuficience byla v počátečních letech cisplatina nahrazena karboplatinou u šesti pacientů. Do konce roku 2013 byly podávány tři cykly NACH s intervalem 28 dní, od ledna 2014 pak čtyři cykly po 21 dnech. U každého pacienta jsme retrospektivně hodnotili dodržení předepsané dávky chemoterapie pomocí John Hopkins Dose Index (JH-DI) (10). Odpověď na chemoterapii byla definována jako kompletní (ypT0N0) nebo parciální (≤ypT1N0).
Medián délky sledování dosáhl 14 měsíců (1–71). Sledování bylo definováno dobou od radikální cystektomie do poslední kontroly nebo do zaznamenání recidivy nebo po úmrtí z jiné příčiny.
Retrospektivně jsme posuzovali vztah jednotlivých klinických charakteristik a odpovědi na chemoterapii. Hodnocené proměnné byly věk, pohlaví, kategorie cT a cN, primárně invazivní versus progredující neinvazivní nádor, makroskopicky kompletní versus nekompletní TUR, lymfovaskulární invaze, hydronefróza, vstupní glomerulární filtrace (eGFR), protokol chemoterapie a John Hopkins Dose Index.
Za ukazatel onkologických výsledků jsme vzhledem ke krátké době sledování zvolili dvouleté přežití bez progrese (PFS), které jsme posuzovali pomocí Kaplan-Meierových křivek a srovnání přežití v rámci podskupin pomocí log-rank testu. Schopnost predikce byla hodnocena pomocí logistické regrese a kvantifikována OR („odds ratio“) s intervalem spolehlivosti a p-hodnotou. Za statisticky signifikantní byly považovány hodnoty p <0,05.
VÝSLEDKY
Charakteristika souboru je uvedena v tabulce 1. Průměrný věk pacientů byl 63 let (42–76), muži a ženy tvořili 73 %, resp. 27 % a medián délky sledování dosáhl 14 měsíců (1–71). Klinicky lokalizované (cT2) a lokálně pokročilé onemocnění (cT3–4) mělo 21 (51 %), resp. 20 (49 %) pacientů a pánevní lymfadenopatii dle vstupních zobrazovacích vyšetření 14 (34 %) nemocných. Všichni pacienti podstoupili radikální cystektomii po NACH, 30denní mortalita byla 2 %.
Tab. 1. <i>Charakteristika souboru pacientů</i> Tab. 1. <i>Patient characteristics</i> 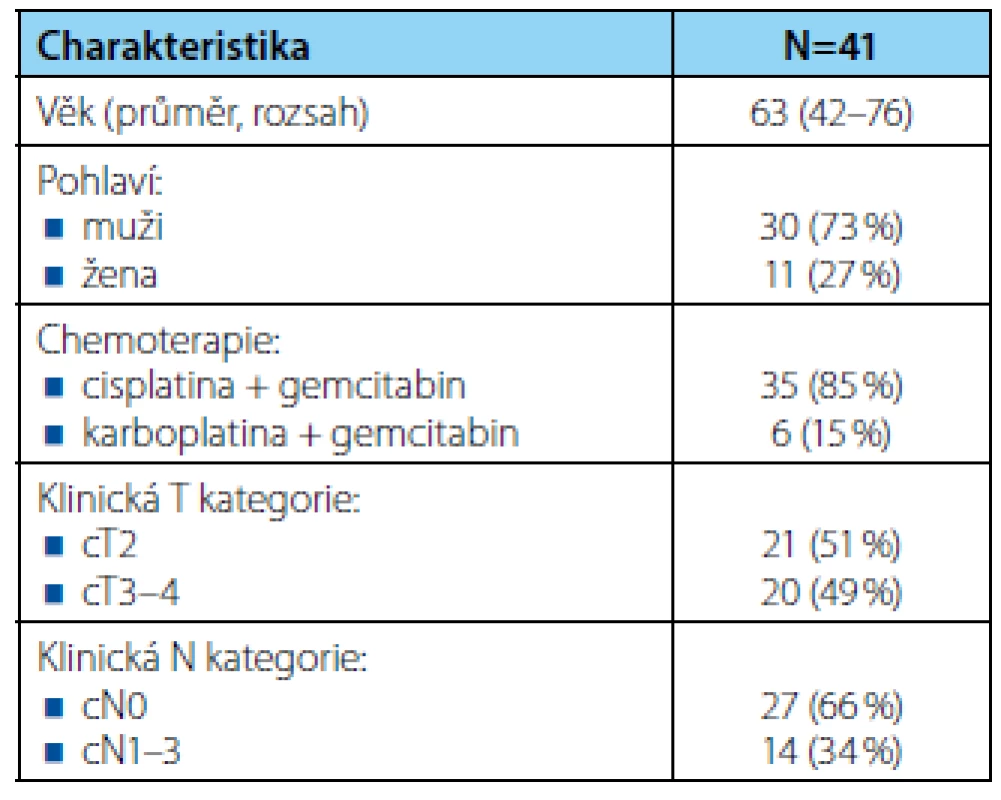
Dvouleté přežití bez progrese (PFS) dosáhlo 69 % (95 %CI: 52;86), k progresi došlo u deseti pacientů s mediánem deset (3–27) měsíců (obrázek 1). U pacientů s klinicky negativními uzlinami (cT2–4N0) bylo dosaženo dvouleté PFS 81 %, horší výsledky jsme zaznamenali u pacientů s klinickým postižením uzlin (cT2–4N1–3) 52 %, s mediánem přežití bez progrese 2,3 let (obrázek 2).
Obr. 1. <i>Pravděpodobnost přežití bez progrese v celém souboru</i> Fig. 1. <i>Probability of progression-free survival in the whole cohort of patients</i> 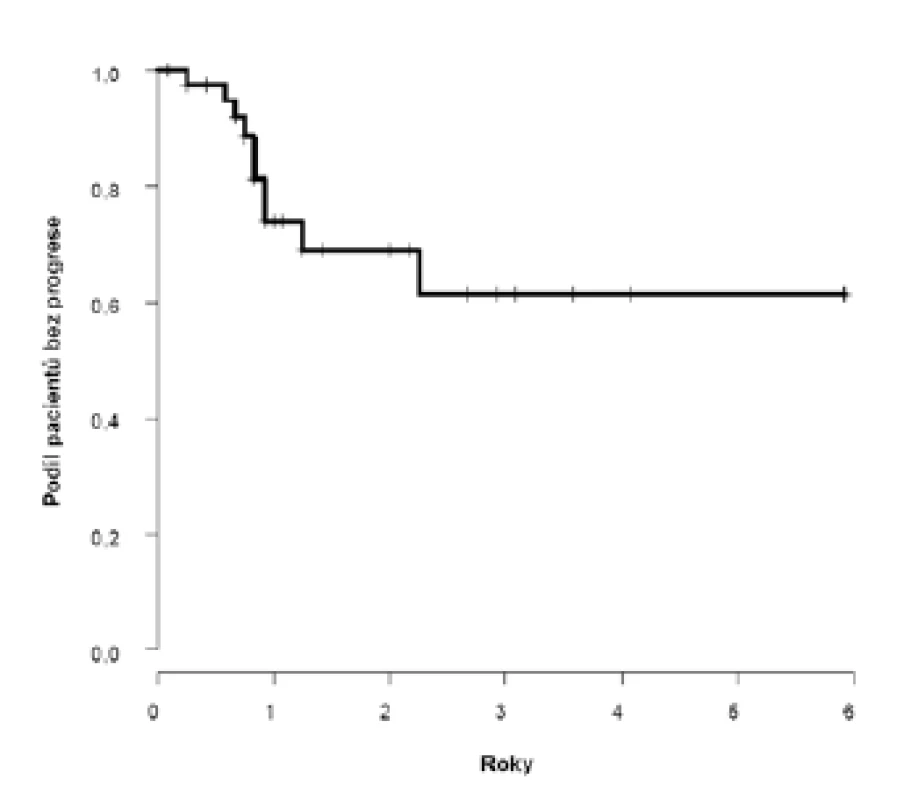
Obr. 2. <i>Pravděpodobnost přežití bez progrese u pacientů s klinicky negativními a pozitivními uzlinami</i> Fig. 2. <i>Probability of progression-free survival in patients with clinically negative and positive lymph nodes</i> 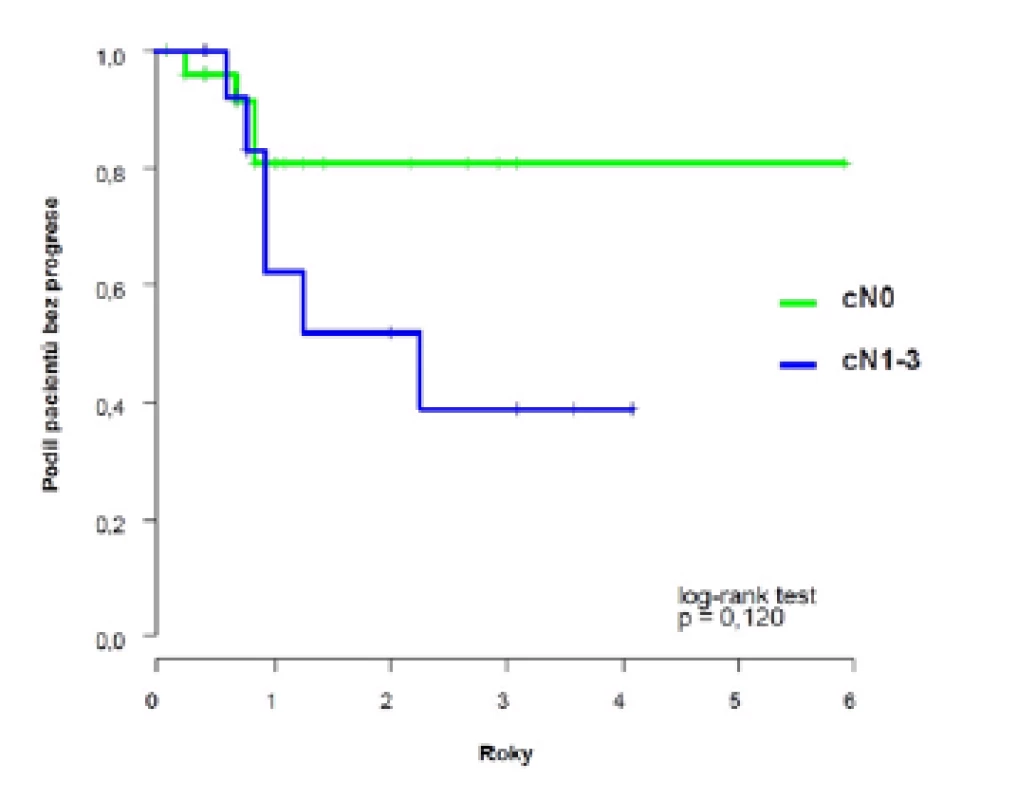
Odpovědi na chemoterapii jsme dosáhli celkově u 24 (59 %) nemocných, kompletní a částečnou u 17 (41 %), resp. 7 (18 %) (tabulka 2). Vyšší pravděpodobnost odpovědi na NACH byla u klinicky lokalizovaných nádorů (cT2) 76 % než u lokálně pokročilých (cT3–4) 40 % (p=0,028). U nádorů cT2 jsme zaznamenali lepší dvouleté PFS 76 % oproti 62 % u cT3–4 onemocnění, rozdíl však nebyl statisticky signifikantní (p=0,309).
Tab. 2. <i>Odpověď na neoadjuvantní chemoterapii podle jednotlivých stadií. CR – kompletní odpověď, PR – částečná odpověď</i> Tab. 2. <i>Response to neoadjuvant chemotherapy stratified by the stage of the disease. CR – complete response, PR – partial response</i> 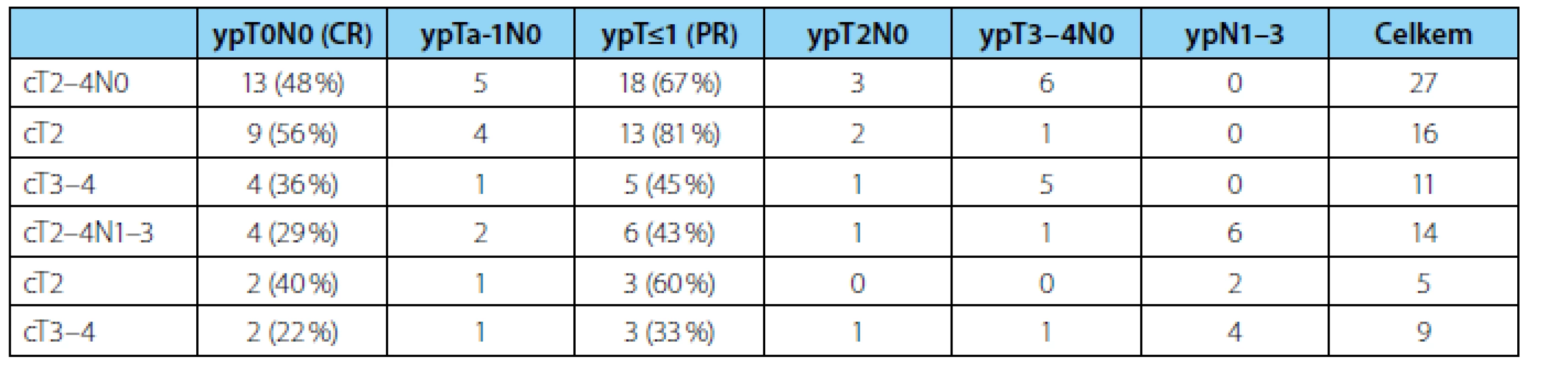
Dvouleté PFS se v rámci celého souboru signifikantně lišilo podle odpovědi na chemoterapii a dosáhlo 93 % ve skupině ypT0, 83 % u ypT1, 50 % u ypT2 a 31 % u ypT3–4 (p=0,003) (obrázek 3). Podobně u nemocných bez uzlinových metastáz po NACH (ypN0) bylo dosaženo vyšší dvouleté PFS 82 % oproti 50 % u ypN2 a 0 % u ypN3 (p=0,049).
Obr. 3. <i>Pravděpodobnost přežití bez progrese v celém souboru podle odpovědi na chemoterapii</i> Fig. 3. <i>Probability of progression-free survival by response to chemotherapy</i> 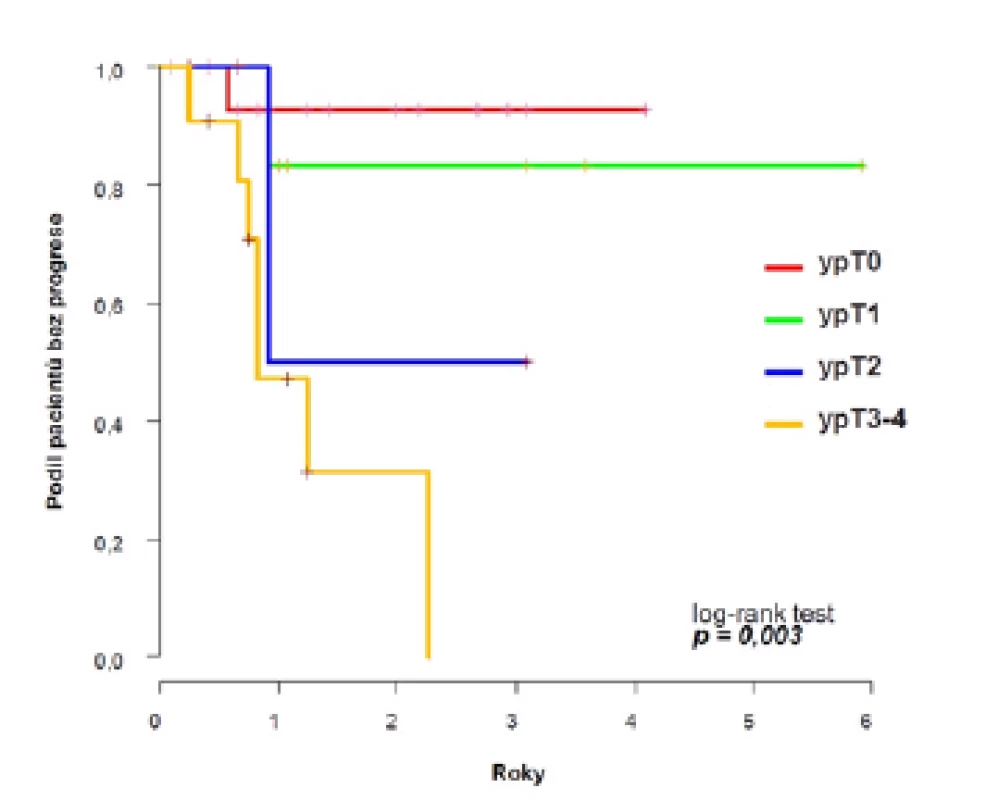
Výrazně lepší výsledky jsme zaznamenali u nádorů bez vstupní lymfadenopatie (cT2–4N0), kde jsme až u 18 z 27 (67 %) pacientů zaznamenali odpověď na chemoterapii a pouze u šesti (22 %) nemocných přetrvávalo lokálně pokročilé onemocnění (ypT3–4). Dvouleté PFS činilo 100 % u ypT0, ypT1 i ypT2, avšak pouze 33 % u ypT3–4.
Univariátním prediktorem kompletní patologické odpovědi (ypT0) bylo z hodnocených proměnných pouze onemocnění cT2 versus cT3 (OR 0,15; p=0,032) a naznačený trend jsme zaznamenali v případě makroskopicky kompletního versus nekompletního TUR (OR 0,30; p=0,128) (tabulka 3). Multivariátní analýza nebyla provedena pro malý počet subjektů.
Tab. 3. Univariátní analýza rizikových faktorů patologické kompletní odpovědi pomocí metodiky logistické regrese. OR = odds ratio, CI = interval spolehlivosti Tab. 3. Univariate analysis of pathologic complete response risk factors using logistic regression. OR = odds ratio, CI = confidence interval. 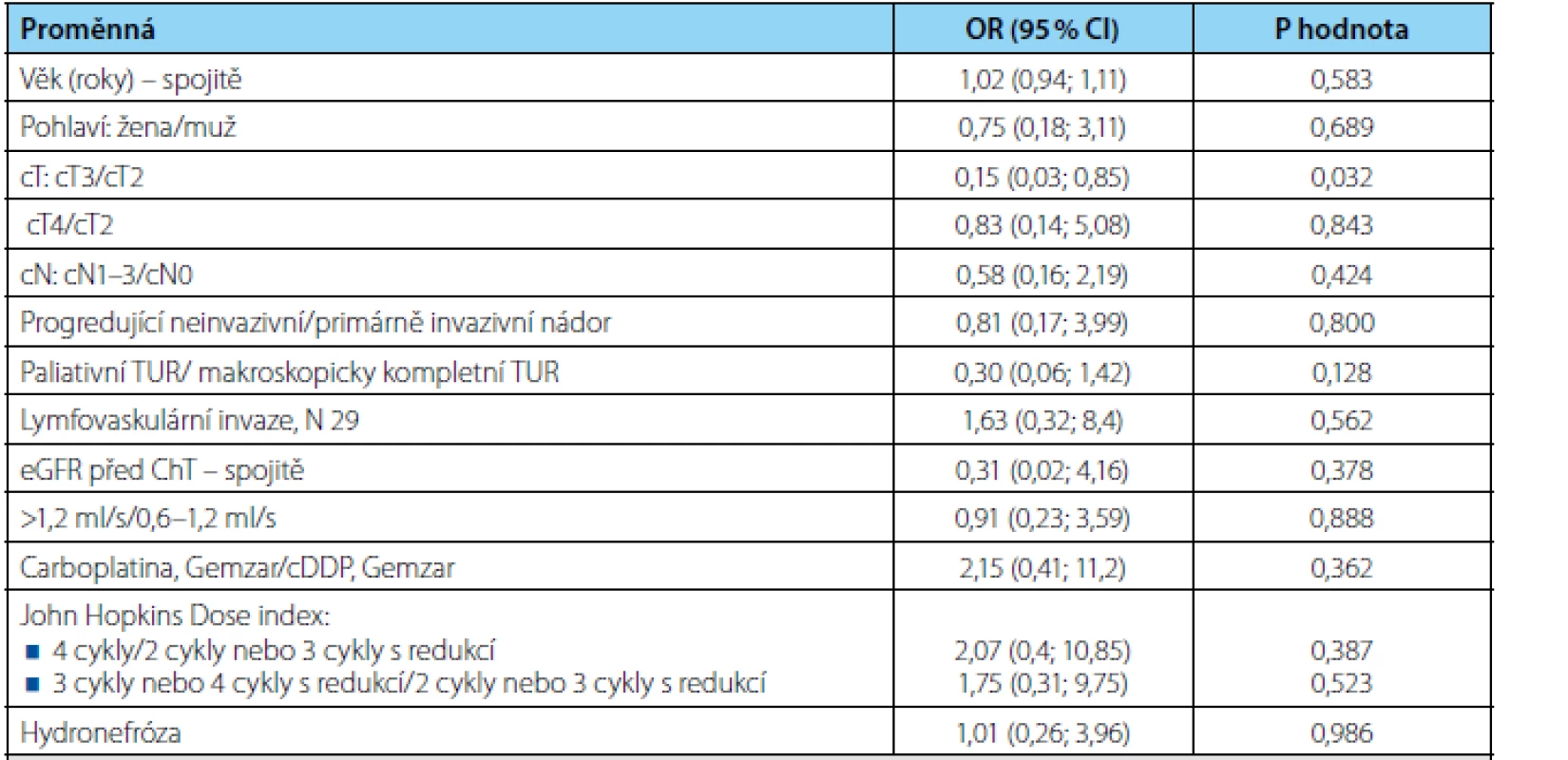
1odds ratio a jeho statistická významnost odvozena z logistické regrese 1odds ratio and its statistical significance derived from logistical regression DISKUZE
Výsledky samotné chirurgické léčby invazivních nádorů měchýře, zejména u lokálně pokročilého onemocnění, jsou neuspokojivé a ke zlepšení můžou vést pouze opatření cílená na časnější diagnostiku nebo efektivní systémová léčba. Metaanalýzou studií s NACH bylo prokázáno zlepšení pětiletého celkového přežití o 5 %, což odpovídá 13% snížení rizika úmrtí (4). I přes prokázaný benefit NACH u invazivních nádorů měchýře je však tento koncept multimodální léčby málo využívaný. Možným vysvětlením jsou obavy z toxicity léčby a z odkladu radikální operace u non-responderů.
V naší práci jsme retrospektivně zhodnotili 41 pacientů s NACH, u kterých bylo dosaženo dvouletého přežití bez progrese 69 %. Všichni pacienti podstoupili radikální cystektomii po chemoterapii a 30denní mortalita kombinované léčby byla pouze 2 %. Při pohledu na skladbu pacientů jsou v našem souboru na rozdíl od publikovaných randomizovaných studií zastoupeni také pacienti s klinicky pozitivními uzlinami před NACH (34 %), což znemožňuje přímé srovnání celého souboru. V randomizovaných studiích s NACH, do kterých byli zařazeni většinou pouze pacienti s klinicky negativními uzlinami cT2–4N0, se pětileté celkové přežití pohybovalo v rozmezí 49–57 % (11–13). V naší srovnatelné skupině 27 pacientů cT2–4N0 jsme zaznamenali optimistické dvouleté PFS 81 %, které je ale pravděpodobně ovlivněno krátkou dobou sledování.
Vícero studií prokázalo, že dosažení kompletní patologické odpovědi pT0 je prognosticky příznivým ukazatelem (5, 9, 11). V metaanalýze 13 studií a 886 pacientů Petrelli et al. popsali kompletní odpověď u 29 % nemocných a u této skupiny bylo sníženo riziko úmrtí o 55 % (9). V největší retrospektivní multicentrické studii 1 130 pacientů s onemocněním cT2–4N0 Zargar et al. zaznamenali celkovou a kompletní odpověď u 41 %, resp. 23 %. Riziko úmrtí bylo u nich sníženo o 75 % oproti skupině bez odpovědi (14). Zastoupení lokálně pokročilých nádorů bylo 53 %, což je srovnatelné s naším souborem, a autoři hodnotili pouze pacienty, kteří dostali alespoň tři cykly chemoterapie.
Výborné onkologické výsledky spojeny s nálezem pT0 při cystektomii se neliší, jestli k nim došlo po samotném TUR tumoru nebo po TUR a následné NACH. Rozdíl v přežití se zdá být způsoben vyšším podílem 25–38 % pacientů s pT0 po NACH oproti 12–15 % po samotné transuretrální resekci (11–13). V našem souboru jsme zaznamenali odpověď na chemoterapii (ypT≤1) u 59 % pacientů, z toho kompletní a částečnou odpověď u 41 %, resp. 18 % případů. V podskupině 27 pacientů s klinicky negativními uzlinami cT2–4N0 jsme dosáhli odpovědi u 67 % nemocných a až 48 % tvořili kompletní odpovědi. Tyto výsledky jsou lepší než v randomizovaných nebo větších retrospektivních studiích, kde se celková odpověď (ypT≤1) a kompletní odpověď (ypT0) pohybuje v rozmezí 22–58 %, resp. 10–38 % (11, 14). Vyšší podíl pacientů s ypT0 v našem souboru může souviset s malým počtem pacientů, jejich selekcí a navíc se jedná o výsledky z jednoho pracoviště s relativně uniformním léčebným protokolem. Pozitivní je, že také ve skupině se vstupní pánevní lymfadenopatií jsme dosáhli relativně vysoké odpovědi na NACH 43 %, kompletní odpověď jsme zaznamenali u 29 % a dvouleté PFS bylo 52 % s mediánem do progrese 2,3 let.
Velice nepříznivým faktorem je přetrvávání invazivního karcinomu měchýře po NACH. V případě nálezu perzistujícího onemocnění ohraničeného na měchýř (ypT2) je rozhodující, zda se jednalo o pacienta se vstupně klinicky negativními (cN0) nebo pozitivními uzlinami (cN1–3), jelikož dvouleté PFS dosáhlo v prvním případě 100 % a ve druhém 50 %. Naopak, v případě reziduálního lokálně pokročilého onemocnění ypT3–4 (27 % pacientů), bylo dvouleté PFS nízké v obou případech a dosáhlo pouze 33 %, resp. 31 %. Výsledky však můžou být ovlivněny malým počtem pacientů.
Několik studií se snažilo o predikci odpovědi na NACH, které by umožnilo selektivní podání pacientům s pravděpodobným léčebným benefitem. Zargar et al. popsali klinickou kategorii cT3–4 a aplikaci jiného chemoterapeutického režimu než MVAC (metotrexát, vinblastin, doxorubicin, cisplatina) a GC jako negativní prediktivní faktory odpovědi na NACH (14). V našem souboru jsme prokázali jako negativní prediktor pouze kategorii cT3 (OR 0,15; p=0,032) a trend byl naznačen v případě nekompletního TUR (p=0,128). Vyšší pravděpodobnost odpovědi na NACH byla publikována v případě věku pod 60 let a vyššího počtu aplikovaných cyklů chemoterapie, v našem souboru ale signifikantně nevyšly (10).
Kvalitní data z randomizovaných studií s NACH máme ze současných protokolů pouze pro MVAC (11). Pro svou vyšší toxicitu byl však MVAC v praxi z velké části nahrazen kombinací GC, nicméně data potvrzující non-inferioritu této kombinace pocházejí z randomizované studie u metastatického onemocnění a v případě NACH jenom z retrospektivních studií (15). Podíly pacientů, kteří dosáhli kompletní odpovědi, se ale mezi protokoly v retrospektivním hodnocení neliší (14).
Je nutné připomenout, že i přes pokroky v systémové léčbě je pro prognózu pacienta rozhodující kvalita chirurgické léčby. Pečlivost lymfadenektomie nebo výskyt pozitivních okrajů sehrávají zásadní roli. V jedné z randomizovaných studií s NACH (SWOG 8710) byl signifikantní rozdíl v pětiletém celkovém přežití 44 %, resp. 61 %, pokud měli pacienti při operaci odstraněno méně nebo více než deset uzlin (16). V našem souboru byl medián odstraněných uzlin 24 (IQR 18–30).
Limitací studie je krátká doba sledování 14 měsíců, což neumožňuje optimální zhodnocení onkologických výsledků. Na druhé straně dvouleté PFS dobře odpovídá dlouhodobějším výsledkům, jelikož k většině recidiv dojde v prvních dvou letech po operaci. Nuhn et al. prokázali na 1 738 pacientech 86% souhlas mezi dvouletým PFS a pětiletým celkovým přežitím (17).
K dosažení optimálních onkologických výsledků u invazivních nádorů měchýře je nutné identifikovat non-respondery na chemoterapii, kteří tvoří asi třetinu cílové populace, abychom zamezili opoždění radikální operace. V nedávné době byly publikovány studie, ve kterých mutace genů zodpovědných za opravu DNA byly spojeny s dobrou odpovědí na NACH (18). Lze předpokládat, že nová taxonomie uroteliálních nádorů na základě molekulárních markerů bude hrát v predikci mnohem větší roli než současné klinické prediktory (19) a velikým příslibem jsou nové možnosti systémové terapie, jako je cílená léčba nebo imunoterapie.
ZÁVĚR
V našem souboru jsme zaznamenali vysoký podíl odpovědi na NACH. Pacienti s kompletní odpovědí měli signifikantně lepší dvouleté přežití bez progrese než pacienti s reziduálním onemocněním. Současné klinické prediktory odpovědi na chemoterapii jsou nedostatečné a je nutný vývoj nových biomarkerů, které umožní identifikovat respondery a selektovat podání NACH.
Došlo: 29. 3. 2016
Přijato: 7. 7. 2016
Kontaktní adresa:
MUDr. Michal Staník, Ph.D.
Oddělení onkourologie, Masarykův onkologický ústav,
Žlutý Kopec 7,
656 53 Brno
e-mail: stanik@mou.cz
Střet zájmů: žádný
Prohlášení o podpoře:
Podpořeno MZ ČR – RVO (MOÚ, 00209805).
Autor prohlašuje, že zpracování tohoto článku nebylo podpořeno žádnou společností.
Zdroje
1. Stein JP, Lieskovsky G, Cote R, et al. Radical cystectomy in the treatment of invasive bladder cancer: long-term results in 1,054 patients. J Clin Oncol 2001; 19(3): 666–675.
2. Sternberg CN, Bellmunt J, Sonpavde G, et al. ICUD-EAU International consultation on bladder cancer 2012: chemotherapy for urothelial carcinoma – neoadjuvant and adjuvant settings. Eur Urol 2013; 63(1): 58–66.
3. Meeks JJ, Bellmunt J, Bochner BH, et al. A systematic review of neoadjuvant and adjuvant chemotherapy for muscle-invasive bladder cancer. Eur Urol 2012; 62 : 523–533.
4. Advanced Bladder Cancer (ABC) Meta-Analysis Collaboration: Neoadjuvant chemotherapy in invasive bladder cancer: update of a systematic review and meta-analysis of individual patient data: advanced bladder cancer (ABC) meta-analysis collaboration. Eur Urol 2005; 48 : 202–205.
5. Lavery HJ, Stensland KD, Niegisch G, Albers P, Droller MJ. Pathological T0 following radical cystectomy with or without neoadjuvant chemotherapy: a useful surrogate. J Urol. 2014; 191(4): 898–906.
6. Culp SH, Dickstein RJ, Grossman HB, et al. Refining patient selection for neoadjuvant chemotherapy before radical cystectomy. J Urol. 2014; 191(1): 40–47.
7. Lotan Y, Gupta A, Shariat SF, et al. Lymphovascular invasion is independently associated with overall survival, cause-specific survival, and local and distant recurrence in patients with negative lymph nodes at radical cystectomy. J Clin Oncol 2005; 23(27): 6533–6539.
8. Stimson CJ, Cookson MS, Barocas DA, et al. Preoperative hydronephrosis predicts extravesical and node positive disease in patients undergoing cystectomy for bladder cancer. J Urol. 2010; 183(5): 1732–1737.
9. Petrelli F, Coinu A, Cabiddu M, et al. Correlation of pathologic complete response with survival after neoadjuvant chemotherapy in bladder cancer treated with cystectomy: a meta-analysis. Eur Urol 2014; 65(2): 350–357.
10. Gandhi NM, Baras A, Munari E, et al. Gemcitabine and cisplatin neoadjuvant chemotherapy for muscle-invasive urothelial carcinoma: Predicting response and assessing outcomes. Urol Oncol 2015; 33(5): 204e1–7.
11. Grossman HB, Natale RB, Tangen CM, et al. Neoadjuvant chemotherapy plus cystectomy compared with cystectomy alone for locally advanced bladder cancer. N Engl J Med. 2003; 349 : 859–866.
12. Sherif A, Holmberg L, Rintala E, et al. Neoadjuvant cisplatinum based combination chemotherapy in patients with invasive bladder cancer: a combined analysis of two Nordic studies. Eur Urol 2004; 45 : 297–303.
13. Griffiths G, Hall R, Sylvester R, Raghavan D, Parmar MK. International phase III trial assessing neoadjuvant cisplatin, methotrexate, and vinblastine chemotherapy for muscle-invasive bladder cancer: long-term results of the BA06 30894 trial. J Clin Oncol 2011; 29(16): 2171–2177.
14. Zarger H, Espiritu PN, Fairey AS, et al. Multicenter assessment of neoadjuvant chemotherapy for muscle-invasive bladder cancer. Eur Urol 2015; 67(2): 241–249.
15. Von der Maase H, Sengelov L, Roberts JT, et al. Long-term survival results of a randomized trial comparing gemcitabine plus cisplatin, with methotrexate, vinblastine, doxorubicin, plus cisplatin in patients with bladder cancer. J Clin Oncol 2005; 23 : 4602–4608.
16. Herr HW, Faulkner JR, Grossman HB, et al. Surgical factors influence bladder cancer outcomes: a cooperative group report. J Clin Oncol 2004; 22(14): 2781–2789.
17. Nuhn P, May M, Fritsche H-M, et al. External validation of disease-free survival at 2 or 3 years as a surrogate and new primary endpoint for patients undergoing radical cystectomy for urothelial carcinoma of the bladder. Eur J Surg Oncol 2012; 38 : 637–642.
18. Plimack ER, Dunbrack RL, Brennan TA, et al. Defects in DNA repair genes predict response to neoadjuvant cisplatin-based chemotherapy in muscle-invasive bladder cancer. Eur Urol 2015; 68(6): 959–967.
19. Cancer Genome Atlas Research Network. Comprehensive molecular characterization of urothelial bladder carcinoma. Nature. 2014; 507 : 315–322.
Štítky
Dětská urologie Nefrologie Urologie
Článek vyšel v časopiseČeská urologie
Nejčtenější tento týden
2016 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Editorial
- LAPAROSKOPICKÁ NEFROPEXE
- OTEVŘENÁ RESEKCE PAPILÁRNÍHO RENÁLNÍHO KARCINOMU KATEGORIE cT2a
- HIV-POZITIVNÍ PACIENT ZNÁMÝ I NEZNÁMÝ: INFEKCE HIV V UROLOGII
- CYSTICKÉ TUMORY LEDVIN
- KABAZITAXEL V LÉČBĚ METASTATICKÉHO KASTRAČNĚ REZISTENTNÍHO KARCINOMU PROSTATY
- NEOADJUVANTNÍ CHEMOTERAPIE U INVAZIVNÍCH UROTELIÁLNÍCH NÁDORŮ MĚCHÝŘE: KORELACE LÉČEBNÉ ODPOVĚDI A PŘEŽITÍ PACIENTŮ
- INKONTINENCIA MOČU U DIEŤAŤA S URETER TRIPLEX A EKTOPICKÝM VYÚSTENÍM MOČOVODU
- MINIINVAZIVNÍ ŘEŠENÍ HEMORAGICKÉ KOMPLIKACE PO ROBOTICKY ASISTOVANÉ RADIKÁLNÍ PROSTATEKTOMII
- THE 23RD ANNUAL CONFERENCE OF THE SLOVAK UROLOGICAL SOCIETY IN ŽILINA, SLOVAKIA, 15–17 JUNE 2016.
- Česká urologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- CYSTICKÉ TUMORY LEDVIN
- HIV-POZITIVNÍ PACIENT ZNÁMÝ I NEZNÁMÝ: INFEKCE HIV V UROLOGII
- KABAZITAXEL V LÉČBĚ METASTATICKÉHO KASTRAČNĚ REZISTENTNÍHO KARCINOMU PROSTATY
- LAPAROSKOPICKÁ NEFROPEXE
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



