-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaBIOPSIE UVEÁLNÍHO MELANOMU PŘEHLED
Autoři: Š. Rusňák 1; L. Hecová 1; Z. Kasl 1; M. Sobotová 1; L. Hauer 2
Působiště autorů: Oční klinika, Fakultní nemocnice v Plzni 1; Stomatologická klinika, Fakultní nemocnice v Plzni 2
Vyšlo v časopise: Čes. a slov. Oftal., 76, 2020, No. 6, p. 247-252
Kategorie: Přehledová práce
doi: https://doi.org/10.31348/2020/9Souhrn
U nitroočních nádorů je diagnostika standardně založena na klinickém vyšetření a vyšetření pomocí zobrazovacích metod bez nutnosti invazivního zákroku nebo odběru vzorků tkání. Diagnózu lze potvrdit biopsií, nicméně v případě nitroočního maligního nádoru je biopsie považována za kontroverzní. S ohledem na rozvoj cytogenetické prognostiky uveálního melanomu a rozvoj oblasti léčby generalizovaného uveálního melanomu ale biopsie nitroočního melanomu nabývá na významu. Diagnostická biopsie nitroočních nádorů se indikuje v případech diagnostické nejistoty u nálezů s protichůdnými výsledky neinvazivních testů a u malých melanocytárních lézí. Tzv. prognostická biopsie nádoru se provádí za účelem získání vzorku tkáně pro cytogenetické vyšetření tumoru, na základě kterého je možné stanovit prognózu a specifické metastatické riziko pacienta.
U nádorů předního segmentu je možné využít odběr předněkomorové tekutiny, biopsii duhovky tenkou jehlou, biopsii punchem, chirurgickou biopsii nebo biopsii za použití vitrektomu. U nádorů zadního segmentu postupy zahrnují transsklerální nebo transretinální biopsii tenkou jehlou, vitrektomem asistovanou biopsii, biopsii punchem, endoresekci nebo transsklerální exoresekci. Mezi hlavní komplikace biopsie nitroočního melanomu patří odběr malého nebo nevalidního vzorku, intratumorální heterogenita, peroperační poranění nitroočních struktur a intraokulární nebo extraokulární diseminace nádoru.
Klíčová slova:
uveální melanom – diagnostická biopsie – prognostická biopsie – biopse tenkou jehou – biopsie punchem – vitrektomem asistovaná biopsie
ÚVOD
V klinické onkologii vyžaduje léčba zhoubných nádorů zpravidla histologické potvrzení diagnózy. U nitroočních nádorů je diagnostika standardně založena na klinickém vyšetření a vyšetření pomocí zobrazovacích metod (ultrasonografie, ultrazvuková biomikroskopie, optická koherenční tomografie, autofluorescence, fluoresceinová a indocyaninová angiografie, popř. PET/CT nebo PET/MR) obvykle bez nutnosti invazivního zákroku nebo odběru vzorků tkání [1,2,3]. Diagnózu lze potvrdit biopsií, nicméně v případě nitroočního maligního nádoru je biopsie považována za kontroverzní. Hlavní obavy panují kvůli riziku diseminace nádoru v důsledku invazivního zákroku, mezi další možné komplikace patří především odběr malého nebo nevalidního vzorku, intratumorální heterogenita a peroperační poranění nitroočních struktur. S ohledem na nové poznatky o cytogenetické prognostice uveálního melanomu a postupující poznatky v oblasti léčby generalizovaného uveálního melanomu ale biopsie nitroočního melanomu nabývá na významu [4].
Indikace biopsie
Účelem diagnostické biopsie nitroočního nádoru je potvrdit nebo vyloučit klinické podezření na malignitu. Celkem vyžadují provedení diagnostické biopsie přibližně 1–2 % nitroočních nádorů [5].
Hlavní indikací pro diagnostickou nitrooční biopsii nádoru zůstává diagnostická nejistota s protichůdnými výsledky neinvazivních testů. Samostatnou problematikou jsou pak malé uveální melanocytární léze (maximální výška do 3 mm). Obvyklá strategie u malých choroidálních melanocytárních lézí (zahrnujících atypické névy a malé melanomy) je pravidelné sledování, terapie se zahajuje až při zachycené progresi léze. Klinická onkologická praxe ale považuje dřívější diagnózu a léčbu za krok ke zlepšení prognózy přežití pacienta [6,7]. S ohledem na malou velikost a časté posteriorní umístění lézí je v těchto případech ale zvýšené riziko jednak odběru nedostatečně velkého vzorku, jednak rozvoje zrak ohrožujících očních komplikací.
Navzdory zlepšení lokální léčby uveálního melanomu, díky které je u většiny pacientů možno dosáhnout lokální kontroly nad tumorem a přitom zachovat bulbus, prevence a léčba metastatického onemocnění zůstávají závažným problémem. U téměř 50 % pacientů s uveálním melanomem se rozvinou metastázy jater. Současné poznatky naznačují, že nádorové buňky jsou v těle přítomny a rozšířeny již v době primární diagnózy a zůstávají neaktivní, dokud nenastanou příznivé podmínky pro vznik makrometastáz [8]. Neustálé hledání nových molekulárních cílů systémové terapie u pacientů s metastatickým postižením a jejich zařazení do léčebných programů v rámci klinických studií na základě molekulárního profilu nádoru vyžadují spolehlivou genetickou a molekulární charakterizaci nádoru [4]. Z tohoto důvodu roste význam tzv. prognostické biopsie nádoru, tj. odběr se provádí ne z důvodu potvrzení diagnózy, ale za účelem získání vzorku tkáně pro cytogenetické vyšetření tumoru [9]. To umožňuje stanovit prognózu, posoudit specifické metastatické riziko pacienta a individuálně nastavit načasování kontrol a screeningových vyšetření (laboratorní kontroly, sonografie břicha, rtg plic) pacientů s uveálním melanomem. Genetická a molekulární charakteristika melanomu je v porovnání s klasickými klinickými a patologickými znaky (jako jsou rozměry nádoru, lokalizace nádoru, přítomnost exsudativní amoce, výsledky histopatologického vyšetření) v předpovědi prognózy spolehlivější [4,10].
Techniky biopsie
Vhodná technika biopsie uveálního melanomu se volí především podle umístění a velikosti léze. U nádorů předního segmentu je možné využít odběr předněkomorové tekutiny, biopsii duhovky tenkou jehlou, biopsii punchem, chirurgickou biopsii nebo biopsii za použití vitrektomu. U nádorů zadního segmentu postupy zahrnují transsklerální nebo transretinální biopsii tenkou jehlou, vitrektomem asistovanou biopsii, biopsii punchem, endoresekci nebo transsklerální exoresekci.
TUMORY PŘEDNÍHO SEGMENTU OKA
Odběr komorové tekutiny
Vyšetření komorové tekutiny umožňuje identifikaci buněčné infiltrace v přední komoře. Tato technika se využívá především u vybraných lézí duhovky (melanomy duhovky, především difuzní, popř. metastázy duhovky) s patrným rozsevem do přední komory [4]. Předmětem studií je využití této techniky v diagnostice melanomu řasnatého tělesa a/nebo cévnatky – v porovnání s benigními lézemi jsou v případě melanomu vyšší hladiny angiogeninu, IL-8 a MCP-1 [11]. Hlavní omezení této techniky spočívá v tom, že vzorky jsou tzv. paucicelulární (tj. množství buněk v odebraném materiálu je minimální) a je velmi obtížené na jejich základě získat validní výsledky vyšetření.
Biopsie duhovky tenkou jehlou
Standardní technika pro biopsii duhovky tenkou jehlou spočívá v limbálním řezu 1 mm v čiré rohovce a injekci viskoelastického materiálu do přední komory. Poté je do nádoru duhovky přes rohovkový řez a přední komoru zavedena ostrá jehla (dle velikosti léze 25-gauge, 27-gauge nebo 30-gauge). Rohovkou je jehla vedena pod úhlem přibližně 20–30° vůči duhovce, v přední komoře by měla jehla být vedena rovnoběžně s duhovkou. Nejvhodnější místo biopsie je přibližně 90° od meridiánu nádoru. Doporučuje se specifický postup zavádění jehly do tkáně tumoru - jemný pohyb jehly tam a zpět do léze při zachování podtlaku, tím dojde k uvolnění nádorových buněk, které jsou pak manuálně nasávány asistujícím lékařem [12,13].
I v případě biopsie duhovky tenkou jehlou lze získat vzorek jen omezené velikosti s malým množstvím buněk a může být obtížné jej validně interpretovat.
Biopsie duhovky vitrektomem
Při této technice je do přední komory zavedena 21-gauge infuze a nitrooční tlak je zvýšen na 70 mmHg. Následně je proveden druhý limbální řez, kterým je zaveden 20-gauge vitrektom k povrchu nádoru tak, že je jeho ústí nádorovou tkání zakryto. Při vysoké hodnotě aspirace (400 mmHg) a nízké frekvenci sekání (80/min.) je poté jedním řezem z povrchu nádoru získán vzorek [4,14].
Chirurgická biopsie duhovky
Chirurgická iridektomie poskytuje dostatečné množství tkáně pro histopatologickou, imunohistochemickou a cytogenetickou analýzu. V klinické praxi se používá především jako tzv. excizní biopsie s odstraněním veškeré neoplastické tkáně. Nevýhodou tohoto postupu je rozsáhlý iatrogenní defekt rohovky nebo skléry [15]. Variantou je minimálně invazivní metoda s provedením multifokální chirurgické biopsie duhovky. Na úvod zákroku je proveden 1,0 mm dlouhý rohovkový řez a přední komora je naplněna 1% natrium-hyaluronátem. Poté je do rohovky zaveden 25G aspirační port a za vysoké hodnoty aspirace (600 mmHg) i frekvence sekání (300/min.) se na několika místech odeberou vzorky duhovky v plné i částečné tloušťce [4,16].
TUMORY ZADNÍHO SEGMENTU OKA
Biopsie tenkou jehlou
Biopsii tenkou jehlou lze v případě nádorů zadního segmentu provádět transretinálně nebo z transsklerálního přístupu.
Transsklerální biopsie tenkou jehlou se provádí u ciliochoroidálních tumorů a u nádorů cévnatky lokalizovaných anteriorně nebo blízko ekvátoru oka. Při transsklerálním, tzv. přímém přístupu se vzorek nádorové tkáně odebírá přes skléru v místě baze tumoru při zachování intaktní sítnice. Po lokalizaci tumoru se vytvoří lamelární sklerální flap (cca 80 % tloušťky skléry) ve tvaru rovnostranného trojúhelníku. Jehla (nejčastěji 25-gauge nebo 30-gauge) se zavede do tkáně nádoru sklerálním řezem o velikosti 300 µm, postupně se odeberou 2–3 vzorky. Sklerální řez se ihned po odběru zašije [17,18,19]. Modifikovanou technikou, která zlepšuje výtěžnost vzorků pro cytologickou a genetickou analýzu, je využití bioptických kleští (tzv. Essen biopsy forceps) s utěsněním sklerálního flapu histoakrylovým lepidlem [4]. V případě odběru vzorku před brachyterapií se okamžitě po provedení biopsie tumoru našije na skléru nad bazi tumoru aplikátor s radionuklidem.
U lézí umístěných více posteriorně je díky lepší vizualizaci nádoru vhodnější transretinální přístup. Transretinální, resp. indirektní metoda znamená přední přístup přes pars plana (sklerotomie je lokalizovaná proti nádoru), následně je jehla vedena sklivcem přes sítnici do choroidálního tumoru v subretinálním prostoru. Při tomto přístupu je třeba hrot jehly (obvykle 25-gauge jehla, někteří autoři doporučují 27-gauge jehlu) ohnout cca 2–3 mm od hrotu do úhlu 60–90° vůči konu jehly. To umožňuje vstup do novotvaru hrotem jehly souběžně se sítnicí, čímž se snižuje riziko perforace skléry, takto se odeberou 2–3 vzorky. Doporučuje se pečlivá lokalizace nepřímou oftalmoskopií, lze využít i operační mikroskop s širokoúhlým zobrazovacím systémem. Zatímco transsklerální přístup obvykle vyžaduje, aby byl tumor alespoň 3 mm vysoký, transretinální přístup umožňuje díky transpupilární vizualizaci během zákroku provedení biopsie i u malých nádorů. Postup může být kombinován s předchozí vitrektomií – kombinovaný zákrok snižuje riziko krvácení do sklivce, resp. rozvoj sklivcové trakce v místě retinotomie (v místě odběru vzorku), která se obvykle samovolně uzavře. Po zašití sklerotomií je možné provést kryopexi [4,17,18,20].
Dle Singha diagnostický výnos významně koreluje s volbou bioptického přístupu (transsklerální 96 %, transretinální 86 %; p = 0,029) a velikostí nádoru (průměr baze do 5,0 mm a výška do 2,5 mm). Shields zkoumal potenciál techniky biopsie tenkou jehlou u malých melanomů (s maximální výškou do 3 mm) - odebíral vzorky v místě nejvyšší prominence choroideálních tumorů 27-gauge jehlou za využití transretinálního postupu, v 97 % případů se mu podařilo odebrat reprezentativní vzorek tumoru vhodný k histopatologické a cytogenetické analýze [18].
Vitrektomem asistovaná biopsie
Vitrektom lze při transretinální biopsii využít přímo k odběru vzorku, případně je možné využít kombinované metody: vitrektomem asistovanou biopsii s odběrem vzorku bioptickými kleštěmi (Essen biopsy forceps) nebo incizní biopsii.
Při tzv. transvitreální retinochoroideální biopsii se vzorek pro cytogenetické a histopatologické vyšetření odebírá vitrektomem, dle velikosti léze 25-gauge nebo 27-gauge. Po zavedení 3 standardních pars plana portů je vitrektom pod přímou transpupilární vizuální kontrolou zaveden sklivcem (bez provedení vitrektomie) k choroidálnímu nádoru. V oblasti zamýšlené biopsie je indukována separace sklivce a provedena důkladná lokální vitrektomie, aby nedošlo k vitreoretinální inkarceraci do vitrektomu v průběhu biopsie. Z důvodu prevence krvácení je zvýšen nitrooční tlak. Vitrektom je po provedení retinotomie zaveden do tumoru a je odebrán vzorek při vysoké hodnotě aspirace (400–600 mmHg) a nízké frekvenci sekání (80–300/min). Vzorek se získává kontinuálním odsáváním a řezáním, dokud se v aspirační hadičce vitrektomu neobjeví dostatečné množství odebraného materiálu. Oblast retinotomie obvykle není nutné ošetřovat, provádí se ale sutura a kryopexe sklerotomií [4,14,21].
Při nitrooční biopsii uveálního melanomu existuje potenciální možnost diseminace nádorových buněk během výkonu; toto riziko bylo významně sníženo používáním menších kanyl a přesných operačních technik [14]. Variantou, která zvyšuje bezpečnost pro pacienta, je provedení biopsie po předchozím ozáření nádoru. Ozáření vyvolává náhodné léze v DNA a až 6 měsíců po ozáření nedochází k významné změně cytogenetiky nádorové tkáně, krátce po ozáření by tedy genetická prognostika neměla být ovlivněna [22].
Transretinální biopsie s použitím bioptických (Essenových) kleští je bezstehová metoda, využívající tříportovou 23-gauge pars plana vitrektomii (PPV) s následným provedením 0,6 mm dlouhé retinální incize, která umožní zavedení otevřených Essenových kleští do nádoru. Vzorek je kleštěmi uchopen a vytažen přes sklivcový prostor sklerálním portem. Hlavní výhodou použití Essenových bioptických kleští je větší velikost získaného vzorku. U vzorků větších než 0,6 mm s sebou ale tato technika nese potenciálně vyšší riziko diseminace tumoru, protože vzorek nebo jeho části mohou uvíznout ve sklerálním portu [4,23].
PPV asistovaná incizní biopsie zahrnuje kompletní tříportovou 23-gauge nebo 20-gauge PPV. Diamantovým nožem je poté provedena retinotomie, následovaná excizí 1 mm3 nádorové tkáně. Vzorek tumoru je extrahován sklerotomií pomocí kleští. K minimalizaci krvácení se používá zvýšení nitroočního tlaku a retinální diatermie, nakonci výkonu je do oka aplikován 20% SF6. Tento postup umožňuje odběr velkých vzorků, které jsou vhodné pro histopatologické a cytogenetické vyšetření, ale je spojen se zvýšeným rizikem odchlípení sítnice [24].
Rizika biopsie
Mezi rizika nitrooční biopsie se řadí především odběr nevalidního nebo nedostatečně velkého vzorku, iatrogenní poškození oka (hyphaema, hemoftalmus, subretinální krvácení, odchlípení sítnice, katarakta, endoftalmitida) a riziko intraokulární nebo extraokulární diseminace nádoru [4,5,12]. Problémem může být také intratumorání heterogenita tumoru, kdy různé části léze mohou vykazovat různé histopatologické a cytogenetické charakteristiky. Vyšetření malého vzorku tkáně proto může poskytnout zavádějící falešně negativní výsledky [25].
ZÁVĚR
Biopsie uveálního melanomu zahrnuje celou řadu technik, které se spolu se znalostmi o patogenezi uveálního melanomu neustále rozvíjejí. V klinické praxi může mít biopsie diagnostický i prognostický význam. S postupným zlepšováním neinvazivních technik klinické diagnostiky je biopsie pro diagnostické účely vyhrazena pro vybrané případy (klinicky nejasné léze, malé hraniční léze). Naopak v návaznosti na neustálé zlepšování systémové terapie nabývá na významu biopsie pro účely cytogenetické analýzy se stanovením rizika rozvoje metastatického onemocnění a individualizované terapie pro konkrétního pacienta (Obrázek 1 a 2). S ohledem na omezenou velikost odebraného materiálu je nezbytností úzká spolupráce se zkušeným histopatologem a cytogenetikem.
Obr. 1. 30letá žena s pokročilým melanomem choroidey levého oka diagnostikovaným v červenci 2010. Po ošetření Leksellovým gamanožem v srpnu 2010 došlo k progresi tumoru, proto byla provedena v říjnu 2010 enukleace bulbu. Histologické (smíšený typ melanomu, pleomorfismus) i cytogenetické (monosomie chromosomu 3 - pozitivní, zisk na chromosomu 6p, tj. isochromosom 6p - negativní, zisk na chromosomu 8q – negativní) vyšetření bylo prognosticky nepříznivé. V rámci pravidelné dispenzarizace zjištěno v dubnu 2014 metastatické postižení jater. Byla zahájena chemoterapie, pro progredující generalizaci s mnohočetným orgánovým postižením následně i biologická léčba. V říjnu 2014 pacientka na následky generalizace uveálního melanomu umírá.
A: Pokročilý melanom choroidey levého oka patrný na MR snímku z července 2010.
B: Histologický nález - solidně alveolární typ růstu, nádorová proliferace epiteloidních a vřetenobuněčných elementů (tvořena vřetenitými buňkami typu B), ojediněle s deposity hnědého pigmentu melaninu.
C: Ztráta chromosomu 3 detekována metodou FISH za použití fluorescenční sondy VHL/CEN 3 (Zytovision, Germany). Lokus VHL (3p25.3) je značen zelenou barvou, kontrolní centromerická oblast (CEN 3) je značena oranžovou barvou, jádra jsou podbarvena modře DAPI. V normálních jádrech se dvěma chromosomy jsou očekávány 2 zelené a 2 oranžové signály. Na obrázku je patrna ztráta chromosomu 3 (pouze 1 zelený a 1 oranžový signál).
D: Metastáza v játrech patrná na PET/CT vyšetření.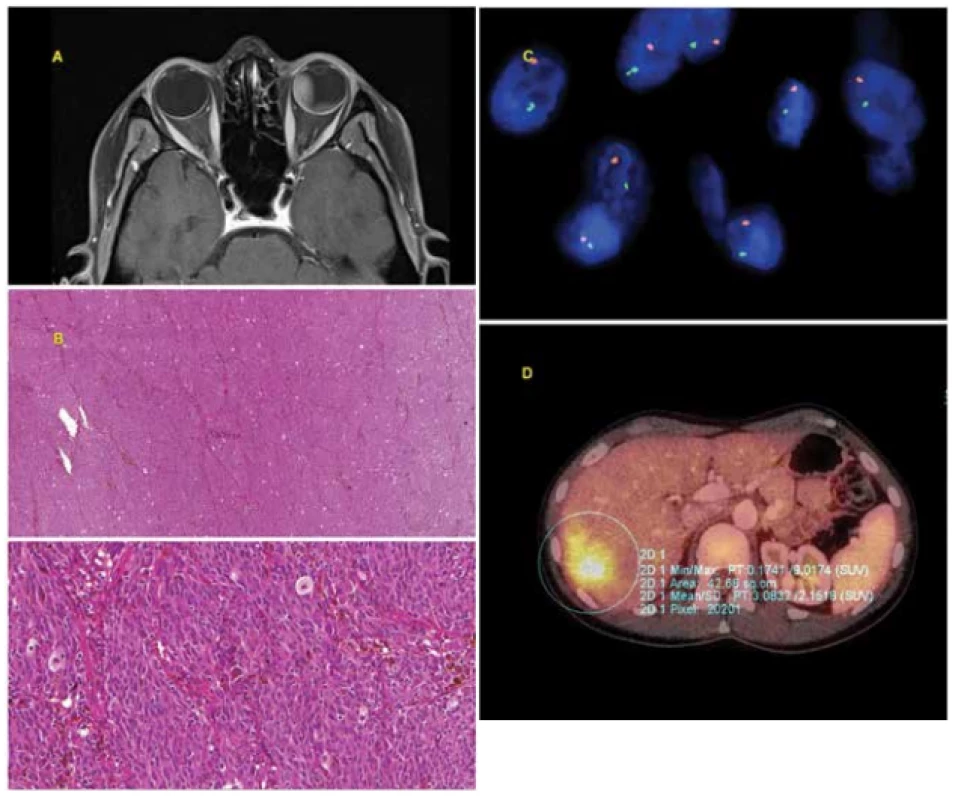
Obr. 2. 42letý muž s pokročilým melanomem choroidey levého oka diagnostikovaným v srpnu 2009. V září 2009 bylo provedeno ošetření Leksellovým gamanožem, vzhledem k velikosti tumoru s rizikem rozvoje toxic tumor syndromu byla provedena v říjnu 2009 exoresekce tumoru (sklerouvektotomie). Cytogenetické vyšetření bylo prognosticky příznivé (monosomie chromosomu 3 - negativní., isochromosom 6p - pozitivní, zisk na chromosomu 8q - negativní). Pacient je pravidelně dispenzarizován (sono břicha, rtg plic, laboratorní vyšetření) – zatím je bez známek generalizace onemocnění.
A: Pokročilý melanom choroidey levého oka patrný na MR snímku ze srpna 2009.
B: Histologický nález - solidní kompaktní nádorová hmota tvořená vřetenobuněčnými elementy a velkým množstvím melaninu.
C: Ztráta v oblasti krátkého raménka chromosomu 6 (6q) společně se ziskem v oblasti dlouhého raménka (6p) detekována metodou FISH pomocí fluorescenčního setu Vysis Melanoma FISH Probe Kit (Vysis, Abbott Molecular, USA). Lokus MYB (6q23) je značen žlutou barvou, lokus RREB1 (6p25), červenou barvou, kontrolní centromerická oblast světle modrou (aqua) barvou, jádra jsou podbarvena modře DAPI. V normálních jádrech jsou očekávány 2 červené, 2 žluté a 2 aqua signály. Na obrázku je patrna ztráta 1 kopie lokusu MYB (1 žlutý signál) a zisk lokusu RREB1 (3 červené signály).
D: Nález na očním pozadí 10 let po terapii uveálního melanomu (ošetření LGK, následná exoresekce tumoru).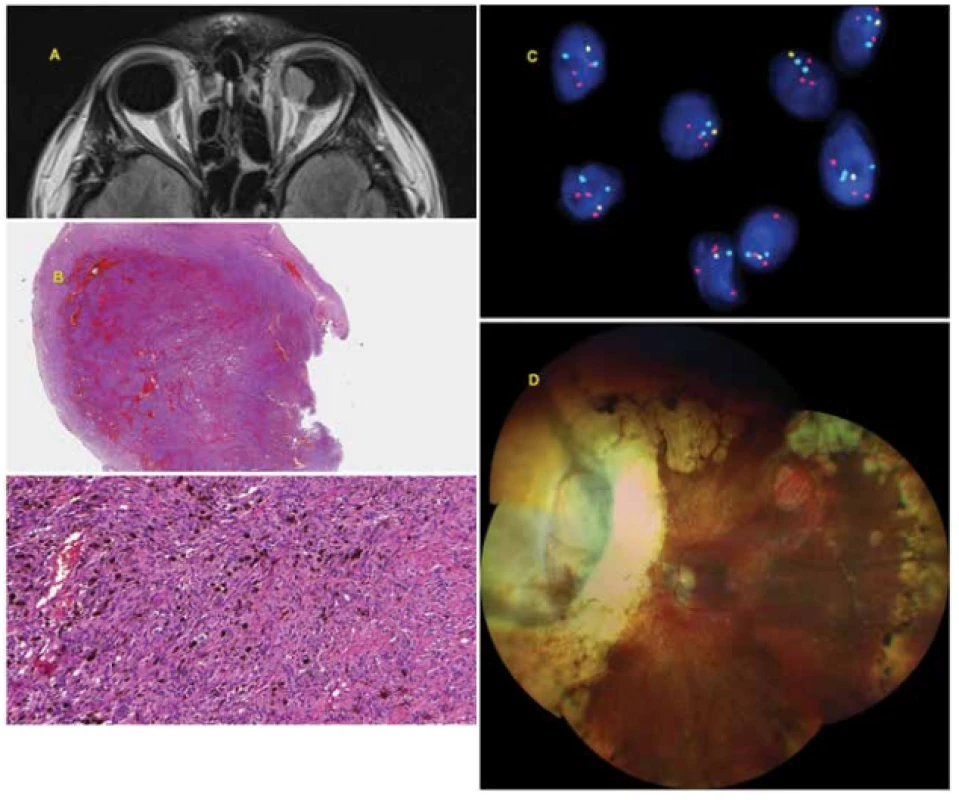
Autoři práce prohlašují, že vznik i téma odborného sdělení a jeho zveřejnění není ve střetu zájmů a není podpořeno žádnou farmaceutickou firmou. Práce nebyla otištěna ani zadána k publikování v jiném odborném periodiku.
Do redakce doručeno dne: 27. 2. 2020
Přijato k publikaci dne: 13. 5. 2020
MUDr. Štěpán Rusňák, Ph.D.
Oční klinika, Fakultní nemocnice v Plzni
Alej Svobody 80
304 60 Plzeň
Zdroje
1. Kivelä T. Diagnosis of uveal melanoma. Dev Ophthalmol. 2012; 49 : 1–15.
2. Tarlan B, Kıratlı H. Uveal Melanoma: Current Trends in Diagnosis and Management. Turk J Ophthalmol. 2016 Jun;46(3):123 – 137.
3. Sayanagi K, Pelayes DE, Kaiser PK, Singh AD. 3D Spectral domain optical coherence tomography findings in choroidal tumors. Eur J Ophthalmol. 2011 May-Jun;21(3):271–275.
4. Frizziero L, Midena E, Trainiti S et al. Uveal Melanoma Biopsy: A Review. Cancers. 2019 Aug;11(8):1075.
5. Aronow ME, Biscotti CV, Chan CC, Singh AD. The Role of Biopsy in the Assessment of Uveal Melanoma. Retinal Physician, 2012 Jun; 9,13–17.
6. Boldt HC, Binkley E. Treating Small Choroidal Melanoma: Smaller Is Better. JAMA Ophthalmol. 2018 Dec;136(12):1333 – 1334.
7. The Collaborative Ocular Melanoma Study Group. Mortality in patients with small choroidal melanoma. COMS report no. 4. The Collaborative Ocular Melanoma Study Group. Arch Ophthalmol. 1997 Jul;115(7):886–893.
8. Singh AD. Uveal melanoma: implications of tumor doubling time. Ophthalmology. 2001 May;108(5):829–831.
9. Bagger MM. Intraocular biopsy of uveal melanoma Risk assessment and identification of genetic prognostic markers. Acta Ophthalmol. 2018 Jul;96 : 1–28.
10. Onken MD, Worley LA, Char DH et al. Collaborative Ocular Oncology Group report number 1: Prospective validation of a multigene prognostic assay in uveal melanoma. Ophthalmology. 2012 Aug;119(8):1596–1603.
11. Usui Y, Tsubota K, Agawa T, et al. Aqueous immune mediators in malignant uveal melanomas in comparison to benign pigmented intraocular tumors. Graefes Arch Clin Exp Ophthalmol. 2017 Feb;255(2):393–399.
12. Shields CL, Manquez ME, Ehya H, Mashayekhi A, Danzig CJ, Shields JA. Fine-needle aspiration biopsy of iris tumors in 100 consecutive cases: Technique and complications. Ophthalmology. 2006 Nov;113(11):2080–2086.
13. Singh AD, Biscotti CV. Fine needle aspiration biopsy of ophthalmic tumors. Saudi J Ophthalmol. 2012 Apr;26(2):117–123.
14. Bechrakis NE, Foerster MH, Bornfeld N. Biopsy in indeterminate intraocular tumors. Ophthalmology. 2002 Feb;109(2):235–242.
15. Klauber S, Jensen PK, Prause JU, Kessing SV. Surgical treatment of iris and ciliary body melanoma: follow-up of a 25-year series of patients. Acta Ophthalmol. 2012 Mar;90(2):122–126.
16. Finger PT, Milman T. Microincision, aspiration cutter-assisted multifocal iris biopsy for melanoma. Eur J Ophthalmol. 2017 Jan;27(1):62–66.
17. Shields CL, Materin MA, Teixeira L, Mashayekhi A, Ganguly A, Shields J.A. Small choroidal melanoma with chromosome 3 monosomy on fine-needle aspiration biopsy. Ophthalmology. 2007 Oct;114(10):1919–1924.
18. Singh AD, Medina CA, Singh N, Aronow ME, Biscotti CV, Triozzi PL. Fine-needle aspiration biopsy of uveal melanoma: Outcomes and complications. Br. J. Ophthalmol. 2016 Apr;100(4):456–462.
19. Midena E, Bonaldi L, Parrozzani R, Tebaldi E, Boccassini B, Vujosevic S. In vivo detection of monosomy 3 in eyes with medium-sized uveal melanoma using transscleral fine needle aspiration biopsy. Eur. J. Ophthalmol. 2006 May-Jun;16(3):422–425.
20. Rishi P, Dhami A, Biswas J. Biopsy techniques for intraocular tumors. Indian J Ophthalmol. 2016 Jun;64(6):415–421.
21. Tang PH, Shields RA, Schefler AC, Mruthyunjaya P. Biopsy of a Choroidal Melanoma Using Transvitreal Pars Plana Vitrectomy. Ophthalmic Surg Lasers Imaging Retin. 2018 Aug;49(8):645–647.
22. Hussain RN, Kalirai H, Groenewald C et al. Prognostic Biopsy of Choroidal Melanoma after Proton Beam Radiation Therapy. Ophthalmology. 2016 Oct;123(10):2264–2265.
23. Akgul H, Otterbach F, Bornfeld N, Jurklies B. Intraocular biopsy using special forceps: A new instrument and refined surgical technique. Br J Ophthalmol. 2011 Jan;95(1):79–82.
24. Seregard S, All-Ericsson C, Hjelmqvist L, Berglin L, Kvanta A. Diagnostic incisional biopsies in clinically indeterminate choroidal tumours. Eye. 2013 Feb;27(2):115–118.
25. Marigo FA, Finger PT. Anterior segment tumors: Current concepts and in
Štítky
Oftalmologie
Článek vyšel v časopiseČeská a slovenská oftalmologie
Nejčtenější tento týden
2020 Číslo 6- Léčba chronické blefaritidy vyžaduje dlouhodobou péči
- Stillova choroba: vzácné a závažné systémové onemocnění
- Citikolin jako užitečný pomocník v léčbě diabetické retinopatie a glaukomu
- Jak působí benzalkonium chlorid a prostaglandiny na epitelové buňky Meibomových žláz?
- Diagnostický algoritmus při podezření na syndrom periodické horečky
-
Všechny články tohoto čísla
- BIOPSIE UVEÁLNÍHO MELANOMU PŘEHLED
- ZRAKOVÉ FUNKCE PO IMPLANTACI MONOFOKÁLNÍCH NITROOČNÍCH ČOČEK ACRYSOF
- Evaluation of Patients Presenting to the Ophthalmology Department of a Tertiary Hospital for Nonemergency Reasons During the Covid-19 Pandemic
- ZMENENÉ ZRAKOVÉ FUNKCIE A KVALITA ŽIVOTA U SENIOROV S DIABETICKOU RETINOPATIOU
- MŮŽE OTEVŘENÉ FORAMEN OVALE OVLIVNIT ZRAKOVÉ FUNKCE?
- POZDNÍ FUNKČNÍ A MORFOLOGICKÉ NÁLEZY PO OTRAVĚ METYLALKOHOLEM.
- Česká a slovenská oftalmologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- MŮŽE OTEVŘENÉ FORAMEN OVALE OVLIVNIT ZRAKOVÉ FUNKCE?
- ZRAKOVÉ FUNKCE PO IMPLANTACI MONOFOKÁLNÍCH NITROOČNÍCH ČOČEK ACRYSOF
- POZDNÍ FUNKČNÍ A MORFOLOGICKÉ NÁLEZY PO OTRAVĚ METYLALKOHOLEM.
- BIOPSIE UVEÁLNÍHO MELANOMU PŘEHLED
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



